Proair Inhaler 100mcg Salbutamol Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er ProAir, og hvordan bruges det?
ProAir er en receptpligtig medicin, der bruges til at behandle symptomerne på akut, svær eller anstrengelsesinduceret astma (bronkospasme). ProAir kan bruges alene eller sammen med anden medicin.
ProAir tilhører en klasse af lægemidler kaldet PAH, PDE-5-hæmmere, phosphodiesterase-5-enzymhæmmere.
Det vides ikke, om ProAir er sikkert og effektivt til børn under 4 år.
Hvad er de mulige bivirkninger af ProAir?
ProAir kan forårsage alvorlige bivirkninger, herunder:
- hvæsen,
- kvælning,
- andre vejrtrækningsproblemer,
- brystsmerter,
- hurtig puls,
- bankende hjerteslag eller flagrende i dit bryst,
- svær hovedpine,
- dunkende i nakken eller ørerne,
- smerte eller svie, når du tisser,
- øget tørst,
- øget vandladning,
- tør mund,
- frugtig ånde lugt,
- kramper i benene,
- forstoppelse,
- uregelmæssige hjerteslag,
- øget tørst eller vandladning,
- følelsesløshed eller prikken, og
- muskelsvaghed eller slap følelse
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af ProAir omfatter:
- brystsmerter,
- hurtige eller bankende hjerteslag,
- svimmelhed,
- føler sig rystende eller nervøs,
- hovedpine,
- rygsmerte,
- kropssmerter,
- dårlig mave,
- ondt i halsen,
- bihulesmerter, og
- løbende eller tilstoppet næse
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af ProAir. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Den aktive ingrediens i ProAir HFA (albuterolsulfat) inhalationsaerosol er albuterolsulfat, et racemisk salt af albuterol. Albuterolsulfat har det kemiske navn α -[(tert-butylamino) methyl]-4-hydroxy-m-xylen-α,α'-diol sulfate (2:1) (salt), og har følgende kemiske struktur:
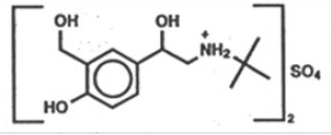
Molekylvægten af albuterolsulfat er 576,7, og den empiriske formel er (C13H21NO3)2 •H2SO4. Albuterolsulfat er et hvidt til råhvidt krystallinsk pulver. Det er opløseligt i vand og lidt opløseligt i ethanol. Albuterolsulfat er det officielle generiske navn i USA, og salbutamolsulfat er det af Verdenssundhedsorganisationen anbefalede generiske navn. ProAir HFA Inhalation Aerosol er en tryksat aerosolenhed med afmålt dosis med en dosistæller. ProAir HFA er kun til oral inhalation. Den indeholder en mikrokrystallinsk suspension af albuterolsulfat i drivmiddel HFA-134a (1, 1, 1, 2-tetrafluorethan) og ethanol.
Grund inhalatoren før brug første gang og i tilfælde, hvor inhalatoren ikke har været brugt i mere end 2 uger ved at frigive tre sprays i luften, væk fra ansigtet. Efter priming afgiver hver aktivering 108 mcg albuterolsulfat fra aktuatormundstykket (svarende til 90 mcg albuterolbase). Hver beholder giver 200 aktiveringer (inhalationer).
Dette produkt indeholder ikke chlorfluorcarboner (CFC'er) som drivmiddel.
INDIKATIONER
Bronkospasme
PROAIR HFA inhalationsaerosol er indiceret til behandling eller forebyggelse af bronkospasme hos patienter på 4 år og ældre med reversibel obstruktiv luftvejssygdom.
Trænings-induceret bronkospasme
PROAIR HFA inhalationsaerosol er indiceret til forebyggelse af anstrengelsesudløst bronkospasme hos patienter på 4 år og ældre.
DOSERING OG ADMINISTRATION
Bronkospasme
Til behandling af akutte episoder med bronkospasme eller forebyggelse af symptomer forbundet med bronkospasme er den sædvanlige dosis for voksne og børn 4 år og ældre to inhalationer, der gentages hver 4. til 6. time. Hyppigere administration eller et større antal inhalationer anbefales ikke. Hos nogle patienter kan en inhalation hver 4. time være tilstrækkelig.
Trænings-induceret bronkospasme
Den sædvanlige dosis for voksne og børn 4 år eller ældre er to inhalationer 15 til 30 minutter før træning.
Administrationsoplysninger
Administrer kun PROAIR HFA ved oral inhalation. Ryst godt før hver spray. For at opretholde korrekt brug af dette produkt og for at forhindre medicinopbygning og blokering er det vigtigt at følge rengøringsanvisningerne omhyggeligt.
Grunding
Grund inhalatoren før brug første gang og i tilfælde, hvor inhalatoren ikke har været brugt i mere end 2 uger ved at frigive tre sprays i luften, væk fra ansigtet.
Rengøring
Som med alle HFA-holdige albuterol-inhalatorer er det vigtigt at rengøre plastikmundstykket regelmæssigt for at opretholde korrekt brug af dette produkt og for at forhindre medicinopbygning og blokering. Inhalatoren kan holde op med at afgive medicin, hvis plastaktuatormundstykket ikke er ordentligt rengjort og tørret. Rengøring: Vask plastikmundstykket med varmt rindende vand i 30 sekunder, ryst overskydende vand af og lufttør grundigt mindst en gang om ugen. Hvis patienten har mere end én PROAIR HFA-inhalator, skal patienten vaske hver enkelt separat for at forhindre fastgørelse af den forkerte beholder til den forkerte plastaktuator. På denne måde kan patienten være sikker på altid at kende det korrekte antal resterende doser. Fastgør aldrig en beholder med medicin fra nogen anden inhalator til PROAIR HFA-aktuatoren, og fastgør aldrig PROAIR HFA-beholderen til en aktuator fra en anden inhalator. Hvis mundstykket bliver blokeret, vil vask af mundstykket fjerne blokeringen. Hvis det er nødvendigt at bruge inhalatoren, før den er helt tør, ryst overskydende vand af, udskift beholderen, spray to gange i luften væk fra ansigtet og tag den foreskrevne dosis. Efter sådan brug skal mundstykket vaskes igen og lades lufttørre grundigt. [se FDA-godkendt patientmærkning ].
Dosistæller
PROAIR HFA har en dosistæller fastgjort til aktuatoren. Når patienten modtager inhalatoren, vises en sort prik i visningsvinduet, indtil den er blevet primet 3 gange, hvorefter tallet 200 vises. Dosistælleren tæller ned, hver gang en spray frigives. Når dosistælleren når 20, vil farven på tallene ændre sig til rød for at minde patienten om at kontakte deres apotek for at få genopfyldning af medicin eller kontakte deres læge for at få en receptpligtig genopfyldning.
Når dosistælleren når 0, skifter baggrunden til konstant rød. PROAIR HFA-inhalatoren skal kasseres, når dosistælleren viser 0 eller efter udløbsdatoen på produktet, alt efter hvad der kommer først.
HVORDAN LEVERET
Doseringsformer og styrker
PROAIR HFA er en inhalationsaerosol. PROAIR HFA leveres som en 8,5 g/200 aktiveringer tryksat aluminiumsbeholder med en rød plastaktuator med en dosistæller og hvid støvhætte hver i kasser af én. Hver aktivering afgiver 120 mcg albuterolsulfat fra beholderventilen og 108 mcg albuterolsulfat fra aktuatormundstykket (svarende til 90 mcg albuterolbase).
Opbevaring & Håndtering
PROAIR HFA (albuterolsulfat) Indånding Aerosol leveres som en trykbeholder af aluminium med en rød plastaktuator med dosistæller og hvid støvhætte hver i kasser af én. Hver beholder indeholder 8,5 g af formuleringen og giver 200 aktiveringer ( NDC 59310-579-22). Hver aktivering afgiver 120 mcg albuterolsulfat fra beholderventilen og 108 mcg albuterolsulfat fra aktuatormundstykket (svarende til 90 mcg albuterolbase).
RYST GODT FØR BRUG. Opbevares mellem 15° og 25°C (59° og 77°F). Indhold under pres. Må ikke punkteres eller brændes. Beskyt mod frostgrader og langvarig udsættelse for direkte sollys. Udsættelse for temperaturer over 120°F kan forårsage sprængning. For de bedste resultater skal beholderen have stuetemperatur før brug. Undgå at sprøjte i øjnene. Holde utilgængeligt for børn.
Se FDA-godkendt patientmærkning for priming og rengøringsinstruktioner.
Den røde aktuator, der følger med PROAIR HFA inhalationsaerosol, bør ikke bruges sammen med beholderen fra andre inhalationsaerosolprodukter. PROAIR HFA inhalationsaerosolbeholderen bør ikke bruges sammen med aktuatoren fra andre inhalationsaerosolprodukter.
PROAIR HFA-inhalatoren har en dosistæller fastgjort til aktuatoren. Patienter bør aldrig forsøge at ændre tallene for dosistælleren eller pille ved stiftmekanismen inde i aktuatoren. Kassér PROAIR HFA-inhalatoren, når tælleren viser 0 eller efter udløbsdatoen på produktet, alt efter hvad der kommer først. Den mærkede mængde medicin i hver aktivering kan ikke sikres, efter at tælleren viser 0, selvom beholderen ikke er helt tom og vil fortsætte med at fungere. Nedsænk aldrig beholderen i vand for at bestemme, hvor fuld beholderen er ("flydetest").
PROAIR HFA Inhalation Aerosol indeholder ikke chlorfluorcarboner (CFC'er) som drivmiddel.
Mktd af: Teva Respiratory, LLC, Frazer, PA 19355. Produceret af: IVAX Pharmaceuticals Ireland Waterford, Irland. Revideret: februar 2019
BIVIRKNINGER
Brug af PROAIR HFA kan være forbundet med følgende:
- Paradoksal bronkospasme [se ADVARSLER OG FORHOLDSREGLER ]
- Kardiovaskulære virkninger [se ADVARSLER OG FORHOLDSREGLER ]
- Øjeblikkelige overfølsomhedsreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Hypokaliæmi [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
I alt 1090 forsøgspersoner blev behandlet med PROAIR HFA inhalationsaerosol eller med den samme formulering af albuterol som i PROAIR HFA inhalationsaerosol under det verdensomspændende kliniske udviklingsprogram.
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Voksne og unge 12 år og ældre
Bivirkningsoplysningerne i tabellen nedenfor vedrørende PROAIR HFA-inhalationsaerosol stammer fra et 6-ugers, blindet studie, som sammenlignede PROAIR HFA-inhalationsaerosol (180 mcg fire gange dagligt) med en dobbeltblindet matchet placebo-HFA-inhalationsaerosol og en evaluator-blindet markedsført aktiv komparator HFA-134a albuterol inhalator i 172 astmatiske patienter i alderen 12 til 76 år. Tabellen viser forekomsten af alle uønskede hændelser (uanset om det vurderes af investigator-lægemidlet relateret til eller ikke-relateret til lægemidlet) fra denne undersøgelse, som forekom med en frekvens på 3 % eller mere i PROAIR HFA-inhalationsaerosol-behandlingsgruppen og hyppigere i PROAIR HFA Inhalation Aerosolbehandlingsgruppe end i den matchede placebogruppe. Samlet set var forekomsten og arten af de rapporterede bivirkninger for PROAIR HFA inhalationsaerosol og den markedsførte aktive komparator HFA-134a albuterol inhalator sammenlignelige.
Forekomster af uønskede oplevelser (% af patienter) i et seks-ugers klinisk forsøg*
Bivirkninger rapporteret af mindre end 3 % af patienterne, der fik PROAIR HFA inhalationsaerosol, men af en større andel af PROAIR HFA inhalationsaerosolpatienter end de matchede placebopatienter, som har potentiale til at være relateret til PROAIR HFA inhalationsaerosol, omfattede brystsmerter, infektion, diarré, glossitis, utilsigtet skade (nervesystemet), angst, dyspnø, øresygdom, øresmerter og urinvejsinfektion.
I studier med små kumulative doser var tremor, nervøsitet og hovedpine de hyppigst forekommende bivirkninger.
Pædiatriske patienter i alderen 4 til 11 år
Bivirkninger rapporteret i et 3-ugers pædiatrisk klinisk forsøg, der sammenlignede den samme formulering af albuterol som i PROAIR HFA inhalationsaerosol (180 mcg albuterol fire gange dagligt) med en matchende placebo HFA inhalationsaerosol forekom med en lav forekomstrate (ikke mere end 2 % i den aktive behandlingsgruppe) og lignede dem, der blev set i forsøg med voksne og unge.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af PROAIR HFA efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering. Rapporter har inkluderet sjældne tilfælde af forværret bronkospasme, manglende effekt, astmaforværring (rapporteret dødelig i ét tilfælde), muskelkramper og forskellige orofaryngeale bivirkninger såsom halsirritation, ændret smag, glossitis, tungesår og gagging.
Følgende bivirkninger er blevet observeret ved brug af inhaleret albuterol efter godkendelse: urticaria, angioødem, udslæt, bronkospasme, hæshed, oropharyngealt ødem og arytmier (inklusive atrieflimren, supraventrikulær takykardi, ekstrasystoler). Derudover kan albuterol, ligesom andre sympatomimetiske midler, forårsage bivirkninger såsom: angina, hypertension eller hypotension, hjertebanken, stimulering af centralnervesystemet, søvnløshed, hovedpine, nervøsitet, tremor, muskelkramper, udtørring eller irritation af oropharynx, hypokaliæmi, hyperglykæmi og metabolisk acidose.
DRUGSINTERAKTIONER
Andre korttidsvirkende sympatomimetiske aerosol-bronkodilatatorer bør ikke anvendes samtidig med PROAIR HFA inhalationsaerosol. Hvis yderligere adrenerge lægemidler skal administreres ad en hvilken som helst måde, bør de anvendes med forsigtighed for at undgå skadelige kardiovaskulære effekter.
Beta-blokkere
Beta-adrenerge receptorblokerende midler blokerer ikke kun den pulmonale virkning af beta-agonister, såsom PROAIR HFA inhalationsaerosol, men kan også forårsage alvorlig bronkospasme hos astmatiske patienter. Patienter med astma bør derfor normalt ikke behandles med betablokkere. Men under visse omstændigheder, f.eks. som profylakse efter myokardieinfarkt, er der muligvis ingen acceptable alternativer til brugen af beta-adrenerge blokerende midler hos patienter med astma. Overvej i denne indstilling kardioselektive betablokkere, selvom de skal administreres med forsigtighed.
Diuretika
EKG-forandringer og/eller hypokaliæmi, som kan være resultatet af administration af ikke-kaliumbesparende diuretika (såsom loop- eller thiaziddiuretika) kan forværres akut af beta-agonister, især når den anbefalede dosis af beta-agonisten overskrides. Selvom den kliniske betydning af disse virkninger ikke er kendt, tilrådes forsigtighed ved samtidig administration af beta-agonister og ikke-kaliumbesparende diuretika. Overvej at overvåge kaliumniveauer.
Digoxin
Gennemsnitlige fald på 16 % og 22 % i serumdigoxinniveauer blev påvist efter henholdsvis intravenøs enkeltdosis og oral administration af albuterol til normale frivillige, som havde fået digoxin i 10 dage. Den kliniske betydning af disse fund for patienter med obstruktiv luftvejssygdom, som får albuterol og digoxin på kronisk basis, er uklar. Ikke desto mindre ville det være klogt at omhyggeligt evaluere serumdigoxinniveauerne hos patienter, der i øjeblikket får digoxin og PROAIR HFA inhalationsaerosol.
Monoaminoxidasehæmmere eller tricykliske antidepressiva
PROAIR HFA-inhalation Aerosol bør administreres med ekstrem forsigtighed til patienter, der behandles med monoaminoxidasehæmmere eller tricykliske antidepressiva, eller inden for 2 uger efter seponering af sådanne midler, fordi virkningen af albuterol på det kardiovaskulære system kan forstærkes. Overvej alternativ behandling hos patienter, der tager MAO-hæmmere eller tricykliske antidepressiva.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Paradoksal bronkospasme
PROAIR HFA Inhalation Aerosol kan producere paradoksal bronkospasme, der kan være livstruende. Hvis der opstår paradoksal bronkospasme, bør PROAIR HFA inhalationsaerosol seponeres øjeblikkeligt og alternativ behandling iværksættes. Det bør erkendes, at paradoksal bronkospasme, når den er forbundet med inhalerede formuleringer, ofte forekommer ved den første brug af en ny beholder.
Forværring af astma
Astma kan forværres akut over en periode på timer eller kronisk over flere dage eller længere. Hvis patienten har behov for flere doser PROAIR HFA inhalationsaerosol end normalt, kan dette være en markør for destabilisering af astma og kræver revurdering af patienten og behandlingsregimen, idet der tages særligt hensyn til det mulige behov for antiinflammatorisk behandling, f.eks. kortikosteroider.
Brug af antiinflammatoriske midler
Brugen af beta-adrenerge agonister bronkodilatatorer alene er muligvis ikke tilstrækkelig til at kontrollere astma hos mange patienter. Det bør tidligt overvejes at tilføje antiinflammatoriske midler, f.eks. kortikosteroider, til det terapeutiske regime.
Kardiovaskulære effekter
PROAIR HFA Inhalation Aerosol kan ligesom andre beta-adrenerge agonister producere klinisk signifikante kardiovaskulære effekter hos nogle patienter målt ved puls, blodtryk og/eller symptomer. Selvom sådanne virkninger er ualmindelige efter administration af PROAIR HFA inhalationsaerosol i anbefalede doser, kan det være nødvendigt at seponere lægemidlet, hvis de opstår. Derudover er beta-agonister blevet rapporteret at producere EKG-ændringer, såsom udfladning af T-bølgen, forlængelse af QTc-intervallet og ST-segmentdepression. Den kliniske betydning af disse fund er ukendt. Derfor bør PROAIR HFA inhalationsaerosol, som alle sympatomimetiske aminer, anvendes med forsigtighed til patienter med kardiovaskulære lidelser, især koronar insufficiens, hjertearytmier og hypertension.
Overskrid ikke den anbefalede dosis
Dødsfald er blevet rapporteret i forbindelse med overdreven brug af inhalerede sympatomimetika hos patienter med astma. Den nøjagtige dødsårsag er ukendt, men der er mistanke om hjertestop efter en uventet udvikling af en alvorlig akut astmatisk krise og efterfølgende hypoxi.
Øjeblikkelige overfølsomhedsreaktioner
Umiddelbare overfølsomhedsreaktioner kan forekomme efter administration af albuterolsulfat, som vist i sjældne tilfælde af nældefeber, angioødem, udslæt, bronkospasme, anafylaksi og orofaryngealt ødem. Potentialet for overfølsomhed skal overvejes i den kliniske evaluering af patienter, som oplever øjeblikkelige overfølsomhedsreaktioner, mens de får PROAIR HFA inhalationsaerosol.
Sameksisterende forhold
PROAIR HFA inhalationsaerosol bør, som alle sympatomimetiske aminer, anvendes med forsigtighed hos patienter med kardiovaskulære lidelser, især koronar insufficiens, hjertearytmier og hypertension; hos patienter med konvulsive lidelser, hyperthyroidisme eller diabetes mellitus; og hos patienter, som er usædvanligt reagerende på sympatomimetiske aminer. Klinisk signifikante ændringer i systolisk og diastolisk blodtryk er set hos individuelle patienter og kan forventes at forekomme hos nogle patienter efter brug af enhver beta-adrenerg bronkodilatator. Store doser af intravenøs albuterol er blevet rapporteret at forværre allerede eksisterende diabetes mellitus og ketoacidose.
Hypokaliæmi
Som med andre beta-agonister kan PROAIR HFA inhalationsaerosol forårsage betydelig hypokaliæmi hos nogle patienter, muligvis gennem intracellulær shunting, som har potentiale til at forårsage uønskede kardiovaskulære effekter. Faldet er normalt forbigående og kræver ikke tilskud.
Patientrådgivningsinformation
Se FDA-godkendt patientmærkning
Patienterne skal have følgende oplysninger:
Brugshyppighed
Virkningen af PROAIR HFA inhalationsaerosol bør vare i 4 til 6 timer. Brug ikke PROAIR HFA inhalationsaerosol oftere end anbefalet. Instruer patienterne i ikke at øge dosis eller hyppighed af doser af PROAIR HFA inhalationsaerosol uden at konsultere lægen. Hvis patienter oplever, at behandling med PROAIR HFA inhalationsaerosol bliver mindre effektiv til symptomatisk lindring, symptomerne bliver værre, og/eller de skal bruge produktet oftere end normalt, bør de straks søge lægehjælp.
Grunding og rengøring
Grunding
Priming er afgørende for at sikre passende albuterolindhold i hver aktivering. Instruer patienterne i at prime inhalatoren før brug første gang og i tilfælde, hvor inhalatoren ikke har været brugt i mere end 2 uger, ved at frigive tre sprays i luften væk fra ansigtet.
Rengøring
For at sikre korrekt dosering og forhindre blokering af aktuatoråbningen, instruer patienterne i at vaske det røde plastikaktuatormundstykke og tørre grundigt mindst en gang om ugen. Instruer patienterne i, at hvis de har mere end én PROAIR HFA-inhalator, skal de vaske hver enkelt på separate tidspunkter for at forhindre, at den forkerte beholder fastgøres til den forkerte plastaktuator. På denne måde kan de være sikre på, at de altid kender det korrekte antal resterende doser. Patienter bør instrueres i aldrig at fastgøre en medicinbeholder fra nogen anden inhalator til PROAIR HFA-aktuatoren og aldrig fastgøre PROAIR HFA-beholderen til en aktuator fra nogen anden inhalator. Patienter bør ikke fjerne beholderen fra aktuatoren undtagen under rengøring, fordi genmontering kan frigive en dosis til luften, og dosistælleren vil tælle ned, hver gang en spray frigives. Detaljerede rengøringsinstruktioner er inkluderet i den illustrerede information til patientfolderen.
Dosistæller
Patienterne skal informeres om, at PROAIR HFA har en dosistæller fastgjort til aktuatoren. Når patienten modtager inhalatoren, vises en sort prik i visningsvinduet, indtil den er blevet primet 3 gange, hvorefter tallet 200 vises. Dosistælleren tæller ned, hver gang en spray frigives. Dosistællervinduet viser antallet af sprays tilbage i inhalatoren i enheder af to (f.eks. 200, 198, 196 osv.). Når tælleren viser 20, skifter farven på tallene til rød for at minde patienten om at kontakte deres apotek for at få genopfyldning af medicin eller kontakte deres læge for at få en receptpligtig genopfyldning. Når dosistælleren når 0, skifter baggrunden til konstant rød. Patienterne skal informeres om at kassere PROAIR HFA-inhalatoren, når dosistælleren viser 0 eller efter udløbsdatoen på produktet, alt efter hvad der kommer først.
Paradoksal bronkospasme
Informer patienterne om, at PROAIR HFA inhalationsaerosol kan producere paradoksal bronkospasme. Instruer patienterne i at seponere PROAIR HFA inhalationsaerosol, hvis der opstår paradoksal bronkospasme.
Samtidig medicinbrug
Mens patienter tager PROAIR HFA inhalationsaerosol, bør andre inhalerede lægemidler og astmamedicin kun tages som anvist af en læge.
Almindelige uønskede hændelser
Almindelige bivirkninger ved behandling med inhaleret albuterol omfatter hjertebanken, brystsmerter, hurtig puls, tremor eller nervøsitet.
Graviditet
Patienter, der er gravide eller ammer, skal kontakte deres læge om brugen af PROAIR HFA inhalationsaerosol.
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for astmamedicin under graviditeten [se Brug i specifikke populationer ].
Generel information om brug
Effektiv og sikker brug af PROAIR HFA inhalationsaerosol inkluderer en forståelse af, hvordan den skal administreres.
Ryst godt før hver spray.
Brug kun PROAIR HFA inhalationsaerosol med den aktuator, der følger med produktet. Kassér PROAIR HFA-inhalatoren, når dosistælleren viser 0 eller efter udløbsdatoen på produktet, alt efter hvad der kommer først. Nedsænk aldrig beholderen i vand for at bestemme, hvor fuld beholderen er ("flydetest").
Generelt er teknikken til administration af PROAIR HFA inhalationsaerosol til børn den samme som for voksne. Børn bør bruge PROAIR HFA inhalationsaerosol under opsyn af en voksen som instrueret af patientens læge.
FDA-godkendt patientmærkning
Se afrivning illustreret Information til patienten folder.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
et 2-årigt studie med Sprague-Dawley-rotter forårsagede albuterolsulfat en dosisrelateret stigning i forekomsten af benigne leiomyomer i mesovarium ved og over diætdoser på 2 mg/kg (ca. 15 gange og 6 gange den maksimalt anbefalede humane daglig inhalationsdosis (MRHDID) til henholdsvis voksne og børn på mg/m²-basis). I en anden undersøgelse blev denne effekt blokeret af samtidig administration af propranolol, en ikke-selektiv beta-adrenerg antagonist. I et 18-måneders studie i CD-1 mus viste albuterolsulfat ingen tegn på tumorigenicitet ved diætdoser på op til 500 mg/kg (ca. 1.900 gange og 740 gange MRHDID for henholdsvis voksne og børn på en mg/m²) basis). I et 22-måneders studie i guldhamstere viste albuterolsulfat ingen tegn på tumorigenicitet ved diætdoser på op til 50 mg/kg (ca. 250 gange og 100 gange MRHDID for henholdsvis voksne og børn på mg/m²-basis) .
Albuterolsulfat var ikke mutagent i Ames-testen eller en mutationstest i gær. Albuterolsulfat var ikke klastogent i et humant perifert lymfocytassay eller i et AH1-stamme muse mikronukleusassay.
Reproduktionsundersøgelser med rotter viste ingen tegn på nedsat fertilitet ved orale doser op til 50 mg/kg (ca. 380 gange MRHDID for voksne på mg/m²-basis).
Brug i specifikke populationer
Graviditet
Graviditetseksponeringsregister
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for astmamedicin under graviditeten. For mere information, kontakt Mothers To Baby Pregnancy Studies udført af Organisation of Teratology Information Specialists på 1-877-311-8972 eller besøg http://mothertobaby.org/pregnancystudies/.
Risikooversigt
Der er ingen randomiserede kliniske undersøgelser af brug af albuterol under graviditet. Tilgængelige data fra offentliggjorte epidemiologiske undersøgelser og postmarketing-caserapporter af graviditetsudfald efter inhaleret albuterolbrug viser ikke konsekvent en risiko for alvorlige fødselsdefekter eller abort. Der er kliniske overvejelser ved brug af albuterol til gravide kvinder [se Kliniske overvejelser ]. I reproduktionsstudier på dyr, når albuterolsulfat blev administreret subkutant til gravide mus, var der tegn på ganespalte ved mindre end og op til 9 gange den maksimalt anbefalede humane daglige inhalationsdosis (MRHDID) [se Data ].
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for de(n) angivne population(er) er ukendt. I den generelle befolkning i USA er den estimerede risiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 til 4 % og 15 til 20 %.
Kliniske overvejelser
Sygdomsassocieret moder- og/eller embryo-/fosterrisiko
Hos kvinder med dårligt eller moderat kontrolleret astma er der en øget risiko for svangerskabsforgiftning hos moderen og præmaturitet, lav fødselsvægt og lille for svangerskabsalderen hos den nyfødte. Gravide kvinder bør overvåges nøje, og medicinen skal justeres efter behov for at opretholde optimal kontrol.
Arbejde eller levering
På grund af potentialet for beta-agonistinterferens med uterus kontraktilitet, bør brugen af PROAIR HFA inhalationsaerosol til lindring af bronkospasme under fødslen begrænses til de patienter, hvor fordelene klart opvejer risikoen. PROAIR HFA Inhalation Aerosol er ikke godkendt til håndtering af for tidlig fødsel. Alvorlige bivirkninger, herunder lungeødem, er blevet rapporteret under eller efter behandling af for tidlig fødsel med beta2-agonister, inklusive albuterol.
Data
Dyredata
et reproduktionsstudie med mus frembragte subkutant administreret albuterolsulfat dannelse af ganespalte hos 5 ud af 111 (4,5 %) fostre ved en eksponering på ni tiendedele af MRHDID for voksne (på mg/m²-basis ved en moderdosis på 0,25 mg/kg) ) og hos 10 ud af 108 (9,3 %) fostre ved ca. 9 gange MRHDID (på en mg/m²-basis ved en moderdosis på 2,5 mg/kg). Lignende virkninger blev ikke observeret ved ca. en ellevte af MRHDID for voksne (på mg/m²-basis ved en maternel dosis på 0,025 mg/kg). Ganespalte forekom også hos 22 ud af 72 (30,5 %) fostre fra hunner behandlet subkutant med isoproterenol (positiv kontrol).
I et reproduktionsstudie med kanin inducerede oralt administreret albuterolsulfat kranioschise hos 7 ud af 19 fostre (37 %) ved ca. 750 gange MRHDID (på mg/m²-basis ved en moderdosis på 50 mg/kg).
et reproduktionsstudie med rotter frembragte en albuterolsulfat/HFA-134a-formulering administreret ved inhalation ingen teratogene virkninger ved eksponeringer på ca. 80 gange MRHDID (på mg/m²-basis ved en moderdosis på 10,5 mg/kg).
En undersøgelse, hvor gravide rotter blev doseret med radioaktivt mærket albuterolsulfat, viste, at lægemiddelrelateret materiale overføres fra moderens kredsløb til fosteret.
Amning
Risikooversigt
Der er ingen tilgængelige data om tilstedeværelsen af albuterol i modermælk, virkningerne på det ammede barn eller virkningerne på mælkeproduktionen. Imidlertid er plasmaniveauer af albuterol efter inhalerede terapeutiske doser lave hos mennesker, og hvis det findes i modermælk, har albuterol en lav oral biotilgængelighed [se KLINISK FARMAKOLOGI ].
De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for albuterol og eventuelle negative virkninger på det ammede barn fra albuterol eller fra den underliggende moderens tilstand.
Pædiatrisk brug
Sikkerheden og effektiviteten af PROAIR HFA inhalationsaerosol til behandling eller forebyggelse af bronkospasmer hos børn på 12 år og ældre med reversibel obstruktiv luftvejssygdom er baseret på et 6-ugers klinisk forsøg med 116 patienter på 12 år og ældre med astma, doser på 180 mcg fire gange dagligt med placebo og et enkelt-dosis crossover-studie, der sammenligner doser på 90, 180 og 270 mcg med placebo hos 58 patienter [se Kliniske Studier ]. Sikkerheden og effektiviteten af PROAIR HFA inhalationsaerosol til behandling af anstrengelsesinduceret bronkospasme hos børn på 12 år og ældre er baseret på en enkeltdosis crossover-undersøgelse hos 24 voksne og unge med anstrengelsesinduceret bronkospasme, der sammenligner doser på 180 mcg med placebo [se Kliniske Studier ].
Sikkerheden af PROAIR HFA inhalationsaerosol til børn i alderen 4 til 11 år er baseret på et 3-ugers klinisk forsøg med 50 patienter i alderen 4 til 11 år med astma, der anvender den samme formulering af albuterol som i PROAIR HFA inhalationsaerosol, der sammenligner doser af 180 mcg fire gange dagligt med placebo. Effektiviteten af PROAIR HFA inhalationsaerosol hos børn i alderen 4 til 11 år er ekstrapoleret fra kliniske forsøg med patienter på 12 år og ældre med astma og anstrengelsesinduceret bronkospasme, baseret på data fra et enkeltdosisstudie, der sammenligner den bronkodilaterende effekt af PROAIR HFA 90 mcg og 180 mcg med placebo hos 55 patienter med astma og et 3-ugers klinisk forsøg med den samme formulering af albuterol som i PROAIR HFA inhalationsaerosol hos 95 astmatiske børn i alderen 4 til 11 år sammenlignet med en dosis på 180 mcg albuterol fire gange dagligt med placebo [se Kliniske Studier ].
Sikkerheden og effektiviteten af PROAIR HFA inhalationsaerosol hos pædiatriske patienter under 4 år er ikke blevet fastlagt.
Geriatrisk brug
Kliniske undersøgelser af PROAIR HFA inhalationsaerosol omfattede ikke et tilstrækkeligt antal patienter på 65 år og derover til at afgøre, om de reagerer anderledes end yngre patienter. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling [se ADVARSLER OG FORHOLDSREGLER ].
Alle beta2-adrenerge agonister, inklusive albuterol, er kendt for at udskilles væsentligt af nyrerne, og risikoen for toksiske reaktioner kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og det kan være nyttigt at overvåge nyrefunktionen.
OVERDOSIS
De forventede symptomer ved overdosering er symptomer på overdreven betaadrenerg stimulering og/eller forekomst eller overdrivelse af nogen af symptomerne anført under BIVIRKNINGER, f.eks. krampeanfald, angina, hypertension eller hypotension, takykardi med hastigheder på op til 200 slag i minuttet, arytmier, nervøsitet , hovedpine, tremor, mundtørhed, hjertebanken, kvalme, svimmelhed, træthed, utilpashed og søvnløshed.
Hypokaliæmi kan også forekomme. Som med al sympatomimetisk medicin kan hjertestop og endda død være forbundet med misbrug af PROAIR HFA inhalationsaerosol.
Behandlingen består af seponering af PROAIR HFA inhalationsaerosol sammen med passende symptomatisk behandling. Den fornuftige brug af en kardioselektiv beta-receptorblokker kan overvejes i betragtning af, at sådan medicin kan fremkalde bronkospasme. Der er utilstrækkelig evidens til at afgøre, om dialyse er gavnligt for overdosering af PROAIR HFA inhalationsaerosol.
Den orale, dødelige orale dosis af albuterolsulfat hos mus er større end 2.000 mg/kg (ca. 6.800 gange den maksimale anbefalede daglige inhalationsdosis for voksne på mg/m²-basis og ca. 3.200 gange den maksimale anbefalede daglige inhalationsdosis til børn på en mg /m² basis). Hos modne rotter er den subkutane median letale dosis af albuterolsulfat ca. 450 mg/kg (ca. 3.000 gange den maksimalt anbefalede daglige inhalationsdosis for voksne på mg/m² basis og ca. 1.400 gange den maksimale anbefalede daglige inhalationsdosis til børn på en mg/m² basis). Hos unge rotter er den subkutane median letale dosis ca. 2.000 mg/kg (ca. 14.000 gange den maksimale anbefalede daglige inhalationsdosis for voksne på mg/m² basis og ca. 6.400 gange den maksimale anbefalede daglige inhalationsdosis for børn på en mg/m² basis). Den dødelige mediandosis ved inhalation er ikke blevet bestemt hos dyr.
KONTRAINDIKATIONER
PROAIR HFA inhalationsaerosol er kontraindiceret til patienter med en historie med overfølsomhed over for albuterol og andre PROAIR HFA inhalationsaerosolkomponenter. Sjældne tilfælde af overfølsomhedsreaktioner, herunder nældefeber, angioødem og udslæt er blevet rapporteret efter brug af albuterolsulfat [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Albuterolsulfat er en beta 2-adrenerg agonist. De farmakologiske virkninger af albuterolsulfat kan tilskrives aktivering af beta 2-adrenerge receptorer på glat muskulatur i luftvejene. Aktivering af beta2-adrenerge receptorer fører til aktivering af adenylcyclase og til en stigning i den intracellulære koncentration af cyklisk-3', 5'-adenosinmonofosfat (cyklisk AMP). Denne stigning af cyklisk AMP er forbundet med aktiveringen af proteinkinase A, som igen hæmmer phosphoryleringen af myosin og sænker intracellulære ioniske calciumkoncentrationer, hvilket resulterer i muskelafslapning. Albuterol afslapper den glatte muskulatur i alle luftveje, fra luftrøret til de terminale bronkioler. Albuterol fungerer som en funktionel antagonist til at slappe af luftvejene uanset det involverede spasmogen og beskytter dermed mod alle bronkokonstriktor-udfordringer. Øgede cykliske AMP-koncentrationer er også forbundet med inhibering af frigivelse af mediatorer fra mastceller i luftvejene. Selvom det er anerkendt, at beta2adrenerge receptorer er de dominerende receptorer på bronkial glat muskulatur, indikerer data, at der er beta-receptorer i det menneskelige hjerte, hvoraf 10% til 50% er hjerte-beta2-adrenerge receptorer. Den præcise funktion af disse receptorer er ikke blevet fastslået [se ADVARSLER OG FORHOLDSREGLER ].
Albuterol har i de fleste kontrollerede kliniske forsøg vist sig at have mere effekt på luftvejene i form af afslapning af den glatte bronkialmuskel end isoproterenol ved sammenlignelige doser, samtidig med at det producerer færre kardiovaskulære effekter. Imidlertid kan inhaleret albuterol, ligesom andre beta-adrenerge agonister, fremkalde en signifikant kardiovaskulær effekt hos nogle patienter, målt ved pulsfrekvens, blodtryk, symptomer og/eller elektrokardiografiske ændringer [se ADVARSLER OG FORHOLDSREGLER ].
Farmakokinetik
De systemiske niveauer af albuterol er lave efter inhalation af anbefalede doser. I en crossover-undersøgelse udført med raske mandlige og kvindelige frivillige, gav høje kumulative doser af PROAIR HFA inhalationsaerosol (1.080 mcg albuterolbase administreret over en time) gennemsnitlige maksimale plasmakoncentrationer (Cmax) og systemisk eksponering (AUCinf) på ca. 4.100 pg/ mL og 28.426 pg/mL*time, sammenlignet med henholdsvis ca. 3.900 pg/mL og 28.395 pg/mL*time efter den samme dosis af en aktiv HFA-134a albuterol inhalator komparator. Den terminale plasmahalveringstid for albuterol leveret af PROAIR HFA inhalationsaerosol var ca. 6 timer. Sammenligning af de farmakokinetiske parametre viste ingen forskelle mellem produkterne.
Den farmakokinetiske profil af PROAIR HFA inhalationsaerosol blev evalueret i et to-vejs cross-over studie med 11 raske pædiatriske frivillige i alderen 4 til 11 år. En enkelt dosisadministration af PROAIR HFA inhalationsaerosol (180 mcg albuterolbase) gav et mindste kvadratmiddel (SE) Cmax og AUC0-∞ på henholdsvis 1.100 (1.18) pg/mL og 5.120 (1,15) pg/mL*time. Den mindste kvadratiske middelværdi (SE) terminal plasmahalveringstid for albuterol leveret af PROAIR HFA inhalationsaerosol var 166 (7,8) minutter.
Metabolisme og eliminering
Information tilgængelig i den publicerede litteratur tyder på, at det primære enzym, der er ansvarligt for metabolismen af albuterol hos mennesker, er SULTIA3 (sulfotransferase). Når racemisk albuterol blev administreret enten intravenøst eller via inhalation efter oral indgivelse af trækul, var der en 3- til 4-dobbelt forskel i området under koncentration-tidskurverne mellem (R)- og (S)albuterol-enantiomererne, med (S) )-albuterolkoncentrationer er konsekvent højere. Uden forbehandling med trækul var forskellene dog 8- til 24-fold efter enten oral eller inhalationsadministration, hvilket tyder på, at (R)-albuterol fortrinsvis metaboliseres i mave-tarmkanalen, formentlig af SULTIA3.
Den primære eliminationsvej for albuterol er gennem nyreudskillelse (80 % til 100 %) af enten moderstoffet eller den primære metabolit. Mindre end 20% af lægemidlet påvises i afføringen. Efter intravenøs administration af racemisk albuterol blev mellem 25 % og 46 % af (R)-albuterolfraktionen af dosis udskilt som uændret (R)-albuterol i urinen.
Geriatrisk, pædiatrisk, nedsat lever-/nyrefunktion
Der er ikke udført farmakokinetiske undersøgelser for PROAIR HFA inhalationsaerosol hos nyfødte eller ældre forsøgspersoner.
Virkningen af nedsat leverfunktion på farmakokinetikken af PROAIR HFA inhalationsaerosol er ikke blevet evalueret.
Virkningen af nedsat nyrefunktion på albuterols farmakokinetik blev evalueret hos 5 forsøgspersoner med kreatininclearance på 7 til 53 ml/min, og resultaterne blev sammenlignet med resultaterne fra raske frivillige. Nyresygdom havde ingen effekt på halveringstiden, men der var et fald på 67 % i albuterol-clearance. Der bør udvises forsigtighed ved administration af høje doser PROAIR HFA inhalationsaerosol til patienter med nedsat nyrefunktion [se Brug i specifikke populationer ].
Dyretoksikologi og/eller farmakologi
Præklinisk
Intravenøse undersøgelser på rotter med albuterolsulfat har vist, at albuterol krydser blod-hjerne-barrieren og når hjernekoncentrationer på ca. 5 % af plasmakoncentrationerne. I strukturer uden for blod-hjerne-barrieren (pineal- og hypofyse) blev albuterolkoncentrationerne fundet at være 100 gange højere end i hele hjernen.
Forsøg med laboratoriedyr (minigrise, gnavere og hunde) har vist forekomsten af hjertearytmier og pludselig død (med histologiske tegn på myokardienekrose), når β-agonister og methylxanthiner blev administreret samtidigt. Den kliniske betydning af disse fund er ukendt.
Drivmiddel HFA-134a er uden farmakologisk aktivitet undtagen ved meget høje doser hos dyr (380-1300 gange den maksimale humane eksponering baseret på sammenligninger af AUC-værdier), hvilket primært producerer ataksi, rysten, dyspnø eller spytsekretion. Disse ligner effekter produceret af de strukturelt beslægtede chlorfluorcarboner (CFC'er), som er blevet brugt i vid udstrækning i inhalatorer med afmålt dosis.
Hos dyr og mennesker blev drivmidlet HFA-134a fundet hurtigt at blive absorberet og hurtigt elimineret med en eliminationshalveringstid på 3-27 minutter hos dyr og 5-7 minutter hos mennesker. Tid til maksimal plasmakoncentration (Tmax) og gennemsnitlig opholdstid er begge ekstremt korte, hvilket fører til en forbigående forekomst af HFA-134a i blodet uden tegn på akkumulering.
Kliniske Studier
Bronkospasme forbundet med astma
Voksne og unge patienter i alderen 12 år og ældre
I et 6-ugers, randomiseret, dobbeltblindt, placebokontrolleret forsøg blev PROAIR HFA inhalationsaerosol (58 patienter) sammenlignet med en matchet placebo HFA inhalationsaerosol (58 patienter) hos astmatiske patienter i alderen 12 til 76 år i en dosis 180 mcg albuterol fire gange dagligt. En evaluator-blind markedsført aktiv komparator HFA-134a albuterol inhalatorarm (56 patienter) blev inkluderet.
Serielle FEV1-målinger, vist nedenfor som procentvis ændring fra testdagens baseline på dag 1 og på dag 43, viste, at to inhalationer af PROAIR HFA inhalationsaerosol producerede signifikant større forbedring i FEV1 i forhold til førbehandlingsværdien end den matchede placebo, samt en bronkodilatatoreffekt sammenlignelig med den markedsførte aktive komparator HFA-134a albuterol inhalator.
FEV1 som gennemsnitlig procentændring fra test-dag før-dosis i et 6-ugers klinisk forsøg Dag 1
PATIENTOPLYSNINGER
PROAIR® HFA (pro' ar) (albuterolsulfat) Indånding Aerosol
Læs denne patientinformation, før du begynder at bruge PROAIR HFA, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din læge om din medicinske tilstand eller din behandling.
Hvad er PROAIR HFA?
PROAIR HFA er en receptpligtig medicin, der bruges til personer på 4 år og ældre til at:
- behandle eller forebygge bronkospasme hos personer, der har reversibel obstruktiv luftvejssygdom
- forhindre motionsinduceret bronkospasme
Det vides ikke, om PROAIR HFA er sikkert og effektivt til børn under 4 år.
Hvem bør ikke bruge PROAIR HFA?
Brug ikke PROAIR HFA, hvis du er allergisk over for albuterolsulfat eller et af indholdsstofferne i PROAIR HFA. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i PROAIR HFA.
Hvad skal jeg fortælle min læge, før jeg bruger PROAIR HFA?
Inden du bruger PROAIR HFA, skal du fortælle det til din læge, hvis du:
- har hjerteproblemer
- har forhøjet blodtryk (hypertension)
- har kramper (kramper)
- har problemer med skjoldbruskkirtlen
- har diabetes
- har lave kaliumniveauer i dit blod
- er gravid eller planlægger at blive gravid. Det vides ikke, om PROAIR HFA vil skade dit ufødte barn. Tal med din læge, hvis du er gravid eller planlægger at blive gravid.
- ammer eller planlægger at amme. Det vides ikke, om PROAIR HFA udskilles i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du bruger PROAIR HFA.
Fortæl din læge om al den medicin du tager, herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler.
PROAIR HFA og anden medicin kan påvirke hinanden og forårsage bivirkninger. PROAIR HFA kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke den måde, PROAIR HFA virker på.
Fortæl det især din læge, hvis du tager:
- anden inhalationsmedicin eller astmamedicin
- betablokker medicin
- diuretika
- digoxin
- monoaminoxidasehæmmere
- tricykliske antidepressiva
Spørg din læge eller apoteket om en liste over disse lægemidler, hvis du er i tvivl.
Kend den medicin du tager. Hold en liste over dem for at vise din læge og apotek, når du får en ny medicin.
Hvordan skal jeg bruge PROAIR HFA?
- For detaljerede instruktioner, se "Brugsvejledning" sidst i denne patientinformation.
- Brug PROAIR HFA nøjagtigt som din læge fortæller dig at bruge det.
- Hvis dit barn skal bruge PROAIR HFA, skal du holde øje med dit barn for at sikre, at dit barn bruger inhalatoren korrekt. Din læge vil vise dig, hvordan dit barn skal bruge PROAIR HFA.
- Hver dosis PROAIR HFA bør vare op til 4 timer til 6 timer.
- Lade være med øge din dosis eller tage ekstra doser PROAIR HFA uden først at tale med din læge.
- Få lægehjælp med det samme, hvis PROAIR HFA ikke længere hjælper på dine symptomer.
- Få lægehjælp med det samme, hvis dine symptomer bliver værre, eller hvis du skal bruge din inhalator oftere.
- Mens du bruger PROAIR HFA, må du ikke bruge anden inhalationsmedicin og astmamedicin, medmindre din læge fortæller dig at gøre det.
- Ring til din læge, hvis dine astmasymptomer som hvæsen og vejrtrækningsbesvær bliver værre i løbet af et par timer eller dage. Din læge skal muligvis give dig anden medicin (f.eks. kortikosteroider) for at behandle dine symptomer.
Hvad er de mulige bivirkninger af PROAIR HFA?
PROAIR HFA kan forårsage alvorlige bivirkninger, herunder:
- forværring af vejrtrækningsbesvær, hoste og hvæsende vejrtrækning (paradoksal bronkospasme). Hvis dette sker, skal du stoppe med at bruge PROAIR HFA og ringe til din læge eller få akut hjælp med det samme. Paradoksal bronkospasme er mere tilbøjelig til at opstå ved din første brug af en ny medicinbeholder.
- hjerteproblemer, herunder hurtigere puls og højere blodtryk
- mulig død hos personer med astma, der bruger for meget PROAIR HFA
- allergiske reaktioner. Ring til din læge med det samme, hvis du har følgende symptomer på en allergisk reaktion:
- kløende hud
- hævelse under din hud eller i din hals
- udslæt
- forværrede vejrtrækningsbesvær
- lavt kaliumniveau i dit blod
- forværring af andre medicinske problemer hos personer, der også bruger PROAIR HFA, herunder stigninger i blodsukkeret
De mest almindelige bivirkninger af PROAIR HFA omfatter:
- dit hjerte føles som om det banker eller banker (hjertebanken)
- brystsmerter
- hurtig puls
- rystelse
- nervøsitet
- hovedpine
- svimmelhed
- ondt i halsen
- løbende næse
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af PROAIR HFA. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare PROAIR HFA?
- Opbevar PROAIR HFA ved stuetemperatur mellem 59°F og 77°F (15°C og 25°C).
- Undgå udsættelse for ekstrem varme og kulde.
- Ryst PROAIR HFA-beholderen godt før brug.
- Lade være med punktere PROAIR HFA-beholderen.
- Lade være med Opbevar PROAIR HFA-beholderen i nærheden af varme eller en flamme. Temperaturer over 120° F kan få beholderen til at briste.
- Lade være med smid PROAIR HFA-beholderen i et bål eller et forbrændingsanlæg.
- Undgå at sprøjte PROAIR HFA i dine øjne.
Opbevar PROAIR HFA og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af PROAIR HFA
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke PROAIR HFA til en tilstand, som den ikke er ordineret til. Giv ikke PROAIR HFA til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne patientinformation opsummerer den vigtigste information om PROAIR HFA. Hvis du vil have mere information, så tal med din læge. Du kan bede din apoteker eller læge om information om PROAIR HFA, der er skrevet til sundhedspersonale.
For mere information, gå til www.ProAirHFA.com eller ring på 1-888-482-9522.
Hvad er ingredienserne i PROAIR HFA?
Aktiv ingrediens: albuterolsulfat
Inaktive ingredienser: drivmiddel HFA-134a og ethanol.
Brugsanvisning
PROAIR® HFA (pro' ar) (albuterolsulfat) Indånding Aerosol
Læs denne brugsanvisning, før du begynder at bruge PROAIR HFA, og hver gang du får en refill. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din læge om din medicinske tilstand eller din behandling.
Delene af din PROAIR HFA-inhalatorenhed:
Der er 2 hoveddele af din PROAIR HFA-inhalator, herunder en:
- rød plastaktuator, der sprayer medicinen fra beholderen. Se figur A.
- beskyttende støvhætte, der dækker mundstykket på aktuatoren. Se figur A.
Der er også en metalbeholder, der rummer medicinen. Se figur A.
Der er også en dosistæller fastgjort på bagsiden af aktuatoren med et visningsvindue, der viser dig, hvor mange sprays af medicin du har tilbage. Se figur B.
Du vil se en sort prik i visningsvinduet på aktuatoren, indtil enheden er blevet spædet 3 gange. Se figur B og "Primning af din PROAIR HFA-enhed" nedenfor.
Figur A og Figur B 
- Lade være med brug PROAIR HFA-aktuatoren med en beholder med medicin fra enhver anden inhalator.
- Lade være med brug en PROAIR HFA-beholder med en aktuator fra enhver anden inhalator, inklusive en anden PROAIR HFA-inhalator.
Klargøring af din PROAIR HFA-enhed:
Din PROAIR-enhed skal primes, før du bruger den første gang, eller hvis din enhed ikke har været brugt i mere end 14 dage i træk. Lade være med primer din PROAIR HFA-enhed hver dag.
- Tag din PROAIR HFA-enhed ud af pakken.
- Fjern den beskyttende støvhætte fra mundstykket.
- Ryst inhalatoren godt, og spray den ud i luften væk fra dit ansigt. Se figur C.
Figur C 
- Ryst og spray inhalatoren sådan 2 gange mere for at afslutte den. Dosistælleren på aktuatoren bør vise tallet 200, efter at du spæder aktuatoren for første gang. Se figur D.
Figur D 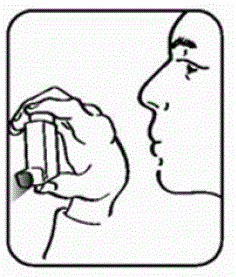
Hver gang du bruger din PROAIR HFA-enhed:
- Sørg for, at beholderen passer godt ind i plastaktuatoren.
- Kig ind i mundstykket for at sikre, at der ikke er fremmedlegemer der, især hvis hætten ikke er blevet brugt til at dække mundstykket.
Aflæsning af dosistælleren på din PROAIR HFA-aktuator
- Dosistælleren tæller ned, hver gang en spray frigives. Dosistællervinduet viser antallet af sprays tilbage i din inhalator i enheder af 2 sprays. For eksempel er der 190 sprays tilbage, hvis pilen er præcis modsat tallet 190, eller 189 sprays tilbage, hvis pilen peger mellem 190 og 188. Se figur D.
- Når dosistælleren når 0, vil den fortsætte med at vise 0, og du bør udskifte din PROAIR HFA-enhed.
- Dosistælleren kan ikke nulstilles og er permanent fastgjort til aktuatoren. Ændre aldrig tallene for dosistælleren eller rør ved stiften inde i aktuatoren.
- Lade være med fjern beholderen fra plastaktuatoren undtagen under rengøring. Gentilslutning af beholderen til aktuatoren kan ved et uheld frigive en dosis PROAIR HFA til luften. Dosistælleren tæller ned, hver gang en spray frigives.
Brug af din PROAIR HFA-enhed:
Trin 1. Ryst inhalatoren godt før hver sprøjtning. Tag hætten af mundstykket på aktuatoren.
Trin 2. Hold inhalatoren med mundstykket nede. Se figur E.
Figur E 
Trin 3. Træk vejret ud gennem munden og skub så meget luft fra dine lunger som du kan. Sæt mundstykket i munden og luk læberne omkring det. Se figur F.
Trin 4. Skub toppen af beholderen helt ned, mens du trækker vejret dybt og langsomt ind gennem munden. Se figur F.
Figur F 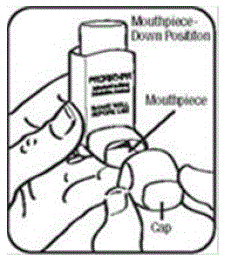
Trin 5. Lige efter at sprayen kommer ud, skal du fjerne fingeren fra beholderen. Når du har trukket vejret hele vejen, skal du tage inhalatoren ud af munden og lukke munden.
Trin 6. Hold vejret så længe du kan, op til 10 sekunder, derefter trække vejret normalt.
Hvis din læge har bedt dig om at bruge flere sprays, vent 1 minut og ryst inhalatoren igen. Gentag trin 2 til trin 6.
Trin 7. Sæt hætten tilbage på mundstykket, hver gang du bruger inhalatoren. Sørg for, at hætten klikker på plads.
Rengøring af din PROAIR HFA-enhed:
Det er meget vigtigt at holde plastaktuatoren ren, så medicinen ikke samler sig og blokerer sprayen. Se figur G og figur H.
Figur G og Figur H 
- Forsøg ikke at rengøre metalbeholderen eller lade den blive våd. Inhalatoren kan stoppe med at sprøjte, hvis den ikke rengøres korrekt.
- Hvis du har mere end 1 PROAIR HFA-inhalator, skal du vaske hver enhed på separate tidspunkter for at undgå at sætte den forkerte beholder sammen med den forkerte plastikaktuator. På denne måde kan du være sikker på, at du altid kender det korrekte antal resterende doser af PROAIR HFA.
- Vask aktuatoren mindst 1 gang om ugen som følger:
- Tag beholderen ud af aktuatoren, og tag hætten af mundstykket.
- Hold aktuatoren under vandhanen og kør varmt vand igennem den i ca. 30 sekunder. Se figur I.
Figur I 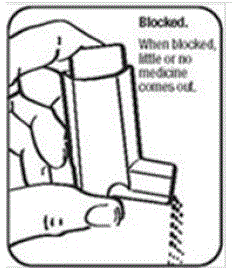
- Vend aktuatoren på hovedet og kør varmt vand gennem mundstykket i ca. 30 sekunder. Se figur J.
Figur J 
- Ryst så meget vand fra aktuatoren som muligt. Kig ind i mundstykket for at sikre dig, at eventuel ophobning af medicin er vasket helt væk. Hvis der er ophobning, gentages vaskeanvisningen.
- Lad aktuatoren lufttørre helt, f.eks. natten over. Se figur K.
Figur K 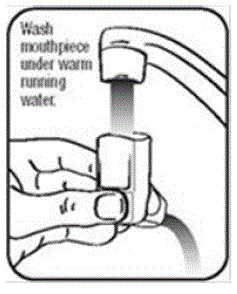
- Når aktuatoren er tør, skal du sætte beholderen i aktuatoren og sørge for, at den sidder godt fast. Ryst inhalatoren godt og spray den to gange ud i luften væk fra dit ansigt. Sæt hætten tilbage på mundstykket.
Hvis du skal bruge din inhalator, før aktuatoren er helt tør:
- Ryst så meget vand af aktuatoren som muligt.
- Sæt beholderen i aktuatoren, og sørg for, at den sidder godt fast.
- Ryst inhalatoren godt og spray den to gange ud i luften væk fra dit ansigt.
- Tag din PROAIR HFA dosis som foreskrevet.
- Følg rengøringsinstruktionerne ovenfor.
Udskiftning af din PROAIR HFA-enhed
- Når dosistælleren på aktuatoren siger tallet 20, farven på tallene ændres til rød. De røde tal skal minde dig om at genopfylde din recept eller bede din læge om en anden recept til PROAIR HFA. Når dosistælleren når 0, skifter baggrundsfarven til konstant rød.
- Smid PROAIR HFA-inhalatoren væk så snart dosistælleren siger 0 eller efter udløbsdatoen på PROAIR HFA-emballagen, alt efter hvad der kommer først. Du bør ikke fortsætte med at bruge inhalatoren efter 200 sprays, selvom beholderen måske ikke er helt tom. Du kan ikke være sikker på, at du får noget medicin efter at have brugt 200 sprays.
- Brug ikke inhalatoren efter udløbsdatoen på PROAIR HFA-emballagen.
Denne patientinformation og brugsanvisning er godkendt af US Food and Drug Administration.
