Spiriva 9mcg Tiotropium Bromide Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Spiriva 9mcg HandiHaler, og hvordan bruges det?
Spiriva HandiHaler (tiotropiumbromid) Inhalationspulver er et antikolinergisk lægemiddel, der bruges til at forhindre bronkospasme (forsnævring af luftvejene i lungerne) hos personer med bronkitis, emfysem eller KOL (kronisk obstruktiv lungesygdom).
Hvad er bivirkninger af Spiriva 9mcg HandiHaler?
Almindelige bivirkninger af Spiriva 9mcg HandiHaler omfatter:
- tør mund,
- forstoppelse,
- dårlig mave,
- opkastning,
- forkølelsessymptomer (tilstoppet næse, nysen, ondt i halsen),
- næseblod, eller
- muskelsmerter.
Fortæl din læge, hvis du har alvorlige bivirkninger af Spiriva 9mcg HandiHaler, herunder:
- vanskelig eller smertefuld vandladning, eller
- hurtig hjerterytme.
BESKRIVELSE
SPIRIVA 9mcg HANDIHALER består af SPIRIVA kapsler og en HANDIHALER enhed. Hver lysegrøn, hård gelatine SPIRIVA 9 mcg kapsel indeholder et tørt pulver bestående af 18 mcg tiotropium (svarende til 22,5 mcg tiotropiumbromidmonohydrat) blandet med lactosemonohydrat (som kan indeholde mælkeproteiner).
Indholdet af SPIRIVA-kapsler er kun beregnet til oral inhalation og er kun beregnet til administration med HANDIHALER-enheden.
Den aktive komponent i SPIRIVA HANDIHALER er tiotropium. Lægemidlet, tiotropiumbromidmonohydrat, er et antikolinergt middel med specificitet for muskarine receptorer. Det er kemisk beskrevet som (1α, 2β, 4β, 5α, 7β)-7-[(Hydroxydi-2-thienylacetyl)oxy]-9,9-dimethyl-3-oxa-9-azoniatricyclo[3.3.1.02,4] nonanbromidmonohydrat. Det er en syntetisk, ikke-chiral, kvaternær ammoniumforbindelse. Tiotropiumbromid er et hvidt eller gulligt hvidt pulver. Det er tungtopløseligt i vand og opløseligt i methanol.
Strukturformlen er:
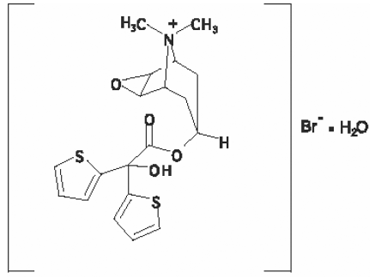
Tiotropiumbromid (monohydrat) har en molekylvægt på 490,4 og en molekylær formel på C19H22NO4S2Br • H2O.
HANDIHALER-enheden er en inhalationsanordning, der bruges til at inhalere det tørre pulver, der er indeholdt i SPIRIVA 9mcg-kapslen. Det tørre pulver leveres fra HANDIHALER-enheden med flowhastigheder så lave som 20 l/min. Under standardiseret in vitro-testing afgiver HANDIHALER-enheden et gennemsnit på 10,4 mcg tiotropium, når den testes ved en flowhastighed på 39 l/min i 3,1 sekunder (2 L i alt). I en undersøgelse af 26 voksne patienter med KOL og alvorligt kompromitteret lungefunktion [gennemsnitlig FEV1 1,02 L (interval 0,45 til 2,24 L); 37,6 % af forudsagt (interval 16 % til 65 %)], median peak inspiratorisk flow (PIF) gennem HANDIHALER-enheden var 30,0 l/min (interval 20,4 til 45,6 l/min). Mængden af lægemiddel leveret til lungerne vil variere afhængigt af patientfaktorer såsom inspiratorisk flow og maksimal inspiratorisk flow gennem HANDIHALER-enheden, som kan variere fra patient til patient og kan variere med eksponeringstiden for SPIRIVA 9mcg-kapslen uden for blisterpakningen pakke.
INDIKATIONER
SPIRIVA HANDIHALER (tiotropiumbromid inhalationspulver) er indiceret til langsigtet vedligeholdelsesbehandling én gang dagligt af bronkospasme forbundet med kronisk obstruktiv lungesygdom (KOL), inklusive kronisk bronkitis og emfysem. SPIRIVA 9mcg HANDIHALER er indiceret til at reducere eksacerbationer hos KOL-patienter.
DOSERING OG ADMINISTRATION
Kun til oral inhalation. SPIRIVA 9mcg kapsler må ikke sluges, da den tilsigtede virkning på lungerne ikke opnås. Indholdet af SPIRIVA-kapslerne bør kun bruges sammen med HANDIHALER-apparatet [se OVERDOSIS ].
Den anbefalede dosis af SPIRIVA HANDIHALER er to inhalationer af pulverindholdet i én SPIRIVA-kapsel én gang dagligt med HANDIHALER-anordningen [se PATIENTOPLYSNINGER ]. Tag ikke mere end én dosis på 24 timer.
Til administration af SPIRIVA HANDIHALER anbringes en SPIRIVA 9mcg kapsel i det midterste kammer på HANDIHALER-enheden. SPIRIVA 9mcg-kapslen gennembores ved at trykke og slippe den grønne piercingknap på siden af HANDIHALER-enheden. Tiotropium-formuleringen dispergeres i luftstrømmen, når patienten inhalerer gennem mundstykket [se PATIENTOPLYSNINGER ].
Dosisjustering er ikke nødvendig for geriatriske, leversvigte eller nyre-svigtede patienter. Patienter med moderat til svær nyreinsufficiens, der får SPIRIVA 9mcg HANDIHALER, bør dog overvåges nøje for antikolinerge virkninger [se ADVARSLER OG FORHOLDSREGLER , Brug i specifikke populationer , og KLINISK FARMAKOLOGI ].
HVORDAN LEVERET
Doseringsformer og styrker
Inhalationspulver
SPIRIVA 9mcg HANDIHALER består af SPIRIVA-kapsler indeholdende tiotropiumpulver til oral inhalation og en HANDIHALER-anordning. SPIRIVA 9 mcg kapsler indeholder 18 mcg tiotropium i en lysegrøn, hård gelatinekapsel med TI 01 trykt på den ene side og Boehringer Ingelheim firmalogo på den anden side. HANDIHALER-enheden er kun beregnet til brug med SPIRIVA-kapslerne.
Opbevaring og håndtering
SPIRIVA HANDIHALER består af SPIRIVA 9mcg kapsler og HANDIHALER enheden. SPIRIVA 9 mcg kapsler indeholder 18 mcg tiotropium og er lysegrønne med Boehringer Ingelheim firmalogoet på SPIRIVA kapselhætten og TI 01 på SPIRIVA kapselhuset eller omvendt.
HANDIHALER-enheden er gråfarvet med en grøn piercingknap. Det er præget med SPIRIVA HANDIHALER (tiotropiumbromid inhalationspulver), Boehringer Ingelheim firmalogo. Det er også påtrykt for at angive, at SPIRIVA-kapsler ikke bør opbevares i HANDIHALER-enheden, og at HANDIHALER-enheden kun må bruges sammen med SPIRIVA 9mcg-kapsler.
SPIRIVA 9mcg kapsler er pakket i et aluminium/aluminium blisterkort og sat sammen langs en perforeret linje. SPIRIVA 9mcg kapsler bør altid opbevares i blisterpakningen og kun fjernes umiddelbart før brug. Lægemidlet skal anvendes umiddelbart efter, at pakningen over en individuel SPIRIVA-kapsel er åbnet.
Følgende pakker er tilgængelige:
- karton indeholdende 5 SPIRIVA 9 mcg kapsler (1 enhedsdosis blisterkort) og 1 HANDIHALER inhalationsenhed ( NDC 0597-0075-75) (institutionel pakke)
- karton indeholdende 30 SPIRIVA 9 mcg kapsler (3 enhedsdosis blisterkort) og 1 HANDIHALER inhalationsenhed ( NDC 0597-0075-41)
- karton indeholdende 90 SPIRIVA kapsler (9 enhedsdosis blisterkort) og 1 HANDIHALER inhalationsenhed ( NDC 0597-0075-47)
Holde utilgængeligt for børn. Få ikke pulver i øjnene.
Opbevaring
Opbevares ved 25°C (77°F); udflugter tilladt til 15° til 30°C (59° til 86°F) [se USP kontrolleret rumtemperatur].
SPIRIVA-kapslerne bør ikke udsættes for ekstreme temperaturer eller fugt. Opbevar ikke SPIRIVA 9mcg-kapsler i HANDIHALER-enheden.
Distribueret af: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Revideret: februar 2018
BIVIRKNINGER
Følgende bivirkninger er beskrevet eller beskrevet mere detaljeret i andre afsnit:
- Øjeblikkelige overfølsomhedsreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Paradoksal bronkospasme [se ADVARSLER OG FORHOLDSREGLER ]
- Forværring af snævervinklet glaukom [se ADVARSLER OG FORHOLDSREGLER ]
- Forværring af urinretention [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan forekomsten af bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med forekomsten i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de forekomster, der er observeret i praksis.
6-måneders til 1-årige forsøg
Dataene beskrevet nedenfor afspejler eksponering for SPIRIVA 9mcg HANDIHALER hos 2663 patienter. SPIRIVA 9mcg HANDIHALER blev undersøgt i to 1-årige placebo-kontrollerede forsøg, to 1-årige aktivt kontrollerede forsøg og to 6-måneders placebo-kontrollerede forsøg med patienter med KOL. I disse forsøg blev 1308 patienter behandlet med SPIRIVA HANDIHALER i den anbefalede dosis på 18 mcg én gang dagligt. Befolkningen havde en alder fra 39 til 87 år med 65 % til 85 % mænd, 95 % kaukasiske og havde KOL med en gennemsnitlig præbronkodilatator forceret eksspiratorisk volumen på et sekund (FEV1) procent forudsagt på 39 % til 43 %. Patienter med snævervinklet glaukom eller symptomatisk prostatahypertrofi eller blæreudløbsobstruktion blev udelukket fra disse forsøg. Et yderligere 6-måneders forsøg udført i en Veteran's Affairs indstilling er ikke inkluderet i denne sikkerhedsdatabase, fordi der kun blev indsamlet alvorlige bivirkninger.
Den mest almindeligt rapporterede bivirkning var mundtørhed. Mundtørhed var sædvanligvis mild og forsvandt ofte under fortsat behandling. Andre reaktioner rapporteret hos individuelle patienter og i overensstemmelse med mulige antikolinerge virkninger omfattede forstoppelse, takykardi, sløret syn, glaukom (nyopstået eller forværret), dysuri og urinretention.
Fire multicenter, 1-årige, placebo-kontrollerede og aktiv-kontrollerede forsøg evaluerede SPIRIVA HANDIHALER hos patienter med KOL. Tabel 1 viser alle bivirkninger, der opstod med en frekvens på ≥3 % i SPIRIVA 9mcg HANDIHALER-gruppen i de 1-årige placebokontrollerede forsøg, hvor hyppigheden i SPIRIVA HANDIHALER-gruppen oversteg placebo med ≥1 %. Hyppigheden af tilsvarende reaktioner i de ipratropium-kontrollerede forsøg er inkluderet til sammenligning.
Arthritis, hoste og influenzalignende symptomer forekom med en frekvens på ≥3 % i SPIRIVA 9mcg HANDIHALER-behandlingsgruppen, men var
Andre reaktioner, der opstod i SPIRIVA HANDIHALER-gruppen med en frekvens på 1 % til 3 % i de placebokontrollerede forsøg, hvor frekvensen oversteg frekvensen i placebogruppen, omfatter:
Kroppen som helhed: allergisk reaktion, bensmerter;
Centrale og perifere nervesystem: dysfoni, paræstesi;
Forstyrrelser i mave-tarmsystemet: gastrointestinal lidelse, ikke andet specificeret (NOS), gastroøsofageal refluks, stomatitis (inklusive ulcerøs stomatitis);
Metaboliske og ernæringsforstyrrelser: hypercholesterolæmi, hyperglykæmi;
Sygdomme i bevægeapparatet: skeletsmerter;
Hjertehændelser: angina pectoris (herunder forværret angina pectoris);
Psykiatrisk lidelse: depression; Infektioner: herpes zoster;
Åndedrætssystemlidelse (øvre): laryngitis;
Synsforstyrrelse: grå stær.
Blandt de bivirkninger, der blev observeret i de kliniske forsøg med en incidens på
de 1-årige forsøg steg forekomsten af mundtørhed, forstoppelse og urinvejsinfektion med alderen [se Brug i specifikke populationer ].
To multicenter, 6-måneders, kontrollerede undersøgelser evaluerede SPIRIVA 9mcg HANDIHALER hos patienter med KOL. Bivirkningerne og forekomsten svarede til dem, der blev set i de 1-årige kontrollerede forsøg.
4-års prøvetid
Dataene beskrevet nedenfor afspejler eksponering for SPIRIVA 9mcg HANDIHALER hos 5992 KOL-patienter i et 4-årigt placebokontrolleret forsøg. I dette forsøg blev 2986 patienter behandlet med SPIRIVA 9 mcg HANDIHALER i den anbefalede dosis på 18 mcg én gang dagligt. Befolkningen havde en aldersgruppe fra 40 til 88 år, var 75 % mænd, 90 % kaukasiske og havde KOL med en gennemsnitlig præ-bronkodilatator FEV1 procent forudsagt på 40 %. Patienter med snævervinklet glaukom eller symptomatisk prostatahypertrofi eller blæreudløbsobstruktion blev udelukket fra disse forsøg. Når bivirkningerne blev analyseret med en frekvens på ≥3 % i SPIRIVA 9mcg HANDIHALER-gruppen, hvor hyppigheden i SPIRIVA 9mcg HANDIHALER-gruppen oversteg placebo med ≥1 %, inkluderede bivirkninger (SPIRIVA 9mcg HANDIHALER, placebo): 12,5 % ph. , 10,8 %), bihulebetændelse (6,5 %, 5,3 %), hovedpine (5,7 %, 4,5 %), forstoppelse (5,1 %, 3,7 %), mundtørhed (5,1 %, 2,7 %), depression (4,4 %, 3,3 %). , søvnløshed (4,4 %, 3,0 %) og artralgi (4,2 %, 3,1 %).
Yderligere bivirkninger
Andre bivirkninger, der ikke tidligere er nævnt, og som blev rapporteret hyppigere hos KOL-patienter behandlet med SPIRIVA 9mcg HANDIHALER end placebo, omfatter: dehydrering, hudsår, stomatitis, tandkødsbetændelse, oropharyngeal candidiasis, tør hud, hudinfektion og ledhævelser.
Postmarketing oplevelse
Bivirkninger er blevet identificeret under verdensomspændende brug af SPIRIVA HANDIHALER efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering. Disse bivirkninger er: irritation på applikationsstedet (glossitis, mundsår og pharyngolaryngeal smerte), svimmelhed, dysfagi, hæshed, intestinal obstruktion inklusive paralytisk ileus, øget intraokulært tryk, oral candidiasis, hjertebanken, pruritus, takykardi, halsirritation og.
DRUGSINTERAKTIONER
Sympatomimetika, Methylxanthiner, Steroider
SPIRIVA 9mcg HANDIHALER er blevet brugt sammen med kort- og langtidsvirkende sympatomimetiske (beta-agonister) bronkodilatatorer, methylxanthiner og orale og inhalerede steroider uden stigning i bivirkninger.
Anticholinergika
Der er potentiale for en additiv interaktion med samtidig brugt antikolinerg medicin. Undgå derfor samtidig administration af SPIRIVA 9mcg HANDIHALER med andre antikolinerge lægemidler, da dette kan føre til en stigning i antikolinerge bivirkninger [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Ikke til akut brug
SPIRIVA 9mcg HANDIHALER er beregnet som vedligeholdelsesbehandling én gang dagligt til KOL og bør ikke anvendes til lindring af akutte symptomer, dvs. som redningsbehandling til behandling af akutte episoder med bronkospasme.
Øjeblikkelige overfølsomhedsreaktioner
Umiddelbare overfølsomhedsreaktioner, inklusive nældefeber, angioødem (inklusive hævelse af læber, tunge eller svælg), udslæt, bronkospasme, anafylaksi eller kløe, kan forekomme efter administration af SPIRIVA 9 mcg HANDIHALER. Hvis en sådan reaktion opstår, skal behandlingen med SPIRIVA 9mcg HANDIHALER stoppes med det samme, og alternative behandlinger bør overvejes. I betragtning af den strukturformel, der ligner atropin og tiotropium, bør patienter med en historie med overfølsomhedsreaktioner over for atropin eller dets derivater monitoreres nøje for lignende overfølsomhedsreaktioner som SPIRIVA HANDIHALER. Derudover bør SPIRIVA HANDIHALER anvendes med forsigtighed til patienter med svær overfølsomhed over for mælkeproteiner.
Paradoksal bronkospasme
Inhalationsmedicin, inklusive SPIRIVA HANDIHALER, kan forårsage paradoksal bronkospasme. Hvis dette sker, skal det behandles straks med en inhaleret korttidsvirkende beta2-agonist såsom albuterol. Behandling med SPIRIVA HANDIHALER bør stoppes, og andre behandlinger bør overvejes.
Forværring af snævervinklet glaukom
SPIRIVA 9mcg HANDIHALER bør anvendes med forsigtighed til patienter med snævervinklet glaukom. Ordinerende læger og patienter bør være opmærksomme på tegn og symptomer på akut snævervinklet glaukom (f.eks. øjensmerter eller ubehag, sløret syn, visuelle glorier eller farvede billeder i forbindelse med røde øjne fra conjunctival congestion og cornea ødem). Instruer patienterne i straks at konsultere en læge, hvis nogen af disse tegn eller symptomer udvikler sig.
Forværring af urinretention
SPIRIVA HANDIHALER bør anvendes med forsigtighed hos patienter med urinretention. Læger og patienter bør være opmærksomme på tegn og symptomer på urinretention (f.eks. vandladningsbesvær, smertefuld vandladning), især hos patienter med prostatahyperplasi eller blærehalsobstruktion. Instruer patienterne i straks at konsultere en læge, hvis nogen af disse tegn eller symptomer udvikler sig.
Nedsat nyrefunktion
Som et overvejende renalt udskilt lægemiddel bør patienter med moderat til svær nyreinsufficiens (kreatininclearance KLINISK FARMAKOLOGI ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTINFORMATION og brugsanvisning ).
Ikke til akut brug
Instruer patienterne i, at SPIRIVA HANDIHALER er en bronkodilatator til vedligeholdelse én gang dagligt og ikke bør anvendes til øjeblikkelig lindring af vejrtrækningsproblemer (dvs. som redningsmedicin).
Øjeblikkelige overfølsomhedsreaktioner
Informer patienterne om, at anafylaksi, angioødem (inklusive hævelse af læber, tunge eller svælg), nældefeber, udslæt, bronkospasme eller kløe, kan forekomme efter administration af SPIRIVA 9 mcg HANDIHALER. Råd patienten til straks at afbryde behandlingen og konsultere en læge, hvis nogen af disse tegn eller symptomer udvikler sig.
Paradoksal bronkospasme
Informer patienterne om, at SPIRIVA HANDIHALER kan fremkalde paradoksal bronkospasme. Rådgiv patienterne, at hvis der opstår paradoksal bronkospasme, skal patienterne seponere med SPIRIVA HANDIHALER.
Forværring af snævervinklet glaukom
Instruer patienterne i at være opmærksomme på tegn og symptomer på snævervinklet glaukom (f.eks. øjensmerter eller ubehag, sløret syn, visuelle glorier eller farvede billeder i forbindelse med røde øjne fra conjunctival congestion og cornea ødem). Instruer patienterne i straks at konsultere en læge, hvis nogen af disse tegn og symptomer udvikler sig.
Informer patienterne om, at man skal passe på ikke at lade pulveret trænge ind i øjnene, da dette kan forårsage sløret syn og pupiludvidelse.
Da svimmelhed og sløret syn kan opstå ved brug af SPIRIVA HANDIHALER, skal patienterne advares om at deltage i aktiviteter såsom at køre bil eller betjene apparater eller maskiner.
Forværring af urinretention
Instruer patienterne i at være opmærksomme på tegn og symptomer på urinretention (f.eks. vandladningsbesvær, smertefuld vandladning). Instruer patienterne i straks at konsultere en læge, hvis nogen af disse tegn eller symptomer udvikler sig.
Instruktioner til administration af SPIRIVA HANDIHALER
Instruer patienterne i, hvordan de korrekt administrerer SPIRIVA 9mcg kapsler ved hjælp af HANDIHALER-enheden [se PATIENTOPLYSNINGER ]. Instruer patienterne i, at SPIRIVA 9mcg-kapsler kun bør administreres via HANDIHALER-enheden, og HANDIHALER-anordningen må ikke anvendes til administration af anden medicin. Mind patienterne om, at indholdet af SPIRIVA 9mcg kapsler kun er til oral inhalation og ikke må sluges.
Instruer patienterne i altid at opbevare SPIRIVA 9mcg kapsler i forseglede blisterpakninger og kun at fjerne én SPIRIVA kapsel umiddelbart før brug, ellers kan dens effektivitet blive reduceret. Instruer patienterne i at kassere ubrugte ekstra SPIRIVA-kapsler, der er udsat for luft (dvs. ikke beregnet til øjeblikkelig brug).
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Der blev ikke observeret tegn på tumorigenicitet i et 104-ugers inhalationsstudie med rotter ved tiotropiumdoser på op til 59 mcg/kg/dag, i et 83-ugers inhalationsstudie med hunmus ved doser op til 145 mcg/kg/dag og i en 101-ugers inhalationsundersøgelse i hanmus i doser op til 2 mcg/kg/dag. Disse doser svarer til henholdsvis ca. 30, 40 og 0,5 gange den anbefalede humane daglige inhalationsdosis (MRHDID) på mcg/m2-basis.
Tiotropiumbromid viste ingen tegn på mutagenicitet eller klastogenicitet i følgende assays: bakteriel genmutationsanalyse, V79 kinesisk hamstercellemutageneseassay, kromosomafvigelsesassays i humane lymfocytter in vitro og muse-mikronkernedannelse in vivo og den ikke-planlagte DNA-syntese primære rotte-hepatocytter in vitro-assay.
Hos rotter blev der observeret fald i antallet af corpora lutea og procentdelen af implantater ved inhalations tiotropium doser på 78 mcg/kg/dag eller mere (ca. 40 gange MRHDID på en mcg/m2 basis). Ingen sådanne effekter blev observeret ved 9 mcg/kg/dag (ca. 5 gange MRHDID på mcg/m2-basis). Fertilitetsindekset blev dog ikke påvirket ved inhalationsdoser op til 1689 mcg/kg/dag (ca. 910 gange MRHDID på en mcg/m2 basis).
Brug i specifikke populationer
Graviditet
Risikooversigt
De begrænsede humane data med brug af SPIRIVA 9mcg HANDIHALER under graviditet er utilstrækkelige til at informere om en lægemiddelrelateret risiko for uønskede graviditetsrelaterede udfald. Baseret på dyrereproduktionsundersøgelser blev der ikke observeret strukturelle abnormiteter, når tiotropium blev administreret ved inhalation til drægtige rotter og kaniner i løbet af organogeneseperioden i doser på henholdsvis 790 og 8 gange den maksimale anbefalede humane daglige inhalationsdosis (MRHDID). Øget post-implantationstab blev observeret hos rotter og kaniner, der fik tiotropium i maternelt toksiske doser henholdsvis 430 gange og 40 gange MRHDID [se Data ].
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Data
Dyredata
2 separate embryo-føtale udviklingsundersøgelser modtog gravide rotter og kaniner tiotropium i løbet af organogeneseperioden i doser op til henholdsvis ca. 790 og 8 gange MRHDID (på mcg/m2 basis ved inhalationsdoser på 1471 og 7 mcg/kg /dag hos henholdsvis rotter og kaniner). Der blev ikke observeret tegn på strukturelle abnormiteter hos rotter eller kaniner. Hos rotter forårsagede tiotropium imidlertid føtal resorption, kuldtab, fald i antallet af levende unger ved fødslen og den gennemsnitlige ungevægt og en forsinkelse i ungernes seksuelle modning ved tiotropiumdoser på ca. 40 gange MRHDID (på en mcg/m2) basis ved en inhalationsdosis for moderen på 78 mcg/kg/dag). Hos kaniner forårsagede tiotropium en stigning i post-implantationstab ved en tiotropiumdosis på ca. 430 gange MRHDID (på en mcg/m2 basis ved en maternel inhalationsdosis på 400 mcg/kg/dag). Sådanne effekter blev ikke observeret ved henholdsvis ca. 5 og 95 gange MRHDID (på mcg/m2 basis ved inhalationsdoser på 9 og 88 mcg/kg/dag hos henholdsvis rotter og kaniner).
Amning
Risikooversigt
Der er ingen data om tilstedeværelsen af tiotropium i modermælk, virkningerne på det ammede spædbarn eller virkningerne på mælkeproduktionen. Tiotropium er til stede i mælk fra diegivende rotter; men på grund af artsspecifikke forskelle i laktationsfysiologi er den kliniske relevans af disse data ikke klar [se Data ]. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for SPIRIVA 9mcg HANDIHALER og eventuelle negative virkninger på det ammede barn fra SPIRIVA HANDIHALER eller fra den underliggende moderens tilstand.
Data
Fordelingen af tiotropiumbromid i mælk blev undersøgt efter en enkelt intravenøs administration af 10 mg/kg til diegivende rotter. Tiotropium og/eller dets metabolitter er til stede i mælken fra diegivende rotter i koncentrationer over plasmakoncentrationerne.
Pædiatrisk brug
SPIRIVA HANDIHALER er ikke indiceret til brug til børn. Sikkerheden og effektiviteten af SPIRIVA 9mcg HANDIHALER hos pædiatriske patienter er ikke blevet fastlagt.
Geriatrisk brug
Baseret på tilgængelige data er ingen justering af SPIRIVA HANDIHALER-dosis hos geriatriske patienter berettiget [se KLINISK FARMAKOLOGI ].
Af det samlede antal patienter, der fik SPIRIVA 9mcg HANDIHALER i de 1-årige kliniske forsøg, var 426
Nedsat nyrefunktion
Patienter med moderat til svær nyreinsufficiens (kreatininclearance DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER , og KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Virkningerne af nedsat leverfunktion på tiotropiums farmakokinetik blev ikke undersøgt.
OVERDOSIS
Høje doser af tiotropium kan føre til antikolinerge tegn og symptomer. Der var dog ingen systemiske antikolinerge bivirkninger efter en enkelt inhaleret dosis på op til 282 mcg tiotropium hos 6 raske frivillige. I en undersøgelse af 12 raske frivillige blev bilateral konjunktivitis og mundtørhed set efter gentagen inhalation én gang dagligt af 141 mcg tiotropium.
Behandling af overdosering består af seponering af SPIRIVA HANDIHALER sammen med indførelse af passende symptomatisk og/eller understøttende behandling.
Utilsigtet indtagelse
Akut forgiftning ved utilsigtet oral indtagelse af SPIRIVA-kapsler er usandsynlig, da den ikke absorberes godt systemisk.
Et tilfælde af overdosering er blevet rapporteret efter markedsføring. En kvindelig patient blev rapporteret at have inhaleret 30 kapsler over en periode på 2,5 dage og udviklet ændret mental status, rysten, mavesmerter og alvorlig forstoppelse. Patienten blev indlagt, SPIRIVA HANDIHALER blev seponeret, og forstoppelsen blev behandlet med lavement. Patienten kom sig og blev udskrevet samme dag.
KONTRAINDIKATIONER
SPIRIVA 9mcg HANDIHALER er kontraindiceret til patienter med overfølsomhed over for tiotropium, ipratropium eller andre komponenter i dette produkt [se ADVARSLER OG FORHOLDSREGLER ]. I kliniske forsøg og erfaring efter markedsføring med SPIRIVA 9mcg HANDIHALER er der rapporteret øjeblikkelige overfølsomhedsreaktioner, inklusive angioødem (inklusive hævelse af læber, tunge eller svælg), kløe eller udslæt [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Tiotropium er et langtidsvirkende, antimuskarin middel, som ofte omtales som et antikolinergt middel. Det har lignende affinitet til undertyperne af muskarine receptorer, M1 til M5. I luftvejene udviser det farmakologiske virkninger gennem hæmning af M3-receptorer ved den glatte muskel, hvilket fører til bronkodilation. Den kompetitive og reversible karakter af antagonisme blev vist med humane og animalske receptorer og isolerede organpræparater. I prækliniske in vitro- såvel som in vivo-studier var forebyggelse af methacholin-inducerede bronkokonstriktionseffekter dosisafhængig og varede længere end 24 timer. Bronkodilatationen efter inhalation af tiotropium er overvejende en stedsspecifik effekt.
Farmakodynamik
Hjerteelektrofysiologi
et multicenter, randomiseret, dobbelt-blindt forsøg med tiotropium-tørpulver til inhalation, der inkluderede 198 patienter med KOL, var antallet af forsøgspersoner med ændringer fra baseline-korrigeret QT-interval på 30 til 60 msek højere i SPIRIVA 9mcg HANDIHALER-gruppen sammenlignet med med placebo. Denne forskel var tydelig ved brug af både Bazett (QTcB) [20 (20 %) patienter vs. 12 (12 %) patienter] og Fredericia (QTcF) [16 (16 %) patienter vs. 1 (1 %) patient] korrektioner af QT for puls. Ingen patienter i nogen af grupperne havde hverken QTcB eller QTcF på >500 msek. Andre kliniske undersøgelser med SPIRIVA HANDIHALER påviste ikke en effekt af lægemidlet på QTc-intervaller.
Effekten af tiotropium tørt pulver til inhalation på QT-intervallet blev også evalueret i et randomiseret, placebo- og positivt kontrolleret crossover-studie med 53 raske frivillige. Forsøgspersonerne fik tiotropium tørt pulver til inhalation 18 mcg, 54 mcg (3 gange den anbefalede dosis) eller placebo i 12 dage. EKG-vurderinger blev udført ved baseline og i hele doseringsintervallet efter den første og sidste dosis af undersøgelsesmedicin. I forhold til placebo var den maksimale gennemsnitlige ændring fra baseline i studiespecifikt QTc-interval 3,2 msek og 0,8 msek for tiotropium-tørpulver til inhalation, henholdsvis 18 mcg og 54 mcg. Ingen forsøgspersoner viste en ny indtræden af QTc >500 msek eller QTc-ændringer fra baseline på ≥60 msek.
Farmakokinetik
Tiotropium administreres ved tørpulverinhalation. Nogle af de farmakokinetiske data beskrevet nedenfor blev opnået med højere doser end anbefalet til behandling. En dedikeret farmakokinetisk undersøgelse hos patienter med KOL, der evaluerede tiotropium én gang dagligt leveret fra RESPIMAT-inhalatoren (5 mcg) og som inhalationspulver (18 mcg) fra HANDIHALER-apparatet, resulterede i en lignende systemisk eksponering mellem de to produkter.
Absorption
Efter indånding af tørt pulver af unge raske frivillige tyder den absolutte biotilgængelighed på 19,5 % på, at den fraktion, der når lungen, er yderst biotilgængelig. Orale opløsninger af tiotropium har en absolut biotilgængelighed på 2-3%. Mad forventes ikke at påvirke absorptionen af tiotropium. Maksimal tiotropium plasmakoncentrationer blev observeret 7 minutter efter inhalation.
Fordeling
Tiotropium er 72 % bundet til plasmaprotein og havde et distributionsvolumen på 32 l/kg efter intravenøs administration til unge raske frivillige. Lokale koncentrationer i lungen kendes ikke, men indgivelsesmåden tyder på væsentligt højere koncentrationer i lungen. Undersøgelser med rotter har vist, at tiotropium ikke let trænger ind i blod-hjerne-barrieren.
Elimination
Den terminale halveringstid for tiotropium hos KOL-patienter efter en gang daglig inhalation af 5 mikrogram tiotropium var ca. 25 timer. Total clearance var 880 ml/min efter intravenøs administration hos unge raske frivillige. Efter kronisk tørpulverinhalation én gang dagligt af KOL-patienter blev farmakokinetisk steady state nået på dag 7 uden akkumulering derefter.
Metabolisme
Omfanget af stofskiftet er lille. Dette fremgår af en urinudskillelse på 74 % af uændret stof efter en intravenøs dosis til unge raske frivillige. Tiotropium, en ester, spaltes ikke-enzymatisk til alkoholen N-methylscopin og dithienylglycolsyre, som ingen af dem binder til muskarine receptorer.
In vitro-forsøg med humane levermikrosomer og humane hepatocytter tyder på, at en brøkdel af den administrerede dosis (74 % af en intravenøs dosis udskilles uændret i urinen, hvilket efterlader 25 % til metabolisme) metaboliseres ved cytokrom P450-afhængig oxidation og efterfølgende glutathionkonjugering til en række fase II-metabolitter. Denne enzymatiske vej kan hæmmes af CYP450 2D6- og 3A4-hæmmere, såsom quinidin, ketoconazol og gestoden. Således er CYP450 2D6 og 3A4 involveret i den metaboliske vej, der er ansvarlig for elimineringen af en lille del af den administrerede dosis. In vitro undersøgelser med humane levermikrosomer viste, at tiotropium i supraterapeutiske koncentrationer ikke hæmmede CYP450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 eller 3A4.
Udskillelse
Intravenøst administreret tiotropiumbromid udskilles hovedsageligt uændret i urinen (74%). Efter tørpulverinhalation til KOL-patienter ved steady state var urinudskillelsen 7 % (1,3 mcg) af den uændrede dosis over 24 timer. Den renale clearance af tiotropium overstiger kreatininclearancen, hvilket indikerer sekretion i urinen.
Specifikke populationer
Geriatriske patienter
Som forventet for alle hovedsageligt renalt udskilte lægemidler var stigende alder forbundet med et fald i tiotropiums renal clearance (365 ml/min hos KOL-patienter
Nedsat nyrefunktion
Efter 4-ugers SPIRIVA 9mcg HANDIHALER eller SPIRIVA 9mcg RESPIMAT én gang dagligt til patienter med KOL, resulterede let nedsat nyrefunktion (kreatininclearance 60-
Nedsat leverfunktion
Virkningerne af nedsat leverfunktion på tiotropiums farmakokinetik blev ikke undersøgt.
Lægemiddelinteraktioner
Et interaktionsstudie med tiotropium (14,4 mcg intravenøs infusion over 15 minutter) og cimetidin 400 mg tre gange dagligt eller ranitidin 300 mg én gang dagligt blev udført. Samtidig administration af cimetidin og tiotropium resulterede i en stigning på 20 % i AUC0-4h, et 28 % fald i den renale clearance af tiotropium og ingen signifikant ændring i Cmax og mængden udskilt i urinen over 96 timer. Samtidig administration af tiotropium og ranitidin påvirkede ikke tiotropiums farmakokinetik.
Almindelig samtidig medicin (langtidsvirkende beta2-adrenerge agonister (LABA), inhalerede kortikosteroider (ICS)) anvendt af patienter med KOL viste sig ikke at ændre eksponeringen for tiotropium.
Kliniske Studier
Det kliniske udviklingsprogram for SPIRIVA 9mcg HANDIHALER (tiotropiumbromid-inhalationspulver) bestod af seks fase 3-studier med 2663 patienter med KOL (1308, der fik SPIRIVA 9mcg HANDIHALER): to 1-årige, placebokontrollerede studier, to 6-måneders, placebokontrollerede undersøgelser undersøgelser og to 1-årige, ipratropium-kontrollerede undersøgelser. Disse undersøgelser inkluderede patienter, der havde en klinisk diagnose af KOL, var 40 år eller ældre, havde en historie med rygning i mere end 10 pakkeår, havde et forceret ekspiratorisk volumen på et sekund (FEV1) mindre end eller lig med 60 % eller 65 % af forudsagt, og et forhold mellem FEV1/FVC på mindre end eller lig med 0,7.
I disse undersøgelser gav SPIRIVA HANDIHALER, administreret én gang dagligt om morgenen, en forbedring af lungefunktionen (FEV1), med maksimal effekt inden for 3 timer efter den første dosis.
To yderligere forsøg evaluerede eksacerbationer: et 6-måneders, randomiseret, dobbeltblindt, placebokontrolleret, multicenter klinisk forsøg med 1829 KOL-patienter i en US Veterans Affairs-indstilling og en 4-årig, randomiseret, dobbeltblind, placebokontrolleret, multicenter, klinisk forsøg med 5992 KOL-patienter. Langtidseffekter på lungefunktion og andre resultater blev også evalueret i det 4-årige multicenterforsøg.
6-måneders til 1-års virkninger på lungefunktionen
de 1-årige placebokontrollerede forsøg var den gennemsnitlige forbedring i FEV1 efter 30 minutter 0,13 liter (13 %) med en maksimal forbedring på 0,24 liter (24 %) i forhold til baseline efter den første dosis (dag 1). Yderligere forbedringer i FEV1 og forceret vital kapacitet (FVC) blev observeret med farmakodynamisk steady state nået på dag 8 med behandling én gang dagligt. Den gennemsnitlige maksimale forbedring i FEV1 i forhold til baseline var 0,28 til 0,31 liter (28% til 31%) efter 1 uge (dag 8) med behandling én gang dagligt. Forbedring af lungefunktionen blev opretholdt i 24 timer efter en enkelt dosis og konsekvent opretholdt over den 1-årige behandlingsperiode uden tegn på tolerance.
de to 6-måneders placebokontrollerede forsøg blev der udført serielle spirometriske evalueringer i løbet af dagtimerne i forsøg A (12 timer) og begrænset til 3 timer i forsøg B. De serielle FEV1-værdier over 12 timer (forsøg A) vises i Figur 1. Disse forsøg understøtter yderligere forbedringen af lungefunktionen (FEV1) med SPIRIVA 9mcg HANDIHALER, som varede i den spirometriske observationsperiode. Effektiviteten blev opretholdt i 24 timer efter administration over den 6-måneders behandlingsperiode.
Figur 1: Gennemsnitlig FEV1 over tid (før og efter administration af forsøgslægemidlet) på dag 1 og 169 for forsøg A (en seks-måneders placebokontrolleret undersøgelse)* 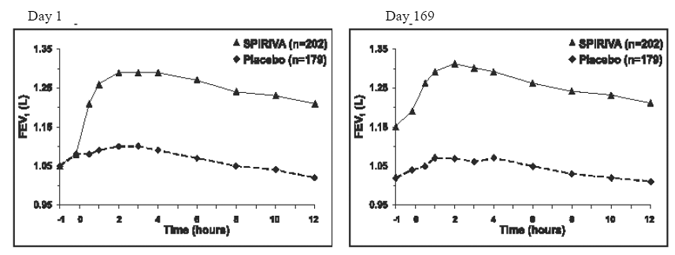
*Betyder justeret for center-, behandlings- og baseline-effekt. På dag 169 gennemførte i alt 183 og 149 patienter i henholdsvis SPIRIVA HANDIHALER- og placebogruppen forsøget. Dataene for de resterende patienter blev imputeret ved hjælp af den sidste observation eller mindst gunstige observation, der blev videreført.
Resultaterne af hvert af de 1-årige ipratropium-kontrollerede forsøg svarede til resultaterne af de 1-årige placebo-kontrollerede forsøg. Resultaterne af et af disse forsøg er vist i figur 2.
Figur 2: Gennemsnitlig FEV1 over tid (0 til 6 timer efter dosis) på henholdsvis dag 1 og 92 for en af de to Ipratropium-kontrollerede undersøgelser* 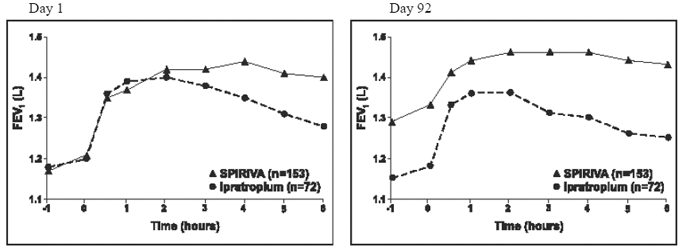
*Betyder justeret for center-, behandlings- og baseline-effekt. På dag 92 (primært endepunkt) gennemførte i alt 151 og 69 patienter i henholdsvis SPIRIVA HANDIHALER- og ipratropium-grupperne gennem 3 måneders observation. Dataene for de resterende patienter blev imputeret ved hjælp af den sidste observation eller mindst gunstige observation, der blev videreført.
Et randomiseret, placebokontrolleret klinisk studie med 105 patienter med KOL viste, at bronkodilatation blev opretholdt gennem hele 24-timers doseringsintervallet sammenlignet med placebo, uanset om SPIRIVA 9mcg HANDIHALER blev administreret om morgenen eller om aftenen.
løbet af hver uge af den 1-årige behandlingsperiode i de to placebokontrollerede undersøgelser havde patienter, der tog SPIRIVA 9mcg HANDIHALER, et reduceret behov for brug af redningskortvirkende beta2-agonister. Reduktion i brugen af rescue korttidsvirkende beta2-agonister sammenlignet med placebo blev påvist i et af de to 6 måneders studier.
4-års effekter på lungefunktionen
Et 4-årigt, randomiseret, dobbeltblindt, placebokontrolleret, multicenter klinisk forsøg med 5992 KOL-patienter blev udført for at evaluere de langsigtede virkninger af SPIRIVA HANDIHALER på sygdomsprogression (rate af fald i FEV1). Patienterne fik lov til at bruge al respiratorisk medicin (inklusive kort- og langtidsvirkende beta-agonister, inhalerede og systemiske steroider og theofylliner) bortset fra inhalerede antikolinergika. Patienterne var i alderen 40 til 88 år, 75 % mænd og 90 % kaukasiske med en diagnose af KOL og en gennemsnitlig præbronkodilatator FEV1 på 39 % forudsagt (interval = 9 % til 76 %) ved studiestart. Der var ingen forskel mellem grupperne i nogen af de co-primære effekt-endepunkter, den årlige hastighed for fald i præ- og post-bronkodilatator FEV1, som vist ved lignende hældninger af FEV1-fald over tid (figur 3).
SPIRIVA HANDIHALER opretholdt forbedringer i bundfaldet (før dosis) FEV1 (justeret gennemsnit over tid: 87 til 103 ml) gennem de 4 år af undersøgelsen (figur 3).
Figur 3: Gennemsnitsværdier for FEV1 (før dosis) på hvert tidspunkt 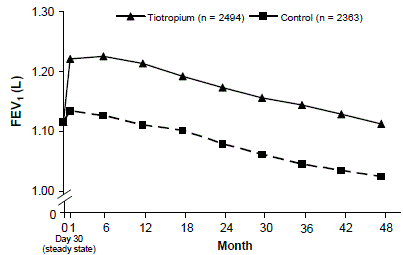
Gentaget måling ANOVA blev brugt til at estimere middelværdier. Middel er justeret for basislinjemålinger. Baseline dal FEV1 (observeret gennemsnit) = 1,12. Patienter med ≥3 acceptable lungefunktionstest efter dag 30 og ikke-manglende baselineværdi blev inkluderet i analysen.
Eksacerbationer
Effekten af SPIRIVA 9mcg HANDIHALER på KOL-eksacerbationer blev evalueret i to kliniske forsøg: et 4-årigt klinisk forsøg beskrevet ovenfor og et 6-måneders klinisk forsøg med 1829 KOL-patienter i Veterans Affairs-miljø. I det 6-måneders forsøg blev KOL-eksacerbationer defineret som et kompleks af luftvejssymptomer (forøgelse eller nyopstået) af mere end én af følgende: hoste, opspyt, hvæsende vejrtrækning, dyspnø eller trykken for brystet med en varighed på mindst 3 dage kræver behandling med antibiotika, systemiske steroider eller hospitalsindlæggelse. Befolkningen havde en alder fra 40 til 90 år med 99 % mænd, 91 % kaukasiske og havde KOL med en gennemsnitlig præbronkodilatator FEV1 procent forudsagt på 36 % (interval = 8 % til 93 %). Patienter fik tilladelse til at bruge respiratorisk medicin (herunder kort- og langtidsvirkende beta-agonister, inhalerede og systemiske steroider og theofylliner) bortset fra inhalerede antikolinergika. I det 6-måneders forsøg var de co-primære endepunkter andelen af patienter med KOL-eksacerbation og andelen af patienter med indlæggelse på grund af KOL-eksacerbation. SPIRIVA 9mcg HANDIHALER reducerede signifikant andelen af KOL-patienter, der oplevede eksacerbationer sammenlignet med placebo (henholdsvis 27,9 % vs. 32,3 %; Odds Ratio (OR) (tiotropium/placebo) = 0,81; 95 % CI = 0,606, p = 0,903; ). Andelen af patienter med hospitalsindlæggelse på grund af KOL-eksacerbationer hos patienter, der brugte SPIRIVA 9mcg HANDIHALER sammenlignet med placebo, var henholdsvis 7,0 % vs. 9,5 %; OR = 0,72; 95% CI = 0,51, 1,01; p = 0,056.
Eksacerbationer blev evalueret som et sekundært resultat i det 4-årige multicenterforsøg. I dette forsøg blev KOL-eksacerbationer defineret som en stigning eller ny indtræden af mere end et af følgende luftvejssymptomer (hoste, opspyt, opspyt purulens, hvæsende vejrtrækning, dyspnø) med en varighed på tre eller flere dage, der kræver behandling med antibiotika og/eller systemiske (orale, intramuskulære eller intravenøse) steroider. SPIRIVA HANDIHALER reducerede signifikant risikoen for en eksacerbation med 14 % (Hazard Ratio (HR) = 0,86; 95 % CI = 0,81, 0,91; p
Dødelighed af alle årsager
det 4-årige placebokontrollerede lungefunktionsforsøg beskrevet ovenfor, blev dødelighed af alle årsager sammenlignet med placebo vurderet. Der var ingen signifikante forskelle i dødelighedsrater af alle årsager mellem SPIRIVA 9mcg HANDIHALER og placebo.
Dødeligheden af alle årsager af SPIRIVA HANDIHALER blev også sammenlignet med tiotropium-inhalationsspray 5 mcg (SPIRIVA RESPIMAT 5 mcg) i et yderligere langsigtet, randomiseret, dobbeltblindt, dobbelt-dummy aktivt kontrolleret studie med en observationsperiode på op til 3 år. Mortalitet af alle årsager var ens mellem SPIRIVA 9mcg HANDIHALER og SPIRIVA RESPIMAT.
PATIENTOPLYSNINGER
SPIRIVA 9mcgR® (speh REE vah) HANDIHALER® (tiotropiumbromid) Inhalationspulver, til oral inhalationsbrug
SPIRIVA-kapsler må IKKE sluges.
Vigtig information: SPIRIVA-kapsler må ikke sluges. SPIRIVA 9mcg kapsler bør kun bruges sammen med HANDIHALER-apparatet og inhaleres gennem munden (oral inhalation).
Læs informationen, der følger med din SPIRIVA HANDIHALER, før du begynder at bruge den, og hver gang du genopfylder din recept. Der kan være nye oplysninger. Denne indlægsseddel træder ikke i stedet for at tale med din læge om din medicinske tilstand eller din behandling.
Hvad er SPIRIVA HANDIHALER?
- SPIRIVA HANDIHALER er en receptpligtig medicin, der bruges hver dag (et vedligeholdelseslægemiddel) til at kontrollere symptomer på kronisk obstruktiv lungesygdom (KOL), herunder kronisk bronkitis og emfysem.
- SPIRIVA HANDIHALER hjælper med at få dine lunger til at fungere bedre i 24 timer. SPIRIVA 9mcg HANDIHALER afslapper dine luftveje og hjælper med at holde dem åbne. Du kan begynde at føle, at det er lettere at trække vejret den første dag, men det kan tage længere tid for dig at mærke den fulde virkning af medicinen. SPIRIVA HANDIHALER virker bedst og kan være med til at gøre det lettere at trække vejret, når du bruger det hver dag.
- SPIRIVA 9mcg HANDIHALER reducerer sandsynligheden for opblussen og forværring af KOL-symptomer (KOL-eksacerbationer). En KOL-eksacerbation er defineret som en stigning eller ny indtræden af mere end ét KOL-symptom såsom hoste, slim, åndenød og hvæsen, der kræver medicin ud over din redningsmedicin.
SPIRIVA 9mcg HANDIHALER er ikke en redningsmedicin og bør ikke bruges til behandling af pludselige vejrtrækningsproblemer. Din læge kan give dig anden medicin til at bruge til pludselige vejrtrækningsproblemer.
Det vides ikke, om SPIRIVA 9mcg HANDIHALER er sikkert og effektivt til børn.
Hvem bør ikke tage SPIRIVA 9mcg HANDIHALER?
Brug ikke SPIRIVA 9mcg HANDIHALER, hvis du:
- er allergisk over for tiotropium, ipratropium (Atrovent®) eller et af indholdsstofferne i SPIRIVA 9mcg HANDIHALER. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i SPIRIVA 9mcg HANDIHALER.
Symptomer på en alvorlig allergisk reaktion på SPIRIVA 9mcg HANDIHALER kan omfatte:
- hævede røde pletter på din hud (nældefeber)
- kløe
- udslæt
- hævelse af ansigt, læber, tunge og svælg, der kan forårsage besvær med at trække vejret eller synke
Hvis du har disse symptomer på en allergisk reaktion, skal du stoppe med at tage SPIRIVA HANDIHALER og ringe til din læge med det samme eller gå til den nærmeste skadestue på hospitalet.
Hvad skal jeg fortælle min læge, før jeg bruger SPIRIVA HANDIHALER?
Inden du tager SPIRIVA HANDIHALER, skal du fortælle din læge om alle dine medicinske tilstande, herunder hvis du:
- har nyreproblemer.
- har glaukom. SPIRIVA HANDIHALER kan gøre dit grøn stær værre.
- har en forstørret prostata, problemer med at tisse eller en blokering i din blære. SPIRIVA 9mcg HANDIHALER kan gøre disse problemer værre.
- er gravid eller planlægger at blive gravid. Det vides ikke, om SPIRIVA HANDIHALER kan skade dit ufødte barn.
- ammer eller planlægger at amme. Det vides ikke, om SPIRIVA HANDIHALER udskilles i modermælken. Du og din læge vil afgøre, om SPIRIVA 9mcg HANDIHALER er det rigtige for dig, mens du ammer.
- har en alvorlig allergi over for mælkeproteiner. Spørg din læge, hvis du ikke er sikker.
Fortæl din læge om al den medicin du tager, herunder receptpligtig og ikke-receptpligtig medicin og øjendråber, vitaminer og naturlægemidler. Nogle af dine andre lægemidler eller kosttilskud kan påvirke den måde, SPIRIVA HANDIHALER virker på. SPIRIVA 9mcg HANDIHALER er en antikolinerg medicin. Du bør ikke tage anden antikolinerg medicin, mens du bruger SPIRIVA 9mcg HANDIHALER, inklusive ipratropium. Spørg din læge eller apoteket, hvis du ikke er sikker på, om en af dine lægemidler er et antikolinergika.
Kend den medicin du tager. Hav en liste over din medicin med dig for at vise din læge og apotek, når du får en ny medicin.
Hvordan skal jeg tage SPIRIVA 9mcg HANDIHALER?
- Brug SPIRIVA 9mcg HANDIHALER nøjagtigt som foreskrevet. Brug SPIRIVA HANDIHALER én gang hver dag.
- Læs "Brugsvejledningen" i slutningen af denne indlægsseddel, før du bruger SPIRIVA HANDIHALER. Tal med din læge, hvis du ikke forstår instruktionerne.
- SPIRIVA 9mcg kapsler må ikke sluges.
- Brug kun SPIRIVA 9mcg kapsler med HANDIHALER-enheden.
- Brug ikke HANDIHALER-enheden til at tage anden medicin.
- SPIRIVA 9mcg HANDIHALER kommer som et pulver i en SPIRIVA 9mcg kapsel, der passer til HANDIHALER enheden. Hver SPIRIVA-kapsel, der kun indeholder en lille mængde SPIRIVA-pulver, er én fuld dosis medicin.
- Adskil en blister fra blisterkortet. Tag derefter en af SPIRIVA 9mcg kapslerne ud af blisterpakningen lige før du bruger den.
- Efter kapslen er gennemboret, skal du tage en komplet dosis SPIRIVA HANDIHALER ved at indånde pulveret gennem munden to gange ved hjælp af HANDIHALER-apparatet (tag 2 inhalationer fra en SPIRIVA-kapsel). Se den "Brugsvejledning" slutningen af denne indlægsseddel.
- Kassér enhver SPIRIVA-kapsel, der ikke er brugt, med det samme efter at den er taget ud af blisterpakningen. Efterlad ikke SPIRIVA-kapslerne åbne for luft; de virker måske ikke så godt.
- Hvis du glemmer en dosis, skal du tage den, så snart du husker det. Brug ikke SPIRIVA HANDIHALER mere end én gang hver 24. time. ? Hvis du bruger mere end din foreskrevne dosis af SPIRIVA HANDIHALER, skal du kontakte din læge eller et giftkontrolcenter.
Hvad skal jeg undgå, mens jeg bruger SPIRIVA 9mcg HANDIHALER?
- Lad ikke pulveret fra SPIRIVA-kapslen komme ind i dine øjne. Dit syn kan blive sløret, og pupillen i dit øje kan blive større (udvide). Hvis dette sker, skal du ringe til din læge.
- SPIRIVA 9mcg HANDIHALER kan forårsage svimmelhed og sløret syn. Hvis du oplever disse symptomer, skal du være forsigtig, når du deltager i aktiviteter som at køre bil eller betjene apparater eller andre maskiner.
Hvad er de mulige bivirkninger af SPIRIVA HANDIHALER?
SPIRIVA 9mcg HANDIHALER kan forårsage alvorlige bivirkninger, herunder: Allergisk reaktion. Symptomer kan omfatte:
- hævede røde pletter på din hud (nældefeber)
- kløe
- udslæt
- hævelse af læber, tunge eller svælg, der kan forårsage besvær med at trække vejret eller synke
Hvis du har disse symptomer på en allergisk reaktion, skal du stoppe med at tage SPIRIVA HANDIHALER og ringe til din læge med det samme eller gå til den nærmeste skadestue på hospitalet.
- Pludselig forsnævring og blokering af luftvejene til lungerne (bronkospasmer) . Din vejrtrækning bliver pludselig værre.
Hvis du har disse symptomer på bronkospasme, skal du stoppe med at tage SPIRIVA 9mcg HANDIHALER og ringe til din læge med det samme eller gå til den nærmeste skadestue på hospitalet.
- Nyt eller forværret øget tryk i øjnene (akut snævervinklet glaukom). Symptomer på akut snævervinklet glaukom kan omfatte:
- øjensmerter
- sløret syn
- se glorier (visuelle glorier) eller farvede billeder sammen med røde øjne
Brug af kun øjendråber til at behandle disse symptomer virker muligvis ikke. Hvis du har disse symptomer, skal du stoppe med at tage SPIRIVA HANDIHALER og kontakte din læge med det samme.
- Ny eller forværret urinretention. Symptomer på blokering i din blære og/eller forstørret prostata kan omfatte: vandladningsbesvær, smertefuld vandladning.
Hvis du har disse symptomer på urinretention, skal du stoppe med at tage SPIRIVA HANDIHALER og kontakte din læge med det samme.
Andre bivirkninger med SPIRIVA 9mcg HANDIHALER omfatter:
- øvre luftvejsinfektion
- tør mund
- sinus infektion
- ondt i halsen
- uspecifikke brystsmerter
- urinvejsinfektion
- dårlig fordøjelse
- løbende næse
- forstoppelse
- øget puls
- sløret syn
Disse er ikke alle de mulige bivirkninger med SPIRIVA HANDIHALER. Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan opbevarer jeg SPIRIVA HANDIHALER?
- Opbevar ikke SPIRIVA-kapsler i HANDIHALER-enheden.
- Opbevar SPIRIVA-kapsler i den forseglede blisterpakning ved stuetemperatur 68°F til 77°F (20°C til 25°C).
- Hold SPIRIVA kapsler væk fra varme og kulde (må ikke fryses).
- Opbevar SPIRIVA 9mcg kapsler på et tørt sted. Smid alle ubrugte SPIRIVA 9mcg-kapsler væk, som har været åbne for luft.
Spørg din læge eller apoteket, hvis du har spørgsmål om opbevaring af dine SPIRIVA 9mcg kapsler.
Opbevar SPIRIVA HANDIHALER, SPIRIVA 9mcg kapsler og al medicin utilgængeligt for børn.
Generel information om SPIRIVA HANDIHALER
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i patientinformationsfoldere. Brug ikke SPIRIVA 9mcg HANDIHALER til et formål, som det ikke er ordineret til. Giv ikke SPIRIVA HANDIHALER til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Tal med din læge for mere information om SPIRIVA HANDIHALER. Du kan bede din læge eller apotek om oplysninger om SPIRIVA 9mcg HANDIHALER, der er skrevet til sundhedspersonale.
For mere information om SPIRIVA 9mcg HANDIHALER, gå til www.SPIRIVA.com, eller scan koden nedenfor, eller ring til Boehringer Ingelheim Pharmaceuticals, Inc. på 1-800-542-6257 eller (TTY) 1-800-459-9906.
Hvad er ingredienserne i SPIRIVA 9mcg HANDIHALER?
Aktiv ingrediens: tiotropium
Inaktiv ingrediens: laktosemonohydrat
Hvad er KOL (kronisk obstruktiv lungesygdom)?
KOL er en alvorlig lungesygdom, der omfatter kronisk bronkitis, emfysem eller begge dele. Det meste KOL er forårsaget af rygning. Når du har KOL, bliver dine luftveje smalle. Så luften bevæger sig langsommere ud af dine lunger. Dette gør det svært at trække vejret.
Denne patientinformation er blevet godkendt af US Food and Drug Administration.
BRUGSVEJLEDNINGSPIRIVA® (speh REE vah) HANDIHALER® (tiotropiumbromid) inhalationspulver, til oral inhalationsbrug
SPIRIVA-kapsler må ikke sluges.
Vigtig information om brug af din SPIRIVA HANDIHALER
- SPIRIVA 9mcg kapsler må ikke sluges.
- SPIRIVA-kapsler bør kun bruges sammen med HANDIHALER-apparatet og inhaleres gennem munden (oral inhalation).
- Brug ikke din HANDIHALER-enhed til at tage anden medicin.
Læs først patientinformationen, læs derefter denne brugsanvisning, før du begynder at bruge SPIRIVA HANDIHALER, og hver gang du genopfylder din recept. Der kan være nye oplysninger.
Bliv fortrolig med din HANDIHALER-enhed og SPIRIVA-kapsler:
Din SPIRIVA HANDIHALER leveres med SPIRIVA 9mcg kapsler i blisteremballage og en HANDIHALER enhed. Brug den nye HANDIHALER-enhed, der følger med din medicin.
Delene på din HANDIHALER enhed omfatter:
(Se figur A)
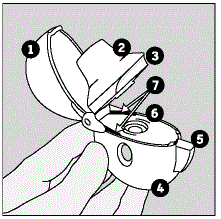
Figur A
Hver SPIRIVA 9mcg kapsel er pakket i en blisterpakning. (Se figur B)
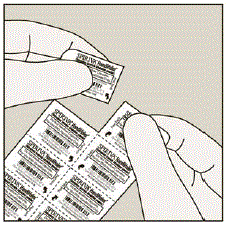
Figur B
- Hver SPIRIVA-kapsel indeholder kun en lille mængde pulver. (Se figur C) Dette er 1 fuld dosis.
- Åbn ikke SPIRIVA 9mcg kapslen ellers virker det måske ikke.

Figur C
At tage din fulde daglige dosis medicin kræver 4 hovedtrin.
Trin 1. Åbning af din HANDIHALER-enhed:
Efter at have fjernet din HANDIHALER-enhed fra posen:
- Åbn støvhætten (låget) ved at trykke på den grønne piercingknap. (Se figur D)
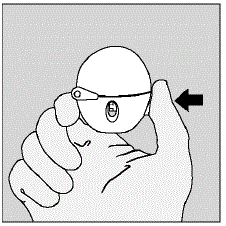
Figur D
- Træk støvhætten (låget) opad væk fra bunden for at blotlægge mundstykket. (Se figur E)
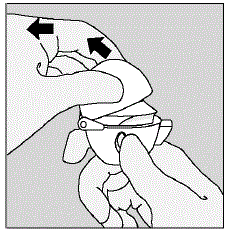
Figur E
- Åbn mundstykket ved at trække mundstykkets kant op og væk fra bunden, så midterkammeret vises. (Se figur F)

Figur F
Trin 2. Indsættelse af SPIRIVA 9mcg-kapslen i din HANDIHALER-enhed:
Hver dag skal du kun adskille 1 af blisterne fra blisterkortet ved at rive langs den perforerede linje. (Se figur G)
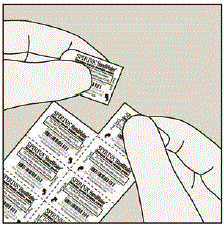
Figur G
Fjern SPIRIVA-kapslen fra blisterpakningen:
- Lade være med skær folien af eller brug skarpe instrumenter til at tage SPIRIVA-kapslen ud af blisterpakningen.
- Bøj 1 af blisterhjørnerne med en pil og adskil aluminiumsfolielagene.
- Træk den trykte folie tilbage, indtil du ser hele SPIRIVA-kapslen. (Se figur H)
- Hvis du har åbnet mere end 1 blister i luften, bør den ekstra SPIRIVA 9mcg kapsel ikke bruges og skal smides væk.
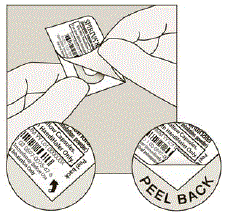
Figur H
Placer SPIRIVA 9mcg-kapslen i det midterste kammer på din HANDIHALER-enhed. (Se figur I)
Figur I
Luk mundstykket fast mod den grå base, indtil du hører et klik. Lad støvhætten (låget) stå åben. (Se figur J)
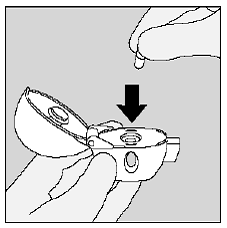
Figur J
Trin 3. Piercing af SPIRIVA 9mcg kapslen:
- Hold din HANDIHALER enhed med mundstykket pegende opad. (Se figur K)
- Tryk én gang på den grønne piercingknap, indtil den er flad (flugt) mod basen, og slip derefter. Sådan laver du huller i SPIRIVA-kapslen, så du får din medicin, når du trækker vejret ind.
- Lade være med tryk på den grønne knap mere end én gang.
- Lade være med ryst din HANDIHALER-enhed.
- Piercingen af SPIRIVA 9mcg kapslen kan producere små gelatine stykker. Nogle af disse små stykker kan passere gennem skærmen på din HANDIHALER-enhed ind i din mund eller hals, når du indånder din medicin. Dette er normalt. De små stykker gelatine bør ikke skade dig.
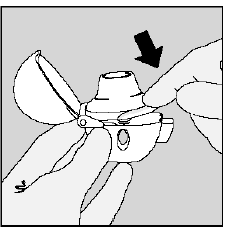
Figur K
Trin 4. Tag din fulde daglige dosis (2 inhalationer fra den samme SPIRIVA 9mcg kapsel):
Træk vejret helt ud i 1 vejrtrækning, tømme dine lunger for luft. (Se figur L)
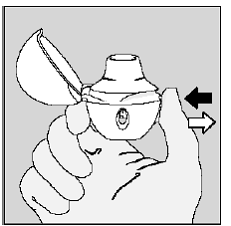
Figur L
Vigtigt: Lad være trække vejret ind i din HANDIHALER enhed.
Med dit næste åndedrag, tag din medicin:
- Hold dit hoved i en oprejst stilling, mens du kigger lige frem. (Se figur M)
- Løft din HANDIHALER-enhed til din mund i vandret position. Lade være med blokerer luftindtagsåbningerne.
- Luk dine læber tæt omkring mundstykket.
- Træk vejret dybt ind indtil dine lunger er fulde. Du burde høre eller mærke SPIRIVA-kapslen vibrere (rangle). (Se figur M)
- Hold vejret i et par sekunder, og tag samtidig din HANDIHALER-enhed ud af munden.
- Træk vejret normalt igen.
Figur M
Ranglen fortæller dig, at du trak vejret rigtigt ind. Hvis du ikke hører eller mærker en ranglen, se afsnittet "Hvis du ikke hører eller mærker SPIRIVA-kapslen rasle, mens du trækker vejret i din medicin."
Figur N
For at få din fulde daglige dosis skal du igen trække vejret helt ud (se figur N) og for anden gang trække vejret ind (se figur O) fra den samme SPIRIVA-kapsel.
Vigtigt: Lad være tryk på den grønne piercing-knap igen.
Figur O
Husk: For at få din fulde medicindosis hver dag skal du trække vejret 2 gange fra den samme SPIRIVA 9mcg kapsel. Sørg for at trække vejret helt ud hver gang, før du trækker vejret ind fra din HANDIHALER enhed.
Pleje og opbevaring af din SPIRIVA HANDIHALER:
Figur P
- Når du har taget din daglige dosis, skal du åbne mundstykket og vippe den brugte SPIRIVA 9mcg kapsel ud i din skraldespand uden at røre den.
- Fjern eventuelle SPIRIVA 9mcg kapselstykker eller SPIRIVA 9mcg pulver ved at vende din HANDIHALER-enhed på hovedet og forsigtigt, men bestemt, banke på den. (Se figur P) Luk derefter mundstykket og støvhætten til opbevaring.
- Lade være med Opbevar din HANDIHALER enhed og SPIRIVA 9mcg kapsler (blister) på et fugtigt fugtigt sted. Opbevar altid SPIRIVA-kapsler i de forseglede blisterpakninger.
Hvis du ikke hører eller mærker SPIRIVA 9mcg kapslen rasle, mens du trækker vejret i din medicin:
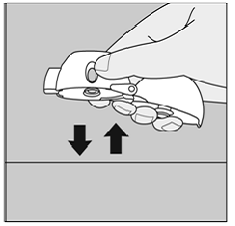
Figur Q
Lade være med tryk på den grønne piercing-knap igen.
Hold din HANDIHALER-enhed med mundstykket pegende opad, og bank din HANDIHALER-enhed forsigtigt på et bord. (Se figur Q)
Kontroller, at mundstykket er helt lukket. Træk vejret helt ud, før du trækker vejret dybt ind igen med mundstykket i munden. (Se figur O)
Hvis du stadig ikke hører eller mærker SPIRIVA-kapslen rasle efter at have gentaget ovenstående trin:
- Smid SPIRIVA-kapslen væk.
- Åbn basen ved at løfte den grønne piercingknap, og kontroller midterkammeret for stykker af SPIRIVA 9mcg-kapslen. SPIRIVA 9mcg kapselstykker i midterkammeret kan få en SPIRIVA 9mcg kapsel til ikke at rasle.
- Vend din HANDIHALER-enhed på hovedet, og tryk forsigtigt, men bestemt for at fjerne SPIRIVA-kapselstykkerne. Ring til din læge for instruktioner.
Rengøring af din HANDIHALER enhed:
Rengør din HANDIHALER-enhed efter behov. (Se figur R)
- Det tager 24 timer at lufttørre din HANDIHALER-enhed, efter du har rengjort den.
- Lade være med brug rengøringsmidler eller rengøringsmidler.
- Lade være med Placer din HANDIHALER enhed i opvaskemaskinen til rengøring.
Rengøringstrin:
- Åbn støvhætten og mundstykket.
- Åbn basen ved at løfte den grønne piercingknap.
- Se i midterkammeret efter SPIRIVA 9mcg kapselstykker eller pulveropbygning. Tryk ud, hvis den ses.
- Skyl din HANDIHALER-enhed med varmt vand ved at trykke på den grønne piercingknap et par gange, så midterkammeret og piercingnålen er under det rindende vand. Kontroller, at eventuel pulverophobning eller SPIRIVA-kapselstykker er fjernet.
- Tør din HANDIHALER-enhed godt ved at hælde det overskydende vand ud på et køkkenrulle. Lufttør bagefter, og lad støvhætten, mundstykket og bunden stå åbne ved at sprede det helt ud, så det tørrer helt.
- Lade være med brug en hårtørrer til at tørre din HANDIHALER-enhed.
- Lade være med brug din HANDIHALER-enhed, når den er våd. Hvis det er nødvendigt, kan du rengøre ydersiden af mundstykket med en ren fugtig klud.
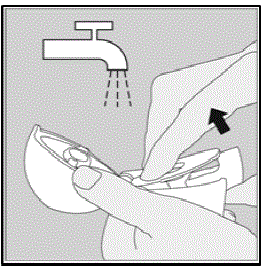
Figur R
Nyttige tip til at hjælpe med at sikre, at du tager din fulde daglige dosis SPIRIVA 9mcg HANDIHALER korrekt:
- Trykke den grønne piercingknap gang; Træk vejret 2 gange; Træk vejret helt ud før hver af de 2 inhalationer.
- Brug altid det nye HANDIHALER-apparat, der følger med din medicin.
- Hold din HANDIHALER-enhed med mundstykket pegende opad, når du trykker på den grønne piercing-knap.
- Tryk 1 gang på den grønne piercingknap for at gennembore SPIRIVA-kapslen.
- Ånd ikke ud i din HANDIHALER-enhed.
- Hold din HANDIHALER-enhed i vandret position, og hold hovedet oprejst, mens du ser lige frem, når du trækker vejret ind.
- Tjek midterkammeret på din HANDIHALER-enhed for SPIRIVA 9mcg kapselstykker eller pulveropbygning. Hvis der ses stykker eller pulver, bankes ud før brug.
- Rengør din HANDIHALER efter behov og tør grundigt.
For mere information, spørg din læge eller apotek, eller gå til www.spiriva.com, eller scan koden nedenfor, eller ring på 1-800-542-6257 eller (TTY) 1-800-459-9906.
Denne brugsanvisning er godkendt af US Food and Drug Administration.
