Medicin mod psykisk sygdom: Strattera 10mg, 18mg, 25mg, 40mg Atomoxetine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Strattera 40mg, og hvordan bruges det?
Strattera er en receptpligtig medicin, der bruges til at behandle symptomer på opmærksomhedsunderskud/hyperaktivitetsforstyrrelse (ADHD). Strattera 18mg kan bruges alene eller sammen med anden medicin.
Strattera 10mg er en selektiv noradrenalin-genoptagelseshæmmer.
Det vides ikke, om Strattera er sikkert og effektivt til børn under 2 år.
Hvad er de mulige bivirkninger af Strattera?
Strattera 25mg kan forårsage alvorlige bivirkninger, herunder:
- brystsmerter,
- vejrtrækningsbesvær,
- svimmelhed,
- hallucinationer,
- nye adfærdsproblemer,
- aggression,
- fjendtlighed,
- paranoia,
- mavesmerter,
- kløe,
- influenzalignende symptomer,
- mørk urin,
- gulsot (gulfarvning af hud eller øjne),
- smertefuld eller vanskelig vandladning, og
- erektion, der er smertefuld eller varer længere end 4 timer
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Strattera 40mg omfatter:
- kvalme,
- opkastning,
- dårlig mave,
- forstoppelse,
- tør mund,
- mistet appetiten,
- humørsvingninger,
- træthedsfornemmelse,
- svimmelhed,
- vandladningsproblemer, og
- impotens, problemer med at få erektion,
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Strattera. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
SELVmordsforestillinger hos børn og unge
STRATTERA (atomoxetin) øgede risikoen for selvmordstanker i korttidsundersøgelser hos børn eller unge med opmærksomhedsunderskud/hyperaktivitetsforstyrrelse (ADHD). Enhver, der overvejer at bruge STRATTERA 18 mg til et barn eller en teenager, skal balancere denne risiko med det kliniske behov. Komorbiditeter, der forekommer med ADHD, kan være forbundet med en stigning i risikoen for selvmordstanker og/eller selvmordsadfærd. Patienter, der påbegyndes i behandling, bør overvåges nøje for suicidalitet (suicidal tankegang og adfærd), klinisk forværring eller usædvanlige ændringer i adfærd. Familier og pårørende bør informeres om behovet for tæt observation og kommunikation med den ordinerende læge. STRATTERA 10mg er godkendt til ADHD hos pædiatriske og voksne patienter. STRATTERA 40mg er ikke godkendt til svær depressiv lidelse. Samlede analyser af kortvarige (6 til 18 uger) placebokontrollerede forsøg med STRATTERA 10 mg til børn og unge (i alt 12 forsøg med over 2200 patienter, herunder 11 forsøg med ADHD og 1 forsøg med enuresis) har afsløret en større risiko af selvmordstanker tidligt under behandlingen hos dem, der fik STRATTERA sammenlignet med placebo. Den gennemsnitlige risiko for selvmordstanker hos patienter, der fik STRATTERA 25 mg, var 0,4 % (5/1357 patienter), sammenlignet med ingen hos placebobehandlede patienter (851 patienter). Der fandt ingen selvmord sted i disse forsøg [se ADVARSLER OG FORHOLDSREGLER ].
BESKRIVELSE
STRATTERA® (atomoxetin) er en selektiv noradrenalin-genoptagelseshæmmer. Atomoxetin HCl er R(-)-isomeren som bestemt ved røntgendiffraktion. Den kemiske betegnelse er (-)-N-Methyl-3-phenyl-3-(o-tolyloxy)-propylaminhydrochlorid. Molekylformlen er C17H21NO•HCl, hvilket svarer til en molekylvægt på 291,82. Den kemiske struktur er:
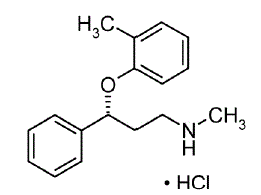
Atomoxetin HCl er et hvidt til praktisk talt hvidt fast stof, som har en opløselighed på 27,8 mg/ml i vand.
STRATTERA kapsler er kun beregnet til oral administration.
Hver kapsel indeholder atomoxetin HCl svarende til 10, 18, 25, 40, 60, 80 eller 100 mg atomoxetin. Kapslerne indeholder også prægelatineret stivelse og dimethicon. Kapselskallerne indeholder gelatine, natriumlaurylsulfat og andre inaktive ingredienser. Kapselskallerne indeholder også en eller flere af følgende:
FD&C Blue No. 2, syntetisk gul jernoxid, titaniumdioxid, rød jernoxid. Kapslerne er præget med spiselig sort blæk.
INDIKATIONER
Attention-Deficit/Hyperactivity Disorder (ADHD)
STRATTERA 25mg er indiceret til behandling af opmærksomhedsunderskud/hyperaktivitetsforstyrrelser (ADHD).
Effekten af STRATTERA kapsler blev fastslået i syv kliniske undersøgelser i ambulante patienter med ADHD: fire 6 til 9-ugers forsøg med pædiatriske patienter (i alderen 6 til 18), to 10-ugers forsøg med voksne og et vedligeholdelsesforsøg i pædiatriske (6 år). til 15) [se Kliniske Studier ].
Diagnostiske overvejelser
En diagnose af ADHD (DSM-IV) indebærer tilstedeværelsen af hyperaktive-impulsive eller uopmærksomme symptomer, der forårsager svækkelse, og som var til stede før 7-årsalderen. Symptomerne skal være vedvarende, skal være mere alvorlige, end det typisk observeres hos individer på et sammenligneligt udviklingsniveau, skal forårsage klinisk signifikant svækkelse, fx i social, akademisk eller erhvervsmæssig funktion, og skal være til stede i 2 eller flere omgivelser, fx skole (eller arbejde) og derhjemme. Symptomerne må ikke forklares bedre af en anden psykisk lidelse.
Den specifikke ætiologi af ADHD er ukendt, og der er ingen enkelt diagnostisk test. Tilstrækkelig diagnose kræver brug ikke kun af medicinske, men også af særlige psykologiske, pædagogiske og sociale ressourcer. Indlæring kan eller kan ikke være svækket. Diagnosen skal baseres på en fuldstændig anamnese og evaluering af patienten og ikke udelukkende på tilstedeværelsen af det nødvendige antal DSM-IV-karakteristika.
For den uopmærksomme type skal mindst 6 af følgende symptomer have varet ved i mindst 6 måneder: manglende opmærksomhed på detaljer/skødesløse fejl, mangel på vedvarende opmærksomhed, dårlig lytter, manglende overholdelse af opgaverne, dårlig organisering, undgår opgaver kræver vedvarende mental indsats, mister ting, let distraheret, glemsom. For den hyperaktive-impulsive type skal mindst 6 af følgende symptomer have varet ved i mindst 6 måneder: tumlen/snurren, forlader sædet, uhensigtsmæssig løb/klatring, besvær med rolige aktiviteter, "på farten", overdreven snak, udstød svar, kan ikke vente tur, påtrængende. For en kombineret type diagnose skal både uopmærksomme og hyperaktiv-impulsive kriterier være opfyldt.
Behov for omfattende behandlingsprogram
STRATTERA 18mg er indiceret som en integreret del af et samlet behandlingsprogram for ADHD, der kan omfatte andre tiltag (psykologiske, pædagogiske, sociale) for patienter med dette syndrom. Lægemiddelbehandling er muligvis ikke indiceret for alle patienter med dette syndrom. Lægemiddelbehandling er ikke beregnet til brug hos patienten, der udviser symptomer sekundært til miljøfaktorer og/eller andre primære psykiatriske lidelser, herunder psykose. Passende pædagogisk placering er afgørende for børn og unge med denne diagnose, og psykosocial intervention er ofte nyttig. NÅR afhjælpende foranstaltninger alene er utilstrækkelige, vil beslutningen om at ordinere lægemiddelbehandling afhænge af lægens vurdering af kroniske karakter og sværhedsgrad af patientens symptomer.
DOSERING OG ADMINISTRATION
Akut behandling
Dosering af børn og unge op til 70 kg kropsvægt
STRATTERA 40 mg bør påbegyndes med en samlet daglig dosis på ca. 0,5 mg/kg og øges efter minimum 3 dage til en målrettet total daglig dosis på ca. 1,2 mg/kg indgivet enten som en enkelt daglig dosis om morgenen eller ligeligt fordelt. doser om morgenen og sen eftermiddag/tidlig aften. Der er ikke påvist yderligere fordele for doser højere end 1,2 mg/kg/dag [se Kliniske Studier ].
Den samlede daglige dosis til børn og unge bør ikke overstige 1,4 mg/kg eller 100 mg, alt efter hvad der er mindst.
Dosering af børn og unge over 70 kg kropsvægt og voksne
STRATTERA 18 mg bør påbegyndes med en samlet daglig dosis på 40 mg og øges efter minimum 3 dage til en målrettet total daglig dosis på ca. 80 mg indgivet enten som en enkelt daglig dosis om morgenen eller som ligeligt fordelte doser om morgenen og sen eftermiddag/tidlig aften. Efter yderligere 2 til 4 uger kan dosis øges til maksimalt 100 mg hos patienter, som ikke har opnået et optimalt respons. Der er ingen data, der understøtter øget effektivitet ved højere doser [se Kliniske Studier ].
Den maksimale anbefalede samlede daglige dosis til børn og unge over 70 kg og voksne er 100 mg.
Vedligeholdelse/Udvidet behandling
Der er generelt enighed om, at farmakologisk behandling af ADHD kan være nødvendig i længere perioder. Fordelen ved at opretholde pædiatriske patienter (i alderen 6-15 år) med ADHD på STRATTERA 18 mg efter opnåelse af respons i et dosisområde på 1,2 til 1,8 mg/kg/dag blev påvist i et kontrolleret forsøg. Patienter, der blev tildelt STRATTERA i vedligeholdelsesfasen, blev generelt fortsat med den samme dosis, som blev brugt til at opnå et respons i den åbne fase. Den læge, der vælger at bruge STRATTERA i længere perioder, bør periodisk revurdere lægemidlets langsigtede anvendelighed for den enkelte patient [se Kliniske Studier ].
Generel doseringsinformation
STRATTERA kan tages med eller uden mad.
STRATTERA 40mg kan seponeres uden at blive nedtrappet.
STRATTERA kapsler er ikke beregnet til at blive åbnet, de skal tages hele [se PATIENTOPLYSNINGER ].
Sikkerheden ved enkeltdoser over 120 mg og samlede daglige doser over 150 mg er ikke blevet systematisk evalueret.
Dosering i specifikke populationer
Dosisjustering til patienter med nedsat leverfunktion
For de ADHD-patienter, som har leverinsufficiens (HI), anbefales dosisjustering som følger: For patienter med moderat HI (Child-Pugh Klasse B) bør start- og måldoserne reduceres til 50 % af den normale dosis (til patienter uden HEJ). For patienter med svær HI (Child-Pugh klasse C) bør startdosis og måldoser reduceres til 25 % af det normale [se Brug i specifikke populationer ].
Dosisjustering til brug med en stærk CYP2D6-hæmmer eller hos patienter, der er kendt for at være CYP2D6 PM'er
Hos børn og unge op til 70 kg legemsvægt administreret stærke CYP2D6-hæmmere, f.eks. paroxetin, fluoxetin og quinidin, eller hos patienter, der vides at være CYP2D6 PM'er, bør STRATTERA påbegyndes med 0,5 mg/kg/dag og kun øges til den sædvanlige måldosis på 1,2 mg/kg/dag, hvis symptomerne ikke forbedres efter 4 uger, og startdosis er veltolereret.
Hos børn og unge over 70 kg legemsvægt og voksne, der får stærke CYP2D6-hæmmere, f.eks. paroxetin, fluoxetin og quinidin, bør STRATTERA påbegyndes med 40 mg/dag og kun øges til den sædvanlige måldosis på 80 mg/dag, hvis symptomerne svigter. forbedres efter 4 uger, og startdosis tolereres godt.
HVORDAN LEVERET
Doseringsformer og styrker
Hver kapsel indeholder atomoxetin HCl svarende til 10 mg (ugennemsigtig hvid, uigennemsigtig hvid), 18 mg (guld, uigennemsigtig hvid), 25 mg (ugennemsigtig blå, uigennemsigtig hvid), 40 mg (ugennemsigtig blå, uigennemsigtig blå), 60 mg (ugennemsigtig Blå, guld), 80 mg (ugennemsigtig brun, uigennemsigtig hvid) eller 100 mg (ugennemsigtig brun, uigennemsigtig brun) atomoxetin.
Opbevaring og håndtering
Opbevares ved 25°C (77°F); udflugter tilladt til 15° til 30°C (59° til 86°F) [se USP kontrolleret rumtemperatur].
Markedsført af: Lilly USA, LLC Indianapolis, IN 46285, USA. Revideret: maj 2017.
BIVIRKNINGER
Erfaring med kliniske forsøg
STRATTERA 10 mg blev givet til 5382 børn eller unge patienter med ADHD og 1007 voksne med ADHD i kliniske undersøgelser. Under de kliniske ADHD-undersøgelser blev 1625 børn og unge patienter behandlet i mere end 1 år, og 2529 børn og unge patienter blev behandlet i mere end 6 måneder.
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Kliniske forsøg med børn og unge
Årsager til afbrydelse af behandling på grund af bivirkninger i kliniske forsøg med børn og unge
akutte placebokontrollerede undersøgelser af børn og unge afbrød 3,0 % (48/1613) af atomoxetin-personerne og 1,4 % (13/945) placebo-personerne på grund af bivirkninger. For alle undersøgelser (inklusive åbne og langtidsundersøgelser) afbrød 6,3 % af patienter med omfattende metabolisering (EM) og 11,2 % af patienter med dårlig metabolisering (PM) på grund af en bivirkning. Blandt STRATTERA-behandlede patienter irritabilitet (0,3 %, N=5); somnolens (0,3 %, N=5); aggression (0,2%, N=4); kvalme (0,2%, N=4); opkastning (0,2%, N=4); mavesmerter (0,2 %, N=4); obstipation (0,1 %, N=2); træthed (0,1%, N=2); følelse unormal (0,1 %, N=2); og hovedpine (0,1 %, N=2) var årsagerne til seponering rapporteret af mere end 1 patient.
Anfald
STRATTERA er ikke blevet systematisk evalueret hos pædiatriske patienter med krampeanfald, da disse patienter blev udelukket fra kliniske undersøgelser under produktets præmarket test. I det kliniske udviklingsprogram blev anfald rapporteret hos 0,2 % (12/5073) af børn, hvis gennemsnitsalder var 10 år (interval 6 til 16 år). I disse kliniske forsøg var krampeanfaldsrisikoen blandt dårlige metabolisatorer 0,3 % (1/293) sammenlignet med 0,2 % (11/4741) for omfattende metabolisatorer.
Almindeligvis observerede bivirkninger i akutte børn og unge, placebokontrollerede forsøg
Almindeligvis observerede bivirkninger forbundet med brugen af STRATTERA (incidens på 2 % eller mere) og ikke observeret ved en tilsvarende hyppighed blandt placebo-behandlede patienter (STRATTERA 40 mg forekomst større end placebo) er anført i tabel 2. Resultaterne var ens i BID og QD-forsøget undtagen som vist i tabel 3, som viser både BID- og QD-resultater for udvalgte bivirkninger baseret på statistisk signifikante Breslow-Day-tests. De hyppigst observerede bivirkninger hos patienter behandlet med STRATTERA (hyppighed på 5 % eller mere og mindst to gange hyppigheden hos placebopatienter, for enten BID eller QD dosering) var: kvalme, opkastning, træthed, nedsat appetit, mavesmerter og somnolens (se tabel 2 og 3).
Yderligere data fra ADHD kliniske forsøg (kontrollerede og ukontrollerede) har vist, at ca. 5 til 10 % af pædiatriske patienter oplevede potentielt klinisk vigtige ændringer i hjertefrekvens (≥20 slag pr. min) eller blodtryk (≥15 til 20 mm Hg) [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Følgende bivirkninger forekom hos mindst 2 % af børn og unge CYP2D6 PM patienter og var statistisk signifikant hyppigere hos PM patienter sammenlignet med CYP2D6 EM patienter: søvnløshed (11 % af PM, 6 % af EM); vægt faldet (7% af PM'er, 4% af EM'er); forstoppelse (7% af PM'er, 4% af EM'er); depression1 (7% af PM'er, 4% af EM'er); tremor (5% af PM'er, 1% af EM'er); excoriation (4% af PM'er, 2% af EM'er); middel søvnløshed (3% af PM'er, 1% af EM'er); conjunctivitis (3% af PM'er, 1% af EM'er); synkope (3% af PM'er, 1% af EM'er); tidlig morgenvågning (2% af PM'er, 1% af EM'er); mydriasis (2% af PM'er, 1% af EM'er); sedation (4% af PM'er, 2% af EM'er).
1Depression omfatter følgende udtryk: depression, svær depression, depressive symptomer, deprimeret humør, dysfori.
Voksen kliniske forsøg
Årsager til afbrydelse af behandling på grund af bivirkninger i akutte placebokontrollerede voksne forsøg
de akutte, placebokontrollerede voksne forsøg ophørte 11,3 % (61/541) atomoxetin-personer og 3,0 % (12/405) placebo-personer på grund af bivirkninger. Blandt STRATTERA-behandlede patienter, søvnløshed (0,9 %, N=5); kvalme (0,9 %, N=5); brystsmerter (0,6 %, N=3); træthed (0,6%, N=3); angst (0,4 %, N=2); erektil dysfunktion (0,4 %, N=2); humørsvingninger (0,4 %, N=2); nervøsitet (0,4 %, N=2); hjertebanken (0,4%, N=2); og urinretention (0,4 %, N=2) var årsagerne til seponering rapporteret af mere end 1 patient.
Anfald
STRATTERA er ikke blevet systematisk evalueret hos voksne patienter med krampeanfald, da disse patienter blev udelukket fra kliniske undersøgelser under produktets præmarket test. I det kliniske udviklingsprogram blev anfald rapporteret hos 0,1 % (1/748) af voksne patienter. I disse kliniske forsøg rapporterede ingen dårlige metabolisatorer (0/43) anfald sammenlignet med 0,1 % (1/705) for omfattende metabolisatorer.
Almindeligvis observerede bivirkninger i akutte, placebokontrollerede voksne forsøg
Almindeligvis observerede bivirkninger forbundet med brugen af STRATTERA (forekomst på 2 % eller mere) og ikke observeret ved en tilsvarende forekomst blandt placebo-behandlede patienter (STRATTERA 25 mg forekomst større end placebo) er anført i tabel 4. De mest almindeligt observerede bivirkninger hos patienter behandlet med STRATTERA (hyppighed på 5 % eller mere og mindst to gange hyppigheden hos placebopatienter) var: forstoppelse, mundtørhed, kvalme, nedsat appetit, svimmelhed, erektil dysfunktion og urintøven (se tabel 4). Yderligere data fra ADHD kliniske forsøg (kontrollerede og ukontrollerede) har vist, at ca. 5 til 10 % af voksne patienter oplevede potentielt klinisk vigtige ændringer i hjertefrekvens (≥20 slag i minuttet) eller blodtryk (≥15 til 20 mm Hg) [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Følgende bivirkninger forekom hos mindst 2 % af voksne CYP2D6-patienter med dårlig metabolisering (PM) og var statistisk signifikant hyppigere hos PM-patienter sammenlignet med CYP2D6-patienter med omfattende metabolisering (EM): sløret syn (4 % af PM, 1 % af EM). ); mundtørhed (35% af PM'er, 17% af EM'er); obstipation (11% af PM'er, 7% af EM'er); følelse af nervøsitet (5% af PM'er, 2% af EM'er); nedsat appetit (23% af PM'er, 15% af EM'er); tremor (5% af PM'er, 1% af EM'er); søvnløshed (19% af PM'er, 11% af EM'er); søvnforstyrrelser (7% af PM'er, 3% af EM'er); middel søvnløshed (5% af PM'er, 3% af EM'er); terminal søvnløshed (3% af PM'er, 1% af EM'er); urinretention (6% af PM'er, 1% af EM'er); erektil dysfunktion (21% af PM'er, 9% af EM'er); ejakulationsforstyrrelse (6% af PM'er, 2% af EM'er); hyperhidrose (15% af PM'er, 7% af EM'er); perifer kulde (3% af PM'er, 1% af EM'er).
Mandlig og kvindelig seksuel dysfunktion
Atomoxetin ser ud til at forringe den seksuelle funktion hos nogle patienter. Ændringer i seksuel lyst, seksuel præstation og seksuel tilfredsstillelse vurderes ikke godt i de fleste kliniske forsøg, fordi de har brug for særlig opmærksomhed, og fordi patienter og læger kan være tilbageholdende med at diskutere dem. Følgelig vil estimater af forekomsten af uønsket seksuel oplevelse og ydeevne, der er nævnt i produktmærkning, sandsynligvis undervurdere den faktiske forekomst. Tabel 4 ovenfor viser forekomsten af seksuelle bivirkninger rapporteret af mindst 2 % af voksne patienter, der tager STRATTERA i placebokontrollerede forsøg.
Der er ingen tilstrækkelige og velkontrollerede undersøgelser, der undersøger seksuel dysfunktion med STRATTERA 40 mg behandling. Selvom det er svært at kende den præcise risiko for seksuel dysfunktion forbundet med brugen af STRATTERA 40 mg, bør læger rutinemæssigt forhøre sig om sådanne mulige bivirkninger.
Postmarketing spontane rapporter
Følgende bivirkninger er blevet identificeret under brug af STRATTERA efter godkendelse. Medmindre andet er angivet, er disse bivirkninger forekommet hos voksne og børn og unge. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Kardiovaskulære system - QT forlængelse, synkope.
Perifere vaskulære effekter - Raynauds fænomen.
Generelle lidelser og tilstande på administrationsstedet - Sløvhed.
Muskuloskeletale system - Rhabdomyolyse.
Forstyrrelser i nervesystemet - Hypoæstesi; paræstesi hos børn og unge; sensoriske forstyrrelser; tics.
Psykiatriske lidelser - Depression og deprimeret stemning; angst, libido ændringer.
Anfald Anfald er blevet rapporteret i perioden efter markedsføring. Anfaldstilfældene efter markedsføring omfatter patienter med allerede eksisterende anfaldslidelser og dem med identificerede risikofaktorer for anfald, såvel som patienter med hverken en historie med eller identificerede risikofaktorer for anfald. Det nøjagtige forhold mellem STRATTERA 40mg og anfald er vanskeligt at evaluere på grund af usikkerhed om baggrundsrisikoen for anfald hos ADHD-patienter.
Hud- og subkutane vævssygdomme - Alopeci, hyperhidrose.
Urogenital system - Mandlige bækkensmerter; urintøven hos børn og unge; urinretention hos børn og unge.
DRUGSINTERAKTIONER
Monoaminoxidasehæmmere
Med andre lægemidler, der påvirker hjernens monoaminkoncentrationer, har der været rapporter om alvorlige, nogle gange fatale reaktioner (inklusive hypertermi, stivhed, myoklonus, autonom ustabilitet med mulige hurtige udsving i vitale tegn og mentale statusændringer, der omfatter ekstrem agitation, der udvikler sig til delirium og koma ) når det tages i kombination med en MAO-hæmmer. Nogle tilfælde præsenteres med træk, der ligner malignt neuroleptisk syndrom. Sådanne reaktioner kan forekomme, når disse lægemidler gives samtidigt eller i umiddelbar nærhed [se KONTRAINDIKATIONER ].
Virkning af CYP2D6-hæmmere på Atomoxetin
Hos ekstensive metabolisatorer (EM'er) øger hæmmere af CYP2D6 (f.eks. paroxetin, fluoxetin og quinidin) atomoxetins steady-state plasmakoncentrationer til eksponeringer svarende til dem, der observeres hos dårlige metabolisatorer (PM'er). Hos EM-individer behandlet med paroxetin eller fluoxetin er AUC for atomoxetin ca. 6-8 gange, og Css, max er ca. 3-4 gange større end atomoxetin alene.
In vitro undersøgelser tyder på, at samtidig administration af cytochrom P450-hæmmere til PM'er ikke vil øge plasmakoncentrationerne af atomoxetin.
Antihypertensiva og pressormidler
På grund af mulige påvirkninger på blodtrykket bør STRATTERA anvendes med forsigtighed sammen med antihypertensiva og pressormidler (f.eks. dopamin, dobutamin) eller andre lægemidler, der øger blodtrykket.
Albuterol
STRATTERA bør administreres med forsigtighed til patienter, der behandles med systemisk administreret (oralt eller intravenøst) albuterol (eller andre beta2-agonister), fordi virkningen af albuterol på det kardiovaskulære system kan forstærkes, hvilket resulterer i stigninger i hjertefrekvens og blodtryk. Albuterol (600 mcg iv over 2 timer) inducerede stigninger i hjertefrekvens og blodtryk. Disse virkninger blev forstærket af atomoxetin (60 mg BID i 5 dage) og var mest udtalte efter den indledende samtidige administration af albuterol og atomoxetin. Disse virkninger på hjertefrekvens og blodtryk blev dog ikke set i et andet studie efter samtidig administration med inhaleret dosis af albuterol (200-800 mcg) og atomoxetin (80 mg dagligt i 5 dage) hos 21 raske asiatiske forsøgspersoner, som blev udelukket for fattige. metabolisator status.
Effekt af Atomoxetin på P450-enzymer
Atomoxetin forårsagede ikke klinisk vigtig hæmning eller induktion af cytochrom P450-enzymer, inklusive CYP1A2, CYP3A, CYP2D6 og CYP2C9.
CYP3A-substrat (f.eks. Midazolam)
Samtidig administration af STRATTERA (60 mg BID i 12 dage) med midazolam, en modelforbindelse til CYP3A4-metaboliserede lægemidler (enkeltdosis på 5 mg), resulterede i en stigning på 15 % i AUC for midazolam. Ingen dosisjustering anbefales for lægemidler, der metaboliseres af CYP3A.
CYP2D6-substrat (f.eks. Desipramin)
Samtidig administration af STRATTERA (40 eller 60 mg BID i 13 dage) med desipramin, en modelforbindelse til CYP2D6-metaboliserede lægemidler (enkeltdosis på 50 mg), ændrede ikke desipramins farmakokinetik. Ingen dosisjustering anbefales for lægemidler, der metaboliseres af CYP2D6.
Alkohol
Indtagelse af ethanol med STRATTERA 18 mg ændrede ikke ethanolens rusvirkning.
Methylphenidat
Samtidig administration af methylphenidat og STRATTERA 18 mg øgede ikke kardiovaskulære effekter ud over dem, der ses med methylphenidat alene.
Lægemidler stærkt bundet til plasmaprotein
In vitro lægemiddelfortrængningsundersøgelser blev udført med atomoxetin og andre stærkt bundne lægemidler i terapeutiske koncentrationer. Atomoxetin påvirkede ikke bindingen af warfarin, acetylsalicylsyre, phenytoin eller diazepam til humant albumin. Tilsvarende påvirkede disse forbindelser ikke bindingen af atomoxetin til humant albumin.
Lægemidler, der påvirker gastrisk pH
Lægemidler, der hæver gastrisk pH (magnesiumhydroxid/aluminiumhydroxid, omeprazol) havde ingen effekt på STRATTERA biotilgængelighed.
Stofmisbrug og afhængighed
kontrolleret stof
STRATTERA er ikke et kontrolleret stof.
Misbrug
I et randomiseret, dobbeltblindt, placebokontrolleret, misbrugspotentielt studie hos voksne, der sammenlignede virkningerne af STRATTERA og placebo, var STRATTERA ikke forbundet med et responsmønster, der tydede på stimulerende eller euforiserende egenskaber.
Afhængighed
Kliniske undersøgelsesdata hos over 2000 børn, unge og voksne med ADHD og over 1200 voksne med depression viste kun isolerede tilfælde af medicinafledning eller uhensigtsmæssig selvadministration forbundet med STRATTERA. Der var ingen tegn på symptomrebound eller bivirkninger, der tyder på en medicinafbrydelse eller abstinenssyndrom.
Dyreoplevelse
Lægemiddeldiskriminationsundersøgelser hos rotter og aber viste inkonsekvent stimulusgeneralisering mellem atomoxetin og kokain.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Selvmordstanker
STRATTERA øgede risikoen for selvmordstanker i korttidsundersøgelser hos børn og unge med opmærksomhedsunderskud/hyperaktivitetsforstyrrelse (ADHD). Samlede analyser af kortvarige (6 til 18 uger) placebokontrollerede forsøg med STRATTERA hos børn og unge har afsløret en større risiko for selvmordstanker tidligt under behandlingen hos dem, der får STRATTERA. Der var i alt 12 forsøg (11 ved ADHD og 1 ved enurese), der involverede over 2200 patienter (inklusive 1357 patienter, der fik STRATTERA og 851, der fik placebo). Den gennemsnitlige risiko for selvmordstanker hos patienter, der fik STRATTERA, var 0,4 % (5/1357 patienter), sammenlignet med ingen hos placebobehandlede patienter. Der var 1 selvmordsforsøg blandt disse ca. 2200 patienter, som fandt sted hos en patient behandlet med STRATTERA. Der fandt ingen selvmord sted i disse forsøg. Alle reaktioner forekom hos børn på 12 år eller derunder. Alle reaktioner forekom i løbet af den første måned af behandlingen. Det er ukendt, om risikoen for selvmordstanker hos pædiatriske patienter strækker sig til længerevarende brug. En lignende analyse hos voksne patienter behandlet med STRATTERA for enten ADHD eller svær depressiv lidelse (MDD) viste ikke en øget risiko for selvmordstanker eller -adfærd i forbindelse med brugen af STRATTERA.
Alle pædiatriske patienter, der behandles med STRATTERA, bør overvåges passende og observeres nøje for klinisk forværring, suicidalitet og usædvanlige ændringer i adfærd, især i løbet af de første par måneder af et lægemiddelbehandlingsforløb eller i tidspunkter med dosisændringer, enten stigninger eller fald. .
Følgende symptomer er blevet rapporteret med STRATTERA: angst, agitation, panikanfald, søvnløshed, irritabilitet, fjendtlighed, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshed), hypomani og mani. Selvom en årsagssammenhæng mellem fremkomsten af sådanne symptomer og fremkomsten af selvmordsimpulser ikke er blevet etableret, er der en bekymring for, at sådanne symptomer kan repræsentere forløbere for ny suicidalitet. Patienter, der behandles med STRATTERA 40 mg, bør derfor observeres for fremkomsten af sådanne symptomer.
Det bør overvejes at ændre det terapeutiske regime, herunder eventuelt seponering af medicinen, hos patienter, som oplever emergent suicidity eller symptomer, der kan være forløbere for emergent suicidity, især hvis disse symptomer er alvorlige eller pludseligt opståede eller ikke var en del af patientens symptomer.
Familier og pårørende til pædiatriske patienter, der behandles med STRATTERA 10 mg, bør advares om behovet for at overvåge patienterne for fremkomsten af agitation, irritabilitet, usædvanlige ændringer i adfærd og de andre symptomer beskrevet ovenfor, såvel som fremkomsten af suicidalitet, og at rapportere sådanne symptomer straks til sundhedsudbydere. Sådan overvågning bør omfatte daglig observation af familier og omsorgspersoner.
Alvorlig leverskade
Postmarketing rapporter indikerer, at STRATTERA kan forårsage alvorlig leverskade. Selvom der ikke blev påvist tegn på leverskade i kliniske forsøg med ca. 6000 patienter, har der været sjældne tilfælde af klinisk signifikant leverskade, som blev anset for at være sandsynligt eller muligvis relateret til brug af STRATTERA 40 mg efter markedsføring. Sjældne tilfælde af leversvigt er også blevet rapporteret, herunder et tilfælde, der resulterede i en levertransplantation. På grund af sandsynlig underrapportering er det umuligt at give et nøjagtigt skøn over den sande forekomst af disse reaktioner. Rapporterede tilfælde af leverskade forekom inden for 120 dage efter påbegyndelse af atomoxetin i de fleste tilfælde, og nogle patienter præsenterede med markant forhøjede leverenzymer [>20 X øvre normalgrænse (ULN)] og gulsot med signifikant forhøjede bilirubinniveauer (>2 X ULN), efterfulgt af bedring ved seponering af atomoxetin. Hos en patient kom leverskade, manifesteret af forhøjede leverenzymer op til 40 X ULN og gulsot med bilirubin op til 12 X ULN, tilbage ved genudsættelse og blev efterfulgt af bedring ved seponering af lægemidlet, hvilket gav bevis for, at STRATTERA sandsynligvis forårsagede leverskaden. Sådanne reaktioner kan forekomme flere måneder efter, at behandlingen er startet, men laboratorieabnormiteter kan fortsætte med at forværres i flere uger efter, at lægemidlet er stoppet. Den ovenfor beskrevne patient kom sig over sin leverskade og krævede ikke en levertransplantation.
STRATTERA bør seponeres hos patienter med gulsot eller laboratoriebevis for leverskade og bør ikke genoptages. Laboratorieundersøgelser for at bestemme leverenzymniveauer bør udføres efter det første symptom eller tegn på leverdysfunktion (f.eks. kløe, mørk urin, gulsot, ømhed i højre øvre kvadrant eller uforklarlige "influenzalignende" symptomer) [se Laboratorieprøver , PATIENTOPLYSNINGER ].
Alvorlige kardiovaskulære hændelser
Pludselig død og allerede eksisterende strukturelle hjerteabnormiteter eller andre alvorlige hjerteproblemer
Børn og unge
Pludselig død er blevet rapporteret i forbindelse med atomoxetinbehandling i sædvanlige doser hos børn og unge med strukturelle hjerteabnormiteter eller andre alvorlige hjerteproblemer. Selvom nogle alvorlige hjerteproblemer alene medfører en øget risiko for pludselig død, bør atomoxetin generelt ikke anvendes til børn eller unge med kendte alvorlige strukturelle hjerteabnormaliteter, kardiomyopati, alvorlige hjerterytmeforstyrrelser eller andre alvorlige hjerteproblemer, der kan gøre dem mere sårbare. til de noradrenerge virkninger af atomoxetin.
Voksne
Pludselige dødsfald, slagtilfælde og myokardieinfarkt er blevet rapporteret hos voksne, der tager atomoxetin i sædvanlige doser for ADHD. Selvom atomoxetins rolle i disse voksne tilfælde også er ukendt, har voksne større sandsynlighed end børn for at have alvorlige strukturelle hjerteabnormiteter, kardiomyopati, alvorlige hjerterytmeabnormiteter, koronararteriesygdomme eller andre alvorlige hjerteproblemer. Det bør overvejes ikke at behandle voksne med klinisk signifikante hjerteabnormaliteter.
Vurdering af kardiovaskulær status hos patienter, der behandles med Atomoxetin
Børn, unge eller voksne, der overvejes til behandling med atomoxetin, bør have en omhyggelig anamnese (herunder vurdering for en familiehistorie med pludselig død eller ventrikulær arytmi) og fysisk undersøgelse for at vurdere tilstedeværelsen af hjertesygdom og bør modtage yderligere hjertesygdomme. evaluering, hvis resultater tyder på en sådan sygdom (f.eks. elektrokardiogram og ekkokardiogram). Patienter, der udvikler symptomer såsom anstrengende brystsmerter, uforklarlig synkope eller andre symptomer, der tyder på hjertesygdom under atomoxetinbehandling, bør gennemgå en hurtig hjerteevaluering.
Effekter på blodtryk og hjertefrekvens
STRATTERA bør anvendes med forsigtighed til patienter, hvis underliggende medicinske tilstande kan forværres af stigninger i blodtryk eller hjertefrekvens, såsom visse patienter med hypertension, takykardi eller kardiovaskulær eller cerebrovaskulær sygdom. Det bør ikke anvendes til patienter med alvorlige hjerte- eller vaskulære lidelser, hvis tilstand forventes at forværres, hvis de oplevede klinisk vigtige stigninger i blodtryk eller hjertefrekvens [se KONTRAINDIKATIONER ]. Puls og blodtryk bør måles ved baseline, efter STRATTERA-dosisforhøjelser og periodisk under behandling for at påvise mulige klinisk vigtige stigninger.
Følgende tabel giver kortsigtede, placebokontrollerede kliniske forsøgsdata for andelen af patienter med en stigning i: diastolisk blodtryk ≥15 mm Hg; systolisk blodtryk ≥20 mm Hg; hjertefrekvens større end eller lig med 20 slag/min, i både den pædiatriske og voksne population (se tabel 1).
placebokontrollerede registreringsundersøgelser, der involverede pædiatriske patienter, blev takykardi identificeret som en bivirkning for 0,3 % (5/1597) af disse STRATTERA 10 mg patienter sammenlignet med 0 % (0/934) af placebopatienterne. Den gennemsnitlige hjertefrekvensstigning hos patienter med ekstensiv metabolisering (EM) var 5,0 slag/minut, og hos patienter med dårligt stofskifte (PM) 9,4 slag/minut.
I kliniske forsøg med voksne, hvor EM/PM-status var tilgængelig, var den gennemsnitlige hjertefrekvensstigning hos PM-patienter signifikant højere end hos EM-patienter (11 slag/minut versus 7,5 slag/minut). Hjertefrekvenseffekterne kan være klinisk vigtige hos nogle PM-patienter.
I placebokontrollerede registreringsundersøgelser, der involverede voksne patienter, blev takykardi identificeret som en bivirkning for 1,5 % (8/540) af STRATTERA 25 mg patienter sammenlignet med 0,5 % (2/402) af placebopatienter.
kliniske forsøg med voksne, hvor EM/PM-status var tilgængelig, var den gennemsnitlige ændring fra baseline i diastolisk blodtryk hos PM-patienter højere end hos EM-patienter (4,21 versus 2,13 mm Hg), ligesom den gennemsnitlige ændring fra baseline i systolisk blodtryk (PM) : 2,75 versus EM: 2,40 mm Hg). Blodtrykseffekterne kan være klinisk vigtige hos nogle PM-patienter.
Ortostatisk hypotension og synkope er blevet rapporteret hos patienter, der tager STRATTERA. I registreringsundersøgelser af børn og unge oplevede 0,2 % (12/5596) af STRATTERA-behandlede patienter ortostatisk hypotension, og 0,8 % (46/5596) oplevede synkope. I korttidsregistreringsundersøgelser af børn og unge oplevede 1,8 % (6/340) af STRATTERA-behandlede patienter ortostatisk hypotension sammenlignet med 0,5 % (1/207) af placebo-behandlede patienter. Synkope blev ikke rapporteret under korttids placebokontrollerede ADHD-registreringsundersøgelser hos børn og unge. STRATTERA 10 mg bør anvendes med forsigtighed ved enhver tilstand, der kan disponere patienter for hypotension, eller tilstande forbundet med pludselige puls- eller blodtryksændringer.
Fremkomst af nye psykotiske eller maniske symptomer
Behandlingsudspringende psykotiske eller maniske symptomer, f.eks. hallucinationer, vrangforestillinger eller mani hos børn og unge uden en tidligere psykotisk sygdom eller mani, kan være forårsaget af atomoxetin ved sædvanlige doser. Hvis sådanne symptomer opstår, bør en mulig årsagsrolle af atomoxetin overvejes, og seponering af behandlingen bør overvejes. I en samlet analyse af flere kortsigtede, placebo-kontrollerede undersøgelser forekom sådanne symptomer hos omkring 0,2 % (4 patienter med reaktioner ud af 1939 udsat for atomoxetin i flere uger ved sædvanlige doser) af atomoxetin-behandlede patienter sammenlignet med 0 ud af 1939. 1056 placebo-behandlede patienter.
Screening af patienter for bipolar lidelse
Generelt bør der udvises særlig forsigtighed ved behandling af ADHD hos patienter med komorbid bipolar lidelse på grund af bekymring for mulig induktion af en blandet/manisk episode hos patienter med risiko for bipolar lidelse. Hvorvidt nogen af de ovenfor beskrevne symptomer repræsenterer en sådan omdannelse er ukendt. Før påbegyndelse af behandling med STRATTERA 40 mg, bør patienter med komorbide depressive symptomer dog screenes tilstrækkeligt for at afgøre, om de har risiko for bipolar lidelse; sådan screening bør omfatte en detaljeret psykiatrisk historie, herunder en familiehistorie med selvmord, bipolar lidelse og depression.
Aggressiv adfærd eller fjendtlighed
Patienter, der begynder behandling for ADHD, bør overvåges for udseende eller forværring af aggressiv adfærd eller fjendtlighed. Aggressiv adfærd eller fjendtlighed observeres ofte hos børn og unge med ADHD. I pædiatriske korttidskontrollerede kliniske forsøg rapporterede 21/1308 (1,6 %) af atomoxetin-patienter mod 9/806 (1,1 %) af placebo-behandlede patienter spontant behandlingsfremkomne fjendtlighedsrelaterede bivirkninger (samlet risikoforhold på 1,33 [95 %). CI 0,67-2,64 – ikke statistisk signifikant]). I placebokontrollerede kliniske forsøg med voksne rapporterede 6/1697 (0,35 %) af atomoxetin-patienter mod 4/1560 (0,26 %) af placebo-behandlede patienter spontant behandlingsfremkomne fjendtlighedsrelaterede bivirkninger (samlet risikoforhold på 1,38 [95 % CI) 0,39-4,88 – ikke statistisk signifikant]). Selvom dette ikke er afgørende bevis på, at STRATTERA 10 mg forårsager aggressiv adfærd eller fjendtlighed, blev denne adfærd hyppigere observeret i kliniske forsøg blandt børn, unge og voksne behandlet med STRATTERA sammenlignet med placebo.
Allergiske hændelser
Selvom det er ualmindeligt, er allergiske reaktioner, inklusive anafylaktiske reaktioner, angioneurotisk ødem, nældefeber og udslæt, blevet rapporteret hos patienter, der tager STRATTERA.
Virkninger på urinudstrømning fra blæren
I voksne ADHD-kontrollerede forsøg var frekvensen af urinretention (1,7 %, 9/540) og urintøven (5,6 %, 30/540) øget blandt atomoxetin-personer sammenlignet med placebo-personer (0 %, 0/402; 0,5 %, 2/402). To voksne atomoxetin-personer og ingen placebo-individer afbrød behandlingen fra kontrollerede kliniske forsøg på grund af urinretention. En klage over urinretention eller urintøven bør betragtes som potentielt relateret til atomoxetin.
Priapisme
Sjældne postmarketing tilfælde af priapisme, defineret som smertefuld og ikke-smertefuld penis erektion, der varer mere end 4 timer, er blevet rapporteret for pædiatriske og voksne patienter behandlet med STRATTERA. Erektionerne forsvandt i tilfælde, hvor opfølgningsinformation var tilgængelig, nogle efter seponering af STRATTERA. Hurtig lægehjælp er påkrævet i tilfælde af mistanke om priapisme.
Effekter på vækst
Data om langtidsvirkningerne af STRATTERA 25 mg på væksten kommer fra åbne undersøgelser, og vægt- og højdeændringer sammenlignes med normative populationsdata. Generelt halter vægt- og højdeforøgelsen hos pædiatriske patienter behandlet med STRATTERA bagud, hvad der er forudsagt af normative befolkningsdata for ca. de første 9-12 måneders behandling. Efterfølgende vender vægtforøgelsen tilbage, og efter ca. 3 års behandling har patienter behandlet med STRATTERA i gennemsnit taget 17,9 kg på, 0,5 kg mere end forudsagt af deres baseline-data. Efter ca. 12 måneder stabiliseres højdestigningen, og efter 3 år har patienter behandlet med STRATTERA 40 mg i gennemsnit taget 19,4 cm på, 0,4 cm mindre end forudsagt af deres baseline-data (se figur 1 nedenfor).
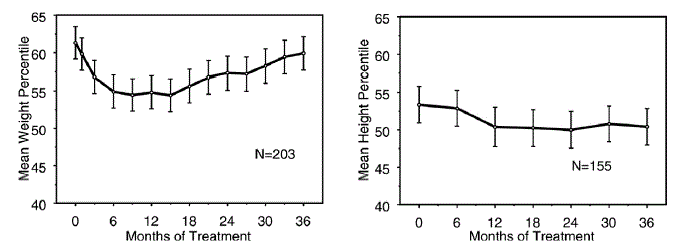
Figur 1: Gennemsnitlig vægt- og højdepercentiler over tid for patienter med tre års STRATTERA 40 mg-behandling
Dette vækstmønster var generelt ens uanset pubertetsstatus på tidspunktet for behandlingsstart. Patienter, der var præ-pubertale ved behandlingens start (piger ≤8 år, drenge ≤9 år) tog i gennemsnit 2,1 kg på og 1,2 cm mindre end forudsagt efter tre år. Patienter, der var pubertet (piger >8 til ≤13 år, drenge >9 til ≤14 år) eller sen pubertet (piger >13 år, drenge >14 år) havde gennemsnitlige vægt- og højdestigninger, der var tæt på eller oversteg de forudsagte efter tre års behandling.
Væksten fulgte et lignende mønster hos både omfattende og dårlige metabolisatorer (EM'er, PM'er). PM'er behandlet i mindst to år tog i gennemsnit 2,4 kg og 1,1 cm mindre på end forudsagt, mens EM'er i gennemsnit tog 0,2 kg og 0,4 cm mindre på end forudsagt.
korttidskontrollerede undersøgelser (op til 9 uger) tabte STRATTERA-behandlede patienter i gennemsnit 0,4 kg og tog i gennemsnit 0,9 cm på sammenlignet med en stigning på 1,5 kg og 1,1 cm hos de placebobehandlede patienter. I et kontrolleret forsøg med fast dosis tabte 1,3 %, 7,1 %, 19,3 % og 29,1 % af patienterne mindst 3,5 % af deres kropsvægt i dosisgrupperne med placebo, 0,5, 1,2 og 1,8 mg/kg/dag.
Væksten bør overvåges under behandling med STRATTERA.
Laboratorieprøver
Rutinemæssig laboratorietest er ikke påkrævet.
CYP2D6 Metabolisme
Dårlige metabolisatorer (PM'er) af CYP2D6 har en 10 gange højere AUC og en 5 gange højere maksimal koncentration til en given dosis af STRATTERA 25 mg sammenlignet med omfattende metabolisatorer (EM'er). Cirka 7% af en kaukasisk befolkning er PM'er. Laboratorietest er tilgængelige for at identificere CYP2D6 PM'er. Blodniveauerne i PM'er svarer til dem, der opnås ved at tage stærke CYP2D6-hæmmere. De højere blodniveauer i PM'er fører til en højere frekvens af nogle bivirkninger af STRATTERA [se BIVIRKNINGER ].
Samtidig brug af potente CYP2D6-hæmmere eller brug hos patienter, der er kendt for at være CYP2D6 PM'er
Atomoxetin metaboliseres primært via CYP2D6-vejen til 4-hydroxyatomoxetin. Dosisjustering af STRATTERA kan være nødvendig, når det administreres sammen med potente CYP2D6-hæmmere (f.eks. paroxetin, fluoxetin og quinidin) eller når det administreres til CYP2D6 PM'er. [Se DOSERING OG ADMINISTRATION og DRUGSINTERAKTIONER ].
Patientrådgivningsinformation
Se FDA-godkendt PATIENTOPLYSNINGER .
Generel information
Læger bør instruere deres patienter i at læse medicinvejledningen, før behandlingen med STRATTERA påbegyndes, og at læse den igen, hver gang recepten fornyes.
Ordinerende læger eller andet sundhedspersonale bør informere patienter, deres familier og deres pårørende om fordele og risici forbundet med behandling med STRATTERA og bør rådgive dem om dens passende brug. Den ordinerende læge eller sundhedspersonalet bør instruere patienter, deres familier og deres pårørende i at læse medicinvejledningen og skal hjælpe dem med at forstå dens indhold. Patienterne skal have mulighed for at diskutere indholdet af medicinvejledningen og få svar på de spørgsmål, de måtte have.
Patienter skal informeres om følgende problemer og bedes om at advare deres ordinerende læge, hvis disse opstår, mens de tager STRATTERA.
Selvmordsrisiko
Patienter, deres familier og deres pårørende bør opmuntres til at være opmærksomme på fremkomsten af angst, agitation, panikanfald, søvnløshed, irritabilitet, fjendtlighed, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshed), hypomani, mani, andre usædvanlige ændringer i adfærd. , depression og selvmordstanker, især tidligt under behandlingen med STRATTERA, og når dosis justeres. Familier og pårørende til patienter bør rådes til at observere for fremkomsten af sådanne symptomer på daglig basis, da ændringer kan være pludselige. Sådanne symptomer bør indberettes til patientens ordinerende læge eller sundhedspersonale, især hvis de er alvorlige, pludseligt opståede eller ikke var en del af patientens symptomer. Symptomer som disse kan være forbundet med en øget risiko for selvmordstanker og -adfærd og indikerer behov for meget tæt overvågning og muligvis ændringer i medicinen.
Alvorlig leverskade
Patienter, der starter STRATTERA, skal advares om, at der kan udvikle sig alvorlig leverskade. Patienter skal instrueres i at kontakte deres læge med det samme, hvis de udvikler kløe, mørk urin, gulsot, ømhed i højre øvre kvadrant eller uforklarlige "influenzalignende" symptomer [se ADVARSLER OG FORHOLDSREGLER ].
Aggression eller fjendtlighed
Patienter skal instrueres i at ringe til deres læge så hurtigt som muligt, hvis de bemærker en stigning i aggression eller fjendtlighed.
Priapisme
Sjældne postmarketing tilfælde af priapisme, defineret som smertefuld og ikke-smertefuld penis erektion, der varer mere end 4 timer, er blevet rapporteret for pædiatriske og voksne patienter behandlet med STRATTERA. Forældre eller værger til pædiatriske patienter, der tager STRATTERA 25 mg, og voksne patienter, der tager STRATTERA, bør instrueres i, at priapisme kræver øjeblikkelig lægehjælp.
Øjenirriterende
STRATTERA er øjenirriterende. STRATTERA kapsler er ikke beregnet til at blive åbnet. I tilfælde af at kapselindholdet kommer i kontakt med øjet, skal det berørte øje straks skylles med vand, og lægehjælp indhentes. Hænder og eventuelle potentielt forurenede overflader skal vaskes så hurtigt som muligt.
Lægemiddel-lægemiddelinteraktion
Patienter bør instrueres i at konsultere en læge, hvis de tager eller planlægger at tage receptpligtig eller håndkøbsmedicin, kosttilskud eller naturlægemidler.
Graviditet
Patienter skal instrueres i at konsultere en læge, hvis de ammer, er gravide eller tænker på at blive gravide, mens de tager STRATTERA.
Mad
Patienter kan tage STRATTERA 25 mg med eller uden mad.
Glemt dosis
Hvis patienter glemmer en dosis, skal de instrueres i at tage den så hurtigt som muligt, men de bør ikke tage mere end den ordinerede samlede daglige mængde af STRATTERA i en 24-timers periode.
Interferens med psykomotorisk ydeevne
Patienter skal instrueres i at være forsigtige, når de kører bil eller betjener farlige maskiner, indtil de er rimeligt sikre på, at deres præstationer ikke påvirkes af atomoxetin.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Atomoxetin HCl var ikke kræftfremkaldende hos rotter og mus, når det blev givet i kosten i 2 år i tidsvægtede gennemsnitsdoser op til henholdsvis 47 og 458 mg/kg/dag. Den højeste dosis, der anvendes til rotter, er ca. 8 og 5 gange den maksimale humane dosis til henholdsvis børn og voksne på mg/m2-basis. Plasmaniveauer (AUC) af atomoxetin ved denne dosis hos rotter estimeres til at være 1,8 gange (udstrakte metabolisatorer) eller 0,2 gange (dårlige metabolisatorer) dem hos mennesker, der får den maksimale humane dosis. Den højeste dosis, der anvendes til mus, er ca. 39 og 26 gange den maksimale humane dosis til henholdsvis børn og voksne på mg/m2-basis.
Mutagenese
Atomoxetin HCl var negativ i en række genotoksicitetsundersøgelser, der omfattede en omvendt punktmutationsanalyse (Ames-test), en in vitro muselymfomanalyse, en kromosomafvigelsestest i ovarieceller fra kinesisk hamster, en ikke-planlagt DNA-syntesetest i rottehepatocytter og en in vivo mikronukleustest i mus. Der var dog en lille stigning i procentdelen af kinesisk hamster-ovarieceller med diplokromosomer, hvilket tyder på endoreduplicering (numerisk aberration).
Metabolitten N-desmethylatomoxetin HCl var negativ i Ames-testen, muselymfomanalysen og ikke-planlagt DNA-syntesetest.
Forringelse af fertilitet
Atomoxetin HCl svækkede ikke fertiliteten hos rotter, når det blev givet i kosten i doser på op til 57 mg/kg/dag, hvilket er ca. 6 gange den maksimale humane dosis på mg/m2-basis.
Brug i specifikke populationer
Graviditet
Graviditetskategori C
Drægtige kaniner blev behandlet med op til 100 mg/kg/dag atomoxetin ved sondemad gennem hele organogeneseperioden. Ved denne dosis blev der i 1 ud af 3 undersøgelser observeret et fald i levende fostre og en stigning i tidlige resorptioner. Der blev observeret en lille stigning i forekomsten af atypisk oprindelse af carotisarterie og fraværende subclaviaarterie. Disse fund blev observeret ved doser, der forårsagede let maternel toksicitet. Ingen effektdosis for disse fund var 30 mg/kg/dag. 100 mg/kg dosis er ca. 23 gange den maksimale humane dosis på mg/m2 basis; plasmaniveauer (AUC) af atomoxetin ved denne dosis hos kaniner anslås til at være 3,3 gange (omfattende metabolisatorer) eller 0,4 gange (dårlige metabolisatorer) dem hos mennesker, der får den maksimale humane dosis.
Rotter blev behandlet med op til ca. 50 mg/kg/dag atomoxetin (ca. 6 gange den maksimale humane dosis på mg/m2-basis) i kosten fra 2 uger (hunner) eller 10 uger (hanner) før parring gennem perioder med organogenese og laktation. I 1 ud af 2 undersøgelser blev der observeret fald i hvalpevægt og hvalpeoverlevelse. Den nedsatte hvalpeoverlevelse blev også set ved 25 mg/kg (men ikke ved 13 mg/kg). I en undersøgelse, hvor rotter blev behandlet med atomoxetin i kosten fra 2 uger (hunner) eller 10 uger (hanner) før parring i hele organogeneseperioden, et fald i fostervægt (kun hundyr) og en stigning i forekomsten af ufuldstændig ossifikation af hvirvelbuen hos fostre blev observeret ved 40 mg/kg/dag (ca. 5 gange den maksimale humane dosis på mg/m2-basis), men ikke ved 20 mg/kg/dag.
Der blev ikke set nogen uønskede føtale virkninger, når drægtige rotter blev behandlet med op til 150 mg/kg/dag (ca. 17 gange den maksimale humane dosis på mg/m2-basis) ved sondemad gennem hele organogeneseperioden. Der er ikke udført tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. STRATTERA 18mg bør ikke anvendes under graviditet, medmindre den potentielle fordel opvejer den potentielle risiko for fosteret.
Arbejde og levering
Fødsel hos rotter blev ikke påvirket af atomoxetin. Effekten af STRATTERA på fødsel og fødsel hos mennesker er ukendt.
Ammende mødre
Atomoxetin og/eller dets metabolitter blev udskilt i mælken hos rotter. Det vides ikke, om atomoxetin udskilles i human mælk. Der skal udvises forsigtighed, hvis STRATTERA administreres til en ammende kvinde.
Pædiatrisk brug
Enhver, der overvejer at bruge STRATTERA til et barn eller en teenager, skal balancere de potentielle risici med det kliniske behov [se KASSE ADVARSEL og ADVARSLER OG FORHOLDSREGLER ]. Atomoxetins farmakokinetik hos børn og unge svarer til dem hos voksne. Sikkerhed, virkning og farmakokinetik af STRATTERA hos pædiatriske patienter under 6 år er ikke blevet evalueret.
En undersøgelse blev udført i unge rotter for at evaluere virkningerne af atomoxetin på vækst og neuroadfærdsmæssig og seksuel udvikling. Rotter blev behandlet med 1, 10 eller 50 mg/kg/dag (henholdsvis ca. 0,2, 2 og 8 gange den maksimale humane dosis på mg/m2-basis) atomoxetin givet ved sondemad fra den tidlige postnatale periode (dag) 10 år) gennem voksenalderen. Små forsinkelser i starten af vaginal åbenhed (alle doser) og præputial adskillelse (10 og 50 mg/kg), let fald i epididymalvægt og sædtal (10 og 50 mg/kg) og et let fald i corpora lutea (50 mg) /kg) blev set, men der var ingen effekter på fertilitet eller reproduktionsevne. En lille forsinkelse i starten af fortandsudbrud blev set ved 50 mg/kg. En let stigning i motorisk aktivitet blev set på dag 15 (mænd ved 10 og 50 mg/kg og kvinder ved 50 mg/kg) og på dag 30 (hun ved 50 mg/kg), men ikke på dag 60. Der var ingen effekter på indlærings- og hukommelsestests. Betydningen af disse fund for mennesker er ukendt.
Geriatrisk brug
Sikkerheden, virkningen og farmakokinetikken af STRATTERA 10 mg hos geriatriske patienter er ikke blevet evalueret.
Leverinsufficiens
Atomoxetineksponering (AUC) er øget sammenlignet med normale forsøgspersoner hos EM-personer med moderat (Child-Pugh Klasse B) (2 gange stigning) og svær (Child-Pugh Klasse C) (4 gange øgning) leverinsufficiens. Dosisjustering anbefales til patienter med moderat eller svær leverinsufficiens [se DOSERING OG ADMINISTRATION ].
Nyreinsufficiens
EM-personer med nyresygdom i slutstadiet havde højere systemisk eksponering for atomoxetin end raske forsøgspersoner (ca. 65 % stigning), men der var ingen forskel, når eksponeringen blev korrigeret for mg/kg dosis. STRATTERA 25 mg kan derfor administreres til ADHD-patienter med nyresygdom i slutstadiet eller mindre grader af nyreinsufficiens ved brug af det normale doseringsregime.
Køn
Køn påvirkede ikke atomoxetin-disponeringen.
Etnisk oprindelse
Etnisk oprindelse påvirkede ikke atomoxetin-disponeringen (bortset fra at PM'er er mere almindelige hos kaukasiere).
Patienter med samtidig sygdom
Tics hos patienter med ADHD og Comorbid Tourettes lidelse
Atomoxetin administreret i et fleksibelt dosisområde på 0,5 til 1,5 mg/kg/dag (gennemsnitlig dosis på 1,3 mg/kg/dag) og placebo blev sammenlignet i 148 randomiserede pædiatriske (alder 717 år) forsøgspersoner med en DSM-IV diagnose ADHD og komorbid tic-lidelse i en 18 ugers, dobbeltblind, placebokontrolleret undersøgelse, hvor størstedelen (80 %) deltog i dette forsøg med Tourettes sygdom (Tourettes sygdom: 116 forsøgspersoner; kronisk motorisk tic-lidelse: 29 forsøgspersoner). En non-inferioritetsanalyse afslørede, at STRATTERA 10 mg ikke forværrede tics hos disse patienter som bestemt af Yale Global Tic Severity Scale Total Score (YGTSS). Ud af 148 patienter, der gik ind i den akutte behandlingsfase, afbrød 103 (69,6%) patienter undersøgelsen. Den primære årsag til seponering i både behandlingsgruppen atomoxetin (38 ud af 76 patienter, 50,0 %) og placebo (45 ud af 72 patienter, 62,5 %) blev identificeret som manglende effekt, hvor de fleste af patienterne stoppede i uge 12. Dette var første besøg, hvor patienter med en CGI-S≥4 også kunne opfylde kriterierne for "klinisk non-responder" (CGI-S forblev det samme eller steg fra undersøgelsens baseline) og være berettiget til at deltage i et åbent forlængelsesstudie med atomoxetin. Der har været rapporter om tics efter markedsføring [se BIVIRKNINGER ].
Angst hos patienter med ADHD og komorbide angstlidelser
I to post-marketing, dobbeltblindede, placebokontrollerede undersøgelser er det blevet påvist, at behandling af patienter med ADHD og komorbide angstlidelser med STRATTERA 10mg ikke forværrer deres angst.
I et 12-ugers dobbeltblindt, placebokontrolleret forsøg blev 176 patienter i alderen 8-17, som opfyldte DSM-IV-kriterierne for ADHD og mindst én af angstlidelserne i forbindelse med separationsangst, generaliseret angst eller social fobi. randomiseret. Efter en 2-ugers dobbeltblind placebo-indføring blev STRATTERA 25 mg påbegyndt med 0,8 mg/kg/dag med stigning til en måldosis på 1,2 mg/kg/dag (median dosis 1,30 mg/kg/dag +/- 0,29 mg/kg/dag). STRATTERA forværrede ikke angst hos disse patienter som bestemt af Pediatric Anxiety Rating Scale (PARS). Af de 158 patienter, der gennemførte den dobbeltblindede placebo-indledning, afbrød 26 (16 %) patienter undersøgelsen.
et separat 16-ugers, dobbeltblindt, placebokontrolleret forsøg blev 442 patienter i alderen 18-65, som opfyldte DSM-IV-kriterierne for voksen ADHD og social angst (hvoraf 23 % også havde generaliseret angstlidelse) randomiseret. Efter en 2-ugers dobbeltblind placebo-indføring blev STRATTERA 10 mg påbegyndt med 40 mg/dag til en maksimal dosis på 100 mg/dag (gennemsnitlig daglig dosis 83 mg/dag +/- 19,5 mg/dag). STRATTERA 18 mg forværrede ikke angsten hos disse patienter som bestemt af Liebowitz Social Anxiety Scale (LSAS). Ud af de 413 patienter, der gennemførte den dobbeltblindede placebo-indledning, afbrød 149 (36,1%) patienter undersøgelsen. Der har efter markedsføring været rapporter om angst [se BIVIRKNINGER ] .
OVERDOSIS
Menneskelig oplevelse
Der er begrænset erfaring med kliniske forsøg med STRATTERA overdosering. Under postmarketing er der rapporteret dødsfald, der involverer en blandet overdosis af STRATTERA 10 mg og mindst ét andet lægemiddel. Der har ikke været rapporter om dødsfald, der involverer overdosering af STRATTERA alene, inklusive bevidste overdoser i mængder op til 1400 mg. I nogle tilfælde af overdosering med STRATTERA er der rapporteret krampeanfald. De mest almindeligt rapporterede symptomer, der fulgte med akutte og kroniske overdoser af STRATTERA, var gastrointestinale symptomer, døsighed, svimmelhed, tremor og unormal adfærd. Hyperaktivitet og agitation er også blevet rapporteret. Tegn og symptomer i overensstemmelse med mild til moderat aktivering af det sympatiske nervesystem (f.eks. takykardi, forhøjet blodtryk, mydriasis, mundtørhed) er også blevet observeret. De fleste hændelser var milde til moderate. Mindre almindeligt har der været rapporter om QT-forlængelse og mentale ændringer, herunder desorientering og hallucinationer [se KLINISK FARMAKOLOGI ].
Håndtering af overdosis
Rådfør dig med et certificeret giftkontrolcenter for at få opdateret vejledning og rådgivning. Da atomoxetin er stærkt proteinbundet, vil dialyse sandsynligvis ikke være nyttig i behandlingen af overdosering.
KONTRAINDIKATIONER
Overfølsomhed
STRATTERA er kontraindiceret til patienter, der vides at være overfølsomme over for atomoxetin eller andre bestanddele af produktet [se ADVARSLER OG FORHOLDSREGLER ].
Monoaminoxidasehæmmere (MAOI)
STRATTERA bør ikke tages med en MAO-hæmmer eller inden for 2 uger efter seponering af en MAO-hæmmer. Behandling med en MAO-hæmmer bør ikke påbegyndes inden for 2 uger efter seponering af STRATTERA. Med andre lægemidler, der påvirker hjernens monoaminkoncentrationer, har der været rapporter om alvorlige, nogle gange fatale reaktioner (inklusive hypertermi, stivhed, myoklonus, autonom ustabilitet med mulige hurtige udsving i vitale tegn og mentale statusændringer, der omfatter ekstrem agitation, der udvikler sig til delirium og koma) når det tages i kombination med en MAO-hæmmer. Nogle tilfælde præsenteres med træk, der ligner malignt neuroleptisk syndrom. Sådanne reaktioner kan forekomme, når disse lægemidler gives samtidigt eller i umiddelbar nærhed [se DRUGSINTERAKTIONER ].
Smalvinklet glaukom
I kliniske forsøg var brug af STRATTERA forbundet med en øget risiko for mydriasis, og derfor anbefales det ikke til patienter med snævervinklet glaukom.
Fæokromocytom
Alvorlige reaktioner, herunder forhøjet blodtryk og takyarytmi, er blevet rapporteret hos patienter med fæokromocytom eller tidligere fæokromocytom, som fik STRATTERA. Derfor bør STRATTERA 18 mg ikke tages af patienter med fæokromocytom eller tidligere fæokromocytom.
Alvorlige kardiovaskulære lidelser
STRATTERA 40 mg bør ikke anvendes til patienter med alvorlige hjerte- eller karsygdomme, hvis tilstand forventes at blive forværret, hvis de oplever stigninger i blodtryk eller hjertefrekvens, der kan være klinisk vigtige (f.eks. 15 til 20 mm Hg i blodtryk eller 20 slag i minuttet i puls). [Se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Den præcise mekanisme, hvormed atomoxetin frembringer dets terapeutiske virkninger ved Attention-Deficit/Hyperactivity Disorder (ADHD) er ukendt, men menes at være relateret til selektiv hæmning af den præsynaptiske noradrenalintransportør, som bestemt i ex vivo-optagelses- og neurotransmitterudtømningsundersøgelser .
Farmakodynamik
En eksponerings-responsanalyse omfattende doser af atomoxetin (0,5, 1,2 eller 1,8 mg/kg/dag) eller placebo påviste atomoxetin eksponering korrelerer med effektivitet målt ved Attention-Deficit/Hyperactivity Disorder Rating Scale-IV-Parent Version: Investigator administreret og scorede. Forholdet mellem eksponering og effektivitet svarede til det, der blev observeret mellem dosis og effektivitet med median eksponeringer ved de to højeste doser, hvilket resulterede i næsten maksimale ændringer fra baseline [se Kliniske Studier ].
Hjerteelektrofysiologi
Effekten af STRATTERA på QTc-forlængelse blev evalueret i et randomiseret, dobbeltblindet, positivt (moxifloxacin 400 mg) og placebokontrolleret, cross-over-studie med raske mandlige CYP2D6-fattige metabolisatorer. I alt 120 raske forsøgspersoner fik STRATTERA (20 mg og 60 mg) to gange dagligt i 7 dage. Der blev ikke observeret store ændringer i QTc-interval (dvs. stigninger >60 msek fra baseline, absolut QTc >480 msek.) i undersøgelsen. Små ændringer i QTc-intervallet kan dog ikke udelukkes fra den aktuelle undersøgelse, fordi undersøgelsen ikke kunne påvise assayfølsomhed. Der var en let stigning i QTc-intervallet med øget atomoxetinkoncentration.
Farmakokinetik
Atomoxetin absorberes godt efter oral administration og påvirkes minimalt af mad. Det elimineres primært ved oxidativ metabolisme gennem den enzymatiske vej cytochrom P450 2D6 (CYP2D6) og efterfølgende glukuronidering. Atomoxetin har en halveringstid på omkring 5 timer. En brøkdel af befolkningen (ca. 7% af kaukasiere og 2% af afroamerikanere) er dårlige metabolisatorer (PM'er) af CYP2D6-metaboliserede lægemidler. Disse individer har reduceret aktivitet på denne vej, hvilket resulterer i 10 gange højere AUC'er, 5 gange højere maksimale plasmakoncentrationer og langsommere elimination (plasmahalveringstid på ca. 24 timer) af atomoxetin sammenlignet med personer med normal aktivitet [ekstensive metabolisatorer (EM'er) )]. Lægemidler, der hæmmer CYP2D6, såsom fluoxetin, paroxetin og quinidin, forårsager lignende stigninger i eksponeringen.
Atomoxetins farmakokinetik er blevet evalueret hos mere end 400 børn og unge i udvalgte kliniske forsøg, primært ved hjælp af populationsfarmakokinetiske undersøgelser. Enkeltdosis og steady-state individuelle farmakokinetiske data blev også opnået hos børn, unge og voksne. Når doser blev normaliseret til mg/kg-basis, blev der observeret lignende halveringstid, Cmax og AUC-værdier hos børn, unge og voksne. Clearance og distributionsvolumen efter justering for kropsvægt var også ens.
Absorption og distribution
Atomoxetin absorberes hurtigt efter oral administration med en absolut biotilgængelighed på ca. 63 % ved EM'er og 94% ved PM'er. Maksimale plasmakoncentrationer (Cmax) nås ca. 1 til 2 timer efter dosering.
STRATTERA 18 mg kan indgives med eller uden mad. Administration af STRATTERA sammen med et standardmåltid med højt fedtindhold til voksne påvirkede ikke omfanget af oral absorption af atomoxetin (AUC), men reducerede absorptionshastigheden, hvilket resulterede i en 37 % lavere Cmax og forsinket Tmax med 3 timer. I kliniske forsøg med børn og unge resulterede administration af STRATTERA sammen med mad i en 9 % lavere Cmax.
Steady-state distributionsvolumen efter intravenøs administration er 0,85 l/kg, hvilket indikerer, at atomoxetin primært fordeler sig i hele kropsvandet. Fordelingsvolumen er ens på tværs af patientvægtområdet efter normalisering for kropsvægt.
Ved terapeutiske koncentrationer er 98 % af atomoxetin i plasma bundet til protein, primært albumin.
Metabolisme og eliminering
Atomoxetin metaboliseres primært gennem den enzymatiske CYP2D6-vej. Mennesker med nedsat aktivitet i denne vej (PM'er) har højere plasmakoncentrationer af atomoxetin sammenlignet med mennesker med normal aktivitet (EM'er). For PM'er er AUC for atomoxetin ca. 10 gange, og Css, max er ca. 5 gange større end EM'er. Laboratorietest er tilgængelige for at identificere CYP2D6 PM'er. Samtidig administration af STRATTERA med potente hæmmere af CYP2D6, såsom fluoxetin, paroxetin eller quinidin, resulterer i en væsentlig stigning i atomoxetin plasmaeksponering, og dosisjustering kan være nødvendig [se ADVARSLER OG FORHOLDSREGLER ]. Atomoxetin hæmmede eller inducerede ikke CYP2D6-vejen.
Den primære oxidative metabolit, der dannes, uanset CYP2D6-status, er 4-hydroxyatomoxetin, som er glucuronideret. 4-Hydroxyatomoxetin er ækvipotent med atomoxetin som en hæmmer af noradrenalintransportøren, men cirkulerer i plasma ved meget lavere koncentrationer (1 % af atomoxetinkoncentrationen i EM'er og 0,1% af atomoxetinkoncentrationen i PM'er). 4-Hydroxyatomoxetin dannes primært af CYP2D6, men i PM'er dannes 4-hydroxyatomoxetin med en langsommere hastighed af flere andre cytochrom P450-enzymer. N-Desmethylatomoxetin dannes af CYP2C19 og andre cytochrom P450-enzymer, men har væsentligt mindre farmakologisk aktivitet sammenlignet med atomoxetin og cirkulerer i plasma ved lavere koncentrationer (5% af atomoxetinkoncentrationen i EM'er og 45% af atomoxetinkoncentrationen i PM'er).
Gennemsnitlig tilsyneladende plasmaclearance af atomoxetin efter oral administration til voksne EM'er er 0,35 l/time/kg, og den gennemsnitlige halveringstid er 5,2 timer. Efter oral administration af atomoxetin til PM'er er den gennemsnitlige tilsyneladende plasmaclearance 0,03 l/time/kg, og den gennemsnitlige halveringstid er 21,6 timer. For PM'er er AUC for atomoxetin ca. 10 gange, og Css, max er ca. 5 gange større end EM'er. Eliminationshalveringstiden for 4-hydroxyatomoxetin svarer til den for N-desmethylatomoxetin (6 til 8 timer) hos EM-personer, mens halveringstiden for N-desmethylatomoxetin er meget længere hos PM-personer (34 til 40 timer).
Atomoxetin udskilles primært som 4-hydroxyatomoxetin-O-glucuronid, hovedsageligt i urinen (større end 80 % af dosis) og i mindre grad i fæces (mindre end 17 % af dosis). Kun en lille del af STRATTERA 40 mg dosis udskilles som uændret atomoxetin (mindre end 3 % af dosis), hvilket indikerer omfattende biotransformation.
[Se Brug i specifikke populationer ].
Kliniske Studier
ADHD-undersøgelser hos børn og unge
Akutte undersøgelser
Effektiviteten af STRATTERA 40 mg til behandling af ADHD blev fastslået i 4 randomiserede, dobbeltblindede, placebokontrollerede undersøgelser af pædiatriske patienter (i alderen 6 til 18). Cirka en tredjedel af patienterne opfyldte DSM-IV-kriterierne for uopmærksom subtype og to tredjedele opfyldte kriterierne for både uopmærksomme og hyperaktive/impulsive subtyper.
Tegn og symptomer på ADHD blev evalueret ved en sammenligning af den gennemsnitlige ændring fra baseline til endpoint for STRATTERA- og placebo-behandlede patienter ved hjælp af en intention-to-treat-analyse af det primære resultatmål, investigator administrerede og scorede ADHD Rating Scale-IV- Parent Version (ADHDRS) totalscore inklusive hyperaktive/impulsive og uopmærksomme underskalaer. Hvert element på ADHDRS'en knytter sig direkte til ét symptomkriterium for ADHD i DSM-IV.
undersøgelse 1, et 8-ugers randomiseret, dobbeltblindt, placebokontrolleret, dosis-respons, akut behandlingsstudie af børn og unge i alderen 8 til 18 (N=297), fik patienterne enten en fast dosis STRATTERA (0,5, 1,2 eller 1,8 mg/kg/dag) eller placebo. STRATTERA 10 mg blev administreret som en delt dosis tidligt om morgenen og sent på eftermiddagen/tidlig aften. Ved de 2 højere doser var forbedringer i ADHD-symptomer statistisk signifikant overlegne hos STRATTERA-behandlede patienter sammenlignet med placebo-behandlede patienter målt på ADHDRS-skalaen. STRATTERA 25 mg dosis på 1,8 mg/kg/dag gav ikke nogen yderligere fordel i forhold til den, der blev observeret med 1,2 mg/kg/dag dosis. 0,5 mg/kg/dag STRATTERA-dosis var ikke bedre end placebo.
undersøgelse 2, en 6-ugers randomiseret, dobbeltblind, placebokontrolleret, akut behandlingsundersøgelse af børn og unge i alderen 6 til 16 (N=171), fik patienterne enten STRATTERA 40 mg eller placebo. STRATTERA blev administreret som en enkelt dosis tidligt om morgenen og titreret på vægtjusteret basis i henhold til klinisk respons op til en maksimal dosis på 1,5 mg/kg/dag. Den gennemsnitlige endelige dosis af STRATTERA 10 mg var ca. 1,3 mg/kg/dag. ADHD-symptomer var statistisk signifikant forbedret på STRATTERA sammenlignet med placebo, målt på ADHDRS-skalaen. Denne undersøgelse viser, at STRATTERA er effektivt, når det administreres én gang dagligt om morgenen.
2 identiske, 9-ugers, akutte, randomiserede, dobbeltblindede, placebokontrollerede undersøgelser af børn i alderen 7 til 13 år (undersøgelse 3, N=147; undersøgelse 4, N=144), blev STRATTERA 40 mg og methylphenidat sammenlignet med placebo . STRATTERA 18 mg blev administreret som en delt dosis tidligt om morgenen og sent på eftermiddagen (efter skole) og titreret på vægtjusteret basis i henhold til klinisk respons. Den maksimalt anbefalede STRATTERA-dosis var 2,0 mg/kg/dag. Den gennemsnitlige endelige dosis af STRATTERA 18 mg for begge undersøgelser var ca. 1,6 mg/kg/dag. I begge undersøgelser forbedredes ADHD-symptomer statistisk signifikant mere på STRATTERA 10mg end på placebo, målt på ADHDRS-skalaen.
Undersøgelse af befolkningsundergrupper baseret på køn og alder (
Vedligeholdelsesundersøgelse
Effektiviteten af STRATTERA 18 mg til vedligeholdelsesbehandling af ADHD blev fastslået i en ambulant undersøgelse af børn og unge (i alderen 6-15 år). Patienter, der opfylder DSM-IV-kriterierne for ADHD, og som udviste kontinuerlig respons i ca. 4 uger under en indledende 10 ugers åben behandlingsfase med STRATTERA (1,2 til 1,8 mg/kg/dag), blev randomiseret til at fortsætte deres nuværende dosis af STRATTERA (N =292) eller placebo (N=124) under dobbeltblind behandling for observation af tilbagefald. Respons under den åbne fase blev defineret som CGI-ADHD-S score ≤2 og en reduktion på mindst 25 % fra baseline i ADHDRS-IV-Parent:Inv total score. Patienter, som blev tildelt STRATTERA og viste kontinuerlig respons i ca. 8 måneder under den første dobbeltblindede behandlingsfase, blev igen randomiseret til fortsættelse af deres nuværende dosis af STRATTERA (N=81) eller til placebo (N=82) under dobbeltblinde behandling for observation af tilbagefald. Tilbagefald under den dobbeltblinde fase blev defineret som en CGI-ADHD-S-scorestigning på mindst 2 fra slutningen af den åbne fase, og ADHDRS-IV-Forældre:Inv totalscore vender tilbage til ≥90 % af studiestartsscore for 2 på hinanden følgende besøg. I begge dobbeltblinde faser oplevede patienter, der fik fortsat STRATTERA-behandling, signifikant længere tid til tilbagefald end dem, der fik placebo.
ADHD-undersøgelser hos voksne
Effektiviteten af STRATTERA til behandling af ADHD blev fastslået i 2 randomiserede, dobbeltblindede, placebokontrollerede kliniske undersøgelser af voksne patienter på 18 år og ældre, som opfyldte DSM-IV-kriterierne for ADHD.
Tegn og symptomer på ADHD blev evalueret ved hjælp af den investigator-administrerede Conners Adult ADHD Rating Scale Screening Version (CAARS), en 30-element skala. Det primære effektivitetsmål var 18-punkts Total ADHD Symptom-score (summen af uopmærksomheds- og hyperaktivitet/impulsivitets-subskalaerne fra CAARS) evalueret ved en sammenligning af den gennemsnitlige ændring fra baseline til endepunkt ved hjælp af en intention-to-treat-analyse.
2 identiske, 10 ugers, randomiserede, dobbeltblindede, placebokontrollerede akutte behandlingsstudier (undersøgelse 5, N=280; undersøgelse 6, N=256), fik patienterne enten STRATTERA 25 mg eller placebo. STRATTERA blev administreret som en delt dosis tidligt om morgenen og sent på eftermiddagen/tidlig aften og titreret i henhold til klinisk respons i et interval på 60 til 120 mg/dag. Den gennemsnitlige endelige dosis af STRATTERA 40 mg for begge undersøgelser var ca. 95 mg/dag. I begge undersøgelser var ADHD-symptomer statistisk signifikant forbedret på STRATTERA, målt på ADHD Symptom-score fra CAARS-skalaen.
Undersøgelse af populationsundergrupper baseret på køn og alder (
PATIENTOPLYSNINGER
STRATTERA® (Stra-TAIR-a) (atomoxetin) Kapsler
Læs medicinvejledningen, der følger med STRATTERA®, før du eller dit barn begynder at tage det, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Denne medicinvejledning træder ikke i stedet for at tale med din læge om din behandling eller dit barns behandling med STRATTERA.
Hvad er den vigtigste information, jeg bør vide om STRATTERA 18mg?
Følgende er blevet rapporteret ved brug af STRATTERA:
Børn og teenagere tænker nogle gange på selvmord, og mange rapporterer, at de forsøger at begå selvmord. Resultater fra STRATTERA kliniske undersøgelser med over 2200 børn eller teenage ADHD-patienter tyder på, at nogle børn og teenagere kan have en større chance for at få selvmordstanker eller -handlinger. Selvom der ikke forekom selvmord i disse undersøgelser, udviklede 4 ud af hver 1000 patienter selvmordstanker. Fortæl dit barn eller teenagers læge, hvis dit barn eller teenager (eller der er en familiehistorie om):
- har bipolar sygdom (maniodepressiv sygdom)
- havde selvmordstanker eller -handlinger, før du startede STRATTERA
Chancen for selvmordstanker og -handlinger kan være højere:
- tidligt under behandlingen med STRATTERA 10 mg
- under dosisjusteringer
Forebyg selvmordstanker og handling hos dit barn eller teenager ved at:
- være meget opmærksom på dit barns eller teenagers humør, adfærd, tanker og følelser under STRATTERA 25mg behandling
- holde alle opfølgende besøg hos dit barn eller teenagers læge som planlagt
Hold øje med følgende tegn hos dit barn eller teenager under STRATTERA 25 mg-behandling:
- angst
- agitation
- Angstanfald
- problemer med at sove
- irritabilitet
- fjendtlighed
- aggressivitet
- impulsivitet
- rastløshed
- mani
- depression
- selvmordstanker
Ring til dit barns eller teenagers læge med det samme, hvis de har nogen af ovenstående tegn, især hvis de er nye, pludselige eller alvorlige. Dit barn eller teenager skal muligvis overvåges nøje for selvmordstanker og -handlinger eller har brug for en ændring i medicin.
STRATTERA kan forårsage leverskade hos nogle patienter. Ring til din læge med det samme, hvis du eller dit barn har følgende tegn på leverproblemer:
- kløe
- højre øvre mavesmerter
- mørk urin
- gul hud eller øjne
- uforklarlige influenzalignende symptomer
- pludselig død hos patienter, der har hjerteproblemer eller hjertefejl
- slagtilfælde og hjerteanfald hos voksne
- øget blodtryk og puls
Fortæl din læge, hvis du eller dit barn har hjerteproblemer, hjertefejl, forhøjet blodtryk eller en familiehistorie med disse problemer. Din læge bør undersøge dig eller dit barn omhyggeligt for hjerteproblemer, før du starter med STRATTERA.
Din læge bør kontrollere dit blodtryk eller dit barns blodtryk og hjertefrekvens regelmæssigt under behandlingen med STRATTERA.
Ring til din læge med det samme, hvis du eller dit barn har tegn på hjerteproblemer såsom brystsmerter, åndenød eller besvimelse, mens du tager STRATTERA.
- nye psykotiske symptomer (såsom at høre stemmer, tro på ting, der ikke er sande, at være mistænksom) eller nye maniske symptomer
Ring til dit barns eller teenagers læge med det samme om eventuelle nye psykiske symptomer fordi det kan være nødvendigt at overveje at justere eller stoppe behandlingen med STRATTERA 40 mg.
Hvad er STRATTERA 18mg?
STRATTERA er en selektiv noradrenalin-genoptagelseshæmmer. Det bruges til behandling af opmærksomhedsunderskud og hyperaktivitetsforstyrrelser (ADHD). STRATTERA kan hjælpe med at øge opmærksomheden og mindske impulsivitet og hyperaktivitet hos patienter med ADHD.
STRATTERA 10 mg bør anvendes som en del af et samlet behandlingsprogram for ADHD, der kan omfatte rådgivning eller andre behandlinger.
STRATTERA er ikke blevet undersøgt hos børn under 6 år.
Hvem bør ikke tage STRATTERA?
STRATTERA bør ikke tages, hvis du eller dit barn:
- tager eller inden for de seneste 14 dage har taget et antidepressionslægemiddel kaldet en monoaminoxidasehæmmer eller MAO-hæmmer. Nogle navne på MAO-hæmmere er Nardil® (phenelzinsulfat), Parnate® (tranylcyprominsulfat) og Emsam® (selegilin transdermalt system).
- har et øjenproblem kaldet snævervinklet glaukom
- er allergiske over for noget i STRATTERA. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser.
- har eller har haft en sjælden tumor kaldet fæokromocytom.
STRATTERA er muligvis ikke det rigtige for dig eller dit barn. Inden du starter STRATTERA, skal du fortælle din læge eller dit barns læge om alle helbredstilstande (eller en familiehistorie af), herunder:
- har eller haft selvmordstanker eller -handlinger
- hjerteproblemer, hjertefejl, uregelmæssig hjerterytme, forhøjet blodtryk eller lavt blodtryk
- psykiske problemer, psykose, mani, bipolar sygdom eller depression
- leverproblemer Fortæl din læge, hvis du eller dit barn er gravid, planlægger at blive gravid eller ammer.
Kan STRATTERA tages sammen med anden medicin?
Fortæl din læge om al den medicin, du eller dit barn tager, inklusive receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. STRATTERA og nogle lægemidler kan interagere med hinanden og forårsage alvorlige bivirkninger. Din læge vil afgøre, om STRATTERA kan tages sammen med anden medicin.
Fortæl det især til din læge, hvis du eller dit barn tager:
- astmamedicin
- medicin mod depression, herunder MAO-hæmmere
- blodtryksmedicin
- medicin mod forkølelse eller allergi, der indeholder dekongestanter
Kend den medicin, du eller dit barn tager. Hav en liste over dine lægemidler med dig for at vise din læge og apotek.
Du må ikke starte med ny medicin, mens du tager STRATTERA, uden først at tale med din læge.
Hvordan skal STRATTERA tages?
- Tag STRATTERA 40 mg nøjagtigt som foreskrevet. STRATTERA 18mg kommer i kapsler med forskellig dosisstyrke. Din læge kan justere dosis, indtil den passer til dig eller dit barn.
- Du må ikke tygge, knuse eller åbne kapslerne. Synk STRATTERA kapsler hele med vand eller andre væsker. Fortæl det til din læge, hvis du eller dit barn ikke kan sluge STRATTERA 10 mg hel. Det kan være nødvendigt at ordinere en anden medicin.
- Undgå at røre ved en ødelagt STRATTERA 18 mg kapsel. Vask hænder og overflader, der rørte ved en åben STRATTERA 10 mg kapsel. Hvis noget af pulveret kommer i dine øjne eller dit barns øjne, skal du straks skylle dem med vand og kontakte din læge.
- STRATTERA kan tages med eller uden mad.
- STRATTERA 10 mg tages normalt en eller to gange dagligt. Tag STRATTERA 25 mg på samme tidspunkt hver dag for at hjælpe dig med at huske. Hvis du glemmer en dosis STRATTERA, skal du tage den, så snart du husker den dag. Hvis du går glip af en dag med STRATTERA 10 mg, må du ikke fordoble din dosis næste dag. Spring blot over den dag, du gik glip af.
- Fra tid til anden kan din læge stoppe behandlingen med STRATTERA 25 mg i et stykke tid for at kontrollere ADHD-symptomer.
- Din læge kan foretage regelmæssige kontroller af blod, hjerte og blodtryk, mens du tager STRATTERA. Børn bør have deres højde og vægt kontrolleret ofte, mens de tager STRATTERA. STRATTERA-behandlingen kan stoppes, hvis der opdages et problem under disse kontroller.
- Hvis du eller dit barn tager for meget STRATTERA eller overdoser, skal du straks kontakte din læge eller giftcentral eller få akut behandling.
Hvad er mulige bivirkninger af STRATTERA?
Se "Hvad er den vigtigste information, jeg bør vide om STRATTERA 10mg?" for information om rapporterede selvmordstanker og -handlinger, andre psykiske problemer, alvorlige leverskader og hjerteproblemer.
Andre alvorlige bivirkninger omfatter:
- alvorlige allergiske reaktioner (ring til din læge, hvis du har vejrtrækningsbesvær, ser hævelse eller nældefeber eller oplever andre allergiske reaktioner)
- langsommere vækst (højde og vægt) hos børn
- vandladningsproblemer inklusiv
- problemer med at starte eller holde en urinstrøm
- kan ikke tømme blæren helt
Almindelige bivirkninger hos børn og teenagere omfatter:
- dårlig mave
- nedsat appetit
- kvalme eller opkastning
- svimmelhed
- træthed
- humørsvingninger
Almindelige bivirkninger hos voksne omfatter:
- forstoppelse
- tør mund
- kvalme
- nedsat appetit
- svimmelhed
- seksuelle bivirkninger
- problemer med at tisse
Andre oplysninger til børn, teenagere og voksne:
- Erektioner, der ikke vil forsvinde (priapisme), er sjældent forekommet under behandling med STRATTERA. Hvis du har en erektion, der varer mere end 4 timer, skal du straks søge lægehjælp. På grund af muligheden for varig skade, herunder den potentielle manglende evne til at få erektion, bør priapisme straks vurderes af en læge.
- STRATTERA 10 mg kan påvirke din evne eller dit barns evne til at køre bil eller betjene tunge maskiner. Vær forsigtig, indtil du ved, hvordan STRATTERA 25 mg påvirker dig eller dit barn.
- Tal med din læge, hvis du eller dit barn har bivirkninger, der er generende eller ikke forsvinder.
Dette er ikke en komplet liste over mulige bivirkninger. Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare STRATTERA?
- Opbevar STRATTERA et sikkert sted ved stuetemperatur, 59 til 86°F (15 til 30°C).
- Opbevar STRATTERA 40 mg og al medicin utilgængeligt for børn.
Generel information om STRATTERA
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke STRATTERA 25 mg til en tilstand, som den ikke er ordineret til. Giv ikke STRATTERA andre personer, selvom de har samme lidelse. Det kan skade dem.
Denne medicinvejledning opsummerer de vigtigste oplysninger om STRATTERA. Hvis du vil have mere information, så tal med din læge. Du kan spørge din læge eller apoteket om oplysninger om STRATTERA, som er skrevet til sundhedspersonale. For mere information om STRATTERA ring 1-800-Lilly-Rx (1-800-545-5979) eller besøg www.strattera.com.
Hvad er indholdsstofferne i STRATTERA 40mg?
Aktiv ingrediens: atomoxetin hydrochlorid.
Inaktive ingredienser: prægelatineret stivelse, dimethicon, gelatine, natriumlaurylsulfat, FD&CBlue nr. 2, syntetisk gul jernoxid, titaniumdioxid, rød jernoxid og spiselig sort blæk.
Denne medicinvejledning er godkendt af US Food and Drug Administration.
