Zovirax 200mg, 400mg, 800mg Acyclovir Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Zovirax 800mg, og hvordan bruges det?
Zovirax er en receptpligtig medicin, der bruges til at behandle symptomerne på forkølelsessår (Herpes Labialis) og genital herpes. Zovirax 800mg kan bruges alene eller sammen med anden medicin.
Zovirax 400mg tilhører en klasse af lægemidler kaldet Antivirals, Topical.
Det vides ikke, om Zovirax 200mg er sikkert og effektivt til børn under 12 år.
Hvad er de mulige bivirkninger af Zovirax 800mg?
Zovirax 200mg kan forårsage alvorlige bivirkninger, herunder:
- let blå mærker eller blødning,
- lilla eller røde prikkede pletter under huden,
- lidt eller ingen vandladning,
- smertefuld eller vanskelig vandladning,
- hævelse i dine fødder eller ankler,
- føler sig træt, og
- stakåndet
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Zovirax omfatter:
- kvalme,
- opkastning,
- diarré,
- generel dårlig følelse,
- hovedpine, og
- mundsmerter, mens du bruger en acyclovir bukkal tablet
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Zovirax. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
OVERSIGT PRODUKTINFORMATION
Lægemiddelstof
Ordentligt navn: acyclovir
Kemisk navn: 9-[(2-hydroxyethoxy)methyl]guanin
Andet navn: acycloguanosin
Molekylformel: C8H11N503
Molekylmasse: 225.2 Strukturformel:
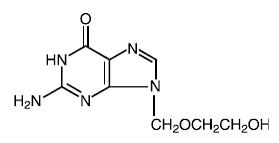
Fysisk-kemiske egenskaber: Acyclovir er et hvidt, krystallinsk pulver med en maksimal opløselighed i vand på 1,3 mg/ml ved 25°C.
INDIKATIONER
Indikationer og klinisk brug
ZOVIRAX® (acyclovir) er indiceret til følgende tilstande:
- Behandling af indledende episoder af herpes genitalis.
- Undertrykkelse af usædvanligt hyppige tilbagefald af herpes genitalis (6 eller flere episoder om året).
- Den akutte behandling af herpes zoster (helvedesild) og varicella (skoldkopper).
Resultaterne af kliniske undersøgelser tyder på, at nogle patienter med tilbagevendende genital herpes kan drage klinisk fordel af administration af oral ZOVIRAX®, hvis de tages ved det første tegn på en forestående episode. De patienter, der har størst sandsynlighed for at få gavn af dem, er patienter, der oplever alvorlige, langvarige tilbagefald; sådan intermitterende terapi kan være mere passende end suppressiv terapi, når disse gentagelser er sjældne.
Tidlig behandling af akut herpes zoster (helvedesild) hos immunkompetente personer med oral ZOVIRAX® resulterede i nedsat viral udskillelse; nedsat tid til heling; mindre formidling; og lindring af akutte smerter.
Behandling af skoldkopper hos immunkompetente patienter med oral ZOVIRAX® reducerede det samlede antal læsioner, fremskyndede progressionen af læsioner til skorpe- og helende stadier og reducerede antallet af resterende hypopigmenterede læsioner. Derudover reducerede ZOVIRAX® feber og konstitutionelle symptomer forbundet med skoldkopper.
Den profylaktiske anvendelse af acyclovir til skoldkopper er ikke blevet fastlagt.
Geriatri (≥ 65 år): Brug i den geriatriske population kan være forbundet med forskelle i sikkerhed på grund af aldersrelaterede ændringer i nyrefunktionen, og en kort diskussion kan findes i de relevante afsnit (se ADVARSLER OG FORHOLDSREGLER ).
Pædiatri ( Ingen data er tilgængelige.
DOSERING OG ADMINISTRATION
Doseringsovervejelser
- Dosis af ZOVIRAX® (acyclovir) bør reduceres hos patienter med nedsat nyrefunktion.
- Behandlingen bør påbegyndes så hurtigt som muligt efter en diagnose af skoldkopper eller herpes zoster, eller ved de første tegn eller symptomer på et udbrud af genital herpes.
- Den anbefalede dosis og brugsvarighed afhænger af indikationen.
Anbefalet dosis og dosisjustering
Behandling af initial infektion af Herpes Genitalis: 200 mg (én 200 mg tablet eller en teskefuld suspension [5 ml]) hver 4. time, 5 gange dagligt i alt 1 g dagligt i 10 dage. Behandlingen bør påbegyndes så tidligt som muligt efter debut af tegn og symptomer.
Undertrykkende terapi for tilbagevendende herpes genitalis
Den initiale anbefalede dosis er 200 mg (én 200 mg tablet eller en teskefuld suspension [5 ml]) tre gange dagligt. Dette kan øges, hvis der sker gennembrud op til en dosis på en 200 mg tablet eller en teskefuld [5 ml] suspension, fem gange dagligt. Om nødvendigt kan en dosis på 400 mg (to 200 mg tabletter eller to teskefulde suspension [10 ml]) givet to gange dagligt overvejes. Periodisk revurdering af behovet for terapi anbefales.
Administration af ZOVIRAX® til intermitterende behandling er 200 mg (én 200 mg tablet eller en teskefuld [5 ml] suspension) hver 4. time 5 gange dagligt i 5 dage. Behandlingen bør påbegyndes ved det tidligste tegn eller symptom (prodrom) på tilbagefald.
Behandling af Herpes Zoster
800 mg oral ZOVIRAX®, hver 4. time, 5 gange dagligt i 7 til 10 dage. Behandlingen bør påbegyndes inden for 72 timer efter debut af læsionerne. I kliniske forsøg opstod den største fordel, når behandlingen blev påbegyndt inden for 48 timer efter begyndelsen af læsionerne.
Behandling af skoldkopper
20 mg/kg (må ikke overstige 800 mg) oralt, 4 gange dagligt i 5 dage. Behandlingen bør påbegyndes inden for 24 timer efter forekomsten af udslæt.
Patienter med akut eller kronisk nyreinsufficiens
Forsigtighed tilrådes ved administration af acyclovir til patienter med nedsat nyrefunktion. Tilstrækkelig hydrering bør opretholdes.
Omfattende farmakokinetiske undersøgelser er blevet afsluttet efter intravenøse acyclovirinfusioner hos patienter med nedsat nyrefunktion.
Baseret på disse undersøgelser anbefales dosisjusteringer i tabel 5 for genital herpes og herpes zoster indikationer.
Hæmodialyse
For patienter, som kræver hæmodialyse, er den gennemsnitlige plasmahalveringstid for acyclovir under hæmodialyse ca. 5 timer. Dette resulterer i et fald på 60 % i plasmakoncentrationer efter en seks timers dialyseperiode. Derfor bør patientens doseringsplan justeres, så der indgives en ekstra dosis efter hver dialyse.
Peritoneal dialyse
Ingen tilskudsdosis ser ud til at være nødvendig efter justering af doseringsintervallet.
Glemt dosis
Hvis en dosis af ZOVIRAX® glemmes, skal patienten rådes til at tage den, så snart han/hun husker det, og derefter fortsætte med den næste dosis med det rigtige tidsinterval.
HVORDAN LEVERET
Opbevaring og stabilitet
ZOVIRAX® tabletter skal opbevares ved kontrolleret stuetemperatur (15 til 25°C) på et tørt sted og beskyttet mod lys.
ZOVIRAX® Suspension skal opbevares ved kontrolleret stuetemperatur (15 til 25°C).
Doseringsformer, sammensætning og emballage
Affjedring: Hver teskefuld (5 ml) ZOVIRAX® Suspension indeholder 200 mg acyclovir og de ikke-medicinske ingredienser banansmag, cellulose, glycerin, methylparaben, propylparaben, sorbitol, vanillin og vand.
Hver ZOVIRAX® 200 tablet indeholder 200 mg acyclovir og de ikke-medicinske ingredienser cellulose, indigotin, lactose, magnesiumstearat, povidon og natriumstivelsesglykolat.
ZOVIRAX® Suspension fås i flasker på 125 ml* og 475 ml. Hver teskefuld (5 ml) råhvid suspension med banansmag indeholder 200 mg acyclovir.
*125 ml flaske ikke tilgængelig i Canada
ZOVIRAX® 200 tabletter fås i flasker med 100 tabletter. Hver blå, skjoldformet, komprimeret tablet med skråkanter indeholder 200 mg acyclovir og er præget med "ZOVIRAX" på den ene side og en trekant på den anden side.
GlaxoSmithKline Inc., 7333 Mississauga Road, Mississauga, Ontario, L5N 6L4 1-800-387-7374. Revideret: 10. november 2014
BIVIRKNINGER
Oversigt over bivirkninger
De hyppigste bivirkninger forbundet med brugen af ZOVIRAX® (acyclovir) er hovedpine og kvalme.
Neurologiske bivirkninger er også blevet rapporteret i sjældne tilfælde. Ældre patienter og patienter med tidligere nedsat nyrefunktion har øget risiko for at udvikle disse virkninger. I de rapporterede tilfælde var disse reaktioner generelt reversible ved seponering af behandlingen (se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER , Bivirkninger efter markedsføring ).
Bivirkninger af kliniske forsøg
Fordi kliniske forsøg udføres under meget specifikke forhold, afspejler de bivirkninger, der er observeret i de kliniske forsøg, muligvis ikke de hastigheder, der observeres i praksis og bør ikke sammenlignes med frekvenserne i de kliniske forsøg med et andet lægemiddel. Bivirkningsoplysninger fra kliniske forsøg er nyttige til at identificere lægemiddelrelaterede bivirkninger og tilnærmelsesvis frekvenser.
Behandling af herpes simplex
Kortvarig administration (5-10 dage): De hyppigste bivirkninger rapporteret under kliniske forsøg med behandling af genital herpes med oral ZOVIRAX® hos 298 patienter er anført i tabel 1.
Undertrykkelse af herpes simplex
Langtidsadministration: De hyppigste bivirkninger rapporteret i et klinisk forsøg til forebyggelse af tilbagefald med kontinuerlig administration af 400 mg (to 200 mg kapsler) 2 gange dagligt er anført i tabel 2.
Evidens indtil nu fra kliniske forsøg tyder på, at sværhedsgraden og hyppigheden af bivirkninger sandsynligvis ikke vil nødvendiggøre seponering af behandlingen.
Herpes zoster
De hyppigste bivirkninger rapporteret under tre kliniske forsøg med behandling af herpes zoster (helvedesild) med 800 mg oral ZOVIRAX® 5 gange dagligt i 7 eller 10 dage eller placebo er anført i tabel 3.
Skoldkopper
De hyppigste bivirkninger rapporteret under tre kliniske forsøg med behandling af skoldkopper med oral ZOVIRAX® eller placebo er anført i tabel 4.
Mindre almindelige bivirkninger ved kliniske forsøg (
Andre bivirkninger rapporteret hos mindre end 1 % af patienterne, der fik ZOVIRAX® i ethvert klinisk forsøg, omfattede: mavesmerter, anoreksi, forstoppelse, svimmelhed, ødem, træthed, flatulens, lyskeadenopati, søvnløshed, bensmerter, medicinsmag, hududslæt, øm hals, krampagtige håndbevægelser og nældefeber.
Unormale hæmatologiske og kliniske kemifund
Der er ikke observeret nogen klinisk signifikante ændringer i laboratorieværdier i kliniske forsøg til behandling af skoldkopper og zoster og til behandling og suppression af genital herpes med ZOVIRAX®.
Bivirkninger efter markedsføring
Følgende hændelser er blevet rapporteret frivilligt under post-market brug af ZOVIRAX® i klinisk praksis. Disse hændelser er blevet valgt til inklusion på grund af enten deres alvor, hyppighed af rapportering, potentielle årsagssammenhænge til ZOVIRAX® eller en kombination af disse faktorer. Uønskede hændelser efter markedsføring rapporteres spontant fra en population af ukendt størrelse, hvorfor estimat af hyppigheden ikke kan foretages.
Generel: Feber, hovedpine, smerter og perifert ødem.
Nervøs: Svimmelhed, paræstesi, agitation, forvirring, tremor, ataksi, dysartri, hallucinationer, psykotiske symptomer, kramper, somnolens, encefalopati og koma er blevet rapporteret. Disse hændelser er generelt reversible og rapporteres normalt hos patienter med nedsat nyrefunktion eller med andre disponerende faktorer (se ADVARSLER OG FORHOLDSREGLER ). Disse symptomer kan være markante, især hos ældre voksne.
Fordøjelse: Diarré, mave-tarmbesvær og kvalme.
Hæmatogisk og lymfatisk: Anæmi, leukopeni, lymfadenopati og trombocytopeni.
Overfølsomhed og hud: Alopeci, erythema multiforme, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, udslæt inklusive lysfølsomhed, pruritus, nældefeber, dyspnø, angioødem og anafylaksi.
Lever og galdeveje og bugspytkirtel: Rapporter om reversibel hyperbilirubinæmi og forhøjede leverrelaterede enzymer. Hepatitis og gulsot.
Muskuloskeletale: Myalgi.
Særlige sanser: Visuelle abnormiteter.
Urogenital: Forhøjet blodkreatinin og blodurinstofnitrogen (BUN). Akut nyresvigt, nyresmerter og hæmaturi er blevet rapporteret. Nyresmerter kan være forbundet med nyresvigt (se ADVARSLER OG FORHOLDSREGLER ).
DRUGSINTERAKTIONER
Lægemiddel-lægemiddelinteraktioner
Ingen klinisk signifikante interaktioner er blevet identificeret.
Acyclovir elimineres primært uændret i urinen via aktiv renal tubulær sekretion. Ethvert lægemiddel, der administreres samtidigt, og som konkurrerer med denne mekanisme, kan øge plasmakoncentrationen af acyclovir. Probenecid og cimetidin øger arealet under kurven (AUC) af acyclovir ved denne mekanisme og reducerer acyclovir renal clearance. Tilsvarende er stigninger i plasma-AUC'er for acyclovir og af den inaktive metabolit af mycophenolatmofetil, et immunsuppressivt middel, der anvendes til transplanterede patienter, blevet vist, når lægemidlerne administreres samtidigt. Det er dog ikke nødvendigt at justere dosis på grund af det brede terapeutiske indeks for acyclovir.
Lægemiddel-fødevareinteraktioner
Der er ingen kendt interaktion med mad (se Handling og klinisk farmakologi , Farmakokinetik ).
Lægemiddel-urte-interaktioner
Interaktioner med urteprodukter er ikke blevet etableret.
Interaktioner med lægemiddel-laboratorietest
Interaktioner med laboratorietest er ikke blevet påvist.
ADVARSLER
ZOVIRAX (acyclovir) kapsler, tabletter og suspension er kun beregnet til oral indtagelse. Nyresvigt, i nogle tilfælde med døden til følge, er blevet observeret ved behandling med acyclovir (se BIVIRKNINGER: Observeret under klinisk praksis og OVERDOSERING ). Trombotisk trombocytopenisk purpura/hæmolytisk uremisk syndrom (TTP/HUS), som har resulteret i dødsfald, er opstået hos immunkompromitterede patienter, der får behandling med acyclovir.
FORHOLDSREGLER
Dosisjustering anbefales, når ZOVIRAX (acyclovir) administreres til patienter med nedsat nyrefunktion (se DOSERING OG ADMINISTRATION ). Der bør også udvises forsigtighed ved administration af ZOVIRAX (acyclovir) til patienter, der får potentielt nefrotoksiske midler, da dette kan øge risikoen for nyreinsufficiens og/eller risikoen for reversible symptomer fra centralnervesystemet, såsom dem, der er blevet rapporteret hos patienter behandlet med intravenøs acyclovir. . Tilstrækkelig hydrering bør opretholdes.
Herpes zoster: Der er ingen data om behandling påbegyndt mere end 72 timer efter debut af zosterudslæt. Patienter bør rådes til at påbegynde behandling så hurtigt som muligt efter en diagnose af herpes zoster.
Genital herpesinfektion: Patienterne skal informeres om, at ZOVIRAX (acyclovir) ikke er en kur mod genital herpes. Der er ingen data, der vurderer, om ZOVIRAX (acyclovir) vil forhindre overførsel af infektion til andre. Fordi genital herpes er en seksuelt overført sygdom, bør patienter undgå kontakt med læsioner eller samleje, når læsioner og/eller symptomer er til stede for at undgå at inficere partnere. Genital herpes kan også overføres i mangel af symptomer gennem asymptomatisk viral udskillelse. Hvis medicinsk behandling af en genital herpes er indiceret, bør patienterne rådes til at påbegynde behandling ved det første tegn eller symptom på en episode.
Skoldkopper: Skoldkopper hos ellers raske børn er normalt en selvbegrænset sygdom af mild til moderat sværhedsgrad. Unge og voksne har en tendens til at have mere alvorlig sygdom. Behandlingen blev påbegyndt inden for 24 timer efter det typiske skoldkoppeudslæt i de kontrollerede undersøgelser, og der er ingen information om virkningerne af behandling påbegyndt senere i sygdomsforløbet.
Karcinogenese, mutagenese, svækkelse af fertilitet
Dataene præsenteret nedenfor inkluderer referencer til maksimale steady-state plasma-acyclovirkoncentrationer observeret hos mennesker behandlet med 800 mg givet oralt 5 gange dagligt (dosis passende til behandling af herpes zoster) eller 200 mg givet oralt 5 gange dagligt (dosering passende til behandling af genital herpes). Plasma-lægemiddelkoncentrationer i dyreforsøg er udtrykt som multipla af human eksponering for acyclovir ved højere og lavere doseringsskemaer (se KLINISK FARMAKOLOGI: Farmakokinetik ).
Acyclovir blev testet i livstidsbioassays i rotter og mus ved enkelt daglige doser på op til 450 mg/kg indgivet ved sonde. Der var ingen statistisk signifikant forskel i forekomsten af tumorer mellem behandlede dyr og kontroldyr, og acyclovir forkortede heller ikke tumorernes latens. Maksimale plasmakoncentrationer var 3 til 6 gange humane niveauer i musebioassayet og 1 til 2 gange humane niveauer i rottebioassay.
Acyclovir blev testet i 16 in vitro og in vivo genetiske toksicitetsassays. Acyclovir var positivt i 5 af analyserne.
Acyclovir svækkede ikke fertiliteten eller reproduktionen hos mus (450 mg/kg/dag, po) eller hos rotter (25 mg/kg/dag, sc). I museundersøgelsen var plasmaniveauerne 9 til 18 gange humane niveauer, mens de i rotteundersøgelsen var 8 til 15 gange humane niveauer. Ved højere doser (50 mg/kg/dag, sc) hos rotter og kaniner (henholdsvis 11 til 22 og 16 til 31 gange humane niveauer) var implantationseffektiviteten, men ikke kuldstørrelsen, nedsat. I et peri- og postnatalt rottestudie med 50 mg/kg/dag, sc, var der et statistisk signifikant fald i gruppegennemsnitlige antal corpora lutea, totale implantationssteder og levende fostre.
Der blev ikke set testikelabnormiteter hos hunde givet 50 mg/kg/dag, IV i 1 måned (21 til 41 gange humane niveauer) eller hos hunde givet 60 mg/kg/dag oralt i 1 år (6 til 12 gange humane niveauer). Testikelatrofi og aspermatogenese blev observeret hos rotter og hunde ved højere dosisniveauer.
Graviditet
Teratogene virkninger: Graviditetskategori B. Acyc lovir administreret under organogenese var ikke teratogent hos mus (450 mg/kg/dag, po), kanin (50 mg/kg/dag, sc og IV) eller rotte (50 mg/kg/dag, sc). Disse eksponeringer resulterede i plasmaniveauer på henholdsvis 9 og 18, 16 og 106 samt 11 og 22 gange humane niveauer.
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Et prospektivt epidemiologisk register over brug af acyclovir under graviditet blev etableret i 1984 og afsluttet i april 1999. Der blev fulgt 749 graviditeter hos kvinder udsat for systemisk acyclovir under graviditetens første trimester, hvilket resulterede i 756 resultater. Forekomsten af fødselsdefekter tilnærmer sig den, der findes i den generelle befolkning. Den lille størrelse af registret er imidlertid utilstrækkelig til at vurdere risikoen for mindre almindelige defekter eller til at tillade pålidelige eller definitive konklusioner vedrørende sikkerheden af acyclovir hos gravide kvinder og deres fostre under udvikling. Acyclovir bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Ammende mødre
Acyclovirkoncentrationer er blevet dokumenteret i modermælk hos 2 kvinder efter oral administration af ZOVIRAX (acyclovir) og varierede fra 0,6 til 4,1 gange tilsvarende plasmaniveauer. Disse koncentrationer ville potentielt udsætte det ammende spædbarn for en dosis acyclovir op til 0,3 mg/kg/dag. ZOVIRAX (acyclovir) bør administreres til en ammende mor med forsigtighed og kun når det er indiceret.
Pædiatrisk brug
Sikkerhed og effektivitet af orale formuleringer af acyclovir hos pædiatriske patienter yngre end 2 år er ikke blevet fastlagt.
Geriatrisk brug
Ud af 376 forsøgspersoner, der fik ZOVIRAX (acyclovir) i et klinisk studie af herpes zoster-behandling hos immunkompetente forsøgspersoner ¡Ý50 år, var 244 65 og derover, mens 111 var 75 og derover. Ingen overordnede forskelle i effektivitet for tid til ophør af ny læsionsdannelse eller tid til heling blev rapporteret mellem geriatriske forsøgspersoner og yngre voksne forsøgspersoner. Varigheden af smerte efter heling var længere hos patienter 65 og derover. Kvalme, opkastning og svimmelhed blev rapporteret hyppigere hos ældre forsøgspersoner. Ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion og har behov for dosisreduktion. Ældre patienter er også mere tilbøjelige til at få nyre- eller CNS-bivirkninger. Med hensyn til CNS-bivirkninger observeret under klinisk praksis, blev somnolens, hallucinationer, forvirring og koma rapporteret hyppigere hos ældre patienter (se KLINISK FARMAKOLOGI, BIVIRKNINGER: Observeret under klinisk praksis, og DOSERING OG ADMINISTRATION ).
OVERDOSIS
Kontakt dit regionale giftkontrolcenter for håndtering af en formodet overdosis.
Aktivt kul kan administreres for at hjælpe med at fjerne uabsorberet lægemiddel. Generelle støtteforanstaltninger anbefales.
Acyclovir absorberes kun delvist i mave-tarmkanalen. Patienter har indtaget op til 20 g acyclovir ved en enkelt lejlighed uden uventede bivirkninger. I kliniske undersøgelser var den højeste plasmakoncentration observeret hos en enkelt patient ved disse doser 10,0 μg/ml. Utilsigtede, gentagne overdoser af oral acyclovir over flere dage er blevet forbundet med gastrointestinale virkninger (såsom kvalme og opkastning) og neurologiske virkninger (hovedpine og forvirring).
Intravenøse doser administreret til mennesker har været så høje som 1.200 mg/m² (28 mg/kg) 3 gange dagligt i op til 2 uger. De maksimale plasmakoncentrationer har nået 80 μg/ml. Overdosering af intravenøs acyclovir har resulteret i forhøjelser af serumkreatinin, blodurinstofnitrogen og efterfølgende nyresvigt. Neurologiske effekter, herunder forvirring, hallucinationer, agitation, kramper og koma er blevet beskrevet i forbindelse med intravenøs overdosering.
Patienter bør observeres nøje for tegn på toksicitet. Hæmodialyse øger væsentligt fjernelsen af acyclovir fra blodet og kan derfor betragtes som en behandlingsmulighed i tilfælde af symptomatisk overdosis. Udfældning af acyclovir i nyretubuli kan forekomme, hvis opløseligheden (2,5 mg/ml) i den intratubulære væske overskrides. I tilfælde af nyresvigt og anuri kan patienten have gavn af hæmodialyse, indtil nyrefunktionen er genoprettet (se DOSERING OG ADMINISTRATION ).
KONTRAINDIKATIONER
ZOVIRAX® (acyclovir) er kontraindiceret til patienter, der udvikler overfølsomhed, eller som er overfølsomme over for acyclovir, valacyclovir eller andre komponenter i formuleringerne af ZOVIRAX®. For en komplet liste, se Doseringsformer , Sammensætning og emballage afsnit af produktmonografien .
KLINISK FARMAKOLOGI
Handling og klinisk farmakologi
Handlingsmekanisme
ZOVIRAX® (acyclovir), en syntetisk acyklisk purin-nukleosidanalog, er et substrat med en høj grad af specificitet for herpes simplex og varicella-zoster-specificeret thymidinkinase. Acyclovir er et dårligt substrat for værtscelle-specificeret thymidinkinase. Herpes simplex og varicella-zoster specificeret thymidinkinase transformerer acyclovir til dets monophosphat, som derefter transformeres af en række cellulære enzymer til acyclovirdiphosphat og acyclovirtriphosphat. Acyclovirtrifosfat er både en hæmmer af og et substrat for herpesvirus-specificeret DNA-polymerase. Selvom den cellulære a-DNA-polymerase i inficerede celler også kan hæmmes af acyclovirtriphosphat, forekommer dette kun ved koncentrationer af acyclovirtriphosphat, som er højere end dem, der inhiberer den herpesvirus-specificerede DNA-polymerase. Acyclovir omdannes selektivt til sin aktive form i herpesvirus-inficerede celler og optages derfor fortrinsvis af disse celler. Acyclovir har vist et meget lavere toksisk potentiale in vitro for normale uinficerede celler, fordi: 1) mindre optages; 2) mindre omdannes til den aktive form; og 3) cellulær a-DNA-polymerase har en lavere følsomhed over for virkningen af den aktive form af lægemidlet. En kombination af thymidinkinasespecificiteten, inhibering af DNA-polymerase og for tidlig afbrydelse af DNA-syntese resulterer i inhibering af herpesvirusreplikation. Der er ikke påvist nogen effekt på latent ikke-replikerende virus. Inhibering af virussen reducerer perioden med viral udskillelse, begrænser graden af spredning og patologiniveau og letter derved helingen. Under suppression er der ingen beviser for, at acyclovir forhindrer neural migration af virussen. Det afbryder episoder med tilbagevendende herpes på grund af hæmning af viral replikation efter reaktivering.
Farmakokinetik
Acyclovirs farmakokinetik efter oral administration er blevet evalueret i 6 kliniske undersøgelser med 110 voksne patienter.
Absorption
en undersøgelse af 35 immunkompromitterede patienter med herpes simplex eller varicella-zoster-infektion, der fik ZOVIRAX®-kapsler i doser på 200 til 1.000 mg hver 4. time, 6 gange dagligt i 5 dage, blev biotilgængeligheden estimeret til at være 15 til 20 %. I denne undersøgelse blev steady-state plasmaniveauer nået på den anden dag af dosering. Gennemsnitlige steady-state top- og bundkoncentrationer efter den sidste 200 mg dosis var henholdsvis 0,49 μg/mL (0,47 til 0,54 μg/mL) og 0,31 μg/mL (0,18 til 0,41 μg/mL), og efter den sidste dosis var 800 mg 2,8 μg/mL (2,3 til 3,1 μg/mL) og 1,8 μg/mL (1,3 til 2,5 μg/mL). I et andet studie fik 20 immunkompetente patienter med tilbagevendende genital herpes simplex-infektioner ZOVIRAX®-kapsler i en dosis på 800 mg hver 6. time, 4 gange dagligt i 5 dage, var den gennemsnitlige steady-state top- og bundkoncentration 1,4 μg/ml (0,66 til 1,8 μg/mL) og 0,55 μg/mL (0,14 til 1,1 μg/mL).
et crossover-studie med flere doser, hvor 23 frivillige modtog ZOVIRAX® som en 200 mg kapsel, en 400 mg tablet og en 800 mg tablet 6 gange dagligt, faldt absorptionen med stigende dosis, og den estimerede biotilgængelighed af acyclovir var 20, 15 og 10 %. , henholdsvis. Faldet i biotilgængelighed menes at være en funktion af dosis og ikke doseringsformen. Det blev påvist, at acyclovir ikke er dosisproportional over doseringsområdet 200 til 800 mg. I denne undersøgelse var steady-state top- og bundkoncentrationer af acyclovir 0,83 og 0,46 μg/mL, 1,21 og 0,63 μg/mL og 1,61 og 0,83 μg/mL for henholdsvis 200, 400 og 800 mg regimerne.
I en anden undersøgelse med 6 frivillige var fødens indflydelse på absorptionen af acyclovir ikke tydelig.
En enkelt oral dosis biotilgængelighedsundersøgelse hos 23 normale frivillige viste, at ZOVIRAX® Kapsler 200 mg er bioækvivalente med 200 mg acyclovir i vandig opløsning. I en separat undersøgelse med 20 frivillige blev det vist, at ZOVIRAX® Suspension er bioækvivalent med ZOVIRAX® Kapsler. I en anden enkeltdosis biotilgængelighed/bioækvivalensundersøgelse hos 24 frivillige blev en ZOVIRAX® 800 mg tablet vist at være bioækvivalent med fire ZOVIRAX® 200 mg kapsler.
Fordeling
Plasmaproteinbinding er relativt lav (9 til 33%), og lægemiddelinteraktioner, der involverer forskydning af bindingssted, forventes ikke.
Elimination
Efter oral administration varierede den gennemsnitlige plasmahalveringstid for acyclovir hos frivillige og patienter med normal nyrefunktion fra 2,5 til 3,3 timer. Den gennemsnitlige nyreudskillelse af uændret lægemiddel udgør 14,4 % (8,6 til 19,8 %) af den oralt administrerede dosis. Den eneste urinmetabolit (identificeret ved højtydende væskekromatografi) er 9-[(carboxymethoxy)methyl]guanin.
Særlige populationer og forhold
Pædiatri
Generelt svarer acyclovirs farmakokinetik hos børn til voksne. Gennemsnitlig halveringstid efter orale doser på 300 og 600 mg/m² hos børn i alderen 7 måneder til 7 år var 2,6 timer (interval 1,59 til 3,74 timer).
Oralt administreret acyclovir til børn under 2 år er endnu ikke fuldt ud undersøgt.
Geriatri
Hos ældre falder den totale kropsclearance med stigende alder, forbundet med fald i kreatininclearance, selvom der er ringe ændring i den terminale plasmahalveringstid. Dosisreduktion kan være nødvendig hos geriatriske patienter med nedsat nyrefunktion (se DOSERING OG ADMINISTRATION ).
Nyreinsufficiens
Halveringstiden og den totale kropsclearance af acyclovir afhænger af nyrefunktionen.
En dosisjustering anbefales til patienter med nedsat nyrefunktion (se DOSERING OG ADMINISTRATION ).
Kliniske forsøg
Indledende genital herpes
Dobbeltblinde, placebokontrollerede undersøgelser har vist, at oralt administreret ZOVIRAX® signifikant reducerede varigheden af akut infektion og varigheden af læsionsheling. Varigheden af smerte og dannelse af ny læsion blev reduceret i nogle patientgrupper.
Tilbagevendende genital herpes
I en undersøgelse af patienter, der fik ZOVIRAX® 400 mg to gange dagligt i 3 år, forblev 45, 52 og 63 % af patienterne fri for tilbagefald i henholdsvis det første, andet og tredje år. Serieanalyser af 3-måneders recidivhyppigheden for patienterne viste, at 71 til 87 % var gentagelsesfri i hvert kvartal.
Herpes zoster infektioner
I en dobbeltblind, placebokontrolleret undersøgelse af immunkompetente patienter med lokaliseret kutan zosterinfektion, forkortede ZOVIRAX® (800 mg 5 gange dagligt i 10 dage) tiden til læsionskorpning, heling og fuldstændig ophør af smerte og reducerede varigheden af viral virus. udskillelse og varigheden af ny læsionsdannelse.
et lignende dobbeltblindt, placebokontrolleret studie forkortede ZOVIRAX® (800 mg 5 gange dagligt i 7 dage) tiderne til at fuldføre læsionsskorpning, heling og ophør af smerte og reducerede varigheden af ny læsionsdannelse.
Behandlingen blev påbegyndt inden for 72 timer efter udslæts begyndelse og var mest effektiv, hvis den blev startet inden for de første 48 timer. Voksne over 50 år viste større fordele.
Skoldkopper
Tre randomiserede, dobbeltblindede, placebokontrollerede forsøg blev udført med 993 pædiatriske patienter i alderen 2 til 18 år med skoldkopper. Alle patienter blev behandlet inden for 24 timer efter udslæts begyndelse. I to forsøg blev ZOVIRAX® administreret med 20 mg/kg fire gange dagligt (op til 3.200 mg pr. dag) i 5 dage. I det tredje forsøg blev doser på 10, 15 eller 20 mg/kg administreret fire gange dagligt i 5 til 7 dage. Behandling med ZOVIRAX® forkortede tiden til 50 % heling, reducerede det maksimale antal læsioner, reducerede mediantallet af vesikler, reducerede mediantallet af resterende læsioner på dag 28 og reducerede andelen af patienter med feber, anoreksi og sløvhed. på dag 2. Behandling med ZOVIRAX® påvirkede ikke varicella zoster virus-specifikke humorale eller cellulære immunresponser 1 måned eller 1 år efter behandlingen.
Detaljeret farmakologi
Se Handling og klinisk farmakologi.
Virologi
Det kvantitative forhold mellem in vitro-følsomheden af herpes simplex-virus (HSV) og varicella-zoster-virus (VZV) over for acyclovir og det kliniske respons på terapi er ikke blevet fastslået hos mennesker, og virusfølsomhedstest er ikke blevet standardiseret. Følsomhedstestresultater, udtrykt som den koncentration af lægemiddel, der kræves for at hæmme væksten af virus i cellekultur (ID50) med 50 %, varierer meget afhængigt af det anvendte assay, den anvendte celletype og laboratoriet, der udfører testen. ID50 for acyclovir mod HSV-1-isolater kan variere fra 0,02 μg/mL (plaque-reduktion i Vero-celler) til 5,9-13,5 μg/mL (plaque-reduktion i grønne abenyre [GMK]-celler). ID50 mod HSV-2 varierer fra 0,01 til 9,9 μg/mL (plakreduktion i henholdsvis Vero- og GMK-celler).
Ved at bruge en farvestofoptagelsesmetode i Vero-celler, som giver ID50-værdier ca. 5 til 10 gange højere end plaque-reduktionsassays, blev 1.417 HSV-isolater (553 HSV-1 og 864 HSV-2) fra ca. 500 patienter undersøgt over en 5- års periode. Disse assays fandt, at 90 % af HSV-1-isolater var følsomme over for ≤ 0,9 μg/ml acyclovir, og 50 % af alle isolater var følsomme over for ≤ 0,2 μg/mL acyclovir. For HSV-2-isolater var 90 % følsomme over for ≤ 2,2 μg/ml, og 50 % af alle isolater var følsomme over for ≤ 0,7 μg/mL acyclovir. Isolater med signifikant nedsat følsomhed blev fundet hos 44 patienter. Det skal understreges, at hverken patienterne eller isolaterne blev tilfældigt udvalgt og derfor ikke repræsenterer den generelle befolkning. De fleste af de mindre følsomme kliniske HSV-isolater har været relativt mangelfulde i den virale thymidinkinase (TK). Stammer med ændringer i viral TK eller viral DNA-polymerase er også blevet rapporteret.
ID50 mod VZV varierer fra 0,17-1,53 μg/mL (udbyttereduktion, humane forhudsfibroblaster) til 1,85-3,98 μg/mL (foci-reduktion, humane embryofibroblaster [HEF]). Reproduktion af EBV-genom er undertrykt med 50 % i superinficerede Raji-celler eller P3HR-1 lymfoblastoidceller med 1,5 μg/ml acyclovir. Cytomegalovirus (CMV) er relativt resistent over for acyclovir med ID50-værdier fra 2,3-17,6 μg/mL (plakreduktion, HEF-celler) til 1,82-56,8 μg/mL (DNA-hybridisering, HEF-celler). Den latente tilstand af genomet af nogen af de humane herpesvirus vides ikke at være følsom over for acyclovir.
Modstand
Langvarig eksponering af HSV for subinhiberende koncentrationer (0,1 μg/ml) af acyclovir i cellekultur har resulteret i fremkomsten af en række acyclovir-resistente stammer. Fremkomsten af resistente stammer menes at ske ved "udvælgelse" af naturligt forekommende vira med relativt lav modtagelighed for acyclovir. Sådanne stammer er blevet rapporteret i isolater før behandling fra flere kliniske undersøgelser.
To resistensmekanismer, der involverer viral thymidinkinase (kræves for aktivering af acyclovir), er blevet beskrevet. Disse er: (a) selektion af thymidinkinase-deficiente mutanter, der inducerer ringe eller ingen enzymaktivitet efter infektion, og (b) selektion af mutanter, der besidder en thymidinkinase med ændret substratspecificitet, som er i stand til at phosphorylere det naturlige nukleosid thymidin, men ikke acyclovir. Størstedelen af mindre modtagelige vira, der opstår in vitro, er af den thymidin-kinase-deficiente type, som har reduceret infektivitet og patogenicitet og mindre sandsynlighed for at inducere latens hos dyr.
En acyclovir-resistent HSV-infektion hos en immunsupprimeret knoglemarvstransplantatmodtager på forlænget acyclovir-terapi viste sig imidlertid at skyldes et klinisk isolat, som havde en normal thymidinkinase, men en ændret DNA-polymerase. Denne tredje resistensmekanisme, der involverer herpes simplex-virus-DNA-polymerase, skyldes udvælgelsen af mutanter, der koder for et ændret enzym, som er resistent over for inaktivering af acyclovirtrifosfat.
VZV ser ud til at vise resistens over for acyclovir via mekanismer svarende til dem, der ses ved HSV.
Begrænset klinisk undersøgelse har imidlertid ikke afsløret nogen tegn på en signifikant ændring i in vitro-følsomhed af VZV med acyclovir-terapi, selvom resistente mutanter af denne virus kan isoleres in vitro på en måde, der er analog med HSV. Analyse af et lille antal kliniske isolater fra patienter, der modtog oral acyclovir eller placebo for akut herpes zoster, tyder på, at in vivo-fremkomst af resistent VZV kan forekomme sjældent. Langvarig acyclovirbehandling af stærkt immunkompromitterede patienter med erhvervet immundefektsyndrom og svær VZV kan føre til fremkomsten af resistent virus.
Krydsresistens over for andre antivirale midler forekommer in vitro i acyclovir-resistente mutanter. HSV-mutanter, som er resistente over for acyclovir på grund af fravær af viral thymidinkinase, er krydsresistente over for andre midler, som phosphoryleres af herpesvirus thymidinkinase, såsom bromovinyldeoxyuridin, ganciclovir og 2'-fluorpyrimidin-nukleosiderne, såsom, 2'-fluoro. -5-iodoarabinosyl-cytosin (FIAC).
Den kliniske respons på acyclovirbehandling har sædvanligvis været god for patienter med normal immunitet, fra hvem HSV med nedsat modtagelighed for acyclovir er blevet genfundet, enten før, under eller efter behandlingen. Imidlertid er visse patientgrupper, såsom alvorligt immunkompromitterede (især knoglemarvstransplanterede) og dem, der gennemgår kroniske suppressive regimer, blevet identificeret som værende oftest forbundet med fremkomsten af resistente herpes simplex-stammer, som kan eller ikke kan ledsage en dårlig respons. til stoffet. Muligheden for forekomsten af mindre følsomme vira skal erkendes ved behandling af sådanne patienter, og følsomhedsmonitorering af kliniske isolater fra disse patienter bør tilskyndes.
Sammenfattende er det kvantitative forhold mellem in vitro-følsomheden af HSV og VZV over for acyclovir og det kliniske respons på terapi ikke klart fastlagt hos mennesker. Standardiserede metoder til virusfølsomhedstestning er nødvendige for at tillade mere præcise korrelationer mellem in vitro virusfølsomhed og klinisk respons på acyclovirbehandling.
Toksikologi
Akut toksicitetsundersøgelser
Voksne mus og rotter : Den akutte toksicitet af oral acyclovir blev bestemt som vist i tabel 6.
Neonatale, umodne og voksne rotter
Grupper på 10 han- og 10 hunrotter Charles River CD (Sprague-Dawley) fik enkelte store doser (5 forskellige dosisniveauer) af en opløsning (pH 11,0) af acyclovir ved subkutan injektion, når de var 3, 10, 28 og 71 dage. af alder. De blev observeret i 14 dage efter behandling, og LD50-værdier blev beregnet ved Litchfield og Wilcoxon-metoden (se tabel 7 nedenfor). Denne undersøgelse blev udført for at bestemme, om alder ved eksponering påvirker den akutte toksicitet af acyclovir; der var ingen beviser for, at unge rotter var mere følsomme end ældre rotter over for de akutte toksiske virkninger af acyclovir.
Der var ingen tilsyneladende sammenhæng mellem længden af overlevelse efter behandling og alder, hvor behandlingen blev givet. Kliniske tegn for rotter behandlet ved 3 og 10 dages alderen inkluderede røde og lilla kutane blærer, blå områder, sårskorper, ar, nekrotisk og udslidt hud, åbne sår, kropsrysten og alopeci. Nedsat aktivitet, tåreflåd, lukkede øjenlåg, rødbrunt eller brunt materiale omkring øjne, næse og mund, ataksi, udmattelse, kropsrystelser, urinpletter omkring maven eller kønsdelene, skorpe eller nekrotiske områder og alopeci blev observeret hos rotter behandlet kl. 28 og 71 dage gammel.
Subkronisk oral toksicitetsundersøgelse
Mus
Fire grupper, der hver bestod af 28 han- og 28 hunmus Charles River CD-1 (ICR) blev oralt doseret med mavesonde i 33 dage med suspensioner af acyclovir. Daglige dosisniveauer var 0, 50, 150 og 450 mg/kg. Hæmatologiske og kliniske kemimålinger blev foretaget på yderligere 8 han- og 8 hunmus pr. gruppe (doseret på samme måde) efter den første og fjerde uges dosering og i løbet af den 3. postdosisuge.
Plasma-lægemiddelkoncentrationer blev målt i poolede prøver fra yderligere 4 han- og 4 hunmus pr. gruppe på dosisdage 1, 15 og 30.
Baseret på foreløbige forsøg med rotter og mus blev den høje dosis på 450 mg/kg udvalgt til at producere de højeste lægemiddelplasmaniveauer, der på en praktisk måde kan opnås ved oral dosering til en gnaverart. Gennemsnitlige lægemiddelplasmakoncentrationer varierede fra ca. 3,4 (ved den lave dosis) til 11,0 (ved den høje dosis) μg/mL plasma en time efter oral dosering.
Der forekom ingen ændringer i sundhed, væksthastighed, hæmatologi og klinisk kemimålinger, som definitivt kunne tilskrives dosering med acyclovir. Grove og histopatologiske undersøgelser af 16 han- og 16 hunrotter fra højdosis- og kontrolgrupperne ved slutningen af dosisperioden afslørede intet bemærkelsesværdigt.
Kronisk toksicitetsundersøgelser
Livsvarig oral toksicitetsundersøgelse hos rotter givet acyclovir ved gastrisk intubation
Charles River CD (Sprague-Dawley) rotter blev givet suspensioner af acyclovir ved sonde. Der var 50 han- og 50 hunrotter ved hvert af følgende dosisniveauer: 0, 50, 150 og 450 mg/kg. Efter 30 og 52 ugers behandling blev 10 han- og 10 hunrotter fra hver gruppe obduceret. De resterende rotter blev doseret hver dag, indtil den naturlige dødelighed reducerede en gruppestørrelse til ca. 20 % af antallet af dyr af det køn, der var til stede i testgrupperne, da undersøgelsen blev startet. Alle tilbageværende rotter blev dræbt og obduceret, når 20% afskæringspunktet var nået. Dette var i uge 110 for hanrotterne og uge 122 for hunrotterne. Væv fra kontrolrotter og dem i højdosisgruppen blev evalueret ved lysmikroskopi. Væv fra rotter i lav- og mellemdosisgrupperne med masser, knuder eller usædvanlige læsioner blev også undersøgt ved lysmikroskopi. Fixerede væv fra rotter, der blev fundet døde i løbet af de første 52 uger af undersøgelsen, blev også evalueret ved lysmikroskopi.
Der blev ikke observeret tegn på toksikose. Plasmaprøver blev opsamlet 1,5 time efter dosering på dag 7, 90, 209, 369, 771 (kun mænd) og 852 (kun kvinder). Gennemsnitlige plasmaniveauer fundet hos højdosis mænd (450 mg/kg/dag) på de ovenfor angivne tidspunkter var som følger: 1,54, 1,63, 1,39, 1,60 og 1,70 μg/ml (6,84, 7,26, 6,17, 7,60 og 7 μM). . Tilsvarende gennemsnitlige plasmaniveauer for højdosis-hunner for de tilsvarende tidsperioder var 1,76, 2,38, 2,12, 1,71 og 1,81 μg/mL (7,82, 10,58, 9,44, 7,62 og 8,03 μM). Plasmaniveauer hos både mænd og kvinder ved alle dosisniveauer efter et års behandling var generelt sammenlignelige med plasmaniveauer opnået ved tidligere prøveudtagninger. Værdier for laboratorietests inklusive hæmatologi, klinisk kemi og oftalmoskopi var alle inden for det normale område. Der var ingen lægemiddelinducerede grove eller mikroskopiske læsioner, og der var ingen tegn på, at acyclovir påvirkede overlevelsen.
Livstids oral kræftfremkaldende undersøgelse hos rotter
Der var ingen tegn på toksikose hos Charles River CD (Sprague-Dawley) rotter (100 rotter/køn/dosisgruppe) givet acyclovir ved oral sondeernæring ved 50, 150 og 450 mg/kg i et livslangt oralt karcinogenicitetsstudie. Gennemsnitlige plasmaniveauer opnået hos mænd med høje doser 1,5 timer efter dosering ved forskellige prøvetagningstider under undersøgelsen var som følger: 1,54, 1,63, 1,39, 1,60 og 1,70 μg/ml (6,84, 7,26, 6,17, 7,56 dage og .M) 7, 90, 209, 369 og 771. Tilsvarende middelværdier for højdosis-hunnerne var 1,76, 2,38, 2,12, 1,71 og 1,81 μg/ml (7,82, 10,58, 9,44, 7,62 og 8,03 μM) på henholdsvis dag 7, 90, 52, 82, 82, 82, 82, 82.
Værdier for kliniske laboratorietests, herunder hæmatologi, klinisk kemi, urinanalyse, kropsvægt, fødevareforbrug og oftalmoskopi var alle inden for normalområdet. Der var ingen lægemiddelinducerede grove eller mikroskopiske læsioner, og der var ingen evidens for, at acyclovir påvirkede overlevelse, tidsmæssige mønstre for tumorforekomst eller tumortal for benigne eller ondartede neoplasmer.
De fleste af de relativt få rotter, der blev fundet døde eller døende i løbet af de første 52 uger af denne undersøgelse, led af doseringsulykker, som det fremgår af postmortem fund af esophageal perforation, der forårsagede pleural effusion, lungebetændelse eller mediastinitis.
Livstids oral kræftfremkaldende undersøgelse i mus
Der var ingen tegn på toksikose hos Charles River CD-1 (ICR) mus (115 mus/køn/dosisgruppe) givet acyclovir ved oral sondeernæring ved 50, 150 og 450 mg/kg/dag i et livslangt oralt karcinogenicitetsstudie. Gennemsnitlige plasmaniveauer opnået hos højdosis mænd 1,5 time efter dosering på forskellige prøveudtagningstider under undersøgelsen var som følger: 2,83, 3,17 og 1,82 μg/mL (12,59, 14,10 og 8,10 μM) på henholdsvis dag 90, 3165 og 5. Tilsvarende middelværdier for højdosis hunnerne var 9,81, 5,85 og 4,0 μg/mL (43,60, 26,0 og 17,79 μM).
Værdier for kliniske laboratorietests inklusive hæmatologi, kropsvægt og fødevareforbrug var alle inden for normalområdet. Der var ingen lægemiddelinducerede grove eller mikroskopiske læsioner. Hunmus, der fik 150 og 450 mg/kg acyclovir, overlevede signifikant længere end kontrolhunmus; overlevelse af behandlede mænd var sammenlignelig med overlevelse af kontrol mænd. Mønstre for tumorincidens og tumortal for benigne eller maligne neoplasmer blev ikke påvirket af behandling med acyclovir.
Kronisk 12-måneders oral toksicitetsundersøgelse hos hunde
Renavlede Beagle-hunde fik 0, 15, 45 eller 150 mg/kg/dag acyclovir hver dag i de første to uger af en et-årig undersøgelse. Der var 9 han- og 9 hunhunde i hver testgruppe. Hundene fik gelatinekapsler, der indeholdt den passende dosis. De blev behandlet tid, hvorfor doseringerne administreret ved hver af tre ensartede dosisperioder var 0, 5, 15 og 50 mg/kg. Dosisniveauerne på 45 og 150 mg/kg inducerede diarré, opkastning, nedsat foderforbrug og vægttab hos både han- og hunhunde i løbet af de første to uger af undersøgelsen. Af denne grund blev det i løbet af den tredje uge af undersøgelsen truffet beslutning om at sænke middel- og højdosisniveauerne til 30 og 60 mg/kg/dag (10 og 20 mg/kg tid). Den lave dosis på 15 mg/kg/dag (5 mg/kg tid) var uændret. Hunde, der fik 60 mg/kg/dag, kastede lejlighedsvis op og havde lejlighedsvis diarré, men klarede sig godt under testens varighed, og værdier for kropsvægtforøgelse og foderforbrug var sammenlignelige med kontrolværdier.
Under toksikose induceret af de større doser af acyclovir var plasmaniveauer af lægemidlet sandsynligvis meget høje (som indikeret ved initiale middelværdier på 24,0 μg/mL (106,6 μM) for højdosis hanner og 17,4 μg/mL (77,2 μM) for højdosis hunner, når det bestemmes 1 time efter den tredje dosis på dag 1 af undersøgelsen). Målt på dag 15 var plasmaniveauer af acyclovir hos hunde med høje doser (150 mg/kg/dag) stadig meget høje, men de faldt senere, når doseringerne blev reduceret. Værdier for plasmaniveauer efter 12 måneders behandling var generelt sammenlignelige med værdier registreret efter 1, 3 og 6 måneders behandling. Der var således ingen tegn på øget metabolisme af acyclovir som følge af kronisk behandling.
løbet af den 13. uge havde nogle han- og hunhunde i både mellem- og højdoseringsniveauer følgende tegn: ømhed i forpoter, erosion af trædepuder og knækkede og løsnede negle. Regenerering af tabte negle begyndte et par uger senere. Negle regenereret efter 6 måneder (når 3 hanner og 3 hunner fra hver gruppe blev dræbt for en midlertidig ofring) og ved afslutningen af undersøgelsen var af generelt god kvalitet. Der var aldrig tegn på effekt på poter eller negle hos hunde i lavdosisgruppen (15 mg/kg/dag).
Det er accepteret, at beskadigelse af korialepitel, der producerer neglekeratin, kan resultere i standset produktion af keratin og produktion af unormal keratin. Den forbigående toksikose induceret af de store doser (45 og 150 mg/kg/dag) af acyclovir givet i løbet af de første to uger af undersøgelsen kan have påvirket korialepitelet. Hvis der var en forbigående effekt på korialepitelet (muligvis relateret til direkte effekter eller sekundært til lægemiddelinduceret sygdom i løbet af de første to uger af undersøgelsen) kunne senere tab af neglen være en følge. Der blev ikke observeret nogen mærkbar effekt på andre keratinproducerende eller keratinholdige væv. Det skal understreges, at ændringerne i neglene syntes at være relateret til den forbigående toksikose induceret af dosisniveauer på 50 og 150 mg/kg/dag testet i løbet af de første to uger af undersøgelsen og ikke til 30 og 60 mg/kg /dag dosisniveauer testet efterfølgende.
Der var ingen væsentlige lægemiddelinducerede ændringer i værdier for biokemiske serumtests, urinanalyser og elektrokardiografiske test udført med passende intervaller under denne undersøgelse. Værdier for serumalbumin og totalt protein var let faldet hos hunde behandlet med 30 og 60 mg/kg/dag i 6 og 12 måneder. Alle værdier for disse parametre forblev dog inden for grænser, der accepteres som normale.
Med undtagelse af resterende ændringer i gammelt keratin i spidsen af kløerne, var der ingen tegn på behandlingsrelaterede effekter i nogen af de væv, der blev undersøgt ved lysmikroskopi. Der var heller ikke meningsfulde ændringer i værdierne for de organer, der blev vejet ved obduktion. Således blev dosisniveauer op til 60 mg/kg/dag godt tolereret i et år. Dosisniveauet for "ingen dosiseffekt" af acyclovir var 15 mg/kg/dag (5 mg/kg tid); dog var de eneste bivirkninger ved 30 eller 60 mg/kg/dag ændringer i negle og trædepuder (30 og 60 mg/kg/dag) og milde gastrointestinale symptomer (60 mg/kg/dag).
Reproduktionsstudier
Teratologi – Rotter
Acyclovir blev administreret til drægtige ARS Sprague-Dawley hunrotter ved subkutan injektion i løbet af organogeneseperioden (dag 6 til og med dag 15 af drægtighed) i dosisniveauer på 0,0, 6,0, 12,5 og 25,0 mg/kg legemsvægt to gange dagligt.
Kriterier, der blev evalueret for sammensat effekt, omfattede moderens kropsvægt, vægtøgning, udseende og adfærd, overlevelsesrater, øjenændringer, graviditetsrater og reproduktionsdata. Afkoms levedygtighed og udvikling blev også evalueret.
Ud over de ovennævnte målinger blev udpegede dyr aflivet 1 time efter den første dosis på dag 15 for at indsamle prøver af moderens blod, fostervand og fostre til måling af lægemiddelkoncentration. Middelværdier fra disse prøver er angivet i tabel 8.
De opnåede værdier for plasma ville repræsentere ca. 30 % af initiale plasmaniveauer som bedømt ved plasmahalveringstiden hos gnavere.
Ingen virkninger, der kan tilskrives administration af acyclovir, blev noteret i sammenligninger af moderens kropsvægtværdier, udseende og adfærd, overlevelsesrater, graviditetsrater eller implantationseffektivitet. Derudover blev der ikke observeret nogen forbindelsesrelaterede forskelle i evalueringer af fosterstørrelse, køn og udvikling.
Selvom forekomsten af resorption og føtal levedygtighed var inden for området for normal variabilitet i alle grupperne, blev der observeret lidt større forekomster af resorptioner i højdosisdyrene, der blev aflivet på dag 15 og 19 af drægtighed; dog var der ikke klare dosisrelaterede tendenser.
Derfor blev acyclovir ikke betragtet som teratogent eller embryotoksisk, når det blev administreret til rotter i niveauer op til 50,0 mg/kg legemsvægt pr. dag under organogenese.
Teratologi – kaniner
En teratologisk undersøgelse blev udført i New Zealand White-kaniner under anvendelse af i det væsentlige det samme eksperimentelle design som hos rotten, bortset fra at doseringen var fra dag 6 til dag 18 af drægtighed. Også opsamling af fostre, fostervand og prøver af moderens blod fandt sted på dag 18 i stedet for dag 15.
Der blev ikke observeret tegn på maternel toksicitet ved nogen dosis, men der var en statistisk signifikant (p
Koncentrationer af acyclovir blev påvist i plasma- og fostervandsprøver såvel som i homogenater af føtalt væv. Alle prøver blev taget en time efter den første dosis på dag 18 af graviditeten. Lægemiddelkoncentrationer i fostervand var væsentligt højere end i plasma (se tabel 9).
Reproduktion – Fertilitet
Acyclovir viste sig ikke at forringe fertiliteten eller reproduktionen i grupper på 15 han- og 30 hunmus i en to-generations fertilitetsundersøgelse. Musene i denne undersøgelse fik acyclovir ved gastrisk intubation i dosisniveauer på 50, 150 og 450 mg/kg/dag. Hanner blev doseret i 64 på hinanden følgende dage før parring og hunner i 21 dage før parring.
et fertilitetsstudie med rotter, hvor grupper på 20 han- og 20 hunrotter fik 0, 12,5, 25,0 og 50,0 mg/kg/dag ved subkutan injektion, viste det sig, at acyclovir ikke havde nogen effekt på parring eller fertilitet. Hannerne blev doseret i 60 dage før parring og indtil deres parringsplan var afsluttet. Hunrotter blev doseret i 14 dage før parring og indtil dag 7 af graviditeten. Ved 50 mg/kg/dag sc var der en statistisk signifikant stigning i post-implantationstab, men ingen samtidig reduktion i kuldstørrelse.
Hos 25 hunkaniner behandlet subkutant med 50 mg/kg/dag acyclovir på dag 6 til 18 af drægtighedsperioden var der et statistisk signifikant fald i implantationseffektiviteten, men ingen samtidig reduktion i kuldstørrelse. Der var også en dosisrelateret stigning i antallet af fostre med overtallige ribben i alle lægemiddelbehandlede grupper. Denne stigning var ikke dosisrelateret, når forekomsten af overtallige ribben pr. kuld blev undersøgt.
Hos 15 hunkaniner behandlet intravenøst med 50 mg/kg/dag acyclovir på dag 6 til 18 af drægtigheden var der ingen effekt på hverken implantationseffektivitet eller kuldstørrelse.
I et peri- og postnatalt rottestudie (20 hunrotter pr. gruppe) blev acyclovir givet subkutant med 0, 12,5, 25 og 50 mg/kg/dag fra 17 dages drægtighed til 21 dage postpartum. Ved 50 mg/kg/dag sc var der et statistisk signifikant fald i gruppens gennemsnitlige antal af corpora lutea, totale implantationssteder og levende fostre i F1-generationen. Selvom det ikke var statistisk signifikant, var der også et dosisrelateret fald i gruppens gennemsnitlige antal levende fostre og implantationssteder ved 12,5 mg/kg/dag og 25 mg/kg/dag sc.
et dosisintervalfund-studie med 5 hunkaniner forårsagede intravenøs administration af acyclovir i en dosis på 100 mg/kg/dag fra dag 6 til 8 af graviditeten, en dosis, der vides at forårsage obstruktiv nefropati, en signifikant stigning i føtale resorptioner og et tilsvarende fald i kuldstørrelsen. Ved en maksimal tolereret intravenøs dosis på 50 mg/kg/dag hos kaniner var der ingen lægemiddelrelaterede reproduktionseffekter.
I et subkronisk toksicitetsstudie, hvor grupper på 20 han- og 20 hunrotter fik intraperitoneale doser af acyclovir på 0, 20, 80 eller 320 mg/kg/dag i en måned og fulgt i en periode på en måned efter dosis, var der testikel atrofi. Nogle histologiske beviser for genopretning af sædproduktion var tydelige 30 dage efter dosis, men dette var utilstrækkelig tid til at demonstrere fuld reversibilitet.
Grupper på 25 han- og 25 hunrotter fik indgivet intraperitoneale doser af acyclovir ved 0, 5, 20 eller 80 mg/kg/dag i 6 måneder. Ti han- og 10 hunrotter i hver gruppe blev fortsat udoseret i 13 uger. Testikelatrofi var begrænset til højdosis rotter givet 80 mg/kg/dag i 6 måneder. Organvægtdata og lysmikroskopi definerede fuld reversibilitet af testikelatrofien ved slutningen af restitutionsperioden efter dosis.
I et 31-dages hundestudie (16 hanner og 16 hunner pr. gruppe), hvor acyclovir blev administreret intravenøst i niveauer på 50, 100 og 200 mg/kg/dag, var testiklerne normale hos hunde ved 50 mg/kg. Doser på 100 eller 200 mg/kg/dag forårsagede død hos nogle hunde på grund af cytostatiske virkninger (knoglemarv og gastrointestinalt epitel) og aspermiske testikler eller testikler med spredte aspermiske tubuli. Det kan ikke udelukkes, at testikelændringen kan have været primær, men lignende ændringer kan observeres sekundært til alvorlig stress hos døende hunde.
Udviklingstoksicitetsundersøgelser
Neonatale rotter - subkronisk undersøgelse
Acyclovir opløst i 0,4 % sterilt saltvand blev givet ved subkutan injektion til Charles River CD (Sprague-Dawley) neonatale rotter i 19 på hinanden følgende dage, begyndende på den 3. post-partum dag. De testede dosisniveauer var 0, 5, 20 og 80 mg/kg legemsvægt. Der var 12 kuld (hver bestående af 5 han- og 5 hun-nyfødte, der ammede den naturlige moder) på hvert dosisniveau. Dæmningerne blev ikke behandlet. Nyfødte blev fjernet fra hver gruppe til obduktion og mikroskopisk evaluering af en lang række forskellige væv, inklusive øjne og flere hjernesektioner, efter at de var blevet behandlet i 5, 12 eller 19 dage og efter en 3-ugers lægemiddelfri periode efter dosis ( på hvilket tidspunkt de var 45 dage gamle). Hæmatologiske (hæmoglobin, pakket cellevolumen, RBC, WBC og differentielle celletal) og klinisk kemi (BUN) test blev udført efter 16 dages behandling og gentaget 18 dage efter den sidste (19.) dosis blev givet.
Blod blev opsamlet fra nogle nyfødte 30 minutter efter behandling på dag 1, på dag 9 og ved slutningen af dosisperioden til bestemmelse af koncentrationer af acyclovir i plasma. Den største koncentration af acyclovir i plasma var 99,1 μg/ml (440,5 μM) fundet i poolet plasma indsamlet fra 6 nyfødte kvindelige højdosis (80 mg/kg) 30 minutter efter den første dosis blev givet. Behandling med acyclovir øgede ikke dødeligheden i den neonatale periode.
Rotter i lavdosisgruppen tog lige så meget på i kropsvægt som de respektive kontrolrotter. Signifikante (p
Øjenundersøgelser og lysmikroskopi afslørede ikke uønskede virkninger på øjens udvikling. Det skal understreges, at der ikke var morfologiske eller funktionelle beviser for uønskede virkninger på udviklende hjerne eller andre dele af centralnervesystemet. Acyclovir er således tydeligt anderledes end cytosin-arabinosid, som blev rapporteret at producere fremtrædende cerebellar og retinal dysplasi hos neonatale rotter.
Mutagenicitet og andre kortsigtede undersøgelser
Acyclovir er blevet testet for mutagent potentiale i en række in vitro- og in vivo-systemer: 10. november 2014 Side 27 af 38
Mikrobiel
Acyclovir blev testet for mutagen aktivitet i Ames Salmonella-pladeassayet; i en præinkubationsmodifikation af Ames-assayet; i Rosenkrantz E. coli polA+/polA- DNA-reparationsassay; og i eukaryoten S. cerevisiae, D-4. Alle undersøgelser blev udført både i nærvær og fravær af eksogen pattedyrs metabolisk aktivering. Acyclovir gav ingen positive reaktioner i nogen af disse systemer.
De tidligere Salmonella undersøgelser blev udvidet til ekstremt høje koncentrationer for at opnå toksicitet. Ingen positive effekter blev observeret hverken i nærvær eller fravær af eksogen metabolisk aktivering af pattedyr ved koncentrationer af acyclovir op til 300 mg/plade eller 80 mg/ml.
Pattedyrs systemer
Acyclovir blev testet for mutagen aktivitet i dyrkede L5178Y muse lymfomceller, heterozygote på thymidinkinase (TK) locus, ved at måle fremadgående mutationshastighed til TK-mangel (TK+/- → TK-/-; yderligere undersøgelser blev udført på HGPRT locus og ved Ouabain-resistensmarkøren i disse samme celler. Alle undersøgelser blev udført i nærvær og i fravær af eksogen pattedyr metabolisk aktivering. Testforbindelsen var mutagent på TK locus ved høje koncentrationer (400 -2.400 μg/mL) (Til sammenligning er den øvre grænse for acyclovir-peakplasmaniveauer efter oral dosering på 200 mg q4h 0,9 μg/ml.) Den var negativ ved HGPRT-locuset og Ouabain-resistensmarkøren. Identiske resultater blev opnået med og uden metabolisk aktivering.
Inkonklusive resultater uden tilsyneladende dosis-relateret respons blev opnået, når acyclovir mutagenicitet blev undersøgt på hver af 3 loci (APRT, HGPRT og Ouabain-resistens) i kinesisk hamster-ovarieceller (CHO), både i nærvær og fravær af eksogen metabolisk aktivering.
Acyclovir, i en koncentration på 50 μg/mL (222 μM) for en 72-timers eksponering, har vist sig at forårsage en statistisk signifikant stigning i forekomsten af morfologisk transformerede foci som følge af behandling af BALB/C-3T3-celler in vitro i fraværet af eksogen metabolisk aktivering. De morfologisk transformerede foci har vist sig at vokse som tumorer efter transplantation i immunsupprimerede, syngene, fravænnede mus. Tumorvæv blev diagnosticeret som enten udifferentierede sarkomer eller lymfosarkomer.
Acyclovir, ved koncentrationer mellem 8 og 64 μg/ml i 18 timers eksponering, inducerede ikke nogen morfologisk transformerede foci blandt C3H/10T ½-celler behandlet in vitro i fravær af eksogen metabolisk aktivering.
Acyclovir, ved koncentrationer på 62,5 og 125 μg/ml for en 48-timers eksponering, inducerede ingen kromosomafvigelser i dyrkede humane lymfocytter i fravær af eksogen metabolisk aktivering. Ved højere koncentrationer, 250 og 500 μg/mL i 48 timers eksponering, forårsagede acyclovir en signifikant stigning i forekomsten af kromosombrud. Der var også et signifikant dosisrelateret fald i mitotisk indeks ved eksponering for acyclovir.
Acyclovir, ved doser på 25 og 50 mg/kg/dag ip i 5 på hinanden følgende dage, frembragte ikke en dominerende dødelig virkning hos han-BKA (CPLP) mus. Yderligere var der ingen tegn på en dominerende dødelig effekt på Charles River CD-1 (ICR) han- og hunmus behandlet oralt ved dosisniveauer på 50, 150 og 450 mg/kg/dag som opsummeret for Two Generation Reproduction/Fertility Study .
Acyclovir, ved enkelt intraperitoneale doser på 25, 50 og 100 mg/kg, kunne ikke inducere kromosomafvigelser i knoglemarvsceller hos kinesiske hamstere, når de blev undersøgt 24 timer efter dosering. Ved højere nefrotoksiske doser (500 og 1.000 mg/kg) sås en blastogen effekt. (En intraperitoneal dosis på 500 mg/kg producerer gennemsnitlige maksimale plasmaniveauer hos kinesiske hamstere på 611 μg/ml (2,72 mM), hvilket er 680 gange højere end den øvre grænse for humane maksimale plasmaniveauer under oral dosering på 200 mg q4h).
Acyclovir, ved enkelt intravenøse doser på 25, 50 og 100 mg/kg, kunne ikke inducere kromosomafvigelser i knoglemarvsceller hos han- og hunrotter, når de blev undersøgt 6, 24 og 48 timer efter behandling.
Således viste alle disse undersøgelser, at acyclovir ikke forårsager enkelt-gen mutationer, men er i stand til at bryde kromosomer.
Immunotoksikologiske undersøgelser
Acyclovir blev udsat for en række in vitro og in vivo immunologiske tests.
I to in vivo-tests, lymfocyt-medieret cytotoksicitet og neutrofil kemotaksi, viste acyclovir ingen hæmmende virkninger ved koncentrationer så høje som 135 μg/ml (600 μM). Forbindelsen hæmmede rosetdannelse ca. 50 % ved 0,9 μg/ml (4 μM).
fire in vivo-test i mus, som målte cellemedieret immunitet (komplementafhængig cellulær cytotoksicitet, komplement-uafhængig cellulær cytotoksicitet, forsinket overfølsomhed og graft vs. vært reaktion) viste acyclovir ingen hæmmende virkninger ved enkeltdoser givet op til 200 mg/kg. på dag 2 efter antigen stimulering.
Fire daglige doser på 100 mg/kg/dag havde ingen signifikant effekt på Jerne hæmolysin plaques eller cirkulerende antistof på dag 7 efter antigen stimulering. Når Jerne-hæmolysin-plakkerne og antistoftitrene blev undersøgt fire dage efter antigenpåvirkning og en dag efter den sidste lægemiddeldosis, viste 100 mg/kg kun en let undertrykkende virkning. Imidlertid gav 200 mg/kg et vist vægttab (-2,2 g), en moderat reduktion i antallet af Jerne-hæmolysin-plaques (PFC/milt blev reduceret til 33% af kontrol, PFC/107 WBC til 46,5% af kontrol). Der var dog kun en lille reduktion i den cirkulerende hæmagglutinintiter (fra 8,3 til 6,5) og den cirkulerende hæmolysintiter (fra 9,5 til 8,3) ved 200 mg/kg.
forsøg med mus designet til at teste, om acyclovir ville forstærke den immunsuppressive virkning af azathioprin på antistofdannelse, blev det fundet, at virkningerne af de to lægemidler ikke var mere end additive. Kun 200 mg/kg dosis af acyclovir viste en øget suppression af antistofrespons, når det blev givet i kombination med azathioprin i doser over 25 mg/kg.
Undersøgelser blev udført for at evaluere virkningen af acyclovir in vitro på human lymfocytfunktion. Hæmmende virkninger på blastogenese blev kun set i assays, der undersøgte topkoncentrationer af potente mitogener, phytohæmagglutinin (PHA) og concanavalin A (Con A), og kun ved koncentrationer af lægemiddel over 50 μg/ml (222 μM) og var meget mindre med monilia og tetanustoksoid-antigener, hvor det blastogene respons er karakteristisk mindre kraftigt. Der var meget lille effekt på cytotoksicitet eller LIF-produktion undtagen ved koncentrationer på 200 μg/mL (890 μM), hvor der allerede er påvist en direkte cytotoksisk effekt. Disse inhiberende koncentrationer er langt over forventede niveauer fra doser valgt til klinisk anvendelse og over 1.000 gange højere end den koncentration, der kræves for at hæmme herpesvirusformering in vitro.
Virkningen af acyclovir på humane celler blev målt. En koncentration på 11,2 - 22,5 μg/mL (50-100 μM) hæmmer opdelingen af fibroblaster i varierende omfang, afhængigt af det eksperimentelle design og sammenløbet af monolaget. Størrelsen af denne effekt var mindre end den, der var forårsaget af adenin-arabinosid eller humant leukocytinterferon, når disse tre antivirale midler blev sammenlignet ved klinisk relevante koncentrationer. Acyclovir hæmmede også thymidin-inkorporering af mononukleære celler i perifert blod stimuleret af PHA eller tre forskellige herpesvirus-antigener. En lineær dosis-responskurve blev observeret med disse celler, og deres proliferation blev 50 % hæmmet af 22,5 μg/ml (100 μM) acyclovir. Inhibering blev udøvet på T-celleproliferation uden tilsyneladende effekt på frigivelsen af lymfokiner eller på monocytfunktionen.
Det skal også nævnes, at der ikke var tegn på skadelige virkninger på immunsystemet i de detaljerede subkroniske og kroniske dyreforsøg, der er dækket tidligere i dette resumé, undtagen ved for høje doser (50 til 100 mg/kg to gange dagligt) hos hunde med markant lymfoid hypoplasi fandt sted.
REFERENCER
1. Balfour HH, Jr., Kelly JM, Suarez CS, Heussner RC, Englund JA, Crane DD et al. Acyclovir behandling af skoldkopper hos ellers raske børn. J Pediatr 1990; 116(4):633-639.
2. Balfour HH, Jr., Rotbart HA, Feldman S, Dunkle LM, Feder HM, Jr., Prober CG et al. Acyclovir behandling af skoldkopper hos ellers raske unge. Den Collaborative Acyclovir Varicella Study Group. J Pediatr 1992; 120(4 Pt 1):627-633.
3. Barry DW, Blum MR. Antivirale lægemidler: acyclovir, i de seneste fremskridt inden for klinisk farmakologi. Turner P, Shand DG (red) Churchill Livingstone, Edinburgh 1983.
4. Barry DW, Nusinoff-Lehrman S. Viral resistens i klinisk praksis: resumé af fem års erfaring med acyclovir. Farmakologiske og kliniske tilgange til herpesvirus og viruskemoterapi, Aiso, Japan, 10.-13. september 1984.
5. Barry DW, Nusinoff-Lehrman S, Ellis MN, Biron KK, Furman PA. Viral resistens, klinisk erfaring. Scand J Infect Dis Suppl 1985; 47:155-164.
6. Barry DW, Nusinoff-Lehrman S. Viral resistens i klinisk praksis: resumé af fem års erfaring med acyclovir. Proceedings of the International Symposium on Pharmacological and Clinical Approches to Herpes Viruses and Virus Chemotherapy, Elsever, Amsterdam 1985;269-270.
7. Biron KK, Elion GB. Virkning af acyclovir kombineret med andre antiherpetiske midler på varicella zoster virus in vitro. Am J Med 1982; 73(1A):54-57.
8. Boelaert J, Schurgers M, Daneels R, Van Landuyt HW, Weatherley BC. Multipel dosis farmakokinetik af intravenøs acyclovir hos patienter i kontinuerlig ambulatorisk peritonealdialyse. J Antimicrob Chemother 1987; 20(1):69-76.
9. Bryson YJ, Dillon M, Lovett M, Acuna G, Taylor S, Cherry JD et al. Behandling af første episoder af genital herpes simplex virusinfektion med oral acyclovir. Et randomiseret dobbeltblindt kontrolleret forsøg med normale forsøgspersoner. N Engl J Med 1983; 308(16):916-921.
10. Burns WH, Saral R, Santos GW, Laskin OL, Lietman PS, McLaren C et al. Isolering og karakterisering af resistent Herpes simplex virus efter acyclovirbehandling. Lancet 1982; 1(8269):421-423.
11. Christophers J, Sutton RN. Karakterisering af acyclovir-resistente og følsomme kliniske herpes simplex-virusisolater fra en immunkompromitteret patient. J Antimicrob Chemother 1987; 20(3):389-398.
12. Cole NL, Balfour HH, Jr. Varicella-Zoster-virus bliver ikke mere resistent over for acyclovir under behandlingen. J Infect Dis 1986; 153(3):605-608.
13. Collins P, Bauer DJ. Aktiviteten in vitro mod herpesvirus af 9-(2-hydroxyethoxymethyl)guanin (acycloguanosin), et nyt antiviralt middel. J Antimicrob Chemother 1979; 5(4):431-436.
14. Collins P, Oliver NM. Følsomhedsovervågning af herpes simplex-virusisolater fra patienter, der får acyclovir. J Antimicrob Chemother 1986; 18 Suppl B:103-112.
15. Collins P. Viral følsomhed efter introduktionen af acyclovir. Am J Med 1988; 85(2A):129-134.
16. Collins P, Larder BA, Oliver NM, Kemp S, Smith IW, Darby G. Karakterisering af en DNA-polymerasemutant af herpes simplex-virus fra en alvorligt immunkompromitteret patient, der modtager acyclovir. J Gen Virol 1989; 70 (Pt 2):375-382.
17. Crumpacker CS, Schnipper LE, Zaia JA, Levin MJ. Vækstinhibering af acycloguanosin af herpesvirus isoleret fra humane infektioner. Antimicrob Agents Chemother 1979; 15(5):642-645.
18. Crumpacker CS, Schnipper LE, Marlowe SI, Kowalsky PN, Hershey BJ, Levin MJ. Resistens over for antivirale lægemidler af herpes simplex virus isoleret fra en patient behandlet med acyclovir. N Engl J Med 1982; 306(6):343-346.
19. Darby G, Inglis MM, Larder BA. Mekanismer for resistens over for nukleosidanaloghæmmere af herpes simplex-virus. 6th Int Congr Virol 1984;(Abstract #W34-5).
20. De Clercq E, Descamps J, Verhelst G, Walker RT, Jones AS, Torrence PF et al. Sammenlignende effektivitet af antiherpes-lægemidler mod forskellige stammer af herpes simplex-virus. J Infect Dis 1980; 141(5):563-574.
21. De Clercq E. Sammenlignende effektivitet af antiherpes-lægemidler i forskellige cellelinjer. Antimicrob Agents Chemother 1982; 21(4):661-663.
22. Dekker C, Ellis MN, McLaren C, Hunter G, Rogers J, Barry DW. Virusresistens i klinisk praksis. J Antimicrob Chemother 1983; 12 Suppl B:137-152.
23. Douglas JM, Davis LG, Remington ML, Paulsen CA, Perrin EB, Goodman P et al. Et dobbeltblindt, placebo-kontrolleret forsøg på virkningen af kronisk administreret oral acyclovir på sædproduktion hos mænd med hyppigt tilbagevendende genital herpes. J Infect Dis 1988 Mar; 157:588-93.
24. Douglas JM, Critchlow C, Benedetti J, Mertz GJ, Connor JD, Hintz MA et al. En dobbeltblind undersøgelse af oral acyclovir til undertrykkelse af gentagelser af genital herpes simplex virusinfektion. N Engl J Med 1984; 310(24):1551-1556.
25. Dunkle LM, Arvin AM, Whitley RJ, Rotbart HA, Feder HM, Jr., Feldman S et al. Et kontrolleret forsøg med acyclovir mod skoldkopper hos normale børn. N Engl J Med 1991; 325(22):1539-1544.
26. Ellis MN, Keller PM, Martin JL, Strauss SE, Nusinoff-Lehrman S etal. Karakterisering af et HSV-2 klinisk isolat indeholdende en ACV-resistent mutant, som producerer en thymidinkinase med ændret substratspecificitet. Ninth Int Herpesvirus Workshop, Seattle, Washington, 24.-29. august 1984.
27. Ellis MN, Keller PM, Fyfe JA, Martin JL, Rooney JF, Straus SE et al. Klinisk isolat af herpes simplex virus type 2, der inducerer en thymidinkinase med ændret substratspecificitet. Antimicrob Agents Chemother 1987; 31(7):1117-1125.
28. Englund JA, Zimmerman ME, Swierkosz EM, Goodman JL, Scholl DR, Balfour HH, Jr. Herpes simplex virus resistent over for acyclovir. Et studie på et videregående center. Ann Intern Med 1990; 112(6):416-422.
29. Erlich KS, Jacobson MA, Koehler JE, Follansbee SE, Drennan DP, Gooze L et al. Foscarnet-terapi til svære acyclovir-resistente herpes simplex-virus type-2-infektioner hos patienter med erhvervet immundefektsyndrom (AIDS). Et ukontrolleret forsøg. Ann Intern Med 1989; 110(9):710-713.
30. Erlich KS, Mills J, Chatis P, Mertz GJ, Busch DF, Follansbee SE et al. Acyclovir-resistente herpes simplex-virusinfektioner hos patienter med erhvervet immundefektsyndrom. N Engl J Med 1989; 320(5):293-296.
31. Field HJ, Darby G, Wildy P. Isolering og karakterisering af acyclovir-resistente mutanter af herpes simplex virus. J Gen Virol 1980; 49(1):115-124.
32. Felt HJ. Problemet med lægemiddelinduceret resistens i vira, i problemer med antiviral terapi. Stuart-Harris CH, Oxford J (Eds) Academic Press, London 1983.
33. Fyfe K. Tilbagevendende mønstre af genital herpes efter ophør af mere end 5 års kronisk acyclovirsuppression. VIII Int Conf AIDS/III Std Wrld Cong 1992;(B240).
34. Huff JC, Bean B, Balfour HH, Jr., Laskin OL, Connor JD, Corey L et al. Terapi af herpes zoster med oral acyclovir. Am J Med 1988; 85(2A):84-89.
35. Jacobson MA, Berger TG, Fikrig S, Becherer P, Moohr JW, Stanat SC et al. Acyclovir-resistent varicella zoster virusinfektion efter kronisk oral acyclovirbehandling hos patienter med erhvervet immundefektsyndrom (AIDS). Ann Intern Med 1990; 112(3):187-191.
36. Kaplowitz LG, Baker D, Gelb L, Blythe J, Hale R, Frost P et al. Langvarig kontinuerlig acyclovirbehandling af normale voksne med hyppigt tilbagevendende genital herpes simplex virusinfektion. Acyclovir Study Group. JAMA 1991; 265(6):747-751.
37. Krasny HC, Liao SH, de Miranda P, Laskin OL, Whelton A, Lietman PS. Hæmodialyses indflydelse på acyclovirs farmakokinetik hos patienter med kronisk nyresvigt. Am J Med 1982; 73(1A):202-204.
38. Kurtz T. Sikkerhed og effekt af langvarig suppressiv cyclovir-behandling af hyppigt tilbagevendende genital herpes: år 5 resultater. 30th Intersci Conf Antimicrob Agents Chemother 1990;270.
39. Laskin OL, Longstreth JA, Whelton A, Krasny HC, Keeney RE, Rocco L et al. Virkning af nyresvigt på farmakokinetikken af acyclovir. Am J Med 1982; 73(1A):197-201.
40. Lau RJ, Emery MG, Galinsky RE. Uventet akkumulering af acyclovir i modermælk med estimering af spædbørns eksponering. Obstet Gynecol 1987; 69(3 Pt 2):468-471.
41. Lehrman SN, Douglas JM, Corey L, Barry DW. Tilbagevendende genital herpes og undertrykkende oral acyclovirbehandling. Sammenhæng mellem klinisk resultat og in vitro lægemiddelfølsomhed. Ann Intern Med 1986; 104(6):786-790.
42. Marlowe S, Douglas J, Corey L, Schnipper L, Crumpacker C. Sensitivitet af HSV genitale isolater efter oral acyclovir. 24. Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8.-10. oktober 1984.
43. Mattison HR, Reichman RC, Benedetti J, Bolgiano D, Davis LG, Bailey-Farchione A et al. Dobbeltblindet, placebokontrolleret forsøg, der sammenligner langvarig suppressiv med kortvarig oral acyclovir-behandling til behandling af tilbagevendende genital herpes. Am J Med 1988; 85(2A):20-25.
44. McLaren C, Sibrack CD, Barry DW. Spektrum af følsomhed af acyclovir af herpes simplex virus kliniske isolater. Am J Med 1982; 73(lA):376-379.
45. McLaren C, Ellis MN, Hunter GA. Et kolorimetrisk assay til måling af herpes simplex-viras følsomhed over for antivirale midler. Antiviral Res 1983; 3(4):223-234.
46. McLaren C, Corey L, Dekket C, Barry DW. In vitro følsomhed over for acyclovir i genital herpes simplex virus fra acyclovir-behandlede patienter. J Infect Dis 1983; 148(5):868-875.
47. Mertz GJ, Critchlow CW, Benedetti J, Reichman RC, Dolin R, Connor J et al. Dobbeltblindet placebokontrolleret forsøg med oral acyclovir i første episode af genital herpes simplex virusinfektion. JAMA 1984; 252(9):1147-1151.
48. Mertz GJ, Jones CC, Mills J, Fife KH, Lemon SM, Stapleton JT et al. Langsigtet acyclovir-undertrykkelse af hyppigt tilbagevendende genital herpes simplex-virusinfektion. Et multicenter dobbelt-blind forsøg. JAMA 1988; 260(2):201-206.
49. Mertz GJ, Eron L, Kaufman R, Goldberg L, Raab B, Conant M et al. Langvarig kontinuerlig versus intermitterende oral acyclovirbehandling hos normale voksne med hyppigt tilbagevendende genital herpes simplex virusinfektion. Am J Med 1988; 85(2A):14-19.
50. Meyer LJ, de Miranda P, Sheth N, Spruance S. Acyclovir i human modermælk. Am J Obstet Gynecol 1988; 158(3 Pt 1):586-588.
51. Mindel A, Weller IV, Faherty A, Sutherland S, Hindley D, Fiddian AP et al. Profylaktisk oral acyclovir ved tilbagevendende genital herpes. Lancet 1984; 2(8394):57-59.
52. Morton P, Thomson AN. Oral acyclovir til behandling af herpes zoster i almen praksis. NZ Med J 1989; 102(863):93-95.
53. Naib ZM, Nahmias AJ, Josey WE, Zaki SA. Relation mellem cytohistopatologi af genital herpesvirusinfektion og cervikal anaplasi. Cancer Res 1973; 33(6):1452-1463.
54. Nilsen AE, Aasen T, Halsos AM, Kinge BR, Tjotta EA, Wikstrom K et al. Effekten af oral acyclovir til behandling af initial og tilbagevendende genital herpes. Lancet 1982; 2(8298):571-573.
55. Nusinoff-Lehrman S, Hunter G, Rogers J, Corey L, Davis G. In vitro acyclovir-følsomheden af herpesvirus udskilles af patienter, der modtager undertrykkende oral terapi. 24th Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8.-10. oktober 1984;(Abstract #1015).
56. O'Brien JJ, Campoli-Richards DM. Acyclovir. En opdateret gennemgang af dets antivirale aktivitet, farmakokinetiske egenskaber og terapeutisk effekt. Drugs 1989; 37(3):233-309.
57. Pahwa S, Biron K, Lim W, Swenson P, Kaplan MH, Sadick N et al. Kontinuerlig varicella-zoster-infektion forbundet med acyclovirresistens hos et barn med AIDS. JAMA 1988; 260(19):2879-2882.
58. Parker AC, Craig JI, Collins P, Oliver N, Smith I. Acyclovir-resistent herpes simplex-virusinfektion på grund af ændret DNA-polymerase. Lancet 1987; 2(8573):1461.
59. Parris DS, Harrington JE. Herpes simplex-virusvarianter, der begrænser høje koncentrationer af acyclovir, findes i kliniske isolater. Antimicrob Agents Chemother 1982; 22(1):71-77.
60. Preblud SR, Arbeter AM, Proctor EA, Starr SE, Plotkin SA. Modtagelighed af vaccinestammer af varicella-zoster-virus over for antivirale forbindelser. Antimicrob Agents Chemother 1984; 25(4):417-421.
61. Reichman RC, Badger GJ, Mertz GJ, Corey L, Richman DD, Connor JD et al. Behandling af tilbagevendende genital herpes simplex-infektioner med oral acyclovir. Et kontrolleret forsøg. JAMA 1984; 251(16):2103-2107.
62. Shah GM, Winer RL, Krasny HC. Acyclovirs farmakokinetik hos en patient i kontinuerlig ambulatorisk peritonealdialyse. Am J Kidney Dis 1986; 7(6):507-510.
63. Sibrack CD, Gutman LT, Wilfert CM, McLaren C, St Clair MH, Keller PM et al. Patogenicitet af acyclovir-resistent herpes simplex virus type 1 fra et immundefekt barn. J Infect Dis 1982; 146(5):673-682.
64. Straus SE, Seidlin M, Takiff H, Jacobs D, Bowen D, Smith HA. Oral acyclovir til at undertrykke tilbagevendende herpes simplex-virusinfektioner hos immundefekte patienter. Ann Intern Med 1984; 100(4):522-524.
65. Straus SE, Takiff HE, Seidlin M, Bachrach S, Lininger L, DiGiovanna JJ et al. Undertrykkelse af hyppigt tilbagevendende genital herpes. Et placebokontrolleret dobbeltblindt forsøg med oral acyclovir. N Engl J Med 1984; 310(24):1545-1550.
66. Straus SE, Croen KD, Sawyer MH, Freifeld AG, Felser JM, Dale JK et al. Acyclovir undertrykkelse af hyppigt tilbagevendende genital herpes. Effektivitet og faldende behov under flere års behandling. JAMA 1988; 260(15):2227-2230.
67. Vinckier F, Boogaerts M, De Clerck D, De Clercq E. Kronisk herpetisk infektion hos en immunkompromitteret patient: rapport om et tilfælde. J Oral Maxillofac Surg 1987; 45(8):723-728.
68. Wade JC, Newton B, McLaren C, Flournoy N, Keeney RE, Meyers JD. Intravenøs acyclovir til behandling af mukokutan herpes simplex-virusinfektion efter marvtransplantation: et dobbeltblindt forsøg. Ann Intern Med 1982; 96(3):265-269.
69. Wade JC, McLaren C, Meyers JD. Hyppighed og betydning af acyclovir-resistent herpes simplex virus isoleret fra marvtransplanterede patienter, der modtager flere behandlingsforløb med acyclovir. J Infect Dis 1983; 148(6):1077-1082.
PATIENTOPLYSNINGER
Patienter instrueres i at rådføre sig med deres læge, hvis de oplever alvorlige eller generende bivirkninger, de bliver gravide eller har til hensigt at blive gravide, de har til hensigt at amme, mens de tager oralt administreret ZOVIRAX (acyclovir), eller de har andre spørgsmål.
Patienter bør rådes til at opretholde tilstrækkelig hydrering.
