Famvir 250mg, 500mg Famciclovir Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Famvir, og hvordan bruges det?
Famvir er en receptpligtig medicin, der bruges til at behandle symptomerne på akut herpes zoster (helvedesild), herpes labiallis og genital herpes. Famvir 250mg kan bruges alene eller sammen med anden medicin.
Famvir 250mg tilhører en klasse af lægemidler kaldet Antivirals, Other.
Det vides ikke, om Famvir er sikkert og effektivt til børn under 18 år.
Hvad er de mulige bivirkninger af Famvir 250mg?
Famvir 250mg kan forårsage alvorlige bivirkninger, herunder:
- forvirring,
- lidt eller ingen vandladning,
- hævelse i dine fødder eller ankler,
- træthed, og
- stakåndet
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Famvir 500mg omfatter:
- hovedpine, og
- kvalme
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Famvir. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Den aktive ingrediens i FAMVIR 500 mg tabletter er famciclovir, et oralt indgivet prodrug af det antivirale middel penciclovir. Kemisk er famciclovir kendt som 2-[2-(2-amino-9H-purin-9-yl)ethyl]-1,3-propandioldiacetat. Dens molekylære formel er C14H19N5O4; dens molekylvægt er 321,3. Det er et syntetisk acyklisk guaninderivat og har følgende struktur
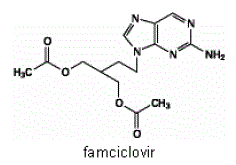
Famciclovir er et hvidt til svagt gult fast stof. Det er frit opløseligt i acetone og methanol og tungtopløseligt i ethanol og isopropanol. Ved 25°C er famciclovir frit opløseligt (>25 % w/v) i vand til at begynde med, men udfældes hurtigt som det tungtopløselige (2 %-3 % w/v) monohydrat. Famciclovir er ikke hygroskopisk under 85 % relativ luftfugtighed. Fordelingskoefficienter er: oktanol/vand (pH 4,8) P=1,09 og oktanol/phosphatbuffer (pH 7,4) P=2,08.
FAMVIR 250 mg tabletter indeholder 125 mg, 250 mg eller 500 mg famciclovir sammen med følgende inaktive ingredienser: hydroxypropylcellulose, hydroxypropylmethylcellulose, lactose, magnesiumstearat, polyethylenglycoler, natriumstivelsesglycolat og titaniumdioxid.
INDIKATIONER
Immunkompetente voksne patienter
Herpes Labialis (forkølelsessår)
FAMVIR er indiceret til behandling af recidiverende herpes labialis.
Genital Herpes
Tilbagevendende episoder:
FAMVIR er indiceret til behandling af tilbagevendende episoder med genital herpes. Effekten af FAMVIR, når den påbegyndes mere end 6 timer efter indtræden af symptomer eller læsioner, er ikke blevet fastslået.
Undertrykkende terapi:
FAMVIR 250mg er indiceret til kronisk suppressiv behandling af tilbagevendende episoder med genital herpes. Effekten og sikkerheden af FAMVIR til suppression af tilbagevendende genital herpes efter 1 år er ikke blevet fastlagt.
Herpes zoster (helvedesild)
FAMVIR 500mg er indiceret til behandling af herpes zoster. Effekten af FAMVIR, når den påbegyndes mere end 72 timer efter indtræden af udslæt, er ikke blevet fastslået.
HIV-smittede voksne patienter
Tilbagevendende Orolabial eller Genital Herpes
FAMVIR er indiceret til behandling af tilbagevendende episoder af orolabial eller genital herpes hos HIV-inficerede voksne. Effekten af FAMVIR, når den påbegyndes mere end 48 timer efter indtræden af symptomer eller læsioner, er ikke blevet fastslået.
Begrænsning af brug
Effekten og sikkerheden af FAMVIR er ikke blevet fastlagt for:
- Patienter
- Patienter med første episode af genital herpes
- Patienter med oftalmisk zoster
- Immunkompromitterede patienter bortset fra til behandling af tilbagevendende orolabial eller genital herpes hos HIV-inficerede patienter
- Sorte og afroamerikanske patienter med tilbagevendende genital herpes
DOSERING OG ADMINISTRATION
FAMVIR 500 mg kan tages med eller uden mad.
Doseringsanbefaling hos immunkompetente voksne patienter
Herpes Labialis (forkølelsessår)
Den anbefalede dosis af FAMVIR 500 mg til behandling af recidiverende herpes labialis er 1500 mg som en enkelt dosis. Behandlingen bør påbegyndes ved det første tegn eller symptom på herpes labialis (f.eks. prikken, kløe, brænden, smerte eller læsion).
Genital Herpes
Tilbagevendende episoder
Den anbefalede dosis af FAMVIR til behandling af tilbagevendende episoder med genital herpes er 1000 mg to gange dagligt i 1 dag. Behandlingen bør påbegyndes ved det første tegn eller symptom på en tilbagevendende episode (f.eks. prikken, kløe, brænden, smerte eller læsion).
Undertrykkende terapi
Den anbefalede dosis af FAMVIR 500 mg til kronisk suppressiv behandling af tilbagevendende episoder af genital herpes er 250 mg to gange dagligt.
Herpes zoster (helvedesild)
Den anbefalede dosis af FAMVIR 250 mg til behandling af herpes zoster er 500 mg hver 8. time i 7 dage. Behandlingen bør påbegyndes, så snart herpes zoster er diagnosticeret.
Doseringsanbefaling hos HIV-inficerede voksne patienter
Tilbagevendende Orolabial eller Genital Herpes
Den anbefalede dosis af FAMVIR til behandling af recidiverende orolabial eller genital herpes hos HIV-inficerede patienter er 500 mg to gange dagligt i 7 dage. Behandlingen bør påbegyndes ved det første tegn eller symptom på en tilbagevendende episode (f.eks. prikken, kløe, brænden, smerte eller læsion).
Doseringsanbefaling hos patienter med nedsat nyrefunktion
Dosisanbefalinger til voksne patienter med nedsat nyrefunktion er angivet i tabel 1 [se Brug i specifikke populationer , KLINISK FARMAKOLOGI ].
HVORDAN LEVERET
Doseringsformer og styrker
FAMVIR tabletter fås i 3 styrker:
- 125 mg: Hvide, runde filmbelagte, bikonvekse, skrå kanter, præget med "FAMVIR" på den ene side og "125" på den anden side
- 250 mg: Hvide, runde filmbelagte, bikonvekse, skrå kanter, præget med "FAMVIR" på den ene side og "250" på den anden side
- 500 mg: Hvid, oval filmovertrukket, bikonveks, præget med "FAMVIR" på den ene side og "500" på den anden side
Opbevaring og håndtering
FAMVIR tabletter leveres som filmovertrukne tabletter som følger: 125 mg i flasker med 30; 250 mg i flasker med 30; 500 mg i flasker med 30 og enkelt enhedspakninger på 50 (kun beregnet til institutionsbrug).
- FAMVIR 125 mg tablet: Hvid, rund filmovertrukket, bikonvekse, skrå kanter, præget med "FAMVIR" på den ene side og "125" på den anden side. 125 mg 30'erne NDC 0078-0366-15
- FAMVIR 250 mg tablet : Hvide, runde filmbelagte, bikonvekse, skrå kanter, præget med "FAMVIR" på den ene side og "250" på den anden. 250 mg 30'erne NDC 0078-0367-15
- FAMVIR 500 mg tablet : Hvid, oval filmbelagt, bikonveks, præget med "FAMVIR" på den ene side og "500" på den anden side. 500 mg 30'erne NDC 0078-0368-15 500 mg SUP 50'er NDC 0078-0368-64
Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F) [se USP kontrolleret rumtemperatur].
Distribueret af: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Revideret: sep 2016
BIVIRKNINGER
Akut nyresvigt er beskrevet mere detaljeret i andre sektioner af etiketten [se ADVARSLER OG FORHOLDSREGLER ].
De mest almindelige bivirkninger rapporteret i mindst 1 indikation af >10 % af voksne patienter behandlet med FAMVIR 250 mg er hovedpine og kvalme.
Erfaring med kliniske forsøg hos voksne patienter
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan de bivirkninger, der er observeret i de kliniske forsøg med et lægemiddel, ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Immunkompetente patienter
Sikkerheden af FAMVIR 250 mg er blevet evalueret i aktive og placebokontrollerede kliniske undersøgelser med 816 FAMVIR-behandlede patienter med herpes zoster (FAMVIR, 250 mg tre gange dagligt til 750 mg tre gange dagligt); 163 FAMVIR-behandlede patienter med tilbagevendende genital herpes (FAMVIR, 1000 mg to gange dagligt); 1.197 patienter med recidiverende genital herpes behandlet med FAMVIR 250 mg som suppressiv terapi (125 mg én gang dagligt til 250 mg tre gange dagligt), hvoraf 570 patienter fik FAMVIR (åbent og/eller dobbeltblindet) i mindst 10 måneder; og 447 FAMVIR-behandlede patienter med herpes labialis (FAMVIR 500 mg, 1500 mg én gang dagligt eller 750 mg to gange dagligt). Tabel 2 viser udvalgte uønskede hændelser.
Tabel 3 viser udvalgte laboratorieabnormiteter i genital herpes-undertrykkelsesforsøg.
HIV-smittede patienter
Hos HIV-inficerede patienter var de hyppigst rapporterede bivirkninger for henholdsvis FAMVIR (500 mg to gange dagligt; n=150) og acyclovir (400 mg, 5x/dag; n=143) hovedpine (17 % vs. 15 % ), kvalme (11 % vs. 13 %), diarré (7 % vs. 11 %), opkastning (5 % vs. 4 %), træthed (4 % vs. 2 %) og mavesmerter (3 % vs. 6 %).
Postmarketing oplevelse
De bivirkninger, der er anført nedenfor, er blevet rapporteret under brug af FAMVIR efter godkendelse. Fordi disse hændelser rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering:
Blod og lymfesystem lidelser : Trombocytopeni
Lever og galdevejslidelser : Unormale leverfunktionsprøver, kolestatisk gulsot
Forstyrrelser i immunsystemet : Anafylaktisk shock, anafylaktisk reaktion
Forstyrrelser i nervesystemet : Svimmelhed, somnolens, krampeanfald
Psykiatriske lidelser Forvirring (herunder delirium, desorientering og forvirringstilstand, der overvejende forekommer hos ældre), hallucinationer
Hud- og subkutane vævssygdomme : Nældefeber, erythema multiforme, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, angioødem (f.eks. ansigt, øjenlåg, periorbitalt og svælgødem), overfølsomhedsvaskulitis
Hjertelidelser : Hjertebanken
DRUGSINTERAKTIONER
Potentiale for FAMVIR 250mg til at påvirke andre lægemidler
Steady-state farmakokinetikken for digoxin blev ikke ændret ved samtidig administration af flere doser famciclovir (500 mg tre gange dagligt). Der blev ikke observeret nogen klinisk signifikant effekt på farmakokinetikken af zidovudin, dets metabolit zidovudin glucuronid eller emtricitabin efter en enkelt oral dosis på 500 mg famciclovir administreret sammen med zidovudin eller emtricitabin.
En in vitro-undersøgelse med humane levermikrosomer tyder på, at famciclovir ikke er en hæmmer af CYP3A4-enzymer.
Potentiale for andre lægemidler til at påvirke Penciclovir
Der blev ikke observeret nogen klinisk signifikante ændringer i penciclovirs farmakokinetik efter enkeltdosisadministration af 500 mg famciclovir efter forbehandling med multiple doser allopurinol, cimetidin, theophyllin, zidovudin, promethazin, når det blev givet kort efter et antacidum (magnesium og aluminiumhydroxidant). emtricitabin. Der blev ikke observeret nogen klinisk signifikant effekt på penciclovirs farmakokinetik efter administration af flere doser (tre gange dagligt) af famciclovir (500 mg) med multiple doser digoxin.
Samtidig brug med probenecid eller andre lægemidler, der signifikant elimineres ved aktiv renal tubulær sekretion, kan resultere i øgede plasmakoncentrationer af penciclovir.
Omdannelsen af 6-deoxy penciclovir til penciclovir katalyseres af aldehydoxidase. Interaktioner med andre lægemidler, der metaboliseres af dette enzym og/eller hæmmer dette enzym, kan potentielt forekomme. Kliniske interaktionsundersøgelser af famciclovir med cimetidin og promethazin, in vitro-hæmmere af aldehydoxidase, viste ikke relevante effekter på dannelsen af penciclovir. Raloxifen, en potent aldehydoxidasehæmmer in vitro, kan mindske dannelsen af penciclovir. Der er dog ikke udført et klinisk lægemiddelinteraktionsstudie for at bestemme omfanget af interaktionen mellem penciclovir og raloxifen.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Akut nyresvigt
Tilfælde af akut nyresvigt er blevet rapporteret hos patienter med underliggende nyresygdom, som har modtaget uhensigtsmæssige høje doser af FAMVIR for deres nyrefunktionsniveau. Dosisreduktion anbefales ved administration af FAMVIR til patienter med nedsat nyrefunktion [se DOSERING OG ADMINISTRATION , Brug i specifikke populationer ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning (patientinformation).
Der er ingen tegn på, at FAMVIR vil påvirke en patients evne til at køre bil eller betjene maskiner. Patienter, der oplever svimmelhed, somnolens, forvirring eller andre forstyrrelser i centralnervesystemet, mens de tager FAMVIR 500 mg, bør dog afstå fra at køre bil eller betjene maskiner.
Fordi FAMVIR indeholder lactose (FAMVIR 125 mg, 250 mg og 500 mg tabletter indeholder henholdsvis 26,9 mg, 53,7 mg og 107,4 mg lactose), bør patienter med sjældne arvelige problemer med galactoseintolerance, en alvorlig laktasemangel-malabsorption være galaktisk eller glucosemangel. rådes til at diskutere med deres læge, før de tager FAMVIR.
Herpes Labialis (forkølelsessår)
Patienter bør rådes til at påbegynde behandling ved det tidligste tegn eller symptom på en tilbagevenden af forkølelsessår (f.eks. prikken, kløe, svie, smerte eller læsion). Patienter bør instrueres i, at behandling af forkølelsessår ikke bør overstige 1 dosis. Patienterne skal informeres om, at FAMVIR ikke er en kur mod forkølelsessår.
Genital Herpes
Patienterne skal informeres om, at FAMVIR ikke er en kur mod genital herpes. Der er ingen data, der vurderer, om FAMVIR vil forhindre overførsel af infektion til andre. Fordi genital herpes er en seksuelt overført sygdom, bør patienter undgå kontakt med læsioner eller samleje, når læsioner og/eller symptomer er til stede for at undgå at inficere partnere. Genital herpes overføres ofte i mangel af symptomer gennem asymptomatisk viral udskillelse. Derfor bør patienter rådes til at bruge sikrere sex-praksis.
Hvis episodisk behandling for tilbagevendende genital herpes er indiceret, bør patienterne rådes til at påbegynde behandling ved det første tegn eller symptom på en episode.
Der er ingen data om sikkerhed eller effektivitet af kronisk suppressiv behandling af længere varighed end 1 år.
Herpes zoster (helvedesild)
Der er ingen data om behandling påbegyndt mere end 72 timer efter debut af zosterudslæt. Patienter bør rådes til at påbegynde behandling så hurtigt som muligt efter en diagnose af herpes zoster.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
To-årige diætcarcinogenicitetsundersøgelser med famciclovir blev udført på rotter og mus. En stigning i forekomsten af brystadenokarcinom (en almindelig tumor hos dyr af denne stamme) blev set hos hunrotter, der fik den høje dosis på 600 mg/kg/dag (1,1 til 4,5 gange den humane systemiske eksponering ved den anbefalede totale daglige orale dosis spænder mellem 500 mg og 2000 mg, baseret på arealet under plasmakoncentrationskurvens sammenligninger [24 timers AUC] for penciclovir). Ingen stigninger i tumorincidens blev rapporteret hos hanrotter behandlet med doser på op til 240 mg/kg/dag (0,7 til 2,7x den humane AUC) eller hos han- og hunmus ved doser op til 600 mg/kg/dag (0,3 til 1,2x den humane AUC).
Mutagenese
Famciclovir og penciclovir (den aktive metabolit af famciclovir) blev testet for genotoksisk potentiale i en række in vitro og in vivo assays. Famciclovir og penciclovir var negative i in vitro-tests for genmutationer i bakterier (S. typhimurium og E. coli) og uplanlagt DNA-syntese i pattedyrs HeLa 83-celler (ved doser op til henholdsvis 10.000 og 5.000 mcg/plade). Famciclovir var også negativ i L5178Y muselymfomanalysen (5000 mcg/ml), in vivo muse mikronukleustest (4800 mg/kg) og rottedominant dødelig undersøgelse (5000 mg/kg). Famciclovir inducerede stigninger i polyploidi i humane lymfocytter in vitro i fravær af kromosombeskadigelse (1200 mcg/ml). Penciclovir var positivt i L5178Y muselymfomassay for genmutation/kromosomafvigelser med og uden metabolisk aktivering (1000 mcg/ml). I humane lymfocytter forårsagede penciclovir kromosomafvigelser i fravær af metabolisk aktivering (250 mcg/ml). Penciclovir forårsagede en øget forekomst af mikrokerner i museknoglemarv in vivo, når det blev administreret intravenøst i doser, der var meget toksiske for knoglemarv (500 mg/kg), men ikke ved oral administration.
Forringelse af fertilitet
Testikeltoksicitet blev observeret hos rotter, mus og hunde efter gentagen administration af famciclovir eller penciclovir. Testikelforandringer omfattede atrofi af sædrørene, reduktion i sædtal og/eller øget forekomst af sædceller med unormal morfologi eller nedsat motilitet. Graden af toksicitet for mandlig reproduktion var relateret til dosis og eksponeringsvarighed. Hos hanrotter blev der observeret nedsat fertilitet efter 10 ugers dosering med 500 mg/kg/dag (1,4 til 5,7x den humane AUC). Niveauet for ingen observerbar effekt for sæd- og testikeltoksicitet hos rotter efter kronisk administration (26 uger) var 50 mg/kg/dag (0,15 til 0,6x den humane systemiske eksponering baseret på AUC-sammenligninger). Testikeltoksicitet blev observeret efter kronisk administration til mus (104 uger) og hunde (26 uger) ved doser på 600 mg/kg/dag (0,3 til 1,2x den humane AUC) og 150 mg/kg/dag (1,3 til 5,1x human AUC).
Famciclovir havde ingen effekt på generel reproduktionsevne eller fertilitet hos hunrotter ved doser op til 1000 mg/kg/dag (2,7 til 10,8x den humane AUC).
To placebokontrollerede undersøgelser med i alt 130 ellers raske mænd med en normal sædprofil over en 8-ugers basislinjeperiode og tilbagevendende genital herpes, der fik oral FAMVIR (250 mg to gange dagligt) (n=66) eller placebo (n=64) behandling i 18 uger viste ingen tegn på signifikante effekter på sædceller, motilitet eller morfologi under behandling eller under en 8-ugers opfølgning.
Brug i specifikke populationer
Graviditet
Graviditetskategori B
Efter oral administration omdannes famciclovir (prodrug) til penciclovir (aktivt lægemiddel). Der er ingen tilstrækkelige og velkontrollerede undersøgelser af brug af famciclovir eller penciclovir hos gravide kvinder. Ingen bivirkninger på embryoføtal udvikling blev observeret i reproduktionsundersøgelser hos dyr med famciclovir og penciclovir i doser højere end den maksimalt anbefalede humane dosis (MRHD) og human eksponering. Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør famciclovir kun anvendes under graviditet, hvis det er nødvendigt.
reproduktionsstudier på dyr modtog gravide rotter og kaniner oral famciclovir i doser (op til 1000 mg/kg/dag), der gav 2,7 til 10,8 gange (rotter) og 1,4 til 5,4 gange (kaniner) den humane systemiske eksponering baseret på AUC. Ingen bivirkninger blev observeret på embryo-føtal udvikling. I andre undersøgelser fik gravide rotter og kaniner intravenøs famciclovir i doser (360 mg/kg/dag) 1,5 til 6 gange (rotter) og (120 mg/kg/dag) 1,1 til 4,5 gange (kaniner) eller penciclovir i doser (80) mg/kg/dag) 0,3 til 1,3 gange (rotter) og (60 mg/kg/dag) 0,5 til 2,1 gange (kaniner) MRHD baseret på sammenligninger af kropsoverfladearealer. Ingen bivirkninger blev observeret på embryo-føtal udvikling.
Rapportering af graviditetseksponering
For at overvåge moder-føtale resultater hos gravide kvinder, der er udsat for FAMVIR 500mg, vedligeholder Novartis Pharmaceuticals Corporation et FAMVIR graviditetsrapporteringssystem. Læger opfordres til at rapportere deres patienter ved at ringe til 1-888-NOW-NOVA (669-6682).
Ammende mødre
Det vides ikke, om famciclovir (prodrug) eller penciclovir (aktivt lægemiddel) udskilles i human mælk. Efter oral administration af famciclovir til diegivende rotter blev penciclovir udskilt i modermælk i koncentrationer, der var højere end dem, der ses i plasma. Der er ingen data om sikkerheden af FAMVIR 250mg hos spædbørn. FAMVIR 500mg bør ikke anvendes til ammende mødre, medmindre de potentielle fordele anses for at opveje de potentielle risici forbundet med behandlingen.
Pædiatrisk brug
Effekten af FAMVIR 250 mg er ikke blevet fastslået hos pædiatriske patienter. Den farmakokinetiske profil og sikkerhed af famciclovir (eksperimentelle granulat blandet med OraSweet® eller tabletter) blev undersøgt i 3 åbne undersøgelser.
Studie 1 var en enkeltdosis farmakokinetisk og sikkerhedsundersøgelse hos spædbørn i alderen 1 måned til
Studie 2 var et åbent, enkeltdosis farmakokinetisk sikkerhedsstudie med flere doser af famciclovir eksperimentelle granulat blandet med OraSweet hos børn i alderen 1 til
alt 100 patienter blev inkluderet i sikkerhedsdelen af flere doser af undersøgelsen; 47 forsøgspersoner med aktiv eller latent HSV-infektion og 53 forsøgspersoner med skoldkopper. Patienter med aktiv eller latent HSV-infektion fik famciclovir to gange dagligt i 7 dage. Den daglige dosis af famciclovir varierede fra 150 mg til 500 mg to gange dagligt afhængigt af patientens kropsvægt. Patienter med skoldkopper fik famciclovir tre gange dagligt i 7 dage. Den daglige dosis af famciclovir varierede fra 150 mg til 500 mg tre gange dagligt afhængigt af patientens kropsvægt. De kliniske uønskede hændelser og abnormiteter i laboratorietestene, der blev observeret i denne undersøgelse, svarede til dem, der blev set hos voksne. De tilgængelige data er utilstrækkelige til at understøtte brugen af famciclovir til behandling af børn i alderen 1 til
Skoldkopper
Effekten af famciclovir til behandling af skoldkopper er ikke blevet fastslået hos hverken pædiatriske eller voksne patienter. Famciclovir er godkendt til behandling af herpes zoster hos voksne patienter. Ekstrapolering af effektdata fra voksne med herpes zoster til børn med skoldkopper ville imidlertid ikke være passende. Selvom skoldkopper og herpes zoster er forårsaget af den samme virus, er sygdommene forskellige.
Genital Herpes
Klinisk information om genital herpes hos børn er begrænset. Effektdata fra voksne kan derfor ikke ekstrapoleres til denne population. Endvidere er famciclovir ikke blevet undersøgt hos børn i alderen 1 til
Herpes Labialis
Der er ingen farmakokinetiske data og sikkerhedsdata hos børn i alderen 1 til
Studie 3 var et åbent, enkeltarmsstudie til evaluering af farmakokinetik, sikkerhed og antiviral aktivitet af en enkelt 1500 mg dosis (tre 500 mg tabletter) af famciclovir hos børn 12 til
et fase 3-forsøg med voksne, hvor patienter fik en enkelt 1500 mg dosis famciclovir eller placebo, var mediantiden til heling blandt patienter med ikke-aborterede læsioner 4,4 dage i famciclovir 1500 mg enkeltdosisgruppen og 6,2 dage i placebo gruppe. Det skal bemærkes, at i voksenstudiet blev behandlingen påbegyndt af patienter inden for 1 time efter symptomernes begyndelse [se Kliniske Studier ]. Baseret på effektivitetsresultaterne i undersøgelse 3 anbefales famciclovir ikke til børn i alderen 12 til
Geriatrisk brug
Af 816 patienter med herpes zoster i kliniske undersøgelser, som blev behandlet med FAMVIR, var 248 (30,4%) ≥65 år og 103 (13%) var ≥75 år. Der blev ikke observeret nogen overordnede forskelle i forekomst eller typer af bivirkninger mellem yngre og ældre patienter. Af 610 patienter med recidiverende herpes simplex (type 1 eller type 2) i kliniske undersøgelser, som blev behandlet med FAMVIR 500 mg, var 26 (4,3 %) >65 år og 7 (1,1 %) >75 år. Kliniske undersøgelser af FAMVIR 500 mg hos patienter med recidiverende genital herpes omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes sammenlignet med yngre forsøgspersoner.
Ingen famciclovir-dosisjustering baseret på alder anbefales, medmindre nyrefunktionen er nedsat [se DOSERING OG ADMINISTRATION , KLINISK FARMAKOLOGI ]. Generelt bør der udvises passende forsigtighed ved administration og monitorering af FAMVIR 250 mg til ældre patienter, hvilket afspejler den større hyppighed af nedsat nyrefunktion og samtidig brug af andre lægemidler.
Patienter med nedsat nyrefunktion
Tilsyneladende plasmaclearance, renal clearance og plasma-elimineringshastighedskonstanten for penciclovir faldt lineært med reduktioner i nyrefunktionen. Efter administration af en enkelt 500 mg famciclovir oral dosis (n=27) til raske frivillige og til frivillige med varierende grader af nedsat nyrefunktion (CLCR varierede fra 6,4 til 138,8 ml/min), blev følgende resultater opnået (tabel 4):
I et flerdosisstudie af famciclovir udført i forsøgspersoner med varierende grader af nedsat nyrefunktion (n=18), var farmakokinetikken for penciclovir sammenlignelig med farmakokinetikken efter enkeltdoser.
En dosisjustering anbefales til patienter med nedsat nyrefunktion [se DOSERING OG ADMINISTRATION ].
Patienter med nedsat leverfunktion
Mild eller moderat nedsat leverfunktion (kronisk hepatitis [n=6], kronisk ethanolmisbrug [n=8] eller primær biliær cirrhose [n=1]) havde ingen effekt på omfanget af tilgængelighed (AUC) af penciclovir efter en enkelt dosis 500 mg famciclovir. Der var dog et fald på 44 % i penciclovir gennemsnitlig maksimal plasmakoncentration (Cmax), og tiden til maksimal plasmakoncentration (tmax) blev øget med 0,75 timer hos patienter med nedsat leverfunktion sammenlignet med normale frivillige. Ingen dosisjustering anbefales til patienter med let eller moderat nedsat leverfunktion. Penciclovirs farmakokinetik er ikke blevet evalueret hos patienter med svært nedsat leverfunktion. Omdannelse af famciclovir til den aktive metabolit penciclovir kan være svækket hos disse patienter, hvilket resulterer i lavere penciclovir plasmakoncentrationer og dermed muligvis et fald i famciclovirs effekt [se KLINISK FARMAKOLOGI ].
Sorte og afroamerikanske patienter
et randomiseret, dobbeltblindt, placebokontrolleret forsøg udført med 304 immunkompetente sorte og afroamerikanske voksne med tilbagevendende genital herpes var der ingen forskel i median tid til heling mellem patienter, der fik FAMVIR eller placebo. Generelt svarede bivirkningsprofilen til den, der blev observeret i andre FAMVIR kliniske undersøgelser for voksne patienter [se BIVIRKNINGER ]. Relevansen af disse undersøgelsesresultater for andre indikationer hos sorte og afroamerikanske patienter er ukendt [se Kliniske Studier ].
OVERDOSIS
Der bør gives passende symptomatisk og understøttende behandling. Penciclovir fjernes ved hæmodialyse.
KONTRAINDIKATIONER
FAMVIR 250mg er kontraindiceret til patienter med kendt overfølsomhed over for produktet, dets komponenter eller Denavir® (penciclovircreme).
KLINISK FARMAKOLOGI
Handlingsmekanisme
Famciclovir er et oralt administreret prodrug af det antivirale middel penciclovir [se Mikrobiologi ].
Farmakokinetik
Famciclovir er diacetyl 6-deoxy-analogen af den aktive antivirale forbindelse penciclovir. Efter oral administration undergår famciclovir en hurtig og omfattende metabolisme til penciclovir, og lidt eller intet famciclovir påvises i plasma eller urin. Penciclovir elimineres overvejende uændret af nyrerne. Derfor skal dosis af FAMVIR 500 mg justeres hos patienter med forskellige grader af nedsat nyrefunktion [se DOSERING OG ADMINISTRATION ].
Farmakokinetik hos voksne
Absorption og biotilgængelighed:
Den absolutte biotilgængelighed af penciclovir er 77 ± 8 % som bestemt efter administration af en oral dosis på 500 mg famciclovir og en intravenøs dosis på 400 mg penciclovir til 12 raske mandlige forsøgspersoner.
Penciclovirkoncentrationerne steg proportionalt med dosis over et dosisområde af famciclovir på 125 mg til 1000 mg administreret som en enkelt dosis. Tabel 5 viser de gennemsnitlige farmakokinetiske parametre for penciclovir efter enkelt administration af FAMVIR til raske mandlige frivillige.
Efter oral enkeltdosis administration af 500 mg famciclovir til 7 patienter med herpes zoster var AUC (gennemsnit ± SD), Cmax og tmax 12,1±1,7 mcg time/ml, 4,0±0,7 mcg/ml og 0,7±0,2 timer , henholdsvis. AUC for penciclovir var ca. 35 % større hos patienter med herpes zoster sammenlignet med raske frivillige. Noget af denne forskel kan skyldes forskelle i nyrefunktionen mellem de 2 grupper.
Der er ingen akkumulering af penciclovir efter administration af 500 mg famciclovir tre gange dagligt i 7 dage.
Penciclovir Cmax faldt ca. 50 %, og tmax blev forsinket med 1,5 time, når en kapselformulering af famciclovir blev administreret sammen med mad (ernæringsindholdet var ca. 910 Kcal og 26 % fedt). Der var ingen effekt på omfanget af tilgængelighed (AUC) af penciclovir. Der var et fald på 18 % i Cmax og en forsinkelse i tmax på ca. 1 time, når famciclovir blev givet 2 timer efter et måltid sammenlignet med dets administration 2 timer før et måltid. Da der ikke var nogen effekt på omfanget af systemisk tilgængelighed af penciclovir, kan FAMVIR 250 mg tages uden hensyntagen til måltider.
Fordeling:
Fordelingsvolumenet (Vdβ) var 1,08±0,17 l/kg hos 12 raske mandlige forsøgspersoner efter en enkelt intravenøs dosis af penciclovir på 400 mg indgivet som en 1-times intravenøs infusion. Penciclovir er
Metabolisme:
Efter oral administration deacetyleres famciclovir og oxideres til dannelse af penciclovir. Metabolitter, der er inaktive, omfatter 6-deoxy penciclovir, monoacetyleret penciclovir og 6-deoxy monoacetyleret penciclovir (henholdsvis 5 %, DRUGSINTERAKTIONER ].
Elimination:
Ca. 94 % af den administrerede radioaktivitet blev genfundet i urinen over 24 timer (83 % af dosis blev udskilt i de første 6 timer) efter administration af 5 mg/kg radioaktivt mærket penciclovir som en 1-times infusion til 3 raske mandlige frivillige. Penciclovir tegnede sig for 91 % af den radioaktivitet, der blev udskilt i urinen.
Efter oral administration af en enkelt dosis på 500 mg radioaktivt mærket famciclovir til 3 raske mandlige frivillige, blev henholdsvis 73 % og 27 % af den administrerede radioaktivitet genfundet i urin og fæces i løbet af 72 timer. Penciclovir tegnede sig for 82 % og 6-deoxy penciclovir stod for 7 % af radioaktiviteten udskilt i urinen. Ca. 60 % af den administrerede radioaktivt mærkede dosis blev opsamlet i urinen i løbet af de første 6 timer.
Efter intravenøs administration af penciclovir hos 48 raske mandlige frivillige var gennemsnitlig ± SD total plasmaclearance af penciclovir 36,6±6,3 l/time (0,48±0,09 l/time/kg). Penciclovir renal clearance tegnede sig for 74,5±8,8 % af total plasmaclearance.
Renal clearance af penciclovir efter oral administration af en enkelt 500 mg dosis famciclovir til 109 raske mandlige frivillige var 27,7±7,6 l/time. Aktiv tubulær sekretion bidrager til renal elimination af penciclovir.
Plasmaelimineringshalveringstiden for penciclovir var 2,0±0,3 timer efter intravenøs administration af penciclovir til 48 raske mandlige frivillige og 2,3±0,4 timer efter oral administration af 500 mg famciclovir til 124 raske mandlige frivillige. Halveringstiden hos 17 patienter med herpes zoster var 2,8±1,0 timer og 2,7±1,0 timer efter henholdsvis enkelt- og gentagne doser.
Særlige Populationer
Geriatriske patienter
Baseret på krydsundersøgelsessammenligning var penciclovir AUC 40 % højere, og penciclovir renal clearance var 22 % lavere hos ældre forsøgspersoner (n=18, alder 65-79 år) sammenlignet med yngre forsøgspersoner. Noget af denne forskel kan skyldes forskelle i nyrefunktionen mellem de 2 grupper. Ingen famciclovir-dosisjustering baseret på alder anbefales, medmindre nyrefunktionen er nedsat [se DOSERING OG ADMINISTRATION , Brug i specifikke populationer ]
Patienter med nedsat nyrefunktion
Hos personer med varierende grader af nedsat nyrefunktion faldt tilsyneladende plasmaclearance, renal clearance og plasma-elimineringshastighedskonstanten for penciclovir lineært med nedsat nyrefunktion efter både enkelt og gentagen dosering [se Brug i specifikke populationer ]. En dosisjustering anbefales til patienter med nedsat nyrefunktion [se DOSERING OG ADMINISTRATION ].
Patienter med nedsat leverfunktion
Mild eller moderat nedsat leverfunktion havde ingen effekt på omfanget af tilgængelighed (AUC) af penciclovir [se Brug i specifikke populationer ]. Ingen dosisjustering anbefales til patienter med let eller moderat nedsat leverfunktion. Virkningen af alvorlig leverinsufficiens på penciclovirs farmakokinetik er ikke blevet evalueret.
HIV-smittede patienter
Efter oral administration af en enkelt dosis på 500 mg famciclovir til HIV-positive patienter var de farmakokinetiske parametre for penciclovir sammenlignelige med dem, der blev observeret hos raske forsøgspersoner.
Køn
Penciclovirs farmakokinetik blev evalueret hos 18 raske mandlige og 18 raske kvindelige frivillige efter oral enkeltdosis administration af 500 mg famciclovir. AUC for penciclovir var 9,3±1,9 mcg time/ml og 11,1±2,1 mcg time/ml hos henholdsvis mænd og kvinder. Penciclovir renal clearance var henholdsvis 28,5±8,9 l/time og 21,8±4,3 l/time. Disse forskelle blev tilskrevet forskelle i nyrefunktionen mellem de 2 grupper. Ingen famciclovir dosisjustering baseret på køn anbefales.
Race
En retrospektiv evaluering blev udført for at sammenligne de farmakokinetiske parametre opnået hos sorte og kaukasiske forsøgspersoner efter enkelt og gentaget én gang dagligt, to gange dagligt eller tre gange dagligt administration af famciclovir 500 mg. Data fra et studie med raske frivillige (enkeltdosis), et studie med forsøgspersoner med varierende grader af nedsat nyrefunktion (enkelt- og gentagen dosis) og en undersøgelse med forsøgspersoner med nedsat leverfunktion (enkeltdosis) viste ikke nogen signifikante forskelle i farmakokinetikken af penciclovir mellem sorte og kaukasiske forsøgspersoner.
Mikrobiologi
Handlingsmekanisme
Famciclovir er et prodrug af penciclovir, som har vist hæmmende aktivitet mod herpes simplex virus type 1 (HSV-1) og 2 (HSV-2) og varicella zoster virus (VZV). I celler inficeret med HSV-1, HSV-2 eller VZV phosphorylerer den virale thymidinkinase penciclovir til en monophosphatform, der igen omdannes af cellulære kinaser til den aktive form penciclovirtriphosphat. Biokemiske undersøgelser viser, at penciclovirtriphosphat hæmmer HSV-2 DNA-polymerase konkurrerende med deoxyguanosintriphosphat. Følgelig hæmmes herpes viral DNA-syntese og derfor replikation selektivt. Penciclovirtriphosphat har en intracellulær halveringstid på 10 timer i HSV-1-, 20 timer i HSV-2 og 7 timer i VZV-inficerede celler dyrket i kultur. Imidlertid er den kliniske betydning af den intracellulære halveringstid ukendt.
Antiviral aktivitet
cellekulturundersøgelser hæmmer penciclovir følgende herpesvirus: HSV-1, HSV-2 og VZV. Den antivirale aktivitet af penciclovir mod vildtype-stammer dyrket på humane forhudsfibroblaster blev vurderet med et plakreduktionsassay og farvning med krystalviolet 3 dage efter infektion for HSV og 10 dage efter infektion for VZV. De mediane EC50-værdier for penciclovir mod laboratorie- og kliniske isolater af HSV-1, HSV-2 og VZV var 2 μM (interval 1,2 til 2,4 μM, n=7), 2,6 μM (interval 1,6 til 11 μM, n=6) henholdsvis 34 μM (interval 6,7 til 71 μM, n=6).
Modstand
Penciclovir-resistente mutanter af HSV og VZV kan skyldes mutationer i de virale thymidinkinase (TK) og DNA-polymerasegenerne. Mutationer i det virale TK-gen kan føre til fuldstændigt tab af TK-aktivitet (TK-negativ), reducerede niveauer af TK-aktivitet (partiel TK) eller ændring i viral TK's evne til at fosforylere lægemidlet uden et tilsvarende tab i evnen til at fosforylere thymidin (TK ændret). De mediane EC50-værdier observeret i en plakreduktionsanalyse med penciclovir-resistent HSV-1, HSV-2 og VZV var 69 μM (interval 14 til 115 μM, n=6), 46 μM (interval 4 til >395 μM, n= 9) og 92 μM (interval 51 til 148 μM, n=4). Muligheden for viral resistens over for penciclovir bør overvejes hos patienter, som ikke reagerer eller oplever tilbagevendende viral udskillelse under behandlingen.
Krydsmodstand
Krydsresistens er blevet observeret blandt HSV DNA-polymerasehæmmere. De mest almindeligt forekommende acyclovir-resistente mutanter, der er TK-negative, er også resistente over for penciclovir.
Kliniske Studier
Herpes Labialis (forkølelsessår)
Et randomiseret, dobbeltblindt, placebokontrolleret forsøg blev udført med 701 immunkompetente voksne med tilbagevendende herpes labialis. Patienter selv-initieret behandling inden for 1 time efter første indtræden af tegn eller symptomer på en tilbagevendende herpes labialis-episode med FAMVIR 1500 mg som en enkelt dosis (n=227), FAMVIR 750 mg to gange dagligt (n=220) eller placebo (n= 254) i 1 dag. Mediantiden til heling blandt patienter med ikke-aborterede læsioner (fremskridt ud over papulstadiet) var 4,4 dage i FAMVIR 1500 mg enkeltdosisgruppen (n=152) sammenlignet med 6,2 dage i placebogruppen (n=168) . Medianforskellen i tid til heling mellem placebo- og FAMVIR 1500 mg-behandlede grupper var 1,3 dage (95 % CI: 0,6-2,0). Der blev ikke observeret forskelle i andelen af patienter med aborterede læsioner (der ikke udviklede sig ud over papulstadiet) mellem patienter, der fik FAMVIR 250 mg eller placebo: 33 % for FAMVIR 1500 mg enkeltdosis og 34 % for placebo. Mediantiden til tab af smerte og ømhed var 1,7 dage hos FAMVIR 1500 mg enkeltdosisbehandlede patienter versus 2,9 dage hos placebobehandlede patienter.
Genital Herpes
Tilbagevendende episoder
Et randomiseret, dobbeltblindt, placebokontrolleret forsøg blev udført med 329 immunkompetente voksne med tilbagevendende genital herpes. Patienterne påbegyndte selv behandling inden for 6 timer efter det første tegn eller symptom på en tilbagevendende genital herpesepisode med enten FAMVIR 1000 mg to gange dagligt (n=163) eller placebo (n=166) i 1 dag. Mediantiden til heling blandt patienter med ikke-aborterede læsioner (fremskridt ud over papulstadiet) var 4,3 dage hos FAMVIR-behandlede patienter (n=125) sammenlignet med 6,1 dage hos placebobehandlede patienter (n=145). Medianforskellen i tid til heling mellem placebo- og FAMVIR-behandlede grupper var 1,2 dage (95 % CI: 0,5 til 2,0). Treogtyve procent af FAMVIR-behandlede patienter havde aborterede læsioner (ingen læsionsudvikling ud over erytem) mod 13 % hos placebo-behandlede patienter. Mediantiden til tab af alle symptomer (f.eks. snurren, kløe, svie, smerte eller ømhed) var 3,3 dage hos FAMVIR-behandlede patienter vs. 5,4 dage hos placebobehandlede patienter.
Et randomiseret (2:1), dobbeltblindt, placebokontrolleret forsøg blev udført med 304 immunkompetente sorte og afroamerikanske voksne med tilbagevendende genital herpes. Patienterne påbegyndte selvbehandling inden for 6 timer efter det første tegn eller symptom på en tilbagevendende genital herpesepisode med enten FAMVIR 1000 mg to gange dagligt (n=206) eller placebo (n=98) i 1 dag. Mediantiden til heling blandt patienter med ikke-aborterede læsioner var 5,4 dage hos FAMVIR-behandlede patienter (n=152) sammenlignet med 4,8 dage hos placebobehandlede patienter (n=78). Medianforskellen i tid til heling mellem placebo- og FAMVIR-behandlede grupper var -0,26 dage (95 % CI: -0,98 til 0,40).
Undertrykkende terapi
To randomiserede, dobbeltblindede, placebokontrollerede, 12-måneders forsøg blev udført i 934 immunkompetente voksne med en historie med 6 eller flere gentagelser af genital herpes-episoder om året. Sammenligninger inkluderede FAMVIR 125 mg tre gange dagligt, 250 mg to gange dagligt, 250 mg tre gange dagligt og placebo. Efter 12 måneder fik 60 % til 65 % af patienterne stadig FAMVIR, og 25 % fik placebobehandling. Hyppigheden af tilbagefald efter 6 og 12 måneder hos patienter behandlet med 250 mg to gange daglig dosis er vist i tabel 6.
FAMVIR-behandlede patienter havde ca. 1/5 af det gennemsnitlige antal tilbagefald sammenlignet med placebo-behandlede patienter. Højere doser af FAMVIR 250 mg var ikke forbundet med øget effekt.
Tilbagevendende orolabial eller genital herpes hos HIV-inficerede patienter
Et randomiseret, dobbeltblindt forsøg sammenlignede famciclovir 500 mg to gange dagligt i 7 dage (n=150) med oral acyclovir 400 mg 5 gange dagligt i 7 dage (n=143) hos HIV-inficerede patienter med tilbagevendende orolabial eller genital herpes behandlet inden for 48 timers begyndelse af læsionen. Ca. 40 % af patienterne havde et CD4+-tal under 200 celler/mm3, 54 % af patienterne havde anogenitale læsioner og 35 % havde orolabiale læsioner. Famciclovir-terapi var sammenlignelig med oral acyclovir med hensyn til at reducere dannelsen af nye læsioner og i tid til fuldstændig heling.
Herpes zoster (helvedesild)
To randomiserede, dobbeltblindede forsøg, 1 placebo-kontrolleret og 1 aktiv-kontrolleret, blev udført i 964 immunkompetente voksne med ukompliceret herpes zoster. Behandlingen blev påbegyndt inden for 72 timer efter første læsions fremkomst og blev fortsat i 7 dage.
det placebokontrollerede forsøg blev 419 patienter behandlet med enten FAMVIR 500 mg tre gange dagligt (n=138), FAMVIR 750 mg tre gange dagligt (n=135) eller placebo (n=146). Mediantiden til fuld skorpedannelse var 5 dage blandt FAMVIR 500 mg-behandlede patienter sammenlignet med 7 dage hos placebobehandlede patienter. Tiderne til fuld skorpedannelse, tab af vesikler, tab af sår og tab af skorper var kortere for FAMVIR 500 mg-behandlede patienter end for placebo-behandlede patienter i den samlede undersøgelsespopulation. Virkningerne af FAMVIR 500 mg var større, når behandlingen blev påbegyndt inden for 48 timer efter udslæt. det var også mere udtalt hos patienter på 50 år eller ældre. Blandt de 65,2 % af patienterne med mindst 1 positiv viral kultur havde FAMVIR-behandlede patienter en kortere median varighed af viral udskillelse end placebo-behandlede patienter (henholdsvis 1 dag og 2 dage).
Der var ingen overordnede forskelle i varigheden af smerte før udslætsheling mellem FAMVIR- og placebobehandlede grupper. Derudover var der ingen forskel i forekomsten af smerte efter udslætsheling (postherpetisk neuralgi) mellem behandlingsgrupperne. Hos de 186 patienter (44,4 % af den samlede undersøgelsespopulation), som udviklede postherpetisk neuralgi, var medianvarigheden af postherpetisk neuralgi kortere hos patienter behandlet med FAMVIR 500 mg end hos dem, der blev behandlet med placebo (henholdsvis 63 dage og 119 dage). Ingen yderligere effekt blev påvist med højere dosis af FAMVIR.
I det aktivt kontrollerede forsøg blev 545 patienter behandlet med 1 ud af 3 doser FAMVIR tre gange dagligt eller med acyclovir 800 mg fem gange dagligt. Tiderne til fuld læsionsskorpedannelse og tiderne til tab af akut smerte var sammenlignelige for alle grupper, og der var ingen statistisk signifikante forskelle i tiden til tab af postherpetisk neuralgi mellem FAMVIR- og acyclovir-behandlede grupper.
PATIENTOPLYSNINGER
FAMVIR® (Fam'-veer) (famciclovir) Tabletter
Læs denne patientinformation, før du begynder at tage FAMVIR, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller behandling.
Hvad er FAMVIR?
Famvir er et receptpligtigt antiviralt lægemiddel, der bruges til at:
- behandle udbrud af forkølelsessår (feberblærer) hos raske voksne
- behandle udbrud af genital herpes hos raske voksne
- mindske antallet af udbrud af genital herpes hos raske voksne
- behandle udbrud af herpes simplex læsioner i eller omkring munden, kønsorganerne og analområdet hos mennesker, der er inficeret med HIV
- behandle helvedesild (herpes zoster) hos voksne med normalt immunsystem
Det vides ikke, om FAMVIR 500mg er sikkert og effektivt til børn under 18 år.
FAMVIR 250mg er ikke en kur mod herpes. Det vides ikke, om FAMVIR kan stoppe spredningen af herpes til andre. Hvis du er seksuelt aktiv, kan du overføre herpes til din partner, selvom du tager FAMVIR. Herpes kan overføres, selvom du ikke har aktive symptomer. Du bør fortsætte med at dyrke mere sikker sex for at mindske chancerne for at sprede genital herpes til andre. Hav ikke seksuel kontakt med din partner under et udbrud af genital herpes, eller hvis du har symptomer på genital herpes. Brug et kondom lavet af latex eller polyurethan, når du har en seksuel kontakt. Spørg din sundhedsudbyder for mere information om sikrere sexpraksis.
Hvem bør ikke tage FAMVIR?
Tag ikke FAMVIR 250 mg, hvis du er allergisk over for nogen af dets indholdsstoffer eller over for Denavir® (penciclovircreme). Se slutningen af denne patientinformationsfolder for en komplet liste over ingredienser i FAMVIR.
Hvad skal jeg fortælle min sundhedsplejerske, før jeg tager FAMVIR 500mg?
Inden du begynder at tage FAMVIR 500mg, skal du fortælle det til din læge, hvis du:
- har nyre- eller leverproblemer
- har et sjældent genetisk problem med galactoseintolerance, en alvorlig laktasemangel, eller du ikke optager glucose-galactose (malabsorption)
- er gravid eller planlægger at blive gravid. Det vides ikke, om FAMVIR 250mg vil skade dit ufødte barn
- Rapportering af graviditetseksponering: Novartis Pharmaceuticals Corporation indsamler graviditetsrapporter, som rapporteres på frivillig basis. I tilfælde af graviditet skal du tale med din læge om at indberette din graviditet
- ammer eller planlægger at amme
Fortæl din sundhedsudbyder om al den medicin, du tager, inklusive receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. Fortæl især din læge, hvis du tager:
- enhver anden medicin og produkter, du bruger til at behandle herpesudbrud
- probenecid (Probalan)
Kend den medicin du tager. Hav en liste over dem med dig, så du kan vise dem til din læge og apotek, hver gang du får en ny medicin.
Hvordan skal jeg tage FAMVIR?
- Tag FAMVIR nøjagtigt som foreskrevet
- Din læge vil fortælle dig, hvor mange FAMVIR du skal tage, og hvornår du skal tage dem. Din dosis af FAMVIR 250 mg og hvor ofte du tager den kan variere afhængigt af din tilstand
- FAMVIR kan tages med eller uden mad
- Det er vigtigt for dig at afslutte al medicinen som foreskrevet, selvom du begynder at få det bedre
- Dine symptomer kan fortsætte, selv efter du er færdig med hele din FAMVIR. Dette betyder ikke, at du har brug for mere medicin, da du allerede har afsluttet en fuld FAMVIR 500mg-kur, og den vil fortsætte med at virke i din krop. Tal med din læge, hvis du har spørgsmål om din tilstand og din behandling
Hvad er de mulige bivirkninger af FAMVIR 250mg?
De mest almindelige bivirkninger af FAMVIR 500mg omfatter:
- hovedpine
- kvalme
Tal med din læge, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af FAMVIR. Spørg din læge eller apotek for mere information.
Ring til din læge for at få medicinsk rådgivning om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA1088.
Hvordan skal jeg opbevare FAMVIR 500mg?
- Opbevar FAMVIR ved stuetemperatur mellem 59°F og 86°F (15°C til 30°C).
Opbevar FAMVIR og al medicin utilgængeligt for børn.
Generel information om FAMVIR
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i patientinformationsfoldere. Brug ikke FAMVIR til en tilstand, som det ikke er ordineret til. Giv ikke FAMVIR 500 mg til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne folder opsummerer de vigtigste oplysninger om FAMVIR. Hvis du vil have mere information, så tal med din sundhedsplejerske. Din sundhedsudbyder eller apotek kan give dig information om FAMVIR 500mg, der er skrevet til sundhedspersonale. For mere information, gå til www.FAMVIR.com eller ring på 1-888-669-6682.
Hvad er ingredienserne i FAMVIR?
Aktiv ingrediens: famciclovir
Inaktive ingredienser: hydroxypropylcellulose, hydroxypropylmethylcellulose, lactose, magnesiumstearat, polyethylenglycoler, natriumstivelsesglycolat og titaniumdioxid
