Sustiva 200mg, 600mg Efavirenz Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Sustiva 600mg, og hvordan bruges det?
Sustiva er en receptpligtig medicin, der bruges til at behandle symptomerne på HIV-infektion. Sustiva kan bruges alene eller sammen med anden medicin.
Sustiva tilhører en klasse af lægemidler kaldet HIV, NNRTI'er.
Det vides ikke, om Sustiva er sikkert og effektivt til børn under 3 måneder.
Hvad er de mulige bivirkninger af Sustiva?
Sustiva kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- feber,
- ondt i halsen,
- brændende øjne,
- hudsmerter,
- rødt eller lilla hududslæt med blærer og afskalning,
- anfald,
- hallucinationer,
- koncentrationsbesvær,
- problemer med at tale eller bevæge sig (kan forekomme måneder eller år efter påbegyndelse af medicinen),
- svimmelhed,
- døsighed,
- forvirring,
- koncentrationsbesvær,
- mærkelige drømme,
- søvnløshed,
- problemer med tale,
- problemer med din balance eller muskelbevægelse,
- angst,
- paranoia,
- usædvanlig adfærd,
- føler sig trist eller håbløs,
- selvmordstanker,
- kvalme,
- mavesmerter,
- mistet appetiten,
- mørk urin,
- lerfarvede afføring,
- gulfarvning af huden eller øjnene (gulsot),
- nattesved,
- hævede kirtler,
- forkølelsessår,
- hoste,
- hvæsen,
- diarré,
- vægttab,
- synkebesvær,
- problemer med balance eller øjenbevægelser,
- svaghed,
- stikkende følelse,
- hævelse i din nakke eller hals (forstørret skjoldbruskkirtel),
- menstruationsændringer, og
- impotens
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Sustiva omfatter:
- kvalme,
- opkastning,
- svimmelhed,
- døsighed,
- koncentrationsbesvær,
- udslæt,
- hovedpine,
- træthed,
- søvnproblemer (søvnløshed),
- mærkelige drømme, og
- ændringer i form eller placering af kropsfedt (især i dine arme, ben, ansigt, hals, bryster og talje)
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Sustiva. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
SUSTIVA® (efavirenz) er en HIV-1-specifik, ikke-nukleosid, revers transkriptasehæmmer (NNRTI). Efavirenz er kemisk beskrevet som (S)-6-chlor-4-(cyclopropylethynyl)-1,4-dihydro4-(trifluormethyl)-2H-3,1-benzoxazin-2-on. Dens empiriske formel er C14H9ClF3NO2 og dens strukturformel er:
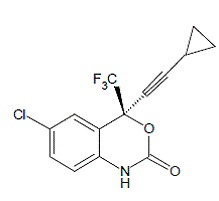
Efavirenz er et hvidt til let rosa krystallinsk pulver med en molekylvægt på 315,68. Det er praktisk talt uopløseligt i vand (
Kapsler
SUSTIVA fås som kapsler til oral administration, der indeholder enten 50 mg eller 200 mg efavirenz og følgende inaktive ingredienser: lactosemonohydrat, magnesiumstearat, natriumlaurylsulfat og natriumstivelsesglykolat. Kapselskallen indeholder følgende inaktive ingredienser og farvestoffer: gelatine, natriumlaurylsulfat, titaniumdioxid og/eller gul jernoxid. Kapselskallerne kan også indeholde siliciumdioxid. Kapslerne er trykt med blæk, der indeholder carmine 40 blue, FD&C Blue No. 2 og titaniumdioxid.
Tabletter
SUSTIVA 600mg fås som filmovertrukne tabletter til oral administration indeholdende 600 mg efavirenz og følgende inaktive ingredienser: croscarmellosenatrium, hydroxypropylcellulose, lactosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose og natriumlaurylsulfat. Filmbelægningen indeholder Opadry Yellow og Opadry Clear. Tabletterne er poleret med carnaubavoks og trykt med lilla blæk, Opacode WB.
INDIKATIONER
SUSTIVA® (efavirenz) i kombination med andre antiretrovirale midler er indiceret til behandling af human immundefektvirus type 1 (HIV-1) infektion hos voksne og pædiatriske patienter, der er mindst 3 måneder gamle og vejer mindst 3,5 kg.
DOSERING OG ADMINISTRATION
Leverfunktion
Overvåg leverfunktionen før og under behandling med SUSTIVA [se ADVARSLER OG FORHOLDSREGLER ]. SUSTIVA 600mg anbefales ikke til patienter med moderat eller svær leverinsufficiens (Child Pugh B eller C) [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Voksne
Den anbefalede dosis af SUSTIVA (efavirenz) er 600 mg oralt én gang dagligt i kombination med en proteasehæmmer og/eller nukleosidanalog revers transkriptasehæmmere (NRTI'er). Det anbefales, at SUSTIVA tages på tom mave, helst ved sengetid. De øgede efavirenzkoncentrationer observeret efter administration af SUSTIVA 600 mg sammen med mad kan føre til en stigning i hyppigheden af bivirkninger [se KLINISK FARMAKOLOGI ]. Dosering ved sengetid kan forbedre tolerabiliteten af nervesystemsymptomer [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER , og PATIENTOPLYSNINGER ]. SUSTIVA kapsler eller tabletter skal sluges intakte med væske. Til patienter, som ikke kan sluge kapsler eller tabletter, anbefales kapseldrys-indgivelsesmetoden [se Indgivelsesmåde for kapseldrys ].
Samtidig antiretroviral terapi
SUSTIVA skal gives i kombination med anden antiretroviral medicin [se INDIKATIONER , ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER , og KLINISK FARMAKOLOGI ].
Dosisjustering
Hvis SUSTIVA 200 mg administreres samtidigt med voriconazol, bør vedligeholdelsesdosis voriconazol øges til 400 mg hver 12. time, og SUSTIVA 200 mg-dosis skal reduceres til 300 mg én gang dagligt ved at bruge kapselformuleringen (én 200 mg og to 50 mg kapsler eller seks 50 mg kapsler). mg kapsler). SUSTIVA 600 mg tabletter må ikke brydes. [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI .]
Hvis SUSTIVA administreres sammen med rifampin til patienter, der vejer 50 kg eller mere, anbefales en stigning i dosis af SUSTIVA 200 mg til 800 mg én gang dagligt [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
Pædiatriske patienter
Det anbefales, at SUSTIVA 600 mg tages på tom mave, helst ved sengetid. Tabel 1 beskriver den anbefalede dosis af SUSTIVA til pædiatriske patienter på 3 måneder eller ældre og vejer mellem 3,5 kg og 40 kg [se KLINISK FARMAKOLOGI ]. Den anbefalede dosis af SUSTIVA til pædiatriske patienter, der vejer 40 kg eller derover, er 600 mg én gang dagligt. Til pædiatriske patienter, som ikke kan sluge kapsler, kan kapselindholdet indgives med en lille mængde mad eller modermælkserstatning ved hjælp af indgivelsesmetoden med kapseldrys [se Indgivelsesmåde for kapseldrys ].
Indgivelsesmåde for kapseldrys
Til pædiatriske patienter, der er mindst 3 måneder gamle og vejer mindst 3,5 kg, og voksne, som ikke kan sluge kapsler eller tabletter, kan kapselindholdet indgives med en lille mængde (1 til 2 teskefulde) mad. Brug af modermælkserstatning til blanding bør kun overvejes for de små spædbørn, som ikke pålideligt kan indtage fast føde. Patienter og plejepersonale bør instrueres i at åbne kapslen forsigtigt for at undgå spild eller spredning af kapselindholdet i luften. Kapslen skal holdes vandret over en lille beholder og forsigtigt drejes for at åbne. For patienter, der kan tåle fast føde, skal hele kapselindholdet forsigtigt blandes med en alderssvarende blød mad, såsom æblemos, vindruegele eller yoghurt, i den lille beholder. For små spædbørn, der får blandingen kapseldrys-modermælkserstatning, skal hele kapselindholdet forsigtigt blandes i 2 tsk rekonstitueret modermælkserstatning ved stuetemperatur i en lille beholder ved forsigtigt at omrøre med en lille ske, og derefter trække blandingen op i en 10 stk. ml oral doseringssprøjte til administration. Efter administration af SUSTIVA-fødevare- eller formelblandingen skal en yderligere lille mængde (ca. 2 teskefulde) mad eller formel tilsættes til den tomme blandebeholder, omrøres for at sprede eventuelle resterende SUSTIVA-rester og indgives til patienten. SUSTIVA-fødevare- eller formelblandingen skal administreres inden for 30 minutter efter blanding. Der må ikke indtages yderligere mad i 2 timer efter administration af SUSTIVA.
Yderligere patientinstruktioner om indgivelsesmetoden til kapseldrys findes i den FDA-godkendte patientmærkning (se PATIENTOPLYSNINGER og BRUGSVEJLEDNING ).
HVORDAN LEVERET
Doseringsformer og styrker
Kapsler
200 mg kapsler er guldfarvede, omvendt trykt med "SUSTIVA" på kroppen og påtrykt "200 mg" på hætten.
50 mg kapsler er guldfarvede og hvide, trykt med "SUSTIVA" på den guldfarvede hætte og omvendt trykt "50 mg" på den hvide krop.
Tabletter
600 mg tabletter er gule, kapselformede, filmovertrukne tabletter med "SUSTIVA" trykt på begge sider.
Opbevaring og håndtering
Kapsler
SUSTIVA® (efavirenz) kapsler fås som følger:
Kapsler 200 mg er guldfarvede, omvendt trykt med "SUSTIVA" på kroppen og påtrykt "200 mg" på hætten.
Flasker med 90 stk. NDC 0056-0474-92
Kapsler 50 mg er guldfarvede og hvide, trykt med "SUSTIVA" på den guldfarvede hætte og omvendt trykt "50 mg" på den hvide krop.
Flasker med 30 stk. NDC 0056-0470-30
Tabletter
SUSTIVA® (efavirenz) tabletter er tilgængelige som følger:
Tabletter 600 mg er gule, kapselformede, filmovertrukne tabletter med "SUSTIVA" trykt på begge sider.
Flasker med 30 stk. NDC 0056-0510-30
Opbevaring
SUSTIVA 600mg kapsler og SUSTIVA tabletter skal opbevares ved 25°C (77°F); udflugter tilladt til 15°C-30°C (59°F-86°F) [se USP kontrolleret rumtemperatur].
Distribueret af: Bristol-Myers Squibb Company Princeton, NJ 08543 USA. Revideret: oktober 2020
BIVIRKNINGER
De mest signifikante bivirkninger observeret hos patienter behandlet med SUSTIVA er:
- psykiatriske symptomer [se ADVARSLER OG FORHOLDSREGLER ],
- nervesystemets symptomer [se ADVARSLER OG FORHOLDSREGLER ],
- udslæt [se ADVARSLER OG FORHOLDSREGLER ].
- hepatotoksicitet [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan de rapporterede bivirkningsrater ikke direkte sammenlignes med frekvenser i andre kliniske undersøgelser og afspejler muligvis ikke de hyppigheder, der er observeret i klinisk praksis.
Bivirkninger hos voksne
De mest almindelige (>5 % i begge efavirenz-behandlingsgrupper) bivirkninger af mindst moderat sværhedsgrad blandt patienter i undersøgelse 006 behandlet med SUSTIVA 200 mg i kombination med zidovudin/lamivudin eller indinavir var udslæt, svimmelhed, kvalme, hovedpine, træthed, søvnløshed, og opkastning.
Udvalgte kliniske bivirkninger af moderat eller svær intensitet observeret hos ≥2 % af SUSTIVA-behandlede patienter i to kontrollerede kliniske forsøg er vist i tabel 2.
Pancreatitis er blevet rapporteret, selvom en årsagssammenhæng med efavirenz ikke er blevet fastslået. Asymptomatiske stigninger i serumamylaseniveauer blev observeret hos et signifikant højere antal patienter behandlet med efavirenz 600 mg end hos kontrolpatienter (se Laboratorieabnormiteter ).
Symptomer på nervesystemet
For 1008 patienter behandlet med regimer indeholdende SUSTIVA og 635 patienter behandlet med kontrolregimer i kontrollerede forsøg, viser tabel 3 hyppigheden af symptomer af forskellig sværhedsgrad og angiver seponeringsraterne for et eller flere af følgende nervesystemsymptomer: svimmelhed, søvnløshed, nedsat koncentrationsevne, somnolens, unormal drøm, eufori, forvirring, agitation, hukommelsestab, hallucinationer, stupor, unormal tænkning og depersonalisering [se ADVARSLER OG FORHOLDSREGLER ]. Hyppigheden af specifikke symptomer på det centrale og perifere nervesystem er angivet i tabel 2.
Psykiatriske symptomer
Alvorlige psykiatriske bivirkninger er blevet rapporteret hos patienter behandlet med SUSTIVA. I kontrollerede forsøg var psykiatriske symptomer observeret med en frekvens på mere end 2 % blandt patienter behandlet med henholdsvis SUSTIVA 600 mg eller kontrolregimer depression (19 %, 16 %), angst (13 %, 9 %) og nervøsitet (7 % , 2%).
Udslæt
kontrollerede kliniske undersøgelser var hyppigheden af udslæt (alle grader, uanset årsagssammenhæng) 26 % for 1008 voksne behandlet med regimer indeholdende SUSTIVA 200 mg og 17 % for 635 voksne behandlet med et kontrolregime. De fleste rapporter om udslæt var milde eller moderate i sværhedsgrad. Hyppigheden af grad 3 udslæt var 0,8 % for SUSTIVA-behandlede patienter og 0,3 % for kontrolgrupper, og hyppigheden af grad 4 udslæt var 0,1 % for SUSTIVA og 0 for kontrolgrupper. Seponeringshyppigheden som følge af udslæt var 1,7 % for SUSTIVA-behandlede patienter og 0,3 % for kontrolgrupper [se ADVARSLER OG FORHOLDSREGLER ].
Erfaring med SUSTIVA hos patienter, der har seponeret andre antiretrovirale midler af NNRTI-klassen, er begrænset. Nitten patienter, der ophørte med nevirapin på grund af udslæt, er blevet behandlet med SUSTIVA. Ni af disse patienter udviklede mildt til moderat udslæt, mens de modtog behandling med SUSTIVA, og to af disse patienter ophørte på grund af udslæt.
Laboratorieabnormiteter
Udvalgte grad 3-4 laboratorieabnormaliteter rapporteret hos ≥2 % af SUSTIVA-behandlede patienter i to kliniske forsøg er vist i tabel 4.
Patienter samtidig med hepatitis B eller C
Leverfunktionsprøver bør overvåges hos patienter med hepatitis B og/eller C i anamnesen. I langtidsdatasættet fra undersøgelse 006 blev 137 patienter behandlet med SUSTIVA-holdige regimer (median behandlingsvarighed, 68 uger) og 84 behandlet med et kontrolregime (median varighed, 56 uger) var seropositive ved screening for hepatitis B (overfladeantigenpositiv) og/eller C (hepatitis C-antistofpositiv). Blandt disse samtidig inficerede patienter udviklede stigninger i ASAT til mere end fem gange ULN hos 13 % af patienterne i SUSTIVA-armene og 7 % af dem i kontrolarmen, og stigninger i ALAT til mere end fem gange ULN udviklet hos 20 % af patienterne i SUSTIVA-armene og 7 % af patienterne i kontrolarmen. Blandt co-inficerede patienter afbrød 3 % af dem, der blev behandlet med SUSTIVA-holdige regimer og 2 % i kontrolarmen, fra undersøgelsen på grund af lever- eller galdevejssygdomme [se ADVARSLER OG FORHOLDSREGLER ].
Lipider
Stigninger fra baseline i total kolesterol på 10-20% er blevet observeret hos nogle uinficerede frivillige, der fik SUSTIVA. Hos patienter behandlet med SUSTIVA + zidovudin + lamivudin blev der observeret stigninger fra baseline i ikke-fastende totalkolesterol og HDL på henholdsvis ca. 20 % og 25 %. Hos patienter behandlet med SUSTIVA + indinavir blev der observeret stigninger fra baseline i ikke-fastende kolesterol og HDL på henholdsvis ca. 40 % og 35 %. Ikke-fastende totale kolesterolniveauer ≥240 mg/dL og ≥300 mg/dL blev rapporteret hos henholdsvis 34 % og 9 % af patienter behandlet med SUSTIVA + zidovudin + lamivudin; henholdsvis 54 % og 20 % af patienter behandlet med SUSTIVA + indinavir; og henholdsvis 28 % og 4 % af patienter behandlet med indinavir + zidovudin + lamivudin. Virkningerne af SUSTIVA 600 mg på triglycerider og LDL i denne undersøgelse var ikke velkarakteriseret, da prøver blev taget fra ikke-fastende patienter. Den kliniske betydning af disse fund er ukendt [se ADVARSLER OG FORHOLDSREGLER ].
Bivirkninger hos pædiatriske patienter
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan de rapporterede bivirkningsrater ikke direkte sammenlignes med frekvenser i andre kliniske undersøgelser og afspejler muligvis ikke de hyppigheder, der er observeret i klinisk praksis.
Vurdering af bivirkninger er baseret på tre kliniske forsøg med 182 HIV-1-inficerede pædiatriske patienter (3 måneder til 21 år), som fik SUSTIVA 200 mg i kombination med andre antiretrovirale midler i en median på 123 uger. De bivirkninger, der blev observeret i de tre forsøg, svarede til dem, der blev observeret i kliniske forsøg hos voksne, bortset fra at udslæt var mere almindeligt hos pædiatriske patienter (32 % for alle grader uanset årsagssammenhæng) og oftere af højere grad (dvs. mere alvorligt). To (1,1 %) pædiatriske patienter oplevede grad 3 udslæt (sammenflydende udslæt med feber, generaliseret udslæt), og fire (2,2 %) pædiatriske patienter havde grad 4 udslæt (alle erythema multiforme). Fem pædiatriske patienter (2,7%) afbrød studiet på grund af udslæt [se ADVARSLER OG FORHOLDSREGLER ].
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af SUSTIVA efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af ukendt størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Kroppen som helhed: allergiske reaktioner, asteni, omfordeling/ophobning af kropsfedt [se ADVARSLER OG FORHOLDSREGLER ]
Centrale og perifere nervesystem: unormal koordination, ataksi, encefalopati, cerebellar koordination og balanceforstyrrelser, kramper, hypoæstesi, paræstesi, neuropati, tremor, vertigo
Endokrine: gynækomasti
Gastrointestinale: forstoppelse, malabsorption
Kardiovaskulær: rødmen, hjertebanken
Lever og galdesystem: øget leverenzym, leversvigt, hepatitis.
Metabolisk og ernæringsmæssig: hyperkolesterolæmi, hypertriglyceridæmi
Muskuloskeletale: artralgi, myalgi, myopati
Psykiatrisk: aggressive reaktioner, agitation, vrangforestillinger, følelsesmæssig labilitet, mani, neurose, paranoia, psykose, selvmord, katatoni
Åndedræt: dyspnø
Hud og vedhæng: erythema multiforme, fotoallergisk dermatitis, Stevens-Johnsons syndrom
Særlige sanser: unormalt syn, tinnitus
DRUGSINTERAKTIONER
Potentiale for SUSTIVA til at påvirke andre lægemidler
Efavirenz har vist sig in vivo at inducere CYP3A og CYP2B6. Andre forbindelser, der er substrater for CYP3A eller CYP2B6, kan have nedsatte plasmakoncentrationer, når de administreres sammen med SUSTIVA.
Potentiale for, at andre lægemidler kan påvirke SUSTIVA
Lægemidler, der inducerer CYP3A-aktivitet (f.eks. phenobarbital, rifampin, rifabutin), forventes at øge clearance af efavirenz, hvilket resulterer i nedsatte plasmakoncentrationer [se DOSERING OG ADMINISTRATION ].
QT-forlængende lægemidler
Der er begrænset information tilgængelig om potentialet for en farmakodynamisk interaktion mellem SUSTIVA 600mg og lægemidler, der forlænger QTc-intervallet. QTc-forlængelse er blevet observeret ved brug af efavirenz [se KLINISK FARMAKOLOGI ]. Overvej alternativer til SUSTIVA 600 mg, når det administreres sammen med et lægemiddel med kendt risiko for Torsade de Pointes.
Etablerede og andre potentielt signifikante lægemiddelinteraktioner
Lægemiddelinteraktioner med SUSTIVA er opsummeret i tabel 5. For farmakokinetiske data, [se KLINISK FARMAKOLOGI ] Tabel 7 og 8. Denne tabel inkluderer potentielt signifikante interaktioner, men er ikke altomfattende.
Lægemidler uden klinisk signifikante interaktioner med SUSTIVA
Der anbefales ingen dosisjustering, når SUSTIVA 600 mg gives sammen med følgende: antacida af aluminium/magnesiumhydroxid, azithromycin, cetirizin, famotidin, fluconazol, lorazepam, nelfinavir, nukleosid revers transkriptasehæmmere (abacavir, stavivoxidudin, stavivoxidin, emtricoxin, stavviroxin, ), paroxetin og raltegravir.
Cannabinoid test interaktion
Efavirenz binder sig ikke til cannabinoidreceptorer. Falsk-positive urin cannabinoid testresultater er blevet rapporteret med nogle screeningsassays i uinficerede og HIV-inficerede forsøgspersoner, der fik efavirenz. Bekræftelse af positive screeningstest for cannabinoider med en mere specifik metode anbefales.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Lægemiddelinteraktioner
Efavirenz plasmakoncentrationer kan ændres af substrater, inhibitorer eller inducere af CYP3A. Ligeledes kan efavirenz ændre plasmakoncentrationer af lægemidler, der metaboliseres af CYP3A eller CYP2B6. Den mest fremtrædende effekt af efavirenz ved steady-state er induktion af CYP3A og CYP2B6 [se DOSERING OG ADMINISTRATION og DRUGSINTERAKTIONER ].
QTc forlængelse
QTc-forlængelse er blevet observeret ved brug af efavirenz [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ]. Overvej alternativer til SUSTIVA 600 mg, når det administreres sammen med et lægemiddel med en kendt risiko for Torsade de Pointes, eller når det administreres til patienter med højere risiko for Torsade de Pointes.
Modstand
SUSTIVA 200mg må ikke anvendes som et enkelt middel til behandling af HIV-1-infektion eller tilføjes som det eneste middel til et svigtende regime. Resistent virus opstår hurtigt, når efavirenz administreres som monoterapi. Valget af nye antiretrovirale midler, der skal anvendes i kombination med efavirenz, bør tage højde for potentialet for viral krydsresistens.
Samadministration med relaterede produkter
Samtidig administration af SUSTIVA og ATRIPLA (efavirenz 600 mg/emtricitabin 200 mg/tenofovirdisoproxilfumarat 300 mg) anbefales ikke, medmindre det er nødvendigt for dosisjustering (f.eks. med rifampin), da efavirenz er et af dets aktive ingredienser.
Psykiatriske symptomer
Alvorlige psykiatriske bivirkninger er blevet rapporteret hos patienter behandlet med SUSTIVA. I kontrollerede forsøg med 1008 patienter behandlet med regimer indeholdende SUSTIVA 600 mg i gennemsnitligt 2,1 år og 635 patienter behandlet med kontrolregimer i gennemsnitligt 1,5 år, var hyppigheden (uanset kausalitet) af specifikke alvorlige psykiatriske hændelser blandt patienter, der fik SUSTIVA eller kontrolregimer var henholdsvis svær depression (2,4 %, 0,9 %), selvmordstanker (0,7 %, 0,3 %), ikke-dødelige selvmordsforsøg (0,5 %, 0), aggressiv adfærd (0,4 %, 0,5 %), paranoide reaktioner (0,4 %). %, 0,3 %) og maniske reaktioner (0,2 %, 0,3 %). Når psykiatriske symptomer svarende til de ovenfor nævnte blev kombineret og evalueret som en gruppe i en multifaktoriel analyse af data fra undersøgelse 006, var behandling med efavirenz forbundet med en stigning i forekomsten af disse udvalgte psykiatriske symptomer. Andre faktorer forbundet med en stigning i forekomsten af disse psykiatriske symptomer var historie med injektionsstofbrug, psykiatrisk historie og modtagelse af psykiatrisk medicin ved studiestart; lignende sammenhænge blev observeret i både SUSTIVA- og kontrolbehandlingsgrupperne. I undersøgelse 006 opstod nye alvorlige psykiatriske symptomer gennem hele undersøgelsen for både SUSTIVA-behandlede og kontrolbehandlede patienter. En procent af de SUSTIVA-behandlede patienter afbrød eller afbrød behandlingen på grund af et eller flere af disse udvalgte psykiatriske symptomer. Der har også været lejlighedsvise postmarketingrapporter om dødsfald som følge af selvmord, vrangforestillinger og psykoselignende adfærd, selvom en årsagssammenhæng til brugen af SUSTIVA ikke kan fastslås ud fra disse rapporter. Postmarketing tilfælde af katatoni er også blevet rapporteret og kan være forbundet med øget efavirenz eksponering. Patienter med alvorlige psykiatriske bivirkninger bør omgående søge lægevurdering for at vurdere muligheden for, at symptomerne kan være relateret til brugen af SUSTIVA, og hvis det er tilfældet, for at afgøre, om risiciene ved fortsat behandling opvejer fordelene. [se BIVIRKNINGER .]
Symptomer på nervesystemet
53 procent (531/1008) af patienterne, der fik SUSTIVA 600 mg i kontrollerede forsøg, rapporterede symptomer på centralnervesystemet (enhver grad, uanset årsagssammenhæng) sammenlignet med 25 % (156/635) af patienterne, der fik kontrolregimer [se BIVIRKNINGER ]. Disse symptomer omfattede, men var ikke begrænset til, svimmelhed (28,1 % af de 1008 patienter), søvnløshed (16,3 %), nedsat koncentrationsevne (8,3 %), somnolens (7,0 %), unormale drømme (6,2 %) og hallucinationer (1,2 %). %). Disse symptomer var alvorlige hos 2,0 % af patienterne; og 2,1 % af patienterne afbrød behandlingen som følge heraf. Disse symptomer begynder sædvanligvis i løbet af den første eller anden behandlingsdag og forsvinder generelt efter de første 2-4 ugers behandling. Efter 4 ugers behandling varierede prævalensen af nervesystemsymptomer af mindst moderat sværhedsgrad fra 5 % til 9 % hos patienter behandlet med regimer indeholdende SUSTIVA og fra 3 % til 5 % hos patienter behandlet med et kontrolregime. Patienterne bør informeres om, at disse almindelige symptomer sandsynligvis ville blive bedre ved fortsat behandling og ikke var forudsigelige for efterfølgende indtræden af de mindre hyppige psykiatriske symptomer [se Psykiatriske symptomer ]. Dosering ved sengetid kan forbedre tolerabiliteten af disse nervesystemsymptomer [se DOSERING OG ADMINISTRATION ].
Analyse af langtidsdata fra undersøgelse 006 (median opfølgning 180 uger, 102 uger og 76 uger for patienter behandlet med henholdsvis SUSTIVA + zidovudin + lamivudin, SUSTIVA + indinavir og indinavir + zidovudin + lamivudin) viste, at 24 ugers behandling var forekomsten af nyopståede nervesystemsymptomer blandt SUSTIVA-behandlede patienter generelt den samme som i den indinavirholdige kontrolarm.
Sent indsættende neurotoksicitet, herunder ataksi og encefalopati (nedsat bevidsthed, forvirring, psykomotorisk opbremsning, psykose, delirium), kan forekomme måneder til år efter påbegyndelse af efavirenzbehandling. Nogle hændelser med sen-debut neurotoksicitet er forekommet hos patienter med CYP2B6 genetiske polymorfismer, som er forbundet med øgede efavirenz-niveauer på trods af standarddosering af SUSTIVA. Patienter, der har tegn og symptomer på alvorlige neurologiske bivirkninger, bør evalueres omgående for at vurdere muligheden for, at disse hændelser kan være relateret til brug af efavirenz, og om seponering af SUSTIVA 600 mg er berettiget.
Patienter, der får SUSTIVA 600 mg, skal gøres opmærksom på muligheden for additive effekter på centralnervesystemet, når SUSTIVA 200 mg anvendes samtidig med alkohol eller psykoaktive stoffer.
Patienter, der oplever symptomer på centralnervesystemet såsom svimmelhed, nedsat koncentrationsevne og/eller døsighed, bør undgå potentielt farlige opgaver såsom at køre bil eller betjene maskiner.
Embryo-føtal toksicitet
Efavirenz kan forårsage fosterskade, når det administreres i løbet af første trimester til en gravid kvinde. Rådgiv kvinder med reproduktionspotentiale, som får SUSTIVA 600 mg, for at undgå graviditet. [se Brug i specifikke populationer .]
Udslæt
I kontrollerede kliniske forsøg oplevede 26 % (266/1008) af voksne patienter behandlet med 600 mg SUSTIVA nyopstået hududslæt sammenlignet med 17 % (111/635) af dem, der blev behandlet i kontrolgrupper [se BIVIRKNINGER ]. Udslæt associeret med blærer, fugtig afskalning eller ulceration forekom hos 0,9 % (9/1008) af patienter behandlet med SUSTIVA. Incidensen af grad 4 udslæt (f.eks. erythema multiforme, Stevens-Johnsons syndrom) hos voksne patienter behandlet med SUSTIVA i alle undersøgelser og udvidet adgang var 0,1 %. Udslæt er sædvanligvis milde til moderate makulopapulære hududslæt, der opstår inden for de første 2 uger efter påbegyndelse af behandling med efavirenz (median tid til indtræden af udslæt hos voksne var 11 dage), og hos de fleste patienter, der fortsætter behandlingen med efavirenz, forsvinder udslæt inden for 1 måned (median varighed, 16 dage). Seponeringshyppigheden for udslæt i kliniske forsøg med voksne var 1,7 % (17/1008).
Udslæt blev rapporteret hos 59 ud af 182 pædiatriske patienter (32%) behandlet med SUSTIVA [se BIVIRKNINGER ]. To pædiatriske patienter oplevede udslæt af grad 3 (sammenflydende udslæt med feber, generaliseret udslæt), og fire patienter havde udslæt af grad 4 (erythema multiforme). Mediantiden til indtræden af udslæt hos pædiatriske patienter var 28 dage (interval 3-1642 dage). Profylakse med passende antihistaminer før påbegyndelse af behandling med SUSTIVA hos pædiatriske patienter bør overvejes.
SUSTIVA 600 mg kan generelt genoptages hos patienter, der afbryder behandlingen på grund af udslæt. SUSTIVA 200 mg bør seponeres hos patienter, der udvikler alvorligt udslæt forbundet med blæredannelse, afskalning, slimhindepåvirkning eller feber. Passende antihistaminer og/eller kortikosteroider kan forbedre tolerabiliteten og fremskynde opløsningen af udslæt. For patienter, der har haft en livstruende kutan reaktion (f.eks. Stevens-Johnsons syndrom), bør alternativ behandling overvejes [se KONTRAINDIKATIONER ].
Hepatotoksicitet
Postmarketing tilfælde af hepatitis, herunder fulminant hepatitis, der udvikler sig til leversvigt, der kræver transplantation eller resulterer i død, er blevet rapporteret hos patienter behandlet med SUSTIVA. Rapporter har inkluderet patienter med underliggende leversygdom, herunder samtidig infektion med hepatitis B eller C, og patienter uden allerede eksisterende leversygdom eller andre identificerbare risikofaktorer.
SUSTIVA 600mg anbefales ikke til patienter med moderat eller svært nedsat leverfunktion. Omhyggelig monitorering anbefales til patienter med let nedsat leverfunktion, der får SUSTIVA. [se BIVIRKNINGER og Brug i specifikke populationer ].
Monitorering af leverenzymer før og under behandlingen anbefales til alle patienter [se DOSERING OG ADMINISTRATION ].
Overvej at seponere SUSTIVA 600 mg hos patienter med vedvarende forhøjelser af serumtransaminaser til mere end fem gange den øvre grænse for normalområdet.Afbryd SUSTIVA 200 mg, hvis stigning i serumtransaminaser er ledsaget af kliniske tegn eller symptomer på hepatitis eller leverdekompensation.
Kramper
Kramper er blevet observeret hos voksne og pædiatriske patienter, der får efavirenz, generelt ved tilstedeværelse af kendt anamnese med anfald [se Ikke-klinisk toksikologi ]. Der bør udvises forsigtighed hos enhver patient med en historie med anfald. Patienter, der samtidig får krampestillende medicin, der primært metaboliseres af leveren, såsom phenytoin og phenobarbital, kan kræve periodisk monitorering af plasmaniveauer [se DRUGSINTERAKTIONER ].
Lipidforhøjelser
Behandling med SUSTIVA har resulteret i stigninger i koncentrationen af total kolesterol og triglycerider [se BIVIRKNINGER ]. Kolesterol- og triglyceridtest bør udføres før påbegyndelse af SUSTIVA 200 mg-behandling og med periodiske intervaller under behandlingen.
Immunrekonstitutionssyndrom
Immunrekonstitutionssyndrom er blevet rapporteret hos patienter behandlet med antiretroviral kombinationsterapi, inklusive SUSTIVA. Under den indledende fase af antiretroviral kombinationsbehandling kan patienter, hvis immunsystem reagerer, udvikle et inflammatorisk respons på indolente eller resterende opportunistiske infektioner (såsom Mycobacterium avium-infektion, cytomegalovirus, Pneumocystis jiroveci pneumoni [PCP] eller tuberkulose), hvilket kan nødvendiggøre yderligere evaluering og behandling.
Autoimmune lidelser (såsom Graves' sygdom, polymyositis, Guillain-Barré syndrom og autoimmun hepatitis) er også blevet rapporteret at forekomme i forbindelse med immunrekonstitution; dog er tiden til debut er mere variabel og kan forekomme mange måneder efter påbegyndelse af behandlingen.
Fedt omfordeling
Omfordeling/akkumulering af kropsfedt inklusive central fedme, dorsocervikal fedtforstørrelse (buffalo hump), perifer svind, ansigtsudslip, brystforstørrelse og "cushingoid udseende" er blevet observeret hos patienter i antiretroviral behandling. Mekanismen og de langsigtede konsekvenser af disse hændelser er i øjeblikket ukendte. En årsagssammenhæng er ikke fastslået.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER og Brugsanvisning ).
Lægemiddelinteraktioner
En erklæring til patienter og sundhedspersonale er inkluderet på produktets flaskeetiketter: ADVARSEL: Find ud af om medicin, der IKKE bør tages sammen med SUSTIVA.
SUSTIVA kan interagere med nogle lægemidler; råd derfor patienterne til at rapportere til deres læge brugen af enhver anden receptpligtig eller ikke-receptpligtig medicin.
Generel information til patienter
Informer patienterne om, at SUSTIVA 200 mg ikke er en kur mod HIV-1-infektion, og patienter kan fortsætte med at opleve sygdomme forbundet med HIV-1-infektion, herunder opportunistiske infektioner. Patienter bør forblive under lægens behandling, mens de tager SUSTIVA.
Rådgive patienter om at undgå at gøre ting, der kan sprede HIV-1-infektion til andre.
- Del eller genbrug ikke nåle eller andet injektionsudstyr.
- Del ikke personlige ejendele, der kan have blod eller kropsvæsker på dem, såsom tandbørster og barberblade.
- Hav ikke nogen form for sex uden beskyttelse. Udøv altid mere sikker sex ved at bruge et latex- eller polyurethankondom for at mindske chancen for seksuel kontakt med sæd, skedesekret eller blod.
- Må ikke amme. Mødre med HIV-1 bør ikke amme, fordi HIV-1 kan overføres til barnet i modermælken.
Doseringsinstruktioner
Rådgiv patienterne at tage SUSTIVA hver dag som foreskrevet. Hvis en patient glemmer at tage SUSTIVA, skal du fortælle patienten om at tage den glemte dosis med det samme, medmindre det næsten er tid til den næste dosis. Rådgiv patienten om ikke at tage 2 doser ad gangen og at tage den næste dosis på det regelmæssigt planlagte tidspunkt. Råd patienten til at spørge en sundhedsplejerske, om han/hun har brug for hjælp til at planlægge de bedste tidspunkter for at tage hans/hendes medicin.
SUSTIVA 200mg skal altid anvendes i kombination med andre antiretrovirale lægemidler. Rådgiv patienterne at tage SUSTIVA 600 mg på tom mave, helst ved sengetid. Indtagelse af SUSTIVA sammen med mad øger efavirenzkoncentrationerne og kan øge hyppigheden af bivirkninger. Dosering ved sengetid kan forbedre tolerabiliteten af nervesystemsymptomer [se DOSERING OG ADMINISTRATION og BIVIRKNINGER ]. Sundhedsudbydere bør hjælpe forældre eller omsorgspersoner med at bestemme den bedste SUSTIVA-doseringsplan for spædbørn og småbørn.
Til voksne og pædiatriske patienter, som ikke kan sluge kapsler eller tabletter, bør patienter eller deres pårørende rådes til at læse og omhyggeligt følge instruktionerne for administration af kapselindholdet i en lille mængde mad eller modermælkserstatning [se DOSERING OG ADMINISTRATION og FDA-godkendt patientmærkning ( PATIENTOPLYSNINGER og BRUGSVEJLEDNING )]. Patienter skal ringe til deres læge eller apotek, hvis de har spørgsmål.
Symptomer på nervesystemet
Informer patienterne om, at symptomer på centralnervesystemet (NSS) inklusive svimmelhed, søvnløshed, nedsat koncentrationsevne, døsighed og unormale drømme er almindeligt rapporteret i løbet af de første uger af behandlingen med SUSTIVA [se ADVARSLER OG FORHOLDSREGLER ]. Dosering ved sengetid kan forbedre tolerabiliteten af disse symptomer, som sandsynligvis vil forbedres med fortsat behandling. Advarer patienterne om potentialet for additive virkninger, når SUSTIVA anvendes samtidig med alkohol eller psykoaktive stoffer. Instruer patienterne i, at hvis de oplever NSS, skal de undgå potentielt farlige opgaver såsom at køre bil eller betjene maskiner.
Informer patienterne om, at der er risiko for at udvikle sent indsættende neurotoksicitet, herunder ataksi og encefalopati, som kan forekomme måneder til år efter påbegyndelse af SUSTIVA-behandling [se ADVARSLER OG FORHOLDSREGLER ].
Psykiatriske symptomer
Informer patienterne om, at alvorlige psykiatriske symptomer, herunder svær depression, selvmordsforsøg, aggressiv adfærd, vrangforestillinger, paranoia, psykose-lignende symptomer og katatoni er blevet rapporteret hos patienter, der får SUSTIVA [se ADVARSLER OG FORHOLDSREGLER ]. Hvis de oplever alvorlige psykiatriske uønskede oplevelser, bør de straks søge lægelig vurdering. Råd patienter til at informere deres læge om enhver historie med psykisk sygdom eller stofmisbrug.
Udslæt
Informer patienterne om, at en almindelig bivirkning er udslæt [se ADVARSLER OG FORHOLDSREGLER ]. Udslæt forsvinder normalt uden nogen ændring i behandlingen. Men da udslæt kan være alvorligt, bør du rådgive patienterne om at kontakte deres læge omgående, hvis der opstår udslæt.
Hepatotoksicitet
Informer patienterne om at holde øje med tidlige advarselstegn på leverbetændelse eller leversvigt, såsom træthed, svaghed, manglende appetit, kvalme og opkastning, samt senere tegn såsom gulsot, forvirring, mavehævelse og misfarvet afføring, og at konsultere deres sundhedspersonale uden forsinkelse, hvis sådanne symptomer opstår [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Hunner af reproduktionspotentiale
Rådgiv kvinder med reproduktionspotentiale til at bruge effektiv prævention samt en barrieremetode under behandling med SUSTIVA 600 mg og i 12 uger efter seponering af SUSTIVA. Rådgive patienter om at kontakte deres læge, hvis de planlægger at blive gravide, blive gravide, eller hvis der er mistanke om graviditet under behandling med SUSTIVA [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Graviditetseksponeringsregister
Rådgiv patienterne om, at der findes et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for SUSTIVA under graviditeten [se Brug i specifikke populationer ].
Fedt omfordeling
Informer patienterne om, at omfordeling eller akkumulering af kropsfedt kan forekomme hos patienter, der får antiretroviral behandling, og at årsagen til og langsigtede helbredseffekter af disse tilstande ikke er kendte [se ADVARSLER OG FORHOLDSREGLER ].
SUSTIVA er et registreret varemærke tilhørende Bristol-Myers Squibb Pharma Company. ATRIPLA er et varemærke tilhørende Bristol-Myers Squibb & Gilead Sciences, LLC.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Langtidskarcinogenicitetsundersøgelser hos mus og rotter blev udført med efavirenz. Mus blev doseret med 0, 25, 75, 150 eller 300 mg/kg/dag i 2 år. Incidensen af hepatocellulære adenomer og karcinomer og pulmonale alveolære/bronchiolære adenomer var øget over baggrunden hos kvinder. Ingen stigninger i tumorincidens over baggrund blev set hos mænd. Der var ingen NOAEL hos kvinder etableret til denne undersøgelse, fordi tumorfund forekom ved alle doser. AUC ved NOAEL (150 mg/kg) hos mænd var ca. 0,9 gange højere end hos mennesker ved den anbefalede kliniske dosis. I rottestudiet blev der ikke observeret stigninger i tumorincidens ved doser op til 100 mg/kg/dag, for hvilke AUC'er var 0,1 (hanner) eller 0,2 (hun) gange dem hos mennesker ved den anbefalede kliniske dosis.
Mutagenese
Efavirenz testet negativt i en række in vitro og in vivo genotoksicitetsanalyser. Disse omfattede bakterielle mutationsassays i S.typhimurium og E. coli, pattedyrmutationsassays i kinesisk hamsterovarieceller, kromosomafvigelsesassays i humane perifere blodlymfocytter eller kinesiske hamsterovarieceller og en in vivo museknoglemarvsmikronukleusassay.
Forringelse af fertilitet
Efavirenz svækkede ikke parring eller fertilitet hos han- eller hunrotter og påvirkede ikke sædceller fra behandlede hanrotter. Reproduktionsevnen hos afkom født af hunrotter, der fik efavirenz, blev ikke påvirket. AUC'erne ved NOAEL-værdierne hos han- (200 mg/kg) og hun- (100 mg/kg) rotter var ca. ≤ 0,15 gange den hos mennesker ved den anbefalede kliniske dosis.
Brug i specifikke populationer
Graviditet
Graviditetseksponeringsregister
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for SUSTIVA 600 mg under graviditet. Læger opfordres til at registrere patienter ved at ringe til Antiretroviral Pregnancy Registry på 1-800-258-4263.
Risikooversigt
Der er retrospektive tilfælde af neuralrørsdefekter hos spædbørn, hvis mødre blev udsat for efavirenz-holdige regimer i graviditetens første trimester. Prospektive graviditetsdata fra Antiretroviral Pregnancy Registry er ikke tilstrækkelige til at vurdere denne risiko tilstrækkeligt. Tilgængelige data fra Antiretroviral Pregnancy Registry viser ingen forskel i risikoen for overordnede større fødselsdefekter sammenlignet med baggrundsraten for større fødselsdefekter på 2,7 % i den amerikanske referencepopulation i Metropolitan Atlanta Congenital Defects Program (MACDP). Selvom der ikke er påvist en årsagssammenhæng mellem eksponering for efavirenz i første trimester og neuralrørsdefekter, er lignende misdannelser blevet observeret i undersøgelser udført på aber i doser svarende til den humane dosis. Derudover forekom føtale og embryonale toksiciteter hos rotter ved en dosis, der er ti gange mindre end den humane eksponering ved den anbefalede kliniske dosis. På grund af den potentielle risiko for neuralrørsdefekter bør efavirenz ikke anvendes i graviditetens første trimester. Rådgiv gravide kvinder om den potentielle risiko for et foster.
Data
Menneskelige data
Der er retrospektive postmarketingrapporter om fund, der stemmer overens med neuralrørsdefekter, inklusive meningomyelocele, alle hos spædbørn af mødre, der blev eksponeret for efavirenz-holdige regimer i første trimester.
Baseret på prospektive rapporter fra Antiretroviral Pregnancy Registry (APR) af ca. 1000 levendefødte efter eksponering for efavirenz-holdige regimer (inklusive over 800 levendefødte eksponerede i første trimester), var der ingen forskel mellem efavirenz og overordnede fødselsdefekter sammenlignet med 2,7 % i den amerikanske referencepopulation i Metropolitan Atlanta Congenital Defects Program. Fra den foreløbige ÅOP-rapport udsendt december 2014 var prævalensen af fødselsdefekter efter eksponering i første trimester 2,3 % (95 % CI: 1,4 %-3,6 %). En af disse prospektivt rapporterede defekter med eksponering i første trimester var en neuralrørsdefekt. Et enkelt tilfælde af anophthalmia med eksponering for efavirenz i første trimester er også blevet rapporteret prospektivt. Dette tilfælde omfattede også svære skæve ansigtsspalter og amniotiske bånd, som har en kendt sammenhæng med anophthalmia.
Dyredata
Effekter af efavirenz på embryo-føtal udvikling er blevet undersøgt hos tre ikke-kliniske arter (cynomolgusaber, rotter og kaniner). Hos aber blev efavirenz 60 mg/kg/dag givet til gravide kvinder gennem hele graviditeten (drægtighedsdage 20 til 150). Den maternelle systemiske lægemiddeleksponering (AUC) var 1,3 gange eksponeringen hos mennesker ved den anbefalede kliniske dosis (600 mg/dag), med føtale navlestrengsvenøse lægemiddelkoncentrationer på ca. 0,7 gange de maternelle værdier. Tre ud af 20 fostre/spædbørn havde en eller flere misdannelser; der var ingen misdannede fostre eller spædbørn fra placebobehandlede mødre. De misdannelser, der opstod hos disse tre abefostre, omfattede anencefali og ensidig anophthalmia hos det ene foster, mikroftalmi hos det andet og ganespalte i det tredje. Der var ingen NOAEL (ingen observerbar uønsket effekt niveau) etableret for denne undersøgelse, fordi kun én dosis blev evalueret. Til rotter blev efavirenz administreret enten under organogenese (drægtighedsdage 7 til 18) eller fra drægtighedsdag 7 til diegivningsdag 21 med 50, 100 eller 200 mg/kg/dag. Administration af 200 mg/kg/dag til rotter var forbundet med stigning i forekomsten af tidlige resorptioner; og doser på 100 mg/kg/dag og mere var forbundet med tidlig neonatal dødelighed. AUC ved NOAEL (50 mg/kg/dag) i dette rottestudie var 0,1 gange højere end hos mennesker ved den anbefalede kliniske dosis. Lægemiddelkoncentrationer i mælken på diegivningsdag 10 var ca. 8 gange højere end i moderens plasma. Hos gravide kaniner var efavirenz hverken embryoletalt eller teratogent, når det blev administreret i doser på 25, 50 og 75 mg/kg/dag i løbet af organogeneseperioden (drægtighedsdage 6 til 18). AUC ved NOAEL (75 mg/kg/dag) hos kaniner var 0,4 gange højere end hos mennesker ved den anbefalede kliniske dosis.
Amning
Risikooversigt
Centers for Disease Control and Prevention anbefaler, at HIV-inficerede mødre ikke ammer deres spædbørn for at undgå at risikere postnatal overførsel af HIV. På grund af potentialet for HIV-overførsel hos ammede spædbørn, rådgive kvinder om ikke at amme.
Hunner og mænd med reproduktionspotentiale
På grund af potentielle teratogene virkninger bør graviditet undgås hos kvinder, der får SUSTIVA. [se Graviditet .]
Graviditetstest
Kvinder med reproduktionspotentiale bør gennemgå graviditetstest før påbegyndelse af SUSTIVA.
Svangerskabsforebyggelse
Kvinder med reproduktionspotentiale bør anvende effektiv prævention under behandling med SUSTIVA 200 mg og i 12 uger efter seponering af SUSTIVA 200 mg på grund af efavirenz' lange halveringstid. Barriereprævention bør altid anvendes i kombination med andre præventionsmetoder. Hormonelle metoder, der indeholder progesteron, kan have nedsat effektivitet [se DRUGSINTERAKTIONER ].
Pædiatrisk brug
Sikkerheden, den farmakokinetiske profil og det virologiske og immunologiske respons af SUSTIVA 600 mg blev evalueret hos antiretroviral-naive og - erfarne HIV-1-inficerede pædiatriske patienter i alderen 3 måneder til 21 år i tre åbne kliniske forsøg [se BIVIRKNINGER , KLINISK FARMAKOLOGI , og Kliniske Studier ]. Typen og frekvensen af bivirkninger i disse undersøgelser svarede generelt til dem hos voksne patienter med undtagelse af en højere frekvens af udslæt, inklusive en højere frekvens af grad 3 eller 4 udslæt, hos pædiatriske patienter sammenlignet med voksne [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Brug af SUSTIVA til patienter under 3 måneder ELLER under 3,5 kg legemsvægt anbefales ikke, fordi sikkerheden, farmakokinetikken og den antivirale aktivitet af SUSTIVA 600 mg ikke er blevet evalueret i denne aldersgruppe, og der er risiko for udvikling af HIV-resistens hvis SUSTIVA er underdoseret. se DOSERING OG ADMINISTRATION til doseringsanbefalinger til pædiatriske patienter.
Geriatrisk brug
Kliniske undersøgelser af SUSTIVA 200 mg omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Generelt bør dosisvalg for en ældre patient være forsigtigt, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden behandling.
Nedsat leverfunktion
SUSTIVA anbefales ikke til patienter med moderat eller svær leverinsufficiens, fordi der er utilstrækkelige data til at bestemme, om dosisjustering er nødvendig. Patienter med let nedsat leverfunktion kan behandles med efavirenz uden dosisjustering. På grund af den omfattende cytokrom P450-medierede metabolisme af efavirenz og begrænset klinisk erfaring hos patienter med nedsat leverfunktion, bør der udvises forsigtighed med at administrere SUSTIVA til disse patienter [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
OVERDOSIS
Nogle patienter, der ved et uheld tager 600 mg to gange dagligt, har rapporteret øgede nervesystemsymptomer. En patient oplevede ufrivillige muskelsammentrækninger.
Behandling af overdosering med SUSTIVA 200 mg bør bestå af generelle støtteforanstaltninger, herunder monitorering af vitale tegn og observation af patientens kliniske status. Administration af aktivt kul kan bruges til at hjælpe med fjernelse af uabsorberet lægemiddel. Der er ingen specifik modgift mod overdosering med SUSTIVA. Da efavirenz er stærkt proteinbundet, er det usandsynligt, at dialyse i væsentlig grad vil fjerne lægemidlet fra blodet.
KONTRAINDIKATIONER
- SUSTIVA er kontraindiceret hos patienter med tidligere påvist klinisk signifikant overfølsomhed (f.eks. Stevens-Johnsons syndrom, erythema multiforme eller toksiske hududbrud) over for nogen af komponenterne i dette produkt.
- Samtidig administration af efavirenz med elbasvir og grazoprevir er kontraindiceret [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Efavirenz er et antiviralt lægemiddel [se Mikrobiologi ].
Farmakodynamik
Hjerteelektrofysiologi
Effekten af SUSTIVA 600 mg på QTc-intervallet blev evalueret i et åbent, positivt og placebokontrolleret, fast enkeltsekvens 3-perioder, 3-behandlings crossover QT-studie med 58 raske forsøgspersoner beriget for CYP2B6 polymorfismer. Den gennemsnitlige Cmax for efavirenz hos forsøgspersoner med CYP2B6 *6/*6 genotype efter administration af 600 mg daglig dosis i 14 dage var 2,25 gange den gennemsnitlige Cmax observeret hos forsøgspersoner med CYP2B6 *1/*1 genotype. En positiv sammenhæng mellem efavirenzkoncentration og QTc-forlængelse blev observeret. Baseret på koncentration-QTc-forholdet er den gennemsnitlige QTc-forlængelse og dens øvre grænse på 90 % konfidensinterval 8,7 ms og 11,3 ms hos personer med CYP2B6*6/*6 genotype efter administration af 600 mg daglig dosis i 14 dage [se ADVARSLER OG FORHOLDSREGLER ].
Farmakokinetik
Absorption
Maksimal plasmakoncentration af efavirenz på 1,6-9,1 μM blev opnået inden for 5 timer efter enkelte orale doser på 100 mg til 1600 mg administreret til uinficerede frivillige. Dosisrelaterede stigninger i Cmax og AUC blev set for doser op til 1600 mg; stigningerne var mindre end proportionale, hvilket tyder på nedsat absorption ved højere doser.
Hos HIV-1-inficerede patienter ved steady state var gennemsnitlig Cmax, gennemsnitlig Cmin og gennemsnitlig AUC dosisproportional efter 200 mg, 400 mg og 600 mg daglige doser. Tid til maksimal plasmakoncentration var ca. 3-5 timer, og steady-state plasmakoncentrationer blev nået på 6-10 dage. Hos 35 patienter, der fik SUSTIVA 600 mg én gang dagligt, var steady-state Cmax 12,9 ± 3,7 μM (gennemsnit ± SD), steadystate Cmin var 5,6 ± 3,2 μM, og AUC var 184 ± 73 μM•h.
Effekt af mad på oral absorption:
Kapsler
Administration af en enkelt 600 mg dosis efavirenz kapsler sammen med et måltid med højt fedtindhold/højt kalorieindhold (894 kcal, 54 g fedt, 54 % kalorier fra fedt) eller et måltid med reduceret fedt/normalt kalorieindhold (440 kcal, 2 g fedt, 4 % kalorier fra fedt) var forbundet med en gennemsnitlig stigning på 22 % og 17 % i efavirenz AUC∞ og en gennemsnitlig stigning på henholdsvis 39 % og 51 % i efavirenz Cmax, i forhold til eksponeringen opnået, når det gives under fastende forhold . [se DOSERING OG ADMINISTRATION og PATIENTOPLYSNINGER .]
Tabletter
Administration af en enkelt 600 mg efavirenz-tablet sammen med et måltid med højt fedtindhold/højt kalorieindhold (ca. 1000 kcal, 500-600 kcal fra fedt) var forbundet med en stigning på 28 % i den gennemsnitlige AUC∞ for efavirenz og en stigning på 79 % i gennemsnittet Cmax for efavirenz i forhold til eksponeringerne opnået under fastende forhold. [se DOSERING OG ADMINISTRATION og PATIENTOPLYSNINGER .]
Biotilgængelighed af kapselindhold blandet med fødevarevehikler
Hos raske voksne forsøgspersoner opfyldte efavirenz AUC, når det blev administreret som indholdet af tre 200 mg kapsler blandet med 2 teskefulde af visse fødevarebærere (æblemos, vindruegele eller yoghurt eller modermælkserstatning) bioækvivalenskriterierne for AUC for den administrerede intakte kapselformulering under fastende forhold.
Fordeling
Efavirenz er stærkt bundet (ca. 99,5-99,75%) til humane plasmaproteiner, overvejende albumin. Hos HIV-1-inficerede patienter (n=9), som fik SUSTIVA 200 til 600 mg én gang dagligt i mindst en måned, varierede cerebrospinalvæskekoncentrationerne fra 0,26 til 1,19 % (gennemsnitlig 0,69 %) af den tilsvarende plasmakoncentration. Denne andel er ca. 3 gange højere end den ikke-proteinbundne (fri) fraktion af efavirenz i plasma.
Metabolisme
Studier på mennesker og in vitro undersøgelser med humane levermikrosomer har vist, at efavirenz hovedsageligt metaboliseres af cytochrom P450-systemet til hydroxylerede metabolitter med efterfølgende glucuronidering af disse hydroxylerede metabolitter. Disse metabolitter er i det væsentlige inaktive over for HIV-1. In vitro undersøgelserne tyder på, at CYP3A og CYP2B6 er de vigtigste isozymer, der er ansvarlige for efavirenz metabolisme.
Efavirenz har vist sig at inducere CYP-enzymer, hvilket resulterer i induktion af dets egen metabolisme. Flere doser på 200-400 mg dagligt i 10 dage resulterede i et lavere end forudsagt omfang af akkumulering (22-42 % lavere) og en kortere terminal halveringstid på 40-55 timer (enkeltdosis halveringstid 52-76 timer) ).
Elimination
Efavirenz har en terminal halveringstid på 52-76 timer efter enkeltdoser og 40-55 timer efter multiple doser. En måneds massebalance/udskillelsesundersøgelse blev udført med 400 mg dagligt med en C-mærket dosis administreret på dag 8. Ca. 14-34 % af radiomærket blev genfundet i urinen, og 16-61 % blev genfundet i fæces . Næsten al urinudskillelsen af det radioaktivt mærkede lægemiddel var i form af metabolitter. Efavirenz tegnede sig for størstedelen af den samlede radioaktivitet målt i fæces.
Særlige Populationer
Pædiatrisk
De farmakokinetiske parametre for efavirenz ved steady state hos pædiatriske patienter blev forudsagt af en populationsfarmakokinetisk model og er opsummeret i tabel 6 efter vægtintervaller, der svarer til de anbefalede doser.
Køn og race
Efavirenz' farmakokinetik hos patienter synes at være ens for mænd og kvinder og blandt de undersøgte racegrupper.
Nedsat nyrefunktion
Efavirenz' farmakokinetik er ikke blevet undersøgt hos patienter med nyreinsufficiens; dog udskilles mindre end 1 % efavirenz uændret i urinen, så virkningen af nedsat nyrefunktion på efavirenz-elimineringen bør være minimal.
Nedsat leverfunktion
Et studie med flere doser viste ingen signifikant effekt på efavirenz farmakokinetik hos patienter med let nedsat leverfunktion (Child-Pugh klasse A) sammenlignet med kontroller. Der var utilstrækkelige data til at bestemme, om moderat eller svær leverinsufficiens (Child-Pugh klasse B eller C) påvirker efavirenz farmakokinetik.
Lægemiddelinteraktionsstudier
Efavirenz har vist sig in vivo at forårsage hepatisk enzyminduktion, hvilket øger biotransformationen af nogle lægemidler, der metaboliseres af CYP3A og CYP2B6. In vitro-studier har vist, at efavirenz hæmmede CYP-isozymer 2C9 og 2C19 med Ki-værdier (8,5-17 μM) i området for observerede efavirenz-plasmakoncentrationer. I in vitro-studier hæmmede efavirenz ikke CYP2E1 og hæmmede CYP2D6 og CYP1A2 (Ki-værdier 82-160 μM) kun ved koncentrationer langt over dem, der er opnået klinisk. Samtidig administration af efavirenz med lægemidler, der primært metaboliseres af CYP2C9, CYP2C19, CYP3A eller CYP2B6 isozymer, kan resultere i ændrede plasmakoncentrationer af det samtidig administrerede lægemiddel. Lægemidler, der inducerer CYP3A- og CYP2B6-aktivitet, forventes at øge clearance af efavirenz, hvilket resulterer i nedsatte plasmakoncentrationer.
Lægemiddelinteraktionsstudier blev udført med efavirenz og andre lægemidler, der sandsynligvis vil blive administreret samtidigt, eller lægemidler, der almindeligvis anvendes som prober til farmakokinetisk interaktion. Effekterne af samtidig administration af efavirenz på Cmax, AUC og Cmin er opsummeret i tabel 7 (effekt af efavirenz på andre lægemidler) og tabel 8 (virkning af andre lægemidler på efavirenz). For information om kliniske anbefalinger se DRUGSINTERAKTIONER .
Mikrobiologi
Handlingsmekanisme
Efavirenz er en NNRTI af HIV-1. Efavirenz-aktivitet medieres overvejende af ikke-kompetitiv hæmning af HIV-1 revers transkriptase. HIV-2 revers transkriptase og humane cellulære DNA-polymeraser α, β, γ og δ hæmmes ikke af efavirenz.
Antiviral aktivitet i cellekultur
Koncentrationen af efavirenz, der hæmmer replikation af vildtype-laboratorietilpassede stammer og kliniske isolater i cellekultur med 90-95 % (EC90-95) varierede fra 1,7 til 25 nM i lymfoblastoide cellelinjer, mononukleære celler fra perifert blod (PBMC'er) og makrofager /monocytkulturer. Efavirenz udviste antiviral aktivitet mod clade B og de fleste non-clade B isolater (subtype A, AE, AG, C, D, F, G, J, N), men havde reduceret antiviral aktivitet mod gruppe O-vira. Efavirenz udviste additiv antiviral aktivitet uden cytotoksicitet mod HIV-1 i cellekulturer, når det kombineres med NNRTI'erne delavirdin og nevirapin, NRTI'er (abacavir, didanosin, emtricitabin, lamivudin, stavudin, tenofovir, zalcitabin, zidovudin, PIs, invirena, PIs, virampudin, PIs nelfinavir, ritonavir, saquinavir) og fusionshæmmeren enfuvirtid. Efavirenz viste additiv til antagonistisk antiviral aktivitet i cellekultur med atazanavir. Efavirenz var ikke antagonistisk med adefovir, anvendt til behandling af hepatitis B-virusinfektion, eller ribavirin, anvendt i kombination med interferon til behandling af hepatitis C-virusinfektion.
Modstand
cellekultur
I cellekultur opstod HIV-1-isolater med reduceret modtagelighed for efavirenz (>380 gange stigning i EC90-værdi) hurtigt i nærvær af lægemiddel. Genotypisk karakterisering af disse vira identificerede enkelte aminosyresubstitutioner L100I eller V179D, dobbeltsubstitutioner L100I/V108I og tredobbelte substitutioner L100I/V179D/Y181C i revers transkriptase.
Kliniske Studier
Der er opnået kliniske isolater med reduceret modtagelighed i cellekultur for efavirenz. En eller flere substitutioner i aminosyrepositionerne 98, 100, 101, 103, 106, 108, 188, 190, 225 og 227 i revers transkriptase blev observeret hos patienter, der svigtede behandling med efavirenz i kombination med indinavir eller med zidovudin plus lamivudin. K103N-substitutionen var den hyppigst observerede. Langtidsresistensovervågning (gennemsnit 52 uger, interval 4-106 uger) analyserede 28 matchende baseline- og virologiske svigtisolater. 61 procent (17/28) af disse svigtende isolater havde nedsat efavirenz-følsomhed i cellekultur med en median 88-fold ændring i efavirenz-følsomhed (EC50-værdi) fra referencen. Den hyppigste NNRTI-substitution, der blev udviklet i disse patientisolater, var K103N (54%). Andre NNRTI-substitutioner, der udviklede sig, omfattede L100I (7%), K101E/Q/R (14%), V108I (11%), G190S/T/A (7%), P225H (18%) og M230I/L (11). %).
Krydsmodstand
Krydsresistens blandt NNRTI'er er blevet observeret. Kliniske isolater tidligere karakteriseret som efavirenz-resistente var også fænotypisk resistente i cellekultur over for delavirdin og nevirapin sammenlignet med baseline. Delavirdin- og/eller nevirapin-resistente kliniske virale isolater med NNRTI-resistens-associerede substitutioner (A98G, L100I, K101E/P, K103N/S, V106A, Y181X, Y188X, G190X, P225H, F227a susceptibility) i cellekultur. Mere end 90 % af NRTI-resistente kliniske isolater testet i cellekultur bevarede modtageligheden for efavirenz.
Dyretoksikologi
Ikke-vedvarende kramper blev observeret hos 6 ud af 20 aber, der fik efavirenz i doser, der gav plasma-AUC-værdier 4-13 gange højere end hos mennesker, der fik den anbefalede dosis [se ADVARSLER OG FORHOLDSREGLER ].
Kliniske Studier
Voksne
Studie 006 et randomiseret, åbent forsøg, sammenlignede SUSTIVA (600 mg én gang dagligt) + zidovudin (ZDV, 300 mg 12. time) + lamivudin (LAM, 150 mg 12. time) eller SUSTIVA (600 mg én gang dagligt) + indinavir (IDV, 1000 mg q8h) med indinavir (800 mg q8h) + zidovudin (300 mg q12h) + lamivudin (150 mg q12h). Tolv hundrede seksogtres patienter (gennemsnitsalder 36,5 år [interval 18-81], 60 % kaukasiske, 83 % mænd) blev indskrevet. Alle patienter var efavirenz-, lamivudin-, NNRTI- og PI-naive ved studiestart. Median baseline CD4+ celletal var 320 celler/mm3 og median baseline HIV-1 RNA niveau var 4,8 log kopier/ml. Behandlingsresultater med standardassay (assaygrænse 400 kopier/ml) gennem 48 og 168 uger er vist i tabel 9. Plasma HIV RNA-niveauer blev kvantificeret med standard (assaygrænse 400 kopier/mL) og ultrasensitiv (assaygrænse 50 kopier/ml) versioner af AMPLICOR HIV-1 MONITOR-analysen. Under undersøgelsen blev version 1.5 af assayet introduceret i Europa for at forbedre påvisningen af non-clade B-virus.
For patienter behandlet med SUSTIVA + zidovudin + lamivudin, SUSTIVA + indinavir eller indinavir + zidovudin + lamivudin var procentdelen af respondere med HIV-1 RNA
ACTG 364 er et randomiseret, dobbeltblindt, placebokontrolleret, 48-ugers studie med NRTI-erfarne patienter, som havde gennemført to tidligere ACTG-studier. Et hundrede seksoghalvfems patienter (gennemsnitsalder 41 år [interval 18-76], 74 % kaukasiske, 88 % mænd) fik NRTI'er i kombination med SUSTIVA (600 mg én gang dagligt) eller nelfinavir (NFV, 750 mg tre gange dagligt) ), eller SUSTIVA (600 mg én gang dagligt) + nelfinavir på en randomiseret, dobbeltblindet måde. Det gennemsnitlige CD4+-celletal ved baseline var 389 celler/mm3, og det gennemsnitlige baseline-HIV-1 RNA-niveau var 8130 kopier/ml. Ved indtræden i undersøgelsen blev alle patienter tildelt et nyt åbent NRTI-regime, som var afhængigt af deres tidligere NRTI-behandlingserfaring. Der var ingen signifikant forskel i det gennemsnitlige CD4+-celletal blandt behandlingsgrupper; den samlede gennemsnitlige stigning var ca. 100 celler efter 48 uger blandt patienter, der fortsatte med undersøgelsesregimer. Behandlingsresultater er vist i tabel 10. Plasma HIV RNA-niveauer blev kvantificeret med AMPLICOR HIV-1 MONITOR-analysen under anvendelse af en nedre grænse for kvantificering på 500 kopier/ml.
En Kaplan-Meier-analyse af tid til behandlingssvigt gennem 72 uger viser en længere varighed af virologisk suppression (HIV RNA
Pædiatriske patienter
Studie AI266922 er et åbent studie til evaluering af farmakokinetik, sikkerhed, tolerabilitet og antiviral aktivitet af SUSTIVA 200 mg i kombination med didanosin og emtricitabin hos antiretroviral-naive og -erfarne pædiatriske patienter. Syvogtredive patienter i alderen 3 måneder til 6 år (median 0,7 år) blev behandlet med SUSTIVA. Ved baseline var median plasma HIV-1 RNA 5,88 log kopier/ml, median CD4+ celletal var 1144 celler/mm3, og median CD4+ procent var 25%. Mediantiden på studieterapi var 60 uger; 27 % af patienterne seponerede før uge 48. Ved hjælp af en ITT-analyse var den samlede andel af patienter med HIV RNA
Studie PACTG 1021 var et åbent studie til evaluering af farmakokinetikken, sikkerheden, tolerabiliteten og den antivirale aktivitet af SUSTIVA 200 mg i kombination med didanosin og emtricitabin hos pædiatriske patienter, som var naive med antiretroviral terapi. 43 patienter i alderen 3 måneder til 21 år (median 9,6 år) blev doseret med SUSTIVA. Ved baseline var median plasma HIV-1 RNA 4,8 log kopier/ml, median CD4+ celletal var 367 celler/mm3, og median CD4+ procent var 18%. Mediantiden på studieterapi var 181 uger; 16 % af patienterne seponerede før uge 48. Ved hjælp af en ITT-analyse var den samlede andel af patienter med HIV RNA
Studie PACTG 382 var et åbent studie til evaluering af farmakokinetik, sikkerhed, tolerabilitet og antiviral aktivitet af SUSTIVA i kombination med nelfinavir og en NRTI hos antiretroviral-naive og NRTI-erfarne pædiatriske patienter. 102 patienter i alderen 3 måneder til 16 år (median 5,7 år) blev behandlet med SUSTIVA. 87 procent af patienterne havde tidligere modtaget antiretroviral behandling. Ved baseline var median plasma HIV-1 RNA 4,57 log kopier/ml, median CD4+ celletal var 755 celler/mm3, og median CD4+ procent var 30%. Mediantiden på studieterapi var 118 uger; 25 % af patienterne seponerede før uge 48. Ved hjælp af en ITT-analyse var den samlede andel af patienter med HIV RNA
PATIENTOPLYSNINGER
SUSTIVA® (sus-TEE-vah) (efavirenz) kapsler
SUSTIVA® (sus-TEE-vah) (efavirenz) tabletter
Vigtigt: Spørg din læge eller apoteket om medicin, der ikke bør tages sammen med SUSTIVA. For mere information, se afsnittet "Hvad skal jeg fortælle min læge, før jeg tager SUSTIVA?"
Læs denne patientinformation, før du begynder at tage SUSTIVA, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din læge om din medicinske tilstand eller behandling.
Hvad er SUSTIVA?
SUSTIVA 600mg er en receptpligtig HIV-1 (Human Immunodeficiency Virus type 1) medicin, der bruges sammen med andre antiretrovirale lægemidler til behandling af HIV-1 infektion hos voksne og børn, der er mindst 3 måneder gamle, og som vejer mindst 7 pounds 12 ounces (3,5 ounces). kg). HIV er den virus, der forårsager AIDS (Acquired Immune Deficiency Syndrome).
Det vides ikke, om SUSTIVA er sikkert og effektivt til børn under 3 måneder, eller som vejer mindre end 7 pund 12 ounce (3,5 kg).
Når det bruges sammen med andre antiretrovirale lægemidler til behandling af HIV-1-infektion, kan SUSTIVA 600 mg hjælpe:
- reducere mængden af HIV-1 i dit blod. Dette kaldes viral load.
- øge antallet af CD4+ (T) celler i dit blod, som hjælper med at bekæmpe andre infektioner.
At reducere mængden af HIV-1 og øge CD4+ (T) cellerne i dit blod kan hjælpe med at forbedre dit immunsystem. Dette kan reducere din risiko for at dø eller få infektioner, der kan opstå, når dit immunsystem er svagt (opportunistiske infektioner).
SUSTIVA 600mg helbreder ikke HIV-1-infektion eller AIDS. Du bør fortsætte med at tage HIV-1-medicin for at kontrollere HIV-1-infektion og mindske HIV-relaterede sygdomme.
Undgå at gøre ting, der kan sprede HIV-1-infektion til andre:
- Del eller genbrug ikke nåle eller andet injektionsudstyr.
- Del ikke personlige ejendele, der kan have blod eller kropsvæsker på dem, såsom tandbørster og barberblade.
- Hav ikke nogen form for sex uden beskyttelse. Udøv altid sikrere sex ved at bruge et latex- eller polyurethankondom for at mindske chancen for seksuel kontakt med kropsvæsker såsom sæd, vaginalt sekret eller blod.
Spørg din læge, hvis du har spørgsmål om, hvordan du forhindrer, at HIV overføres til andre mennesker.
Hvem bør ikke tage SUSTIVA 600mg?
Tag ikke SUSTIVA, hvis du er allergisk over for efavirenz eller et af indholdsstofferne i SUSTIVA. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i SUSTIVA.
Tag ikke SUSTIVA, hvis du i øjeblikket tager elbasvir og grazoprevir (ZEPATIER®).
Hvad skal jeg fortælle min læge, før jeg tager SUSTIVA 200mg?
Inden du tager SUSTIVA, skal du fortælle din læge, hvis du har nogen medicinske tilstande, og især hvis du:
- har en hjertesygdom
- nogensinde har haft et psykisk problem
- nogensinde har brugt gadestoffer eller store mængder alkohol
- har leverproblemer, herunder hepatitis B- eller C-virusinfektion
- har en historie med anfald
- er gravid eller planlægger at blive gravid. SUSTIVA 600mg kan skade dit ufødte barn. Hvis du er i stand til at blive gravid, skal din læge tage en graviditetstest, før du starter med SUSTIVA. Du bør ikke blive gravid, mens du tager SUSTIVA og i 12 uger efter, at behandlingen med SUSTIVA er stoppet. Kvinder, der er i stand til at blive gravide, bør bruge 2 effektive former for prævention under behandlingen og i 12 uger efter ophør af behandlingen med SUSTIVA. En barriereform for prævention bør altid bruges sammen med en anden form for prævention.
- Barriereformer for prævention kan omfatte latex- eller polyurethankondom, svangerskabsforebyggende svamp, membran med sæddræbende middel og cervikal hætte.
- Hormonelle former for prævention, såsom p-piller, injektioner, vaginale ringe eller implantater virker muligvis ikke under behandling med SUSTIVA.
- Tal med din læge om former for prævention, der kan bruges under behandling med SUSTIVA.
- Graviditetsregister. Der findes et graviditetsregister for kvinder, der tager antiretroviral medicin under graviditeten. Formålet med dette register er at indsamle oplysninger om helbredet for dig og din baby. Tal med din læge om, hvordan du kan deltage i dette register.
- Du må ikke amme, hvis du tager SUSTIVA.
- Du bør ikke amme, hvis du har HIV på grund af risikoen for at overføre HIV til din baby.
Fortæl din læge og apoteket om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler.
SUSTIVA 600mg kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke, hvordan SUSTIVA 600mg virker, og kan forårsage alvorlige bivirkninger. Hvis du tager visse lægemidler sammen med SUSTIVA, kan mængden af SUSTIVA 600 mg i din krop være for lav, og det kan muligvis ikke hjælpe med at kontrollere din hiv-infektion. HIV-virussen i din krop kan blive resistent over for SUSTIVA eller anden HIV-medicin, der ligner den.
Du bør ikke tage SUSTIVA 600 mg, hvis du tager ATRIPLA (efavirenz, emtricitabin, tenofovirdisoproxilfumarat), medmindre din læge fortæller dig det.
Fortæl din læge og apoteket om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. Nogle lægemidler interagerer med SUSTIVA.
Hold en liste over din medicin for at vise din læge og apotek.
- Du kan bede din læge eller apoteket om en liste over lægemidler, der interagerer med SUSTIVA.
- Begynd ikke at tage en ny medicin uden at fortælle det til din læge. Din læge kan fortælle dig, om det er sikkert at tage SUSTIVA sammen med anden medicin.
Hvordan skal jeg tage SUSTIVA?
- Tag SUSTIVA 600 mg nøjagtigt som din læge fortæller dig.
- Du må ikke ændre din dosis eller stoppe med at tage SUSTIVA, medmindre din læge fortæller dig det.
- Bliv under din læges pleje under behandlingen med SUSTIVA.
- SUSTIVA skal bruges sammen med andre antiretrovirale lægemidler.
- Tag SUSTIVA 1 gang hver dag.
- SUSTIVA kommer som tabletter eller kapsler.
- SUSTIVA tabletter må ikke brydes.
- Synk SUSTIVA tabletter eller kapsler hele med væske.
Hvordan og hvornår skal du tage SUSTIVA.
- Du bør tage SUSTIVA 600 mg på tom mave ved sengetid. Hvis du tager SUSTIVA 200 mg sammen med mad, øges mængden af medicin i din krop. Nogle bivirkninger kan genere dig mindre, hvis du tager SUSTIVA 600 mg på tom mave og ved sengetid.
- Dit barns læge vil ordinere den rigtige dosis SUSTIVA 200 mg baseret på dit barns vægt.
- Hvis du har svært ved at sluge tabletter eller kapsler, skal du fortælle det til din læge. Din læge kan anbefale at åbne SUSTIVA-kapslen og blande indholdet med mad eller modermælkserstatning. Se den detaljerede "Brugsvejledning" i slutningen af denne patientinformation for at lære den rigtige måde at tage SUSTIVA 600mg på ved hjælp af kapselstrøsmetoden.
- Voksne og børn, der tager SUSTIVA 600mg ved hjælp af kapseldrysmetoden, bør ikke spise i 2 timer efter at have taget en dosis SUSTIVA.
- Spædbørn bør ikke gives modermælkserstatning i 2 timer efter at have taget en dosis SUSTIVA ved brug af kapselstrøsmetoden.
- Gå ikke glip af en dosis SUSTIVA. Hvis du glemmer at tage SUSTIVA, skal du tage den glemte dosis med det samme, medmindre det næsten er tid til din næste dosis. Tag ikke 2 doser på én gang. Du skal bare tage din næste dosis på dit faste tidspunkt. Spørg din læge eller apotek, hvis du har brug for hjælp til at planlægge de bedste tidspunkter for at tage din medicin.
- Hvis du tager for meget SUSTIVA, skal du straks kontakte din læge eller gå til den nærmeste skadestue.
- Når din SUSTIVA 600mg forsyning begynder at løbe tør, få mere fra din læge eller apotek. Det er vigtigt ikke at løbe tør for SUSTIVA. Mængden af HIV-1 i dit blod kan stige, hvis medicinen stoppes i blot en kort periode. Virussen kan blive resistent over for SUSTIVA 600 mg og sværere at behandle.
Hvad er de mulige bivirkninger af SUSTIVA?
SUSTIVA 600mg kan forårsage alvorlige bivirkninger, herunder:
Hvis du har svimmelhed, koncentrationsbesvær eller døsighed, må du ikke køre bil, bruge maskiner eller gøre noget, der kræver, at du er opmærksom.
Nogle nervesystemsymptomer (f.eks. forvirring, langsomme tanker og fysiske bevægelser og vrangforestillinger [falske overbevisninger] eller hallucinationer [at se eller høre ting, som andre ikke ser eller hører]) kan forekomme måneder til år efter påbegyndelse af SUSTIVA 600 mg behandling. Kontakt straks din læge, hvis nogen af disse symptomer opstår.
Fortæl din læge med det samme, hvis du får nogle af følgende symptomer:
- Alvorlige psykiske problemer kan forekomme hos personer, der tager SUSTIVA. Fortæl din læge med det samme, hvis du har nogle af følgende symptomer:
- føler dig trist eller håbløs, stol ikke på andre mennesker
- føle sig ængstelig eller rastløs høre eller se ting, der ikke er ægte
- har tanker om at skade dig selv (selvmord) eller har forsøgt at skade dig selv eller andre
- er ikke i stand til at bevæge sig eller tale normalt
- er ikke i stand til at kende forskel på, hvad der er sandt eller virkeligt, og hvad der er falsk eller uvirkeligt
- Symptomer på nervesystemet er almindelige hos personer, der tager SUSTIVA 200 mg og kan være alvorlige. Disse symptomer begynder normalt i løbet af den første eller anden dag af behandlingen med SUSTIVA 200 mg og forsvinder normalt efter 2 til 4 ugers behandling. Nogle symptomer kan forekomme måneder til år efter påbegyndelse af SUSTIVA-behandling. Disse symptomer kan blive værre, hvis du drikker alkohol, tager medicin mod psykiske problemer eller bruger visse gadestoffer under behandling med SUSTIVA. Symptomer kan omfatte:
- svimmelhed
- koncentrationsbesvær
- problemer med at sove
- døsighed
- usædvanlige drømme
- manglende koordination eller problemer med balancen
- Udslæt er almindelig med SUSTIVA 600 mg, men kan nogle gange være alvorlig. Hududslæt forsvinder normalt uden nogen ændring i behandlingen. Hvis du udvikler udslæt med et af følgende symptomer, skal du straks fortælle det til din læge:
- hududslæt, med eller uden kløe
- afskalning af hud
- feber
- sår i munden
- hævelse af dit ansigt
- røde eller betændte øjne, som "pink eye" (konjunktivitis)
- blærer eller hudlæsioner
- Leverproblemer, herunder leversvigt og død kan forekomme hos personer, der tager SUSTIVA. Leverproblemer kan forekomme hos mennesker uden en historie med leverproblemer. Din læge vil tage blodprøver for at kontrollere din lever, før du starter med SUSTIVA 200 mg og under behandlingen.
- din hud eller den hvide del af dine øjne bliver gul (gulsot)
- du har ikke lyst til at spise mad i flere dage eller længere
- din urin bliver mørk
- du får ondt i maven (kvalme)
- din afføring (afføring) bliver lys i farven
- du har smerter i nederste del af maven (mave).
- Anfald kan forekomme hos personer, der tager SUSTIVA. Anfald er mere tilbøjelige til at ske, hvis du tidligere har haft anfald. Fortæl det til din læge, hvis du har haft et anfald, eller hvis du tager medicin for at forhindre anfald.
- Ændringer i dit immunsystem (Immun Reconstitution Syndrome) kan ske, når du begynder at tage HIV-1-medicin. Dit immunsystem kan blive stærkere og begynde at bekæmpe infektioner, der har været skjult i din krop i lang tid. Fortæl det til din læge, hvis du begynder at få nye symptomer efter at have startet din HIV-1 medicin.
- Ændringer i kropsfedt kan ske hos personer, der tager HIV-1-medicin. Disse ændringer kan omfatte øget mængde fedt i den øvre del af ryggen og nakken ("bøffelpukkel"), brystet og omkring hoveddelen af din krop (stammen). Tab af fedt fra ben, arme og ansigt kan også ske. Årsagen til og langsigtede helbredseffekter af disse tilstande kendes ikke.
De mest almindelige bivirkninger af SUSTIVA 600mg omfatter:
- udslæt
- unormale drømme
- svimmelhed
- træthed
- kvalme
- problemer med at sove
- hovedpine
- opkastning
- koncentrationsbesvær
Nogle patienter, der tager SUSTIVA, har oplevet forhøjede niveauer af lipider (kolesterol og triglycerider) i blodet. Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af SUSTIVA. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare SUSTIVA?
- Opbevar SUSTIVA kapsler og tabletter ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
Opbevar SUSTIVA og al medicin utilgængeligt for børn.
Generel information om SUSTIVA
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en patientinformationsfolder. Brug ikke SUSTIVA 600mg til en tilstand, som den ikke er ordineret til. Giv ikke SUSTIVA 600 mg til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Hvis du vil have mere information, så tal med din læge. Du kan bede din apoteker eller læge om oplysninger om SUSTIVA, som er skrevet til sundhedspersonale. For mere information, gå til www.sustiva.com eller ring på 1-800-321-1335.
Hvad er ingredienserne i SUSTIVA?
Aktiv ingrediens: efavirenz
Inaktive ingredienser:
SUSTIVA 600mg kapsler: lactosemonohydrat, magnesiumstearat, natriumlaurylsulfat og natriumstivelsesglycolat. Kapselskallen indeholder gelatine, natriumlaurylsulfat, titaniumdioxid og/eller gult jernoxid. Kapselskallen kan også indeholde siliciumdioxid. Kapslerne er trykt med blæk, der indeholder carmine 40 blue, FD&C Blue No. 2 og titaniumdioxid.
SUSTIVA tabletter: croscarmellosenatrium, hydroxypropylcellulose, lactosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose og natriumlaurylsulfat. Tabletfilmovertrækket indeholder Opadry Yellow og Opadry Clear. Tabletterne er poleret med carnaubavoks og trykt med lilla blæk, Opacode WB.
Denne patientinformation er blevet godkendt af US Food and Drug Administration.
Brugsanvisning
SUSTIVA® (sus-TEE-vah) (efavirenz) kapsler
Forberedelse af en dosis SUSTIVA 600mg ved hjælp af kapselstrøsmetoden
Læs denne brugsanvisning, før du tilbereder din første dosis SUSTIVA blandet med mad eller modermælkserstatning ved hjælp af kapselstrøsmetoden, hver gang du får genopfyldning og efter behov. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din læge om din medicinske tilstand eller behandling. Spørg din læge eller apotekspersonalet, hvis du har spørgsmål om, hvordan du blander eller giver en dosis SUSTIVA 200 mg ved hjælp af kapselstrøsmetoden.
Vigtig information:
- For mere information om SUSTIVA 600 mg kapsler, se patientinformationsfolderen.
- Kapseldrysmetoden til at blande indholdet af SUSTIVA kapsler med blød mad eller modermælkserstatning kan bruges til voksne eller børn, der ikke kan sluge kapsler eller tabletter.
- Du bør tage SUSTIVA 600 mg på tom mave ved sengetid.
- Du bør ikke spise i 2 timer efter at have taget SUSTIVA blandet med mad.
- Spædbørn, der er gamle nok til at sluge mad, bør gives SUSTIVA ved at bruge kapseldrysmetoden blandet med mad i stedet for med modermælkserstatning.
- Tal med din læge for at hjælpe med at bestemme den bedste tidsplan for at give din baby SUSTIVA blandet med modermælkserstatning ved hjælp af kapseldrysmetoden.
Tilberedning af en dosis SUSTIVA 600mg blandet med mad ved hjælp af kapselstrøsmetoden.
Inden du tilbereder en dosis SUSTIVA 200 mg blandet med mad ved hjælp af kapselstrøsmetoden, skal du samle følgende forsyninger:
- papirhåndklæder
- teske til måling
- lille ske til omrøring og fodring
- lille ren beholder (såsom en lille kop eller skål)
- blød mad såsom æblemos, druegelé eller yoghurt
Trin 1. Vælg en ren, flad arbejdsflade. Læg et rent køkkenrulle på arbejdsfladen. Læg derefter de andre forsyninger på køkkenrullen.
Trin 2. Vask og tør hænderne godt.
Trin 3. Læg 1 til 2 teskefulde blød mad såsom æblemos, vindruegelé eller yoghurt i den lille beholder (se Figur A ). Farven og tykkelsen af maden kan ændre sig, når den blandes med medicinen.
Figur A
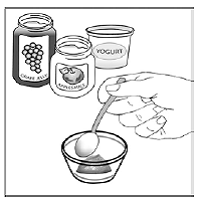
Trin 4. Der er 2 dele af SUSTIVA 200 mg kapslen. Se på SUSTIVA-kapslen for at se, hvilken del af kapslen der overlapper den anden del (se Figur B ).
Figur B
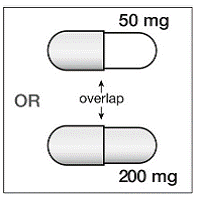
Trin 5. Hold SUSTIVA-kapslen i en sidelæns (vandret) position direkte over beholderen med mad. Hold hver ende af SUSTIVA-kapslen mellem dine tommelfingre og pegefingre (se Figur C ).
Figur C
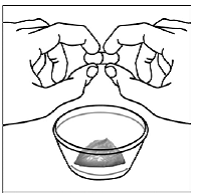
Trin 6. Brug din tommelfinger og pegefinger til at klemme tæt på enden af den overlappende del af SUSTIVA 600 mg kapslen (se Figur D ).
Figur D
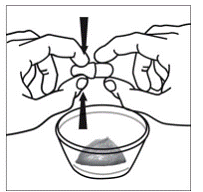
Drej derefter forsigtigt begge ender af SUSTIVA 600 mg kapslen i modsatte retninger for at åbne den (se Figur E ). Pas på ikke at spilde kapselindholdet eller sprede det i luften.
Figur E

Trin 7. Drys indholdet af SUSTIVA-kapslen på maden (se Figur F ).
- Tjek kapselskallerne for at sikre, at de er tomme.
- Smid de tomme kapselskaller væk.
Figur F

Hvis den samlede ordinerede dosis er mere end 1 kapsel, skal du følge trin 4 til 7 for hver kapsel. Tilføj ikke mere mad.
Trin 8 til 11 skal fuldføres inden for 30 minutter at blande medicinen (se Figur G ).
Figur G

Trin 8. Brug den lille ske til forsigtigt at blande kapselindholdet og maden sammen (se Figur H ). Drys vil ikke opløses. Blandingen vil se kornet ud, men bør ikke være klumpet.
Figur H
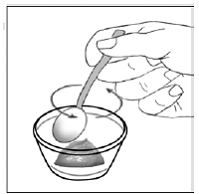
Trin 9. Brug den lille ske til at give eller tage blandingen af mad og kapselindhold. Sørg for, at hele blandingen er slugt.
Trin 10. Tilsæt ca. 2 tsk mere af maden til den tomme beholder og rør forsigtigt med den lille ske for at blande det med kapselindholdet, der stadig er i beholderen.
Trin 11. Brug den lille ske til at give eller tage blandingen af mad og kapselindhold. Sørg for, at hele blandingen er slugt.
Trin 12. Vask beholderen og skeerne. Smid papirhåndklædet væk og rengør arbejdsfladen. Vask dine hænder.
Forberedelse af en dosis SUSTIVA 600mg blandet med modermælkserstatning ved hjælp af kapseldrysmetoden
For at sikre, at dit barn får al medicinen, må du ikke give SUSTIVA kapselindholdet til dit barn i en flaske.
Inden du tilbereder en dosis SUSTIVA blandet med modermælkserstatning ved hjælp af kapseldrysmetoden, skal du samle følgende forsyninger:
- papirhåndklæder
- teske til omrøring og måling
- lille ren beholder (såsom en lille kop eller skål) (se Figur I ).
- 10 mL oral doseringssprøjte (spørg på apoteket om dette) (se Figur I ).
- modermælkserstatning ved stuetemperatur.
Figur I
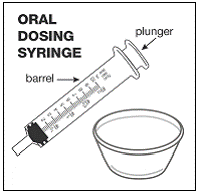
Trin 1. Forbered modermælkserstatningen i henhold til anvisningerne på modermælkserstatningen. Du vil bruge omkring 1 ounce af formlen til at give medicinen. Eventuel resterende modermælkserstatning bør ikke gives til barnet i 2 timer.
Trin 2. Vælg en ren, flad arbejdsflade. Læg et rent køkkenrulle på arbejdsfladen. Placer de forsyninger, du skal bruge, på papirhåndklædet.
Trin 3. Vask og tør hænderne godt.
Trin 4. Hæld 2 teskefulde modermælkserstatning ved stuetemperatur i beholderen (se Figur J ).
Figur J
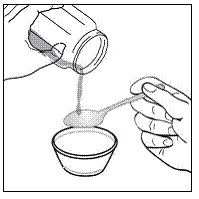
Trin 5. Der er 2 dele af SUSTIVA kapslen. Se på SUSTIVA-kapslen for at se, hvilken del af kapslen der overlapper den anden del (se Figur K ).
Figur K
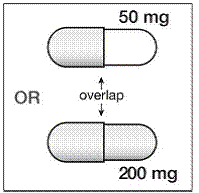
Trin 6. Hold SUSTIVA-kapslen i en sidelæns (vandret) position direkte over beholderen med modermælkserstatningen. Hold hver ende af SUSTIVA 600 mg kapslen mellem tommelfingre og pegefingre (se Figur L ).
Figur L
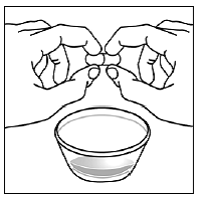
Trin 7. Brug din tommelfinger og pegefinger til at klemme tæt på enden af den overlappende del af SUSTIVA-kapslen (se Figur M ).
Figur M
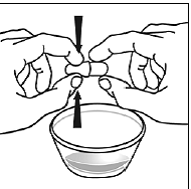
Drej derefter forsigtigt begge ender af SUSTIVA-kapslen i modsatte retninger for at åbne den (se Figur N ). Pas på ikke at spilde kapselindholdet eller sprede det i luften.
Figur N
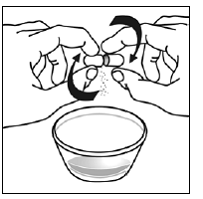
Trin 8. Drys indholdet af SUSTIVA 600 mg kapslen på modermælkserstatningen (se Figur O ).
- Tjek kapselskallerne for at sikre, at de er tomme.
- Smid de tomme kapselskaller væk.
Figur O
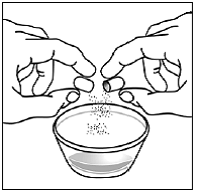
Hvis den samlede ordinerede dosis er mere end 1 kapsel, skal du følge trin 5 til 8 for hver kapsel. Tilføj ikke mere modermælkserstatning.
Trin 9 til 12 skal fuldføres inden for 30 minutter at blande medicinen (se Figur P ).
Figur P

Trin 9. Hold beholderen med den ene hånd. Brug teskeen med den anden hånd til forsigtigt at blande kapselindholdet og modermælkserstatningen (se Figur Q ). Drys vil ikke opløses. Blandingen vil se kornet ud, men bør ikke være klumpet.
Figur Q
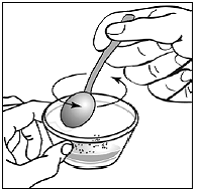
Trin 10. For at trække hele blandingen op i den orale doseringssprøjte:
Figur R
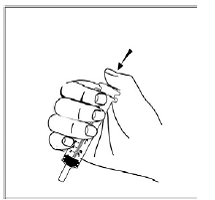
Figur S
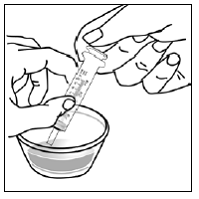
Figur T
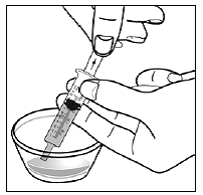
- Kontroller, at stemplet er skubbet helt ind i sprøjtens cylinder (se Figur R ).
- Placer spidsen af sprøjten i blandingen i beholderen (se Figur S ).
- Træk langsomt stemplet tilbage og træk hele blandingen op (se Figur T ).
Trin 11. Placer spidsen af sprøjten i dit barns mund langs den indre kind (se Figur U ). Tryk langsomt på stemplet for at give din baby hele blandingen.
Figur U
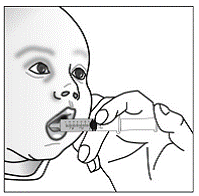
Trin 12. For at sikre, at al medicinen gives til din baby:
- Gentag trin 4 ovenfor.
- Rør rundt med en teskefuld.
- Gentag derefter Trin 10 og 11 ovenfor (se Figur V ).
Figur V
Trin 13. Fjern stemplet fra den orale doseringssprøjte. Vask beholderen, teskeen og oral doseringssprøjte. Lad stemplet og sprøjtebeholderen tørre, før du sætter dem sammen igen.
Trin 14. Smid papirhåndklædet væk og rengør arbejdsfladen. Vask dine hænder.
Hvordan skal jeg opbevare SUSTIVA 600mg kapsler?
- Opbevar SUSTIVA kapsler ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
Opbevar SUSTIVA 600 mg kapsler og al medicin utilgængeligt for børn.
Denne brugsanvisning er godkendt af US Food and Drug Administration.
