Copegus 100mg Ribavirin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Copegus 100mg, og hvordan bruges det?
Copegus 100mg er en receptpligtig medicin, der bruges til at behandle symptomerne på kronisk hepatitis C. Copegus 100mg kan bruges alene eller sammen med anden medicin.
Copegus tilhører en klasse af lægemidler kaldet Hepatitis B/Hepatitis C-midler; RSV-agenter.
Hvad er de mulige bivirkninger af Copegus?
Copegus kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- problemer med dit syn,
- stærke smerter i din øvre mave breder sig til ryggen,
- kvalme,
- opkastning,
- diarré,
- ny eller forværret hoste,
- feber,
- stikkende brystsmerter,
- hvæsen,
- stakåndet,
- svær depression,
- tanker om selvskade eller skade på en anden,
- bleg eller gulnet hud,
- mørk farvet urin,
- forvirring,
- svaghed,
- kuldegysninger,
- influenzalignende symptomer,
- hævede tandkød,
- sår i munden,
- hudsår,
- let blå mærker,
- usædvanlig blødning, og
- svimmelhed
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Copegus omfatter:
- kvalme,
- opkastning,
- mistet appetiten,
- feber,
- kuldegysninger eller rysten,
- lavt antal blodlegemer,
- anæmi,
- svaghed,
- træthed,
- hovedpine,
- muskelsmerter,
- humørsvingninger,
- angst, og
- irritabilitet
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Copegus. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
RISIKO FOR ALVORLIGE SYDELSER OG RIBAVIRIN-ASSOCIEREDE VIRKNINGER
COPEGUS (ribavirin) monoterapi er ikke effektiv til behandling af kronisk hepatitis C-virusinfektion og bør ikke anvendes alene til denne indikation.
Den primære kliniske toksicitet af ribavirin er hæmolytisk anæmi. Den anæmi, der er forbundet med ribavirinbehandling, kan resultere i forværring af hjertesygdom og føre til dødelige og ikke-dødelige myokardieinfarkter. Patienter med en anamnese med signifikant eller ustabil hjertesygdom bør ikke behandles med COPEGUS [se ADVARSLER OG FORHOLDSREGLER, BIVIRKNINGER samt DOSERING OG ADMINISTRATION].
Signifikante teratogene og/eller embryocidale virkninger er blevet påvist hos alle dyrearter, der er udsat for ribavirin. Derudover har ribavirin en halveringstid til flere doser på 12 dage, og det kan vare i ikke-plasma-kompartmenter i så længe som 6 måneder. Derfor er ribavirin, inklusive COPEGUS 100 mg, kontraindiceret hos gravide kvinder og hos de mandlige partnere til gravide kvinder. Der skal udvises ekstrem forsigtighed for at undgå graviditet under behandlingen og i 6 måneder efter afslutning af behandlingen hos både kvindelige patienter og hos kvindelige partnere til mandlige patienter, som tager ribavirinbehandling. Mindst to pålidelige former for effektiv prævention skal anvendes under behandlingen og i løbet af den 6-måneders opfølgningsperiode efter behandlingen [se KONTRAINDIKATIONER, ADVARSLER OG FORHOLDSREGLER og brug i specifikke populationer].
BESKRIVELSE
COPEGUS 100mg, ribavirin, er en nukleosidanalog med antiviral aktivitet. Det kemiske navn på ribavirin er 1-β-Dribofuranosyl-1H-1,2,4-triazol-3-carboxamid og har følgende strukturformel:
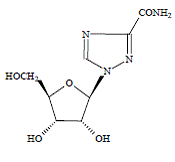
Den empiriske formel for ribavirin er C8H12N4O5 og molekylvægten er 244,2. Ribavirin er et hvidt til råhvidt pulver. Det er frit opløseligt i vand og let opløseligt i vandfri alkohol.
COPEGUS (ribavirin) er tilgængelig som en lys pink til pink farvet, flad, oval, filmovertrukket tablet til oral administration. Hver tablet indeholder 200 mg ribavirin og følgende inaktive ingredienser: prægelatineret stivelse, mikrokrystallinsk cellulose, natriumstivelsesglykolat, majsstivelse og magnesiumstearat. Overtrækket på tabletten indeholder Chromatone-P eller Opadry Pink (fremstillet ved at bruge hydroxypropylmethylcellulose, talkum, titaniumdioxid, syntetisk gul jernoxid og syntetisk rød jernoxid), ethylcellulose (ECD-30) og triacetin.
INDIKATIONER
COPEGUS 100mg i kombination med PEGASYS (peginterferon alfa-2a) er indiceret til behandling af patienter på 5 år og ældre med kronisk hepatitis C (CHC) virusinfektion, som har kompenseret leversygdom og ikke tidligere er blevet behandlet med interferon alfa.
Følgende punkter bør overvejes, når COPEGUS 100 mg kombinationsbehandling med PEGASYS påbegyndes:
- Denne indikation er baseret på kliniske forsøg med kombinationsbehandling hos patienter med CHC og kompenseret leversygdom, hvoraf nogle havde histologiske tegn på cirrhose (Child-Pugh klasse A), og hos voksne patienter med klinisk stabil HIV-sygdom og CD4-tal større end 100 celler/mm³.
- Denne indikation er baseret på opnåelse af upåviselig HCV-RNA efter behandling i 24 eller 48 uger, baseret på HCV-genotype, og opretholdelse af et vedvarende virologisk respons (SVR) 24 uger efter den sidste dosis.
- Sikkerheds- og effektdata er ikke tilgængelige for behandling længere end 48 uger.
- Sikkerheden og effekten af COPEGUS 100 mg og PEGASYS-behandling er ikke blevet fastslået hos lever- eller andre organtransplanterede patienter, patienter med dekompenseret leversygdom eller tidligere ikke-responderende på interferonbehandling.
- Sikkerheden og effekten af COPEGUS-behandling til behandling af adenovirus-, RSV-, parainfluenza- eller influenzainfektioner er ikke blevet fastlagt. COPEGUS bør ikke anvendes til disse indikationer. Ribavirin til inhalation har en separat indlægsseddel, som bør konsulteres, hvis ribavirin inhalationsbehandling overvejes.
DOSERING OG ADMINISTRATION
COPEGUS 100mg bør tages sammen med mad. COPEGUS bør gives i kombination med PEGASYS; det er vigtigt at bemærke, at COPEGUS 100 mg aldrig bør gives som monoterapi. Se PEGASYS indlægsseddel for alle instruktioner vedrørende PEGASYS dosering og administration.
Kronisk hepatitis C monoinfektion
Voksne patienter
Den anbefalede dosis af COPEGUS 100 mg tabletter er angivet i tabel 1. Den anbefalede behandlingsvarighed for patienter, der tidligere ikke er behandlet med ribavirin og interferon, er 24 til 48 uger.
Den daglige dosis af COPEGUS 100 mg er 800 mg til 1200 mg indgivet oralt i to opdelte doser. Dosis bør individualiseres til patienten afhængig af baseline sygdomskarakteristika (f.eks. genotype), respons på terapi og tolerabilitet af kuren (se ).
Pædiatriske patienter
PEGASYS administreres som 180 mcg/1,73 m² x BSA en gang om ugen subkutant, til en maksimal dosis på 180 mcg, og bør gives i kombination med ribavirin. Den anbefalede behandlingsvarighed for patienter med genotype 2 eller 3 er 24 uger og for andre genotyper er 48 uger.
COPEGUS bør gives i kombination med PEGASYS. COPEGUS 100 mg er kun tilgængelig som en 200 mg tablet, og derfor bør lægen afgøre, om denne størrelse tablet kan sluges af den pædiatriske patient. De anbefalede doser for COPEGUS er angivet i tabel 2. Patienter, der påbegynder behandling før deres 18-års fødselsdag, bør opretholde pædiatrisk dosering gennem afslutningen af behandlingen.
Kronisk hepatitis C med HIV-saminfektion
Voksne patienter
Den anbefalede dosis til behandling af kronisk hepatitis C hos patienter co-inficeret med HIV er PEGASYS 180 mcg subkutant én gang om ugen og COPEGUS 800 mg gennem munden dagligt i en samlet varighed på 48 uger, uanset HCV-genotype.
Dosisændringer
Voksne og pædiatriske patienter
Hvis der udvikles alvorlige bivirkninger eller laboratorieabnormaliteter under kombinationsbehandling med COPEGUS/PEGASYS, skal dosis ændres eller seponeres, hvis det er relevant, indtil bivirkningerne aftager eller falder i sværhedsgrad. Hvis intolerancen varer ved efter dosisjustering, skal COPEGUS/PEGASYS-behandlingen seponeres. Tabel 3 giver retningslinjer for dosisændringer og seponering baseret på patientens hæmoglobinkoncentration og hjertestatus.
COPEGUS 100 mg bør administreres med forsigtighed til patienter med allerede eksisterende hjertesygdom. Patienter bør vurderes før påbegyndelse af behandlingen og bør overvåges passende under behandlingen. Hvis der er nogen forværring af kardiovaskulær status, skal behandlingen stoppes [se ADVARSLER OG FORHOLDSREGLER ].
Retningslinjerne for COPEGUS 100 mg dosisændringer, der er beskrevet i denne tabel, gælder også for laboratorieabnormiteter eller andre bivirkninger end fald i hæmoglobinværdier.
Voksne patienter
Når COPEGUS 100 mg er blevet tilbageholdt på grund af enten en laboratorieabnormitet eller klinisk bivirkning, kan der gøres et forsøg på at genstarte COPEGUS 100 mg med 600 mg dagligt og yderligere øge dosis til 800 mg dagligt. Det anbefales dog ikke, at COPEGUS øges til den oprindeligt tildelte dosis (1000 mg til 1200 mg).
Pædiatriske patienter
Efter afhjælpning af en laboratorieabnormitet eller klinisk bivirkning kan en stigning i COPEGUS 100 mg dosis til den oprindelige dosis forsøges afhængigt af lægens vurdering. Hvis COPEGUS er blevet tilbageholdt på grund af en laboratorieabnormitet eller klinisk bivirkning, kan der gøres et forsøg på at genstarte COPEGUS 100 mg med halvdelen af den fulde dosis.
Nedsat nyrefunktion
Den samlede daglige dosis af COPEGUS bør reduceres for patienter med kreatininclearance mindre end eller lig med 50 ml/min. og den ugentlige dosis af PEGASYS bør reduceres for kreatininclearance mindre end 30 ml/min som følger i tabel 4 [se Brug i specifikke populationer , Farmakokinetik , og PEGASYS indlægsseddel ].
Dosis af COPEGUS 100 mg bør ikke ændres yderligere hos patienter med nedsat nyrefunktion. Hvis der udvikles alvorlige bivirkninger eller laboratorieabnormiteter, skal COPEGUS seponeres, hvis det er relevant, indtil bivirkningerne aftager eller falder i sværhedsgrad. Hvis intolerancen fortsætter efter genstart af COPEGUS 100 mg, skal COPEGUS/PEGASYS-behandlingen seponeres.
Der er ingen tilgængelige data for pædiatriske forsøgspersoner med nedsat nyrefunktion.
Seponering af dosering
Seponering af PEGASYS/COPEGUS 100 mg-behandling bør overvejes, hvis patienten ikke har kunnet påvise mindst 2 log10-reduktion fra baseline i HCV-RNA med 12 ugers behandling, eller upåviselige HCV-RNA-niveauer efter 24 ugers behandling.
PEGASYS/COPEGUS 100 mg behandling bør seponeres hos patienter, som udvikler leverdekompensation under behandlingen [se ADVARSLER OG FORHOLDSREGLER ].
HVORDAN LEVERET
Doseringsformer og styrker
COPEGUS (ribavirin) er tilgængelig som en lys pink til pink farvet, flad, oval, filmovertrukket tablet til oral administration. Hver tablet indeholder 200 mg ribavirin.
COPEGUS® (ribavirin) fås som tabletter til oral administration. Hver tablet indeholder 200 mg ribavirin og er lyserød til lyserød, flad, oval, filmovertrukket og indgraveret med RIB 200 på den ene side og ROCHE på den anden side. De er pakket som en flaske med 168 tabletter ( NDC 0004-0086-94).
Opbevaring og håndtering
Opbevar COPEGUS®-tabletflasken ved 25°C (77°F); udflugter er tilladt mellem 15°C og 30°C (59°F og 86°F) [se USP kontrolleret rumtemperatur ]. Hold flasken tæt lukket.
Fremstillet af: Hoffmann-La Roche, Inc. c/o Genentech, Inc. Medlem af Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990. Revideret: august 2015
BIVIRKNINGER
PEGASYS i kombination med COPEGUS forårsager en lang række alvorlige bivirkninger [se KASSET ADVARSEL og ADVARSLER OG FORHOLDSREGLER ]. De mest almindelige alvorlige eller livstruende bivirkninger induceret eller forværret af COPEGUS/PEGASYS omfatter depression, selvmord, tilbagefald af stofmisbrug/overdosis og bakterielle infektioner, der hver optræder med en frekvens på mindre end 1 %. Leverdekompensation forekom hos 2 % (10/574) CHC/HIV-patienter [se ADVARSLER OG FORHOLDSREGLER ].
Erfaring fra kliniske studier
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan frekvenser af bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
Voksne patienter
I de pivotale registreringsforsøg NV15801 og NV15942 fik 886 patienter COPEGUS i 48 uger i doser på 1000/1200 mg baseret på kropsvægt. I disse undersøgelser forekom en eller flere alvorlige bivirkninger hos 10 % af monoinficerede patienter med CHC og hos 19 % af patienter med CHC/HIV, der fik PEGASYS alene eller i kombination med COPEGUS. Den mest almindelige alvorlige bivirkning (3 % ved CHC og 5 % ved CHC/HIV) var bakteriel infektion (f.eks. sepsis, osteomyelitis, endocarditis, pyelonefritis, lungebetændelse).
Andre alvorlige bivirkninger forekom med en frekvens på mindre end 1 % og omfattede: selvmord, selvmordstanker, psykose, aggression, angst, stofmisbrug og overdosis, angina, leverdysfunktion, fedtlever, kolangitis, arytmi, diabetes mellitus, autoimmune fænomener (fx hyperthyroidisme, hypothyroidisme, sarkoidose, systemisk lupus erythematosus, rheumatoid arthritis), perifer neuropati, aplastisk anæmi, mavesår, gastrointestinal blødning, pancreatitis, colitis, hornhindens ulcus, pulmonal emboli, lungeemboli, myopenthromboli, psykotisk lidelse og hallucinationer.
Procentdelen af patienter i kliniske forsøg, som oplevede en eller flere bivirkninger, var 98 %. De mest almindeligt rapporterede bivirkninger var psykiatriske reaktioner, herunder depression, søvnløshed, irritabilitet, angst og influenzalignende symptomer såsom træthed, feber, myalgi, hovedpine og rigor. Andre almindelige reaktioner var anoreksi, kvalme og opkastning, diarré, artralgier, reaktioner på injektionsstedet, alopeci og pruritus.
viser antallet af bivirkninger, der forekommer hos mere end eller lig med 5 % af forsøgspersonerne, der fik pegyleret interferon og ribavirin kombinationsbehandling i CHC Clinical Trial, NV15801.
Ti procent af monoinficerede CHC-patienter, der modtog 48 ugers behandling med PEGASYS i kombination med COPEGUS 100 mg, afbrød behandlingen; 16 % af CHC/HIV-saminficerede patienter afbrød behandlingen. De mest almindelige årsager til afbrydelse af behandlingen var psykiatrisk, influenzalignende syndrom (f.eks. sløvhed, træthed, hovedpine), dermatologiske og gastrointestinale lidelser og laboratorieabnormiteter (trombocytopeni, neutropeni og anæmi).
Samlet krævede 39 % af patienterne med CHC eller CHC/HIV modifikation af PEGASYS- og/eller COPEGUS-behandlingen. Den mest almindelige årsag til dosisændring af PEGASYS hos CHC- og CHC/HIV-patienter var laboratorieabnormiteter; neutropeni (henholdsvis 20 % og 27 %) og trombocytopeni (henholdsvis 4 % og 6 %). Den mest almindelige årsag til dosisændring af COPEGUS hos patienter med CHC og CHC/HIV var anæmi (henholdsvis 22 % og 16 %).
PEGASYS dosis blev reduceret hos 12 % af patienterne, der fik 1000 mg til 1200 mg COPEGUS 100 mg i 48 uger, og hos 7 % af patienterne, der fik 800 mg COPEGUS i 24 uger. COPEGUS-dosis blev reduceret hos 21 % af patienterne, der fik 1000 mg til 1200 mg COPEGUS 100 mg i 48 uger, og hos 12 % af patienterne, der fik 800 mg COPEGUS 100 mg i 24 uger.
Kronisk hepatitis C monoinficerede patienter behandlet i 24 uger med PEGASYS og 800 mg COPEGUS 100 mg blev observeret at have lavere forekomst af alvorlige bivirkninger (3 % vs. 10 %), hæmoglobin mindre end 10 g/dL (3 % vs. 15 %) , dosisændring af PEGASYS (30 % vs. 36 %) og COPEGUS (19 % vs. 38 %) og af seponering fra behandling (5 % vs. 15 %) sammenlignet med patienter behandlet i 48 uger med PEGASYS og 1000 mg eller 1200 mg COPEGUS. På den anden side så den samlede forekomst af bivirkninger ud til at være ens i de to behandlingsgrupper.
Pædiatriske patienter
et klinisk forsøg med 114 pædiatriske forsøgspersoner (5 til 17 år) behandlet med PEGASYS alene eller i kombination med COPEGUS 100 mg, var dosisændringer påkrævet hos ca. en tredjedel af forsøgspersonerne, oftest for neutropeni og anæmi. Generelt var sikkerhedsprofilen, der blev observeret hos pædiatriske forsøgspersoner, den samme som hos voksne. I den pædiatriske undersøgelse var de mest almindelige bivirkninger hos forsøgspersoner behandlet med kombinationsbehandling PEGASYS og COPEGUS 100 mg i op til 48 uger influenzalignende sygdom (91 %), øvre luftvejsinfektion (60 %), hovedpine (64 %), gastrointestinale lidelser (56 %), hudlidelser (47 %) og reaktion på injektionsstedet (45 %). Syv forsøgspersoner, der modtog kombinationsbehandling med PEGASYS og COPEGUS i 48 uger, afbrød behandlingen af sikkerhedsmæssige årsager (depression, unormal psykiatrisk evaluering, forbigående blindhed, retinale ekssudater, hyperglykæmi, type 1-diabetes mellitus og anæmi). Alvorlige bivirkninger blev rapporteret hos 2 forsøgspersoner i PEGASYS plus COPEGUS 100 mg kombinationsterapigruppen (hyperglykæmi og kolecystektomi).
Hos pædiatriske forsøgspersoner randomiseret til kombinationsbehandling var forekomsten af de fleste bivirkninger ens i hele behandlingsperioden (op til 48 uger plus 24 ugers opfølgning) sammenlignet med de første 24 uger og steg kun lidt for hovedpine, mave-tarmsygdomme , irritabilitet og udslæt. Størstedelen af bivirkningerne forekom i de første 24 uger af behandlingen.
Væksthæmning hos pædiatriske forsøgspersoner
[se ADVARSLER OG FORHOLDSREGLER ].
Pædiatriske forsøgspersoner behandlet med PEGASYS plus ribavirin kombinationsbehandling viste en forsinkelse i vægt- og højdestigninger med op til 48 ugers behandling sammenlignet med baseline. Både vægt for alder og højde for alder z-scores samt percentilerne for den normative population for forsøgspersonens vægt og højde faldt under behandlingen. Ved afslutningen af 2 års opfølgning efter behandling var de fleste forsøgspersoner vendt tilbage til baseline normative kurvepercentiler for vægt (64. middelpercentil ved baseline, 60. middelpercentil 2 år efter behandling) og højde (54. middelpercentil ved baseline, 56. middelpercentil 2 år efter behandling). Ved afslutningen af behandlingen oplevede 43 % (23 af 53) af forsøgspersonerne et fald i vægtpercentil på mere end 15 percentiler, og 25 % (13 af 53) oplevede et fald i højdepercentil på mere end 15 percentiler på de normative vækstkurver. 2 år efter behandling var 16 % (6 af 38) af forsøgspersonerne mere end 15 percentiler under deres baseline-vægtkurve, og 11 % (4 af 38) var mere end 15 percentiler under deres baseline-højdekurve.
Otteogtredive af de 114 forsøgspersoner indrulleret i langtidsopfølgningsstudiet, der strækker sig op til 6 år efter behandling. For de fleste forsøgspersoner blev væksten efter behandlingen opretholdt 2 år efter behandlingen til 6 år efter behandlingen.
Almindelige bivirkninger ved CHC med HIV-saminfektion (voksne)
Bivirkningsprofilen for samtidig inficerede patienter behandlet med PEGASYS/COPEGUS i undersøgelse NR15961 svarede generelt til den, der blev vist for monoinficerede patienter i undersøgelse NV15801 (tabel 5). Hændelser, der forekom hyppigere hos co-inficerede patienter, var neutropeni (40 %), anæmi (14 %), trombocytopeni (8 %), vægttab (16 %) og humørsvingninger (9 %).
Abnormiteter i laboratorietest
Voksne patienter
Anæmi på grund af hæmolyse er den mest signifikante toksicitet ved ribavirinbehandling. Anæmi (hæmoglobin mindre end 10 g/dL) blev observeret hos 13 % af alle COPEGUS- og PEGASYS-kombinationsbehandlede patienter i kliniske forsøg. Det maksimale fald i hæmoglobin forekom i løbet af de første 8 uger efter påbegyndelse af ribavirinbehandling [se DOSERING OG ADMINISTRATION ].
Pædiatriske patienter
Fald i hæmoglobin, neutrofiler og blodplader kan kræve dosisreduktion eller permanent seponering af behandlingen [se DOSERING OG ADMINISTRATION ]. De fleste laboratorieabnormiteter, der blev noteret under det kliniske forsøg, vendte tilbage til baseline-niveauer kort efter seponering af behandlingen.
Hos patienter randomiseret til kombinationsbehandling steg forekomsten af abnormiteter under hele behandlingsfasen (op til 48 uger plus 24 ugers opfølgning) i sammenligning med de første 24 uger en smule for neutrofiler mellem 500 og 1.000 celler/mm³ og hæmoglobinværdier mellem 8,5 og 10 g/dL. Størstedelen af hæmatologiske abnormiteter forekom i de første 24 uger af behandlingen.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret og rapporteret under brug af PEGASYS/COPEGUS 100 mg kombinationsbehandling efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Blod og lymfesystem lidelser
Ren røde celle aplasi
Øre- og labyrintlidelser
Nedsat hørelse, høretab
Øjenlidelser
Serøs nethindeløsning
Immunforstyrrelser
Afstødning af lever og nyretransplantat
Metabolisme og ernæringsforstyrrelser
Dehydrering
Hud- og subkutane vævsforstyrrelser
Stevens-Johnsons syndrom (SJS)
Toksisk epidermal nekrolyse (TEN)
DRUGSINTERAKTIONER
Resultater fra en farmakokinetisk sub-undersøgelse viste ingen farmakokinetisk interaktion mellem PEGASYS (peginterferon alfa-2a) og ribavirin.
Nukleosid reverse transkriptasehæmmere (NRTI'er)
In vitro-data indikerer, at ribavirin reducerer fosforylering af lamivudin, stavudin og zidovudin. Der blev dog ikke observeret nogen farmakokinetisk (f.eks. plasmakoncentrationer eller intracellulære triphosphorylerede aktive metabolitkoncentrationer) eller farmakodynamiske (f.eks. tab af HIV/HCV virologisk suppression) interaktion, når ribavirin og lamivudin (n=18), stavudin (n=10) eller zidovudin (n=6) blev administreret samtidig som en del af et multilægemiddelregime til HCV/HIV-saminficerede patienter.
I undersøgelse NR15961 blandt CHC/HIV co-inficerede cirrosepatienter, der fik NRTI'er, blev der observeret tilfælde af leverdekompensation (nogle dødelige) [se ADVARSLER OG FORHOLDSREGLER ].
Patienter, der får PEGASYS/COPEGUS 100 mg og NRTI'er, bør overvåges nøje for behandlingsrelaterede toksiciteter. Læger bør henvise til ordinationsinformation for de respektive NRTI'er for vejledning vedrørende toksicitetshåndtering. Derudover bør dosisreduktion eller seponering af PEGASYS, COPEGUS 100 mg eller begge overvejes, hvis der observeres forværrede toksiciteter, herunder leverdekompensation (f.eks. Child-Pugh større end eller lig med 6) [se ADVARSLER OG FORHOLDSREGLER og DOSERING OG ADMINISTRATION ].
Didanosin
Samtidig administration af COPEGUS og didanosin er kontraindiceret. Koncentrationerne af didanosin eller dets aktive metabolit (dideoxyadenosin 5'-triphosphat) øges, når didanosin administreres sammen med ribavirin, hvilket kan forårsage eller forværre klinisk toksicitet. Rapporter om fatalt leversvigt såvel som perifer neuropati, pancreatitis og symptomatisk hyperlaktæmi/laktatacidose er blevet rapporteret i kliniske forsøg [se KONTRAINDIKATIONER ].
Zidovudin
undersøgelse NR15961 udviklede patienter, der fik zidovudin i kombination med PEGASYS/COPEGUS, svær neutropeni (ANC mindre end 500) og svær anæmi (hæmoglobin mindre end 8 g/dL) hyppigere end tilsvarende patienter, der ikke fik zidovudin (neutropeni 15 % vs. 9 %) (anæmi 5 % vs. 1 %). Seponering af zidovudin bør betragtes som medicinsk passende.
Lægemidler metaboliseret af Cytokrom P450
In vitro undersøgelser indikerer, at ribavirin ikke hæmmer CYP 2C9, CYP 2C19, CYP 2D6 eller CYP 3A4.
Azathioprin
Brug af ribavirin til behandling af kronisk hepatitis C hos patienter, der får azathioprin, er blevet rapporteret at inducere alvorlig pancytopeni og kan øge risikoen for azathioprin-relateret myelotoksicitet. Inosinmonophosphatdehydrogenase (IMDH) er nødvendig for en af azathioprins metaboliske veje. Ribavirin er kendt for at hæmme IMDH, hvilket fører til akkumulering af en azathioprin-metabolit, 6-methylthioinosinmonophosphat (6-MTITP), som er forbundet med myelotoksicitet (neutropeni, trombocytopeni og anæmi). Patienter, der får azathioprin sammen med ribavirin, bør have fuldstændige blodtællinger, inklusive trombocyttal, overvåget ugentligt i den første måned, to gange om måneden i den anden og tredje måned af behandlingen, derefter månedligt eller oftere, hvis dosis eller andre terapiændringer er nødvendige [se ADVARSLER OG FORHOLDSREGLER ].
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Væsentlige bivirkninger forbundet med COPEGUS/PEGASYS kombinationsbehandling omfatter svær depression og selvmordstanker, hæmolytisk anæmi, suppression af knoglemarvsfunktion, autoimmune og infektionssygdomme, oftalmologiske lidelser, cerebrovaskulære lidelser, pulmonal dysfunktion, colitis, pancreatitis og diabetes.
PEGASYS indlægssedlen bør gennemgås i sin helhed for yderligere sikkerhedsinformation før påbegyndelse af kombinationsbehandling.
Graviditet
COPEGUS 100mg kan forårsage fosterskader og/eller død hos det eksponerede foster. Ribavirin har påvist signifikant teratogene og/eller embryocidale virkninger hos alle dyrearter, hvor der er udført tilstrækkelige undersøgelser. Disse virkninger opstod ved doser så lave som en tyvendedel af den anbefalede humane dosis af ribavirin.
COPEGUS-behandling bør ikke påbegyndes, medmindre der er indhentet en rapport om en negativ graviditetstest umiddelbart før planlagt behandlingsstart. Der skal udvises ekstrem forsigtighed for at undgå graviditet hos kvindelige patienter og hos mandlige patienters kvindelige partnere. Patienter skal instrueres i at bruge mindst to former for effektiv prævention under behandlingen og i 6 måneder efter behandlingen er stoppet. Graviditetstest skal udføres månedligt under COPEGUS 100 mg-behandling og i 6 måneder efter behandlingen er stoppet [se KASSET ADVARSEL , KONTRAINDIKATIONER , Brug i specifikke populationer , og PATIENTOPLYSNINGER ].
Anæmi
Den primære toksicitet af ribavirin er hæmolytisk anæmi, som blev observeret hos ca. 13 % af alle COPEGUS/PEGASYS-behandlede forsøgspersoner i kliniske forsøg. Anæmi forbundet med COPEGUS 100 mg opstår inden for 1 til 2 uger efter påbegyndelse af behandlingen. Da det indledende fald i hæmoglobin kan være signifikant, tilrådes det, at hæmoglobin eller hæmatokrit opnås forbehandling og i uge 2 og uge 4 af behandlingen eller oftere, hvis det er klinisk indiceret. Patienter bør derefter følges efter klinisk passende behandling. Der bør udvises forsigtighed ved påbegyndelse af behandling hos enhver patient med baseline-risiko for svær anæmi (f.eks. spherocytose, anamnese med gastrointestinal blødning) [se DOSERING OG ADMINISTRATION ].
Fatale og ikke-fatale myokardieinfarkter er blevet rapporteret hos patienter med anæmi forårsaget af COPEGUS. Patienter bør vurderes for underliggende hjertesygdom før påbegyndelse af ribavirinbehandling. Patienter med allerede eksisterende hjertesygdom bør have elektrokardiogrammer indgivet før behandling og bør overvåges passende under behandlingen. Hvis der er nogen forværring af kardiovaskulær status, bør behandlingen suspenderes eller seponeres [se DOSERING OG ADMINISTRATION ]. Fordi hjertesygdom kan forværres af lægemiddelinduceret anæmi, bør patienter med en historie med signifikant eller ustabil hjertesygdom ikke bruge COPEGUS [se KASSET ADVARSEL og DOSERING OG ADMINISTRATION ].
Leversvigt
Patienter med kronisk hepatitis C (CHC) med cirrose kan have risiko for leverdekompensation og død, når de behandles med alfa-interferoner, inklusive PEGASYS. Cirrhotiske CHC-patienter samtidig med HIV, der modtager højaktiv antiretroviral behandling (HAART) og interferon alfa-2a med eller uden ribavirin, ser ud til at have øget risiko for udvikling af leverdekompensation sammenlignet med patienter, der ikke får HAART. I undersøgelse NR15961 [se Kliniske Studier ], blandt 129 CHC/HIV-cirrosepatienter, der fik HAART, udviklede 14 (11 %) af disse patienter i alle behandlingsarme leverdekompensation, hvilket resulterede i 6 dødsfald. Alle 14 patienter var på NRTI'er, inklusive stavudin, didanosin, abacavir, zidovudin og lamivudin. Dette lille antal patienter tillader ikke diskrimination mellem specifikke NRTI'er eller den associerede risiko. Under behandlingen skal patienternes kliniske status og leverfunktion overvåges nøje for tegn og symptomer på leverdekompensation. Behandling med PEGASYS/COPEGUS 100 mg bør seponeres øjeblikkeligt hos patienter med leverdekompensation [se KONTRAINDIKATIONER ].
Overfølsomhed
Alvorlige akutte overfølsomhedsreaktioner (f.eks. urticaria, angioødem, bronkokonstriktion og anafylaksi) er blevet observeret under alfa-interferon- og ribavirinbehandling. Hvis en sådan reaktion opstår, skal behandlingen med PEGASYS og COPEGUS 100 mg seponeres øjeblikkeligt og passende medicinsk behandling iværksættes. Alvorlige hudreaktioner, herunder vesikulobulløse udbrud, reaktioner i spektret af Stevens-Johnsons syndrom (erythema multiforme major) med varierende grader af hud- og slimhindepåvirkning og eksfoliativ dermatitis (erythrodermi) er blevet rapporteret hos patienter, der fik PEGASYS med og uden ribavirin. Patienter, der udvikler tegn eller symptomer på alvorlige hudreaktioner, skal afbryde behandlingen [se BIVIRKNINGER ].
Lungesygdomme
Dyspnø, pulmonære infiltrater, pneumonitis, pulmonal hypertension og pneumoni er blevet rapporteret under behandling med ribavirin og interferon. Lejlighedsvise tilfælde af dødelig lungebetændelse er forekommet. Derudover er sarkoidose eller forværring af sarkoidose blevet rapporteret. Hvis der er tegn på pulmonale infiltrater eller svækkelse af lungefunktion, skal patienterne monitoreres nøje, og hvis det er relevant, bør kombinationsbehandlingen COPEGUS/PEGASYS seponeres.
Knoglemarvsundertrykkelse
Pancytopeni (markante fald i røde blodlegemer, neutrofiler og blodplader) og knoglemarvssuppression er blevet rapporteret i litteraturen for at forekomme inden for 3 til 7 uger efter samtidig administration af pegyleret interferon/ribavirin og azathioprin. Hos dette begrænsede antal patienter (n=8) var myelotoksiciteten reversibel inden for 4 til 6 uger efter seponering af både HCV antiviral behandling og samtidig azathioprin og opstod ikke igen ved genindførelse af nogen af behandlingen alene. PEGASYS, COPEGUS 100 mg og azathioprin bør seponeres for pancytopeni, og pegyleret interferon/ribavirin bør ikke genintroduceres med samtidig azathioprin [se DRUGSINTERAKTIONER ].
Pancreatitis
COPEGUS- og PEGASYS-behandlingen bør seponeres hos patienter med tegn og symptomer på pancreatitis og seponeres hos patienter med bekræftet pancreatitis.
Indvirkning på vækst hos pædiatriske patienter
Under kombinationsbehandling i op til 48 uger med PEGASYS plus ribavirin blev væksthæmning observeret hos pædiatriske forsøgspersoner i alderen 5 til 17 år. Der blev observeret fald i vægt for alder z-score og højde for alder z-score op til 48 ugers behandling sammenlignet med baseline. 2 år efter behandling var 16 % af pædiatriske forsøgspersoner mere end 15 percentiler under deres baseline-vægtkurve, og 11 % var mere end 15 percentiler under deres baseline-højdekurve.
De tilgængelige langtidsdata om forsøgspersoner, der blev fulgt op til 6 år efter behandling, er for begrænsede til at bestemme risikoen for nedsat voksenhøjde hos nogle patienter [se Erfaring fra kliniske studier ].
Laboratorieprøver
Før påbegyndelse af PEGASYS/COPEGUS kombinationsbehandling anbefales standard hæmatologiske og biokemiske laboratorietests til alle patienter. Der skal udføres graviditetsscreening for kvinder i den fødedygtige alder. Patienter, som har allerede eksisterende hjerteabnormaliteter, skal have elektrokardiogrammer indgivet før behandling med PEGASYS/COPEGUS.
Efter påbegyndelse af behandlingen skal hæmatologiske tests udføres efter 2 uger og 4 uger, og biokemiske tests skal udføres efter 4 uger. Yderligere test bør udføres med jævne mellemrum under behandlingen. I kliniske undersøgelser af voksne blev CBC (inklusive hæmoglobinniveau og antal hvide blodlegemer og blodplader) og kemi (inklusive leverfunktionsprøver og urinsyre) målt efter 1, 2, 4, 6 og 8 uger og derefter hver 4. 6 uger eller oftere, hvis der blev fundet abnormiteter. I det pædiatriske kliniske forsøg var hæmatologiske og kemiske vurderinger efter 1, 3, 5 og 8 uger, derefter hver 4. uge. Skjoldbruskkirtelstimulerende hormon (TSH) blev målt hver 12. uge. Månedlig graviditetstest skal udføres under kombinationsbehandling og i 6 måneder efter seponering af behandlingen.
De adgangskriterier, der anvendes til de kliniske undersøgelser af COPEGUS 100mg og PEGASYS, kan betragtes som en retningslinje for acceptable baseline-værdier for påbegyndelse af behandling:
- Blodpladetal større end eller lig med 90.000 celler/mm³ (så lavt som 75.000 celler/mm³ hos HCV-patienter med cirrhose eller 70.000 celler/mm³ hos patienter med CHC og HIV)
- Absolut neutrofiltal (ANC) større end eller lig med 1500 celler/mm³
- TSH og T4 inden for normale grænser eller tilstrækkeligt kontrolleret skjoldbruskkirtelfunktion
- CD4+ celletal større end eller lig med 200 celler/mm³ eller CD4+ celletal større end eller lig med 100 celler/mm³ men mindre end 200 celler/mm³ og HIV-1 RNA mindre end 5.000 kopier/ml hos patienter co-inficeret med HIV
- Hæmoglobin større end eller lig med 12 g/dL for kvinder og større end eller lig med 13 g/dL for mænd hos CHC monoinficerede patienter
- Hæmoglobin større end eller lig med 11 g/dL for kvinder og større end eller lig med 12 g/dL for mænd hos patienter med CHC og HIV
Patientrådgivningsinformation
- Se FDA-godkendt patientmærkning (medicinvejledning)
Graviditet
Patienterne skal informeres om, at ribavirin kan forårsage fosterskader og/eller død hos det eksponerede foster. COPEGUS 100 mg-behandling må ikke anvendes af kvinder, der er gravide eller af mænd, hvis kvindelige partnere er gravide. Der skal udvises ekstrem forsigtighed for at undgå graviditet hos kvindelige patienter og hos kvindelige partnere til mandlige patienter, der tager COPEGUS-behandling og i 6 måneder efter behandling. Patienter bør anvende to pålidelige præventionsmetoder, mens de tager COPEGUS-behandling og i 6 måneder efter behandling. Behandling med COPEGUS bør ikke påbegyndes, før en rapport om en negativ graviditetstest er modtaget umiddelbart før påbegyndelse af behandlingen. Patienter skal udføre en graviditetstest månedligt under behandlingen og i 6 måneder efter behandlingen.
Kvindelige patienter i den fødedygtige alder og mandlige patienter med kvindelige partnere i den fødedygtige alder skal informeres om de teratogene/embryocidale risici og skal instrueres i at anvende effektiv prævention under COPEGUS-behandling og i 6 måneder efter behandling. Patienter bør rådes til straks at underrette sundhedspersonalet i tilfælde af graviditet [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Anæmi
Den mest almindelige bivirkning forbundet med ribavirin er anæmi, som kan være alvorlig [se KASSET ADVARSEL , ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ]. Patienter bør informeres om, at laboratorieevalueringer er påkrævet før påbegyndelse af COPEGUS-behandling og periodisk derefter [se ADVARSLER OG FORHOLDSREGLER ]. Det tilrådes, at patienterne er godt hydrerede, især i de indledende stadier af behandlingen.
Patienter, som udvikler svimmelhed, forvirring, somnolens og træthed, skal advares om at undgå at køre bil eller betjene maskiner.
Patienter bør rådes til at tage COPEGUS 100 mg sammen med mad.
Patienter bør udspørges om tidligere stofmisbrug før påbegyndelse af COPEGUS/PEGASYS, da tilbagefald af stofafhængighed og overdosering af lægemidler er blevet rapporteret hos patienter behandlet med interferoner.
Patienter bør rådes til ikke at drikke alkohol, da alkohol kan forværre kronisk hepatitis C-infektion.
Patienterne skal informeres om, hvad de skal gøre, hvis de glemmer en dosis COPEGUS. De glemte doser skal tages så hurtigt som muligt i løbet af samme dag. Patienter bør ikke fordoble den næste dosis. Patienter bør rådes til at ringe til deres læge, hvis de har spørgsmål.
Patienterne skal informeres om, at effekten af PEGASYS/COPEGUS-behandling af hepatitis C-infektion på overførsel ikke er kendt, og at passende forholdsregler for at forhindre overførsel af hepatitis C-virus under behandlingen eller i tilfælde af behandlingssvigt bør træffes.
Patienterne skal informeres om de potentielle fordele og risici, der er forbundet med brugen af COPEGUS. Der bør gives instruktioner om passende brug, herunder gennemgang af indholdet af det vedlagte MEDICIN GUIDE , som ikke er en afsløring af alle eller mulige negative virkninger.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
I et p53 (+/-) musekarcinogenicitetsstudie op til den maksimalt tolererede dosis på 100 mg/kg/dag var ribavirin ikke onkogent. Ribavirin var heller ikke onkogent i et 2-årigt karcinogenicitetsstudie med rotter ved doser op til den maksimalt tolererede dosis på 60 mg/kg/dag. På basis af kropsoverfladen er disse doser henholdsvis ca. 0,5 og 0,6 gange den maksimalt anbefalede daglige humane dosis af ribavirin.
Mutagenese
Ribavirin udviste mutagen aktivitet i in vitro muselymfomanalysen. Der blev ikke observeret nogen klastogen aktivitet i et in vivo musemikronukleusassay ved doser op til 2000 mg/kg. Imidlertid viser resultater fra undersøgelser publiceret i litteraturen klastogen aktivitet i in vivo muse mikronukleusassay ved orale doser op til 2000 mg/kg. Et dominant letalt assay hos rotter var negativt, hvilket indikerer, at hvis der opstod mutationer i rotter, blev de ikke overført gennem hankønsceller.
Forringelse af fertilitet
et fertilitetsstudie med rotter viste ribavirin en marginal reduktion i sædceller ved en dosis på 100 mg/kg/dag uden effekt på fertiliteten. Ved ophør af behandlingen forekom total genopretning efter 1 spermatogenesecyklus. Abnormiteter i sperm blev observeret i undersøgelser med mus designet til at evaluere tidsforløbet og reversibiliteten af ribavirin-induceret testikeldegeneration ved doser på 15 til 150 mg/kg/dag (ca. 0,1 til 0,8 gange den maksimalt anbefalede daglige dosis af ribavirin) i 3 til 6 måneder. Ved ophør af behandlingen var der i det væsentlige fuldstændig genopretning fra ribavirin-induceret testikeltoksicitet inden for 1 eller 2 spermatogene cyklusser.
Kvindelige patienter i den fødedygtige alder og mandlige patienter med kvindelige partnere i den fødedygtige alder bør ikke få COPEGUS, medmindre patienten og hans/hendes partner bruger effektiv prævention (to pålidelige former). Baseret på en halveringstid med flere doser (t½) af ribavirin på 12 dage, skal der anvendes effektiv prævention i 6 måneder efter behandling (dvs. 15 halveringstider for clearance for ribavirin).
Der er ikke udført reproduktionstoksikologiske undersøgelser med PEGASYS i kombination med COPEGUS. Imidlertid har peginterferon alfa-2a og ribavirin, når de administreres separat, hver for sig uønskede virkninger på reproduktionen. Det bør antages, at virkningerne produceret af begge midler alene også ville være forårsaget af kombinationen af de to midler.
Brug i specifikke populationer
Graviditet
Kategori X [se KONTRAINDIKATIONER ]. Ribavirin gav betydelige embryocidale og/eller teratogene virkninger hos alle dyrearter, hvor der er udført tilstrækkelige undersøgelser. Misdannelser af kraniet, ganen, øjet, kæben, lemmerne, skelettet og mave-tarmkanalen blev noteret. Hyppigheden og sværhedsgraden af teratogene virkninger steg med eskalering af lægemiddeldosis. Overlevelse af fostre og afkom blev reduceret [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
I konventionelle embryotoksicitets-/teratogenicitetsundersøgelser i rotter og kaniner var dosisniveauer uden effekt et godt stykke under niveauet for den foreslåede kliniske anvendelse (0,3 mg/kg/dag for både rotte og kanin; ca. 0,06 gange den anbefalede daglige humane dosis af ribavirin) . Ingen maternel toksicitet eller virkninger på afkom blev observeret i et peri/postnatalt toksicitetsstudie med rotter doseret oralt med op til 1 mg/kg/dag (ca. 0,01 gange den maksimale anbefalede daglige dosis af ribavirin til mennesker).
Behandling og efterbehandling: Potentiel risiko for fosteret
Ribavirin er kendt for at akkumulere i intracellulære komponenter, hvorfra det udskilles meget langsomt. Det vides ikke, om ribavirin er indeholdt i sædceller og i givet fald vil udøve en potentiel teratogene virkning ved befrugtning af æggene. Men på grund af de potentielle humane teratogene virkninger af ribavirin, bør mandlige patienter rådes til at tage alle forholdsregler for at undgå risiko for graviditet for deres kvindelige partnere.
COPEGUS bør ikke anvendes af gravide kvinder eller af mænd, hvis kvindelige partnere er gravide. Kvindelige patienter i den fødedygtige alder og mandlige patienter med kvindelige partnere i den fødedygtige alder bør ikke få COPEGUS, medmindre patienten og hans/hendes partner bruger effektiv prævention (to pålidelige former) under behandlingen og i 6 måneder efter behandlingen [se KONTRAINDIKATIONER ].
Ribavirin Graviditetsregister
Et Ribavirin-graviditetsregister er blevet etableret for at overvåge moder-føtale resultater af graviditeter af kvindelige patienter og kvindelige partnere til mandlige patienter, der er blevet eksponeret for ribavirin under behandlingen og i 6 måneder efter behandlingens ophør. Sundhedsudbydere og patienter opfordres til at rapportere sådanne tilfælde ved at ringe til 1-800-593-2214.
Ammende mødre
Det vides ikke, om ribavirin udskilles i human mælk. Da mange lægemidler udskilles i modermælk og for at undgå ethvert potentiale for alvorlige bivirkninger hos ammende spædbørn fra ribavirin, bør der træffes en beslutning om enten at afbryde amning eller behandling med COPEGUS 100 mg, baseret på behandlingens betydning for moderen.
Pædiatrisk brug
Farmakokinetiske evalueringer hos pædiatriske patienter er ikke blevet udført.
Sikkerhed og effektivitet af COPEGUS er ikke blevet fastslået hos patienter under 5 år.
Geriatrisk brug
Kliniske undersøgelser af COPEGUS 100 mg og PEGASYS omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år eller derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Specifikke farmakokinetiske evalueringer for ribavirin hos ældre er ikke blevet udført. Risikoen for toksiske reaktioner på dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Dosis af COPEGUS 100 mg bør reduceres hos patienter med kreatininclearance mindre end eller lig med 50 ml/min. og dosis af PEGASYS bør reduceres hos patienter med kreatininclearance mindre end 30 ml/min [se DOSERING OG ADMINISTRATION ; Brug i specifikke populationer ].
Race
En farmakokinetisk undersøgelse med 42 forsøgspersoner viste, at der ikke er nogen klinisk signifikant forskel i ribavirins farmakokinetik blandt sorte (n=14), latinamerikanske (n=13) og kaukasiske (n=15) forsøgspersoner.
Nedsat nyrefunktion
Nyrefunktionen bør evalueres hos alle patienter før påbegyndelse af COPEGUS ved at estimere patientens kreatininclearance.
Et klinisk forsøg evaluerede behandling med COPEGUS og PEGASYS hos 50 CHC-patienter med moderat (kreatininclearance 30-50 ml/min) eller svær (kreatininclearance mindre end 30 ml/min) nyreinsufficiens eller nyresygdom i slutstadiet (ESRD), der kræver kronisk hæmodialyse (HD). Hos 18 forsøgspersoner med ESRD, der modtog kronisk HS, blev COPEGUS administreret i en dosis på 200 mg dagligt uden nogen åbenbar forskel i bivirkningsprofilen sammenlignet med forsøgspersoner med normal nyrefunktion. Dosisreduktioner og midlertidige afbrydelser af COPEGUS (på grund af COPEGUS-relaterede bivirkninger, hovedsageligt anæmi) blev observeret hos op til en tredjedel ESRD/HD-personer under behandlingen; og kun en tredjedel af disse forsøgspersoner modtog COPEGUS i 48 uger. Ribavirin plasmaeksponeringer var ca. 20 % lavere hos personer med ESRD på HD sammenlignet med personer med normal nyrefunktion, der fik standarddosis på 1000/1200 mg COPEGUS.
Forsøgspersoner med moderat (n=17) eller svær (n=14) nedsat nyrefunktion tolererede ikke henholdsvis 600 mg eller 400 mg daglige doser af COPEGUS på grund af COPEGUS-relaterede bivirkninger, hovedsageligt anæmi, og udviste 20 % til 30 %. højere plasmaeksponeringer for ribavirin (på trods af hyppige dosisændringer) sammenlignet med personer med normal nyrefunktion (kreatininclearance større end 80 ml/min), der fik standarddosis af COPEGUS. Seponeringshyppigheden var højere hos forsøgspersoner med svært nedsat nyrefunktion sammenlignet med det, der blev observeret hos forsøgspersoner med moderat nedsat nyrefunktion eller normal nyrefunktion. Farmakokinetisk modellering og simulering indikerer, at en dosis på 200 mg dagligt hos patienter med svært nedsat nyrefunktion og en dosis på 200 mg dagligt skiftevis med 400 mg den følgende dag hos patienter med moderat nedsat nyrefunktion vil give plasma-ribavirineksponering svarende til patienter med normal nyrefunktion. modtager det godkendte regime af COPEGUS. Disse doser er ikke blevet undersøgt hos patienter [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
Baseret på de farmakokinetiske og sikkerhedsmæssige resultater fra dette forsøg bør patienter med kreatininclearance mindre end eller lig med 50 ml/min. have en reduceret dosis af COPEGUS; og patienter med kreatininclearance mindre end 30 ml/min skal have en reduceret dosis af PEGASYS. Den kliniske og hæmatologiske status for patienter med kreatininclearance mindre end eller lig med 50 ml/min, som får COPEGUS 100 mg, bør overvåges nøje. Patienter med klinisk signifikante laboratorieabnormaliteter eller bivirkninger, som er vedvarende alvorlige eller forværrede, bør seponeres behandlingen [se DOSERING OG ADMINISTRATION , KLINISK FARMAKOLOGI , og PEGASYS indlægsseddel ].
Nedsat leverfunktion
Virkningen af nedsat leverfunktion på ribavirins farmakokinetik efter administration af COPEGUS er ikke blevet evalueret. De kliniske forsøg med COPEGUS 100 mg var begrænset til patienter med Child-Pugh klasse A sygdom.
Køn
Der blev ikke observeret nogen klinisk signifikante forskelle i ribavirins farmakokinetik mellem mandlige og kvindelige forsøgspersoner.
Ribavirins farmakokinetik, når korrigeret for vægt, er ens hos mandlige og kvindelige patienter.
Organtransplantationsmodtagere
Sikkerheden og effekten af PEGASYS og COPEGUS 100 mg behandling er ikke blevet fastslået hos patienter med lever- og andre transplantationer. Som med andre alfa-interferoner er lever- og nyretransplantatafstødninger blevet rapporteret på PEGASYS, alene eller i kombination med COPEGUS [se BIVIRKNINGER ].
OVERDOSIS
Der er ikke rapporteret tilfælde af overdosering med COPEGUS i kliniske forsøg. Hypocalcæmi og hypomagnesæmi er blevet observeret hos personer, der har fået over den anbefalede dosis af ribavirin. I de fleste af disse tilfælde blev ribavirin administreret intravenøst i doser op til og i nogle tilfælde over fire gange den anbefalede maksimale orale daglige dosis.
KONTRAINDIKATIONER
COPEGUS (ribavirin) er kontraindiceret ved:
- Kvinder, der er gravide. COPEGUS kan forårsage fosterskader, når det administreres til en gravid kvinde. COPEGUS er kontraindiceret til kvinder, der er eller kan blive gravide. Hvis dette lægemiddel bruges under graviditet, eller hvis patienten bliver gravid, mens du tager dette lægemiddel, skal patienten informeres om den potentielle fare for fosteret [se ADVARSLER OG FORHOLDSREGLER , Brug i specifikke populationer , og PATIENTOPLYSNINGER ].
- Mænd, hvis kvindelige partnere er gravide.
- Patienter med hæmoglobinopatier (f.eks. thalassæmi major eller seglcelleanæmi).
- I kombination med didanosin. Rapporter om fatalt leversvigt, såvel som perifer neuropati, pancreatitis og symptomatisk hyperlaktæmi/laktatacidose er blevet rapporteret i kliniske forsøg [se DRUGSINTERAKTIONER ].
COPEGUS og PEGASYS kombinationsbehandling er kontraindiceret til patienter med:
- Autoimmun hepatitis.
- Leverdekompensation (Child-Pugh score større end 6; klasse B og C) hos cirrose CHC monoinficerede patienter før behandling [se ADVARSLER OG FORHOLDSREGLER ].
- Leverdekompensation (Child-Pugh-score større end eller lig med 6) hos cirrose CHC-patienter co-inficeret med HIV før behandling [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Ribavirin er et antiviralt lægemiddel [se Mikrobiologi ].
Farmakokinetik
Farmakokinetiske data for multiple doser ribavirin er tilgængelige for HCV-patienter, som fik ribavirin i kombination med peginterferon alfa-2a. Efter administration af 1200 mg/dag med mad i 12 ugers gennemsnit±SD (n=39; kropsvægt større end 75 kg) var AUC0-12 timer 25.361±7110 ng·time/ml, og Cmax var 2748±818 ng/ml. Den gennemsnitlige tid til at nå Cmax var 2 timer. Laveste plasmakoncentrationer af ribavirin efter 12 ugers dosering med mad var 1662±545 ng/ml hos HCV-inficerede patienter, som fik 800 mg/dag (n=89), og 2112±810 ng/mL hos patienter, der fik 1200 mg/dag ( n=75; kropsvægt større end 75 kg).
Den terminale halveringstid for ribavirin efter administration af en enkelt oral dosis COPEGUS er ca. 120 til 170 timer. Den samlede tilsyneladende clearance efter administration af en enkelt oral dosis af COPEGUS 100 mg er ca. 26 l/time. Der er omfattende akkumulering af ribavirin efter gentagen dosering (to gange dagligt), således at Cmax ved steady state var fire gange højere end for en enkelt dosis.
Effekt af mad på absorption af ribavirin
Biotilgængeligheden af en enkelt oral dosis ribavirin blev øget ved samtidig administration med et fedtrigt måltid. Absorptionen blev langsommere (Tmax blev fordoblet), og AUC0-192h og Cmax steg med henholdsvis 42 % og 66 %, når COPEGUS blev taget sammen med et fedtrigt måltid sammenlignet med fastetilstande [se DOSERING OG ADMINISTRATION og PATIENTOPLYSNINGER ].
Elimination og metabolisme
Bidraget fra nyre- og leverveje til eliminering af ribavirin efter administration af COPEGUS 100 mg er ikke kendt. In vitro undersøgelser indikerer, at ribavirin ikke er et substrat for CYP450-enzymer.
Nedsat nyrefunktion
Et klinisk forsøg evaluerede 50 CHC-personer med enten moderat (kreatininclearance 30 til 50 ml/min) eller alvorlig (kreatininclearance mindre end 30 ml/min) nyrefunktionsnedsættelse eller nyresygdom i slutstadiet (ESRD), der kræver kronisk hæmodialyse (HD). Den tilsyneladende clearance af ribavirin var reduceret hos forsøgspersoner med kreatininclearance mindre end eller lig med 50 ml/min, inklusive forsøgspersoner med ESRD på HD, som udviste ca. 30 % af værdien fundet hos forsøgspersoner med normal nyrefunktion. Farmakokinetisk modellering og simulering indikerer, at en dosis på 200 mg dagligt hos patienter med svært nedsat nyrefunktion og en dosis på 200 mg dagligt skiftevis med 400 mg den følgende dag hos patienter med moderat nedsat nyrefunktion vil give plasma-ribavirineksponeringer svarende til dem, der er observeret hos patienter med normal nyrefunktion, der modtager standard 1000/1200 mg COPEGUS daglig dosis. Disse doser er ikke blevet undersøgt hos patienter.
Hos 18 forsøgspersoner med ESRD, der modtog kronisk HD, blev COPEGUS administreret i en dosis på 200 mg dagligt. Ribavirin plasmaeksponeringer hos disse forsøgspersoner var ca. 20 % lavere sammenlignet med forsøgspersoner med normal nyrefunktion, der fik standard 1000/1200 mg COPEGUS daglig dosis [se DOSERING OG ADMINISTRATION , Brug i specifikke populationer ].
Plasma ribavirin fjernes ved hæmodialyse med et ekstraktionsforhold på ca. 50 %; På grund af det store distributionsvolumen af ribavirin forventes plasmaeksponering dog ikke at ændre sig med hæmodialyse.
Mikrobiologi
Virkningsmekanisme
Den mekanisme, hvorved ribavirin bidrager til dets antivirale effekt i klinikken, er ikke fuldt ud forstået. Ribavirin har direkte antiviral aktivitet i vævskultur mod mange RNA-vira. Ribavirin øger mutationsfrekvensen i genomerne af flere RNA-vira, og ribavirintriphosphat hæmmer HCV-polymerase i en biokemisk reaktion.
Antiviral aktivitet i cellekultur
det stabile HCV-cellekulturmodelsystem (HCV-replikon) hæmmede ribavirin autonom HCV-RNA-replikation med en 50 % effektiv koncentration (EC50)-værdi på 11-21 mcM. I den samme model hæmmede PEG-IFN a-2a også HCV RNA-replikation med en EC50-værdi på 0,1-3 ng/ml. Kombinationen af PEG-IFN α-2a og ribavirin var mere effektiv til at hæmme HCV RNA-replikation end begge midler alene.
Modstand
Forskellige HCV-genotyper udviser betydelig klinisk variation i deres respons på PEG-IFN-α og ribavirinbehandling. Virale genetiske determinanter forbundet med det variable respons er ikke blevet endeligt identificeret.
Krydsmodstand
Krydsresistens mellem IFN α og ribavirin er ikke blevet observeret.
Dyretoksikologi
I en undersøgelse med rotter blev det konkluderet, at dominant dødelighed ikke blev induceret af ribavirin ved doser op til 200 mg/kg i 5 dage (op til 1,7 gange den maksimalt anbefalede humane dosis af ribavirin).
Langtidsstudier med mus og rotter (18 til 24 måneder; dosis henholdsvis 20 til 75 og 10 til 40 mg/kg/dag, ca. 0,1 til 0,4 gange den maksimale daglige humane dosis af ribavirin) har vist en sammenhæng mellem kronisk ribavirineksponering og en øget forekomst af vaskulære læsioner (mikroskopiske blødninger) hos mus. Hos rotter forekom retinal degeneration hos kontrolpersoner, men forekomsten var øget hos ribavirinbehandlede rotter.
Kliniske Studier
Patienter med kronisk hepatitis C
Voksne patienter
Sikkerheden og effektiviteten af PEGASYS i kombination med COPEGUS til behandling af hepatitis C-virusinfektion blev vurderet i to randomiserede kontrollerede kliniske forsøg. Alle patienter var voksne, havde kompenseret leversygdom, påviselig hepatitis C-virus, leverbiopsidiagnose af kronisk hepatitis og var tidligere ubehandlet med interferon. Ca. 20 % af patienterne i begge undersøgelser havde kompenseret cirrhose (Child-Pugh klasse A). Patienter co-inficeret med HIV blev udelukket fra disse undersøgelser.
undersøgelse NV15801 blev patienterne randomiseret til at modtage enten PEGASYS 180 mcg subkutant en gang om ugen med en oral placebo, PEGASYS 180 mcg en gang om ugen med COPEGUS 1000 mg gennem munden (legemsvægt mindre end 75 kg) eller 1200 mg gennem munden (kropsvægt større end eller lig med 75 kg) eller interferon alfa-2b 3 mio. IE subkutant tre gange om ugen plus ribavirin 1000 mg eller 1200 mg gennem munden. Alle patienter fik 48 ugers behandling efterfulgt af 24 ugers behandlingsfri opfølgning. COPEGUS eller placebobehandling blev blindet. Vedvarende virologisk respons blev defineret som upåviselig (mindre end 50 IE/ml) HCV RNA på eller efter undersøgelsesuge 68. PEGASYS i kombination med COPEGUS 100 mg resulterede i en højere SVR sammenlignet med PEGASYS alene eller interferon alfa-2b og ribavirin (tabel 9). . I alle behandlingsarme havde patienter med viral genotype 1, uanset viral belastning, en lavere responsrate på PEGASYS i kombination med COPEGUS 100 mg sammenlignet med patienter med andre virale genotyper.
Forskellen i overordnet behandlingsrespons (PEGASYS/COPEGUS – Interferon alfa-2b/ribavirin) var 9 % (95 % CI 2,3, 15,3).
I undersøgelse NV15942 fik alle patienter PEGASYS 180 mcg subkutant én gang ugentligt og blev randomiseret til behandling i enten 24 eller 48 uger og til en COPEGUS-dosis på enten 800 mg eller 1000 mg/1200 mg (for kropsvægt mindre end 75 kg/mere end eller lig med 75 kg). Tildeling til de fire behandlingsarme blev stratificeret efter viral genotype og baseline HCV viral titer. Patienter med genotype 1 og høj viral titer (defineret som større end 2 x 106 HCV RNA kopier/ml serum) blev fortrinsvis tildelt behandling i 48 uger.
Vedvarende virologisk respons (SVR) og HCV-genotype
HCV 1 og 4 — Uanset baseline viral titer resulterede behandling i 48 uger med PEGASYS og 1000 mg eller 1200 mg COPEGUS i højere SVR (defineret som upåviselig HCV RNA i slutningen af den 24-ugers behandlingsfrie opfølgningsperiode) sammenlignet med kortere behandling (24 uger) og/eller 800 mg COPEGUS.
HCV 2 og 3 — Uanset baseline viral titer, resulterede behandling i 24 uger med PEGASYS og 800 mg COPEGUS i en lignende SVR sammenlignet med længere behandling (48 uger) og/eller 1000 mg eller 1200 mg COPEGUS (se tabel 10).
Antallet af patienter med genotype 5 og 6 var for få til at give mulighed for meningsfuld vurdering.
Pædiatriske patienter
Tidligere ubehandlede pædiatriske forsøgspersoner i alderen 5 til 17 år (55 % under 12 år) med kronisk hepatitis C, kompenseret leversygdom og påviselig HCV RNA blev behandlet med COPEGUS 100 mg ca. 15 mg/kg/dag plus PEGASYS 180 mcg/1,73 mcg² x kropsoverfladeareal en gang om ugen i 48 uger. Alle forsøgspersoner blev fulgt i 24 uger efter behandlingen. Vedvarende virologisk respons (SVR) blev defineret som upåviselig (mindre end 50 IE/mL) HCV RNA på eller efter undersøgelsesuge 68. I alt 114 forsøgspersoner blev randomiseret til at modtage enten kombinationsbehandling af COPEGUS plus PEGASYS eller PEGASYS monoterapi; forsøgspersoner, der svigtede PEGASYS monoterapi efter 24 uger eller senere, kunne modtage åbent COPEGUS plus PEGASYS. De indledende randomiserede arme var afbalanceret for demografiske faktorer; 55 forsøgspersoner modtog indledende kombinationsbehandling af COPEGUS 100 mg plus PEGASYS og 59 modtog PEGASYS plus placebo; i den samlede intention-to-treat-population var 45 % kvinder, 80 % var kaukasiske, og 81 % var inficeret med HCV genotype 1. SVR-resultaterne er opsummeret i tabel 11.
Andre behandlingsresponsprædiktorer
Behandlingsresponsrater er lavere hos patienter med dårlige prognostiske faktorer, der modtager pegyleret interferon alfa-terapi. I undersøgelserne NV15801 og NV15942 var behandlingsresponsraterne lavere hos patienter over 40 år (50 % vs. 66 %), hos patienter med cirrhose (47 % vs. 59 %), hos patienter, der vejede over 85 kg (49 % vs. 60 %) og hos patienter med genotype 1 med høj vs. lav viral load (43 % vs. 56 %). Afroamerikanske patienter havde lavere responsrater sammenlignet med kaukasiere.
undersøgelserne NV15801 og NV15942 var mangel på tidlig virologisk respons efter 12 uger (defineret som HCV RNA upåviselig eller mere end 2 log10 lavere end baseline) grund til at seponere behandlingen. Af patienter, som manglede et tidligt viralt respons i 12 uger og gennemførte et anbefalet behandlingsforløb på trods af en protokoldefineret mulighed for at seponere behandlingen, opnåede 5/39 (13 %) en SVR. Af patienter, som manglede et tidligt viralt respons efter 24 uger, gennemførte 19 et fuldt terapiforløb, og ingen opnåede en SVR.
Kronisk hepatitis C/HIV samtidig inficerede patienter
undersøgelse NR15961 blev patienter med CHC/HIV randomiseret til at modtage enten PEGASYS 180 mcg subkutant en gang om ugen plus en oral placebo, PEGASYS 180 mcg en gang om ugen plus COPEGUS 800 mg gennem munden dagligt eller interferon alfa-2a, 3 mio. IE subkutant tre gange om ugen plus COPEGUS 800 mg gennem munden dagligt. Alle patienter modtog 48 ugers behandling, og vedvarende virologisk respons (SVR) blev vurderet efter 24 ugers behandlingsfri opfølgning. COPEGUS 100 mg eller placebobehandling blev blindet i PEGASYS-behandlingsarmene. Alle patienter var voksne, havde kompenseret leversygdom, påviselig hepatitis C-virus, leverbiopsidiagnose af kronisk hepatitis C og var tidligere ubehandlet med interferon. Patienterne havde også CD4+ celletal større end eller lig med 200 celler/mm³ eller CD4+ celletal større end eller lig med 100 celler/mm³ men mindre end 200 celler/mm³ og HIV-1 RNA mindre end 5000 kopier/ml og stabil status af HIV. Cirka 15 % af patienterne i undersøgelsen havde skrumpelever. Resultaterne er vist i tabel 12.
Behandlingsresponsraterne var lavere hos CHC/HIV-patienter med dårlige prognostiske faktorer (inklusive HCV genotype 1, HCV RNA større end 800.000 IE/ml og cirrose), der fik pegyleret interferon alfa-behandling.
Af de patienter, der ikke udviste hverken upåviselig HCV-RNA eller mindst en 2 log10-reduktion fra baseline i HCV-RNA-titer med 12 ugers PEGASYS- og COPEGUS-kombinationsbehandling, opnåede 2 % (2/85) en SVR.
Hos CHC-patienter med HIV-saminfektion, som modtog 48 ugers PEGASYS alene eller i kombination med COPEGUS 100 mg-behandling, steg gennemsnitlige og mediane HIV-RNA-titere ikke over baseline under behandling eller 24 uger efter behandling.
PATIENTOPLYSNINGER
COPEGUS® (Co-PEG-UHS) (ribavirin) Tabletter
Læs denne medicinvejledning omhyggeligt, før du begynder at tage COPEGUS 100mg, og læs medicinvejledningen, hver gang du får mere COPEGUS. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller din behandling.
Læs også medicinvejledningen til PEGASYS (peginterferon alfa-2a).
Hvad er den vigtigste information, jeg bør vide om COPEGUS?
- Kvinderne skal have en graviditetstest, før de starter med COPEGUS, hver måned under behandling med COPEGUS 100 mg og hver måned i de 6 måneder efter behandling med COPEGUS.
- Hvis du eller din kvindelige sexpartner bliver gravid mens du tager COPEGUS 100 mg eller inden for 6 måneder efter du holder op med at tage COPEGUS, skal du straks fortælle det til din læge. Du eller din sundhedsplejerske skal kontakte Ribavirin Graviditetsregister ved at ringe på 1-800-593-2214. Ribavirin Pregnancy Registry indsamler oplysninger om, hvad der sker med mødre og deres babyer, hvis moderen tager COPEGUS, mens hun er gravid.
Hvad er COPEGUS 100mg?
COPEGUS 100mg er et receptpligtigt lægemiddel, der bruges sammen med et andet lægemiddel kaldet PEGASYS (peginterferon alfa-2a) til behandling af kronisk (varig lang tid) hepatitis C-infektion hos personer på 5 år og ældre, hvis lever stadig fungerer normalt, og som ikke er blevet behandlet før med et lægemiddel kaldet et interferon alfa. Det vides ikke, om COPEGUS er sikkert og vil virke på børn under 5 år.
Hvem bør ikke tage COPEGUS 100mg?
Se "Hvad er den vigtigste information, jeg bør vide om COPEGUS 100mg?"
Tag ikke COPEGUS, hvis du:
- har visse typer af hepatitis forårsaget af dit immunsystem, der angriber din lever (autoimmun hepatitis)
- har visse blodsygdomme, såsom thalassæmi major eller seglcelleanæmi (hæmoglobinopatier)
- tage didanosin (Videx eller Videx EC)
Tal med din læge, før du starter behandling med COPEGUS 100mg, hvis du har nogen af disse medicinske tilstande.
Hvad skal jeg fortælle min sundhedsplejerske, før jeg tager COPEGUS 100mg?
Inden du tager COPEGUS, skal du fortælle det til din læge, hvis du har eller har haft:
- behandling for hepatitis C, der ikke virkede for dig
- alvorlige allergiske reaktioner over for COPEGUS eller et af indholdsstofferne i COPEGUS. Se slutningen af denne medicinvejledning for en liste over ingredienser.
- vejrtrækningsproblemer. COPEGUS 100mg kan forårsage eller forværre dine vejrtrækningsproblemer, du allerede har.
- synsproblemer. COPEGUS kan forårsage øjenproblemer eller forværre øjenproblemer, du allerede har. Du bør have en øjenundersøgelse, før du starter behandling med COPEGUS.
- visse blodsygdomme såsom anæmi
- forhøjet blodtryk, hjerteproblemer eller har haft et hjerteanfald. Din læge bør teste dit blod og dit hjerte, før du starter behandling med COPEGUS.
- problemer med skjoldbruskkirtlen
- diabetes. COPEGUS 100mg og PEGASYS kombinationsbehandling kan gøre din diabetes værre eller sværere at behandle.
- leverproblemer andet end hepatitis C-virusinfektion
- humant immundefektvirus (HIV) eller andre immunitetsproblemer
- psykiske problemer, herunder depression eller selvmordstanker
- nyreproblemer
- en organtransplantation
- stofmisbrug eller stofmisbrug
- infektion med hepatitis B-virus
- enhver anden medicinsk tilstand
- ammer. Det vides ikke, om COPEGUS 100 mg udskilles i din modermælk. Du og din læge bør beslutte, om du vil tage COPEGUS eller amme.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. Nogle lægemidler kan forårsage alvorlige bivirkninger, hvis de tages, mens du også tager COPEGUS. Nogle lægemidler kan påvirke, hvordan COPEGUS 100mg virker, eller COPEGUS 100mg kan påvirke, hvordan din anden medicin virker.
Fortæl især din læge, hvis du tager medicin til behandling af HIV, inklusive didanosin (Videx eller Videx EC), eller hvis du tager azathioprin (Imuran eller Azasan).
Kend den medicin du tager. Hold en liste over dem for at vise din læge eller apotek, når du får en ny medicin.
Hvordan skal jeg tage COPEGUS 100mg?
- Tag COPEGUS nøjagtigt som din læge fortæller dig. Din læge vil fortælle dig, hvor meget COPEGUS du skal tage, og hvornår du skal tage det. Til børn på 5 år og ældre vil din læge ordinere dosis af COPEGUS 100 mg baseret på vægt.
- Tag COPEGUS sammen med mad.
- Hvis du glemmer en dosis af COPEGUS 100 mg, skal du tage den glemte dosis så hurtigt som muligt på samme dag. Du må ikke fordoble den næste dosis. Hvis du har spørgsmål om, hvad du skal gøre, så ring til din læge.
- Hvis du tager for meget COPEGUS 100mg, skal du straks ringe til din læge eller det lokale giftkontrolcenter, eller gå til den nærmeste skadestue på hospitalet med det samme.
- Din læge bør tage blodprøver, før du starter behandling med COPEGUS, i uge 2 og 4 af behandlingen, og derefter efter behov for at se, hvor godt du tåler behandlingen, og for at tjekke for bivirkninger. Din læge kan ændre din dosis af COPEGUS 100 mg baseret på blodprøveresultater eller bivirkninger, du måtte have.
- Hvis du har hjerteproblemer, bør din læge tjekke dit hjerte ved at lave et elektrokardiogram, før du starter behandling med COPEGUS, og om nødvendigt under behandlingen.
Hvad skal jeg undgå, mens jeg tager COPEGUS?
COPEGUS 100mg kan få dig til at føle dig træt, svimmel eller forvirret. Du bør ikke køre bil eller betjene maskiner, hvis du har nogle af disse symptomer.
Drik ikke alkohol, herunder øl, vin og spiritus. Dette kan gøre din leversygdom værre.
Hvad er de mulige bivirkninger af COPEGUS?
COPEGUS 100mg kan forårsage alvorlige bivirkninger, herunder:
Se "Hvad er den vigtigste information, jeg bør vide om COPEGUS 100mg?"
- Hævelse og irritation af din bugspytkirtel (pancreatitis). Du kan have mavesmerter, kvalme, opkastning eller diarré.
- Alvorlige allergiske reaktioner. Symptomerne kan omfatte nældefeber, hvæsen, vejrtrækningsbesvær, brystsmerter, hævelse af din mund, tunge eller læber eller alvorligt udslæt.
- Alvorlige vejrtrækningsproblemer. Åndedrætsbesvær kan være tegn på en alvorlig lungeinfektion (lungebetændelse), der kan føre til døden.
- Alvorlige øjenproblemer som kan føre til synstab eller blindhed.
- Leverproblemer. Nogle mennesker kan få forværring af leverfunktionen. Fortæl din læge med det samme, hvis du har nogle af disse symptomer: oppustet mave, forvirring, brun urin og gule øjne.
- Alvorlig depression
- Selvmordstanker og -forsøg
- Effekt på vækst hos børn. Børn kan opleve en forsinkelse i vægtøgning og øget højde, mens de behandles med PEGASYS og COPEGUS. Indhentning af væksten sker efter behandlingens ophør, men nogle børn når muligvis ikke den højde, som de forventedes at have før behandlingen. Tal med din læge, hvis du er bekymret over dit barns vækst under behandling med PEGASYS og COPEGUS.
Ring til din sundhedsplejerske eller få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor. Disse kan være tegn på en alvorlig bivirkning af COPEGUS 100 mg behandling.
Almindelige bivirkninger af COPEGUS taget sammen med PEGASYS omfatter:
- influenzalignende symptomer - træthed, hovedpine, rysten sammen med høj temperatur (feber) og muskel- eller ledsmerter
- humørsvingninger, irritabel følelse, angst og søvnbesvær
- tab af appetit, kvalme, opkastning og diarré
- hårtab
- kløe
Fortæl din læge om enhver bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger ved COPEGUS-behandling. For mere information, spørg din læge eller apotek.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Du kan også indberette bivirkninger til Genentech på 1-888-835-2555.
Hvordan skal jeg opbevare COPEGUS 100mg?
- Opbevar COPEGUS-tabletter mellem 59°F og 86°F (15°C og 30°C).
- Hold flasken tæt lukket.
Opbevar COPEGUS 100mg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af COPEGUS
Det vides ikke, om behandling med COPEGUS 100 mg i kombination med PEGASYS vil forhindre en inficeret person i at sprede hepatitis C-virus til en anden person under behandling.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke COPEGUS 100mg til en tilstand, som den ikke er ordineret til. Giv ikke COPEGUS til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne medicinvejledning opsummerer de vigtigste oplysninger om COPEGUS. Hvis du vil have mere information, så tal med din sundhedsplejerske. Du kan bede din sundhedsplejerske eller dit apotek om oplysninger om COPEGUS, som er skrevet til sundhedspersonale.
Hvad er ingredienserne i COPEGUS 100mg?
Aktiv ingrediens: ribavirin
Inaktive ingredienser: Tablettens kerne indeholder prægelatineret stivelse, mikrokrystallinsk cellulose, natriumstivelsesglykolat, majsstivelse og magnesiumstearat. Overtrækket på tabletten indeholder Chromatone-P eller Opadry Pink (fremstillet ved at bruge hydroxypropylmethylcellulose, talkum, titaniumdioxid, syntetisk gul jernoxid og syntetisk rød jernoxid), ethylcellulose (ECD-30) og triacetin.
Denne medicinvejledning er godkendt af US Food and Drug Administration.
