Protonix 20mg, 40mg Pantoprazole Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Protonix 40mg, og hvordan bruges det?
Protonix 40mg er en receptpligtig medicin, der bruges til at behandle symptomer på spiserørsbetændelse forårsaget af mavesyre på grund af gastroøsofageal reflukssygdom eller GERD og Zollinger-Ellisons syndrom eller andre tilstande, der forårsager overskydende mavesyre. Protonix 40mg kan bruges alene eller sammen med anden medicin.
Protonix tilhører en klasse af lægemidler kaldet protonpumpehæmmere (PPI'er).
Det vides ikke, om Protonix er sikkert og effektivt til børn under 5 år.
Hvad er de mulige bivirkninger af Protonix?
Protonix kan forårsage alvorlige bivirkninger, herunder:
- stærke mavesmerter,
- diarré, der er vandig eller har blod i sig,
- pludselig smerte eller besvær med at bevæge din hofte, håndled eller ryg,
- blå mærker eller hævelse på injektionsstedet,
- lidt eller ingen vandladning,
- blod i urinen,
- hævelse,
- hurtig vægtøgning,
- svimmelhed,
- hurtig eller uregelmæssig puls,
- rysten (rysten) eller rykkende bevægelser,
- føler sig nervøs,
- muskelkramper eller spasmer i dine hænder eller fødder,
- hoste,
- kvælende følelse,
- ledsmerter, og
- hududslæt på dine kinder eller arme, som forværres om natten
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Protonix omfatter:
- hovedpine,
- svimmelhed,
- mavesmerter,
- gas,
- kvalme,
- opkastning,
- diarré,
- ledsmerter,
- feber,
- udslæt, og
- forkølelsessymptomer (hyppigst hos børn)
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Prometrium. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
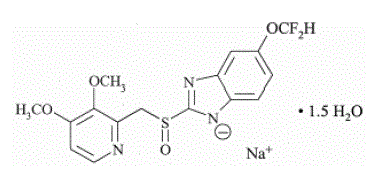
Den aktive ingrediens i PROTONIX (pantoprazolnatrium) til oral suspension med forsinket frigivelse og PROTONIX (pantoprazolnatrium) tabletter med forsinket frigivelse, en PPI, er en substitueret benzimidazol, natrium 5-(difluormethoxy)-2-[[(3,4-) dimethoxy-2-pyridinyl)methyl]sulfinyl]-1H-benzimidazol-sesquihydrat, en forbindelse, der hæmmer mavesyresekretion. Dens empiriske formel er C16H14F2N3NaO4S x 1,5 H2O, med en molekylvægt på 432,4. Strukturformlen er:
Pantoprazolnatriumsesquihydrat er et hvidt til råhvidt krystallinsk pulver og er racemisk. Pantoprazol har svagt basiske og sure egenskaber. Pantoprazolnatriumsesquihydrat er frit opløseligt i vand, meget lidt opløseligt i fosfatbuffer ved pH 7,4 og praktisk talt uopløseligt i n-hexan.
Stabiliteten af forbindelsen i vandig opløsning er pH-afhængig. Nedbrydningshastigheden stiger med faldende pH. Ved omgivelsestemperatur er nedbrydningshalveringstiden ca. 2,8 timer ved pH 5 og ca. 220 timer ved pH 7,8.
PROTONIX 40mg leveres som oral suspension til forsinket frigivelse i enhedsdosispakninger, tilgængelig i én styrke (40 mg) pantoprazol, (svarende til 45,1 mg pantoprazolnatrium), og som en tablet med forsinket frigivelse, tilgængelig i to styrker 20 mg pantoprazol (svarende til 22,56 mg pantoprazolnatrium) og 40 mg pantoprazol (svarende til 45,1 mg pantoprazolnatrium).
PROTONIX tabletter med forsinket frigivelse indeholder følgende inaktive ingredienser: calciumstearat, crospovidon, hypromellose, jernoxid, mannitol, methacrylsyrecopolymer, polysorbat 80, povidon, propylenglycol, natriumcarbonat, natriumlaurylsulfat, titaniumdioxidcitrat og. PROTONIX tabletter med forsinket frigivelse (40 mg og 20 mg) overholder USP opløsningstest 2.
PROTONIX 40mg til oral suspension med forsinket frigivelse indeholder følgende inaktive ingredienser: crospovidon, hypromellose, methacrylsyrecopolymer, mikrokrystallinsk cellulose, polysorbat 80, povidon, natriumcarbonat, natriumlaurylsulfat, talkum, titaniumdioxid, triethylferricitratoxid, triethylferricitratoxid.
INDIKATIONER
PROTONIX til oral suspension med forsinket frigivelse og PROTONIX 40 mg tabletter med forsinket frigivelse er indiceret til:
Kortvarig behandling af erosiv øsofagitis forbundet med gastroøsofageal reflukssygdom (GERD)
PROTONIX 20 mg er indiceret til voksne og pædiatriske patienter i alderen fem år og ældre til korttidsbehandling (op til 8 uger) til heling og symptomatisk lindring af erosiv esophagitis (EE). For de voksne patienter, som ikke er helet efter 8 ugers behandling, kan en yderligere 8-ugers kur med PROTONIX overvejes. Sikkerheden ved behandling ud over 8 uger hos pædiatriske patienter er ikke blevet fastlagt.
Vedligeholdelse af heling af erosiv esophagitis
PROTONIX er indiceret til opretholdelse af heling af EE og reduktion af tilbagefaldsrater af halsbrandssymptomer i dag- og nattetimer hos voksne patienter med GERD. Kontrollerede undersøgelser strakte sig ikke ud over 12 måneder.
Patologiske hypersekretoriske tilstande, herunder Zollinger-Ellisons syndrom
PROTONIX 20mg er indiceret til langtidsbehandling af patologiske hypersekretoriske tilstande, herunder Zollinger-Ellison (ZE) syndrom.
DOSERING OG ADMINISTRATION
Anbefalet doseringsskema
PROTONIX leveres som granulat med forsinket frigivelse i pakninger til fremstilling af orale suspensioner eller som tabletter med forsinket frigivelse. De anbefalede doser er angivet i tabel 1.
Administrationsinstruktioner
Instruktioner for indgivelsesmåde for hver doseringsform er vist i tabel 2.
Tag en glemt dosis så hurtigt som muligt. Hvis det næsten er tid til den næste dosis, skal du springe den glemte dosis over og tage den næste dosis på det normale planlagte tidspunkt. Tag ikke 2 doser på samme tid.
PROTONIX tabletter med forsinket frigivelse
Synk PROTONIX tabletter med forsinket frigivelse hele, med eller uden mad i maven. Til patienter, der ikke er i stand til at sluge en 40 mg tablet, kan der tages to 20 mg tabletter. Samtidig administration af antacida påvirker ikke absorptionen af PROTONIX-tabletter med forsinket frigivelse.
PROTONIX til oral suspension med forsinket frigivelse
Administrer PROTONIX til oral suspension med forsinket frigivelse ca. 30 minutter før et måltid via oral administration i æblejuice eller æblemos eller kun nasogastrisk sonde i æblejuice. Fordi korrekt pH er nødvendig for stabilitet, må PROTONIX 20mg til oral suspension med forsinket frigivelse ikke indgives i andre væsker end æblejuice eller andre fødevarer end æblemos.
Opdel ikke pakken med 40 mg PROTONIX 20 mg til oral suspension med forsinket frigivelse for at skabe en 20 mg dosis til pædiatriske patienter, som ikke er i stand til at tage tabletformuleringen.
PROTONIX til oral suspension med forsinket frigivelse - Oral administration i æblemos
- Åbn pakken.
- Drys granulat på en teskefuld æblemos. BRUG IKKE ANDRE FØDEVARER ELLER KNUS ELLER TYG GRANULERNE.
- Tag inden for 10 minutter efter forberedelse.
- Tag slurke vand for at sikre, at granulat skylles ned i maven. Gentag vandslukke efter behov.
PROTONIX til oral suspension med forsinket frigivelse - Oral administration i æblejuice
- Åbn pakken.
- Tøm granulat i en lille kop eller teske, der indeholder en teskefuld æblejuice.
- Rør i 5 sekunder (granulat opløses ikke) og synk med det samme.
- For at sikre, at hele dosis er taget, skal du skylle beholderen en eller to gange med æblejuice for at fjerne eventuelle resterende granulat. Synk straks.
PROTONIX 40 mg til oral suspension med forsinket frigivelse - Nasogastrisk (NG) sonde eller gastrostomisonde
Til patienter, som har en nasogastrisk sonde eller gastrostomisonde på plads, kan PROTONIX 40 mg til oral suspension med forsinket frigivelse gives som følger:
- Fjern stemplet fra cylinderen på en 2 ounce (60 ml) kateterspidssprøjte. Kassér stemplet.
- Forbind kateterspidsen af sprøjten til et 16 fransk (eller større) rør.
- Hold sprøjten fastgjort til slangen så højt som muligt, mens du giver PROTONIX til oral suspension med forsinket frigivelse for at forhindre bøjning af slangen.
- Tøm indholdet af pakken i sprøjtens cylinder.
- Tilsæt 10 mL (2 teskefulde) æblejuice og bank forsigtigt og/eller ryst sprøjtens cylinder for at hjælpe med at skylle sprøjten og slangen. Gentag mindst to gange mere med den samme mængde æblejuice (10 ml eller 2 teskefulde) hver gang. Der må ikke forblive granulat i sprøjten.
HVORDAN LEVERET
Doseringsformer og styrker
Tabletter med forsinket udgivelse:
- 40 mg pantoprazol, gule ovale bikonvekse tabletter præget med PROTONIX (brunt blæk) på den ene side
- 20 mg pantoprazol, gule ovale bikonvekse tabletter præget med P20 (brunt blæk) på den ene side
For oral suspension med forsinket frigivelse:
- 40 mg pantoprazol, svagt gulligt til mørkebrunligt, enterisk overtrukne granulat i en enhedsdosispakke
Opbevaring og håndtering
PROTONIX (pantoprazolnatrium) tabletter med forsinket frigivelse leveres som gule, ovale bikonvekse tabletter med forsinket frigivelse præget med PROTONIX (brunt blæk) på den ene side indeholdende 40 mg pantoprazol og fås som følger:
NDC 0008-0841-81, flasker á 90 stk
PROTONIX (pantoprazolnatrium) tabletter med forsinket frigivelse leveres som gule ovale bikonvekse tabletter med forsinket frigivelse præget med P20 (brunt blæk) på den ene side indeholdende 20 mg pantoprazol og fås som følger:
NDC 0008-0843-81, flasker á 90 stk
PROTONIX (pantoprazolnatrium) Til oral suspension med forsinket frigivelse leveres som lysegullige til mørkebrune, enterisk-coatede granulat indeholdende 40 mg pantoprazol i en enhedsdosispakke og fås som følger:
NDC 0008-0844-02, enhedsdosis karton med 30 stk
Opbevaring
Opbevar PROTONIX 40 mg til oral suspension med forsinket frigivelse og PROTONIX 20 mg tabletter med forsinket frigivelse ved 20° til 25°C (68° til 77°F); udflugter tilladt til 15° til 30°C (59° til 86°F) [se USP kontrolleret rumtemperatur ].
Distribueret af: Wyeth Pharmaceuticals LLC, Et datterselskab af Pfizer Inc., Philadelphia, PA 19101. Revideret: nov 2020
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i mærkningen:
- Akut Tubulointerstitiel nefritis [se ADVARSLER OG FORHOLDSREGLER ]
- Clostridium difficile-associeret diarré [se ADVARSLER OG FORHOLDSREGLER ]
- Knoglebrud [se ADVARSLER OG FORHOLDSREGLER ]
- Kutan og systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ]
- Cyanocobalamin (vitamin B-12) mangel [se ADVARSLER OG FORHOLDSREGLER ]
- Hypomagnesæmi [se ADVARSLER OG FORHOLDSREGLER ]
- Fundiske kirtelpolypper [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Bivirkningsprofilerne for PROTONIX (pantoprazolnatrium) til oral suspension med forsinket frigivelse og PROTONIX (pantoprazolnatrium) tabletter med forsinket frigivelse er ens.
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan frekvenser af bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
Voksne
Sikkerhed i ni randomiserede sammenlignende amerikanske kliniske forsøg med patienter med GERD inkluderede 1.473 patienter på oral PROTONIX (20 mg eller 40 mg), 299 patienter på en H2-receptorantagonist, 46 patienter på en anden PPI og 82 patienter på placebo. De hyppigst forekommende bivirkninger er angivet i tabel 3.
Yderligere bivirkninger, der blev rapporteret for PROTONIX 20 mg i kliniske forsøg med en frekvens på ≤2 %, er anført nedenfor efter kropssystem:
Kroppen som helhed: allergisk reaktion, pyreksi, lysfølsomhedsreaktion, ansigtsødem
Gastrointestinale: forstoppelse, mundtørhed, hepatitis
Hæmatologisk: leukopeni, trombocytopeni
Metabolisk/ernæringsmæssig: forhøjet CK (kreatinkinase), generaliseret ødem, forhøjede triglycerider, forhøjede leverenzymer
Muskuloskeletale: myalgi
Nervøs: depression, svimmelhed
Hud og vedhæng: nældefeber, udslæt, kløe
Særlige sanser: sløret syn
Pædiatriske patienter
Sikkerheden af PROTONIX i behandlingen af EE forbundet med GERD blev evalueret hos pædiatriske patienter i alderen 1 år til 16 år i tre kliniske forsøg. Sikkerhedsforsøg involverede pædiatriske patienter med EE; men da EE er ualmindeligt i den pædiatriske population, blev 249 pædiatriske patienter med endoskopisk dokumenteret eller symptomatisk GERD også evalueret. Alle voksne bivirkninger af PROTONIX 20 mg anses for relevante for pædiatriske patienter. Hos patienter i alderen 1 år til 16 år omfatter de mest almindeligt rapporterede (>4%) bivirkninger: URI, hovedpine, feber, diarré, opkastning, udslæt og mavesmerter.
For sikkerhedsinformation til patienter under 1 år se Brug i specifikke populationer .
Yderligere bivirkninger, der blev rapporteret for PROTONIX 20 mg hos pædiatriske patienter i kliniske forsøg med en frekvens på ≤4 %, er anført nedenfor efter kropssystem:
Kroppen som helhed: allergisk reaktion, ansigtsødem
Gastrointestinale: forstoppelse, flatulens, kvalme
Metabolisk/ernæringsmæssig: forhøjede triglycerider, forhøjede leverenzymer, forhøjet CK (kreatinkinase)
Muskuloskeletale: artralgi, myalgi
Nervøs: svimmelhed, svimmelhed
Hud og vedhæng: nældefeber
Følgende bivirkninger set hos voksne i kliniske forsøg blev ikke rapporteret hos pædiatriske patienter i kliniske forsøg, men anses for relevante for pædiatriske patienter: lysfølsomhedsreaktion, mundtørhed, hepatitis, trombocytopeni, generaliseret ødem, depression, kløe, leukopeni og sløret syn .
Zollinger-Ellison (ZE) syndrom
I kliniske undersøgelser af ZE-syndrom var bivirkninger rapporteret hos 35 patienter, der tog PROTONIX 80 mg/dag til 240 mg/dag i op til 2 år, de samme som rapporteret hos voksne patienter med GERD.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af PROTONIX efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Disse bivirkninger er angivet nedenfor efter kropssystem:
Gastrointestinale lidelser: fundic kirtel polypper
Generelle lidelser og administrationsbetingelser: asteni, træthed, utilpashed
Hæmatologisk: pancytopeni, agranulocytose
Lever og galdeveje: hepatocellulær skade, der fører til gulsot og leversvigt
Forstyrrelser i immunsystemet: anafylaksi (herunder anafylaktisk shock), systemisk lupus erythematosus
Infektioner og angreb: Clostridium difficile associeret diarré
Undersøgelser: vægtændringer
Metabolisme og ernæringsforstyrrelser: hyponatriæmi, hypomagnesæmi
Muskuloskeletale lidelser: rhabdomyolyse, knoglebrud
Nervøs: ageusi, dysgeusi
Psykiatriske lidelser: hallucinationer, forvirring, søvnløshed, somnolens
Nyre- og urinvejslidelser: akut tubulointerstitiel nefritis
Hud- og subkutane vævsforstyrrelser: alvorlige dermatologiske reaktioner (nogle dødelige), herunder erythema multiforme, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse (TEN, nogle dødelig), angioødem (Quinckes ødem) og kutan lupus erythematosus
DRUGSINTERAKTIONER
Tabel 4 inkluderer lægemidler med klinisk vigtige lægemiddelinteraktioner og interaktion med diagnostik, når de administreres samtidig med PROTONIX og instruktioner til at forebygge eller håndtere dem.
Se mærkningen af samtidig anvendte lægemidler for at få yderligere oplysninger om interaktioner med PPI'er.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Tilstedeværelse af gastrisk malignitet
Hos voksne udelukker symptomatisk respons på behandling med PROTONIX ikke tilstedeværelsen af gastrisk malignitet. Overvej yderligere opfølgning og diagnostisk testning hos voksne patienter, som har et suboptimalt respons eller et tidligt symptomatisk tilbagefald efter endt behandling med en PPI. Overvej også en endoskopi hos ældre patienter.
Akut Tubulointerstitiel nefritis
Akut tubulointerstitiel nefritis (TIN) er blevet observeret hos patienter, der tager PPI'er og kan forekomme på ethvert tidspunkt under PPI-behandling. Patienter kan vise sig med forskellige tegn og symptomer fra symptomatiske overfølsomhedsreaktioner til uspecifikke symptomer på nedsat nyrefunktion (f.eks. utilpashed, kvalme, anoreksi). I rapporterede tilfældeserier blev nogle patienter diagnosticeret på biopsi og i fravær af ekstrarenale manifestationer (f.eks. feber, udslæt eller artralgi). Seponer PROTONIX 20 mg og evaluer patienter med mistanke om akut TIN [se KONTRAINDIKATIONER ].
Clostridium difficile-associeret diarré
Publicerede observationsstudier tyder på, at PPI-behandling som PROTONIX 20mg kan være forbundet med en øget risiko for Clostridium difficile-associeret diarré, især hos indlagte patienter. Denne diagnose bør overvejes for diarré, der ikke forbedres [se BIVIRKNINGER ].
Patienter bør anvende den laveste dosis og korteste varighed af PPI-behandling, der er passende til den tilstand, der behandles.
Knoglebrud
Adskillige publicerede observationsstudier tyder på, at PPI-behandling kan være forbundet med en øget risiko for osteoporose-relaterede frakturer i hofte, håndled eller rygsøjle. Risikoen for fraktur var øget hos patienter, der fik høje doser, defineret som flere daglige doser, og langvarig PPI-behandling (et år eller længere). Patienter bør anvende den laveste dosis og korteste varighed af PPI-behandling, der er passende til den tilstand, der behandles. Patienter med risiko for osteoporose-relaterede frakturer bør behandles i henhold til etablerede behandlingsretningslinjer [se DOSERING OG ADMINISTRATION , BIVIRKNINGER ].
Kutan og systemisk lupus erythematosus
Kutan lupus erythematosus (CLE) og systemisk lupus erythematosus (SLE) er blevet rapporteret hos patienter, der tager PPI'er, inklusive pantoprazolnatrium. Disse hændelser er opstået som både nyopstået og en forværring af eksisterende autoimmun sygdom. Størstedelen af PPI-inducerede lupus erytematøse tilfælde var CLE.
Den mest almindelige form for CLE rapporteret hos patienter behandlet med PPI'er var subakut CLE (SCLE) og forekom inden for uger til år efter kontinuerlig lægemiddelbehandling hos patienter lige fra spædbørn til ældre. Generelt blev histologiske fund observeret uden organinvolvering.
Systemisk lupus erythematosus (SLE) er mindre almindeligt rapporteret end CLE hos patienter, der får PPI'er. PPI-associeret SLE er normalt mildere end ikke-lægemiddelinduceret SLE. Indtræden af SLE forekom typisk inden for dage til år efter påbegyndelse af behandling, primært hos patienter lige fra unge voksne til ældre. Størstedelen af patienterne fik udslæt; dog blev der også rapporteret om artralgi og cytopeni.
Undgå administration af PPI'er i længere tid end medicinsk indiceret. Hvis der observeres tegn eller symptomer, der stemmer overens med CLE eller SLE, hos patienter, der får PROTONIX 40 mg, skal lægemidlet seponeres og patienten henvises til den relevante specialist for evaluering. De fleste patienter forbedres ved seponering af PPI alene i 4 til 12 uger. Serologiske test (f.eks. ANA) kan være positive, og forhøjede serologiske testresultater kan tage længere tid at løse end kliniske manifestationer.
Cyanocobalamin (vitamin B-12) mangel
Generelt kan daglig behandling med syre-undertrykkende medicin over en lang periode (f.eks. længere end 3 år) føre til malabsorption af cyanocobalamin (vitamin B-12) forårsaget af hypo- eller achlorhydri. Sjældne rapporter om cyanocobalaminmangel, der forekommer i forbindelse med syreundertrykkende behandling, er blevet rapporteret i litteraturen. Denne diagnose bør overvejes, hvis der observeres kliniske symptomer, der stemmer overens med cyanocobalaminmangel.
Hypomagnesæmi
Hypomagnesæmi, symptomatisk og asymptomatisk, er sjældent blevet rapporteret hos patienter behandlet med PPI i mindst tre måneder og i de fleste tilfælde efter et års behandling. Alvorlige bivirkninger omfatter tetany, arytmier og anfald. Hos de fleste patienter krævede behandling af hypomagnesiæmi magnesiumerstatning og seponering af PPI.
For patienter, der forventes at være i langvarig behandling, eller som tager PPI'er sammen med medicin såsom digoxin eller lægemidler, der kan forårsage hypomagnesæmi (f.eks. diuretika), kan sundhedspersonale overveje at overvåge magnesiumniveauer før påbegyndelse af PPI-behandling og periodisk [se BIVIRKNINGER ].
Tumorogenicitet
På grund af den kroniske karakter af GERD kan der være mulighed for forlænget administration af PROTONIX. I langtidsundersøgelser med gnavere var pantoprazol kræftfremkaldende og forårsagede sjældne typer mave-tarmtumorer. Relevansen af disse fund for tumorudvikling hos mennesker er ukendt [se Ikke-klinisk toksikologi ].
Fundiske kirtelpolypper
PPI-brug er forbundet med en øget risiko for fundiske kirtelpolypper, der øges ved langvarig brug, især ud over et år. De fleste PPI-brugere, som udviklede fundiske kirtelpolypper, var asymptomatiske, og fundiske kirtelpolypper blev identificeret ved endoskopi. Brug den korteste varighed af PPI-behandling, der passer til den tilstand, der behandles.
Interferens med undersøgelser for neuroendokrine tumorer
Serumchromogranin A (CgA) niveauer stiger sekundært til lægemiddelinducerede fald i mavesyreindholdet. Det øgede CgA-niveau kan forårsage falske positive resultater i diagnostiske undersøgelser for neuroendokrine tumorer. Sundhedsudbydere bør midlertidigt stoppe behandlingen med PROTONIX 20 mg mindst 14 dage før vurdering af CgA-niveauer og overveje at gentage testen, hvis de initiale CgA-niveauer er høje. Hvis der udføres serielle tests (f.eks. til overvågning), bør det samme kommercielle laboratorium bruges til test, da referenceintervaller mellem test kan variere [se KLINISK FARMAKOLOGI ].
Interferens med Urin Screen for THC
Der har været rapporter om falsk positive urinscreeningstests for tetrahydrocannabinol (THC) hos patienter, der fik PPI'er, inklusive PROTONIX [se DRUGSINTERAKTIONER ].
Samtidig brug af PROTONIX og methotrexat
Litteraturen tyder på, at samtidig brug af PPI'er med methotrexat (primært i høje doser; se methotrexat-receptinformation) kan forhøje og forlænge serumniveauer af methotrexat og/eller dets metabolit, hvilket muligvis kan føre til methotrexat-toksicitet. Ved højdosis methotrexatadministration kan en midlertidig seponering af PPI overvejes hos nogle patienter [se DRUGSINTERAKTIONER ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning og brugsanvisning ).
Mave Malignitet
Rådgive patienter om at vende tilbage til deres læge, hvis de har en suboptimal respons eller et tidligt symptomatisk tilbagefald [se ADVARSLER OG FORHOLDSREGLER ].
Akut Tubulointerstitiel nefritis
Råd patienter til straks at ringe til deres læge, hvis de oplever tegn og/eller symptomer forbundet med akut tubulointerstitiel nefritis [se KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER ].
Clostridium Difficile-associeret diarré
Råd patienter til straks at ringe til deres læge, hvis de oplever diarré, der ikke forbedres [se ADVARSLER OG FORHOLDSREGLER ].
Knoglebrud
Råd patienter til at rapportere eventuelle brud, især i hofte, håndled eller rygsøjle, til deres læge [se ADVARSLER OG FORHOLDSREGLER ].
Kutan og systemisk lupus erythematosus
Råd patienter om straks at ringe til deres læge for nye eller forværrede symptomer forbundet med kutan eller systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ].
Cyanocobalamin (vitamin B-12) mangel
Råd patienter til at rapportere alle kliniske symptomer, der kan være forbundet med cyancobalaminmangel, til deres læge, hvis de har fået PROTONIX 40 mg i mere end 3 år [se ADVARSLER OG FORHOLDSREGLER ].
Hypomagnesæmi
Rådgive patienter til at rapportere alle kliniske symptomer, der kan være forbundet med hypomagnesiæmi til deres læge, hvis de har fået PROTONIX 40 mg i mindst 3 måneder [se ADVARSLER OG FORHOLDSREGLER ].
Lægemiddelinteraktioner
Instruer patienterne i at informere deres læge om enhver anden medicin, de i øjeblikket tager, inklusive rilpivirinholdige produkter [se KONTRAINDIKATIONER ] digoxin [se ADVARSLER OG FORHOLDSREGLER ] og højdosis methotrexat [se ADVARSLER OG FORHOLDSREGLER ].
Graviditet
Informer en gravid kvinde om den potentielle risiko for et foster. Rådgiv kvinder med reproduktionspotentiale om at informere deres læge om en kendt eller formodet graviditet [se Brug i specifikke populationer ].
Administration
- Du må ikke dele, knuse eller tygge PROTONIX til oral suspension med forsinket frigivelse og PROTONIX 20 mg tabletter med forsinket frigivelse.
- PROTONIX oral suspension er en fast dosis og kan ikke opdeles til en mindre dosis.
- Synk PROTONIX 20 mg tabletter med forsinket frigivelse hele, med eller uden mad i maven.
- Samtidig administration af antacida påvirker ikke absorptionen af PROTONIX-tabletter med forsinket frigivelse.
- Tag PROTONIX 20 mg til oral suspension med forsinket frigivelse cirka 30 minutter før et måltid.
- Administrer PROTONIX til oral suspension med forsinket frigivelse i æblejuice eller æblemos, som beskrevet i brugsanvisningen. Må ikke administreres i vand, andre væsker eller fødevarer.
- Til patienter med en nasogastrisk (NG) eller gastrostomisonde kan PROTONIX For Delayed-Release Oral Suspension administreres med æblejuice, som beskrevet i brugsanvisningen.
- Tag en glemt dosis så hurtigt som muligt. Hvis det næsten er tid til den næste dosis, skal du springe den glemte dosis over og tage den næste dosis på det normale planlagte tidspunkt. Tag ikke 2 doser på samme tid.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
et 24-måneders carcinogenicitetsstudie blev Sprague-Dawley-rotter behandlet oralt med pantoprazol-doser på 0,5 til 200 mg/kg/dag, ca. /dag. I gastrisk fundus frembragte behandling med 0,5 til 200 mg/kg/dag enterochromaffin-lignende (ECL) cellehyperplasi og godartede og maligne neuroendokrine celletumorer på en dosisrelateret måde. I formaven frembragte behandling med 50 og 200 mg/kg/dag (ca. 10 og 40 gange den anbefalede humane dosis på kropsoverfladebasis) godartede pladecellepapillomer og ondartede pladecellecarcinomer. Sjældne gastrointestinale tumorer forbundet med pantoprazolbehandling inkluderede et adenocarcinom i tolvfingertarmen med 50 mg/kg/dag og benigne polypper og adenokarcinomer i mavefundus med 200 mg/kg/dag. I leveren gav behandling med 0,5 til 200 mg/kg/dag dosisrelaterede stigninger i forekomsten af hepatocellulære adenomer og carcinomer. I skjoldbruskkirtlen gav behandling med 200 mg/kg/dag øget forekomst af follikulære celleadenomer og karcinomer hos både han- og hunrotter.
et 24-måneders karcinogenicitetsstudie blev Fischer 344-rotter behandlet oralt med doser på 5 til 50 mg/kg/dag af pantoprazol, ca. 1 til 10 gange den anbefalede humane dosis baseret på kropsoverfladeareal. I den gastriske fundus frembragte behandling med 5 til 50 mg/kg/dag enterochromaffin-lignende (ECL) cellehyperplasi og benigne og ondartede neuroendokrine celletumorer. Dosisvalg til denne undersøgelse har muligvis ikke været tilstrækkelig til en omfattende evaluering af pantoprazols karcinogene potentiale.
I et 24-måneders karcinogenicitetsstudie blev B6C3F1-mus behandlet oralt med doser på 5 til 150 mg/kg/dag af pantoprazol, 0,5 til 15 gange den anbefalede humane dosis baseret på kropsoverfladeareal. I leveren gav behandling med 150 mg/kg/dag øget forekomst af hepatocellulære adenomer og carcinomer hos hunmus. Behandling med 5 til 150 mg/kg/dag frembragte også gastrisk-fundisk ECL-cellehyperplasi.
En 26-ugers p53 +/-transgen mus carcinogenicitetsundersøgelse var ikke positiv.
Pantoprazol var positiv i in vitro humane lymfocytkromosomafvigelsesassays, i en af to muse mikronucleus tests for klastogene effekter og i in vitro kinesisk hamster ovariecelle/HGPRT forward mutation assay for mutagene effekter. Tvetydige resultater blev observeret i in vivo rottelever-DNA kovalent bindingsassay. Pantoprazol var negativ i in vitro Ames mutationsassay, in vitro unscheduled DNA-syntese (UDS) assay med rottehepatocytter, in vitro AS52/GPT pattedyr celle-forward genmutationsanalyse, in vitro thymidinkinase mutationstest med muse lymfom L5178Y celler og in vivo rotteknoglemarvscelle-kromosomafvigelsesassayet.
Der var ingen effekt på fertilitet eller reproduktionsevne, når pantoprazol blev givet i orale doser på op til 500 mg/kg/dag til hanrotter (98 gange den anbefalede humane dosis baseret på kropsoverfladeareal) og 450 mg/kg/dag til hunrotter. (88 gange den anbefalede humane dosis baseret på kropsoverfladeareal).
Brug i specifikke populationer
Graviditet
Risikooversigt
Tilgængelige data fra publicerede observationsstudier viste ikke en sammenhæng mellem større misdannelser eller andre uønskede graviditetsudfald med pantoprazol.
I dyrereproduktionsstudier blev der ikke observeret tegn på uønskede udviklingsresultater med pantoprazol. Reproduktionsundersøgelser er blevet udført på rotter ved orale doser op til 450 mg/kg/dag (ca. 88 gange den anbefalede humane dosis) og kaniner ved orale doser op til 40 mg/kg/dag (ca. 16 gange den anbefalede humane dosis) med administration af pantoprazol under organogenese hos drægtige dyr og har ikke afsløret tegn på skade på fosteret på grund af pantoprazol i denne undersøgelse (se Data ).
En præ- og postnatal udviklingstoksicitetsundersøgelse i rotter med yderligere endepunkter for at evaluere effekten på knogleudvikling blev udført med pantoprazolnatrium. Orale pantoprazoldoser på 5, 15 og 30 mg/kg/dag (ca. 1, 3 og 6 gange den humane dosis på 40 mg/dag) blev administreret til gravide kvinder fra drægtighedsdag (GD) 6 til og med laktationsdagen (LD). ) 21. Ændringer i knoglemorfologi blev observeret hos unger eksponeret for pantoprazol in utero og gennem mælk i diegivningsperioden samt ved oral dosering fra postnatal dag (PND) 4 til PND 21 [se Brug i specifikke populationer ]. Der var ingen lægemiddelrelaterede fund hos moderdyr. Informer gravide kvinder om den potentielle risiko for fosterskader.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i de klinisk anerkendte graviditeter henholdsvis 2 til 4 % og 15 til 20 %.
Data
Menneskelige data
Tilgængelige data fra publicerede observationsstudier viste ikke en sammenhæng mellem uønskede graviditetsrelaterede udfald og brug af pantoprazol. Metodiske begrænsninger af disse observationsstudier kan ikke med sikkerhed fastslå eller udelukke nogen lægemiddelassocieret risiko under graviditet. I en prospektiv undersøgelse foretaget af European Network of Teratology Information Services blev resultaterne fra en gruppe på 53 gravide kvinder, der fik administreret median daglige doser på 40 mg pantoprazol, sammenlignet med en kontrolgruppe på 868 gravide kvinder, som ikke tog nogen protonpumpehæmmere (PPI'er). . Der var ingen forskel i frekvensen af større misdannelser mellem kvinder udsat for PPI'er og kontrolgruppen, svarende til en relativ risiko (RR)=0,55, [95 % konfidensinterval (CI) 0,08-3,95]. I et populationsbaseret retrospektivt kohortestudie, der dækkede alle levende fødte i Danmark fra 1996 til 2008, var der ingen signifikant stigning i større fødselsdefekter under analyse af første trimester eksponering for pantoprazol hos 549 levendefødte børn. En meta-analyse, der sammenlignede 1.530 gravide kvinder udsat for PPI'er i mindst første trimester med 133.410 ueksponerede gravide, viste ingen signifikant stigning i risikoen for medfødte misdannelser eller spontan abort med eksponering for PPI'er (for større misdannelser OR=1,12 ([95 %) CI 0,86-1,45] og for spontane aborter OR=1,29 [95 % CI 0,84-1,97]).
Dyredata
Reproduktionsundersøgelser er blevet udført på rotter ved orale pantoprazoldoser op til 450 mg/kg/dag (ca. 88 gange den anbefalede humane dosis baseret på kropsoverfladeareal) og på kaniner ved orale doser op til 40 mg/kg/dag (ca. 16 gange den anbefalede humane dosis baseret på kropsoverfladeareal) med administration af pantoprazolnatrium under organogenese hos drægtige dyr. Undersøgelserne har ikke afsløret tegn på nedsat fertilitet eller skade på fosteret på grund af pantoprazol.
En præ- og postnatal udviklingstoksicitetsundersøgelse i rotter med yderligere endepunkter for at evaluere effekten på knogleudvikling blev udført med pantoprazolnatrium. Orale pantoprazoldoser på 5, 15 og 30 mg/kg/dag (ca. 1, 3 og 6 gange den humane dosis på 40 mg/dag på basis af kropsoverfladeareal) blev administreret til gravide kvinder fra drægtighedsdagen (GD) 6 til og med laktationsdag (LD) 21. På postnatal dag (PND 4) til og med PND 21 fik ungerne orale doser på 5, 15 og 30 mg/kg/dag (ca. 1, 2,3 og 3,2 gange eksponeringen (ca. AUC) hos mennesker i en dosis på 40 mg). Der var ingen lægemiddelrelaterede fund hos moderdyr. Under doseringsfasen før fravænning (PND 4 til 21) af ungerne var der øget dødelighed og/eller moribunditet og nedsat kropsvægt og vægtøgning ved 5 mg/kg/dag (ca. lige store eksponeringer (AUC) hos mennesker, der fik de 40 mg dosis) og højere doser. På PND 21 blev der observeret nedsat gennemsnitlig lårbenslængde og vægt og ændringer i lårbensknoglemasse og geometri hos afkommet ved 5 mg/kg/dag (ca. lige store eksponeringer (AUC) hos mennesker ved 40 mg dosis) og højere doser. Femurfundene inkluderede lavere totalareal, knoglemineralindhold og tæthed, periosteal og endosteal omkreds og tværsnitsinertimoment. Der var ingen mikroskopiske ændringer i det distale lårben, proksimale skinneben eller kvælende led. Ændringer i knogleparametre var delvist reversible efter en restitutionsperiode, med fund på PND 70 begrænset til lavere lårbensmetafyse cortical/subcortical knoglemineraltæthed hos hununger ved 5 mg/kg/dag (ca. lige store eksponeringer (AUC) hos mennesker ved de 40 mg dosis) og højere doser.
Amning
Risikooversigt
Pantoprazol er blevet påvist i modermælk fra en ammende mor efter en enkelt 40 mg oral dosis pantoprazol. Der var ingen virkninger på det ammede spædbarn (se Data ). Der er ingen data om pantoprazols virkning på mælkeproduktionen.

De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for PROTONIX 40mg og eventuelle negative virkninger på det ammede barn fra pantoprazol eller fra den underliggende moderens tilstand.
Data
Modermælken fra en 42-årig kvinde, der fik 40 mg oral pantoprazol 10 måneder efter fødslen, blev undersøgt i 24 timer for at påvise lave niveauer af pantoprazol i modermælken. Pantoprazol kunne påvises i mælk kun 2 og 4 timer efter dosis med mælkeniveauer på henholdsvis ca. 36 mcg/l og 24 mcg/l. Et mælk-til-plasma-forhold på 0,022 blev observeret 2 timer efter lægemiddeladministration. Pantoprazol var ikke påviselig (
Pædiatrisk brug
Sikkerheden og effektiviteten af PROTONIX til korttidsbehandling (op til otte uger) af EE forbundet med GERD er blevet fastslået hos pædiatriske patienter i alderen 1 år til 16 år. Effektivitet for EE er ikke blevet påvist hos patienter under 1 år. For patienter under 5 år er der desuden ingen passende doseringsstyrke i en alderssvarende formulering tilgængelig. Derfor er PROTONIX indiceret til korttidsbehandling af EE forbundet med GERD til patienter på 5 år og ældre. Sikkerheden og effektiviteten af PROTONIX til andre pædiatriske anvendelser end EE er ikke blevet fastslået.
1 år til 16 år
Brug af PROTONIX til pædiatriske patienter i alderen 1 år til 16 år til korttidsbehandling (op til otte uger) af EE forbundet med GERD understøttes af: a) ekstrapolering af resultater fra tilstrækkelige og velkontrollerede undersøgelser, der understøttede godkendelsen af PROTONIX til behandling af EE forbundet med GERD hos voksne, og b) sikkerhed, effektivitet og farmakokinetiske undersøgelser udført hos pædiatriske patienter [se Kliniske Studier , KLINISK FARMAKOLOGI ].
Sikkerheden af PROTONIX 40 mg til behandling af EE forbundet med GERD hos pædiatriske patienter i alderen 1 til 16 år blev evalueret i tre multicenter, randomiserede, dobbeltblindede, parallel-behandlingsstudier, der involverede 249 pædiatriske patienter, herunder 8 med EE (4 patienter) alderen 1 år til 5 år og 4 patienter 5 år til 11 år). Børn i alderen 1 år til 5 år med endoskopisk diagnosticeret EE (defineret som en endoskopisk Hetzel-Dent-score ≥2) blev behandlet én gang dagligt i 8 uger med et af to dosisniveauer af PROTONIX (ca. 0,6 mg/kg eller 1,2 mg/kg). ). Alle 4 af disse patienter med EE blev helbredt (Hetzel-Dent-score på 0 eller 1) efter 8 uger. Fordi EE er ualmindeligt i den pædiatriske population, blev overvejende pædiatriske patienter med endoskopisk dokumenteret eller symptomatisk GERD også inkluderet i disse undersøgelser. Patienterne blev behandlet med en række doser af PROTONIX 20 mg én gang dagligt i 8 uger. For sikkerhedsfund se BIVIRKNINGER Fordi disse pædiatriske undersøgelser ikke havde placebo, aktiv komparator eller evidens for et dosisrespons, var forsøgene inkonklusive med hensyn til den kliniske fordel af PROTONIX 20 mg til symptomatisk GERD i den pædiatriske population. Effektiviteten af PROTONIX 40 mg til behandling af symptomatisk GERD hos pædiatriske patienter er ikke blevet fastslået.
Selvom data fra de kliniske forsøg understøtter brug af PROTONIX til korttidsbehandling af EE forbundet med GERD hos pædiatriske patienter 1 år til 5 år, er der ingen kommercielt tilgængelig doseringsformulering, der er passende til patienter under 5 år [se DOSERING OG ADMINISTRATION ].
en populationsfarmakokinetisk analyse havde clearanceværdier hos børn i alderen 1 til 5 år med endoskopisk påvist GERD en medianværdi på 2,4 l/time. Efter en ækvivalent dosis på 1,2 mg/kg (15 mg for ≤12,5 kg og 20 mg for >12,5 til
Nyfødte til mindre end et år
PROTONIX 20 mg viste sig ikke at være effektiv i et multicenter, randomiseret, dobbelt-blindt, placebokontrolleret, behandling-seponeringsstudie med 129 pædiatriske patienter i alderen 1 til 11 måneder. Patienter blev inkluderet, hvis de havde symptomatisk GERD baseret på sygehistorie og ikke havde reageret på ikke-farmakologiske interventioner for GERD i to uger. Patienterne fik PROTONIX dagligt i fire uger i en åben fase, hvorefter patienterne blev randomiseret i lige store forhold til at modtage PROTONIX 40 mg behandling eller placebo i de efterfølgende fire uger på en dobbeltblind måde. Effekten blev vurderet ved at observere tiden fra randomisering til undersøgelsesophør på grund af symptomforværring i løbet af den fire uger lange behandling-seponeringsfase. Der var ingen statistisk signifikant forskel mellem PROTONIX 20 mg og placebo i seponeringshastigheden.
dette forsøg var de bivirkninger, der blev rapporteret mere almindeligt (forskel på ≥4%) i den behandlede population sammenlignet med placebopopulationen, forhøjet CK, mellemørebetændelse, rhinitis og laryngitis.
I en populationsfarmakokinetisk analyse var den systemiske eksponering højere hos patienter under 1 år med GERD sammenlignet med voksne, der fik en enkelt dosis på 40 mg (geometrisk gennemsnitlig AUC var 103 % højere hos præmature spædbørn og nyfødte, der fik en enkelt dosis på 2,5 mg af PROTONIX og 23 % højere hos spædbørn i alderen 1 til 11 måneder, der får en enkelt dosis på ca. 1,2 mg/kg). Hos disse patienter steg den tilsyneladende clearance (CL/F) med alderen (median clearance: 0,6 l/time, interval: 0,03 til 3,2 l/time).
Disse doser resulterede i farmakodynamiske virkninger på gastrisk, men ikke esophageal pH. Efter én gang daglig dosering af 2,5 mg PROTONIX 20 mg til præmature spædbørn og nyfødte var der en stigning i den gennemsnitlige gastriske pH (fra 4,3 ved baseline til 5,2 ved steady-state) og i den gennemsnitlige %-tid, hvor gastrisk pH var > 4 ( fra 60 % ved baseline til 80 % ved steady-state). Efter én gang daglig dosering på ca. 1,2 mg/kg PROTONIX 20 mg til spædbørn i alderen 1 til 11 måneder, var der en stigning i den gennemsnitlige gastriske pH (fra 3,1 ved baseline til 4,2 ved steady-state) og i den gennemsnitlige %-tid, som gastrisk pH var > 4 (fra 32 % ved baseline til 60 % ved steady-state). Der blev dog ikke observeret nogen signifikante ændringer i den gennemsnitlige intraesophageal pH eller % tid, hvor esophageal pH var
Da PROTONIX 20 mg ikke viste sig at være effektivt i den randomiserede, placebokontrollerede undersøgelse i denne aldersgruppe, er brugen af PROTONIX til behandling af symptomatisk GERD hos spædbørn under 1 år ikke indiceret.
Toksicitetsdata for dyr
I et præ- og postnatalt udviklingsstudie med rotter fik ungerne orale doser pantoprazol på 5, 15 og 30 mg/kg/dag (ca. 1, 2,3 og 3,2 gange eksponeringen (AUC) hos børn i alderen 6 til 11 år ved en dosis på 40 mg) på postnatal dag (PND 4) til og med PND 21, foruden laktationseksponering gennem mælk. På PND 21 blev der observeret nedsat gennemsnitlig lårbenslængde og vægt og ændringer i lårbensknoglemasse og -geometri hos afkommet ved 5 mg/kg/dag (ca. lige store eksponeringer (AUC) hos børn i alderen 6 til 11 år ved 40 mg dosis) og højere doser. Ændringer i knogleparametre var delvist reversible efter en restitutionsperiode.
Hos neonatale/juvenile dyr (rotter og hunde) svarede toksiciteten til dem, der blev observeret hos voksne dyr, inklusive gastriske ændringer, fald i massen af røde blodlegemer, stigninger i lipider, enzyminduktion og hepatocellulær hypertrofi. En øget forekomst af eosinofile hovedceller hos voksne og neonatale/juvenile rotter og atrofi af hovedceller hos voksne rotter og hos neonatale/juvenile hunde blev observeret i funduslimhinden i maven i undersøgelser med gentagne doser. Fuld til delvis genvinding af disse virkninger blev observeret hos dyr i begge aldersgrupper efter en restitutionsperiode.
Geriatrisk brug
I kortvarige amerikanske kliniske forsøg svarede EE-helingsraten hos de 107 ældre patienter (≥65 år) behandlet med PROTONIX til dem, der blev fundet hos patienter under 65 år. Hyppigheden af bivirkninger og laboratorieabnormiteter hos patienter i alderen 65 år og ældre lignede dem, der var forbundet med patienter yngre end 65 år.
OVERDOSIS
Erfaring med patienter, der tager meget høje doser af PROTONIX (større end 240 mg), er begrænset. Spontane post-marketing rapporter om overdosering er generelt inden for den kendte sikkerhedsprofil for PROTONIX.
Pantoprazol fjernes ikke ved hæmodialyse. I tilfælde af overdosering skal behandlingen være symptomatisk og støttende.
Enkelte orale doser af pantoprazol på 709 mg/kg, 798 mg/kg og 887 mg/kg var dødelige for henholdsvis mus, rotter og hunde. Symptomerne på akut toksicitet var hypoaktivitet, ataksi, bøjet siddende, lemmer-spredning, sidestilling, segregation, fravær af ørerefleks og tremor.
Hvis der opstår overeksponering for PROTONIX 20mg, skal du ringe til dit giftkontrolcenter på 1-800-222-1222 for at få aktuelle oplysninger om håndtering af forgiftning eller overdosering.
KONTRAINDIKATIONER
- PROTONIX er kontraindiceret til patienter med kendt overfølsomhed over for enhver komponent i formuleringen eller substitueret benzimidazol. Overfølsomhedsreaktioner kan omfatte anafylaksi, anafylaktisk shock, angioødem, bronkospasme, akut tubulointerstitiel nefritis og nældefeber [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ].
- Protonpumpehæmmere (PPI'er), inklusive PROTONIX, er kontraindiceret hos patienter, der får rilpivirinholdige produkter [se DRUGSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Pantoprazol er en PPI, der undertrykker det sidste trin i mavesyreproduktionen ved kovalent binding til (H+, K+)-ATPase-enzymsystemet ved den sekretoriske overflade af maveparietalcellen. Denne effekt fører til hæmning af både basal og stimuleret mavesyresekretion, uanset stimulus. Bindingen til (H+, K+)-ATPasen resulterer i en varighed af antisekretorisk effekt, der varer længere end 24 timer for alle testede doser (20 mg til 120 mg).
Farmakodynamik
PROTONIX 20 mg til oral suspension med forsinket frigivelse, 40 mg har vist sig at være sammenlignelig med PROTONIX tabletter med forsinket frigivelse ved undertrykkelse af pentagastrin-stimuleret MAO hos patienter (n = 49) med GERD og en historie med EE. I dette multicenter, farmakodynamiske crossover-studie, blev en 40 mg oral dosis af PROTONIX til oral suspension med forsinket frigivelse administreret i en teskefuld æblemos sammenlignet med en 40 mg oral dosis af PROTONIX tabletter med forsinket frigivelse efter administration af hver formulering én gang dagligt i 7 dage. Begge medikamenter blev indgivet tredive minutter før morgenmad. Pentagastrin-stimuleret (MAO) blev vurderet fra time 23 til 24 ved steady state.
Antisekretorisk aktivitet
Under maksimale syrestimulerende forhold ved anvendelse af pentagastrin forekommer et dosisafhængigt fald i mavesyreproduktionen efter en enkelt dosis oral (20-80 mg) eller en enkelt dosis af intravenøs (20-120 mg) pantoprazol hos raske forsøgspersoner. Pantoprazol givet én gang dagligt resulterer i øget hæmning af mavesyresekretion. Efter den indledende orale dosis på 40 mg pantoprazol opnåedes en gennemsnitlig hæmning på 51 % efter 2,5 timer. Ved dosering én gang dagligt i 7 dage blev den gennemsnitlige hæmning øget til 85 %. Pantoprazol undertrykte syresekretion på over 95 % hos halvdelen af forsøgspersonerne. Syresekretionen var vendt tilbage til normal inden for en uge efter den sidste dosis pantoprazol; der var ingen tegn på rebound hypersekretion.
en række dosis-respons undersøgelser forårsagede pantoprazol ved orale doser fra 20 til 120 mg dosisrelaterede stigninger i median basal gastrisk pH, og i procenten af tid gastrisk pH var >3 og >4. Behandling med 40 mg pantoprazol gav signifikant større stigninger i gastrisk pH end 20 mg dosis. Doser højere end 40 mg (60, 80, 120 mg) resulterede ikke i yderligere signifikante stigninger i median gastrisk pH. Effekterne af pantoprazol på median-pH fra en dobbeltblind crossover-undersøgelse er vist i tabel 5.
Serum Gastrin Effekter
Fastende gastrinniveauer i serum blev vurderet i to dobbeltblindede undersøgelser af akut heling af EE, hvor 682 patienter med gastroøsofageal reflukssygdom (GERD) fik 10, 20 eller 40 mg PROTONIX 20 mg i op til 8 uger. Efter 4 ugers behandling var der en stigning i de gennemsnitlige gastrinniveauer på 7 %, 35 % og 72 % i forhold til værdierne før behandling i henholdsvis 10, 20 og 40 mg behandlingsgrupperne. En lignende stigning i serumgastrinniveauer blev noteret ved det 8-ugers besøg med gennemsnitlige stigninger på 3 %, 26 % og 84 % for de tre pantoprazoldosisgrupper. Median serumgastrinniveauer forblev inden for normale grænser under vedligeholdelsesbehandling med PROTONIX-tabletter med forsinket frigivelse.
langtidsinternationale undersøgelser, der involverede over 800 patienter, blev der observeret en 2- til 3 gange gennemsnitlig stigning fra gastrinniveauet i fastende serum før behandling i de første måneder af behandling med pantoprazol ved doser på 40 mg dagligt under GERD-vedligeholdelsesundersøgelser og 40 mg eller højere om dagen hos patienter med refraktær GERD. Fastende serumgastrinniveauer forblev generelt på ca. 2 til 3 gange baseline i op til 4 års periodisk opfølgning i kliniske forsøg.
Efter kortvarig behandling med PROTONIX 20 mg vender forhøjede gastrinniveauer tilbage til det normale med mindst 3 måneder.
Enterochromaffin-lignende (ECL) celleeffekter
Hos 39 patienter behandlet med oral pantoprazol 40 mg til 240 mg dagligt (flertallet fik 40 mg til 80 mg) i op til 5 år, var der en moderat stigning i ECL-celletætheden, startende efter det første års brug, hvilket så ud til at plateau efter 4 år.
et ikke-klinisk studie med Sprague-Dawley-rotter resulterede livstidseksponering (24 måneder) for pantoprazol i doser på 0,5 til 200 mg/kg/dag i dosisrelaterede stigninger i gastrisk ECL-celleproliferation og gastriske neuroendokrine (NE)-celletumorer . Gastriske NE-celletumorer hos rotter kan skyldes kronisk stigning i serumgastrinkoncentrationer. Den høje tæthed af ECL-celler i rottemaven gør denne art meget modtagelig for de proliferative virkninger af forhøjede gastrinkoncentrationer produceret af PPI'er. Der blev dog ikke observeret stigninger i serumgastrin efter administration af pantoprazol i en dosis på 0,5 mg/kg/dag. I en separat undersøgelse blev en gastrisk NE-celletumor uden samtidige ECL-celle proliferative ændringer observeret hos 1 hunrotte efter 12 måneders dosering med pantoprazol på 5 mg/kg/dag og en 9 måneders off-dosis recovery [se Ikke-klinisk toksikologi ].
Endokrine virkninger
et klinisk farmakologisk studie havde PROTONIX 40 mg givet én gang dagligt i 2 uger ingen effekt på niveauet af følgende hormoner: kortisol, testosteron, triiodothyronin (T3), thyroxin (T4), thyreoidea-stimulerende hormon (TSH), thyronin- bindende protein, parathyroidhormon, insulin, glucagon, renin, aldosteron, follikelstimulerende hormon, luteiniserende hormon, prolaktin og væksthormon.
I et 1-årigt studie med GERD-patienter behandlet med PROTONIX 40 mg eller 20 mg, var der ingen ændringer fra baseline i overordnede niveauer af T3, T4 og TSH.
Farmakokinetik
PROTONIX 40 mg tabletter med forsinket frigivelse fremstilles som enterisk overtrukne tabletter, således at absorptionen af pantoprazol først begynder, efter at tabletten forlader maven. Maksimal serumkoncentration (Cmax) og areal under serumkoncentrationstidskurven (AUC) stiger proportionalt med orale og intravenøse doser fra 10 mg til 80 mg. Pantoprazol akkumuleres ikke, og dets farmakokinetik er uændret ved flere daglige doseringer. Efter oral eller intravenøs administration falder serumkoncentrationen af pantoprazol bieksponentielt med en terminal halveringstid på ca. en time.
Hos ekstensive metabolisatorer med normal leverfunktion, som får en oral dosis af den enterisk overtrukne 40 mg pantoprazol-tablet, er peak-koncentrationen (Cmax) 2,5 μg/ml; tiden til at nå topkoncentrationen (tmax) er 2,5 timer, og det gennemsnitlige samlede areal under kurven for plasmakoncentration versus tid (AUC) er 4,8 μg•t/mL (interval 1,4 til 13,3 μg•t/mL). Efter intravenøs administration af pantoprazol til omfattende metabolisatorer er dets totale clearance 7,6-14,0 l/time, og dets tilsyneladende distributionsvolumen er 11,0-23,6 l.
En enkelt oral dosis af PROTONIX til oral suspension med forsinket frigivelse, 40 mg, viste sig at være bioækvivalent, når den blev administreret til raske forsøgspersoner (N = 22) som granulat drysset over en teskefuld æblemos, som granulat blandet med æblejuice eller blandet med æblejuice efterfulgt af administration gennem en nasogastrisk sonde. De farmakokinetiske plasmaparametre fra et crossover-studie med raske forsøgspersoner er opsummeret i tabel 6.
Absorption
Efter administration af en enkelt eller flere orale 40 mg doser af PROTONIX 20 mg tabletter med forsinket frigivelse blev den maksimale plasmakoncentration af pantoprazol opnået på ca. 2,5 timer, og Cmax var 2,5 μg/ml. Pantoprazol gennemgår kun lidt first-pass metabolisme, hvilket resulterer i en absolut biotilgængelighed på ca. 77 %. Pantoprazols absorption påvirkes ikke af samtidig administration af antacida.
Administration af PROTONIX tabletter med forsinket frigivelse sammen med mad kan forsinke dets absorption op til 2 timer eller længere; Cmax og omfanget af pantoprazolabsorption (AUC) ændres dog ikke. Således kan PROTONIX 40 mg tabletter med forsinket frigivelse tages uden hensyntagen til tidspunktet for måltider.
Administration af pantoprazolgranulat, 40 mg, sammen med et fedtrigt måltid forsinket mediantiden til maksimal plasmakoncentration med 2 timer. Med et samtidig måltid med højt fedtindhold faldt Cmax og AUC for pantoprazolgranulat, 40 mg, drysset på æblemos med henholdsvis 51 % og 29 %. Derfor bør PROTONIX 20 mg til oral suspension med forsinket frigivelse tages cirka 30 minutter før et måltid.
Fordeling
Det tilsyneladende distributionsvolumen af pantoprazol er ca. 11 til 23,6 L, fordelt hovedsageligt i ekstracellulær væske. Serumproteinbindingen af pantoprazol er omkring 98 %, primært til albumin.
Elimination
Metabolisme
Pantoprazol metaboliseres i udstrakt grad i leveren gennem cytokrom P450 (CYP) systemet. Pantoprazols metabolisme er uafhængig af administrationsvejen (intravenøs eller oral). Den vigtigste metaboliske vej er demethylering ved hjælp af CYP2C19 med efterfølgende sulfatering; andre metaboliske veje omfatter oxidation med CYP3A4. Der er ingen tegn på, at nogen af pantoprazolmetabolitterne har signifikant farmakologisk aktivitet.
Udskillelse
Efter en enkelt oral eller intravenøs dosis af 14C-mærket pantoprazol til raske forsøgspersoner med normal metabolisme, blev ca. 71 % af dosis udskilt i urinen, med 18 % udskilt i fæces gennem galdeudskillelse. Der var ingen renal udskillelse af uændret pantoprazol.
Specifikke populationer
Geriatriske patienter
Kun let til moderat stigning i AUC (43%) og Cmax (26%) for pantoprazol blev fundet hos ældre forsøgspersoner (64 til 76 år) efter gentagen oral administration sammenlignet med yngre forsøgspersoner [se Brug i specifikke populationer ].
Pædiatriske patienter
Pantoprazols farmakokinetik blev undersøgt hos børn under 16 år i fire randomiserede, åbne kliniske forsøg med pædiatriske patienter med formodet/påvist GERD. En pædiatrisk granulatformulering blev undersøgt hos børn gennem 5 år, og PROTONIX 40 mg tabletter med forsinket frigivelse blev undersøgt hos børn over 5 år.
I en populations-PK-analyse steg den totale clearance med stigende kropsvægt på en ikke-lineær måde. Den totale clearance steg også kun med stigende alder hos børn under 3 år.
Nyfødt gennem 5 års alderen
[se Brug i specifikke populationer ]
Børn og unge i alderen 6 til 16 år
Farmakokinetikken af PROTONIX-tabletter med forsinket frigivelse blev evalueret hos børn i alderen 6 til 16 år med en klinisk diagnose af GERD. De farmakokinetiske parametre efter en enkelt oral dosis på 20 mg eller 40 mg PROTONIX 40 mg tabletter til børn i alderen 6 til 16 år var meget variable (%CV spænder fra 40 til 80%). Den geometriske middelværdi af AUC estimeret ud fra populationsfarmakatiske analyser efter en 40 mg PROTONIX 40 mg tablet til pædiatriske patienter var henholdsvis ca. 39 % og 10 % højere hos 6 til 11 og 12 til 16-årige børn sammenlignet med voksne (tabel 7). .
Mandlige og kvindelige patienter
Der er en beskeden stigning i pantoprazols AUC og Cmax hos kvinder sammenlignet med mænd. Vægtnormaliserede clearance-værdier er dog ens hos kvinder og mænd.
Hos pædiatriske patienter i alderen 1 til 16 år var der ingen klinisk relevante effekter af køn på clearance af pantoprazol, som vist ved populationsfarmakokinetisk analyse.
Patienter med nedsat nyrefunktion
Hos patienter med svært nedsat nyrefunktion svarede de farmakokinetiske parametre for pantoprazol til dem for raske forsøgspersoner.
Patienter med nedsat leverfunktion
Hos patienter med let til svær leverinsufficiens (Child-Pugh A til C cirrhose) steg maksimale pantoprazolkoncentrationer kun lidt (1,5 gange) i forhold til raske forsøgspersoner. Selvom serumhalveringstiden steg til 7-9 timer, og AUC-værdierne steg med 5 til 7 gange hos patienter med nedsat leverfunktion, var disse stigninger ikke større end dem, der blev observeret hos CYP2C19-fattige metabolisatorer, hvor ingen dosisjustering er berettiget. Disse farmakokinetiske ændringer hos patienter med nedsat leverfunktion resulterer i minimal lægemiddelakkumulering efter administration af flere doser én gang dagligt. Doser højere end 40 mg/dag er ikke blevet undersøgt hos patienter med nedsat leverfunktion.
Lægemiddelinteraktionsstudier
Virkning af andre lægemidler på pantoprazol
Pantoprazol metaboliseres hovedsageligt af CYP2C19 og i mindre omfang af CYP 3A4, 2D6 og 2C9. I in vivo lægemiddelinteraktionsstudier med CYP2C19-substrater (diazepam [også et CYP3A4-substrat] og phenytoin [også en CYP3A4-inducer] og clopidogrel), nifedipin, midazolam og clarithromycin (CYP3A4-substrater), substrat CYP2D6a, substratCYP2D6a), , naproxen og piroxicam (CYP2C9-substrater) og theophyllin (et CYP1A2-substrat) hos raske forsøgspersoner, var pantoprazols farmakokinetik ikke signifikant ændret.
Effekt af Pantoprazol på andre lægemidler
Clopidogrel
Clopidogrel metaboliseres til dets aktive metabolit delvist af CYP2C19. I et klinisk crossover-studie fik 66 raske forsøgspersoner clopidogrel (300 mg startdosis efterfulgt af 75 mg dagligt) alene og sammen med pantoprazol (80 mg på samme tid som clopidogrel) i 5 dage. På dag 5 var den gennemsnitlige AUC for den aktive metabolit af clopidogrel reduceret med ca. 14 % (geometrisk gennemsnitlig ratio var 86 %, med 90 % CI på 79 til 93 %), når pantoprazol blev administreret sammen med clopidogrel sammenlignet med clopidogrel administreret alene. Farmakodynamiske parametre blev også målt og viste, at ændringen i hæmning af trombocytaggregation (induceret af 5 μM ADP) var korreleret med ændringen i eksponeringen for den aktive clopidogrel-metabolit. Den kliniske betydning af dette fund er ikke klar.
Mycophenolatmofetil (MMF)
Administration af pantoprazol 40 mg to gange dagligt i 4 dage og en enkelt 1000 mg dosis af MMF cirka en time efter den sidste dosis pantoprazol til 12 raske forsøgspersoner i en cross-over undersøgelse resulterede i en 57 % reduktion i Cmax og 27 % reduktion i AUC for MPA. Transplantationspatienter, der fik ca. 2000 mg MMF pr. dag (n=12), blev sammenlignet med transplantationspatienter, der fik ca. den samme dosis MMF og pantoprazol 40 mg pr. dag (n=21). Der var en 78 % reduktion i Cmax og en 45 % reduktion i AUC for MPA hos patienter, der fik både pantoprazol og MMF [se DRUGSINTERAKTIONER ].
Andre stoffer
In vivo undersøgelser tyder også på, at pantoprazol ikke signifikant påvirker kinetikken af følgende lægemidler (cisaprid, theophyllin, diazepam [og dets aktive metabolit, desmethyldiazepam], phenytoin, metoprolol, nifedipin, carbamazepin, midazolam, clarithromycin, diclofenac, naproxen, og orale præventionsmidler [levonorgestrel/ethinylestradiol]). I andre in vivo undersøgelser havde digoxin, ethanol, glyburid, antipyrin, koffein, metronidazol og amoxicillin ingen klinisk relevante interaktioner med pantoprazol.
Selvom der ikke er observeret signifikante lægemiddelinteraktioner i kliniske undersøgelser, er potentialet for signifikante lægemiddelinteraktioner ved dosering mere end én gang dagligt med høje doser pantoprazol ikke blevet undersøgt hos dårlige metabolisatorer eller personer med nedsat leverfunktion.
Antacida
Der var heller ingen interaktion med samtidig administrerede antacida.
Farmakogenomi
CYP2C19 udviser en kendt genetisk polymorfi på grund af dens mangel i nogle underpopulationer (f.eks. er ca. 3% af kaukasiere og afroamerikanere og 17% til 23% af asiatere dårlige metabolisatorer). Selvom disse subpopulationer af pantoprazol-fattige metabolisatorer har eliminationshalveringstidsværdier på 3,5 til 10 timer hos voksne, har de stadig minimal akkumulering (23 % eller mindre) ved dosering én gang dagligt. For voksne patienter, som er CYP2C19-fattige metabolisatorer, er dosisjustering ikke nødvendig.
I lighed med voksne udviste pædiatriske patienter, som har den dårlige metaboliseringsgenotype af CYP2C19 (CYP2C19 *2/*2), mere end en 6-fold stigning i AUC sammenlignet med omfattende pædiatrisk (CYP2C19 *1/*1) og mellemliggende (CYP2C19 *1) /*x) metabolisatorer. Dårlige metabolisatorer udviste ca. 10 gange lavere tilsyneladende oral clearance sammenlignet med omfattende metabolisatorer.
For kendte pædiatriske metabolisatorer bør en dosisreduktion overvejes.
Kliniske Studier
PROTONIX 20 mg tabletter med forsinket frigivelse blev brugt i følgende kliniske forsøg.
Erosiv esophagitis (EE) associeret med gastroøsofageal reflukssygdom (GERD)
Voksne patienter
En amerikansk multicenter, dobbeltblind, placebokontrolleret undersøgelse af PROTONIX 10 mg, 20 mg eller 40 mg én gang dagligt blev udført i 603 patienter med reflukssymptomer og endoskopisk diagnosticeret EE af grad 2 eller derover (Hetzel-Dent-skalaen). I denne undersøgelse havde cirka 25 % af de tilmeldte patienter alvorlig EE af grad 3, og 10 % havde grad 4. Procentdelen af patienter, der blev helbredt (pr. protokol, n = 541) i denne undersøgelse er vist i tabel 8.
I denne undersøgelse havde alle PROTONIX-behandlingsgrupper signifikant højere helingshastigheder end placebogruppen. Dette var sandt uanset H. pylori-status for behandlingsgrupperne på 40 mg og 20 mg PROTONIX 40 mg. Dosis på 40 mg af PROTONIX 20 mg resulterede i helingshastigheder, der var signifikant højere end dem, der blev fundet med enten 20 mg eller 10 mg dosis.
En signifikant større del af patienterne, der tog PROTONIX 40 mg, oplevede fuldstændig lindring af halsbrand dag- og nattetid og fravær af opstød, fra den første behandlingsdag, sammenlignet med placebo. Patienter, der tog PROTONIX, indtog betydeligt færre antacida tabletter om dagen end dem, der fik placebo.
PROTONIX 40 mg og 20 mg én gang dagligt blev også sammenlignet med nizatidin 150 mg to gange dagligt i et amerikansk multicenter, dobbeltblindt studie af 243 patienter med reflukssymptomer og endoskopisk diagnosticeret EE af grad 2 eller derover. Procentdelen af helbredte patienter (pr. protokol, n = 212) er vist i tabel 9.
Behandling én gang dagligt med PROTONIX 40 mg eller 20 mg resulterede i signifikant bedre helingshastigheder efter både 4 og 8 uger sammenlignet med behandling to gange dagligt med 150 mg nizatidin. For 40 mg-behandlingsgruppen blev der opnået signifikant højere helingshastigheder sammenlignet med nizatidin uanset H. pylori-status.
En signifikant større andel af patienterne i PROTONIX-behandlingsgrupperne oplevede fuldstændig lindring af halsbrand om natten og opstød, startende på den første dag og af halsbrand i dagtimerne på den anden dag, sammenlignet med dem, der tog nizatidin 150 mg to gange dagligt. Patienter, der tog PROTONIX, indtog betydeligt færre antacida tabletter om dagen end dem, der tog nizatidin.
Pædiatriske patienter i alderen 5 år til 16 år
Effekten af PROTONIX til behandling af EE associeret med GERD hos pædiatriske patienter i alderen 5 år til 16 år er ekstrapoleret fra tilstrækkelige og velgennemførte undersøgelser hos voksne, da patofysiologien menes at være den samme. Fire pædiatriske patienter med endoskopisk diagnosticeret EE blev undersøgt i multicenter, randomiserede, dobbeltblindede, parallelle behandlingsforsøg. Børn med endoskopisk diagnosticeret EE (defineret som en endoskopisk Hetzel-Dent-score ≥2) blev behandlet én gang dagligt i 8 uger med et af to dosisniveauer af PROTONIX (20 mg eller 40 mg). Alle 4 patienter med EE blev helbredt (Hetzel-Dent-score på 0 eller 1) efter 8 uger.
Langsigtet vedligeholdelse af heling af erosiv øsofagitis
To uafhængige, multicenter, randomiserede, dobbeltblindede, komparatorkontrollerede undersøgelser af identisk design blev udført på voksne GERD-patienter med endoskopisk bekræftet helet EE for at demonstrere effektiviteten af PROTONIX til langsigtet vedligeholdelse af heling. De to amerikanske undersøgelser inkluderede henholdsvis 386 og 404 patienter til at modtage enten 10 mg, 20 mg eller 40 mg PROTONIX 40 mg tabletter med forsinket frigivelse én gang dagligt eller 150 mg ranitidin to gange dagligt. Som vist i tabel 10 var PROTONIX 40 mg og 20 mg signifikant bedre end ranitidin på hvert tidspunkt med hensyn til opretholdelse af heling. Derudover var PROTONIX 40 mg overlegen i forhold til alle andre undersøgte behandlinger.
PROTONIX 40 mg var overlegen i forhold til ranitidin med hensyn til at reducere antallet af halsbrandepisoder dag- og nattetid fra den første til og med den tolvte behandlingsmåned. PROTONIX 20 mg, indgivet én gang dagligt, var også effektivt til at reducere episoder med halsbrand i dag- og nattetimerne i et forsøg, som vist i tabel 11.
Patologiske hypersekretoriske tilstande, herunder Zollinger-Ellisons syndrom
et åbent multicenterforsøg med 35 patienter med patologiske hypersekretoriske tilstande, såsom Zollinger-Ellisons syndrom, med eller uden multipel endokrin neoplasi-type I, kontrollerede PROTONIX med succes mavesyresekretion. Doser fra 80 mg dagligt til 240 mg dagligt holdt mavesyreproduktionen under 10 mEq/time hos patienter uden forudgående syrereducerende kirurgi og under 5 mEq/time hos patienter med tidligere syrereducerende kirurgi.
Doserne blev initialt titreret til den individuelle patientbehov og justeret hos nogle patienter baseret på den kliniske respons med tiden [se DOSERING OG ADMINISTRATION ]. PROTONIX 40 mg blev godt tolereret ved disse dosisniveauer i længere perioder (mere end 2 år hos nogle patienter).
PATIENTOPLYSNINGER
PROTONIX (pro-TAH-nix)(pantoprazolnatrium) tabletter med forsinket frigivelse og PROTONIX (pro-TAH-nix) (pantoprazolnatrium) til oral suspension med forsinket frigivelse
Hvad er den vigtigste information, jeg bør vide om PROTONIX?
Du skal tage PROTONIX 20 mg nøjagtigt som foreskrevet, i den lavest mulige dosis og i den kortest mulige tid.
PROTONIX kan hjælpe på dine syrerelaterede symptomer, men du kan stadig have alvorlige maveproblemer. Tal med din læge.
PROTONIX kan forårsage alvorlige bivirkninger, herunder:
- En type nyreproblem (akut tubulointerstitiel nefritis). Nogle mennesker, der tager medicin med protonpumpehæmmere (PPI), inklusive PROTONIX 40 mg, kan udvikle et nyreproblem kaldet akut tubulointerstitiel nefritis, som kan opstå når som helst under behandlingen med PROTONIX. Ring til din læge med det samme, hvis du har et fald i mængden af vand, eller hvis du har blod i urinen.
- Diarré forårsaget af en infektion (Clostridium difficile) i dine tarme. Ring til din læge med det samme, hvis du har vandig afføring eller mavesmerter, der ikke går væk. Du har måske eller måske ikke feber.
- Knoglebrud (hofte, håndled eller rygsøjle). Knoglebrud i hoften, håndleddet eller rygsøjlen kan forekomme hos personer, der tager flere daglige doser af PPI-medicin og i en længere periode (et år eller længere). Fortæl din læge, hvis du har et knoglebrud, især i hoften, håndleddet eller rygsøjlen.
- Visse typer af lupus erythematosus. Lupus erythematosus er en autoimmun lidelse (kroppens immunceller angriber andre celler eller organer i kroppen). Nogle mennesker, der tager PPI-medicin, inklusive PROTONIX 40mg, kan udvikle visse typer af lupus erythematosus eller få en forværring af den lupus, de allerede har. Ring til din læge med det samme, hvis du har nye eller forværrede ledsmerter eller udslæt på dine kinder eller arme, der bliver værre i solen.
Tal med din læge om din risiko for disse alvorlige bivirkninger.
PROTONIX kan have andre alvorlige bivirkninger. Se "Hvad er de mulige bivirkninger af PROTONIX?"
Hvad er PROTONIX 20mg?
En receptpligtig medicin kaldet en protonpumpehæmmer (PPI), der bruges til at reducere mængden af syre i din mave.
Hos voksne, PROTONIX bruges til:
- op til 8 uger til heling og symptomlindring af syrerelateret skade på slimhinden i spiserøret (kaldet erosiv esophagitis eller EE). Din læge kan ordinere yderligere 8 uger med PROTONIX 20 mg til patienter, hvis EE ikke heler.
- opretholdelse af heling af EE og for at hjælpe med at forhindre tilbagevenden af halsbrandssymptomer forårsaget af GERD. Det vides ikke, om PROTONIX 40mg er sikkert og effektivt, når det bruges i mere end 12 måneder til dette formål.
- den langvarige behandling af tilstande, hvor din mave laver for meget syre. Dette omfatter en sjælden tilstand kaldet Zollinger-Ellison Syndrom.
Hos børn fra 5 år og ældre, PROTONIX bruges til:
- op til 8 uger til heling og symptomlindring af EE. Det vides ikke, om PROTONIX 20 mg er sikkert, hvis det bruges i mere end 8 uger til børn.
PROTONIX 20mg er ikke til brug hos børn under 5 år. Det vides ikke, om PROTONIX 40mg er sikkert og effektivt til børn til anden behandling end EE.
Tag ikke PROTONIX 20 mg, hvis du er:
- allergisk over for pantoprazolnatrium, enhver anden PPI-medicin eller et af indholdsstofferne i PROTONIX. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser.
- tager en medicin, der indeholder rilpivirin (EDURANT, COMPLERA, ODEFSEY, JULUCA), der bruges til at behandle HIV-1 (humant immundefektvirus).
Inden du tager PROTONIX, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du:
- har lave magnesiumniveauer i dit blod.
- er gravid eller planlægger at blive gravid. PROTONIX 40 mg kan skade dit ufødte barn. Fortæl det til din læge, hvis du bliver gravid eller tror, du kan være gravid under behandling med PROTONIX.
- ammer eller planlægger at amme. PROTONIX kan passere over i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager PROTONIX.
Fortæl din læge om al den medicin du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. Fortæl det især din læge, hvis du tager methotrexat (Otrexup, Rasuvo, Trexall, XATMEP), digoxin (LANOXIN) eller en vandpille (vanddrivende).
Hvordan skal jeg tage PROTONIX 20mg?
- Tag PROTONIX 40 mg nøjagtigt som foreskrevet af din læge.
PROTONIX tabletter med forsinket frigivelse (PROTONIX 20 mg tabletter):
-
- Du må ikke dele, tygge eller knuse PROTONIX 40 mg tabletter.
- Synk PROTONIX 20 mg tabletter hele, med eller uden mad.
- Fortæl det til din læge, hvis du ikke er i stand til at sluge din PROTONIX 20 mg tablet.
- Du kan bruge antacida, mens du tager PROTONIX 40 mg tabletter.
PROTONIX 40 mg til oral suspension med forsinket frigivelse (PROTONIX til oral suspension):
-
- Må ikke splittes, tygges eller knuses PROTONIX 20mg til oral suspension.
- Tag PROTONIX 40 mg til oral suspension ca. 30 minutter før et måltid.
- PROTONIX til oral suspension bør kun gives gennem munden blandet i æblejuice eller æblemos eller gennem et nasogastrisk (NG) sonde eller gastrostomirør blandet i æblejuice. Bland ikke PROTONIX til oral suspension i andre væsker end æblejuice eller andre fødevarer end æblemos.
- Del ikke en pakke PROTONIX 20 mg til oral suspension for at lave en mindre dosis.
- Se den "Brugsvejledning" i slutningen af denne medicinvejledning for instruktioner om, hvordan man blander og tager PROTONIX 40mg til oral suspension gennem munden i æblemos eller æblejuice, eller hvordan man blander og giver suspensionen gennem et NG-rør eller gastrostomirør blandet i æblejuice.
- Hvis du glemmer en dosis PROTONIX, skal du tage den så hurtigt som muligt. Hvis det næsten er tid til din næste dosis, må du ikke tage den glemte dosis. Tag den næste dosis på dit normale tidspunkt. Tag ikke 2 doser på samme tid.
- Hvis du tager for meget PROTONIX, skal du straks ringe til din læge eller dit giftkontrolcenter på 1-800-222-1222 eller gå til den nærmeste skadestue.
Hvad er de mulige bivirkninger af PROTONIX 40mg?
PROTONIX 20mg kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om PROTONIX?"
- Lavt vitamin B-12 niveau i din krop kan forekomme hos personer, der har taget PROTONIX 40 mg i lang tid (mere end 3 år). Fortæl din læge, hvis du har symptomer på lave vitamin B-12-niveauer, herunder åndenød, svimmelhed, uregelmæssig hjerterytme, muskelsvaghed, bleg hud, træthed, humørsvingninger og prikken eller følelsesløshed i arme og ben.
- Lavt magnesiumniveau i din krop kan forekomme hos personer, der har taget PROTONIX i mindst 3 måneder. Fortæl din læge, hvis du har symptomer på lave magnesiumniveauer, herunder kramper, svimmelhed, uregelmæssig hjerterytme, nervøsitet, muskelsmerter eller -svaghed og spasmer i hænder, fødder eller stemme.
- Mavevækster (fundiske kirtelpolypper). Personer, der tager PPI-medicin i lang tid, har en øget risiko for at udvikle en bestemt type mavevækst kaldet fundic gland polypper, især efter at have taget PPI-medicin i mere end 1 år.
De mest almindelige bivirkninger af PROTONIX 40 mg hos voksne omfatter: hovedpine, diarré, kvalme, smerter i maveområdet (mave), opkastning, gas, svimmelhed og ledsmerter.
De mest almindelige bivirkninger af PROTONIX 40 mg hos børn omfatter: øvre luftvejsinfektion, hovedpine, feber, diarré, opkastning, udslæt og smerter i maveområdet (mave). Disse er ikke alle de mulige bivirkninger af PROTONIX. Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare PROTONIX 40mg?
Opbevar PROTONIX 20mg ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
Opbevar PROTONIX og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af PROTONIX.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke PROTONIX til en tilstand, som det ikke er ordineret til. Giv ikke PROTONIX 20 mg til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem. Du kan spørge din læge eller apoteket om information om PROTONIX 20mg, der er skrevet til sundhedspersonale.
Hvad er ingredienserne i PROTONIX?
Aktiv ingrediens: pantoprazol natrium sesquihydrat
Inaktive ingredienser i PROTONIX tabletter med forsinket frigivelse: calciumstearat, crospovidon, hypromellose, jernoxid, mannitol, methacrylsyrecopolymer, polysorbat 80, povidon, propylenglycol, natriumcarbonat, natriumlaurylsulfat, titaniumdioxid og triethylcitrat.
Inaktive ingredienser i PROTONIX 40 mg til oral suspension med forsinket frigivelse: crospovidon, hypromellose, methacrylsyrecopolymer, mikrokrystallinsk cellulose, polysorbat 80, povidon, natriumcarbonat, natriumlaurylsulfat, talkum, titaniumdioxid, triethylcitrat og gult jernoxid.
Brugsanvisning
PROTONIX (pro-TAH-nix) (pantoprazolnatrium) til oral suspension med forsinket frigivelse
PROTONIX 40mg til forsinket frigivelse oral suspension (PROTONIX 40 mg til oral suspension):
Vigtig information:
- Må ikke splittes, tygges eller knuses PROTONIX til oral suspension.
- Tag PROTONIX til oral suspension ca. 30 minutter før et måltid.
- PROTONIX til oral suspension:
- skulle gerne kun tages med æblemos eller æblejuice.
- skulle gerne må ikke blandes i vand eller andre væsker eller andre fødevarer.
- pakken bør ikke deles for at lave en mindre dosis.
Indtagelse af PROTONIX 20 mg til oral suspension med æblemos:
Indtagelse af PROTONIX 40 mg til oral suspension med æblejuice:
Indgivelse af PROTONIX 40 mg til oral suspension gennem en nasogastrisk (NG) sonde eller gastrostomisonde:
- PROTONIX til oral suspension kan gives gennem et NG-rør eller gastrostomirør, dvs størrelse 16 fransk eller større. Giv ikke PROTONIX 20 mg til oral suspension gennem et NG-rør eller gastrostomirør, der er mindre end størrelse 16 French.
- Blande PROTONIX 20 mg til oral suspension kun i æblejuice når der gives gennem en NG-sonde eller gastrostomisonde.
Hvordan skal jeg opbevare PROTONIX 20mg?
Opbevar PROTONIX 20mg ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
Opbevar PROTONIX 40 mg og al medicin utilgængeligt for børn.
Denne medicinvejledning og brugsanvisning er godkendt af US Food and Drug Administration.
