Aciphex 10mg, 20mg Rabeprazole Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Aciphex 10mg, og hvordan bruges det?
Aciphex 10mg er en receptpligtig medicin, der bruges til at behandle symptomer på gastroøsofageal reflukssygdom (GERD), Helicobacter Pylori og tarmsår. Aciphex 10mg kan bruges alene eller sammen med anden medicin.
Aciphex er en protonpumpehæmmer.
Det vides ikke, om Aciphex 20mg tablet med forsinket frigivelse er sikker og effektiv til børn under 12 år. Det vides ikke, om Aciphex 10mg tablet med forsinket frigivelse (drys) er sikker og effektiv til børn under 1 år.
Hvad er de mulige bivirkninger af Aciphex 10mg?
Aciphex kan forårsage alvorlige bivirkninger, herunder:
- stærke mavesmerter,
- blodig diarré,
- pludselig smerte eller besvær med at bevæge hofte, håndled eller ryg,
- krampeanfald (kramper),
- vandladning mindre end normalt,
- blod i din urin,
- hævelse,
- hurtig vægtøgning,
- ledsmerter,
- hududslæt på dine kinder eller arme forværret af sollys,
- svimmelhed,
- hurtig eller uregelmæssig puls,
- rystende eller rykkende muskelbevægelser (skælven),
- føler sig nervøs,
- muskelkramper eller spasmer i dine hænder eller fødder,
- hoste,
- synkebesvær eller kvælning,
- hovedpine,
- svaghed,
- blå mærker,
- usædvanlig blødning (næseblod, tandkød),
- rød eller lyserød urin,
- kraftig menstruation,
- blodig eller tjæreagtig afføring,
- hoste blod eller opkast, der ligner kaffegrums,
- blødninger, der er svære at kontrollere,
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Aciphex omfatter:
- hovedpine,
- kvalme,
- opkastning,
- diarré,
- forstoppelse,
- mavesmerter,
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Aciphex. Spørg din læge eller apotek for mere information.
BESKRIVELSE
Den aktive ingrediens i ACIPHEX 20 mg tabletter med forsinket frigivelse er rabeprazolnatrium, som er en protonpumpehæmmer. Det er en substitueret benzimidazol kendt kemisk som 2-[[[4-(3methoxypropoxy)-3-methyl-2-pyridinyl]-methyl]sulfinyl]-1H-benzimidazol-natriumsalt. Den har en empirisk formel på C18H20N3NaO3S og en molekylvægt på 381,42. Rabeprazolnatrium er et hvidt til let gulligt-hvidt fast stof. Det er meget opløseligt i vand og methanol, frit opløseligt i ethanol, chloroform og ethylacetat og uopløseligt i ether og n-hexan. Stabiliteten af rabeprazolnatrium er en funktion af pH; det nedbrydes hurtigt i sure medier og er mere stabilt under alkaliske forhold. Den strukturelle figur er:
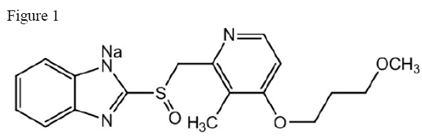
ACIPHEX er tilgængelig til oral administration som enterisk overtrukne tabletter med forsinket frigivelse indeholdende 20 mg rabeprazolnatrium.
Inaktive ingredienser i 20 mg tabletten er carnaubavoks, crospovidon, diacetylerede monoglycerider, ethylcellulose, hydroxypropylcellulose, hypromellosephthalat, magnesiumstearat, mannitol, propylenglycol, natriumhydroxid, natriumstearylfumarat, talkum og titaniumdioxid. Gul jernoxid er farvestoffet til tabletcoatingen. Jernoxidrød er blækpigmentet.
INDIKATIONER
Heling af erosiv eller ulcerativ GERD hos voksne
ACIPHEX 20 mg tabletter med forsinket frigivelse er indiceret til kortvarig (4 til 8 uger) behandling til heling og symptomatisk lindring af erosiv eller ulcerativ gastroøsofageal reflukssygdom (GERD). For de patienter, der ikke er helet efter 8 ugers behandling, kan en yderligere 8-ugers behandling med ACIPHEX overvejes.
Vedligeholdelse af heling af erosiv eller ulcerativ GERD hos voksne
ACIPHEX tabletter med forsinket frigivelse er indiceret til at opretholde heling og reduktion af tilbagefaldsraten af halsbrandsymptomer hos patienter med erosiv eller ulcerativ gastroøsofageal reflukssygdom (GERD Maintenance). Kontrollerede undersøgelser strækker sig ikke ud over 12 måneder.
Behandling af symptomatisk GERD hos voksne
ACIPHEX 20 mg tabletter med forsinket frigivelse er indiceret til behandling af dag- og nathalsbrand og andre symptomer forbundet med GERD hos voksne i op til 4 uger.
Heling af duodenalsår hos voksne
ACIPHEX 20 mg tabletter med forsinket frigivelse er indiceret til kortvarig (op til fire uger) behandling til heling og symptomatisk lindring af duodenalsår. De fleste patienter heler inden for fire uger.
Helicobacter Pylori udryddelse for at reducere risikoen for gentagelse af duodenalsår hos voksne
ACIPHEX 10 mg tabletter med forsinket frigivelse, i kombination med amoxicillin og clarithromycin som et regime med tre lægemidler, er indiceret til behandling af patienter med H. pylori-infektion og duodenal ulcus sygdom (aktiv eller historie inden for de seneste 5 år) for at udrydde H. pylori . Udryddelse af H. pylori har vist sig at reducere risikoen for tilbagefald af duodenalsår.
Hos patienter, der mislykkes i behandlingen, bør der udføres følsomhedstest. Hvis der påvises resistens over for clarithromycin, eller følsomhedstestning ikke er mulig, bør alternativ antimikrobiel behandling påbegyndes [se KLINISK FARMAKOLOGI og den fulde ordinationsinformation for clarithromycin].
Behandling af patologiske hypersekretoriske tilstande, herunder Zollinger-Ellison syndrom hos voksne
ACIPHEX tabletter med forsinket frigivelse er indiceret til langtidsbehandling af patologiske hypersekretoriske tilstande, herunder Zollinger-Ellisons syndrom.
Behandling af symptomatisk GERD hos unge patienter i alderen 12 år og ældre
ACIPHEX 20 mg tabletter med forsinket frigivelse er indiceret til behandling af symptomatisk GERD hos unge på 12 år og derover i op til 8 uger.
DOSERING OG ADMINISTRATION
Tabel 1 viser den anbefalede dosis af ACIPHEX tabletter med forsinket frigivelse til voksne og unge patienter på 12 år og ældre. Brugen af ACIPHEX tabletter med forsinket frigivelse anbefales ikke til brug til pædiatriske patienter i alderen 1 år til under 12 år, fordi den lavest tilgængelige tabletstyrke (20 mg) overstiger den anbefalede dosis til disse patienter. Brug en anden rabeprazol-formulering til pædiatriske patienter i alderen 1 år til under 12 år.
Administrationsinstruktioner
- Synk ACIPHEX 20 mg tabletter med forsinket frigivelse hele. Du må ikke tygge, knuse eller dele tabletter.
- Til behandling af duodenalsår skal du tage ACIPHEX tabletter med forsinket frigivelse efter et måltid.
- For at udrydde Helicobacter pylori skal du tage ACIPHEX 20 mg tabletter med forsinket frigivelse sammen med mad.
- For alle andre indikationer kan ACIPHEX tabletter med forsinket frigivelse tages med eller uden mad.
- Tag en glemt dosis så hurtigt som muligt. Hvis det næsten er tid til den næste dosis, skal du springe den glemte dosis over og gå tilbage til det normale skema. Tag ikke to doser på samme tid.
HVORDAN LEVERET
Doseringsformer og styrker
ACIPHEX 10 mg tabletter med forsinket frigivelse leveres i én styrke, 20 mg. Tabletterne er runde, lysegule, enterisk overtrukne, bikonvekse tabletter. "ACIPHEX 20" er præget med rødt på den ene side af tabletten.
Opbevaring og håndtering
ACIPHEX 20 mg leveres som lysegule enterisk overtrukne tabletter med forsinket frigivelse. Navnet og styrken, i mg, (ACIPHEX 20) er præget på den ene side.
Flasker med 30 stk. NDC 69784-243-30)
Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F) [se USP kontrolleret rumtemperatur ]. Beskyt mod fugt.
Distribueret af Eisai Inc., Woodcliff Lake, NJ 07677. Revideret: Mar 2022
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i mærkningen:
- Akut Tubulointerstitiel nefritis [se ADVARSLER OG FORHOLDSREGLER ]
- Clostridium difficile-associeret diarré [se ADVARSLER OG FORHOLDSREGLER ]
- Knoglebrud [se ADVARSLER OG FORHOLDSREGLER ]
- Alvorlige kutane bivirkninger [se ADVARSLER OG FORHOLDSREGLER ]
- Kutan og systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ]
- Cyanocobalamin (vitamin B-12) mangel [se ADVARSLER OG FORHOLDSREGLER ]
- Hypomagnesæmi og mineralmetabolisme [se ADVARSLER OG FORHOLDSREGLER ]
- Fundiske kirtelpolypper [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske studier
Fordi kliniske forsøg udføres under forskellige forhold, kan frekvenser af bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i praksis.
Voksne
Dataene beskrevet nedenfor afspejler eksponering for ACIPHEX tabletter med forsinket frigivelse hos 1064 voksne patienter eksponeret i op til 8 uger. Undersøgelserne var primært placebo- og aktivt kontrollerede forsøg med voksne patienter med erosiv eller ulcerativ gastroøsofageal reflukssygdom (GERD), duodenalsår og mavesår. Befolkningen havde en gennemsnitsalder på 53 år (interval 18-89 år) og havde et forhold på ca. 60 % mænd: 40 % kvinder. Racefordelingen var 86% kaukasiske, 8% afroamerikanske, 2% asiatiske og 5% andre. De fleste patienter fik enten 10 mg, 20 mg eller 40 mg dagligt af ACIPHEX 20 mg tabletter med forsinket frigivelse.
En analyse af bivirkninger, der optrådte hos ≥2 % af patienterne behandlet med ACIPHEX 10 mg tabletter med forsinket frigivelse (n=1064) og med en højere frekvens end placebo (n=89) i kontrollerede nordamerikanske og europæiske akutte behandlingsforsøg, afslørede følgende bivirkninger: smerter (3 % vs. 1 %), pharyngitis (3 % vs. 2 %), flatulens (3 % vs. 1 %), infektion (2 % vs. 1 %) og forstoppelse (2 % vs. 1 %).
Tre langsigtede vedligeholdelsesundersøgelser bestod af i alt 740 voksne patienter; mindst 54 % af voksne patienter blev eksponeret for ACIPHEX 20 mg tabletter med forsinket frigivelse i 6 måneder, og mindst 33 % blev eksponeret i 12 måneder. Af de 740 voksne patienter fik 247 (33 %) og 241 (33 %) patienter henholdsvis 10 mg og 20 mg ACIPHEX 20 mg tabletter med forsinket frigivelse, mens 169 (23 %) patienter fik placebo og 83 (11 %) omeprazol.
Sikkerhedsprofilen for rabeprazol i vedligeholdelsesundersøgelserne hos voksne var i overensstemmelse med det, der blev observeret i de akutte undersøgelser.
Mindre almindelige bivirkninger set i kontrollerede kliniske forsøg (
Kombinationsbehandling med amoxicillin og clarithromycin
I kliniske forsøg med kombinationsbehandling med rabeprazol plus amoxicillin og clarithromycin (RAC) blev der ikke observeret bivirkninger unikke for denne lægemiddelkombination. I det amerikanske multicenterstudie var de hyppigst rapporterede lægemiddelrelaterede bivirkninger for patienter, der fik RAC-behandling i 7 eller 10 dage, diarré (8 % og 7 %) og smagsforstyrrelser (henholdsvis 6 % og 10 %).
Der blev ikke observeret nogen klinisk signifikante laboratorieabnormiteter, der er specifikke for lægemiddelkombinationerne.
For mere information om bivirkninger eller laboratorieændringer med amoxicillin eller clarithromycin henvises til deres respektive ordinationsoplysninger, afsnittet Bivirkninger.
Pædiatri
et åbent multicenterstudie af unge patienter i alderen 12 til 16 år med en klinisk diagnose af symptomatisk GERD eller endoskopisk dokumenteret GERD, var bivirkningsprofilen den samme som hos voksne. De bivirkninger, der blev rapporteret uden hensyntagen til forholdet til ACIPHEX 20 mg tabletter med forsinket frigivelse, som forekom hos ≥2 % af 111 patienter, var hovedpine (9,9 %), diarré (4,5 %), kvalme (4,5 %), opkastning (3,6 %) og mavesmerter (3,6%). De relaterede rapporterede bivirkninger, der forekom hos ≥2 % af patienterne, var hovedpine (5,4 %) og kvalme (1,8 %). Der var ingen bivirkninger rapporteret i denne undersøgelse, som ikke tidligere er observeret hos voksne.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af rabeprazol efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering:
Blod og lymfesystem lidelser: agranulocytose, hæmolytisk anæmi, leukopeni, pancytopeni, trombocytopeni
Øre- og labyrintlidelser: svimmelhed
Øjenlidelser: sløret syn
Gastrointestinale lidelser: fundic kirtel polypper
Generelle lidelser og administrationsbetingelser: pludselig død
Lever og galdeveje: gulsot
Forstyrrelser i immunsystemet: anafylaksi, angioødem, systemisk lupus erythematosus, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse (nogle dødelig), DRESS, AGEP
Infektioner og angreb: Clostridium difficile-associeret diarré
Undersøgelser: Forøgelse af protrombintid/INR (hos patienter behandlet med samtidig warfarin), TSH-stigninger
Metabolisme og ernæringsforstyrrelser: hyperammonæmi, hypomagnesiæmi, hypocalcæmi, hypokaliæmi [advarsler og forholdsregler 5.8], hyponatriæmi
Sygdomme i bevægeapparatet: knoglebrud, rabdomyolyse
Forstyrrelser i nervesystemet: koma
Psykiatriske lidelser: delirium, desorientering
Nyre- og urinvejslidelser: interstitiel nefritis
Åndedræts-, thorax- og mediastinale lidelser: interstitiel lungebetændelse
Hud- og subkutane vævsforstyrrelser: alvorlige dermatologiske reaktioner, herunder bulløse og andre lægemiddeludbrud i huden, kutan lupus erythematosus, erythema multiforme
DRUGSINTERAKTIONER
Tabel 2 inkluderer lægemidler med klinisk vigtige lægemiddelinteraktioner og interaktion med diagnostik, når de administreres samtidig med ACIPHEX 10 mg tabletter med forsinket frigivelse og instruktioner til at forebygge eller håndtere dem.
Se mærkningen af samtidig anvendte lægemidler for at få yderligere oplysninger om interaktioner med PPI'er.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Tilstedeværelse af gastrisk malignitet
Hos voksne udelukker symptomatisk respons på behandling med ACIPHEX 10 mg ikke tilstedeværelsen af gastrisk malignitet. Overvej yderligere opfølgning og diagnostisk testning hos voksne patienter, som har et suboptimalt respons eller et tidligt symptomatisk tilbagefald efter endt behandling med en PPI.
Interaktion med Warfarin
Steady-state interaktioner mellem rabeprazol og warfarin er ikke blevet tilstrækkeligt evalueret hos patienter. Der har været rapporter om øget INR og protrombintid hos patienter, der fik en protonpumpehæmmer og warfarin samtidigt. Forøgelser i INR og protrombintid kan føre til unormal blødning og endda død. Patienter, der behandles med ACIPHEX 10 mg tabletter med forsinket frigivelse og warfarin samtidig, skal muligvis overvåges for stigninger i INR og protrombintid [se DRUGSINTERAKTIONER ].
Akut Tubulointerstitiel nefritis
Akut tubulointerstitiel nefritis (TIN) er blevet observeret hos patienter, der tager PPI'er og kan forekomme på ethvert tidspunkt under PPI-behandling. Patienter kan vise sig med varierende tegn og symptomer fra symptomatiske overfølsomhedsreaktioner til uspecifikke symptomer på nedsat nyrefunktion (f.eks. utilpashed, kvalme, anoreksi). I rapporterede tilfældeserier blev nogle patienter diagnosticeret på biopsi og i fravær af ekstrarenale manifestationer (f.eks. feber, udslæt eller artralgi).
Seponer ACIPHEX og evaluer patienter med mistanke om akut TIN [se KONTRAINDIKATION ].
Clostridium Difficile-associeret diarré
Publicerede observationsstudier tyder på, at PPI-behandling som ACIPHEX kan være forbundet med en øget risiko for Clostridium difficile-associeret diarré, især hos indlagte patienter. Denne diagnose bør overvejes for diarré, der ikke forbedres [se BIVIRKNINGER ].
Patienter bør anvende den laveste dosis og korteste varighed af PPI-behandling, der er passende til den tilstand, der behandles.
Clostridium difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler. For mere information, der er specifik for antibakterielle midler (clarithromycin og amoxicillin), der er indiceret til brug i kombination med ACIPHEX, henvises til afsnittet Advarsler og Forsigtighedsregler i den tilsvarende ordinationsinformation.
Knoglebrud
Adskillige publicerede observationsstudier hos voksne tyder på, at PPI-behandling kan være forbundet med en øget risiko for osteoporose-relaterede frakturer i hofte, håndled eller rygsøjle. Risikoen for fraktur var øget hos patienter, der fik høje doser, defineret som flere daglige doser, og langvarig PPI-behandling (et år eller længere). Patienter bør anvende den laveste dosis og korteste varighed af PPI-behandling, der er passende til den tilstand, der behandles. Patienter med risiko for osteoporose-relaterede frakturer bør behandles i henhold til etablerede behandlingsretningslinjer [se DOSERING OG ADMINISTRATION , BIVIRKNINGER ].
Alvorlige kutane bivirkninger
Alvorlige kutane bivirkninger, herunder Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) og akut generaliseret eksantematøs pustulose (AGEP) er blevet rapporteret i forbindelse med brugen af PPI'er [se BIVIRKNINGER ]. Seponer ACIPHEX ved første tegn eller symptomer på alvorlige kutane bivirkninger eller andre tegn på overfølsomhed og overvej yderligere evaluering.
Kutan og systemisk lupus erythematosus
Kutan lupus erythematosus (CLE) og systemisk lupus erythematosus (SLE) er blevet rapporteret hos patienter, der tager PPI'er, inklusive rabeprazol. Disse hændelser er opstået som både nyopstået og en forværring af eksisterende autoimmun sygdom. Størstedelen af PPI-inducerede lupus erythematosus tilfælde var CLE.
Den mest almindelige form for CLE rapporteret hos patienter behandlet med PPI'er var subakut CLE (SCLE) og forekom inden for uger til år efter kontinuerlig lægemiddelbehandling hos patienter lige fra spædbørn til ældre. Generelt blev histologiske fund observeret uden organinvolvering.
Systemisk lupus erythematosus (SLE) er mindre almindeligt rapporteret end CLE hos patienter, der får PPI'er. PPI-associeret SLE er normalt mildere end ikke-lægemiddelinduceret SLE. Indtræden af SLE forekom typisk inden for dage til år efter påbegyndelse af behandling, primært hos patienter lige fra unge voksne til ældre. Størstedelen af patienterne fik udslæt; dog blev der også rapporteret om artralgi og cytopeni.
Undgå administration af PPI'er i længere tid end medicinsk indiceret. Hvis der observeres tegn eller symptomer, der stemmer overens med CLE eller SLE hos patienter, der får ACIPHEX, skal du seponere lægemidlet og henvise patienten til den relevante specialist for evaluering. De fleste patienter forbedres ved seponering af PPI alene i 4 til 12 uger. Serologiske test (f.eks. ANA) kan være positive, og forhøjede serologiske testresultater kan tage længere tid at løse end kliniske manifestationer.
Cyanocobalamin (vitamin B-12) mangel
Daglig behandling med syrehæmmende medicin over en længere periode (f.eks. længere end 3 år) kan føre til malabsorption af cyanocobalamin (vitamin B-12) forårsaget af hypo- eller achlorhydri. Sjældne rapporter om cyanocobalaminmangel, der forekommer i forbindelse med syreundertrykkende behandling, er blevet rapporteret i litteraturen. Denne diagnose bør overvejes, hvis der observeres kliniske symptomer i overensstemmelse med cyanocobalaminmangel hos patienter behandlet med ACIPHEX.
Hypomagnesæmi og mineralmetabolisme
Hypomagnesæmi, symptomatisk og asymptomatisk, er sjældent blevet rapporteret hos patienter behandlet med PPI i mindst tre måneder, i de fleste tilfælde efter et års behandling. Alvorlige bivirkninger omfatter tetany, arytmier og anfald. Hypomagnesæmi kan føre til hypocalcæmi og/eller hypokaliæmi og kan forværre underliggende hypocalcæmi hos risikopatienter. Hos de fleste patienter krævede behandling af hypomagnesiæmi magnesiumerstatning og seponering af PPI.
For patienter, der forventes at være i langvarig behandling, eller som tager PPI'er sammen med medicin såsom digoxin eller lægemidler, der kan forårsage hypomagnesæmi (f.eks. diuretika), kan sundhedspersonale overveje at overvåge magnesiumniveauer før påbegyndelse af PPI-behandling og periodisk [se BIVIRKNINGER ].
Overvej at monitorere magnesium- og calciumniveauer før påbegyndelse af ACIPHEX og periodisk under behandling hos patienter med en allerede eksisterende risiko for hypocalcæmi (f.eks. hypoparathyroidisme). Suppler med magnesium og/eller calcium efter behov. Hvis hypocalcæmi er refraktær over for behandling, skal du overveje at seponere PPI.
Interaktion med methotrexat
Litteraturen tyder på, at samtidig brug af PPI'er med methotrexat (primært i høje doser; se methotrexat-receptinformation) kan forhøje og forlænge serumkoncentrationerne af methotrexat og/eller dets metabolit, hvilket muligvis kan føre til methotrexat-toksicitet. Ved højdosis methotrexatadministration kan en midlertidig seponering af PPI overvejes hos nogle patienter [se DRUGSINTERAKTIONER ].
Fundiske kirtelpolypper
PPI-brug er forbundet med en øget risiko for fundiske kirtelpolypper, der øges ved langvarig brug, især ud over et år. De fleste PPI-brugere, som udviklede fundiske kirtelpolypper, var asymptomatiske, og fundiske kirtelpolypper blev identificeret ved endoskopi. Brug den korteste varighed af PPI-behandling, der passer til den tilstand, der behandles.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning ).
Akut Tubulointerstitiel nefritis
Råd patienten eller plejepersonalet til straks at ringe til patientens sundhedsplejerske, hvis de oplever tegn og/eller symptomer forbundet med akut tubulointerstitiel nefritis [se ADVARSLER OG FORHOLDSREGLER ].
Clostridium Difficile-associeret diarré
Råd patienten eller plejepersonalet til straks at ringe til patientens sundhedsplejerske, hvis de oplever diarré, der ikke forbedres [se ADVARSLER OG FORHOLDSREGLER ].
Knoglebrud
Rådgiv patienten eller plejepersonalet om at rapportere eventuelle frakturer, især i hofte, håndled eller rygsøjle, til patientens sundhedsplejerske [se ADVARSLER OG FORHOLDSREGLER ].
Alvorlige kutane bivirkninger
Rådgiv patienten eller plejepersonalet om at seponere ACIPHEX 20mg og indberette alle tegn og symptomer på en alvorlig kutan bivirkning eller andre tegn på overfølsomhed til lægen [se ADVARSLER OG FORHOLDSREGLER ].
Kutan og systemisk lupus erythematosus
Rådgiv patienten eller plejepersonalet om straks at ringe til patientens sundhedsplejerske for nye eller forværrede symptomer forbundet med kutan eller systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ].
Cyanocobalamin (vitamin B-12) mangel
Rådgiv patienten eller plejepersonalet om at rapportere alle kliniske symptomer, der kan være forbundet med cyanocobalaminmangel, til patientens sundhedsplejerske, hvis de har fået ACIPHEX 20 mg i mere end 3 år [se ADVARSLER OG FORHOLDSREGLER ].
Hypomagnesæmi og mineralmetabolisme
Rådgiv patienten eller plejepersonalet om at rapportere alle kliniske symptomer, der kan være forbundet med hypomagnesiæmi, hypocalcæmi, hypokaliæmi og hyponatriæmi til patientens sundhedsplejerske, hvis de har fået ACIPHEX i mindst 3 måneder [se ADVARSLER OG FORHOLDSREGLER ].
Lægemiddelinteraktioner
Råd patienter til at rapportere til deres læge, hvis de tager rilpivirin-holdige produkter [se KONTRAINDIKATIONER ], warfarin, digoxin eller højdosis methotrexat [se ADVARSLER OG FORHOLDSREGLER ].
Administration
- Synk ACIPHEX 10 mg tabletter med forsinket frigivelse hele. Du må ikke tygge, knuse eller dele tabletterne.
- Til behandling af duodenalsår skal du tage ACIPHEX tabletter med forsinket frigivelse efter et måltid.
- For at udrydde Helicobacter pylori skal du tage ACIPHEX 20 mg tabletter med forsinket frigivelse sammen med mad.
- For alle andre indikationer kan ACIPHEX 10 mg tabletter med forsinket frigivelse tages med eller uden mad.
- Tag en glemt dosis så hurtigt som muligt. Hvis det næsten er tid til den næste dosis, skal du springe den glemte dosis over og gå tilbage til det normale skema. Tag ikke to doser på samme tid.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
et 88/104-ugers karcinogenicitetsstudie i CD-1-mus gav rabeprazol i orale doser op til 100 mg/kg/dag ingen øget tumorforekomst. Den højeste testede dosis gav en systemisk eksponering for rabeprazol (AUC) på 1,40 μg•time/mL, hvilket er 1,6 gange den humane eksponering (plasma AUC0-∞ = 0,88 μg•time/mL) ved den anbefalede dosis for GERD (20 mg/ dag). I et 28-ugers karcinogenicitetsstudie i p53+/-transgene mus forårsagede rabeprazol ved orale doser på 20, 60 og 200 mg/kg/dag ikke en stigning i forekomsten af tumorer, men forårsagede gastrisk slimhindehyperplasi ved alle doser. Den systemiske eksponering for rabeprazol ved 200 mg/kg/dag er omkring 17 til 24 gange den humane eksponering ved den anbefalede dosis for GERD. I et 104-ugers karcinogenicitetsstudie i Sprague-Dawley-rotter blev hanner behandlet med orale doser på 5, 15, 30 og 60 mg/kg/dag og hunner med 5, 15, 30, 60 og 120 mg/kg/dag. . Rabeprazol producerede gastrisk enterochromaffin-lignende (ECL) cellehyperplasi hos han- og hunrotter og ECL-celle carcinoide tumorer hos hunrotter ved alle doser inklusive den laveste testede dosis. Den laveste dosis (5 mg/kg/dag) gav en systemisk eksponering for rabeprazol (AUC) på ca. 0,1 μg•time/mL, hvilket er ca. 0,1 gange den humane eksponering ved den anbefalede dosis for GERD. Hos hanrotter blev der ikke observeret behandlingsrelaterede tumorer ved doser op til 60 mg/kg/dag, hvilket gav en rabeprazol plasmaeksponering (AUC) på ca. 0,2 μg•time/ml (0,2 gange den humane eksponering ved den anbefalede dosis for GERD).
Rabeprazol var positiv i Ames-testen, den kinesiske hamster-ovariecelle (CHO/HGPRT) fremadgående genmutationstest og muselymfomcelle (L5178Y/TK+/–) fremadgående genmutationstest. Dens demethylerede metabolit var også positiv i Ames-testen. Rabeprazol var negativ i in vitro-kromosomafvigelsestesten for kinesisk hamster-lungecelle, in vivo-mus mikronucleus-testen og in vivo- og ex vivo-rottehepatocyt-unscheduled DNA-syntese (UDS)-testene.
Rabeprazol ved intravenøse doser op til 30 mg/kg/dag (plasma-AUC på 8,8 μg•time/ml, ca. 10 gange den humane eksponering ved den anbefalede dosis for GERD) viste sig ikke at have nogen effekt på fertilitet og reproduktionsevne hos mænd og mænd. hunrotter.
Brug i specifikke populationer
Graviditet
Risikooversigt
Der er ingen tilgængelige humane data om brug af ACIPHEX 10 mg til gravide kvinder for at informere om den lægemiddelrelaterede risiko. Baggrundsrisikoen for alvorlige fødselsdefekter og abort for de angivne populationer er ukendt. Imidlertid er baggrundsrisikoen i den generelle befolkning i USA for alvorlige fødselsdefekter 2 til 4 % og for abort er 15 til 20 % af klinisk anerkendte graviditeter. Der blev ikke set nogen tegn på uønskede udviklingsmæssige virkninger i dyrereproduktionsundersøgelser med rabeprazol administreret under organogenese ved 13 og 8 gange det humane areal under plasmakoncentration-tid-kurven (AUC) ved den anbefalede dosis for GERD, i henholdsvis rotter og kaniner [se Data ].
Ændringer i knoglemorfologi blev observeret hos afkom fra rotter behandlet med orale doser af en anden PPI gennem det meste af graviditet og amning. Når moderens administration kun var begrænset til drægtighed, var der ingen virkninger på knoglefysisk morfologi hos afkommet på nogen alder [se Data ].
Data
Dyredata
Embryo-føtale udviklingsundersøgelser er blevet udført på rotter under organogenese ved intravenøse doser af rabeprazol op til 50 mg/kg/dag (plasma-AUC på 11,8 μg•time/ml, ca. 13 gange den humane eksponering ved den anbefalede orale dosis for GERD) og kaniner ved intravenøse doser op til 30 mg/kg/dag (plasma AUC på 7,3 μg•time/mL, ca. 8 gange den humane eksponering ved den anbefalede orale dosis for GERD) og har ikke afsløret tegn på skade på fosteret pga. rabeprazol.
Administration af rabeprazol til rotter i sen drægtighed og under diegivning med en oral dosis på 400 mg/kg/dag (ca. 195 gange den humane orale dosis baseret på mg/m²) resulterede i fald i ungernes vægtøgning.
En præ- og postnatal udviklingstoksicitetsundersøgelse i rotter med yderligere endepunkter til evaluering af knogleudvikling blev udført med en anden PPI ved ca. 3,4 til 57 gange en oral human dosis på basis af kropsoverfladeareal. Nedsat lårbenslængde, bredde og tykkelse af kortikal knogle, nedsat tykkelse af tibial vækstplade og minimal til mild knoglemarvshypocellularitet blev noteret ved doser af denne PPI lig med eller større end 3,4 gange en oral human dosis på basis af kropsoverfladeareal. . Fysisk dysplasi i lårbenet blev også observeret hos afkom efter in utero og laktationseksponering for PPI ved doser lig med eller større end 33,6 gange en oral human dosis på kropsoverfladebasis. Effekter på maternel knogler blev observeret hos drægtige og diegivende rotter i et præ- og postnatal toksicitetsstudie, når PPI blev administreret i orale doser på 3,4 til 57 gange en oral human dosis på basis af kropsoverfladeareal. Når rotter blev doseret fra svangerskabsdag 7 til fravænning på postnatal dag 21, blev der observeret et statistisk signifikant fald i moderens femurvægt på op til 14 % (sammenlignet med placebobehandling) ved doser lig med eller større end 33,6 gange en oral human dosis på kropsoverfladebasis.
En opfølgende udviklingstoksicitetsundersøgelse hos rotter med yderligere tidspunkter til at evaluere ungens knogleudvikling fra postnatal dag 2 til voksenalderen blev udført med en anden PPI ved orale doser på 280 mg/kg/dag (ca. 68 gange en oral human dosis på en kropsoverfladebasis), hvor lægemiddeladministration var fra enten svangerskabsdag 7 eller svangerskabsdag 16 indtil fødslen. Når moderadministration kun var begrænset til graviditet, var der ingen virkninger på knoglefysisk morfologi hos afkommet på nogen alder.
Amning
Risikooversigt
Amningsundersøgelser er ikke blevet udført for at vurdere tilstedeværelsen af rabeprazol i modermælk, virkningerne af rabeprazol på det ammede spædbarn eller virkningerne af rabeprazol på mælkeproduktionen. Rabeprazol findes i rottemælk. Udviklingen og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for ACIPHEX og eventuelle negative virkninger på det ammede spædbarn fra ACIPHEX eller fra den underliggende moderens tilstand.
Pædiatrisk brug
Sikkerheden og effektiviteten af ACIPHEX 20 mg tabletter med forsinket frigivelse er blevet fastslået hos pædiatriske patienter til unge patienter på 12 år og ældre til behandling af symptomatisk GERD. Brug af ACIPHEX 20 mg tabletter med forsinket frigivelse i denne aldersgruppe understøttes af tilstrækkelige og velkontrollerede undersøgelser hos voksne og et multicenter, randomiseret, åbent parallelgruppestudie med 111 unge patienter i alderen 12 til 16 år. Patienterne havde en klinisk diagnose af symptomatisk GERD eller mistænkt eller endoskopisk bevist GERD og blev randomiseret til enten 10 mg eller 20 mg én gang dagligt i op til 8 uger til evaluering af sikkerhed og effekt. Bivirkningsprofilen hos unge patienter var den samme som hos voksne. De relaterede rapporterede bivirkninger, der forekom hos ≥2 % af patienterne, var hovedpine (5 %) og kvalme (2 %). Der var ingen bivirkninger rapporteret i disse undersøgelser, som ikke tidligere er observeret hos voksne.
Sikkerheden og effektiviteten af ACIPHEX 10 mg tabletter med forsinket frigivelse er ikke blevet fastslået hos pædiatriske patienter til:
- Heling af erosiv eller ulcerativ GERD
- Vedligeholdelse af heling af erosiv eller ulcerativ GERD
- Behandling af symptomatisk GERD
- Heling af duodenalsår
- Helicobacter pylori udryddelse for at reducere risikoen for tilbagefald af duodenalsår
- Behandling af patologiske hypersekretoriske tilstande, herunder Zollinger-Ellisons syndrom
ACIPHEX 20 mg tabletter med forsinket frigivelse anbefales ikke til brug til pædiatriske patienter under 12 år, fordi tabletstyrken overstiger den anbefalede dosis til disse patienter [se DOSERING OG ADMINISTRATION ]. Overvej en anden rabeprazol-formulering til pædiatriske patienter i alderen 1 år til under 12 år. Sikkerheden og effektiviteten af en anden doseringsform og doseringsstyrke af rabeprazol er blevet fastslået hos pædiatriske patienter 1 til 11 år til behandling af GERD.
Data om unge dyr
Der blev udført undersøgelser af unge og unge voksne rotter og hunde. I undersøgelser med unge dyr blev rabeprazolnatrium administreret oralt til rotter i op til 5 uger og til hunde i op til 13 uger, hver påbegyndt på dag 7 efter fødslen og efterfulgt af en 13-ugers restitutionsperiode. Rotter blev doseret med 5, 25 eller 150 mg/kg/dag, og hunde blev doseret med 3, 10 eller 30 mg/kg/dag. Dataene fra disse undersøgelser var sammenlignelige med dem, der blev rapporteret for unge voksne dyr. Farmakologisk medierede ændringer, herunder øgede serumgastrinniveauer og maveforandringer, blev observeret ved alle dosisniveauer hos både rotter og hunde. Disse observationer var reversible over de 13 ugers restitutionsperioder. Selvom kropsvægt og/eller krone-rump-længder var minimalt reduceret under dosering, blev der ikke observeret nogen effekt på udviklingsparametrene hos hverken unge rotter eller hunde.
Når unge dyr blev behandlet i 28 dage med en anden PPI i doser lig med eller større end 34 gange den daglige orale humane dosis på basis af kropsoverfladeareal, blev den samlede vækst påvirket og behandlingsrelaterede fald i kropsvægt (ca. 14 %) og kropsvægtøgning, og fald i lårbensvægt og lårbenslængde blev observeret.
Geriatrisk brug
Af det samlede antal forsøgspersoner (n=2009) i kliniske undersøgelser af ACIPHEX 20 mg tabletter med forsinket frigivelse var 19 % 65 år og derover, mens 4 % var 75 år og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes.
Nedsat leverfunktion
Administration af ACIPHEX tabletter med forsinket frigivelse til patienter med let til moderat nedsat leverfunktion (henholdsvis Child-Pugh klasse A og B) resulterede i øget eksponering og nedsat elimination [se KLINISK FARMAKOLOGI ]. Dosisjustering er ikke nødvendig hos patienter med let til moderat nedsat leverfunktion. Der er ingen information om patienter med svært nedsat leverfunktion (Child-Pugh klasse C). Undgå brug af ACIPHEX tabletter med forsinket frigivelse til patienter med svært nedsat leverfunktion; men hvis behandling er nødvendig, skal du overvåge patienterne for bivirkninger [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ].
OVERDOSIS
Der er modtaget syv rapporter om utilsigtet overdosering med rabeprazol. Den maksimale rapporterede overdosis var 80 mg. Der var ingen kliniske tegn eller symptomer forbundet med nogen rapporteret overdosis. Patienter med Zollinger-Ellisons syndrom er blevet behandlet med op til 120 mg rabeprazol én gang dagligt. Der kendes ingen specifik modgift mod rabeprazol. Rabeprazol er udstrakt proteinbundet og er ikke let dialyserbart.
tilfælde af overdosering skal behandlingen være symptomatisk og støttende.
Hvis der opstår overeksponering, skal du ringe til dit giftkontrolcenter på 1-800-222-1222 for aktuelle oplysninger om håndtering af forgiftning eller overdosering.
KONTRAINDIKATIONER
- ACIPHEX 10mg er kontraindiceret til patienter med kendt overfølsomhed over for rabeprazol, substituerede benzimidazoler eller over for enhver komponent i formuleringen. Overfølsomhedsreaktioner kan omfatte anafylaksi, anafylaktisk shock, angioødem, bronkospasme, akut tubulointerstitiel nefritis og nældefeber [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ].
- PPI'er, inklusive ACIPHEX, er kontraindiceret med rilpivirinholdige produkter [se DRUGSINTERAKTIONER ].
- For information om kontraindikationer af antibakterielle midler (clarithromycin og amoxicillin) indiceret i kombination med ACIPHEX 20 mg tabletter med forsinket frigivelse, se afsnittet Kontraindikationer i deres indlægssedler.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Rabeprazol tilhører en klasse af antisekretoriske forbindelser (substituerede benzimidazol protonpumpehæmmere), som ikke udviser antikolinerge eller histamin H2-receptorantagonistegenskaber, men som undertrykker mavesyresekretion ved at hæmme den gastriske H+, K+ATPase på mavens sekretoriske overflade. parietal celle. Fordi dette enzym betragtes som syrepumpen (proton) i parietalcellen, er rabeprazol blevet karakteriseret som en gastrisk protonpumpehæmmer. Rabeprazol blokerer det sidste trin af mavesyresekretion.
I gastriske parietalceller protoneres rabeprazol, akkumuleres og omdannes til et aktivt sulfenamid. Ved undersøgelse in vitro aktiveres rabeprazol kemisk ved pH 1,2 med en halveringstid på 78 sekunder. Det hæmmer syretransport i mavevesikler hos svin med en halveringstid på 90 sekunder.
Farmakodynamik
Antisekretorisk aktivitet
Den antisekretoriske virkning begynder inden for en time efter oral administration af 20 mg ACIPHEX 20 mg tabletter med forsinket frigivelse. Den mediane hæmmende effekt af rabeprazol på 24 timers mavesyre er 88 % af maksimal efter den første dosis. En dosis på 20 mg ACIPHEX tabletter med forsinket frigivelse hæmmer basal- og pepton-måltidsstimuleret syresekretion versus placebo med henholdsvis 86 % og 95 % og øger procentdelen af en 24-timers periode, hvor den gastriske pH>3 fra 10 % til 65 % (se tabel nedenfor). Denne relativt forlængede farmakodynamiske virkning sammenlignet med den korte farmakokinetiske halveringstid (1 til 2 timer) afspejler den vedvarende inaktivering af H+, K+ATPasen.
Sammenlignet med placebo reducerede 10 mg, 20 mg og 40 mg ACIPHEX tabletter med forsinket frigivelse, administreret én gang dagligt i 7 dage, markant den intragastriske surhedsgrad med alle doser for hvert af fire måltidsrelaterede intervaller og den samlede 24-timers periode. I denne undersøgelse var der ingen statistisk signifikante forskelle mellem doser; dog var der et signifikant dosisrelateret fald i intragastrisk surhedsgrad. Rabeprazols evne til at forårsage et dosisrelateret fald i den gennemsnitlige intragastriske surhedsgrad er illustreret nedenfor.

Efter administration af 20 mg ACIPHEX 20 mg tabletter med forsinket frigivelse én gang dagligt i otte dage, var den gennemsnitlige procentdel af tid, hvor mave-pH større end 3 eller gastrisk pH-værdi over 4 efter en enkelt dosis (dag 1) og flere doser (dag 8) var signifikant større end placebo (se tabel nedenfor). Faldet i mavesyreindholdet og stigningen i mavens pH observeret med 20 mg ACIPHEX 10 mg tabletter med forsinket frigivelse administreret én gang dagligt i otte dage blev sammenlignet med de samme parametre for placebo, som illustreret nedenfor:
Virkninger på esophageal syre eksponering
Hos patienter med GERD og moderat til svær eksponering for esophageal syre reducerede en dosis på 20 mg og 40 mg dagligt af ACIPHEX 20 mg tabletter med forsinket frigivelse 24-timers esophageal syreeksponering. Efter syv dages behandling faldt den procentdel af tid, hvor esophageal pH var mindre end 4, fra baselines på 24,7 % for 20 mg og 23,7 % for 40 mg til henholdsvis 5,1 % og 2,0 %. Normalisering af 24-timers intraesophageal syreeksponering var korreleret til gastrisk pH større end 4 i mindst 35 % af 24-timersperioden; dette niveau blev opnået hos 90 % af forsøgspersonerne, der fik ACIPHEX 20 mg, og hos 100 % af forsøgspersonerne, der fik ACIPHEX 40 mg. Med ACIPHEX 20 mg og 40 mg dagligt blev signifikante effekter på gastrisk og esophageal pH noteret efter én dags behandling og mere udtalt efter syv dages behandling.
Virkninger på Serum Gastrin
Medianniveauet for fastende gastrin steg på en dosisrelateret måde hos patienter behandlet én gang dagligt med ACIPHEX 10 mg tabletter med forsinket frigivelse i op til otte uger for ulcerøs eller erosiv esophagitis og hos patienter behandlet i op til 52 uger for at forhindre tilbagefald af sygdommen. Gruppens medianværdier holdt sig inden for det normale område.
Hos en gruppe forsøgspersoner behandlet med 20 mg ACIPHEX tabletter med forsinket frigivelse i 4 uger blev der observeret en fordobling af den gennemsnitlige serumgastrinkoncentration. Ca. 35 % af disse behandlede forsøgspersoner udviklede serumgastrinkoncentrationer over den øvre normalgrænse.
Virkninger på Enterochromaffin-lignende (ECL) celler
Øget serumgastrin sekundært til antisekretoriske midler stimulerer proliferation af gastriske ECL-celler, som over tid kan resultere i ECL-cellehyperplasi hos rotter og mus og gastriske carcinoider hos rotter, især hos hunner [se Ikke-klinisk toksikologi ].
Hos over 400 patienter behandlet med ACIPHEX tabletter med forsinket frigivelse (10 eller 20 mg) én gang dagligt i op til et år, steg forekomsten af ECL-cellehyperplasi med tid og dosis, hvilket er i overensstemmelse med protonpumpehæmmerens farmakologiske virkning. Ingen patient udviklede de adenomatoide, dysplastiske eller neoplastiske ændringer af ECL-celler i maveslimhinden. Ingen patient udviklede de carcinoide tumorer observeret hos rotter.
Endokrine virkninger
Studier på mennesker i op til et år har ikke afsløret klinisk signifikante effekter på det endokrine system. Hos raske mandlige forsøgspersoner behandlet med ACIPHEX tabletter med forsinket frigivelse i 13 dage er der ikke påvist nogen klinisk relevante ændringer i følgende undersøgte endokrine parametre: 17 β-østradiol, thyroidstimulerende hormon, tri-iodothyronin, thyroxin, thyroxinbindende protein, parathyroid hormon, insulin, glucagon, renin, aldosteron, follikelstimulerende hormon, luteotrofisk hormon, prolaktin, somatotrofisk hormon, dehydroepiandrosteron, kortisolbindende globulin og urin-6β-hydroxycortisol, serumtestosteron og døgnkortisolprofil.
Andre effekter
Hos mennesker behandlet med ACIPHEX 10 mg tabletter med forsinket frigivelse i op til et år er der ikke observeret systemiske effekter på centralnerve-, lymfoid-, hæmatopoietiske, renale, lever-, kardiovaskulære eller respiratoriske systemer. Der er ingen tilgængelige data om langtidsbehandling med ACIPHEX 10 mg tabletter med forsinket frigivelse og øjeneffekter.
Farmakokinetik
Efter oral administration af 20 mg ACIPHEX 10 mg tabletter med forsinket frigivelse forekommer maksimale plasmakoncentrationer (Cmax) af rabeprazol over et interval på 2 til 5 timer (Tmax). Rabeprazols Cmax og AUC er lineære over et oralt dosisområde på 10 mg til 40 mg. Der er ingen nævneværdig akkumulering, når doser på 10 mg til 40 mg administreres hver 24. time; rabeprazols farmakokinetik ændres ikke ved gentagen dosering.
Absorption
Absolut biotilgængelighed for en 20 mg oral tablet af rabeprazol (sammenlignet med intravenøs administration) er ca. 52 %. Når ACIPHEX 10 mg tabletter med forsinket frigivelse indgives sammen med et måltid med højt fedtindhold, er Tmax variabel; hvilken samtidig fødeindtagelse kan forsinke absorptionen med op til 4 timer eller længere. Cmax og omfanget af rabeprazol-absorption (AUC) ændres dog ikke signifikant. ACIPHEX tabletter med forsinket frigivelse kan derfor tages uden hensyntagen til tidspunktet for måltider.
Fordeling
Rabeprazol er 96,3 % bundet til humane plasmaproteiner.
Elimination
Metabolisme
Rabeprazol metaboliseres i høj grad. En betydelig del af rabeprazol metaboliseres via systemisk ikke-enzymatisk reduktion til en thioetherforbindelse. Rabeprazol metaboliseres også til sulfon- og desmethylforbindelser via cytochrom P450 i leveren. Thioetheren og sulfonen er de primære metabolitter målt i humant plasma. Disse metabolitter blev ikke observeret at have signifikant antisekretorisk aktivitet. In vitro undersøgelser har vist, at rabeprazol metaboliseres i leveren primært af cytochromerne P450 3A (CYP3A) til en sulfonmetabolit og cytochrom P450 2C19 (CYP2C19) til desmethylrabeprazol. CYP2C19 udviser en kendt genetisk polymorfi på grund af dens mangel i nogle underpopulationer (f.eks. 3 til 5 % af kaukasiere og 17 til 20 % af asiater). Rabeprazol-metabolismen er langsom i disse underpopulationer, derfor omtales de som dårlige metabolisatorer af lægemidlet.
Udskillelse
Efter en enkelt 20 mg oral dosis af 14C-mærket rabeprazol blev ca. 90 % af lægemidlet elimineret i urinen, primært som thioethercarboxylsyre; dets glucuronid og mercapturinsyremetabolitter. Resten af dosis blev genfundet i fæces. Samlet genvinding af radioaktivitet var 99,8%. Der blev ikke fundet uændret rabeprazol i urinen eller afføringen.
Specifikke populationer
Geriatriske patienter
Hos 20 raske ældre forsøgspersoner, der fik 20 mg ACIPHEX tabletter med forsinket frigivelse én gang dagligt i syv dage, blev AUC-værdierne ca. fordoblet, og Cmax steg med 60 % sammenlignet med værdierne i en parallel yngre kontrolgruppe. Der var ingen tegn på lægemiddelakkumulering efter én gang daglig administration [se Brug i specifik population ].
Pædiatriske patienter
Rabeprazols farmakokinetik blev undersøgt hos 12 unge patienter med GERD i alderen 12 til 16 år i en multicenterundersøgelse. Patienterne fik 20 mg ACIPHEX tabletter med forsinket frigivelse én gang dagligt i fem eller syv dage. En ca. 40 % stigning i rabeprazoleksponeringen blev noteret efter 5 til 7 dages dosering sammenlignet med eksponeringen efter 1 dags dosering. Farmakokinetiske parametre hos unge patienter med GERD i alderen 12 til 16 år var inden for det interval, der blev observeret hos raske voksne forsøgspersoner.
Mandlige og kvindelige patienter og racemæssige eller etniske grupper
I analyser justeret for kropsmasse og højde viste rabeprazols farmakokinetik ingen klinisk signifikante forskelle mellem mandlige og kvindelige forsøgspersoner. I undersøgelser, der brugte forskellige formuleringer af rabeprazol, var AUC0-∞-værdier for raske japanske mænd ca. 50 til 60 % højere end værdier afledt af poolede data fra raske mænd i USA.
Patienter med nedsat nyrefunktion
Hos 10 patienter med stabil nyresygdom i slutstadiet, der kræver vedligeholdelseshæmodialyse (kreatininclearance ≤5 ml/min/1,73 m²), blev der ikke observeret nogen klinisk signifikante forskelle i farmakokinetikken af rabeprazol efter en enkelt 20 mg dosis af ACIPHEX 20 mg tabletter med forsinket frigivelse. sammenlignet med 10 raske forsøgspersoner.
Patienter med nedsat leverfunktion
I et enkeltdosisstudie med 10 patienter med let til moderat nedsat leverfunktion (henholdsvis Child-Pugh klasse A og B), som fik en enkelt dosis på 20 mg ACIPHEX 10 mg tabletter med forsinket frigivelse, blev AUC0-24 ca. fordoblet, elimineringen halveringstiden var 2 til 3 gange højere, og den samlede kropsclearance blev reduceret til mindre end det halve sammenlignet med værdierne hos raske mænd.
et flerdosisstudie med 12 patienter med let til moderat nedsat leverfunktion, der fik 20 mg ACIPHEX 10 mg tabletter med forsinket frigivelse én gang dagligt i otte dage, steg AUC0-∞- og Cmax-værdierne ca. 20 % sammenlignet med værdier hos raske alders- og kønsmatchede emner. Disse stigninger var ikke statistisk signifikante.
Der findes ingen information om rabeprazol-disposition hos patienter med svært nedsat leverfunktion (Child-Pugh klasse C) [se Brug i specifikke populationer ].
Lægemiddelinteraktionsstudier
Kombineret administration med antimikrobielle stoffer
Seksten raske forsøgspersoner, genotypet som omfattende metabolisatorer med hensyn til CYP2C19, fik 20 mg ACIPHEX tabletter med forsinket frigivelse, 1000 mg amoxicillin, 500 mg clarithromycin eller alle 3 lægemidler i et fire-vejs crossover-studie. Hver af de fire kure blev administreret to gange dagligt i 6 dage. AUC og Cmax for clarithromycin og amoxicillin var ikke forskellige efter kombineret administration sammenlignet med værdier efter enkelt administration. Imidlertid steg rabeprazols AUC og Cmax med henholdsvis 11 % og 34 % efter kombineret administration. AUC og Cmax for 14-hydroxyclarithromycin (aktiv metabolit af clarithromycin) steg også med henholdsvis 42 % og 46 %. Denne stigning i eksponeringen for rabeprazol og 14-hydroxyclarithromycin forventes ikke at give anledning til sikkerhedsproblemer.
Virkninger af andre lægemidler på Rabeprazol
Antacida
Samtidig administration af ACIPHEX 20 mg tabletter med forsinket frigivelse og antacida gav ingen klinisk relevante ændringer i plasmakoncentrationen af rabeprazol.
Virkninger af Rabeprazol på andre lægemidler
Undersøgelser med raske forsøgspersoner har vist, at rabeprazol ikke har klinisk signifikante interaktioner med andre lægemidler, der metaboliseres af CYP450-systemet, såsom theophyllin (CYP1A2) givet som enkelt orale doser, diazepam (CYP2C9 og CYP3A4) som en enkelt intravenøs dosis og phenytoin ( CYP2C9 og CYP2C19) givet som en enkelt intravenøs dosis (med supplerende oral dosering). Steady-state interaktioner mellem rabeprazol og andre lægemidler, der metaboliseres af dette enzymsystem, er ikke blevet undersøgt hos patienter.
Clopidogrel
Clopidogrel metaboliseres til dets aktive metabolit delvist af CYP2C19. En undersøgelse af raske forsøgspersoner, inklusive CYP2C19-ekstensive og mellemliggende metabolisatorer, der fik clopidogrel 75 mg én gang dagligt samtidig med placebo eller med 20 mg ACIPHEX 20 mg tabletter med forsinket frigivelse (n=36), i 7 dage, blev udført. Den gennemsnitlige AUC for den aktive metabolit af clopidogrel blev reduceret med ca. 12 % (gennemsnitlig AUC-ratio var 88 %, med 90 % CI på 81,7 til 95,5 %), når ACIPHEX tabletter med forsinket frigivelse blev administreret samtidigt sammenlignet med administration af clopidogrel og placebo [se DRUGSINTERAKTIONER ].
Digoxin
Hos raske voksne forsøgspersoner (n=16) resulterede samtidig administration af 20 mg rabeprazolnatrium-tabletter med forsinket frigivelse med 2,5 mg én gang daglige doser af digoxin ved steady state i ca. 29 % og 19 % stigning i gennemsnitlig Cmax og AUC(0- 24) af digoxin [se DRUGSINTERAKTIONER ].
Ketoconazol
Hos raske voksne forsøgspersoner (n=19) resulterede samtidig administration af 20 mg rabeprazolnatrium-tabletter med forsinket frigivelse ved steady state med en enkelt 400 mg oral dosis ketoconazol i cirka en gennemsnitlig reduktion på 31 % i både Cmax og AUC(0-). inf) af ketoconazol [se DRUGSINTERAKTIONER ].
Cyclosporin
In vitro-inkubationer med humane levermikrosomer indikerede, at rabeprazol hæmmede cyclosporinmetabolismen med en IC50 på 62 mikromolær, en koncentration, der er over 50 gange højere end Cmax hos raske frivillige efter 14 dages dosering med 20 mg ACIPHEX 10 mg forsinket tabletter. Denne grad af inhibering svarer til den af omeprazol i ækvivalente koncentrationer.
Mikrobiologi
Følgende in vitro-data er tilgængelige, men den kliniske betydning er ukendt.
Rabeprazolnatrium, amoxicillin og clarithromycin som et regime med tre lægemidler har vist sig at være aktive mod de fleste stammer af Helicobacter pylori in vitro og ved kliniske infektioner [se INDIKATIONER OG BRUG , Kliniske Studier ].
Helicobacter pylori
Følsomhedstest af H. pylori-isolater blev udført for amoxicillin og clarithromycin ved anvendelse af agarfortyndingsmetodologi1, og minimale hæmmende koncentrationer (MIC'er) blev bestemt.
Standardiserede følsomhedstestprocedurer kræver brug af laboratoriekontrolmikroorganismer til at kontrollere de tekniske aspekter af laboratorieprocedurerne.
Forekomst af antibiotika-resistente organismer blandt kliniske isolater
Forbehandlingsmodstand
Clarithromycin forbehandlingsresistensrate (MIC ≥1 mcg/ml) over for H. pylori var 9 % (51/560) ved baseline i alle behandlingsgrupper kombineret. Mere end 99 % (558/560) af patienterne havde H. pylori-isolater, som blev anset for at være modtagelige (MIC ≤0,25 mcg/ml) for amoxicillin ved baseline. To patienter havde baseline H. pylori-isolater med en amoxicillin MIC på 0,5 mcg/ml.
For information om følsomhedstest om Helicobacter pylori, se afsnittet Mikrobiologi i ordinationsinformation for clarithromycin og amoxicillin.
Patienter med vedvarende H. pylori-infektion efter behandling med rabeprazol, amoxicillin og clarithromycin vil sandsynligvis have clarithromycin-resistente kliniske isolater. Derfor bør clarithromycin-følsomhedstest udføres, når det er muligt. Hvis der påvises resistens over for clarithromycin, eller følsomhedstestning ikke er mulig, bør alternativ antimikrobiel behandling påbegyndes.
Amoxicillin-følsomhedstestresultater og kliniske/bakteriologiske resultater
det amerikanske multicenterstudie havde mere end 99 % (558/560) af patienterne H. pylori-isolater, som blev anset for at være modtagelige (MIC ≤0,25 mcg/ml) for amoxicillin ved baseline. De andre 2 patienter havde baseline H. pylori isolater med en amoxicillin MIC på 0,5 mcg/ml, og begge isolater var clarithromycin-resistente ved baseline; i et tilfælde blev H. pylori udryddet. I 7- og 10-dages behandlingsgrupperne blev henholdsvis 75 % (107/145) og 79 % (112/142) af de patienter, som havde amoxicillin-modtagelige MIC'er (≤0,25 mcg/ml), udryddet af H. pylori før behandling. . Ingen patienter udviklede amoxicillin-resistent H. pylori under behandlingen.
Farmakogenomi
et klinisk studie til evaluering af ACIPHEX-tabletter med forsinket frigivelse hos voksne japanske patienter, kategoriseret efter CYP2C19-genotype (n=6 pr. genotypekategori), var mavesyreundertrykkelsen højere hos dårlige metabolisatorer sammenlignet med omfattende metabolisatorer. Dette kan skyldes højere plasmaniveauer af rabeprazol hos dårlige metabolisatorer. Den kliniske relevans af dette er ikke kendt. Hvorvidt interaktioner mellem rabeprazolnatrium og andre lægemidler, der metaboliseres af CYP2C19, vil være forskellige mellem ekstensive metabolisatorer og dårlige metabolisatorer, er ikke blevet undersøgt.
Kliniske Studier
Heling af erosiv eller ulcerativ GERD hos voksne
en amerikansk, multicenter, randomiseret, dobbeltblind, placebokontrolleret undersøgelse blev 103 patienter behandlet i op til otte uger med placebo, 10 mg, 20 mg eller 40 mg ACIPHEX tabletter med forsinket frigivelse én gang dagligt. Til denne og alle undersøgelser af GERD-heling var kun patienter med GERD-symptomer og mindst grad 2 esophagitis (modificeret Hetzel-Dent-graderingsskala) berettigede til adgang. Endoskopisk heling blev defineret som grad 0 eller 1. Hver rabeprazoldosis var signifikant bedre end placebo med hensyn til at producere endoskopisk heling efter fire og otte ugers behandling. Procentdelen af patienter, der udviste endoskopisk heling, var som følger:
Derudover var der en statistisk signifikant forskel til fordel for ACIPHEX 10 mg, 20 mg og 40 mg doser sammenlignet med placebo i uge 4 og 8 med hensyn til fuldstændig opløsning af GERD halsbrandsfrekvens (p≤0,026). Alle ACIPHEX-grupper rapporterede signifikant højere grad af fuldstændig opløsning af GERD-halsbrandsgraden om dagen sammenlignet med placebo i uge 4 og 8 (p≤0,036). Gennemsnitlige reduktioner fra baseline i den daglige antacida dosis var statistisk signifikant for alle ACIPHEX-grupper sammenlignet med placebo i både uge 4 og 8 (p≤0,007).
I et nordamerikansk multicenter, randomiseret, dobbeltblindt, aktivt kontrolleret studie af 336 patienter, var procentdelen af patienter, der blev helbredt ved endoskopi efter fire og otte ugers behandling, statistisk overlegen hos patienterne behandlet med ACIPHEX tabletter med forsinket frigivelse sammenlignet med ranitidin. :
En dosis på 20 mg én gang dagligt af ACIPHEX tabletter med forsinket frigivelse var signifikant mere effektiv end ranitidin 150 mg fire gange dagligt i procentdelen af patienter med fuldstændig opløsning af halsbrand i uge 4 og 8 (p
Den anbefalede dosis af ACIPHEX 10 mg tabletter med forsinket frigivelse er 20 mg én gang dagligt i 4 til 8 uger.
Langsigtet vedligeholdelse af heling af erosiv eller ulcerativ GERD hos voksne
Den langsigtede opretholdelse af heling hos patienter med erosiv eller ulcerativ GERD, der tidligere var helet med gastrisk antisekretorisk behandling, blev vurderet i to amerikanske, multicenter, randomiserede, dobbeltblindede, placebokontrollerede undersøgelser af identisk design af 52 ugers varighed. De to undersøgelser randomiserede henholdsvis 209 og 285 patienter til at modtage enten 10 mg eller 20 mg ACIPHEX tabletter med forsinket frigivelse én gang dagligt eller placebo. Som vist i tabel 10 og 11 nedenfor var patienter behandlet med ACIPHEX tabletter med forsinket frigivelse signifikant bedre end placebo i begge undersøgelser med hensyn til opretholdelse af heling af GERD og andelen af patienter, der forblev fri for halsbrandsymptomer efter 52 uger. Den anbefalede dosis af ACIPHEX 20 mg tabletter med forsinket frigivelse er 20 mg én gang dagligt.
Behandling af symptomatisk GERD hos voksne
To amerikanske, multicenter, dobbeltblindede, placebokontrollerede undersøgelser blev udført med 316 voksne patienter med halsbrand dag- og nattetid. Patienterne rapporterede 5 eller flere perioder med moderat til meget alvorlig halsbrand under placebobehandlingsfasen ugen før randomisering. Patienterne blev bekræftet ved endoskopi, at de ikke havde nogen esophageal erosioner.
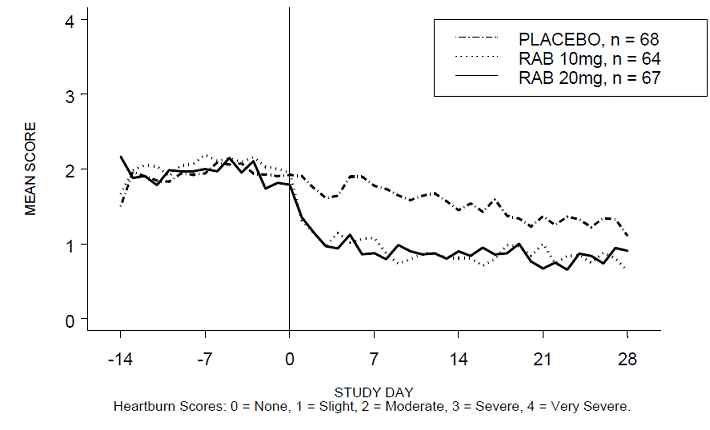
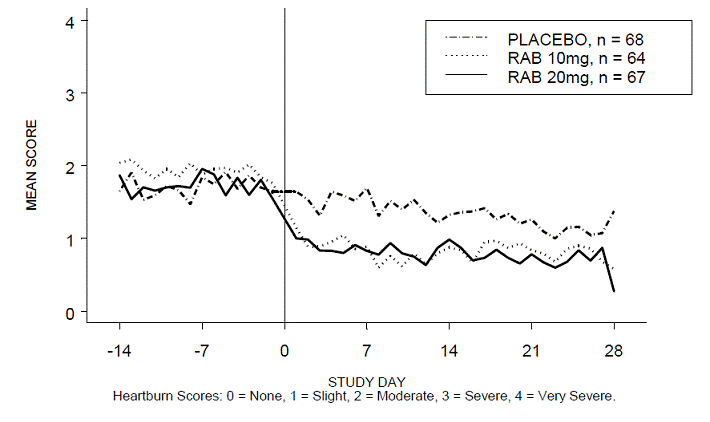
Procentdelen af halsbrandsfri dag- og/eller natperioder var større med 20 mg ACIPHEX 20 mg tabletter med forsinket frigivelse sammenlignet med placebo i løbet af de 4 ugers undersøgelse i undersøgelse RABUSA-2 (47 % vs. 23 %) og undersøgelse RAB-USA- 3 (52 % mod 28 %). Gennemsnitsfaldet fra baseline i gennemsnitsscore for halsbrand dag- og nattetid var signifikant større for ACIPHEX 20 mg sammenlignet med placebo i uge 4. Grafiske visninger, der afbilder de daglige gennemsnitsscorer for dag- og nattimerne, findes i figur 2 til 5.
Figur 2: Gennemsnitlig score for halsbrand i dagtimerne RAB-USA-2
Figur 3: Gennemsnitlig score for halsbrand om natten RAB-USA-2
Figur 4: Gennemsnitlig score for halsbrand i dagtimerne RAB-USA-3 Figur 3: Gennemsnitlig score for halsbrand i dagtimerne RAB - USA –3
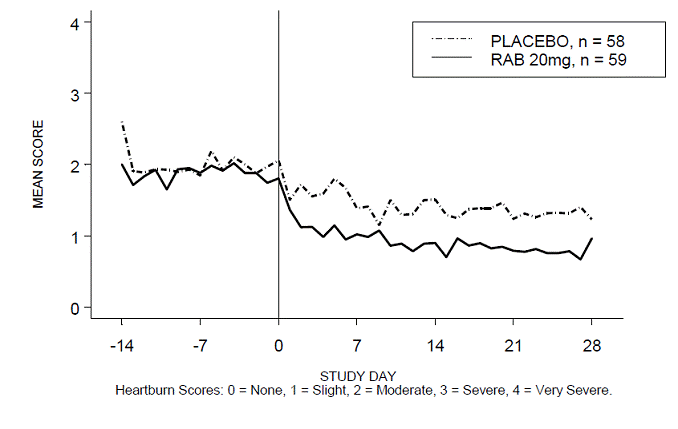
Figur 5: Gennemsnitlig score for halsbrand om natten RAB-USA-3
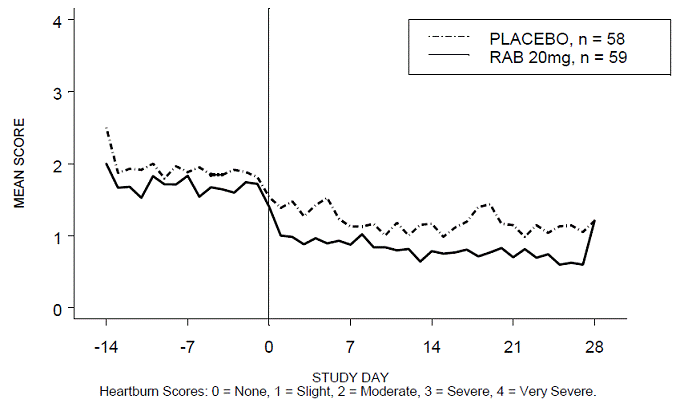
Derudover viste den kombinerede analyse af disse to undersøgelser, at 20 mg ACIPHEX 10 mg tabletter med forsinket frigivelse signifikant forbedrede andre GERD-associerede symptomer (regurgitation, bøvsen og tidlig mæthed) i uge 4 sammenlignet med placebo (alle p-værdier
En dosis på 20 mg ACIPHEX 20 mg tabletter med forsinket frigivelse reducerede også signifikant det daglige antacidaforbrug i forhold til placebo over 4 uger (p
Den anbefalede dosis af ACIPHEX tabletter med forsinket frigivelse er 20 mg én gang dagligt i 4 uger.
Heling af duodenalsår hos voksne
et amerikansk, randomiseret, dobbeltblindt multicenterstudie, der vurderede effektiviteten af 20 mg og 40 mg ACIPHEX 10 mg tabletter med forsinket frigivelse én gang dagligt versus placebo til heling af endoskopisk definerede duodenalsår, blev 100 patienter behandlet i op til fire uger. ACIPHEX var signifikant bedre end placebo med hensyn til at frembringe heling af duodenalsår. Procentdelen af patienter med endoskopisk heling er vist nedenfor:
uge 2 og 4 rapporterede signifikant flere patienter i ACIPHEX 20- og 40 mg-grupperne fuldstændig opløsning af ulcus smertefrekvens (p≤0,018), smertesværhed i dagtimerne (p≤0,023) og smertesværhed om natten (p≤0,035) sammenlignet med placebopatienter. Den eneste undtagelse var 40 mg-gruppen versus placebo i uge 2 for duodenal ulcus smertefrekvens (p=0,094). Signifikante forskelle i opløsning af smerter om dagen og om natten blev noteret i begge ACIPHEX-grupper i forhold til placebo ved udgangen af den første uge af undersøgelsen. Signifikante reduktioner i daglig brug af antacida blev også noteret i begge ACIPHEX-grupper sammenlignet med placebo i uge 2 og 4 (p
Et internationalt randomiseret, dobbeltblindt, aktivt kontrolleret forsøg blev udført med 205 patienter, der sammenlignede 20 mg ACIPHEX tabletter med forsinket frigivelse én gang dagligt med 20 mg omeprazol én gang dagligt. Undersøgelsen var designet til at give mindst 80 % kraft til at udelukke en forskel på mindst 10 % mellem ACIPHEX 10 mg og omeprazol, idet det antages fire ugers helingsresponsrater på 93 % for begge grupper. Hos patienter med endoskopisk definerede sår på tolvfingertarmen, der blev behandlet i op til fire uger, var ACIPHEX sammenlignelig med omeprazol med hensyn til at frembringe heling af sår på tolvfingertarmen. Procentdelen af patienter med endoskopisk heling efter to og fire uger er præsenteret nedenfor:
ACIPHEX 20 mg og omeprazol var sammenlignelige med hensyn til at give fuldstændig opløsning af symptomer.
Den anbefalede dosis af ACIPHEX 20 mg tabletter med forsinket frigivelse er 20 mg én gang dagligt i 4 uger.
Helicobacter pylori udryddelse hos patienter med mavesår eller symptomatisk ikke-ulcus sygdom hos voksne
Det amerikanske multicenterstudie var en dobbeltblind parallel-gruppe sammenligning af ACIPHEX tabletter med forsinket frigivelse, amoxicillin og clarithromycin i 3, 7 eller 10 dage i forhold til omeprazol, amoxicillin og clarithromycin i 10 dage. Behandlingen bestod af rabeprazol 20 mg to gange dagligt, amoxicillin 1000 mg to gange dagligt og clarithromycin 500 mg to gange dagligt (RAC) eller omeprazol 20 mg to gange dagligt, amoxicillin 1000 mg to gange dagligt og clarithromycin 500 mg to gange dagligt (OAC). Patienter med H. pylori-infektion blev stratificeret i forholdet 1:1 for dem med mavesår (aktive eller tidligere haft mavesår i de sidste fem år) [PUD] og dem, der var symptomatiske, men uden mavesår [NPUD], som bestemt ved øvre gastrointestinal endoskopi. De overordnede H. pylori-udryddelsesrater, defineret som negativ 13C-UBT for H. pylori ≥6 uger fra afslutningen af behandlingen, er vist i følgende tabel. Udryddelsesraterne i 7-dages og 10-dages RAC-regimerne blev fundet at svare til 10-dages OAC-regimer ved brug af enten Intent-to-Treat (ITT) eller Per-Protocol (PP) populationer. Udryddelsesrater i RAC 3-dages regimet var ringere end de andre regimer.
Den anbefalede dosis af ACIPHEX 20 mg tabletter med forsinket frigivelse er 20 mg to gange dagligt med amoxicillin og clarithromycin i 7 dage.
Patologiske hypersekretoriske tilstande, herunder Zollinger-Ellison syndrom hos voksne
Tolv patienter med idiopatisk gastrisk hypersekretion eller Zollinger-Ellisons syndrom er blevet behandlet med succes med ACIPHEX 10 mg tabletter med forsinket frigivelse i doser fra 20 til 120 mg i op til 12 måneder. ACIPHEX 10 mg gav tilfredsstillende hæmning af mavesyresekretion hos alle patienter og fuldstændig opløsning af tegn og symptomer på syre-peptisk sygdom, hvor de var til stede. ACIPHEX 20mg forhindrede også tilbagefald af gastrisk hypersekretion og manifestationer af syre-peptisk sygdom hos alle patienter. De høje doser af ACIPHEX, der blev brugt til at behandle denne lille gruppe af patienter med gastrisk hypersekretion, blev godt tolereret.
Den anbefalede startdosis af ACIPHEX tabletter med forsinket frigivelse er 60 mg én gang dagligt.
REFERENCER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder til fortynding Antimikrobielle følsomhedstests for bakterier, der vokser aerobt; Godkendt standard - tiende udgave. CLSI Document M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, USA 2015.
PATIENTOPLYSNINGER
ACIPHEX® (a-se-feks) (rabeprazolnatrium) tabletter med forsinket frigivelse
Hvad er den vigtigste information, jeg bør vide om ACIPHEX 10mg?
Du bør tage ACIPHEX 20 mg nøjagtigt som foreskrevet, i den lavest mulige dosis og i den kortest mulige tid.
ACIPHEX 20 mg kan hjælpe på dine syrerelaterede symptomer, men du kan stadig have alvorlige maveproblemer. Tal med din læge.
ACIPHEX 20mg kan forårsage alvorlige bivirkninger, herunder:
- En type nyreproblem (akut tubulointerstitiel nefritis). Nogle mennesker, der tager protonpumpehæmmere (PPI), inklusive ACIPHEX, kan udvikle et nyreproblem kaldet akut tubulointerstitiel nefritis, som kan opstå når som helst under behandlingen med ACIPHEX. Ring til din læge med det samme, hvis du har et fald i mængden af vand, eller hvis du har blod i urinen.
- Diarré forårsaget af en infektion (Clostridium difficile) i dine tarme. Ring til din læge med det samme, hvis du har vandig afføring eller mavesmerter, der ikke går væk. Du har måske eller måske ikke feber.
- Knoglebrud (hofte, håndled eller rygsøjle). Knoglebrud i hoften, håndleddet eller rygsøjlen kan forekomme hos personer, der tager flere daglige doser af PPI-medicin og i en længere periode (et år eller længere). Fortæl din læge, hvis du har et knoglebrud, især i hoften, håndleddet eller rygsøjlen.
- Visse typer af lupus erythematosus. Lupus erythematosus er en autoimmun lidelse (kroppens immunceller angriber andre celler eller organer i kroppen). Nogle mennesker, der tager PPI-medicin, herunder ACIPHEX, kan udvikle visse typer af lupus erythematosus eller få forværring af den lupus, de allerede har. Ring til din læge med det samme, hvis du har nye eller forværrede ledsmerter eller udslæt på dine kinder eller arme, der bliver værre i solen.
Tal med din læge om din risiko for disse alvorlige bivirkninger.
ACIPHEX 10mg kan have andre alvorlige bivirkninger. Se "Hvad er de mulige bivirkninger af ACIPHEX 10mg?"
Hvad er ACIPHEX 20mg?
ACIPHEX 10mg er et receptpligtigt lægemiddel kaldet en protonpumpehæmmer (PPI).
ACIPHEX 20mg reducerer mængden af syre i din mave.
Hos voksne, ACIPHEX bruges til:
- 8 uger op til 16 uger for at helbrede syrerelateret skade på slimhinden i spiserøret (kaldet erosiv esophagitis eller EE) og for at lindre symptomer, såsom halsbrandssmerter.
- opretholdelse af heling af spiserøret og lindring af symptomer relateret til EE. Det vides ikke, om ACIPHEX 20mg er sikkert og effektivt, hvis det bruges i mere end 12 måneder (1 år).
- op til 4 uger til at behandle halsbrand om dagen og om natten og andre symptomer, der opstår med gastroøsofageal reflukssygdom (GERD).
- op til 4 uger til heling og lindring af symptomer på duodenalsår.
- 7 dage med visse antibiotisk medicin til behandling af en infektion og mavesår (duodenale) forårsaget af bakterier kaldet H. pylori.
- den langvarige behandling af tilstande, hvor din mave laver for meget syre. Dette omfatter en sjælden tilstand kaldet Zollinger-Ellisons syndrom.
Hos unge 12 år og ældre, ACIPHEX 10mg bruges i op til 8 uger til at behandle symptomer på GERD.
Det vides ikke, om ACIPHEX er sikkert og effektivt til børn under 12 år til anden brug.
ACIPHEX tabletter med forsinket frigivelse bør ikke anvendes til børn under 12 år.
Tag ikke ACIPHEX 10 mg, hvis du er:
- allergisk over for rabeprazol, enhver anden PPI-medicin eller et af indholdsstofferne i ACIPHEX. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser.
- tager en medicin, der indeholder rilpivirin (EDURANT, COMPLERA, ODEFSEY), der bruges til at behandle HIV-1 (humant immundefektvirus).
Inden du tager ACIPHEX, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du:
- har lave magnesiumniveauer, lave calciumniveauer og lave kaliumniveauer i dit blod.
- har leverproblemer.
- er gravid eller planlægger at blive gravid. Det vides ikke, om ACIPHEX 20mg kan skade dit ufødte barn.
- ammer eller planlægger at amme. Det vides ikke, om ACIPHEX 10 mg udskilles i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager ACIPHEX.
Fortæl din læge om al den medicin du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. Sig det især til din læge hvis du tager et antibiotikum, der indeholder clarithromycin eller amoxicillin, eller hvis du tager warfarin (COUMADIN, JANTOVEN), methotrexat (OTREXUP, RASUVO, TREXALL, XATMEP), digoxin (LANOXIN) eller en vandpille (vanddrivende).
Hvordan skal jeg tage ACIPHEX?
- Tag ACIPHEX nøjagtigt som foreskrevet.
- ACIPHEX tages normalt 1 gang hver dag. Din læge vil fortælle dig, hvornår på dagen du skal tage ACIPHEX, baseret på din medicinske tilstand.
- ACIPHEX 10 mg kan tages med eller uden mad. Din læge vil fortælle dig, om du skal tage denne medicin med eller uden mad baseret på din medicinske tilstand.
- Synk hver ACIPHEX 20 mg tablet hel. Du må ikke tygge, knuse eller dele ACIPHEX 10 mg tabletter. Fortæl det til din læge, hvis du ikke kan sluge tabletter hele.
- Hvis du glemmer en dosis ACIPHEX 10 mg, skal du tage den så hurtigt som muligt. Hvis det næsten er tid til din næste dosis, bør du ikke tage den glemte dosis. Du bør tage din næste dosis på dit normale tidspunkt. Tag ikke 2 doser på samme tid.
- Hvis du tager for meget ACIPHEX 20mg, skal du straks ringe til din læge eller dit giftkontrolcenter på 1-800-222-1222, eller gå til den nærmeste skadestue.
- Hvis din læge ordinerer antibiotisk medicin sammen med ACIPHEX, skal du læse patientinformationen, der følger med den antibiotiske medicin, før du tager dem.
Hvad er de mulige bivirkninger af ACIPHEX 20mg?
ACIPHEX 10mg kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om ACIPHEX 20mg?"
- Interaktion med warfarin. At tage warfarin sammen med en PPI-medicin kan føre til en øget risiko for blødning og død. Hvis du tager warfarin, kan din læge tjekke dit blod for at se, om du har en øget risiko for blødning. Hvis du tager warfarin under behandling med ACIPHEX 20 mg, skal du straks fortælle det til din læge, hvis du har tegn eller symptomer på blødning, herunder:
- smerte, hævelse eller ubehag
- hovedpine, svimmelhed eller svaghed
- usædvanlige blå mærker (blå mærker, der opstår uden kendt årsag, eller som vokser i størrelse)
- næseblod
- blødende tandkød
- blødning fra sår tager lang tid at stoppe
- menstruationsblødninger, der er tungere end normalt
- lyserød eller brun urin
- rød eller sort afføring
- hoste blod op
- opkastning af blod eller opkast, der ligner kaffegrums
- Lavt vitamin B-12 niveau kroppen kan ske hos personer, der har taget ACIPHEX 10mg i lang tid (mere end 3 år). Fortæl din læge, hvis du har symptomer på lave vitamin B-12-niveauer, herunder åndenød, svimmelhed, uregelmæssig hjerterytme, muskelsvaghed, bleg hud, træthed, humørsvingninger og prikken eller følelsesløshed i arme og ben.
- Lavt magnesiumniveau i kroppen kan forekomme hos personer, der har taget ACIPHEX 20 mg i mindst 3 måneder. Fortæl din læge, hvis du har symptomer på lave magnesiumniveauer, herunder kramper, svimmelhed, uregelmæssig hjerterytme, nervøsitet, muskelsmerter eller -svaghed og spasmer i hænder, fødder eller stemme.
- Mavevækster (fundiske kirtelpolypper). Personer, der tager PPI-medicin i lang tid, har en øget risiko for at udvikle en bestemt type mavevækst kaldet fundic gland polypper, især efter at have taget PPI-medicin i mere end 1 år.
- Alvorlige hudreaktioner. ACIPHEX kan forårsage sjældne, men alvorlige hudreaktioner, som kan påvirke enhver del af din krop. Disse alvorlige hudreaktioner skal muligvis behandles på et hospital og kan være livstruende:
- Hududslæt, som kan have blærer, afskalning eller blødning på nogen del af din hud (inklusive dine læber, øjne, mund, næse, kønsorganer, hænder eller fødder).
- Du kan også have feber, kulderystelser, smerter i kroppen, åndenød eller forstørrede lymfeknuder.
Stop med at tage ACIPHEX 20 mg og ring til din læge med det samme. Disse symptomer kan være det første tegn på en alvorlig hudreaktion.
De mest almindelige bivirkninger af ACIPHEX 20mg hos voksne omfatter: smerter, ondt i halsen, gas, infektion og forstoppelse.
De mest almindelige bivirkninger af ACIPHEX hos unge på 12 år og ældre omfatter: hovedpine, diarré, kvalme, opkastning og smerter i maveområdet (mave).
Disse er ikke alle de mulige bivirkninger af ACIPHEX. Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare ACIPHEX?
Opbevar ACIPHEX tabletter på et tørt sted ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
Opbevar ACIPHEX 20mg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af ACIPHEX.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke ACIPHEX til en tilstand, som det ikke er ordineret til. Giv ikke ACIPHEX til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Du kan bede din læge eller apotek om oplysninger om ACIPHEX, som er skrevet til sundhedspersonale.
Hvad er ingredienserne i ACIPHEX 10mg?
Aktiv ingrediens: rabeprazolnatrium
Inaktive ingredienser: carnaubavoks, crospovidon, diacetylerede monoglycerider, ethylcellulose, hydroxypropylcellulose, hypromellosephthalat, magnesiumstearat, mannitol, natriumhydroxid, natriumstearylfumarat, talkum og titaniumdioxid. Gul jernoxid er farvestoffet til tabletcoatingen. Jernoxidrød er blækpigmentet.
Denne medicinvejledning er godkendt af US Food and Drug Administration. Revideret: 03/2022
