Pepcid 20mg, 40mg Famotidine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Pepcid, og hvordan bruges det?
Pepcid (famotidin) bruges til at behandle halsbrand, GERD og Zollinger-Ellisons syndrom. Den fås i håndkøb. Pepcid 20mg er tilgængelig som generisk.
Hvad er mulige bivirkninger ved at bruge Pepcid?
Bivirkninger er ualmindelige, men kan omfatte:
- træthed,
- opkastning,
- kvalme,
- ubehag i maven,
- anoreksi,
- tør mund,
- udslæt, og
- muskelkramper
BESKRIVELSE
Den aktive ingrediens i PEPCID® (famotidin) er en histamin H2-receptorantagonist. Famotidin er N'(aminosulfonyl)-3-[[[2-[(diaminomethylen)amino]-4-thiazolyl]methyl]thio]propanimidamid. Den empiriske formel for famotidin er C8H15N7O2S3 og dens molekylvægt er 337,43. Dens strukturformel er:
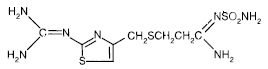
Famotidin er en hvid til bleggul krystallinsk forbindelse, der er frit opløselig i iseddikesyre, let opløselig i methanol, meget lidt opløselig i vand og praktisk talt uopløselig i ethanol.
Hver tablet til oral administration indeholder enten 20 mg eller 40 mg famotidin og følgende inaktive ingredienser: hydroxypropylcellulose, hypromellose, jernoxider, magnesiumstearat, mikrokrystallinsk cellulose, majsstivelse, talkum, titaniumdioxid og carnaubavoks.
INDIKATIONER
PEPCID 40mg er indiceret i:
DOSERING OG ADMINISTRATION
Duodenalsår
Akut terapi: Den anbefalede orale dosis til voksne for aktivt duodenalsår er 40 mg én gang dagligt ved sengetid. De fleste patienter heler inden for 4 uger; der er sjældent grund til at bruge PEPCID i fuld dosis i mere end 6 til 8 uger. Et regime på 20 mg to gange dagligt er også effektivt.
Vedligeholdelsesterapi: Den anbefalede orale dosis til voksne er 20 mg én gang dagligt ved sengetid.
Godartet mavesår
Akut terapi: Den anbefalede orale dosis til voksne for aktivt godartet mavesår er 40 mg én gang dagligt ved sengetid.
Gastroøsofageal reflukssygdom (GERD)
Den anbefalede orale dosis til behandling af voksne patienter med symptomer på GERD er 20 mg to gange dagligt i op til 6 uger. Den anbefalede orale dosis til behandling af voksne patienter med esophagitis inklusive erosioner og ulcerationer og ledsagende symptomer på grund af GERD er 20 eller 40 mg dagligt i op til 12 uger (se KLINISK FARMAKOLOGI hos voksne , Kliniske Studier ).
Dosering til pædiatriske patienter
Se FORHOLDSREGLER , Pædiatriske patienter
Studierne beskrevet i FORSIGTIGHEDSREGLER, pædiatriske patienter
Dosering til pædiatriske patienter i alderen 1-16 år
Se FORHOLDSREGLER , Pædiatriske patienter i alderen 1-16 år.
Studierne beskrevet i FORSIGTIGHEDSREGLER, pædiatriske patienter i alderen 1-16 år foreslår følgende startdoser til pædiatriske patienter i alderen 1-16 år:
Mavesår - 0,5 mg/kg/dag po ved sengetid eller delt bud op til 40 mg/dag.
Gastroøsofageal reflukssygdom med eller uden esophagitis inklusive erosioner og sårdannelser - 1,0 mg/kg/dag po delt bid op til 40 mg bid
Mens offentliggjorte ukontrollerede undersøgelser tyder på effektiviteten af famotidin i behandlingen af gastroøsofageal reflukssygdom og mavesår, er data fra pædiatriske patienter utilstrækkelige til at fastslå procentvis respons med dosis og varighed af behandlingen. Derfor bør behandlingsvarighed (initielt baseret på anbefalinger for varighed hos voksne) og dosis individualiseres baseret på klinisk respons og/eller pH-bestemmelse (mave eller spiserør) og endoskopi. Publicerede ukontrollerede kliniske undersøgelser hos pædiatriske patienter i alderen 1-16 år har anvendt doser op til 1 mg/kg/dag for mavesår og 2 mg/kg/dag for GERD med eller uden esophagitis inklusive erosioner og ulcerationer.
Patologiske hypersekretoriske tilstande (f.eks. Zollinger-Ellison syndrom, multiple endokrine adenomer)
Doseringen af PEPCID til patienter med patologiske hypersekretoriske tilstande varierer med den enkelte patient. Den anbefalede orale startdosis for voksne til patologiske hypersekretoriske tilstande er 20 mg q 6 timer. Hos nogle patienter kan en højere startdosis være nødvendig. Doser bør justeres til individuelle behov og bør fortsætte, så længe det er klinisk indiceret. Doser op til 160 mg q 6 timer er blevet administreret til nogle voksne patienter med svær Zollinger-Ellison syndrom.
Samtidig brug af antacida
Antacida kan gives samtidig, hvis det er nødvendigt.
Dosisjustering til patienter med moderat eller svær nyreinsufficiens
Hos voksne patienter med moderat (kreatininclearance
Baseret på sammenligningen af farmakokinetiske parametre for PEPCID hos voksne og pædiatriske patienter, bør dosisjustering hos pædiatriske patienter med moderat eller svær nyreinsufficiens overvejes.
HVORDAN LEVERET
PEPCID 40mg tabletter 20 mg, er beigefarvede, afrundede firkantede, filmovertrukne tabletter kodet MSD på den ene side og almindelige på den anden side. De leveres som følger:
NDC 42998-639-09 flasker med 30 stk NDC 42998-639-98 flasker med 100 brugsenheder.
PEPCID 40 mg tabletter, 40 mg, er gyldenbrune, afrundede firkantede, filmovertrukne tabletter kodet MSD på den ene side og almindelige på den anden side. De leveres som følger:
NDC 42998-649-09 flasker med 30 stk NDC 42998-649-98 brugsenhed flasker á 100. Opbevaring
Opbevares ved kontrolleret stuetemperatur.
PEPCID® (famotidin) tabletter 20 mg og tabletter 40 mg er fremstillet til: Marathon Pharmaceuticals, LLC, Northbrook, IL 60062, USA. Udgivet februar 2014.
BIVIRKNINGER
De bivirkninger, der er anført nedenfor, er blevet rapporteret under nationale og internationale kliniske forsøg med ca. 2500 patienter. I de kontrollerede kliniske forsøg, hvor PEPCID 40 mg tabletter blev sammenlignet med placebo, var forekomsten af bivirkninger i gruppen, som fik PEPCID tabletter, 40 mg ved sengetid, den samme som i placebogruppen.
Følgende bivirkninger er blevet rapporteret at forekomme hos mere end 1 % af patienterne i behandling med PEPCID i kontrollerede kliniske forsøg og kan være årsagsrelaterede til lægemidlet: hovedpine (4,7 %), svimmelhed (1,3 %), forstoppelse (1,2 % ) og diarré (1,7%).
Følgende andre bivirkninger er sjældent blevet rapporteret i kliniske forsøg eller siden lægemidlet blev markedsført. Forholdet til behandling med PEPCID 20mg har i mange tilfælde været uklart. Inden for hver kategori er bivirkningerne listet i rækkefølge efter faldende sværhedsgrad:
Kroppen som helhed: feber, asteni, træthed
Kardiovaskulær: arytmi, AV-blok, hjertebanken. Forlænget QT-interval hos patienter med nedsat nyrefunktion er meget sjældent blevet rapporteret.
Gastrointestinale: kolestatisk gulsot, hepatitis, leverenzym abnormiteter, opkastning, kvalme, abdominal ubehag, anoreksi, mundtørhed
Hæmatologisk: sjældne tilfælde af agranulocytose, pancytopeni, leukopeni, trombocytopeni
Overfølsomhed: anafylaksi, angioødem, orbital- eller ansigtsødem, nældefeber, udslæt, konjunktival injektion
Muskuloskeletale: rabdomyolyse, muskuloskeletale smerter inklusive muskelkramper, artralgi
Nervesystem/psykiatrisk: grand mal anfald; psykiske forstyrrelser, som var reversible i tilfælde, hvor der blev opnået opfølgning, herunder hallucinationer, forvirring, agitation, depression, angst, nedsat libido; paræstesi; søvnløshed; somnolens. Kramper hos patienter med nedsat nyrefunktion er meget sjældent blevet rapporteret.
Åndedræt: bronkospasme, interstitiel lungebetændelse
Hud: toksisk epidermal nekrolyse/Stevens-Johnsons syndrom (meget sjældent), alopeci, acne, kløe, tør hud, rødmen
Særlige sanser: tinnitus, smagsforstyrrelse
Andet: sjældne tilfælde af impotens og sjældne tilfælde af gynækomasti er blevet rapporteret; I kontrollerede kliniske forsøg var forekomsterne dog ikke større end dem, der blev set med placebo.
De rapporterede bivirkninger for PEPCID-tabletter kan også forekomme med PEPCID 20 mg til oral suspension.
Pædiatriske patienter
I et klinisk studie med 35 pædiatriske patienter
DRUGSINTERAKTIONER
Ingen lægemiddelinteraktioner er blevet identificeret. Studier med famotidin hos mennesker, i dyremodeller og in vitro har ikke vist nogen signifikant interferens med dispositionen af forbindelser metaboliseret af de hepatiske mikrosomale enzymer, f.eks. cytochrom P450-systemet. Forbindelser testet hos mennesker omfatter warfarin, theophyllin, phenytoin, diazepam, aminopyrin og antipyrin. Indocyaningrøn som et indeks for levermedicinsekstraktion er blevet testet, og der er ikke fundet signifikante effekter.
ADVARSLER
Ingen oplysninger angivet
FORHOLDSREGLER
Generel
Symptomatisk respons på behandling med PEPCID udelukker ikke tilstedeværelsen af gastrisk malignitet.
Patienter med moderat eller svær nyreinsufficiens
Da CNS-bivirkninger er blevet rapporteret hos patienter med moderat og svær nyreinsufficiens, kan det være nødvendigt at bruge længere intervaller mellem doser eller lavere doser hos patienter med moderat (kreatininclearance KLINISK FARMAKOLOGI hos voksne og DOSERING OG ADMINISTRATION ). Forlænget QT-interval er meget sjældent blevet rapporteret hos patienter med nedsat nyrefunktion, hvis dosis/doseringsinterval af famotidin muligvis ikke er blevet justeret korrekt.
Karcinogenese, mutagenese, svækkelse af fertilitet
I et 106-ugers studie med rotter og et 92-ugers studie med mus, der fik orale doser på op til 2000 mg/kg/dag (ca. 2500 gange den anbefalede humane dosis for aktivt duodenalsår), var der ingen tegn på kræftfremkaldende potentiale for PEPCID.
Famotidin var negativ i den mikrobielle mutagentest (Ames-test) under anvendelse af Salmonella typhimurium og Escherichia coli med eller uden rotteleverenzymaktivering ved koncentrationer op til 10.000 mcg/plade. I in vivo undersøgelser med mus, med en mikronukleustest og en kromosomafvigelsestest, blev der ikke observeret tegn på en mutagen effekt.
I studier med rotter, der fik orale doser på op til 2000 mg/kg/dag eller intravenøse doser på op til 200 mg/kg/dag, blev fertilitet og reproduktionsevne ikke påvirket.

Graviditet
Graviditetskategori B
Reproduktionsundersøgelser er blevet udført på rotter og kaniner ved orale doser på henholdsvis op til 2000 og 500 mg/kg/dag og i begge arter ved IV doser på op til 200 mg/kg/dag, og har ikke afsløret nogen signifikant evidens for nedsat fertilitet eller skade på fosteret på grund af PEPCID. Selvom der ikke er observeret nogen direkte føtotoksiske virkninger, sås sporadiske aborter, der kun forekommer hos mødre med markant nedsat fødeindtagelse, hos nogle kaniner ved orale doser på 200 mg/kg/dag (250 gange den sædvanlige humane dosis) eller højere. Der er dog ingen tilstrækkelige eller velkontrollerede undersøgelser af gravide kvinder. Da reproduktionsstudier hos dyr ikke altid forudsiger human respons, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Ammende mødre
Undersøgelser udført på diegivende rotter har vist, at famotidin udskilles i modermælken. Forbigående vækstdepression blev observeret hos unge rotter, der dieede fra mødre behandlet med maternotoksiske doser på mindst 600 gange den sædvanlige humane dosis. Famotidin kan påvises i modermælk. På grund af risikoen for alvorlige bivirkninger hos ammende spædbørn fra PEPCID, bør der tages en beslutning om at stoppe amningen eller seponere lægemidlet under hensyntagen til lægemidlets betydning for moderen.
Pædiatriske patienter
Brug af PEPCID 20 mg til pædiatriske patienter
To farmakokinetiske undersøgelser hos pædiatriske patienter 3 måneder til 1 år svarer til den, der ses hos ældre pædiatriske patienter (1-15 år) og voksne . I modsætning hertil havde pædiatriske patienter i alderen 0-3 måneder famotidin-clearance-værdier, der var 2-4 gange mindre end hos ældre pædiatriske patienter og voksne. Disse undersøgelser viser også, at den gennemsnitlige biotilgængelighed hos pædiatriske patienter KLINISK FARMAKOLOGI hos pædiatriske patienter , Farmakokinetik og farmakodynamik .)
et dobbeltblindt, randomiseret behandling-seponeringsstudie blev 35 pædiatriske patienter BIVIRKNINGER , Pædiatriske patienter ).
Disse undersøgelser tyder på, at en startdosis på 0,5 mg/kg/dosis af famotidin oral suspension kan være gavnlig til behandling af GERD i op til 4 uger én gang dagligt hos patienter
Pædiatriske patienter i alderen 1-16 år
Brug af PEPCID 40 mg til pædiatriske patienter i alderen 1-16 år understøttes af evidens fra tilstrækkelige og velkontrollerede undersøgelser af PEPCID hos voksne og af følgende undersøgelser hos pædiatriske patienter: I publicerede undersøgelser med et lille antal pædiatriske patienter 1-15 år, var clearance af famotidin den samme som hos voksne. Hos pædiatriske patienter i alderen 11-15 år var orale doser på 0,5 mg/kg forbundet med et gennemsnitligt areal under kurven (AUC) svarende til det, der ses hos voksne behandlet oralt med 40 mg. Tilsvarende var intravenøse doser på 0,5 mg/kg hos pædiatriske patienter i alderen 1-15 år forbundet med en gennemsnitlig AUC svarende til den, der ses hos voksne behandlet intravenøst med 40 mg. Begrænsede publicerede undersøgelser tyder også på, at forholdet mellem serumkoncentration og syreundertrykkelse er ens hos pædiatriske patienter i alderen 1-15 år sammenlignet med voksne. Disse undersøgelser foreslår en startdosis for pædiatriske patienter i alderen 1-16 år som følger:
Mavesår - 0,5 mg/kg/dag po Ved sengetid eller delt bud Op til 40 mg/dag.
Gastroøsofageal reflukssygdom med eller uden esophagitis inklusive erosioner og sårdannelser - 1,0 mg/kg/dag po delt bid op til 40 mg bid
Mens offentliggjorte ukontrollerede undersøgelser tyder på effektiviteten af famotidin i behandlingen af gastroøsofageal reflukssygdom og mavesår, er data fra pædiatriske patienter utilstrækkelige til at fastslå procentvis respons med dosis og varighed af behandlingen. Derfor bør behandlingsvarighed (initielt baseret på anbefalinger for varighed hos voksne) og dosis individualiseres baseret på klinisk respons og/eller pH-bestemmelse (mave eller spiserør) og endoskopi. Publicerede ukontrollerede kliniske undersøgelser af pædiatriske patienter har anvendt doser på op til 1 mg/kg/dag for mavesår og 2 mg/kg/dag for GERD med eller uden esophagitis inklusive erosioner og ulcerationer.
Geriatrisk brug
Af de 4.966 forsøgspersoner i kliniske undersøgelser, som blev behandlet med famotidin, var 488 forsøgspersoner (9,8 %) 65 år og ældre, og 88 forsøgspersoner (1,7 %) var ældre end 75 år. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner. Større følsomhed hos nogle ældre individer kan dog ikke udelukkes.
Ingen dosisjustering er nødvendig baseret på alder (se KLINISK FARMAKOLOGI hos voksne , Farmakokinetik ). Dette lægemiddel vides at udskilles væsentligt af nyrerne, og risikoen for toksiske reaktioner på dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og det kan være nyttigt at overvåge nyrefunktionen. Dosisjustering i tilfælde af moderat eller svær nyreinsufficiens er nødvendig (se FORHOLDSREGLER , Patienter med moderat eller svær nyreinsufficiens og DOSERING OG ADMINISTRATION , Dosisjustering for patienter med moderat eller svær nyreinsufficiens ).
OVERDOSIS
Bivirkningerne i tilfælde af overdosering svarer til de bivirkninger, man støder på i normal klinisk erfaring (se BIVIRKNINGER ). Orale doser på op til 640 mg/dag er blevet givet til voksne patienter med patologiske hypersekretoriske tilstande uden alvorlige bivirkninger. I tilfælde af overdosering skal behandlingen være symptomatisk og støttende. Ikke-absorberet materiale bør fjernes fra mave-tarmkanalen, patienten bør overvåges, og understøttende behandling bør anvendes.
Den orale LD50 af famotidin hos han- og hunrotter og -mus var større end 3000 mg/kg, og den mindste letale akutte orale dosis hos hunde oversteg 2000 mg/kg. Famotidin fremkaldte ikke åbenlyse virkninger ved høje orale doser hos mus, rotter, katte og hunde, men inducerede signifikant anoreksi og vækstdepression hos kaniner startende med 200 mg/kg/dag oralt. Den intravenøse LD50 af famotidin til mus og rotter varierede fra 254-563 mg/kg, og den mindste dødelige enkelt IV dosis til hunde var ca. 300 mg/kg. Tegn på akut forgiftning hos IV-behandlede hunde var emeser, rastløshed, bleghed af slimhinder eller rødme af mund og ører, hypotension, takykardi og kollaps.
KONTRAINDIKATIONER
Overfølsomhed over for enhver komponent i disse produkter. Krydsfølsomhed i denne klasse af forbindelser er blevet observeret. PEPCID 40 mg bør derfor ikke administreres til patienter med en anamnese med overfølsomhed over for andre H2-receptorantagonister.
KLINISK FARMAKOLOGI
Klinisk farmakologi hos voksne
GI effekter
PEPCID er en kompetitiv hæmmer af histamin H2-receptorer. Den primære klinisk vigtige farmakologiske aktivitet af PEPCID 40 mg er hæmning af mavesekretion. Både syrekoncentrationen og volumen af mavesekretion undertrykkes af PEPCID, mens ændringer i pepsinsekretion er proportional med volumenoutput.
Hos normale frivillige og hypersekretorer hæmmede PEPCID 20mg basal og natlig mavesekretion, samt sekretion stimuleret af mad og pentagastrin. Efter oral administration indtrådte den antisekretoriske virkning inden for en time; den maksimale effekt var dosisafhængig og indtraf inden for en til tre timer. Varigheden af inhibering af sekretion ved doser på 20 og 40 mg var 10 til 12 timer.
Enkelte orale doser på 20 og 40 mg om aftenen hæmmede basal og natlig syresekretion hos alle forsøgspersoner; gennemsnitlig natlig mavesyresekretion blev hæmmet med henholdsvis 86 % og 94 % i en periode på mindst 10 timer. De samme doser givet om morgenen undertrykte fødevarestimuleret syresekretion hos alle forsøgspersoner. Den gennemsnitlige suppression var henholdsvis 76 % og 84 % 3 til 5 timer efter administration og henholdsvis 25 % og 30 % 8 til 10 timer efter administration. Hos nogle forsøgspersoner, som modtog 20 mg-dosis, forsvandt den antisekretoriske virkning dog inden for 6-8 timer. Der var ingen kumulativ effekt ved gentagne doser. Den natlige intragastriske pH blev hævet med aftendoser på 20 og 40 mg PEPCID til middelværdier på henholdsvis 5,0 og 6,4. Når PEPCID 40 mg blev givet efter morgenmad, blev den basale dagtid interfordøjelses-pH ved 3 og 8 timer efter 20 eller 40 mg PEPCID 40 mg hævet til omkring 5.
PEPCID 40 mg havde ringe eller ingen effekt på fastende eller postprandiale serumgastrinniveauer. Mavetømning og eksokrin pancreasfunktion blev ikke påvirket af PEPCID.
Andre effekter
Systemiske effekter af PEPCID i CNS, kardiovaskulære, respiratoriske eller endokrine systemer blev ikke noteret i kliniske farmakologiske undersøgelser. Der blev heller ikke noteret nogen antiandrogene virkninger. (Se BIVIRKNINGER .) Serumhormonniveauer, inklusive prolaktin, cortisol, thyroxin (T4) og testosteron, blev ikke ændret efter behandling med PEPCID.
Farmakokinetik
PEPCID 20 mg absorberes ufuldstændigt. Biotilgængeligheden af orale doser er 40-45%. Biotilgængeligheden kan øges lidt ved mad eller en smule nedsat af antacida; disse virkninger har dog ingen klinisk konsekvens. PEPCID gennemgår minimal first-pass metabolisme. Efter orale doser opstår maksimale plasmaniveauer efter 1-3 timer. Plasmaniveauer efter flere doser svarer til niveauerne efter enkeltdoser. Femten til 20 % af PEPCID 20 mg i plasma er proteinbundet. PEPCID har en eliminationshalveringstid på 2,5-3,5 timer. PEPCID elimineres via nyrerne (65-70%) og metaboliske (30-35%) veje. Renal clearance er 250-450 ml/min, hvilket indikerer en vis tubulær udskillelse. Femogtyve til 30 % af en oral dosis og 65-70 % af en intravenøs dosis genfindes i urinen som uændret forbindelse. Den eneste metabolit, der identificeres hos mennesker, er S-oxidet.
Der er en tæt sammenhæng mellem værdier for kreatininclearance og eliminationshalveringstiden for PEPCID. Hos patienter med alvorlig nyreinsufficiens, dvs. kreatininclearance mindre end 10 ml/min, kan eliminationshalveringstiden for PEPCID overstige 20 timer, og justering af dosis eller dosisintervaller ved moderat og svær nyreinsufficiens kan være nødvendig (se FORHOLDSREGLER , DOSERING OG ADMINISTRATION ).
Hos ældre patienter er der ingen klinisk signifikante aldersrelaterede ændringer i farmakokinetikken af PEPCID. Hos ældre patienter med nedsat nyrefunktion kan clearance af lægemidlet dog være nedsat (se FORHOLDSREGLER , Geriatrisk brug ).
Kliniske Studier
Duodenalsår
I et amerikansk multicenter, dobbeltblindet studie i ambulante patienter med endoskopisk bekræftet duodenalsår, blev oralt administreret PEPCID sammenlignet med placebo. Som vist i tabel 1 var 70 % af de patienter, der blev behandlet med PEPCID 40 mg t. helbredt i uge 4.
Patienter, der ikke var helbredt i uge 4, fortsatte i undersøgelsen. I uge 8 var 83 % af patienterne behandlet med PEPCID helet mod 45 % af patienterne behandlet med placebo. Incidensen af heling af sår med PEPCID var signifikant højere end med placebo på hvert tidspunkt baseret på andelen af endoskopisk bekræftede helede sår.
I denne undersøgelse var tiden til lindring af dag- og natlige smerter signifikant kortere for patienter, der fik PEPCID, end for patienter, der fik placebo; patienter, der fik PEPCID, tog også mindre antacida end de patienter, der fik placebo.
Langsigtet vedligeholdelsesbehandling af duodenalsår
PEPCID 40 mg, 20 mg pohs, blev sammenlignet med placebo-hs som vedligeholdelsesbehandling i to dobbeltblindede, multicenterundersøgelser af patienter med endoskopisk bekræftede helede duodenalsår. I det amerikanske studie var den observerede ulcusforekomst inden for 12 måneder hos patienter behandlet med placebo 2,4 gange større end hos patienter behandlet med PEPCID. De 89 patienter behandlet med PEPCID havde en kumulativ observeret ulcusincidens på 23,4 % sammenlignet med en observeret ulcusincidens på 56,6 % hos de 89 patienter, der fik placebo (p
Mavesår
både et amerikansk og et internationalt multicenter blev dobbeltblindet studie af patienter med endoskopisk bekræftet aktivt godartet mavesår, oralt administreret PEPCID 20 mg, 40 mg t., sammenlignet med placebo-hs Antacida var tilladt under undersøgelserne, men forbruget var ikke signifikant forskelligt mellem PEPCID- og placebogrupperne. Som vist i tabel 2 var forekomsten af sårheling (udfald regnet som uhelet) med PEPCID 20 mg statistisk signifikant bedre end placebo i uge 6 og 8 i det amerikanske studie og i uge 4, 6 og 8 i det internationale studie, baseret på på antallet af sår, der helede, bekræftet ved endoskopi.
Tiden til fuldstændig lindring af dag- og natsmerter var statistisk signifikant kortere for patienter, der fik PEPCID 20 mg, end for patienter, der fik placebo; I ingen af undersøgelserne var der dog en statistisk signifikant forskel i andelen af patienter, hvis smerter var lindret ved afslutningen af undersøgelsen (uge 8).
Gastroøsofageal reflukssygdom (GERD)
Oralt administreret PEPCID blev sammenlignet med placebo i en amerikansk undersøgelse, der inkluderede patienter med symptomer på GERD og uden endoskopiske tegn på erosion eller ulceration af spiserøret. PEPCID 20 mg to gange dagligt var statistisk signifikant bedre end 40 mg t. og placebo med hensyn til at give et vellykket symptomatisk resultat, defineret som moderat eller fremragende forbedring af symptomer (tabel 3).
Efter to ugers behandling blev symptomatisk succes observeret hos en større procentdel af patienter, der tog PEPCID 20 mg to gange dagligt sammenlignet med placebo (p ≤ 0,01).
Symptomatisk forbedring og heling af endoskopisk verificeret erosion og ulceration blev undersøgt i to yderligere forsøg. Heling blev defineret som fuldstændig opløsning af alle erosioner eller ulcerationer, der var synlige med endoskopi. Den amerikanske undersøgelse, der sammenlignede PEPCID 40 mg pobid med placebo og PEPCID 20 mg pobid, viste en signifikant større procentdel af heling for PEPCID 40 mg to gange i uge 6 og 12 (tabel 4).
Sammenlignet med placebo havde patienter, der fik PEPCID, hurtigere lindring af halsbrand om dagen og om natten, og en større procentdel af patienterne oplevede fuldstændig lindring af halsbrand om natten. Disse forskelle var statistisk signifikante.
I det internationale studie, hvor PEPCID 40 mg pobid blev sammenlignet med ranitidin 150 mg pobid, blev der observeret en statistisk signifikant større procentdel af heling med PEPCID 40 mg to gange i uge 12 (tabel 5). Der var dog ingen signifikant forskel mellem behandlingerne i symptomlindring.
Patologiske hypersekretoriske tilstande (f.eks. Zollinger-Ellison syndrom, multiple endokrine adenomer)
I undersøgelser af patienter med patologiske hypersekretoriske tilstande såsom Zollinger-Ellison Syndrom med eller uden multiple endokrine adenomer, hæmmede PEPCID signifikant mavesyresekretion og kontrollerede associerede symptomer. Oralt indgivne doser fra 20 til 160 mg q 6 timer holdt basal syresekretion under 10 mEq/time; initialdoserne blev titreret til den enkelte patients behov, og efterfølgende justeringer var nødvendige med tiden hos nogle patienter. PEPCID 40 mg blev godt tolereret ved disse høje dosisniveauer i længere perioder (mere end 12 måneder) hos otte patienter, og der var ingen tilfælde rapporteret om gynækomasti, øgede prolaktinniveauer eller impotens, som blev anset for at skyldes lægemidlet.
Klinisk farmakologi hos pædiatriske patienter
Farmakokinetik
Tabel 6 viser farmakokinetiske data fra kliniske forsøg og en publiceret undersøgelse af pædiatriske patienter (
Plasmaclearance er reduceret, og eliminationshalveringstiden forlænges hos pædiatriske patienter i alderen 0-3 måneder sammenlignet med ældre pædiatriske patienter. De farmakokinetiske parametre for pædiatriske patienter i alderen > 3 måneder-15 år er sammenlignelige med dem opnået for voksne.
Biotilgængelighedsundersøgelser af 8 pædiatriske patienter (11-15 år) viste en gennemsnitlig oral biotilgængelighed på 0,5 sammenlignet med værdier for voksne på 0,42 til 0,49. Orale doser på 0,5 mg/kg opnåede AUC'er på 645 ± 249 ng-t/mL og 580 ± 60 ng-t/mL hos pædiatriske patienter
Farmakodynamik
Farmakodynamikken af famotidin blev evalueret hos 5 pædiatriske patienter i alderen 2-13 år ved brug af sigmoid Emax-modellen. Disse data tyder på, at forholdet mellem serumkoncentration af famotidin og mavesyreundertrykkelse svarer til det, der blev observeret i en undersøgelse af voksne (tabel 7).
Fem publicerede undersøgelser (tabel 8) undersøgte virkningen af famotidin på gastrisk pH og varigheden af syresuppression hos pædiatriske patienter. Mens hver undersøgelse havde et andet design, er syreundertrykkelsesdata over tid opsummeret som følger:
Varigheden af virkningen af famotidin IV 0,5 mg/kg på gastrisk pH og syreundertrykkelse blev i et studie vist at være længere hos pædiatriske patienter
PATIENTOPLYSNINGER
Ingen oplysninger angivet. Der henvises til FORHOLDSREGLER afsnit.
