Prevacid 15mg, 30mg Lansoprazole Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Prevacid, og hvordan bruges det?
Prevacid 15mg er en receptpligtig medicin, der bruges til at behandle symptomer på mavesår og tarmsår og til at mindske mængden af syre, der produceres i maven. Prevacid 15mg kan bruges alene eller sammen med anden medicin.
- Prevacid 15mg er en protonpumpehæmmer.
Hvad er de mulige bivirkninger af Prevacid 30mg?
Prevacid 30mg kan forårsage alvorlige bivirkninger, herunder:
- stærke mavesmerter,
- diarré indeholdende blod,
- krampeanfald (kramper,
- vandladningsbesvær,
- blod i din urin,
- hævelse,
- hurtig vægtøgning,
- svimmelhed,
- hurtig eller uregelmæssig puls,
- ryster,
- rykkende muskelbevægelser,
- føler sig nervøs,
- muskelkramper eller spasmer i dine hænder eller fødder,
- hoste,
- føler, at du er ved at blive kvalt,
- ledsmerter, og
- hududslæt på dine kinder eller arme, der forværres i sollys
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Prevacid 15mg omfatter:
- kvalme,
- mavesmerter,
- diarré,
- forstoppelse, og
- hovedpine
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Prevacid. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
FORORD (lansoprazol) oralt disintegrerende tabletter med forsinket frigivelse
BESKRIVELSE
Den aktive ingrediens i PREVACID 30 mg kapsler med forsinket frigivelse og PREVACID 15 mg SoluTab oralt disintegrerende tabletter med forsinket frigivelse er lansoprazol, en substitueret benzimidazol, 2-[[[3-methyl-4-(2,2,2-trifluorethoxy]-2-pyridyl]-2- methyl] sulfinyl] benzimidazol, en forbindelse, der hæmmer mavesyresekretion. Dens empiriske formel er C16H14F3N3O2S med en molekylvægt på 369,37. Lansoprazol har følgende struktur:
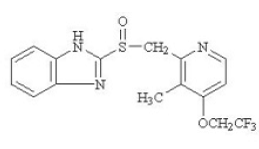
Lansoprazol er et hvidt til brunligt-hvidt lugtfrit krystallinsk pulver, som smelter ved nedbrydning ved ca. 166°C. Lansoprazol er frit opløseligt i dimethylformamid; opløselig i methanol; tungtopløselig i ethanol; let opløselig i ethylacetat, dichlormethan og acetonitril; meget lidt opløselig i ether og praktisk talt uopløselig i hexan og vand.
Lansoprazol er stabilt, når det udsættes for lys i op til to måneder. Hastigheden for nedbrydning af forbindelsen i en vandig opløsning stiger med faldende pH. Nedbrydningshalveringstiden for lægemiddelstoffet i en vandig opløsning ved 25°C er ca. 0,5 timer ved pH 5,0 og ca. 18 timer ved pH 7,0.
PREVACID leveres i kapsler med forsinket frigivelse, og PREVACID 15 mg SoluTab leveres i oralt nedbrydende tabletter med forsinket frigivelse (SoluTab) til oral administration.
PREVACID fås i to doseringsstyrker: 15 og 30 mg lansoprazol pr. kapsel. Hver kapsel med forsinket frigivelse indeholder enterisk-coatede granulat bestående af 15 eller 30 mg lansoprazol (aktiv ingrediens) og følgende inaktive ingredienser: sukkerkugle, saccharose, methacrylsyrecopolymer, lavsubstitueret hydroxypropylcellulose, stivelse, magnesiumcarbonat, talkum, polyethylen glycol, titaniumdioxid, polysorbat 80, hydroxypropylcellulose, kolloid siliciumdioxid, D&C Red No. 28, FD&C Blue No. 1, FD&C Green No. 31 og FD&C Red No. 40.
PREVACID 30mg SoluTab fås i to doseringsstyrker: 15 og 30 mg lansoprazol pr. tablet. Hver oralt disintegrerende tablet med forsinket frigivelse indeholder enterisk coatede mikrogranulat bestående af 15 eller 30 mg lansoprazol (aktiv ingrediens) og følgende inaktive ingredienser: mannitol, methacrylsyre, hydroxypropylcellulose, lactosemonohydrat-mikrokrystallinsk cellulosekugle, tricroethylcitrat, polyacrylat, magnesiumcarbonat, aspartam2, glycerylmonostearat, hypromellose, magnesiumstearat, citronsyre, titaniumdioxid, talkum, kunstig jordbærsmag, polyethylenglycol, polysorbat 80 og jernoxid.
Kun 1PREVACID 15 mg kapsler. 2Phenylketonurics: PREVACID SoluTab indeholder phenylalanin 2,5 mg pr. 15 mg tablet og 5,1 mg pr. 30 mg tablet.
INDIKATIONER
Behandling af aktivt duodenalsår
PREVACID og PREVACID SoluTab er indiceret til voksne til korttidsbehandling (i fire uger) til heling og symptomlindring af aktivt duodenalsår [se Kliniske Studier ].
Udryddelse af H. pylori for at reducere risikoen for tilbagefald af duodenalsår
Tredobbelt terapi: PREVACID eller PREVACID SoluTab/amoxicillin/clarithromycin
PREVACID eller PREVACID 30 mg SoluTab i kombination med amoxicillin plus clarithromycin som tredobbelt behandling er indiceret til voksne til behandling af patienter med H. pylori-infektion og duodenalsårsygdom (aktiv eller et års anamnese med duodenalsår) for at udrydde H. pylori. Udryddelse af H. pylori har vist sig at reducere risikoen for tilbagefald af duodenalsår [se Kliniske Studier ].
Se venligst den fulde ordinationsinformation for amoxicillin og clarithromycin.
Dobbeltterapi: PREVACID eller PREVACID SoluTab/amoxicillin
PREVACID eller PREVACID 15 mg SoluTab i kombination med amoxicillin som dobbeltbehandling er indiceret til voksne til behandling af patienter med H. pylori-infektion og duodenalsårsygdom (aktiv eller et års anamnese med duodenalsår), som enten er allergiske eller intolerante over for clarithromycin eller hos hvem der kendes eller mistænkes for resistens over for clarithromycin (se ordinationsinformationen for clarithromycin, afsnittet Mikrobiologi). Udryddelse af H. pylori har vist sig at reducere risikoen for tilbagefald af duodenalsår [se Kliniske Studier ].
Se venligst den fulde ordinationsinformation for amoxicillin.
Vedligeholdelse af helede duodenalsår
PREVACID og PREVACID SoluTab er indiceret til voksne for at opretholde helingen af duodenalsår. Kontrollerede undersøgelser strækker sig ikke ud over 12 måneder [se Kliniske Studier ].
Behandling af aktivt godartet mavesår
PREVACID og PREVACID 30 mg SoluTab er indiceret til voksne til korttidsbehandling (op til otte uger) til heling og symptomlindring af aktivt godartet mavesår [se Kliniske Studier ].
Heling af NSAID-associeret mavesår
PREVACID 30mg og PREVACID SoluTab er indiceret til voksne til behandling af NSAID-associeret mavesår hos patienter, der fortsætter med at bruge NSAID. Kontrollerede undersøgelser strakte sig ikke ud over otte uger [se Kliniske Studier ].
Risikoreduktion af NSAID-associeret mavesår
PREVACID 15mg og PREVACID SoluTab er indiceret til voksne for at reducere risikoen for NSAID-associerede mavesår hos patienter med en anamnese med et dokumenteret mavesår, som kræver brug af et NSAID. Kontrollerede undersøgelser strakte sig ikke ud over 12 uger [se Kliniske Studier ].
Behandling af symptomatisk gastroøsofageal reflukssygdom (GERD)
PREVACID 15mg og PREVACID 30mg SoluTab er indiceret til korttidsbehandling til voksne og pædiatriske patienter i alderen 12 til 17 år (op til otte uger) og pædiatriske patienter i alderen 1 til 11 år (op til 12 uger) til behandling af halsbrand og andre symptomer forbundet med GERD [se Kliniske Studier ].
Behandling af erosiv øsofagitis (EE)
PREVACID 15mg og PREVACID 30mg SoluTab er indiceret til korttidsbehandling til voksne og pædiatriske patienter i alderen 12 til 17 år (op til otte uger) og pædiatriske patienter i alderen 1 til 11 år (op til 12 uger) til heling og symptomlindring af alle kvaliteter af EE.
For voksne, der ikke heler med PREVACID 30mg eller PREVACID 15mg SoluTab i otte uger (5 til 10%), kan det være nyttigt at give yderligere otte ugers behandling. Hvis der er et tilbagefald af erosiv esophagitis, kan en yderligere otte ugers kur med PREVACID 30mg eller PREVACID SoluTab overvejes [se Kliniske Studier ].
Vedligeholdelse af heling af EE
PREVACID og PREVACID SoluTab er indiceret til voksne for at opretholde heling af EE. Kontrollerede undersøgelser strakte sig ikke ud over 12 måneder [se Kliniske Studier ].
Patologiske hypersekretoriske tilstande, herunder Zollinger-Ellison syndrom (ZES)
PREVACID 15mg og PREVACID SoluTab er indiceret til voksne til langtidsbehandling af patologiske hypersekretoriske tilstande, herunder Zollinger-Ellisons syndrom [se Kliniske Studier ].
DOSERING OG ADMINISTRATION
Anbefalet voksendosis efter indikation
Anbefalet pædiatrisk dosering efter indikation
Pædiatriske patienter i alderen 1 til 11 år
I kliniske undersøgelser blev PREVACID ikke administreret ud over 12 uger til 1-11-årige. Det vides ikke, om PREVACID er sikkert og effektivt, hvis det bruges længere end den anbefalede varighed. Overskrid ikke den anbefalede dosis og varighed af brug hos pædiatriske patienter som beskrevet nedenfor [se Brug i specifikke populationer ].
Nedsat leverfunktion
Den anbefalede dosis er 15 mg oralt dagligt til patienter med svært nedsat leverfunktion (Child-Pugh C) [se Brug i specifikke populationer ].
Vigtige administrationsoplysninger
- Tag PREVACID eller PREVACID 30mg SoluTab før måltider.
- Du må ikke knuse eller tygge PREVACID 15mg kapsel eller PREVACID 30mg SoluTab.
- Tag PREVACID eller PREVACID 30 mg SoluTab mindst 30 minutter før sucralfat [se DRUGSINTERAKTIONER ].
- Antacida kan anvendes samtidig med PREVACID eller PREVACID SoluTab.
- Glemte doser: Hvis en dosis glemmes, indgives så hurtigt som muligt. Men hvis den næste planlagte dosis er på vej, skal du ikke tage den glemte dosis, og tage den næste dosis til tiden. Tag ikke to doser ad gangen for at kompensere for en glemt dosis.
PREVACID kapsler
- Synke hele; ikke tygge.
- Til patienter, som har svært ved at sluge kapsler, kan PREVACID-kapsler åbnes og indgives oralt eller via en nasogastrisk sonde i de bløde fødevarer eller væsker, der er specificeret nedenfor.
- Administration af PREVACID i andre fødevarer eller væsker end dem, der er beskrevet nedenfor, er ikke blevet undersøgt klinisk og anbefales derfor ikke.
Administration i bløde fødevarer (æblemos, ENSURE budding, hytteost, yoghurt eller siede pærer):
Administration i væsker (æblejuice, appelsinjuice eller tomatjuice):
Administration med æblejuice gennem en nasogastrisk sonde (≥16 fransk)
PREVACID 15mg SoluTab
- Må ikke brydes eller skæres.
- Placer tabletten på tungen, lad den gå i opløsning, med eller uden vand, indtil mikrogranulatet kan sluges. Tyg ikke mikrogranulatet.
- Tabletten går typisk i opløsning på mindre end et minut.
- Alternativt, til børn eller andre patienter, der har svært ved at sluge tabletter, kan PREVACID SoluTab administreres med vand via oral sprøjte eller NG-rør som følger:
Administration med vand i en oral sprøjte
Administration med vand via et NG-rør (≥8 fransk)
HVORDAN LEVERET
Doseringsformer og styrker
PREVACID 15mg Kapsler med forsinket frigivelse
- 15 mg styrke er en uigennemsigtig, lyserød og grøn kapsel præget med "TAP" og "PREVACID 15".
- 30 mg styrke er en uigennemsigtig, lyserød og sort kapsel præget med "TAP" og "PREVACID 30".
PREVACID 30mg SoluTab oralt disintegrerende tabletter med forsinket frigivelse
- Styrken 15 mg er en hvid til gullig hvid, uovertrukket rund tablet indeholdende orange til mørkebrune pletter med "15" præget på den ene side.
- 30 mg styrke er en hvid til gullig hvid, uovertrukket rund tablet indeholdende orange til mørkebrune pletter med "30" præget på den ene side.
Opbevaring og håndtering
PREVACID kapsler med forsinket frigivelse , 15 mg, er uigennemsigtige, lyserøde og grønne med "TAP" og "PREVACID 15" præget på kapslerne. 30 mg kapslerne med forsinket frigivelse er uigennemsigtige, lyserøde og sorte med "TAP" og "PREVACID 30" præget på kapslerne. De er tilgængelige som følger:
PREVACID 30mg SoluTab oralt nedbrydende tabletter med forsinket frigivelse , 15 mg, er hvide til gullighvide, runde, ikke-overtrukne tabletter indeholdende orange til mørkebrune pletter med "15" præget på den ene side af tabletten. De 30 mg er hvide til gullighvide, runde, ikke-overtrukne tabletter, der indeholder orange til mørkebrune pletter med "30" præget på den ene side af tabletten. Tabletterne fås som følger:
Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F)[se USP kontrolleret rumtemperatur ].
Distribueret af: Takeda Pharmaceuticals America, Inc., Deerfield, IL 60015. Revideret: jun 2018
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i mærkningen:
- Akut Tubulointerstitiel nefritis [se ADVARSLER OG FORHOLDSREGLER ]
- Clostridium difficile-associeret diarré [se ADVARSLER OG FORHOLDSREGLER ]
- Knoglebrud [se ADVARSLER OG FORHOLDSREGLER ]
- Alvorlige kutane bivirkninger [se ADVARSLER OG FORHOLDSREGLER ]
- Kutan og systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ]
- Cyanocobalamin (vitamin B12) mangel [se ADVARSLER OG FORHOLDSREGLER ]
- Hypomagnesæmi og mineralmetabolisme [se ADVARSLER OG FORHOLDSREGLER ]
- Fundiske kirtelpolypper [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan frekvenser af bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
På verdensplan er over 10.000 patienter blevet behandlet med PREVACID 30 mg i fase 2 eller fase 3 kliniske forsøg, der involverer forskellige doser og behandlingsvarigheder. Generelt har PREVACID 30 mg behandling været veltolereret i både korttids- og langtidsforsøg.
Følgende bivirkninger blev rapporteret af den behandlende læge for at have et muligt eller sandsynligt forhold til lægemidlet hos 1 % eller flere af de PREVACID-behandlede patienter og forekom i højere grad hos PREVACID-behandlede patienter end placebo-behandlede patienter i tabel 1.
Hovedpine blev også set med mere end 1 % forekomst, men var mere almindelig på placebo. Forekomsten af diarré var ens mellem patienter, der fik placebo og patienter, der fik 15 og 30 mg PREVACID, men højere hos patienterne, der fik 60 mg PREVACID (henholdsvis 2,9, 1,4, 4,2 og 7,4%).
Den mest almindeligt rapporterede muligvis eller sandsynligvis behandlingsrelaterede bivirkning under vedligeholdelsesbehandling var diarré.
risikoreduktionsundersøgelsen af PREVACID for NSAID-associerede mavesår var forekomsten af diarré hos patienter behandlet med PREVACID 30 mg, misoprostol og placebo henholdsvis 5, 22 og 3 %.
En anden undersøgelse for samme indikation, hvor patienter tog enten en COX-2-hæmmer eller lansoprazol og naproxen, viste, at sikkerhedsprofilen svarede til den tidligere undersøgelse. Yderligere reaktioner fra denne undersøgelse, som ikke tidligere er observeret i andre kliniske forsøg med PREVACID 30 mg, omfattede kontusion, duodenitis, epigastrisk ubehag, esophageal lidelse, træthed, sult, hiatal brok, hæshed, svækket gastrisk tømning, metaplasi og nedsat nyrefunktion.
Yderligere bivirkninger, der forekommer hos mindre end 1 % af patienter eller forsøgspersoner, der fik PREVACID 15 mg i indenlandske forsøg, er vist nedenfor:
Kroppen som helhed - forstørret mave, allergisk reaktion, asteni, rygsmerter, candidiasis, karcinom, brystsmerter (ikke andet specificeret), kulderystelser, ødem, feber, influenzasyndrom, halitose, infektion (ikke andet specificeret), utilpashed, nakkesmerter, nakkestivhed, smerter , bækkensmerter
Kardiovaskulære system - angina, arytmi, bradykardi, cerebrovaskulær ulykke/hjerneinfarkt, hypertension/hypotension, migræne, myokardieinfarkt, hjertebanken, shock (cirkulationssvigt), synkope, takykardi, vasodilatation
Fordøjelsessystemet - unormal afføring, anoreksi, bezoar, kardiospasme, kolelithiasis, colitis, mundtørhed, dyspepsi, dysfagi, enteritis, eructation, esophageal stenose, esophageal ulcus, esophagitis, fækal misfarvning, flatulens, gastrisk anodus gastropsengitis, gastrisk anodus gastropsengitis, gastrisk angreb gastropsengitis. , gastrointestinal lidelse, gastrointestinal blødning, glossitis, tandkødsblødning, hæmatemese, øget appetit, øget spytudskillelse, melena, mundsår, kvalme og opkastning, kvalme og opkastning og diarré, gastrointestinal moniliasis, endetarmsbetændelse, endetarmsbetændelse, endetarmsbetændelse, endetarmsbetændelse, tungelidelse, colitis ulcerosa, ulcerøs stomatitis
Endokrine system - diabetes mellitus, struma, hypothyroidisme Hemisk og lymfesystem - anæmi, hæmolyse, lymfadenopati
Metabolisme og ernæringsforstyrrelser - avitaminose, gigt, dehydrering, hyperglykæmi/hypoglykæmi, perifert ødem, vægtøgning/tab
Muskuloskeletale system - artralgi, arthritis, knoglelidelse, ledlidelse, benkramper, muskel- og skeletsmerter, myalgi, myasthenia, ptosis, synovitis
Nervesystem - unormale drømme, agitation, hukommelsestab, angst, apati, forvirring, kramper, demens, depersonalisering, depression, dobbeltsyn, svimmelhed, følelsesmæssig labilitet, hallucinationer, hemiplegi, fjendtlighed forværret, hyperkinesi, hypertoni, hypestesi, søvnløshed, nedsat libido, nervøsitet neurose, paræstesi, søvnforstyrrelse, somnolens, tænkeabnormitet, tremor, vertigo
Åndedrætsorganerne - astma, bronkitis, øget hoste, dyspnø, næseblod, hæmoptyse, hikke, larynx neoplasi, lungefibrose, pharyngitis, pleural lidelse, lungebetændelse, respiratorisk lidelse, øvre luftvejsbetændelse/infektion, rhinitis, bihulebetændelse, stridor
Hud og vedhæng - acne, alopeci, kontaktdermatitis, tør hud, fast udbrud, hårlidelse, makulopapulært udslæt, neglelidelse, kløe, udslæt, hudkarcinom, hudlidelse, svedtendens, nældefeber
Særlige sanser - unormalt syn, amblyopi, blepharitis, sløret syn, grå stær, conjunctivitis, døvhed, tørre øjne, øre/øjenlidelse, øjensmerter, grøn stær, mellemørebetændelse, parosmi, fotofobi, nethindegeneration/lidelse, smagstab, smagsforstyrrelse, tinnitus, syn feltfejl
Urogenitale system - unormal menstruation, brystforstørrelse, brystsmerter, ømhed i brysterne, dysmenoré, dysuri, gynækomasti, impotens, nyresten, nyresmerter, leukoré, menorrhagi, menstruationsforstyrrelse, penisforstyrrelse, polyuri, testikellidelse, urinrørssmerter, urinfrekvens, urinvejsinfektion, urintrang, vandladningsforringelse, vaginitis
Postmarketing oplevelse
Yderligere bivirkninger er blevet rapporteret, siden PREVACID og PREVACID 30 mg SoluTab er blevet markedsført. Størstedelen af disse tilfælde stammer fra udenlandsk oprindelse, og der er ikke påvist en sammenhæng med PREVACID 15mg eller PREVACID SoluTab. Da disse reaktioner blev rapporteret frivilligt fra en population af ukendt størrelse, kan der ikke foretages skøn over hyppigheden. Disse hændelser er angivet nedenfor af COSTART kropssystem.
Kroppen som helhed - anafylaktiske/anafylaktoide reaktioner, systemisk lupus erythematosus;
Fordøjelsessystemet - hepatotoksicitet, pancreatitis, opkastning;
Hemisk og lymfesystem - agranulocytose, aplastisk anæmi, hæmolytisk anæmi, leukopeni, neutropeni, pancytopeni, thrombocytopeni og thrombotisk thrombocytopenisk purpura;
Infektioner og angreb - Clostridium difficile-associeret diarré;
Metabolisme og ernæringsforstyrrelser - hypomagnesiæmi, hypocalcæmi, hypokaliæmi, hyponatriæmi;
Muskuloskeletale system - knoglebrud, myositis;
Hud og vedhæng - alvorlige dermatologiske reaktioner, herunder erythema multiforme, SJS/TEN (nogle dødelige), DRESS, AGEP, kutan lupus erythematosus;
Særlige sanser - taleforstyrrelse;
Urogenitale system - interstitiel nefritis, urinretention.
Kombinationsterapi med amoxicillin og clarithromycin
I kliniske forsøg med kombinationsbehandling med PREVACID plus amoxicillin og clarithromycin og PREVACID 30 mg plus amoxicillin blev der ikke observeret bivirkninger, der var særlige for disse lægemiddelkombinationer. Bivirkninger, der er opstået, har været begrænset til dem, der tidligere var blevet rapporteret med PREVACID 15 mg, amoxicillin eller clarithromycin.
Tredobbelt terapi: PREVACID/amoxicillin/clarithromycin
De hyppigst rapporterede bivirkninger for patienter, der fik tripelbehandling i 14 dage, var diarré (7 %), hovedpine (6 %) og smagsforstyrrelser (5 %). Der var ingen statistisk signifikante forskelle i hyppigheden af rapporterede bivirkninger mellem 10- og 14-dages tripelbehandlingsregimerne. Ingen behandlingsudløste bivirkninger blev observeret med signifikant højere frekvenser med tripelbehandling end med nogen dobbeltbehandlingsregime.
Dobbeltterapi: PREVACID/amoxicillin
De hyppigst rapporterede bivirkninger for patienter, der fik PREVACID 30 mg tre gange dagligt plus amoxicillin tre gange daglig dobbeltbehandling, var diarré (8 %) og hovedpine (7 %). Der blev ikke observeret nogen behandlingsudløste bivirkninger i signifikant højere frekvens med PREVACID 30 mg tre gange dagligt plus amoxicillin tre gange dagligt dobbeltbehandling end med PREVACID 15 mg alene.
For information om bivirkninger med antibakterielle midler (amoxicillin og clarithromycin) indiceret i kombination med PREVACID eller PREVACID SoluTab henvises til afsnittet Bivirkninger i deres ordinationsinformation.
Laboratorieværdier
Følgende ændringer i laboratorieparametre hos patienter, der fik PREVACID 30 mg, blev rapporteret som bivirkninger:
Unormale leverfunktionsprøver, øget SGOT (AST), øget SGPT (ALT), øget kreatinin, øget alkalisk fosfatase, øget globuliner, øget GGTP, øget/nedsat/unormalt WBC, unormalt AG-forhold, unormalt RBC, bilirubinæmi, øget kalium i blodet, øget urinstof i blodet, tilstedeværende krystalurin, eosinofili, nedsat hæmoglobin, hyperlipæmi, øget/sænket elektrolytter, øget/sænket kolesterol, øget glukokortikoider, øget LDH, øget/faldende/unormale blodplader, øget gastrinniveau og positivt fækalt okkult blod. Urinabnormiteter såsom albuminuri, glykosuri og hæmaturi blev også rapporteret. Yderligere isolerede laboratorieabnormiteter blev rapporteret.
de placebokontrollerede undersøgelser, hvor SGOT (AST) og SGPT (ALT) blev evalueret, havde 0,4 % (4/978) og 0,4 % (11/2677) patienter, som fik henholdsvis placebo og PREVACID, enzymstigninger større end tre gange den øvre grænse for normalområdet ved det afsluttende behandlingsbesøg. Ingen af disse patienter, som fik PREVACID 30 mg, rapporterede gulsot på noget tidspunkt under undersøgelsen.
I kliniske forsøg med kombinationsbehandling med PREVACID 15mg plus amoxicillin og clarithromycin og PREVACID plus amoxicillin blev der ikke observeret øgede laboratorieabnormaliteter, der er specifikke for disse lægemiddelkombinationer.
For information om ændringer i laboratorieværdier med antibakterielle midler (amoxicillin og clarithromycin) indiceret i kombination med PREVACID eller PREVACID 30mg SoluTab henvises til afsnittet Bivirkninger i deres ordinationsinformation.
DRUGSINTERAKTIONER
Tabel 2 og 3 inkluderer lægemidler med klinisk vigtige lægemiddelinteraktioner og interaktion med diagnostik, når de administreres samtidig med PREVACID 15mg eller PREVACID SoluTab og instruktioner til at forebygge eller håndtere dem.
Se mærkningen af samtidig anvendte lægemidler for at få yderligere oplysninger om interaktioner med PPI'er.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Tilstedeværelse af gastrisk malignitet
Hos voksne udelukker symptomatisk respons på behandling med PREVACID 15mg eller PREVACID SoluTab ikke tilstedeværelsen af gastrisk malignitet. Overvej yderligere opfølgning og diagnostisk testning hos voksne patienter, som har et suboptimalt respons eller et tidligt symptomatisk tilbagefald efter endt behandling med en PPI. Overvej også en endoskopi hos ældre patienter.
Akut Tubulointerstitiel nefritis
Akut tubulointerstial nefritis (TIN) er blevet observeret hos patienter, der tager PPI'er og kan forekomme på ethvert tidspunkt under PPI-behandling. Patienter kan vise sig med forskellige tegn og symptomer fra symptomatiske overfølsomhedsreaktioner til uspecifikke symptomer på nedsat nyrefunktion (f.eks. utilpashed, kvalme, anoreksi). I rapporterede tilfældeserier blev nogle patienter diagnosticeret på biopsi og i fravær af ekstrarenale manifestationer (f.eks. feber, udslæt eller artralgi). Afbryd PREVACID eller PREVACID 15mg SoluTab og evaluer patienter med mistanke om akut TIN [se KONTRAINDIKATIONER ].
Clostridium Difficile-associeret diarré
Publicerede observationsstudier tyder på, at PPI-behandling som PREVACID 30mg og PREVACID 30mg SoluTab kan være forbundet med en øget risiko for Clostridium difficile-associeret diarré (CDAD), især hos indlagte patienter. Denne diagnose bør overvejes for diarré, der ikke forbedres [se BIVIRKNINGER ].
Patienter bør anvende den laveste dosis og korteste varighed af PPI-behandling, der er passende til den tilstand, der behandles.
CDAD er blevet rapporteret ved brug af næsten alle antibakterielle midler. For mere information, der er specifik for antibakterielle midler (clarithromycin og amoxicillin), der er indiceret til brug i kombination med PREVACID 15mg eller PREVACID 15mg SoluTab, henvises til afsnittet Advarsler og forholdsregler i deres ordinationsoplysninger.
Knoglebrud
Adskillige publicerede observationsstudier tyder på, at PPI-behandling kan være forbundet med en øget risiko for osteoporose-relaterede frakturer i hofte, håndled eller rygsøjle. Risikoen for fraktur var øget hos patienter, der fik høje doser, defineret som flere daglige doser, og langvarig PPI-behandling (et år eller længere). Patienter bør anvende den laveste dosis og korteste varighed af PPI-behandling, der er passende til den tilstand, der behandles. Patienter med risiko for osteoporose-relaterede frakturer bør behandles i henhold til etablerede behandlingsretningslinjer [se DOSERING OG ADMINISTRATION , BIVIRKNINGER ].
Alvorlige kutane bivirkninger
Alvorlige kutane bivirkninger, herunder Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) og akut generaliseret eksantematøs pustulose (AGEP) er blevet rapporteret i forbindelse med brugen af PPI'er [se BIVIRKNINGER ]. Afbryd PREVACID 30mg eller PREVACID SoluTab ved de første tegn eller symptomer på alvorlige kutane bivirkninger eller andre tegn på overfølsomhed og overvej yderligere evaluering.
Kutan og systemisk lupus erythematosus
Kutan lupus erythematosus (CLE) og systemisk lupus erythematosus (SLE) er blevet rapporteret hos patienter, der tager PPI'er, inklusive lansoprazol. Disse hændelser er opstået som både nyopstået og en forværring af eksisterende autoimmun sygdom. Størstedelen af PPI-inducerede lupus erythematosus tilfælde var CLE.
Den mest almindelige form for CLE rapporteret hos patienter behandlet med PPI'er var subakut CLE (SCLE) og forekom inden for uger til år efter kontinuerlig lægemiddelbehandling hos patienter lige fra spædbørn til ældre. Generelt blev histologiske fund observeret uden organinvolvering.
Systemisk lupus erythematosus (SLE) er mindre almindeligt rapporteret end CLE hos patienter, der får PPI'er. PPI-associeret SLE er normalt mildere end ikke-lægemiddelinduceret SLE. Indtræden af SLE forekom typisk inden for dage til år efter påbegyndelse af behandling, primært hos patienter lige fra unge voksne til ældre. Størstedelen af patienterne fik udslæt; dog blev der også rapporteret om artralgi og cytopeni.
Undgå administration af PPI'er i længere tid end medicinsk indiceret. Hvis der observeres tegn eller symptomer, der stemmer overens med CLE eller SLE hos patienter, der får PREVACID 15mg eller PREVACID SoluTab, skal du seponere lægemidlet og henvise patienten til den relevante specialist for evaluering. De fleste patienter forbedres ved seponering af PPI alene i fire til 12 uger. Serologiske test (f.eks. ANA) kan være positive, og forhøjede serologiske testresultater kan tage længere tid at løse end kliniske manifestationer.
Cyanocobalamin (vitamin B12) mangel
Daglig behandling med syre-undertrykkende medicin over en længere periode (f.eks. længere end tre år) kan føre til malabsorption af cyanocobalamin (vitamin B12) forårsaget af hypo- eller achlorhydri. Sjældne rapporter om cyanocobalaminmangel, der forekommer i forbindelse med syreundertrykkende behandling, er blevet rapporteret i litteraturen. Denne diagnose bør overvejes, hvis der observeres kliniske symptomer i overensstemmelse med cyanocobalaminmangel hos patienter behandlet med PREVACID eller PREVACID SoluTab.
Hypomagnesæmi og mineralmetabolisme
Hypomagnesæmi, symptomatisk og asymptomatisk, er sjældent blevet rapporteret hos patienter behandlet med PPI i mindst tre måneder, i de fleste tilfælde efter et års behandling. Alvorlige bivirkninger omfatter tetany, arytmier og anfald. Hypomagnesæmi kan føre til hypocalcæmi og/eller hypokaliæmi og kan forværre underliggende hypocalcæmi hos risikopatienter. Hos de fleste patienter krævede behandling af hypomagnesiæmi magnesiumerstatning og seponering af PPI.
For patienter, der forventes at være i langvarig behandling, eller som tager PPI'er sammen med medicin såsom digoxin eller lægemidler, der kan forårsage hypomagnesæmi (f.eks. diuretika), kan sundhedspersonale overveje at overvåge magnesiumniveauer før påbegyndelse af PPI-behandling og periodisk [se BIVIRKNINGER ].
Overvej at monitorere magnesium- og calciumniveauer før påbegyndelse af PREVACID 30mg eller PREVACID SoluTab og periodisk under behandling hos patienter med en allerede eksisterende risiko for hypocalcæmi (f.eks. hypoparathyroidisme). Suppler med magnesium og/eller calcium efter behov. Hvis hypocalcæmi er refraktær over for behandling, skal du overveje at seponere PPI.
Interaktioner med undersøgelser for neuroendokrine tumorer
Serumchromogranin A (CgA) niveauer stiger sekundært til lægemiddelinducerede fald i mavesyreindholdet. Det øgede CgA-niveau kan forårsage falske positive resultater i diagnostiske undersøgelser for neuroendokrine tumorer. Sundhedsudbydere bør midlertidigt stoppe lansoprazolbehandlingen mindst 14 dage før vurdering af CgA-niveauer og overveje at gentage testen, hvis de initiale CgA-niveauer er høje. Hvis der udføres serielle tests (f.eks. til overvågning), bør det samme kommercielle laboratorium bruges til test, da referenceintervaller mellem test kan variere [se DRUGSINTERAKTIONER , KLINISK FARMAKOLOGI ].
Interaktion med methotrexat
Litteraturen tyder på, at samtidig brug af PPI'er med methotrexat (primært i høje doser) kan hæve og forlænge serumniveauer af methotrexat og/eller dets metabolit, hvilket muligvis kan føre til methotrexattoksicitet. Ved højdosis methotrexatadministration kan en midlertidig seponering af PPI overvejes hos nogle patienter [se DRUGSINTERAKTIONER , KLINISK FARMAKOLOGI ].
Patienter med phenylketonuri
Phenylalanin kan være skadeligt for patienter med phenylketonuri (PKU). PREVACID 30mg SoluTab indeholder phenylalanin, en komponent af aspartam. Hver 15 mg tablet indeholder 2,5 mg, og hver 30 mg tablet indeholder 5,1 mg phenylalanin. Før du ordinerer PREVACID SoluTab til en patient med PKU, skal du overveje den kombinerede daglige mængde phenylalanin fra alle kilder, inklusive PREVACID 30 mg SoluTab.
Fundiske kirtelpolypper
PPI-brug er forbundet med en øget risiko for fundiske kirtelpolypper, der øges ved langvarig brug, især ud over et år. De fleste PPI-brugere, som udviklede fundiske kirtelpolypper, var asymptomatiske, og fundiske kirtelpolypper blev identificeret ved endoskopi. Brug den korteste varighed af PPI-behandling, der passer til den tilstand, der behandles.
Risiko for fortykkelse af hjerteklap hos pædiatriske patienter under et år
PREVACID 30mg og PREVACID SoluTab er ikke godkendt til pædiatriske patienter under et år. Ikke-kliniske undersøgelser med unge rotter med lansoprazol har vist en negativ effekt af hjerteklapsfortykkelse. Risikoen for hjerteklapskade ser ikke ud til at være relevant for patienter i alderen 1 år og ældre [se Brug i specifikke populationer ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning og Brugsanvisning ).
Rådgive patienter om at:
Akut Tubulointerstitiel nefritis
Ring til deres læge, hvis de oplever tegn og/eller symptomer forbundet med akut tubulointerstitiel nefritis [se ADVARSLER OG FORHOLDSREGLER ].
Clostridium Difficile-associeret diarré
At straks ringe til deres læge, hvis de oplever diarré, der ikke forbedres [se ADVARSLER OG FORHOLDSREGLER ].
Knoglebrud
For at rapportere eventuelle brud, især i hoften, håndleddet eller rygsøjlen, til deres læge [se ADVARSLER OG FORHOLDSREGLER ].
Alvorlige kutane bivirkninger
For at seponere PREVACID eller PREVACID 30mg SoluTab og straks ringe til deres læge for yderligere evaluering [se ADVARSLER OG FORHOLDSREGLER ].
Kutan og systemisk lupus erythematosus
At straks ringe til deres læge for enhver ny eller forværring af symptomer forbundet med kutan eller systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ].
Cyanocobalamin (vitamin B12) mangel
 At rapportere eventuelle kliniske symptomer, der kan være forbundet med cyanocobalaminmangel, til deres læge, hvis de har fået PREVACID eller PREVACID SoluTab i mere end tre år [se ADVARSLER OG FORHOLDSREGLER ].
Hypomagnesæmi og mineral
Metabolisme At rapportere eventuelle kliniske symptomer, der kan være forbundet med hypomagnesiæmi, hypocalcæmi og/eller hypokaliæmi til deres læge, hvis de har fået PREVACID eller PREVACID 15 mg SoluTab i mindst tre måneder [se ADVARSLER OG FORHOLDSREGLER ].
Lægemiddelinteraktioner
Råd patienter til at rapportere til deres læge, hvis de tager rilpivirin-holdige produkter [se KONTRAINDIKATIONER ] eller højdosis methotrexat [se ADVARSLER OG FORHOLDSREGLER ].
Graviditet
Informer en gravid kvinde om den potentielle risiko for et foster. Rådgiv kvinder med reproduktionspotentiale om at informere deres læge om en kendt eller formodet graviditet [se Brug i specifikke populationer ].
Administration
- Glemte doser: Hvis en dosis glemmes, indgives så hurtigt som muligt. Men hvis den næste planlagte dosis er på vej, skal du ikke tage den glemte dosis, og tage den næste dosis til tiden. Tag ikke to doser ad gangen for at kompensere for en glemt dosis.
- PREVACID eller PREVACID 30mg SoluTab bør tages før spisning.
- Du må ikke knuse eller tygge PREVACID 15mg kapsel eller PREVACID SoluTab.
- Tag PREVACID eller PREVACID 30 mg SoluTab mindst 30 minutter før sucralfat.
- Phenylketonurics: Indeholder phenylalanin 2,5 mg pr. 15 mg PREVACID 30mg SoluTab-tablet og 5,1 mg pr. 30 mg PREVACID SoluTab-tablet.
PREVACID kapsler
- Synke hele; ikke tygge.
- Til patienter, der har svært ved at sluge kapsler:
- PREVACID 15mg kapsler kan åbnes og drysses på æblemos, ENSURE budding, hytteost, yoghurt eller siede pærer
- PREVACID 15mg kapsler kan også tømmes i en lille mængde af enten æblejuice, appelsinjuice eller tomatjuice
- Alternativt kan PREVACID-kapsler indgives med æblejuice via nasogastrisk sonde
- Se brugsanvisningen for en beskrivelse af alle forberedelses- og administrationsanvisninger
PREVACID SoluTab
- Må ikke brydes eller skæres.
- Placer tabletten på tungen; lad det gå i opløsning, med eller uden vand, indtil partiklerne kan sluges. Tyg ikke partiklerne.
- Tabletten går typisk i opløsning på mindre end et minut.
- Alternativt kan PREVACID 30mg SoluTab til børn eller andre patienter, der har svært ved at synke tabletter, administreres med vand via oral sprøjte eller NG-slange, som beskrevet i brugsanvisningen.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
to 24 måneders karcinogenicitetsundersøgelser blev Sprague-Dawley-rotter behandlet med orale lansoprazoldoser på 5 til 150 mg/kg/dag, ca. af gennemsnitshøjde [1,46 m² kropsoverfladeareal (BSA)] givet den anbefalede humane dosis på 30 mg/dag. Lansoprazol producerede dosisrelateret gastrisk enterochromaffin-lignende (ECL) cellehyperplasi og ECL-cellecarcinoider hos både han- og hunrotter. Det øgede også forekomsten af intestinal metaplasi af det gastriske epitel hos begge køn. Hos hanrotter producerede lansoprazol en dosisrelateret stigning i testikel-interstitielle celleadenomer. Forekomsten af disse adenomer hos rotter, der fik doser på 15 til 150 mg/kg/dag (fire til 40 gange den anbefalede humane dosis baseret på BSA), oversteg den lave baggrundshyppighed (interval = 1,4 til 10%) for denne rottestamme.
et 24 måneders karcinogenicitetsstudie blev CD-1 mus behandlet med orale lansoprazoldoser på 15 til 600 mg/kg/dag, to til 80 gange den anbefalede humane dosis baseret på BSA. Lansoprazol gav en dosisrelateret øget forekomst af gastrisk ECL-cellehyperplasi. Det gav også en øget forekomst af levertumorer (hepatocellulært adenom plus karcinom). Tumorforekomsten hos hanmus behandlet med 300 og 600 mg/kg/dag (40 til 80 gange den anbefalede humane dosis baseret på BSA) og hunmus behandlet med 150 til 600 mg/kg/dag (20 til 80 gange den anbefalede humane dosis) dosis baseret på BSA) oversteg intervallerne for baggrundsincidenser i historiske kontroller for denne musestamme. Lansoprazolbehandling frembragte adenom i rete testis hos hanmus, der fik 75 til 600 mg/kg/dag (10 til 80 gange den anbefalede humane dosis baseret på BSA).
En 26 ugers p53 (+/-) transgen mus carcinogenicitetsundersøgelse var ikke positiv.
Lansoprazol var positivt i Ames-testen og in vitro-analysen af human lymfocytkromosomafvigelse. Lansoprazol var ikke genotoksisk i ex vivo-rottehepatocyt-unscheduled DNA-syntese (UDS)-testen, in vivo-mus mikronucleus-testen eller rotteknoglemarvscelle-kromosomafvigelsestesten.
Lansoprazol i orale doser op til 150 mg/kg/dag (40 gange den anbefalede humane dosis baseret på BSA) viste sig ikke at have nogen effekt på fertilitet og reproduktionsevne hos han- og hunrotter.
Brug i specifikke populationer
Graviditet
Risikooversigt
Tilgængelige data fra publicerede observationsstudier indikerer generelt ikke en sammenhæng mellem uønskede graviditetsudfald med lansoprazolbehandling (se Data ).
I reproduktionsstudier på dyr medførte oral administration af lansoprazol til rotter under organogenese gennem amning ved 6,4 gange den maksimale anbefalede humane dosis reduktioner hos afkommet i lårbensvægt, lårbenslængde, krone-rump-længde og vækstpladetykkelse (kun hanner) på postnatal dag 21 (se Data ). Disse virkninger var forbundet med reduktion i kropsvægtøgning. Informer gravide kvinder om den potentielle risiko for fosteret.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for de angivne populationer er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 til 4 % og 15 til 20 %.
Hvis PREVACID 15mg eller PREVACID 15mg SoluTab administreres sammen med clarithromycin, gælder graviditetsoplysningerne for clarithromycin også for kombinationsregimet. Se ordinationsinformationen for clarithromycin for mere information om brug under graviditet.
Data
Menneskelige data
Tilgængelige data fra publicerede observationsstudier viste ikke en sammenhæng mellem uønskede graviditetsrelaterede udfald og lansoprazolbrug. Metodiske begrænsninger af disse observationsstudier kan ikke med sikkerhed fastslå eller udelukke nogen lægemiddelassocieret risiko under graviditet. I et prospektivt studie foretaget af European Network of Teratology Information Services blev resultaterne fra en gruppe på 62 gravide kvinder, der fik administreret median daglige doser på 30 mg lansoprazol, sammenlignet med en kontrolgruppe på 868 gravide kvinder, som ikke tog nogen PPI'er. Der var ingen forskel i antallet af større misdannelser mellem kvinder, der blev eksponeret for PPI'er og kontrolgruppen, svarende til en relativ risiko (RR)=1,04, [95 % konfidensinterval (CI) 0,25-4,21]. I et populationsbaseret retrospektivt kohortestudie, der dækkede alle levende fødte i Danmark fra 1996 til 2008, var der ingen signifikant stigning i større fødselsdefekter under analyse af første trimester eksponering for lansoprazol hos 794 levendefødte børn. En metaanalyse, der sammenlignede 1.530 gravide kvinder udsat for PPI'er i mindst første trimester med 133.410 ueksponerede gravide, viste ingen signifikant stigning i risikoen for medfødte misdannelser eller spontan abort med eksponering for PPI'er (for større misdannelser Odds Ratio (OR)=1,12 , [95 % CI 0,86-1,45] og for spontane aborter OR=1,29, [95 % CI 0,841,97]).
Dyredata
Der forekom ingen bivirkninger på embryo-føtal udvikling i undersøgelser udført på drægtige rotter ved orale lansoprazoldoser op til 150 mg/kg/dag (40 gange den anbefalede humane dosis [30 mg/dag] baseret på kropsoverfladeareal) administreret under organogenese og gravide kaniner ved orale lansoprazoldoser op til 30 mg/kg/dag (16 gange den anbefalede humane dosis baseret på kropsoverfladeareal) administreret under organogenese.
Et præ- og postnatalt udviklingstoksicitetsstudie hos rotter med yderligere endepunkter for at evaluere knogleudvikling blev udført med lansoprazol i orale doser på 10 til 100 mg/kg/dag (0,7 til 6,4 gange den maksimalt anbefalede human lansoprazoldosis på 30 mg baseret på AUC [areal under plasmakoncentration-tid-kurven]) administreret under organogenese gennem laktation. Maternelle virkninger observeret ved 100 mg/kg/dag (6,4 gange den maksimale anbefalede humane lansoprazoldosis på 30 mg baseret på AUC) omfattede øget drægtighedsperiode, nedsat kropsvægtøgning under graviditeten og nedsat fødeindtagelse. Antallet af dødfødsler blev øget ved denne dosis, hvilket kan have været sekundært til maternel toksicitet. Legemsvægten for unger blev reduceret med 100 mg/kg/dag fra dag 11 efter fødslen. Lårbensvægt, lårbenslængde og krone-rumpslængde blev reduceret med 100 mg/kg/dag på dag 21 efter fødslen. Lårbensvægt var stadig faldet i 100 mg/kg/dag-gruppen i alderen 17 til 18 uger. Vækstpladetykkelsen faldt hos mændene på 100 mg/kg/dag på postnatal dag 21 og blev øget hos mændene på 30 og 100 mg/kg/dag i alderen 17 til 18 uger. Virkningerne på knogleparametre var forbundet med reduktion i kropsvægtøgning.
Amning
Risikooversigt
Der er ingen information om tilstedeværelsen af lansoprazol i modermælk, virkningerne på det ammede spædbarn eller virkningerne på mælkeproduktionen. Imidlertid er lansoprazol og dets metabolitter til stede i rottemælk. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for PREVACID 30mg eller PREVACID 30mg SoluTab og eventuelle negative virkninger på det ammede barn fra PREVACID 30mg eller PREVACID SoluTab eller fra den underliggende moderens tilstand.
Pædiatrisk brug
Sikkerheden og effektiviteten af PREVACID 15mg og PREVACID 30mg SoluTab er blevet fastslået hos pædiatriske patienter i alderen 1-17 år til korttidsbehandling af symptomatisk GERD og erosiv esophagitis.
kliniske undersøgelser af symptomatisk GERD og erosiv esophagitis blev PREVACID 30 mg ikke administreret ud over 12 uger til patienter i alderen 1 år til 11 år. Det vides ikke, om PREVACID 30mg og PREVACID SoluTab er sikre og effektive, hvis de bruges længere end den anbefalede varighed. Overskrid ikke den anbefalede dosis og varighed af brug hos pædiatriske patienter (se Toksicitetsdata for unge dyr ).
PREVACID var ikke effektivt hos pædiatriske patienter med symptomatisk GERD fra en måned til mindre end et år i et multicenter, dobbeltblindt, placebokontrolleret studie. Derfor er sikkerhed og effektivitet ikke blevet fastslået hos patienter under et år. Ikke-kliniske undersøgelser med unge rotter har vist en negativ effekt af hjerteklapsfortykkelse og knogleforandringer ved lansoprazoldoser, der er højere end den maksimalt anbefalede ækvivalente humane dosis.
Nyfødt til under et år
Lansoprazols farmakokinetik blev undersøgt hos pædiatriske patienter med GERD i alderen mindre end 28 dage og en til 11 måneder. Sammenlignet med raske voksne, der fik 30 mg, havde nyfødte højere eksponering (gennemsnitlige vægtbaserede normaliserede AUC-værdier 2,04 og 1,88 gange højere ved doser på henholdsvis 0,5 og 1 mg/kg/dag). Spædbørn i alderen ≤10 uger havde clearance- og eksponeringsværdier, der svarede til nyfødte. Spædbørn over 10 uger, som fik 1 mg/kg/dag, havde gennemsnitlige AUC-værdier, der svarede til voksne, der fik en dosis på 30 mg.
Lansoprazol viste sig ikke at være effektivt i et amerikansk og polsk fire ugers, multicenter, dobbeltblindet, placebokontrolleret, parallelgruppestudie af 162 patienter mellem en måned og under 12 måneder med symptomatisk GERD baseret på en sygehistorie af gråd/uro/irritabilitet forbundet med fodring, som ikke havde reageret på konservativ GERD-behandling (dvs. ikke-farmakologisk intervention) i syv til 14 dage. Patienter modtaget
lansoprazol som en suspension dagligt (0,2 til 0,3 mg/kg/dag hos spædbørn ≤10 uger eller 1,0 til 1,5 mg/kg/dag hos spædbørn over 10 uger eller placebo) i op til fire ugers dobbeltblind behandling.
Det primære effektmål blev vurderet ved mere end 50 % reduktion fra baseline i enten procentdelen af fodringer med en episode med gråd/uro/irritabilitet eller varigheden (minutter) af en episode med gråd/uro/irritabilitet inden for en time efter fodring.
Der var ingen forskel i procentdelen af respondere mellem lansoprazol pædiatrisk suspension-gruppen og placebogruppen (54 % i begge grupper).
Der var ingen bivirkninger rapporteret i pædiatriske kliniske undersøgelser (en måned til under 12 måneder), som ikke tidligere er observeret hos voksne.
Baseret på resultaterne af fase 3-effektivitetsstudiet blev lansoprazol ikke vist at være effektivt. Derfor understøtter disse resultater ikke brugen af lansoprazol til behandling af symptomatisk GERD hos spædbørn.
Et år til 11 år
I et ukontrolleret, åbent, amerikansk multicenterstudie blev 66 pædiatriske patienter (et år til 11 år) med GERD tildelt, baseret på kropsvægt, til at modtage en startdosis på enten PREVACID 15 mg dagligt, hvis ≤30 kg eller PREVACID 30 mg dagligt, hvis mere end 30 kg administreret i otte til 12 uger. PREVACID-dosis blev øget (op til 30 mg to gange dagligt) hos 24 ud af 66 pædiatriske patienter efter to eller flere ugers behandling, hvis de forblev symptomatiske. Ved baseline havde 85 % af patienterne milde til moderate generelle GERD-symptomer (vurderet ved investigatorinterview), 58 % havde ikke-erosiv GERD og 42 % havde erosiv esophagitis (vurderet ved endoskopi).
Efter otte til 12 ugers behandling med PREVACID 15 mg viste intention-to-treat-analysen en cirka 50 % reduktion i hyppigheden og sværhedsgraden af GERD-symptomer.
Enogtyve af 27 patienter med erosiv øsofagitis blev helbredt efter otte uger, og 100 % af patienterne blev helbredt efter 12 uger ved endoskopi (tabel 4).
et studie med 66 pædiatriske patienter i aldersgruppen et år til 11 år efter behandling med PREVACID 15 mg givet oralt i doser på 15 mg dagligt til 30 mg to gange dagligt, svarede stigninger i serumgastrinniveauer til dem, der blev observeret i voksne undersøgelser. Mediane fastende serumgastrinniveauer steg 89 % fra 51 pg/ml ved baseline til 97 pg/ml [interkvartilområde (25. til 75. percentil) på 71 til 130 pg/ml] ved det sidste besøg.
Den pædiatriske sikkerhed af PREVACID 30 mg kapsler er blevet vurderet hos 66 pædiatriske patienter i alderen et til 11 år. Af de 66 patienter med GERD tog 85 % (56/66) PREVACID 30 mg i otte uger og 15 % (10/66) tog det i 12 uger.
De hyppigst rapporterede (to eller flere patienter) behandlingsrelaterede bivirkninger hos patienter i alderen 1 til 11 år (N=66) var forstoppelse (5 %) og hovedpine (3 %).
Tolv år til 17 år
et ukontrolleret, åbent, amerikansk multicenterstudie blev 87 unge patienter (12 år til 17 år) med symptomatisk GERD behandlet med PREVACID i otte til 12 uger. Baseline øvre endoskopier klassificerede disse patienter i to grupper: 64 (74 %) ikke-erosiv GERD og 23 (26 %) erosiv esophagitis (EE). De ikke-erosive GERD-patienter fik PREVACID 15 mg dagligt i otte uger, og EE-patienterne fik PREVACID 30 mg dagligt i otte til 12 uger. Ved baseline havde 89 % af disse patienter milde til moderate generelle GERD-symptomer (vurderet af investigator-interviews). I løbet af otte ugers behandling med PREVACID 15 mg oplevede unge patienter en 63 % reduktion i hyppigheden og en 69 % reduktion i sværhedsgraden af GERD-symptomer baseret på dagbogsresultater.
Enogtyve ud af 22 (95,5 %) patienter med erosiv øsofagitis hos unge blev helbredt efter otte ugers behandling med PREVACID 15 mg. En patient forblev uhelbredt efter 12 ugers behandling (tabel 5).
Hos disse 87 unge patienter svarede stigninger i serumgastrinniveauer til dem, der blev observeret i voksne undersøgelser, median fastende serumgastrinniveauer steg 42 % fra 45 pg/ml ved baseline til 64 pg/ml [interkvartilområde (25. til 75. percentil) af 44 til 88 pg/ml] ved det sidste besøg. (Normale serumgastrinniveauer er 25 til 111 pg/ml.)
Sikkerheden af PREVACID kapsler er blevet vurderet hos disse 87 unge patienter. Af de 87 unge patienter med GERD tog 6 % (5/87) PREVACID 15 mg i mindre end seks uger, 93 % (81/87) i seks til 10 uger og 1 % (1/87) i mere end 10 uger .
De hyppigst rapporterede (mindst 3 %) behandlingsrelaterede bivirkninger hos disse patienter var hovedpine (7 %), mavesmerter (5 %), kvalme (3 %) og svimmelhed (3 %). Behandlingsrelateret svimmelhed, rapporteret i denne ordinationsinformation som forekommende hos mindre end 1 % af voksne patienter, blev rapporteret i denne undersøgelse af tre unge patienter med ikke-eroderende GERD, som havde svimmelhed samtidig med andre reaktioner (såsom migræne, dyspnø, og opkastning).
Toksicitetsdata for unge dyr
Hjerteklapsfortykkelse
to orale toksicitetsundersøgelser forekom fortykkelse af mitralhjerteklappen hos unge rotter behandlet med lansoprazol. Hjerteklapfortykkelse blev primært observeret ved oral dosering påbegyndt på postnatal dag 7 (alder svarende til neonatale mennesker) og postnatal dag 14 (human aldersækvivalent på ca. et år) ved doser på 250 mg/kg/dag og højere (på postnatal dag 7 og postnatal dag 14, henholdsvis 6,2 gange og 4,2 gange den daglige pædiatriske dosis på 15 mg hos pædiatriske patienter i alderen et til 11 år, der vejer 30 kg eller mindre, baseret på AUC). Behandlingsvarigheden forbundet med hjerteklapsfortykkelse varierede fra 5 dage til 8 uger. Resultaterne vendte eller vendte mod reversibilitet efter en 4-ugers medicinfri restitutionsperiode. Forekomsten af hjerteklapfortykkelse efter påbegyndelse af dosering på postnatal dag 21 (menneskelig aldersækvivalent på ca. to år) var begrænset til en enkelt rotte (1/24) i grupper givet 500 mg/kg/dag i 4 eller 8 uger (ca. 5,2 gange den daglige pædiatriske dosis på 15 mg til pædiatriske patienter i alderen 1-11 år, der vejer 30 kg eller derunder, baseret på AUC). Baseret på eksponeringsmarginer synes risikoen for hjerteklapskade ikke at være relevant for patienter fra 1 år og ældre.
Knogleforandringer
I en otte ugers oral toksicitetsundersøgelse med unge rotter med dosering påbegyndt på postnatal dag 7, doser lig med eller større end 100 mg/kg/dag (2,5 gange den daglige pædiatriske dosis på 15 mg til børn i alderen 1 til 11 år, der vejer 30 år) kg eller mindre, baseret på AUC) producerede forsinket vækst, med svækkelse af vægtøgning observeret så tidligt som postnatal dag 10 (alder svarende til neonatale mennesker). Ved afslutningen af behandlingen inkluderede tegnene på svækket vækst ved 100 mg/kg/dag og højere reduktioner i kropsvægt (14 til 44 % sammenlignet med kontroller), absolut vægt af flere organer, lårbensvægt, lårbenslængde og krone. rump længde. Tykkelsen af lårbensvækstpladen blev kun reduceret hos mænd og kun ved dosis på 500 mg/kg/dag. Effekterne relateret til forsinket vækst fortsatte til slutningen af den fire uger lange genopretningsperiode. Langsigtede data blev ikke indsamlet.
Geriatrisk brug
Af det samlede antal patienter (n=21.486) i kliniske undersøgelser af PREVACID var 16 % af patienterne i alderen 65 år og derover, mens 4 % var 75 år og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse patienter og yngre patienter, og anden rapporteret klinisk erfaring har ikke identificeret signifikante forskelle i respons mellem geriatriske og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes [se KLINISK FARMAKOLOGI ].

Nedsat leverfunktion
Hos patienter med forskellige grader af kronisk leverinsufficiens var eksponeringen for lansoprazol øget sammenlignet med raske forsøgspersoner med normal leverfunktion [se KLINISK FARMAKOLOGI ]. Ingen dosisjustering for PREVACID eller PREVACID SoluTab er nødvendig for patienter med let (Child-Pugh Klasse A) eller moderat (Child-Pugh Klasse B) nedsat leverfunktion. Den anbefalede dosis er 15 mg oralt dagligt til patienter med svært nedsat leverfunktion (Child-Pugh klasse C) [se DOSERING OG ADMINISTRATION ].
OVERDOSIS
Lansoprazol fjernes ikke fra kredsløbet ved hæmodialyse. I en rapporteret overdosis indtog en patient 600 mg PREVACID 15 mg uden bivirkninger. Orale lansoprazoldoser op til 5000 mg/kg hos rotter [ca. 1300 gange den humane dosis på 30 mg baseret på kropsoverfladeareal (BSA)] og hos mus (ca. 675,7 gange den humane dosis på 30 mg baseret på BSA) forårsagede ikke dødsfald eller eventuelle kliniske tegn.
I tilfælde af overeksponering bør behandlingen være symptomatisk og støttende.
Hvis der opstår overeksponering, skal du ringe til dit giftkontrolcenter på 1-800-222-1222 for aktuelle oplysninger om håndtering af forgiftning eller overeksponering.
KONTRAINDIKATIONER
- PREVACID 15mg og PREVACID 15mg SoluTab er kontraindiceret til patienter med kendt overfølsomhed over for en hvilken som helst komponent i formuleringen. Overfølsomhedsreaktioner kan omfatte anafylaksi, anafylaktisk shock, angioødem, bronkospasme, akut tubulointerstitiel nefritis og nældefeber [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ].
- Protonpumpehæmmere (PPI'er), inklusive PREVACID og PREVACID SoluTab, er kontraindiceret med rilpivirinholdige produkter [se DRUGSINTERAKTIONER ].
- For information om kontraindikationer af antibakterielle midler (clarithromycin og amoxicillin) indiceret i kombination med PREVACID eller PREVACID 30mg SoluTab henvises til afsnittet Kontraindikationer i deres ordinationsinformation.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Lansoprazol tilhører en klasse af antisekretoriske forbindelser, de substituerede benzimidazoler, der undertrykker mavesyresekretion ved specifik inhibering af (H+, K+)-ATPase-enzymsystemet ved den sekretoriske overflade af maveparietalcellen. Fordi dette enzymsystem betragtes som syrepumpen (proton) i parietalcellen, er lansoprazol blevet karakteriseret som en mavesyrepumpehæmmer, idet den blokerer det sidste trin i syreproduktionen. Denne effekt er dosisrelateret og fører til hæmning af både basal og stimuleret mavesyresekretion uanset stimulus. Lansoprazol udviser ikke antikolinerg eller histamin type-2 antagonistaktivitet.
Farmakodynamik
Antisekretorisk aktivitet
Efter oral administration viste lansoprazol sig at reducere basalsyreproduktionen signifikant og signifikant øge den gennemsnitlige mave-pH og procentvis af tid, hvor gastrisk pH var større end tre og større end fire. Lansoprazol reducerede også markant måltidsstimuleret mavesyreproduktion og sekretionsvolumen, såvel som pentagastrinstimuleret syreproduktion. Hos patienter med hypersekretion af syre reducerede lansoprazol signifikant den basale og pentagastrinstimulerede mavesyresekretion. Lansoprazol hæmmede den normale stigning i sekretionsvolumen, surhedsgrad og syreproduktion induceret af insulin.
De intragastriske pH-resultater af et fem-dages, farmakodynamisk, crossover-studie med 15 og 30 mg lansoprazol én gang dagligt er vist i tabel 6:
Efter startdosis i denne undersøgelse blev der set øget gastrisk pH inden for en til to timer med 30 mg lansoprazol og to til tre timer med 15 mg lansoprazol. Efter flere daglige doseringer blev der set øget gastrisk pH inden for den første time efter dosering med 30 mg lansoprazol og inden for en til to timer efter dosering med 15 mg lansoprazol.
Syresuppression kan øge effekten af antimikrobielle stoffer til at udrydde Helicobacter pylori (H. pylori). Procentdelen af den tid, gastrisk pH var forhøjet til over fem, og seks blev evalueret i en crossover-undersøgelse af PREVACID givet dagligt, to gange dagligt og tre gange dagligt (tabel 7).
Hæmningen af mavesyresekretion målt ved intragastrisk pH vendte gradvist tilbage til normal i løbet af to til fire dage efter flere doser. Der var ingen indikation af rebound gastrisk surhed.
Enterochromaffin-lignende (ECL) celleeffekter
Under livstidseksponering af rotter med op til 150 mg/kg/dag af lansoprazol doseret syv dage om ugen, blev der observeret markant hypergastrinæmi efterfulgt af ECL-celleproliferation og dannelse af carcinoide tumorer, især hos hunrotter. Mavebiopsiprøver fra mavekroppen fra ca. 150 patienter behandlet kontinuerligt med lansoprazol i mindst et år viste ikke tegn på ECL-celleeffekter svarende til dem, der er set i rotteundersøgelser. Langtidsdata er nødvendige for at udelukke muligheden for en øget risiko for udvikling af gastriske tumorer hos patienter, der får langtidsbehandling med lansoprazol [se Ikke-klinisk toksikologi ].
Andre mavepåvirkninger hos mennesker
Lansoprazol påvirkede ikke slimhindeblodgennemstrømningen i fundus i maven signifikant. På grund af den normale fysiologiske virkning forårsaget af hæmningen af mavesyresekretion, blev der set et fald på ca. 17 % i blodgennemstrømningen i antrum, pylorus og duodenal bulb. Lansoprazol bremsede markant mavetømningen af fordøjelige faste stoffer. Lansoprazol øgede serumpepsinogenniveauer og nedsatte pepsinaktivitet under basale forhold og som reaktion på måltidsstimulering eller insulininjektion. Som med andre midler, der hæver intragastrisk pH, var stigninger i mave-pH forbundet med stigninger i nitratreducerende bakterier og forhøjet nitritkoncentration i mavesaft hos patienter med mavesår. Der blev ikke observeret nogen signifikant stigning i nitrosaminkoncentrationer.
Serum Gastrin Effekter
Hos over 2100 patienter steg mediane fastende serumgastrinniveauer 50 til 100 % fra baseline, men forblev inden for normalområdet efter behandling med 15 til 60 mg oral lansoprazol. Disse stigninger nåede et plateau inden for to måneder efter behandlingen og vendte tilbage til niveauerne før behandlingen inden for fire uger efter seponering af behandlingen.
Øget gastrin forårsager enterochromaffin-lignende cellehyperplasi og øgede serum-CgA-niveauer. De øgede CgA-niveauer kan forårsage falske positive resultater i diagnostiske undersøgelser for neuroendokrine tumorer [se ADVARSLER OG FORHOLDSREGLER ].
Endokrine virkninger
Menneskelige undersøgelser i op til et år har ikke påvist nogen klinisk signifikant virkning på det endokrine system. Undersøgte hormoner omfatter testosteron, luteiniserende hormon (LH), follikelstimulerende hormon (FSH), kønshormonbindende globulin (SHBG), dehydroepiandrosteronsulfat (DHEA-S), prolaktin, cortisol, østradiol, insulin, aldosteron, parathormon, glukagon, skjoldbruskkirtelstimulerende hormon (TSH), triiodothyronin (T3), thyroxin (T4) og somatotropt hormon (STH). Lansoprazol i orale doser på 15 til 60 mg i op til et år havde ingen klinisk signifikant effekt på seksuel funktion. Derudover havde lansoprazol i orale doser på 15 til 60 mg i to til otte uger ingen klinisk signifikant effekt på skjoldbruskkirtelfunktionen. I 24 måneders karcinogenicitetsundersøgelser hos Sprague-Dawley-rotter med daglige lansoprazoldoser på op til 150 mg/kg var proliferative ændringer i Leydig-cellerne i testiklerne, inklusive benign neoplasma, øget sammenlignet med kontrolrotter.
Andre effekter
Der er ikke fundet nogen systemisk effekt af lansoprazol på centralnervesystemet, lymfoide, hæmatopoietiske, renale, hepatiske, kardiovaskulære eller respiratoriske systemer hos mennesker. Blandt 56 patienter, som havde omfattende baseline øjenvurderinger, blev der ikke observeret nogen visuel toksicitet efter lansoprazolbehandling (op til 180 mg/dag) i op til 58 måneder. Efter livslang eksponering for lansoprazol hos rotter blev der set fokal pancreasatrofi, diffus lymfoid hyperplasi i thymus og spontan retinal atrofi.
Farmakokinetik
Absorption
PREVACID 15mg og PREVACID SoluTab indeholder en enterisk coatet granulatformulering af lansoprazol (fordi lansoprazol er syrelabil), således at absorptionen af lansoprazol først begynder, efter at granulatet forlader maven. De gennemsnitlige maksimale plasmaniveauer af lansoprazol forekommer efter ca. 1,7 timer. Efter en enkeltdosis administration af 15 til 60 mg oral lansoprazol var peak plasmakoncentrationer (Cmax) af lansoprazol og arealet under plasmakoncentrationskurverne (AUC'er) for lansoprazol omtrent proportionelle med den administrerede dosis. Lansoprazol akkumuleres ikke, og dets farmakokinetik er uændret ved gentagen dosering. Den absolutte biotilgængelighed er over 80%. Hos raske forsøgspersoner var den gennemsnitlige (±SD) plasmahalveringstid 1,5 (±1,0) timer. Både Cmax og AUC formindskes med ca. 50 til 70 %, hvis lansoprazol gives 30 minutter efter mad, sammenlignet med den fastende tilstand. Der er ingen signifikant fødevareeffekt, hvis lansoprazol gives før måltider.
Fordeling
Lansoprazol er 97 % bundet til plasmaproteiner. Plasmaproteinbinding er konstant over koncentrationsområdet på 0,05 til 5 mcg/ml.
Elimination
Metabolisme
Lansoprazol metaboliseres i vid udstrækning i leveren. To metabolitter er blevet identificeret i målbare mængder i plasma (de hydroxylerede sulfinyl- og sulfonderivater af lansoprazol). Disse metabolitter har meget lille eller ingen antisekretorisk aktivitet. Lansoprazol menes at blive transformeret til to aktive arter, som hæmmer syresekretion ved at blokere protonpumpen [(H+, K+)-ATPase-enzymsystemet] ved den sekretoriske overflade af maveparietalcellen. De to aktive arter er ikke til stede i det systemiske kredsløb. Halveringstiden for plasmaeliminering af lansoprazol er mindre end to timer, mens den syrehæmmende virkning varer mere end 24 timer. Derfor afspejler plasmaelimineringshalveringstiden for lansoprazol ikke dets varighed af suppression af mavesyresekretion.
Udskillelse
Efter oral enkeltdosis administration af PREVACID blev stort set ingen uændret lansoprazol udskilt i urinen. I en undersøgelse, efter en enkelt oral dosis af 14Clansoprazol, blev ca. en tredjedel af den administrerede stråling udskilt i urinen, og to tredjedele blev genfundet i fæces. Dette indebærer en signifikant galdeudskillelse af lansoprazolmetabolitterne.
Specifikke populationer
Pædiatriske patienter
1-17 år
Lansoprazols farmakokinetik blev undersøgt hos pædiatriske patienter med GERD i alderen et til 11 år og 12 til 17 år i to separate kliniske undersøgelser. Hos børn i alderen 1 til 11 år blev lansoprazol doseret 15 mg dagligt til forsøgspersoner, der vejede ≤30 kg, og 30 mg dagligt til forsøgspersoner, der vejede mere end 30 kg. Gennemsnitlige Cmax- og AUC-værdier observeret på dag 5 af doseringen var ens mellem de to dosisgrupper og var ikke påvirket af vægt eller alder inden for hver vægtjusteret dosisgruppe anvendt i undersøgelsen. Hos unge forsøgspersoner i alderen 12 til 17 år blev forsøgspersonerne randomiseret til at modtage lansoprazol på 15 eller 30 mg dagligt. Gennemsnitlige Cmax- og AUC-værdier for lansoprazol blev ikke påvirket af kropsvægt eller alder; og næsten dosisproportionale stigninger i gennemsnitlige Cmax- og AUC-værdier blev observeret mellem de to dosisgrupper i undersøgelsen. Overordnet set var lansoprazols farmakokinetik hos pædiatriske patienter i alderen 1 til 17 år den samme som hos raske voksne forsøgspersoner.
Geriatriske patienter
Clearance af lansoprazol er nedsat hos ældre, med en halveringstid på ca. 50 til 100 %. Da den gennemsnitlige halveringstid hos ældre forbliver mellem 1,9 og 2,9 timer, resulterer gentagen dosering én gang dagligt ikke i akkumulering af lansoprazol. Maksimal plasmaniveauer var ikke øget hos ældre [se Brug i specifikke populationer ].
Mandlige og kvindelige patienter
I en undersøgelse, der sammenlignede 12 mandlige og seks kvindelige forsøgspersoner, som fik lansoprazol, blev der ikke fundet nogen kønsrelaterede forskelle i farmakokinetik og intragastriske pH-resultater.
Race- eller etniske grupper
De samlede gennemsnitlige farmakokinetiske parametre for PREVACID fra tolv amerikanske undersøgelser (N=513) blev sammenlignet med de gennemsnitlige farmakokinetiske parametre fra to asiatiske undersøgelser (N=20). Gennemsnits-AUC'erne for PREVACID 30 mg hos asiatiske forsøgspersoner var ca. to gange dem, der ses i poolede amerikanske data; dog var den interindividuelle variabilitet høj. Cmax-værdierne var sammenlignelige.
Patienter med nedsat nyrefunktion
Hos patienter med svært nedsat nyrefunktion faldt plasmaproteinbindingen med 1 til 1,5 % efter administration af 60 mg lansoprazol. Patienter med nedsat nyrefunktion havde en forkortet eliminationshalveringstid og nedsat total AUC (fri og bundet). AUC for frit lansoprazol i plasma var imidlertid ikke relateret til graden af nedsat nyrefunktion; og Cmax og Tmax (tid til at nå den maksimale koncentration) var ikke anderledes end Cmax og Tmax fra forsøgspersoner med normal nyrefunktion. Lansoprazols farmakokinetik var derfor ikke klinisk anderledes hos patienter med mild, moderat eller svær nyreinsufficiens sammenlignet med raske forsøgspersoner med normal nyrefunktion.
Patienter med nedsat leverfunktion
Hos patienter med let (Child-Pugh Klasse A) eller moderat (Child-Pugh Klasse B) nedsat leverfunktion var der en omtrentlig 3-fold stigning i gennemsnitlig AUC sammenlignet med raske forsøgspersoner med normal leverfunktion efter flere orale doser på 30 mg PREVACID 30 mg i syv dage. Den tilsvarende gennemsnitlige plasmahalveringstid for lansoprazol blev forlænget fra 1,5 til fire timer (Child-Pugh A) eller fem timer (Child-Pugh B).
Hos patienter med kompenseret og dekompenseret cirrhose var der en omtrentlig 6- og 5-fold stigning i AUC, henholdsvis sammenlignet med raske forsøgspersoner med normal leverfunktion efter en enkelt oral dosis på 30 mg PREVACID [se DOSERING OG ADMINISTRATION , Brug i specifikke populationer ].
Lægemiddelinteraktionsstudier
Effekt af Lansoprazol på andre lægemidler
Cytokrom P450-interaktioner
Lansoprazol metaboliseres gennem cytochrom P450-systemet, specifikt gennem CYP3A og CYP2C19 isozymerne. Undersøgelser har vist, at PREVACID 15mg ikke har klinisk signifikante interaktioner med andre lægemidler, der metaboliseres af cytochrom P450-systemet, såsom warfarin, antipyrin, indomethacin, ibuprofen, phenytoin, propranolol, prednison, diazepam eller clarithromycin hos raske forsøgspersoner. Disse forbindelser metaboliseres gennem forskellige cytochrom P450 isozymer, herunder CYP1A2, CYP2C9, CYP2C19, CYP2D6 og CYP3A.
Theophyllin
Når PREVACID 30 mg blev administreret samtidig med theophyllin (CYP1A2, CYP3A), sås en mindre stigning (10 %) i clearance af theophyllin. På grund af den lille størrelse og retningen af virkningen på theophyllin-clearance, er det usandsynligt, at denne interaktion er af klinisk betydning [se DRUGSINTERAKTIONER ].
Methotrexat og 7-hydroxymethotrexat
et åbent, enkeltarmet, otte dages, farmakokinetisk studie af 28 voksne reumatoid arthritispatienter (som krævede kronisk brug af 7,5 til 15 mg methotrexat givet ugentligt), administration af syv dages naproxen 500 mg to gange dagligt og PREVACID 30 mg dagligt havde ingen effekt på farmakokinetikken af methotrexat og 7-hydroxymethotrexat. Selvom denne undersøgelse ikke var designet til at vurdere sikkerheden af denne kombination af lægemidler, blev der ikke noteret nogen større bivirkninger. Denne undersøgelse blev dog udført med lave doser af methotrexat. Et lægemiddelinteraktionsstudie med høje doser methotrexat er ikke blevet udført [se ADVARSLER OG FORHOLDSREGLER ].
Amoxicillin
PREVACID 30mg har heller ikke vist sig at have nogen klinisk signifikant interaktion med amoxicillin.
Sucralfat
I en enkeltdosis crossover-undersøgelse, der undersøgte PREVACID 30 mg administreret alene og samtidig med sucralfat 1 gram, blev absorptionen af lansoprazol forsinket, og biotilgængeligheden blev reduceret med 17 %, når det blev administreret samtidig med sucralfat [se DOSERING OG ADMINISTRATION , DRUGSINTERAKTIONER ].
Antacida
kliniske forsøg blev antacida administreret samtidig med PREVACID 15 mg, og der var ingen tegn på en ændring i virkningen af PREVACID.
Clopidogrel
Clopidogrel metaboliseres til dets aktive metabolit delvist af CYP2C19. En undersøgelse af raske forsøgspersoner, som var CYP2C19 omfattende metabolisatorer, som fik clopidogrel 75 mg én gang dagligt alene eller samtidig med PREVACID 30 mg (n=40), i ni dage, blev udført. Den gennemsnitlige AUC for den aktive metabolit af clopidogrel blev reduceret med ca. 14 % (gennemsnitlig AUC-ratio var 86 %, med 90 % CI på 80 til 92 %), når PREVACID blev administreret samtidigt sammenlignet med administration af clopidogrel alene.
Farmakodynamiske parametre blev også målt og viste, at ændringen i hæmning af trombocytaggregation (induceret af 5 mcM ADP) var relateret til ændringen i eksponeringen for den aktive clopidogrel-metabolit. Effekten på eksponeringen for den aktive metabolit af clopidogrel og på clopidogrel-induceret trombocythæmning anses ikke for at være klinisk vigtig.
Virkning af andre lægemidler på Lansoprazol
Da lansoprazol metaboliseres af CYP2C19 og CYP3A4, kan inducere og hæmmere af disse enzymer potentielt ændre eksponeringen af lansoprazol.
Mikrobiologi
Mikrobiologi
Lansoprazol, clarithromycin og/eller amoxicillin har vist sig at være aktive mod de fleste stammer af Helicobacter pylori in vitro og ved kliniske infektioner [se INDIKATIONER OG BRUG ].
Helicobacter Pylori forbehandlingsresistens
Clarithromycin-forbehandlingsresistens (≥2,0 mcg/ml) var 9,5 % (91/960) ved E-test og 11,3 % (12/106) ved agarfortynding i de kliniske dobbelt- og tredobbelte terapiforsøg (M93-125, M93-130, M93131, M95-392 og M95-399).
Amoxicillin-forbehandlingsfølsomme isolater (≤0,25 mcg/ml) forekom hos 97,8 % (936/957) og 98,0 % (98/100) af patienterne i de kliniske dobbelt- og tredobbelte terapiforsøg ved henholdsvis E-test og agarfortynding. Enogtyve ud af 957 patienter (2,2 %) ved E-test og to ud af 100 patienter (2,0 %) ved agarfortynding havde amoxicillin-forbehandlings-MIC'er på mere end 0,25 mcg/ml. Én patient i 14-dages tripelbehandlingsregimet havde en ubekræftet amoxicillin-minimumshæmmende koncentration (MIC) på mere end 256 mcg/ml ved E-test, og patienten blev udryddet af H. pylori (tabel 8).
Patienter, der ikke er udryddet af H. pylori efter trippelbehandling med lansoprazol/amoxicillin/clarithromycin, vil sandsynligvis have clarithromycin-resistent H. pylori. Derfor bør clarithromycin-følsomhedstestning udføres for de patienter, som ikke behandles, når det er muligt. Patienter med clarithromycin-resistent H. pylori bør ikke behandles med lansoprazol/amoxicillin/clarithromycin tripelterapi eller med regimer, der inkluderer clarithromycin som det eneste antimikrobielle middel.
Amoxicillin følsomhedstest resultater og kliniske/bakteriologiske resultater
de kliniske forsøg med dobbelt- og tredobbelt terapi blev 82,6 % (195/236) af de patienter, der havde amoxicillin-følsomme MIC'er (≤0,25 mcg/ml), udryddet af H. pylori før behandlingen. Af dem med forbehandling amoxicillin MIC'er på mere end 0,25 mcg/ml, havde tre ud af seks H. pylori udryddet. I alt 30 % (21/70) af patienterne svigtede lansoprazol 30 mg tre gange dagligt/amoxicillin 1 g tre gange dagligt dobbeltbehandling og i alt 12,8 % (22/172) af patienterne svigtede 10 og 14 dages triplen terapi regimer. Der blev ikke opnået følsomhedsresultater efter behandling på 11 af de patienter, som mislykkedes i behandlingen. Ni ud af de 11 patienter med amoxicillin efter behandlings-MIC'er, der svigtede den tredobbelte terapi-kur, havde også clarithromycin-resistente H. pylori-isolater.
Følsomhedstest for Helicobacter pylori
For følsomhedstest oplysninger om Helicobacter pylori, se Mikrobiologi afsnit i ordinationsinformation for clarithromycin og amoxicillin .
Kliniske Studier
Duodenalsår
et amerikansk multicenter, dobbeltblindt, placebokontrolleret, dosis-respons (15, 30 og 60 mg PREVACID én gang dagligt) undersøgelse af 284 patienter med endoskopisk dokumenteret duodenalsår, var procentdelen af patienter helbredt efter to og fire uger. signifikant højere med alle doser af PREVACID end med placebo. Der var ingen tegn på større eller tidligere respons med de to højere doser sammenlignet med PREVACID 15 mg. Baseret på denne undersøgelse og den anden undersøgelse, der er beskrevet nedenfor, er den anbefalede dosis af PREVACID 15 mg ved duodenalsår 15 mg dagligt (tabel 9).
PREVACID 15 mg var signifikant mere effektivt end placebo til at lindre dag- og natmavesmerter og til at mindske mængden af antacida indtaget pr. dag.
en anden amerikansk multicenterundersøgelse, også dobbeltblind, placebokontrolleret, dosissammenligning (15 og 30 mg PREVACID 15 mg én gang dagligt), og inklusive en sammenligning med ranitidin, hos 280 patienter med endoskopisk dokumenteret duodenalsår, viste procenten af patienter helbredt efter fire uger var signifikant højere med begge doser af PREVACID 15 mg end med placebo. Der var ingen tegn på større eller tidligere respons med den højere dosis af PREVACID. Selvom 15 mg-dosis af PREVACID var overlegen i forhold til ranitidin efter fire uger, efterlader manglen på signifikant forskel efter to uger og fraværet af en forskel mellem 30 mg PREVACID og ranitidin den komparative effektivitet af de to midler ubestemt (tabel 10) [ se INDIKATIONER OG BRUG ].
Udryddelse af H. pylori for at reducere risikoen for tilbagefald af duodenalsår
Randomiserede, dobbeltblindede kliniske undersøgelser udført i USA hos patienter med H. pylori og duodenalsår (defineret som et aktivt sår eller historie med et sår inden for et år) evaluerede effektiviteten af PREVACID i kombination med amoxicillin og clarithromycin som triple 14 dagsterapi eller i kombination med amoxicillin som dobbelt 14-dages behandling til udryddelse af H. pylori. Baseret på resultaterne af disse undersøgelser blev sikkerheden og effekten af to forskellige udryddelsesregimer fastlagt:
Tredobbelt terapi : PREVACID 30 mg to gange dagligt/amoxicillin 1 g to gange dagligt/clarithromycin 500 mg to gange dagligt
Dobbelt terapi : PREVACID 30 mg tre gange dagligt/amoxicillin 1 g tre gange dagligt
Alle behandlinger var på 14 dage. H. pylori-udryddelse blev defineret som to negative tests (kultur og histologi) fire til seks uger efter afslutningen af behandlingen.
Tredobbelt terapi viste sig at være mere effektivt end alle mulige kombinationer af dobbeltterapi. Dobbeltbehandling viste sig at være mere effektiv end begge monoterapier. Udryddelse af H. pylori har vist sig at reducere risikoen for tilbagefald af duodenalsår.
En randomiseret, dobbelt-blind klinisk undersøgelse udført i USA med patienter med H. pylori og duodenalsår (defineret som et aktivt sår eller historie med et sår inden for et år) sammenlignede effektiviteten af PREVACID tripelbehandling i 10 og 14 dage. Denne undersøgelse fastslog, at 10 dages tripelterapi svarede til 14 dages tripelterapi til udryddelse af H. pylori (tabel 11 og 12) [se INDIKATIONER OG BRUG ].
Vedligeholdelse af helede duodenalsår
PREVACID har vist sig at forhindre gentagelse af duodenalsår. To uafhængige, dobbeltblindede, multicenter, kontrollerede forsøg blev udført med patienter med endoskopisk bekræftede helede duodenalsår. Patienterne forblev helede betydeligt længere, og antallet af gentagelser af duodenalsår var signifikant mindre hos patienter behandlet med PREVACID 15 mg end hos patienter behandlet med placebo over en 12 måneders periode (tabel 13) [se INDIKATIONER OG BRUG ].
I forsøg #2 blev der ikke observeret nogen signifikant forskel mellem PREVACID 15 og 30 mg med hensyn til at opretholde remission.
Mavesår
I et amerikansk multicenter, dobbeltblindt, placebokontrolleret studie af 253 patienter med endoskopisk dokumenteret mavesår, var procentdelen af patienter, der blev helet efter fire og otte uger, signifikant højere med PREVACID 15 og 30 mg én gang dagligt end med placebo (tabel 14) ) [se INDIKATIONER OG BRUG ].
Patienter behandlet med en hvilken som helst PREVACID-dosis rapporterede signifikant færre mavesmerter dag og nat sammen med færre dages brug af antacida og færre antacida tabletter brugt om dagen end placebogruppen.
Uafhængig dokumentation af effektiviteten af PREVACID 30 mg blev leveret af en metaanalyse af publicerede og ikke-publicerede data.
Heling af NSAID-associeret mavesår
to amerikanske og canadiske multicenter, dobbeltblindede, aktiv-kontrollerede undersøgelser af patienter med endoskopisk bekræftet NSAID-associeret mavesår, som fortsatte deres NSAID-brug, var procentdelen af patienter helbredt efter otte uger statistisk signifikant højere med 30 mg PREVACID end med den aktive kontrol. I alt 711 patienter blev indskrevet i undersøgelsen, og 701 patienter blev behandlet. Patienterne varierede i alderen fra 18 til 88 år (medianalder 59 år), med 67 % kvindelige patienter og 33 % mandlige patienter. Race blev fordelt som følger: 87% kaukasisk, 8% sort, 5% andet. Der var ingen statistisk signifikant forskel mellem PREVACID 30 mg dagligt og den aktive kontrol med hensyn til symptomlindring (dvs. mavesmerter) (tabel 15) [se INDIKATIONER OG BRUG ].
Risikoreduktion af NSAID-associeret mavesår
en stor amerikansk, multicenter, dobbeltblind, placebo- og misoprostol-kontrolleret (misoprostol kun blindet for endoskopisten) undersøgelse hos patienter, som krævede kronisk brug af et NSAID, og som havde en historie med et endoskopisk dokumenteret mavesår, var andelen af patienter, der forblev fri for mavesår efter fire, otte og 12 uger, var signifikant højere med 15 eller 30 mg PREVACID 15 mg end placebo. I alt 537 patienter blev inkluderet i undersøgelsen, og 535 patienter blev behandlet. Patienter varierede i alder fra 23 til 89 år (medianalder 60 år), med 65 % kvindelige patienter og 35 % mandlige patienter. Race blev fordelt som følger: 90% kaukasisk, 6% sort, 4% andet. 30 mg-dosis af PREVACID viste ingen yderligere fordele i risikoreduktion af det NSAID-associerede mavesår end 15 mg-dosis (tabel 16) [se INDIKATIONER OG BRUG ].
Symptomatisk gastroøsofageal reflukssygdom (GERD)
Symptomatisk GERD
et amerikansk multicenter, dobbeltblindt, placebokontrolleret studie af 214 patienter med hyppige GERD-symptomer, men ingen esophageal erosioner ved endoskopi, blev der observeret signifikant større lindring af halsbrand forbundet med GERD ved administration af lansoprazol 15 mg én gang dagligt op til otte uger end med placebo. Der blev ikke observeret nogen signifikant yderligere fordel ved lansoprazol 30 mg én gang dagligt.
Intent-to-treat-analyserne viste signifikant reduktion i hyppigheden og sværhedsgraden af halsbrand dag og nat. Data for hyppighed og sværhedsgrad for den otte ugers behandlingsperiode er vist i tabel 17 og i figur 1 og 2:
Figur 1: Gennemsnitlig sværhedsgrad af halsbrand efter undersøgelsesdag for evaluerbare patienter (3=svær, 2=moderat, 1=mild, 0=ingen)
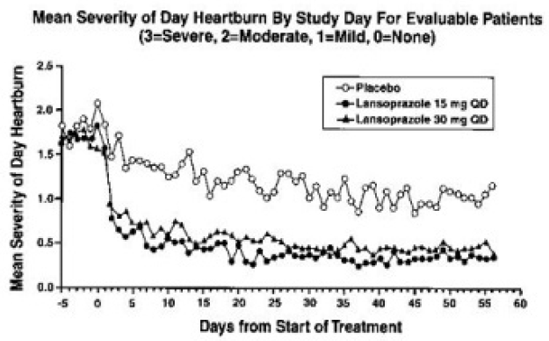
Figur 2: Gennemsnitlig sværhedsgrad af nathalsbrand efter undersøgelsesdag for evaluerbare patienter (3=svær, 2=moderat, 1=mild, 0=ingen)
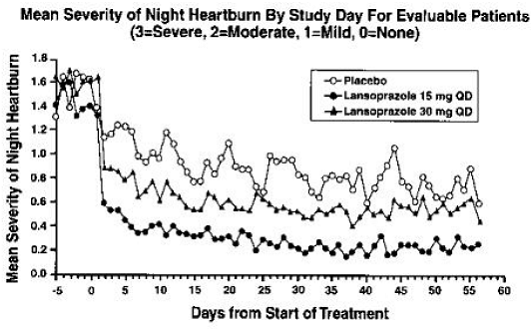
to amerikanske, multicenter dobbeltblindede, ranitidin-kontrollerede undersøgelser af i alt 925 patienter med hyppige GERD-symptomer, men ingen esophageal erosioner ved endoskopi, var lansoprazol 15 mg bedre end ranitidin 150 mg (to gange dagligt) med hensyn til at reducere hyppigheden og sværhedsgraden af dagen. og nathalsbrand forbundet med GERD i den otte ugers behandlingsperiode. Der blev ikke observeret nogen signifikant yderligere fordel ved lansoprazol 30 mg én gang dagligt [se INDIKATIONER OG BRUG ].
Erosiv esophagitis
I en amerikansk, multicenter, dobbeltblind, placebokontrolleret undersøgelse af 269 patienter, der kommer ind med en endoskopisk diagnose af esophagitis med slimhindegrad på to eller flere og grad tre og fire, der betyder erosiv sygdom, er procentdelen af patienter med heling vist i tabel 18:
denne undersøgelse rapporterede alle PREVACID-grupper signifikant større lindring af halsbrand og mindre mavesmerter dag og nat sammen med færre dages brug af syreneutraliserende midler og færre antacida tabletter taget om dagen end placebogruppen. Selvom alle doser var effektive, tyder den tidligere heling i de højere to doser på 30 mg dagligt som den anbefalede dosis.
PREVACID blev også sammenlignet i et amerikansk, multicenter, dobbeltblindt studie med en lav dosis ranitidin hos 242 patienter med erosiv refluks-øsofagitis. PREVACID i en dosis på 30 mg var signifikant mere effektivt end ranitidin 150 mg to gange dagligt som vist nedenfor (tabel 19).
Derudover rapporterede patienter behandlet med PREVACID 30 mg mindre halsbrand dag og nat og tog færre antacida tabletter i færre dage end patienter, der tog ranitidin 150 mg to gange dagligt.
Selvom denne undersøgelse viser effektiviteten af PREVACID 15 mg til at helbrede erosiv esophagitis, repræsenterer den ikke en tilstrækkelig sammenligning med ranitidin, fordi den anbefalede ranitidindosis til esophagitis er 150 mg fire gange dagligt, to gange den dosis, der blev brugt i denne undersøgelse.
I de to beskrevne forsøg og i flere mindre undersøgelser, der involverede patienter med moderat til svær erosiv esophagitis, frembragte PREVACID helingshastigheder svarende til dem, der er vist ovenfor.
et amerikansk, multicenter, dobbeltblindt, aktivt kontrolleret studie blev 30 mg PREVACID 30 mg sammenlignet med ranitidin 150 mg to gange dagligt hos 151 patienter med erosiv refluksøsofagitis, som reagerede dårligt på minimum 12 ugers behandling med mindst 12 ugers behandling. en H2-receptorantagonist givet i den dosis, der er angivet til symptomlindring eller større, nemlig cimetidin 800 mg/dag, ranitidin 300 mg/dag, famotidin 40 mg/dag eller nizatidin 300 mg/dag. PREVACID 30 mg var mere effektivt end ranitidin 150 mg to gange dagligt til at helbrede refluksøsofagitis, og procentdelen af patienter med heling var som følger. Denne undersøgelse udgør ikke en sammenligning af effektiviteten af histamin H2-receptorantagonister med PREVACID 30 mg, da alle patienter havde vist manglende respons på histamin H2-receptorantagonistbehandlingsmetoden. Det tyder dog på, at PREVACID 30 mg kan være nyttig til patienter, der fejler på en histamin H2-receptorantagonist (tabel 20) [se INDIKATIONER OG BRUG ].
Vedligeholdelse af heling af erosiv esophagitis
To uafhængige, dobbeltblindede, multicenter, kontrollerede forsøg blev udført med patienter med endoskopisk bekræftet helbredt esophagitis. Patienterne forblev i remission signifikant længere, og antallet af tilbagefald af erosiv esophagitis var signifikant mindre hos patienter behandlet med PREVACID 30 mg end hos patienter behandlet med placebo over en 12 måneders periode (tabel 21).
Uanset indledende grad af erosiv esophagitis var PREVACID 15 og 30 mg ens med hensyn til at opretholde remission.
et amerikansk, randomiseret, dobbeltblindt studie blev PREVACID 15 mg dagligt (n=100) sammenlignet med ranitidin 150 mg to gange dagligt (n=106), i den anbefalede dosis, hos patienter med endoskopisk dokumenteret helbredt erosiv esophagitis over en 12 måneders periode. Behandling med PREVACID 15 mg resulterede i, at patienter forblev helede (grad 0 læsioner) af erosiv esophagitis i signifikant længere perioder end dem, der blev behandlet med ranitidin (p INDIKATIONER OG BRUG ].
Patologiske hypersekretoriske tilstande, herunder Zollinger-Ellisons syndrom
åbne undersøgelser af 57 patienter med patologiske hypersekretoriske tilstande, såsom Zollinger-Ellisons syndrom (ZES) med eller uden multiple endokrine adenomer, hæmmede PREVACID 15mg signifikant mavesyresekretion og kontrollerede associerede symptomer på diarré, anoreksi og smerte. Doser varierende fra 15 mg hver anden dag til 180 mg pr. dag opretholdt basal syresekretion under 10 mEq/time hos patienter uden forudgående gastrisk operation og under 5 mEq/time hos patienter med tidligere gastrisk operation.
Startdoser blev titreret til den individuelle patientbehov, og justeringer var nødvendige med tiden hos nogle patienter [se DOSERING OG ADMINISTRATION ]. PREVACID blev veltolereret ved disse høje dosisniveauer i længere perioder (mere end fire år hos nogle patienter). Hos de fleste ZES-patienter blev serumgastrinniveauerne ikke ændret af PREVACID. Hos nogle patienter steg serumgastrin imidlertid til niveauer, der var højere end de, der var til stede før påbegyndelse af lansoprazolbehandling [se INDIKATIONER OG BRUG ].
PATIENTOPLYSNINGER
FORORD (prev-a-sid) (lansoprazol) kapsler med forsinket frigivelse, til oral brug og
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansoprazol) oralt disintegrerende tabletter med forsinket frigivelse
Hvad er den vigtigste information, jeg bør vide om PREVACID og PREVACID 15mg SoluTab?
Du skal tage PREVACID og PREVACID 15 mg SoluTab nøjagtigt som foreskrevet, i den lavest mulige dosis og i den kortest mulige tid.
PREVACID og PREVACID SoluTab kan hjælpe på dine syrerelaterede symptomer, men du kan stadig have alvorlige maveproblemer.
Tal med din læge. PREVACID 30mg og PREVACID 30mg SoluTab kan forårsage alvorlige bivirkninger, herunder:
- En type nyreproblem (akut tubulointerstitiel nefritis). Nogle mennesker, der tager protonpumpehæmmere (PPI), inklusive PREVACID 30mg og PREVACID 15mg SoluTab, kan udvikle et nyreproblem kaldet akut tubulointerstitiel nefritis, som kan opstå når som helst under behandling med PPI-medicin, herunder PREVACID og PREVACID SoluTab. Ring til din læge med det samme, hvis du har et fald i mængden af vand, eller hvis du har blod i urinen.
- Diarré forårsaget af en infektion (Clostridium difficile) i dine tarme. Ring til din læge med det samme, hvis du har vandig afføring eller mavesmerter, der ikke går væk. Du har måske eller måske ikke feber.
- Knoglebrud (hofte, håndled eller rygsøjle). Knoglebrud i hoften, håndleddet eller rygsøjlen kan forekomme hos personer, der tager flere daglige doser af PPI-medicin og i en længere periode (et år eller længere). Fortæl din læge, hvis du har et knoglebrud, især i hoften, håndleddet eller rygsøjlen.
- Visse typer af lupus erythematosus. Lupus erythematosus er en autoimmun lidelse (kroppens immunceller angriber andre celler eller organer i kroppen). Nogle mennesker, der tager PPI-medicin, herunder PREVACID 15mg og PREVACID 30mg SoluTab, kan udvikle visse typer lupus erythematosus eller få forværring af den lupus, de allerede har. Ring til din læge med det samme, hvis du har nye eller forværrede ledsmerter eller udslæt på dine kinder eller arme, der bliver værre i solen.
Tal med din læge om din risiko for disse alvorlige bivirkninger.
PREVACID 15mg og PREVACID SoluTab kan have andre alvorlige bivirkninger. Se "Hvad er de mulige bivirkninger af PREVACID og PREVACID SoluTab?".
Hvad er PREVACID og PREVACID 30mg SoluTab?
En receptpligtig medicin kaldet en protonpumpehæmmer (PPI), der bruges til at reducere mængden af syre i din mave.
Hos voksne, PREVACID 15mg og PREVACID SoluTab bruges til:
- 4 uger til heling og symptomlindring af duodenalsår.
- 10 til 14 dage med visse antibiotika til behandling af en infektion forårsaget af bakterier kaldet H. pylori.
- opretholdelse af heling af duodenalsår. PREVACID 30mg er ikke blevet undersøgt efter 12 måneder til dette formål.
- op til 8 uger til heling og symptomlindring af mavesår.
- op til 8 uger til heling af mavesår hos personer, der tager smertestillende medicin kaldet ikke-steroide antiinflammatoriske lægemidler (NSAID'er). PREVACID 30mg er ikke blevet undersøgt efter 8 uger til dette formål.
- reduktion af risikoen for mavesår hos personer, der har risiko for at udvikle mavesår med NSAID. PREVACID er ikke blevet undersøgt efter 12 uger til dette formål.
- op til 8 uger til at behandle halsbrand og andre symptomer, der opstår med gastroøsofageal reflukssygdom (GERD). GERD sker, når syre i din mave bakkes op i røret (spiserøret), der forbinder din mund til din mave. Dette kan forårsage en brændende følelse i brystet eller halsen, sur smag eller bøvsen.
- op til 8 uger til heling og symptomlindring af syrerelateret skade på slimhinden i spiserøret (kaldet erosiv esophagitis eller EE). Din læge kan ordinere yderligere 8 til 16 uger med PREVACID eller PREVACID 15 mg SoluTab til patienter, hvis EE ikke forbedres, eller hvis symptomer vender tilbage.
- opretholdelse af heling af EE. PREVACID er ikke blevet undersøgt mere end 12 måneder til dette formål.
- den langvarige behandling af tilstande, hvor din mave laver for meget syre. Dette omfatter en sjælden tilstand kaldet Zollinger-Ellisons syndrom.
Børn: Giv PREVACID 30mg og PREVACID 30mg SoluTab nøjagtigt som foreskrevet af dit barns læge. Du må ikke øge dosis af PREVACID og PREVACID SoluTab eller give dit barn PREVACID 15mg og PREVACID 15mg SoluTab længere end den tid, som din læge har bedt dig om.
Hos børn i alderen 1 til 11 år, PREVACID 15mg og PREVACID 15mg SoluTab bruges til:
- op til 12 uger til at behandle halsbrand og andre symptomer, der kan opstå med GERD.
- op til 12 uger til heling og symptomlindring af EE.
Hos børn i alderen 12 til 17 år, PREVACID og PREVACID SoluTab bruges til:
- op til 8 uger til at behandle halsbrand og andre symptomer, der kan opstå med GERD.
- op til 8 uger til heling og symptomlindring af EE.
PREVACID 30mg og PREVACID SoluTab anbefales ikke til behandling af symptomerne på GERD hos børn under 1 år og kan skade dem.
Tag ikke PREVACID eller PREVACID 15mg SoluTab, hvis du er:
- allergisk over for lansoprazol, enhver anden PPI-medicin eller et af indholdsstofferne i PREVACID 15mg eller PREVACID 30mg SoluTab. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser i PREVACID og PREVACID 30mg SoluTab.
- tager en medicin, der indeholder rilpivirin (EDURANT, COMPLERA, ODEFSEY, JULUCA), der bruges til at behandle HIV-1 (humant immundefektvirus).
Inden du tager PREVACID 15mg eller PREVACID SoluTab, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du:
- har lavt indhold af magnesium, calcium, kalium eller natrium i dit blod, eller du tager et vanddrivende middel.
- har leverproblemer.
- har phenylketonuri. PREVACID SoluTab indeholder aspartam.
- er gravid, tror du kan være gravid eller planlægger at blive gravid. PREVACID eller PREVACID SoluTab kan skade dit ufødte barn. Tal med din læge om de mulige risici for et ufødt barn, hvis PREVACID 30 mg eller PREVACID 15 mg SoluTab tages under graviditet.
- ammer eller planlægger at amme. Det vides ikke, om PREVACID eller PREVACID 30mg SoluTab udskilles i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager PREVACID eller PREVACID SoluTab.
Fortæl din læge om al den medicin du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. Fortæl det især til din læge, hvis du tager methotrexat (OTREXUP, RASUVO, TREXALL, REDITREX, XATMEP).
Hvordan skal jeg tage PREVACID 15mg og PREVACID 30mg SoluTab?
- Tag PREVACID 30mg eller PREVACID SoluTab nøjagtigt som foreskrevet af din læge.
- Du må ikke ændre din dosis eller stoppe med at tage PREVACID 30mg eller PREVACID SoluTab uden at tale med din læge.
- Tag PREVACID 30mg eller PREVACID 15mg SoluTab før måltider.
PREVACID 15 mg kapsler:
-
- Synk PREVACID 30 mg kapsler hele.
- PREVACID-kapsler må ikke knuses eller tygges.
- Hvis du har problemer med at sluge en hel kapsel, kan du åbne kapslen og tage indholdet sammen med visse fødevarer eller juice. Se "Brugsvejledning" i slutningen af denne medicinvejledning for instruktioner om, hvordan du tager PREVACID 30 mg kapsler sammen med visse fødevarer eller juice.
- Se "Brugsvejledning" i slutningen af denne medicinvejledning for instruktioner om, hvordan man blander og giver PREVACID 30 mg kapsler gennem et nasogastrisk sonde (NG-rør).
PREVACID SoluTab:
-
- PREVACID 30mg SoluTab er en tablet, der smelter i munden med eller uden vand.
- Tabletterne må ikke knækkes, skæres, knuses eller tygges.
- Se "Brugsvejledning" i slutningen af denne medicinvejledning for instruktioner om, hvordan man blander og giver PREVACID SoluTab gennem en sprøjte og NG-rør.
- Hvis du glemmer en dosis PREVACID eller PREVACID 30 mg SoluTab, skal du tage den, så snart du husker det. Hvis det næsten er tid til din næste dosis, må du ikke tage den glemte dosis. Tag din næste dosis på dit normale tidspunkt. Tag ikke 2 doser på samme tid.
- Hvis du tager for meget PREVACID eller PREVACID 30mg SoluTab, skal du straks ringe til din læge eller dit giftkontrolcenter på 1-800-222-1222 eller gå til den nærmeste skadestue på hospitalet.
Hvad er de mulige bivirkninger af PREVACID og PREVACID SoluTab?
PREVACID og PREVACID SoluTab kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om PREVACID 30mg og PREVACID SoluTab?".
- Lavt vitamin B12 niveau kroppen kan forekomme hos personer, der har taget PREVACID 30mg eller PREVACID SoluTab i lang tid (mere end 3 år). Fortæl din læge, hvis du har symptomer på lave vitamin B12-niveauer, herunder åndenød, svimmelhed, uregelmæssig hjerterytme, muskelsvaghed, bleg hud, træthed, humørsvingninger og prikken eller følelsesløshed i arme og ben.
- Mavevækster (fundiske kirtelpolypper). Personer, der tager PPI-medicin i lang tid, har en øget risiko for at udvikle en bestemt type mavevækst kaldet fundic gland polypper, især efter at have taget PPI-medicin i mere end 1 år.
- Lavt magnesiumniveau i kroppen kan forekomme hos personer, der har taget PREVACID i mindst 3 måneder. Fortæl din læge med det samme, hvis du har symptomer på lave magnesiumniveauer, herunder anfald, svimmelhed, uregelmæssig hjerterytme, nervøsitet, muskelsmerter eller -svaghed og spasmer i hænder, fødder eller stemme.
- Alvorlige hudreaktioner. PREVACID 15mg kan forårsage sjældne, men alvorlige hudreaktioner, som kan påvirke enhver del af din krop. Disse alvorlige hudreaktioner skal muligvis behandles på et hospital og kan være livstruende:
- Hududslæt, som kan have blærer, afskalning eller blødning på nogen del af din hud (inklusive dine læber, øjne, mund, næse, kønsorganer, hænder eller fødder).
- Du kan også have feber, kulderystelser, smerter i kroppen, åndenød eller forstørrede lymfeknuder.
Stop med at tage PREVACID og ring til din læge med det samme. Disse symptomer kan være det første tegn på en alvorlig hudreaktion.
De mest almindelige bivirkninger af PREVACID og PREVACID SoluTab omfatter: diarré, smerter i maveområdet (mave), kvalme og forstoppelse.
Disse er ikke alle de mulige bivirkninger af PREVACID 30mg og PREVACID 30mg SoluTab.
Ring til din læge for lægehjælp om bivirkninger.
Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare PREVACID og PREVACID 30mg SoluTab?
Opbevar PREVACID ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
Opbevar PREVACID 15mg og PREVACID SoluTab og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af PREVACID 15mg og PREVACID SoluTab.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke PREVACID eller PREVACID 30mg SoluTab til tilstande, som det ikke er ordineret til. Giv ikke PREVACID 30mg eller PREVACID SoluTab til andre mennesker, heller ikke selvom de har de samme symptomer, som du har. Det kan skade dem. Du kan bede din læge eller apotek om information om PREVACID 30mg og PREVACID 15mg SoluTab, der er skrevet til sundhedspersonale.
Hvad er ingredienserne i PREVACID og PREVACID SoluTab?
Aktiv ingrediens: lansoprazol.
Inaktive ingredienser i PREVACID 30mg kapsler: sukkerkugle, saccharose, methacrylsyrecopolymer, lavsubstitueret hydroxypropylcellulose, stivelse, magnesiumcarbonat, talkum, polyethylenglycol, titaniumdioxid, polysorbat 80, hydroxypropylcellulose, kolloid siliciumdioxid, D&C Red No. 28, FD&C Blue No. 1, og FD&C Rød nr. 40.
Kun PREVACID 15 mg kapsel: FD&C Grøn nr. 3.
Inaktive ingredienser i PREVACID 15mg SoluTab: mannitol, methacrylsyre, hydroxypropylcellulose, lactosemonohydrat-mikrokrystallinsk cellulosekugle, triethylcitrat, crospovidon, polyacrylat, magnesiumcarbonat, aspartam, glycerylmonostearat, hypromellose, magnesiumstearat, citronsyre, titanium, kunstig smagsstof, polyglycen, talkum, talkum polysorbat 80 og jernoxid.
PREVACID SoluTab indeholder 2,5 mg phenylalanin i hver 15 mg tablet og 5,1 mg phenylalanin i hver 30 mg tablet.
BRUGSVEJLEDNING
FORORD (prev-a-sid) (lansoprazol) kapsler med forsinket frigivelse, til oral brug og
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansoprazol) oralt disintegrerende tabletter med forsinket frigivelse
Vigtig:
- Tag PREVACID 15mg eller PREVACID 15mg SoluTab før måltider.
- Du må ikke knuse eller tygge PREVACID 15mg kapsler eller PREVACID 30mg SoluTab.
- PREVACID eller PREVACID 15mg SoluTab bør kun bruges sammen med de fødevarer og juicer, der er anført nedenfor.
PREVACID kapsler med forsinket frigivelse (PREVACID 30 mg kapsler)
Indtagelse af PREVACID 15 mg kapsler sammen med visse fødevarer:
Du kan kun bruge æblemos, ENSURE budding, hytteost, yoghurt eller siede pærer.
Indtagelse af PREVACID kapsler sammen med visse juicer:
Du kan kun bruge æblejuice, appelsinjuice eller tomatjuice.
Indgivelse af PREVACID-kapsler gennem en nasogastrisk sonde (NG-rør) størrelse 16 fransk eller større:
Du kan kun bruge æblejuice.
PREVACID 15mg SoluTab oralt disintegrerende tabletter med forsinket frigivelse (PREVACID SoluTab)
Til patienter, der har problemer med at sluge tabletter, kan PREVACID SoluTab gives som følger:
Indgivelse af PREVACID SoluTab med vand ved hjælp af en oral sprøjte:
Indgivelse af PREVACID 15 mg SoluTab med vand gennem en nasogastrisk sonde (NG-slange) størrelse 8 French eller større:
Hvordan skal jeg opbevare PREVACID og PREVACID 30mg SoluTab?
- Opbevar PREVACID kapsler og PREVACID 15mg SoluTab ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
Opbevar PREVACID og PREVACID 30mg SoluTab og al medicin utilgængeligt for børn.
Denne brugsanvisning er godkendt af US Food and Drug Administration.
