Imodium 2mg Loperamide Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Imodium 2mg, og hvordan bruges det?
Imodium 2mg er en receptpligtig medicin, der bruges til at behandle symptomerne på akut diarré, kronisk diarré og Traveler's Diarrhea. Imodium kan bruges alene eller sammen med andre lægemidler.
Imodium tilhører en klasse af lægemidler kaldet Antidiarrheals.
Hvad er de mulige bivirkninger af Imodium?
Imodium kan forårsage alvorlige bivirkninger, herunder:
- diarré, der er vandig eller blodig,
- mavesmerter eller oppustethed,
- vedvarende eller forværret diarré,
- hurtige eller bankende hjerteslag,
- flagrende i dit bryst,
- åndenød, og
- svimmelhed
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Imodium omfatter:
- forstoppelse,
- svimmelhed,
- døsighed,
- kvalme, og
- mavekramper
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Imodium. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
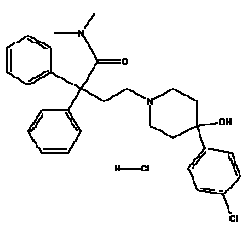
IMODIUM® (loperamid hydrochlorid), 4-(p-chlorphenyl)-4-hydroxy-N, N-dimethyl-a, a-diphenyl-1-piperidinbutyramid monohydrochlorid, er et syntetisk antidiarré til oral brug.
IMODIUM® (loperamid hcl) fås i 2 mg kapsler.
De inaktive ingredienser er: Lactose, majsstivelse, talkum og magnesiumstearat. IMODIUM® (loperamid hcl) kapsler indeholder FD&C gul nr. 6.
INDIKATIONER
IMODIUM® (loperamidhydrochlorid) er indiceret til kontrol og symptomatisk lindring af akut uspecifik diarré og kronisk diarré forbundet med inflammatorisk tarmsygdom. IMODIUM® (loperamid hcl) er også indiceret til at reducere volumen af udledning fra ileostomier.
DOSERING OG ADMINISTRATION
(1 kapsel = 2 mg)
Patienter bør modtage passende væske- og elektrolytterstatning efter behov.
Akut diarré
Voksne: Den anbefalede startdosis er 4 mg (to kapsler) efterfulgt af 2 mg (én kapsel) efter hver uformet afføring. Den daglige dosis bør ikke overstige 16 mg (otte kapsler). Klinisk forbedring observeres normalt inden for 48 timer.
Børn: Til børn i alderen 2 til 5 år (20 kg eller derunder) bør den ikke-receptpligtige flydende formulering (IMODIUM® (loperamid hcl) AD 1 mg/5 ml) anvendes; til alderen 6 til 12 år kan enten IMODIUM® (loperamid hcl) kapsler eller IMODIUM® (loperamid hcl) AD Liquid anvendes. For børn i alderen 2 til 12 år vil følgende skema for kapsler eller væske sædvanligvis opfylde de initiale dosiskrav:
Anbefalet doseringsplan for første dag
To til fem år: 1 mg tid (3 mg daglig dosis) (13 til 20 kg) Seks til otte år: 2 mg dagligt (4 mg daglig dosis) (20 til 30 kg) Otte til tolv år: 2 mg tid (6 mg daglig dosis) (større end 30 kg )
Anbefalet efterfølgende daglig dosis
Efter den første behandlingsdag anbefales det, at efterfølgende IMODIUM® (loperamid hcl) doser (1 mg/10 kg legemsvægt) kun administreres efter en løs afføring. Den samlede daglige dosis bør ikke overstige de anbefalede doser den første dag.
Kronisk diarré
Børn: Selvom IMODIUM® (loperamid hcl) er blevet undersøgt hos et begrænset antal børn med kronisk diarré; den terapeutiske dosis til behandling af kronisk diarré hos en pædiatrisk population er ikke fastlagt.
Voksne: Den anbefalede startdosis er 4 mg (to kapsler) efterfulgt af 2 mg (én kapsel) efter hver uformet afføring, indtil diarréen er under kontrol, hvorefter doseringen af IMODIUM® (loperamid hcl) bør reduceres for at opfylde individuelle behov. Når den optimale daglige dosis er blevet fastlagt, kan denne mængde indgives som en enkelt dosis eller i opdelte doser.
Den gennemsnitlige daglige vedligeholdelsesdosis i kliniske forsøg var 4 til 8 mg (to til fire kapsler). En dosis på 16 mg (otte kapsler) blev sjældent overskredet. Hvis der ikke observeres klinisk bedring efter behandling med 16 mg dagligt i mindst 10 dage, er det usandsynligt, at symptomerne kan kontrolleres ved yderligere administration. IMODIUM® (loperamid hcl) administration kan fortsættes, hvis diarré ikke kan kontrolleres tilstrækkeligt med diæt eller specifik behandling.
Børn under 2 år
Brug af IMODIUM (loperamid hcl) til børn under 2 år anbefales ikke. Der har været sjældne rapporter om paralytisk ileus forbundet med abdominal udspilning. De fleste af disse rapporter forekom i forbindelse med akut dysenteri, overdosering og med meget små børn under to år.
Ældre
Der blev ikke udført formelle farmakokinetiske undersøgelser hos ældre forsøgspersoner. Der var dog ingen større forskelle i lægemiddeldispositionen hos ældre patienter med diarré i forhold til unge patienter. Dosisjustering er ikke nødvendig for ældre.
Nedsat nyrefunktion
Der er ingen tilgængelige farmakokinetiske data hos patienter med nedsat nyrefunktion. Da metabolitterne og det uændrede lægemiddel hovedsageligt udskilles i fæces, er dosisjustering ikke nødvendig for patienter med nedsat nyrefunktion (se afsnittet FORHOLDSREGLER ).
Nedsat leverfunktion
Selvom der ikke er tilgængelige farmakokinetiske data hos patienter med nedsat leverfunktion, bør IMODIUM (loperamid hcl) anvendes med forsigtighed hos sådanne patienter på grund af reduceret first-pass metabolisme. (se FORHOLDSREGLER ).
HVORDAN LEVERET
Kapsler - hver kapsel indeholder 2 mg loperamidhydrochlorid. Kapslerne har en lysegrøn krop og en mørkegrøn hætte med "JANSSEN" påtrykt på det ene segment og "IMODIUM" på det andet segment. IMODIUM® (loperamid hcl) kapsler leveres i flasker med 100 stk.
NDC 50458-400-10.........(100 KAPSULER)
Opbevares ved 15°-25°C (59°-77°F).
Janssen Pharmaceutica Inc. Revideret september 1996, juli 1998. FDA Rev. dato: 21/10/2005
BIVIRKNINGER
Data fra kliniske forsøg
De bivirkninger, der er rapporteret under kliniske undersøgelser af IMODIUM® (loperamidhydrochlorid), er vanskelige at skelne fra symptomer forbundet med diarrésyndromet. Bivirkninger registreret under kliniske studier med IMODIUM® (loperamid hcl) var generelt af mindre og selvbegrænsende karakter. De blev mere almindeligt observeret under behandlingen af kronisk diarré.
De rapporterede uønskede hændelser er opsummeret uafhængigt af efterforskernes kausalitetsvurdering.
1) Bivirkninger fra 4 placebokontrollerede studier hos patienter med akut diarré Bivirkningerne med en incidens på 1,0 % eller mere, som blev rapporteret mindst lige så ofte hos patienter på loperamidhydrochlorid som hos placebo, er vist i tabellen nedenfor.
Bivirkningerne med en incidens på 1,0 % eller mere, som blev rapporteret hyppigere hos patienter på placebo end hos loperamidhydrochlorid, var: mundtørhed, flatulens, mavekramper og kolik.
2) Bivirkninger fra 20 placebokontrollerede undersøgelser hos patienter med kronisk diarré
Bivirkningerne med en incidens på 1,0 % eller mere, som blev rapporteret mindst lige så ofte hos patienter på loperamidhydrochlorid som hos placebo, er vist nedenfor i tabellen nedenfor.
Bivirkningerne med en incidens på 1,0 % eller mere, som blev rapporteret hyppigere hos patienter på placebo end hos loperamidhydrochlorid, var: kvalme, opkastning, hovedpine, meteorisme, mavesmerter, mavekramper og kolik.
3) Bivirkninger fra 76 kontrollerede og ukontrollerede undersøgelser hos patienter med akut eller kronisk diarré
Bivirkningerne med en forekomst på 1,0 % eller mere hos patienter fra alle undersøgelser er angivet i tabellen nedenfor.
Erfaring efter markedsføring
Følgende bivirkninger er blevet rapporteret:
Hud- og subkutane vævssygdomme
Udslæt, pruritus, nældefeber, angioødem og ekstremt sjældne tilfælde af bulløst udbrud, herunder erythema multiforme, Stevens-Johnsons syndrom og toksisk epidermal nekrolyse, er blevet rapporteret ved brug af IMODIUM (loperamid hcl).
Forstyrrelser i immunsystemet
Isolerede forekomster af allergiske reaktioner og i nogle tilfælde alvorlige overfølsomhedsreaktioner inklusive anafylaktisk shock og anafylaktoide reaktioner er blevet rapporteret ved brug af IMODIUM (loperamid hcl).

Gastrointestinale lidelser
Mundtørhed, mavesmerter, udspilning eller ubehag, kvalme, opkastning, flatulens, dyspepsi, forstoppelse, paralytisk ileus, megacolon, inklusive giftig megacolon (se KONTRAINDIKATIONER og ADVARSLER ).
Nyre- og urinvejslidelser
Urinretention
Forstyrrelser i nervesystemet
Døsighed, svimmelhed
Generelle lidelser og administrative forhold på stedet
Træthed
En række af de bivirkninger, der er rapporteret under de kliniske undersøgelser og erfaring efter markedsføring med loperamid, er hyppige symptomer på det underliggende diarrésyndrom (mavesmerter/ubehag, kvalme, opkastning, mundtørhed, træthed, døsighed, svimmelhed, forstoppelse og flatulens) . Disse symptomer er ofte svære at skelne fra uønskede lægemiddeleffekter.
Stofmisbrug og afhængighed
Misbrug
En specifik klinisk undersøgelse designet til at vurdere misbrugspotentialet af loperamid ved høje doser resulterede i en konstatering af ekstremt lavt misbrugspotentiale.
Afhængighed
Undersøgelser med morfinafhængige aber viste, at loperamidhydrochlorid i doser over dem, der anbefales til mennesker, forhindrede tegn på morfinabstinenser. Hos mennesker var naloxon-udfordringspupiltesten, som, når den er positiv, indikerer opiatlignende effekter, udført efter en enkelt høj dosis eller efter mere end to års terapeutisk brug af IMODIUM® (loperamidhydrochlorid), negativ. Oralt administreret IMODIUM® (loperamid hcl) (loperamid formuleret med magnesiumstearat) er både meget uopløseligt og trænger dårligt ind i CNS.
DRUGSINTERAKTIONER
Ikke-kliniske data har vist, at loperamid er et P-glycoprotein-substrat. Samtidig administration af loperamid (16 mg enkeltdosis) med en enkeltdosis på 600 mg af enten quinidin eller ritonavir, som begge er P-glykoproteinhæmmere, resulterede i en 2- til 3-fold stigning i loperamidplasmaniveauer. På grund af potentialet for forstærkede centrale effekter, når loperamid administreres sammen med quinidin og ritonavir, bør der udvises forsigtighed, når loperamid administreres i de anbefalede doser (2 mg, op til 16 mg maksimal daglig dosis) med P-glycoproteinhæmmere.
Når en enkelt 16 mg-dosis af loperamid administreres samtidigt med en enkeltdosis på 600 mg saquinavir, reducerede loperamid saquinavireksponeringen med 54 %, hvilket kan være af klinisk relevans på grund af reduktion af saquinavirs terapeutiske effekt. Virkningen af saquinavir på loperamid er af mindre klinisk betydning. Når loperamid gives sammen med saquinavir, bør den terapeutiske virkning af saquinavir derfor overvåges nøje.
ADVARSLER
Væske- og elektrolytmangel forekommer ofte hos patienter, der har diarré. I sådanne tilfælde er administration af passende væske og elektrolytter meget vigtig. Brugen af IMODIUM® (loperamid hcl) udelukker ikke behovet for passende væske- og elektrolytbehandling.
Generelt bør IMODIUM (loperamid hcl) ikke anvendes, når hæmning af peristaltikken skal undgås på grund af den mulige risiko for betydelige følgesygdomme inklusive ileus, megacolon og toksisk megacolon. IMODIUM (loperamid hcl) skal seponeres omgående, når der udvikles forstoppelse, abdominal udspilning eller ileus.
Behandling af diarré med IMODIUM (loperamid hcl) er kun symptomatisk. Når en underliggende ætiologi kan bestemmes, bør specifik behandling gives, når det er relevant (eller når det er indiceret).
Patienter med AIDS behandlet med IMODIUM (loperamid hcl) mod diarré bør have stoppet behandlingen ved de tidligste tegn på abdominal udspilning. Der har været isolerede rapporter om toksisk megacolon hos AIDS-patienter med infektiøs colitis fra både virale og bakterielle patogener behandlet med loperamidhydrochlorid. {ref EDMS-PSDB-2564186, s. 12}
IMODIUM® (loperamid hcl) bør anvendes med særlig forsigtighed til små børn på grund af den større variation i respons i denne aldersgruppe. Dehydrering, især hos yngre børn, kan yderligere påvirke variabiliteten af respons på IMODIUM® (loperamid hcl).
FORHOLDSREGLER
Generel
Ekstremt sjældne allergiske reaktioner inklusive anafylaksi og anafylaktisk shock er blevet rapporteret. Ved akut diarré, hvis klinisk bedring ikke observeres inden for 48 timer, bør administrationen af IMODIUM® (loperamidhydrochlorid) afbrydes, og patienter bør rådes til at konsultere deres læge. Selvom der ikke er tilgængelige farmakokinetiske data hos patienter med nedsat leverfunktion, bør IMODIUM (loperamid hcl) anvendes med forsigtighed hos sådanne patienter på grund af reduceret first-pass metabolisme. Patienter med leverdysfunktion bør overvåges nøje for tegn på CNS-toksicitet. Der er ingen tilgængelige farmakokinetiske data hos patienter med nedsat nyrefunktion. Da det er blevet rapporteret, at størstedelen af lægemidlet metaboliseres, og metabolitter eller det uændrede lægemiddel hovedsageligt udskilles i fæces, er dosisjusteringer hos patienter med nedsat nyrefunktion ikke påkrævet. Der er ikke udført formelle undersøgelser for at evaluere farmakokinetikken af loperamid hos ældre forsøgspersoner. I to undersøgelser, der omfattede ældre patienter, var der imidlertid ingen større forskelle i lægemiddeldispositionen hos ældre patienter med diarré i forhold til unge patienter.
Karcinogenese, mutagenese, svækkelse af fertilitet
I en 18-måneders rotteundersøgelse med orale doser op til 40 mg/kg/dag (21 gange den maksimale humane dosis på 16 mg/dag, baseret på en sammenligning af kropsoverfladearealet), var der ingen tegn på carcinogenese.
Loperamid var ikke genotoksisk i Ames-testen, SOS-kromotesten i E. coli, den dominerende letale test i hunmus eller museembryocelletransformationsanalysen.
Fertilitet og reproduktionsevne blev evalueret hos rotter ved brug af orale doser på 2,5, 10 og 40 mg/kg/dag i en undersøgelse og 1, 5, 10, 20 og 40 mg/kg/dag (kun hunner) i et andet undersøgelse. Oral administration af 20 mg/kg/dag (ca. 11 gange den humane dosis baseret på en sammenligning af kropsoverfladeareal) og højere gav en kraftig svækkelse af kvindelig fertilitet. Behandling af hunrotter med op til 10 mg/kg/dag po (ca. 5 gange den humane dosis baseret på en kropsoverfladesammenligning) havde ingen effekt på fertiliteten. Behandling af hanrotter med 40 mg/kg/dag po (ca. 21 gange den humane dosis baseret på en kropsoverfladesammenligning) forårsagede svækkelse af hanfertiliteten, hvorimod administration på op til 10 mg/kg/dag (ca. 5 gange den menneskelige dosis baseret på en kropsoverfladesammenligning) havde ingen effekt.
Graviditet
Teratogene virkninger Graviditet Kategori C
Teratologiske undersøgelser er blevet udført på rotter med orale doser på 2,5, 10 og 40 mg/kg/dag og på kaniner med orale doser på 5, 20 og 40 mg/kg/dag. Disse undersøgelser har ikke afsløret tegn på nedsat fertilitet eller skade på fosteret ved doser op til 10 mg/kg/dag hos rotter (5 gange den humane dosis baseret på kropsoverfladesammenligning) og 40 mg/kg/dag hos kaniner (43 gange den menneskelige dosis baseret på kropsoverfladesammenligning). Behandling af rotter med 40 mg/kg/dag po (21 gange den humane dosis baseret på en kropsoverfladesammenligning) gav markant svækkelse af fertiliteten. Undersøgelserne gav ingen tegn på teratogene aktivitet. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Loperamid bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Ikke-teratogene virkninger
I et peri- og postnatalt reproduktionsstudie med rotter forårsagede oral administration af 40 mg/kg/dag svækkelse af vækst og overlevelse af afkom.
Ammende mødre
Små mængder loperamid kan forekomme i human modermælk. Derfor frarådes IMODIUM (loperamid hcl) under amning.
Pædiatrisk brug
Se " ADVARSLER "Sektion for information om den større variabilitet af respons i denne aldersgruppe.
I tilfælde af utilsigtet overdosering af IMODIUM® af børn, se " OVERDOSERING "Sektion for foreslået behandling.
OVERDOSIS
I tilfælde af overdosering (herunder relativ overdosering på grund af leverdysfunktion), kan urinretention, paralytisk ileus og CNS-depression forekomme. Børn kan være mere følsomme over for CNS-effekter end voksne. Kliniske forsøg har vist, at en opslæmning af aktivt kul administreret umiddelbart efter indtagelse af loperamidhydrochlorid kan reducere mængden af lægemiddel, der absorberes i det systemiske kredsløb, med så meget som ni gange. Hvis opkastning sker spontant ved indtagelse, bør en opslæmning af 100 g aktivt kul administreres oralt, så snart væske kan tilbageholdes.
Hvis opkastning ikke er forekommet, bør maveskylning udføres efterfulgt af administration af 100 g af opslæmningen af aktivt kul gennem mavesonden. I tilfælde af overdosering skal patienter overvåges for tegn på CNS-depression i mindst 24 timer.
Hvis der opstår symptomer på overdosering, kan naloxon gives som modgift. Hvis de reagerer på naloxon, skal vitale tegn overvåges nøje for gentagelse af symptomer på overdosering i mindst 24 timer efter den sidste dosis af naloxon.
I lyset af den forlængede virkning af loperamid og den korte varighed (en til tre timer) af naloxon, skal patienten monitoreres nøje og behandles gentagne gange med naloxon som angivet. Da relativt lidt lægemiddel udskilles i urinen, forventes forceret diurese ikke at være effektiv ved overdosering af IMODIUM® (loperamidhydrochlorid).
kliniske forsøg var en voksen, der tog tre 20 mg doser inden for en 24 timers periode, kvalme efter den anden dosis og kastede op efter den tredje dosis. I undersøgelser designet til at undersøge potentialet for bivirkninger, resulterede bevidst indtagelse af op til 60 mg loperamidhydrochlorid i en enkelt dosis til raske forsøgspersoner ikke i nogen signifikante bivirkninger.
KONTRAINDIKATIONER
IMODIUM (loperamid hcl) er kontraindiceret til patienter med kendt overfølsomhed over for loperamidhydrochlorid eller over for et eller flere af hjælpestofferne.
IMODIUM (loperamid hcl) er kontraindiceret til patienter med mavesmerter i fravær af diarré.
IMODIUM (loperamid hcl) anbefales ikke til spædbørn under 24 måneder.
IMODIUM (loperamid hcl) bør ikke anvendes som den primære behandling:
- hos patienter med akut dysenteri, som er karakteriseret ved blod i afføring og høj feber,
- hos patienter med akut colitis ulcerosa,
hos patienter med bakteriel enterocolitis forårsaget af invasive organismer, herunder Salmonella, Shigella og Campylobacter,
- hos patienter med pseudomembranøs colitis forbundet med brugen af bredspektrede antibiotika.
KLINISK FARMAKOLOGI
In vitro- og dyreforsøg viser, at IMODIUM® (loperamidhydrochlorid) virker ved at bremse tarmens motilitet og ved at påvirke vand- og elektrolytbevægelsen gennem tarmen. Loperamid binder sig til opiatreceptoren i tarmvæggen. Følgelig hæmmer det frigivelsen af acetylcholin og prostaglandiner og reducerer derved peristaltikken og øger tarmens transittid. Loperamid øger tonen i analsfinkteren og reducerer derved inkontinens og haster.
Hos mennesker forlænger IMODIUM® (loperamid hcl) transittiden af tarmindholdet. Det reducerer det daglige fækale volumen, øger viskositeten og bulkdensiteten og mindsker tabet af væske og elektrolytter. Tolerance over for den antidiarréeffekt er ikke blevet observeret. Kliniske undersøgelser har vist, at den tilsyneladende eliminationshalveringstid for loperamid hos mennesker er 10,8 timer med et interval på 9,1 - 14,4 timer. Plasmaniveauer af uændret lægemiddel forbliver under 2 nanogram pr. ml efter indtagelse af en 2 mg kapsel IMODIUM® (loperamid hcl). Plasmaniveauerne er højest cirka fem timer efter indgivelse af kapslen og 2,5 timer efter væsken. De maksimale plasmaniveauer af loperamid var ens for begge formuleringer. Elimination af loperamid sker hovedsageligt ved oxidativ N-demethylering. Cytochrom P450 (CYP450) isozymer, CYP2C8 og CYP3A4, menes at spille en vigtig rolle i loperamid-N-demethyleringsprocessen, da quercetin (CYP2C8-hæmmer) og ketoconazol (CYP3A4-hæmmer) signifikant hæmmede N- vitro-demethyleringsprocessen ved 40 % og 90 %. %, henholdsvis. Derudover synes CYP2B6 og CYP2D6 at spille en mindre rolle i loperamid N-demethylering. Udskillelse af det uændrede loperamid og dets metabolitter sker hovedsageligt gennem fæces. Hos de patienter, hvor biokemiske og hæmatologiske parametre blev overvåget under kliniske forsøg, blev der ikke observeret nogen tendenser til abnormitet under IMODIUM® (loperamid hcl)-behandling. Tilsvarende viste urinanalyser, EKG og kliniske oftalmologiske undersøgelser ikke tendenser til abnormitet.
PATIENTOPLYSNINGER
Patienter bør rådes til at tjekke med deres læge, hvis deres diarré ikke forbedres inden for 48 timer, eller hvis de bemærker blod i deres afføring, udvikler feber eller udvikler abdominal udspilning.
Træthed, svimmelhed eller døsighed kan forekomme i forbindelse med diarrésyndromer behandlet med IMODIUM (loperamid hcl). Derfor er det tilrådeligt at være forsigtig, når du kører bil eller betjener maskiner. (se BIVIRKNINGER ).
