Pentasa 400mg Mesalamine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Pentasa, og hvordan bruges det?
Pentasa er en receptpligtig medicin, der bruges til at behandle symptomerne på colitis ulcerosa. Pentasa 400mg kan bruges alene eller sammen med anden medicin.
Pentasa tilhører en klasse af lægemidler kaldet 5-aminosalicylsyrederivater.
Det vides ikke, om Pentasa er sikkert og effektivt til børn over 5 år.
Hvad er de mulige bivirkninger af Pentasa?
Pentasa kan forårsage alvorlige bivirkninger, herunder:
- stærke mavesmerter,
- mavekramper,
- blodig diarré,
- feber,
- hovedpine,
- udslæt,
- blodig eller tjæreagtig afføring,
- hoste blod op,
- opkast, der ligner kaffegrums,
- lidt eller ingen vandladning,
- smertefuld eller vanskelig vandladning,
- hævelse i dine fødder eller ankler,
- træthed eller åndenød,
- mistet appetiten,
- smerter i øvre mave,
- træthed,
- let blå mærker eller blødning,
- mørk urin,
- lerfarvede afføring, og
- gulfarvning af hud eller øjne
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Pentasa 400mg omfatter:
- kvalme,
- opkastning,
- mavesmerter,
- diarré,
- dårlig fordøjelse,
- gas,
- hovedpine,
- udslæt, og
- unormale leverfunktionsprøver
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Pentasa. Spørg din læge eller apotek for mere information.
BESKRIVELSE
PENTASA (mesalamin) til oral administration er en formulering med kontrolleret frigivelse af mesalamin, et aminosalicylat antiinflammatorisk middel til gastrointestinal brug.
Kemisk er mesalamin 5-amino-2-hydroxybenzoesyre. Det har en molekylvægt på 153,14.
Strukturformlen er:
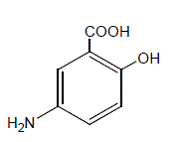
Hver 250 mg kapsel indeholder 250 mg mesalamin. Det indeholder også følgende inaktive ingredienser: acetyleret monoglycerid, ricinusolie, kolloid siliciumdioxid, ethylcellulose, hydroxypropylmethylcellulose, stivelse, stearinsyre, sukker, talkum og hvid voks. Kapselskallen indeholder D&C Yellow #10, FD&C Blue #1, FD&C Green #3, gelatine, titaniumdioxid og andre ingredienser.
Hver 500 mg kapsel indeholder 500 mg mesalamin. Det indeholder også følgende inaktive ingredienser: acetyleret monoglycerid, ricinusolie, kolloid siliciumdioxid, ethylcellulose, hydroxypropylmethylcellulose, stivelse, stearinsyre, sukker, talkum og hvid voks. Kapselskallen indeholder FD&C Blue #1, gelatine, titaniumdioxid og andre ingredienser.
INDIKATIONER
PENTASA 400mg er indiceret til induktion af remission og til behandling af voksne patienter med mild til moderat aktiv colitis ulcerosa.
DOSERING OG ADMINISTRATION
Den anbefalede dosis til induktion af remission og symptomatisk behandling af mild til moderat aktiv colitis ulcerosa hos voksne er 1 g (4 PENTASA 250 mg kapsler eller 2 PENTASA 500 mg kapsler) 4 gange dagligt til en samlet daglig dosis på 4 g. Behandlingsvarighed i kontrollerede forsøg var op til 8 uger.
PENTASA-kapsler kan sluges hele, eller alternativt kan kapslen åbnes og hele indholdet drysses på æblemos eller yoghurt. Hele indholdet skal indtages med det samme. Kapslerne og kapselindholdet må ikke knuses eller tygges.
Drik en passende mængde væske.
Sikkerhed og effekt af PENTASA 400mg hos pædiatriske patienter er ikke blevet fastslået.
HVORDAN LEVERET
PENTASA forlænget udgivelse 250 mg kapsler leveres i flasker med 240 kapsler ( NDC 54092-189-81). Hver grøn og blå kapsel indeholder 250 mg mesalamin i perler med forlænget frigivelse. PENTASA-kapsler med forlænget frigivelse er identificeret med et femkantet starburst-logo og nummeret 2010 på den grønne del og S429 250 mg på den blå del af kapslerne.
PENTASA forlænget udgivelse 500 mg kapsler leveres i flasker med 120 kapsler ( NDC 54092-191-12). Hver blå kapsel indeholder 500 mg mesalamin i perler med forlænget frigivelse. PENTASA 400 mg kapsler med forlænget frigivelse er identificeret med et femkantet starburst-logo og S429 500 mg på kapslerne.
Opbevares ved 25°C (77°F); udflugter tilladt til 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur].
Kontakt Takeda Pharmaceuticals på 1800-828-2088 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch for at rapportere FORSINKTE BIVIRKNINGER.
Distribueret af: Takeda Pharmaceuticals America, Inc. Lexington, MA 02421, USA. Revideret: november 2021
BIVIRKNINGER
I kombinerede indenlandske og udenlandske kliniske forsøg modtog mere end 2100 patienter med colitis ulcerosa eller Crohns sygdom PENTASA-behandling. Generelt var PENTASA-terapi godt tolereret. De mest almindelige hændelser (dvs. større end eller lig med 1 %) var diarré (3,4 %), hovedpine (2,0 %), kvalme (1,8 %), mavesmerter (1,7 %), dyspepsi (1,6 %), opkastning (1,5 %). %) og udslæt (1,0 %).
to indenlandske placebokontrollerede undersøgelser, der involverede over 600 patienter med colitis ulcerosa, var bivirkninger færre hos PENTASA (mesalamin)-behandlede patienter end i placebogruppen (PENTASA 14 % vs. placebo 18 %) og var ikke dosisrelaterede. Hændelser, der forekommer hos mere end 1 %, er vist i tabellen nedenfor. Af disse var kun kvalme og opkastning hyppigere i PENTASA-gruppen. Seponering fra behandlingen på grund af bivirkninger var mere almindelig på placebo end PENTASA (7 % vs. 4 %).
Kliniske laboratoriemålinger viste ingen signifikante unormale tendenser for nogen test, inklusive måling af hæmatologisk funktion, lever- og nyrefunktion.
Følgende uønskede hændelser, præsenteret efter kropssystem, blev rapporteret sjældent (dvs. mindre end 1 %) under huslig ulcerøs colitis og Crohns sygdom-forsøg. I mange tilfælde er forholdet til PENTASA ikke blevet fastslået.
Gastrointestinale: abdominal udspilning, anoreksi, obstipation, duodenalsår, dysfagi, udbrud, esophageal ulcus, fækal inkontinens, GGTP-stigning, GI-blødning, øget alkalisk fosfatase, LDH-stigning, mundsår, oral moniliasis, pancreatitis, SGOT-øgning, SGOT-stigning, abnormiteter i afføringen (farve eller teksturændring), tørst
Dermatologisk: acne, alopeci, tør hud, eksem, erythema nodosum, neglelidelse, lysfølsomhed, kløe, svedtendens, nældefeber
Nervesystem: depression, svimmelhed, søvnløshed, somnolens, paræstesi
Kardiovaskulær: hjertebanken, perikarditis, vasodilatation
Andet: albuminuri, amenoré, stigning i amylase, artralgi, asteni, brystsmerter, conjunctivitis, ekkymose, ødem, feber, hæmaturi, hypomenoré, Kawasaki-lignende syndrom, kramper i benene, lichen planus, lipaseforøgelse, utilpashed, menorgiragi, mymonorrhagi, , trombocytæmi, trombocytopeni, vandladningsfrekvens
En uge efter afslutningen af en 8-ugers colitis ulcerosa undersøgelse udviklede en 72-årig mand, uden tidligere lungeproblemer, dyspnø. Patienten blev efterfølgende diagnosticeret med interstitiel lungefibrose uden eosinofili af en læge og bronchiolitis obliterans med organiserende pneumonitis af en anden læge. En årsagssammenhæng mellem denne hændelse og mesalaminbehandling er ikke blevet fastlagt.
Offentliggjorte case-rapporter og/eller spontan postmarketing-overvågning har beskrevet sjældne tilfælde af pericarditis, fatal myocarditis, brystsmerter og T-bølge abnormiteter, overfølsomhedspneumonitis, pancreatitis, nefrotisk syndrom, interstitiel nefritis, hepatitis, aplastisk anæmi, leukocytisk anæmi, pneumonitis, pneumoni anæmi, mens du modtager mesalaminbehandling. Anæmi kan være en del af den kliniske præsentation af inflammatorisk tarmsygdom. Allergiske reaktioner, som kan involvere eosinofili, kan ses i forbindelse med PENTASA 400mg behandling.
Postmarketing rapporter
Følgende hændelser er blevet identificeret under post-godkendelse brug af PENTASA mærket af mesalamin i klinisk praksis. Da de rapporteres frivilligt fra en population af ukendt størrelse, kan der ikke foretages skøn over hyppigheden. Disse hændelser er blevet valgt til inklusion på grund af en kombination af alvor, hyppighed af rapportering eller potentiel årsagssammenhæng til mesalamin:
Gastrointestinale: Rapporter om levertoksicitet, herunder forhøjede leverenzymer (SGOT/AST, SGPT/ALT, GGT, LDH, alkalisk fosfatase, bilirubin), hepatitis, gulsot, kolestatisk gulsot, skrumpelever og mulig hepatocellulær skade inklusive levernekrose og leversvigt. Nogle af disse tilfælde var dødelige. Et tilfælde af Kawasaki-lignende syndrom, som omfattede leverfunktionsændringer, blev også rapporteret.
Andet: anafylaktisk reaktion, SJS/TEN, DRESS, AGEP, pleuritis/pleuritis, lungebetændelse, granulocytopeni, systemisk lupus erythematosus, lupuslignende syndrom, akut nyresvigt, interstitiel lungesygdom, hypersensitivitetspneumonitis (inklusive interstitiel lungebetændelse, pneumoninitis), kronisk nyresvigt, nefrogen diabetes insipidus, nefrolithiasis, intrakraniel hypertension, angioødem og oligospermi (reversibel).
DRUGSINTERAKTIONER
Der er ikke udført undersøgelser af interaktioner mellem PENTASA 400mg og andre lægemidler; følgende lægemiddel-interaktioner er imidlertid blevet rapporteret for produkter, der indeholder mesalamin:
Nefrotoksiske midler, herunder ikke-steroide antiinflammatoriske lægemidler
Samtidig brug af mesalamin og kendte nefrotoksiske midler, herunder ikke-steroide antiinflammatoriske lægemidler (NSAID'er), kan øge risikoen for nefrotoksicitet. Overvåg patienter, der tager nefrotoksiske lægemidler for ændringer i nyrefunktionen og mesalamin-relaterede bivirkninger.

Azathioprin eller 6-Mercaptopurin
Samtidig brug af mesalamin med azathioprin eller 6-mercaptopurin og/eller andre lægemidler, der vides at forårsage myelotoksicitet, kan øge risikoen for blodsygdomme, knoglemarvssvigt og associerede komplikationer. Hvis samtidig brug af PENTASA og azathioprin eller 6-mercaptopurin ikke kan undgås, skal du overvåge blodprøver, inklusive fuldstændige blodcelletællinger og blodpladetal.
ADVARSLER
Ingen oplysninger givet
FORHOLDSREGLER
Nedsat nyrefunktion
Nedsat nyrefunktion, herunder minimal forandringssygdom, akut og kronisk interstitiel nefritis og nyresvigt er blevet rapporteret hos patienter, der har fået PENTASA eller andre produkter, der indeholder mesalamin eller er omdannet til mesalamin.
Mesalamin er kendt for at udskilles væsentligt af nyrerne, og risikoen for bivirkninger kan være større hos patienter med nedsat nyrefunktion. Evaluer nyrefunktionen hos alle patienter før påbegyndelse og periodisk under behandling med PENTASA. Vurder risici og fordele ved at bruge PENTASA til patienter med kendt nyreinsufficiens eller en historie med nyresygdom eller samtidig behandling med nefrotoksiske lægemidler.
Mesalamin-induceret akut intolerancesyndrom
Mesalamin er blevet forbundet med et akut intolerancesyndrom, der kan være vanskeligt at skelne fra en opblussen af inflammatorisk tarmsygdom. Symptomerne omfatter kramper, akutte mavesmerter, blodig diarré og nogle gange feber, hovedpine og udslæt. Overvåg patienterne for forværring af disse symptomer under behandling. Hvis der er mistanke om akut intolerancesyndrom, skal behandlingen med PENTASA omgående afbrydes.
Overfølsomhedsreaktioner
Overfølsomhedsreaktioner er blevet rapporteret hos patienter, der tager sulfasalazin. Nogle patienter kan have en lignende reaktion på PENTASA eller på andre forbindelser, der indeholder eller omdannes til mesalamin.
Som med sulfasalazin kan mesalamin-inducerede overfølsomhedsreaktioner vise sig som involvering af indre organer, herunder myocarditis, pericarditis, nefritis, hepatitis, pneumonitis og hæmatologiske abnormiteter. Evaluer straks patienterne, hvis der er tegn eller symptomer på en overfølsomhedsreaktion. Seponer PENTASA, hvis en alternativ ætiologi for tegn og symptomer ikke kan fastslås.
Leversvigt
Der har været rapporter om leversvigt hos patienter med allerede eksisterende leversygdom, som har fået andre produkter, der indeholder mesalamin. Vurder risici og fordele ved at bruge PENTASA 400mg til patienter med kendt leverinsufficiens.
Alvorlige kutane bivirkninger
Alvorlige kutane bivirkninger, såsom Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) og akut generaliseret eksantematøs pustulose (AGEP) er blevet rapporteret ved brug af mesalamin (se BIVIRKNINGER ). Seponer PENTASA ved de første tegn eller symptomer på alvorlige kutane bivirkninger eller andre tegn på overfølsomhed og overvej yderligere evaluering.
Lysfølsomhed
Patienter med allerede eksisterende hudsygdomme såsom atopisk dermatitis og atopisk eksem har rapporteret mere alvorlige lysfølsomhedsreaktioner. Rådgiv patienterne om at undgå soleksponering, bære beskyttende tøj og bruge en bredspektret solcreme, når de er udendørs.
Nephrolithiasis
Der er rapporteret tilfælde af nefrolithiasis ved brug af mesalamin, herunder sten med 100 % mesalaminindhold. Mesalaminholdige sten er radiotransparente og kan ikke påvises ved standard radiografi eller computertomografi (CT). Sørg for tilstrækkelig hydrering under behandlingen.
Interferens med laboratorietests
Brug af mesalamin kan føre til falske forhøjede testresultater ved måling af urinnormetanephrin ved væskekromatografi med elektrokemisk detektion på grund af ligheden i kromatogrammerne af normetanephrin og mesalamins hovedmetabolit, N-acetyl-5-aminosalicylsyre (N-Ac-5-ASA) ). Overvej en alternativ, selektiv analyse for normetanephrin.
Karcinogenese, mutagenese, svækkelse af fertilitet
I en 104-ugers diætcarcinogenicitetsundersøgelse af mesalamin blev CD-1 mus behandlet med doser op til 2500 mg/kg/dag, og de var ikke tumorogene. For en person på 50 kg med gennemsnitlig højde (1,46 m2 kropsoverfladeareal) repræsenterer dette 2,5 gange den anbefalede humane dosis på basis af kropsoverfladeareal (2960 mg/m2/dag). I en 104-ugers diætcarcinogenicitetsundersøgelse i Wistar-rotter var mesalamin op til en dosis på 800 mg/kg/dag ikke tumorfremkaldende. Denne dosis repræsenterer 1,5 gange den anbefalede humane dosis på basis af kropsoverfladeareal.
Der blev ikke observeret tegn på mutagenicitet i en in vitro Ames-test og i en in vivo-muse mikronucleus-test.
Der blev ikke observeret nogen effekt på fertilitet eller reproduktionsevne hos han- eller hunrotter ved orale doser af mesalamin på op til 400 mg/kg/dag (0,8 gange den anbefalede humane dosis baseret på kropsoverfladeareal).
Sædabnormiteter og infertilitet hos mænd, som er blevet rapporteret i forbindelse med sulfasalazin, er ikke set med PENTASA 400 mg kapsler under kontrollerede kliniske forsøg.
Graviditet
Teratogene virkninger
Publicerede data fra metaanalyser, kohortestudier og case-serier om brugen af mesalamin under graviditet har ikke pålideligt informeret om en sammenhæng med mesalamin og alvorlige fødselsdefekter, abort eller uønskede maternelle eller føtale resultater. Der er ingen klar evidens for, at eksponering for mesalamin tidligt i graviditeten er forbundet med en øget risiko for større medfødte misdannelser, herunder hjertemisdannelser. Publicerede epidemiologiske undersøgelser har vigtige metodologiske begrænsninger, som hindrer fortolkning af dataene, herunder manglende evne til at kontrollere for konfoundere, såsom underliggende maternel sygdom, moderbrug af samtidig medicin og manglende information om dosis og varighed af brug for mesalaminprodukter. PENTASA bør kun anvendes under graviditet, hvis fordelene opvejer risiciene.
reproduktionsstudier på dyr afslørede oral administration af mesalamin under organogenese til drægtige rotter i doser op til 1000 mg/kg/dag (5900 mg/m²) og kaniner i doser på 800 mg/kg/dag (6856 mg/m²) ingen tegn. af teratogene virkninger eller skade på fosteret på grund af mesalamin.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for de angivne populationer er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og aborter i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Ikke-ratatogene virkninger
Publicerede data tyder på, at øget sygdomsaktivitet er forbundet med risikoen for at udvikle uønskede graviditetsudfald hos kvinder med colitis ulcerosa. Uønskede graviditetsresultater omfatter præmatur fødsel (før 37 ugers svangerskab), lav fødselsvægt (mindre end 2500 g) spædbørn og lille for svangerskabsalderen ved fødslen.
Ammende mødre
Data fra offentliggjort litteratur rapporterer tilstedeværelsen af mesalamin og dets metabolit, N-acetyl-5-aminosalicylsyre, i modermælk i små mængder med relative spædbørnsdoser (RID) på 0,1 % eller mindre for mesalamin. Den kliniske betydning af dette er ikke fastlagt, og der er begrænset erfaring med, at ammende kvinder bruger mesalamin.
Der er rapporter om diarré hos ammede spædbørn, der er udsat for mesalamin. Effekten af PENTASA 400 mg på mælkeproduktionen er ukendt. Udvis forsigtighed, hvis PENTASA 400mg administreres til en ammende kvinde, og overvåg ammede spædbørn for diarré.
offentliggjorte laktationsundersøgelser varierede maternelle mesalamindoser fra forskellige orale og rektale formuleringer og produkter fra 500 mg til 4,8 g dagligt. Den gennemsnitlige koncentration af mesalamin i mælk varierede fra ikke-påviselig til 0,5 mg/L. Den gennemsnitlige koncentration af N-acetyl-5-aminosalicylsyre i mælk varierede fra 0,2 til 9,3 mg/L. Baseret på disse koncentrationer er estimerede daglige doser af spædbørn for et spædbarn, der udelukkende ammes, 0 til 0,075 mg/kg/dag mesalamin (RID 0% til 0,1%) og 0,03 til 1,4 mg/kg/dag af N-acetyl-5-aminosalicylsyre syre.
Pædiatrisk brug
Sikkerhed og effekt af PENTASA hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Kliniske forsøg med PENTASA 400 mg inkluderede ikke et tilstrækkeligt antal patienter på 65 år og derover til at afgøre, om de reagerer anderledes end yngre patienter. Rapporter fra ukontrollerede kliniske undersøgelser og postmarketing rapporteringssystemer tydede på en højere forekomst af bloddyskrasier (dvs. agranulocytose, neutropeni og pancytopeni) hos patienter, der fik mesalaminholdige produkter såsom PENTASA 400 mg, som var 65 år eller ældre sammenlignet med yngre patienter. Overvåg fuldstændigt blodcelletal og blodpladetal hos ældre patienter under behandling med PENTASA.
Overvej generelt den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og samtidig sygdom eller anden lægemiddelbehandling hos ældre patienter, når PENTASA ordineres.
OVERDOSIS
PENTASA 400mg er et aminosalicylat, og symptomer på salicylattoksicitet kan være mulige, såsom: kvalme, opkastning, mavesmerter, takypnø, hyperpnø, tinnitus og neurologiske symptomer (hovedpine, svimmelhed, forvirring, anfald). Alvorlig forgiftning med salicylater kan føre til elektrolyt- og pH-ubalance i blodet og potentielt til skade på andre organer (f.eks. nyre og lever).
Behandling af overdosering
Der er ingen specifik modgift mod overdosering af mesalamin; konventionel behandling for salicylattoksicitet kan dog være fordelagtig i tilfælde af akut overdosering og kan omfatte dekontaminering af mave-tarmkanalen for at forhindre yderligere absorption. Korriger væske- og elektrolytforstyrrelser ved at indgive passende intravenøs behandling og bibehold tilstrækkelig nyrefunktion.
KONTRAINDIKATIONER
PENTASA er kontraindiceret til patienter med kendt eller mistænkt overfølsomhed over for salicylater, aminosalicylater eller andre komponenter i denne medicin.
KLINISK FARMAKOLOGI
Sulfasalazin opdeles ved bakteriel virkning i tyktarmen til sulfapyridin (SP) og mesalamin (5-ASA). Den sædvanlige orale dosis af sulfasalazin til aktiv colitis ulcerosa hos voksne er 2 til 4 g dagligt i opdelte doser. Fire gram sulfasalazin giver 1,6 g fri mesalamin til tyktarmen.
Virkningsmekanismen af mesalamin (og sulfasalazin) er ikke fuldt ud forstået, men det ser ud til at være en topisk anti-inflammatorisk effekt på colonepitelceller. Slimhindeproduktionen af arachidonsyre (AA)-metabolitter, både gennem cyclooxygenase-vejene (dvs. prostanoider) og gennem lipoxygenase-vejene (dvs. leukotriener (LT'er) og hydroxyeicosatetraensyrer (HETE'er), øges hos patienter med colitis ulcerosa, og det er muligt, at mesalamin mindsker inflammation ved at blokere cyclooxygenase og hæmme prostaglandin (PG) produktion i tyktarmen.
Human farmakokinetik og metabolisme
Absorption
PENTASA er en ethylcellulose-overtrukket formulering af mesalamin med forlænget frigivelse designet til at frigive terapeutiske mængder mesalamin i hele mave-tarmkanalen. Baseret på data om urinudskillelse absorberes 20 % til 30 % af mesalaminen i PENTASA. I modsætning hertil, når mesalamin indgives oralt som en uformuleret 1-g vandig suspension, absorberes mesalamin ca. 80 %.
Plasmamesalaminkoncentrationen toppede med ca. 1 mcg/ml 3 timer efter en 1-g PENTASA-dosis og faldt på en bifasisk måde. Litteraturen beskriver en gennemsnitlig terminal halveringstid på 42 minutter for mesalamin efter intravenøs administration. På grund af den kontinuerlige frigivelse og absorption af mesalamin fra PENTASA gennem mave-tarmkanalen, kan den sande eliminationshalveringstid ikke bestemmes efter oral administration. N-acetyl-5-aminosalicylsyre, hovedmetabolitten af mesalamin (5-aminosalicylsyre), toppede ved ca. 3 timer ved 1,8 mcg/ml, og dens koncentration fulgte et bifasisk fald. Farmakologiske aktiviteter af N-acetyl-5-aminosalicylsyre er ukendte, og andre metabolitter er ikke blevet identificeret.
Oral mesalamins farmakokinetik var ikke-lineær, når PENTASA-kapsler blev doseret fra 250 mg til 1 g fire gange dagligt, med steady-state mesalamin-plasmakoncentrationer, der steg omkring ni gange, fra 0,14 mcg/mL til 1,21 mcg/ml, hvilket tyder på mættet first-pass metabolisme. N-acetyl-5-aminosalicylsyre farmakokinetik var lineær.
Elimination
Omkring 130 mg fri mesalamin blev genfundet i fæces efter en enkelt 1-g PENTASA 400 mg dosis, hvilket var sammenligneligt med de 140 mg mesalamin, der blev udvundet fra den molære ækvivalente sulfasalazin-tabletdosis på 2,5 g. Elimination af fri mesalamin og salicylater i fæces steg proportionalt med PENTASA-dosis. N-acetyl-5-aminosalicylsyre var den primære forbindelse, der blev udskilt i urinen (19 % til 30 %) efter PENTASA 400 mg dosering.
Kliniske forsøg
to randomiserede, dobbeltblindede, placebokontrollerede, dosis-respons forsøg (UC-1 og UC-2) med 625 patienter med aktiv mild til moderat colitis ulcerosa, PENTASA 400 mg, ved en oral dosis på 4 g/dag givet 1 g fire gange dagligt, gav en konsekvent forbedring i prospektivt identificerede primære effektivitetsparametre, PGA, Tx F og SI som vist i tabellen nedenfor.
4-g dosis af PENTASA gav også konsekvent forbedring i sekundære effektparametre, nemlig hyppigheden af toiletbesøg, afføringens konsistens, rektal blødning, mave/rektale smerter og haster. 4-g dosis af PENTASA inducerede remission som vurderet ved endoskopiske og symptomatiske endepunkter.
Hos nogle patienter blev 2-g-dosis af PENTASA 400 mg observeret for at forbedre de målte effektparametre. Dog gav 2-g dosis inkonsistente resultater i primære effektparametre på tværs af de to tilstrækkelige og velkontrollerede forsøg.
PATIENTOPLYSNINGER
Ingen oplysninger givet. Der henvises til FORHOLDSREGLER afsnit.
