Prilosec 40mg, 10mg, 20mg Omeprazole Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Prilosec 40mg, og hvordan bruges det?
Prilosec 40mg er et receptpligtigt og håndkøbslægemiddel, der bruges til at behandle symptomer på gastroøsofageal reflukssygdom (GERD), mavesår og andre tilstande forårsaget af overskydende mavesyre. Prilosec 10mg kan bruges alene eller sammen med anden medicin.
Prilosec tilhører en klasse af lægemidler kaldet protonpumpehæmmere.
Det vides ikke, om Prilosec 40mg er sikkert og effektivt til børn under 1 måned.
Hvad er de mulige bivirkninger af Prilosec 10mg?
Prilosec kan forårsage alvorlige bivirkninger, herunder:
- stærke mavesmerter,
- diarré, der er vandig eller blodig,
- nye eller usædvanlige smerter i håndled, lår, hofte eller ryg,
- krampeanfald (kramper),
- lidt eller ingen vandladning,
- blod i din urin,
- hævelse,
- hurtig vægtøgning,
- svimmelhed,
- uregelmæssige hjerteslag,
- føler sig nervøs,
- muskelkramper,
- muskelspasmer,
- hoste,
- kvælende følelse,
- ledsmerter, og
- hududslæt på dine kinder eller arme, der forværres af sollys
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Prilosec omfatter:
- mavesmerter,
- gas,
- kvalme,
- opkastning,
- diarré, og
- hovedpine
BESKRIVELSE
Den aktive ingrediens i PRILOSEC (omeprazol) kapsler med forsinket frigivelse er en substitueret benzimidazol, 5-methoxy-2-[[(4-methoxy-3, 5-dimethyl-2-pyridinyl) methyl]sulfinyl]-1H-benzimidazol, en forbindelse, der hæmmer mavesyresekretion. Dens empiriske formel er C17H19N3O3S, med en molekylvægt på 345,42. Strukturformlen er:
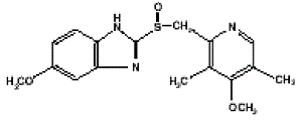
Omeprazol er et hvidt til råhvidt krystallinsk pulver, der smelter ved nedbrydning ved ca. 155°C. Det er en svag base, frit opløselig i ethanol og methanol, og lidt opløselig i acetone og isopropanol og meget lidt opløselig i vand. Stabiliteten af omeprazol er en funktion af pH; det nedbrydes hurtigt i sure medier, men har acceptabel stabilitet under alkaliske betingelser.
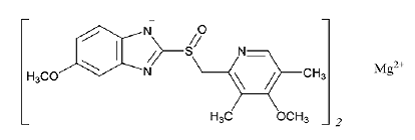
Den aktive ingrediens i PRILOSEC (omeprazolmagnesium) til oral suspension med forsinket frigivelse er 5-methoxy-2-[[(4-methoxy-3,5-dimethyl-2-pyridinyl)methyl]sulfinyl]-1H-benzimidazol, magnesium salt (2:1)
Omeprazolmagnesium er et hvidt til råhvidt pulver med et smeltepunkt ved nedbrydning ved 200°C. Saltet er let opløseligt (0,25 mg/ml) i vand ved 25°C, og det er opløseligt i methanol. Halveringstiden er meget pH-afhængig.
Den empiriske formel for omeprazolmagnesium er (C17H18N3O3S)2 Mg, molekylvægten er 713,12 og strukturformlen er:
PRILOSEC leveres som kapsler med forsinket frigivelse til oral administration. Hver kapsel med forsinket frigivelse indeholder enten 10 mg, 20 mg eller 40 mg omeprazol i form af enterisk coatede granula med følgende inaktive ingredienser: cellulose, dinatriumhydrogenphosphat, hydroxypropylcellulose, hypromellose, lactose, mannitol, natriumlaurylsulfat og andre ingredienser. Kapselskallerne har følgende inaktive ingredienser: gelatine-NF, FD&C Blue #1, FD&C Red #40, D&C Red #28, titaniumdioxid, syntetisk sort jernoxid, isopropanol, butylalkohol, FD&C Blue #2, D&C Red #7 Calcium Lake, og derudover indeholder 10 mg og 40 mg kapselskallerne også D&C Yellow #10.
Hver pakke PRILOSEC For Delayed-Release Oral Suspension indeholder enten 2,8 mg eller 11,2 mg omeprazolmagnesium (svarende til 2,5 mg eller 10 mg omeprazol), i form af enterisk coatede granula med følgende inaktive ingredienser: glycerylmonostearat, hydroxypropyl cellulose, hypromellose, magnesiumstearat, methacrylsyre copolymer C, polysorbat, sukkerkugler, talkum og triethylcitrat, og også inaktive granulat. De inaktive granula er sammensat af følgende ingredienser: citronsyre, crospovidon, dextrose, hydroxypropylcellulose, jernoxid og xanthamgummi. Omeprazolgranulatet og det inaktive granulat er konstitueret med vand til dannelse af en suspension og gives ved oral, nasogastrisk eller direkte gastrisk administration.
INDIKATIONER
Behandling af aktivt duodenalsår
PRILOSEC 20mg er indiceret til korttidsbehandling af aktivt duodenalsår hos voksne. De fleste patienter heler inden for fire uger. Nogle patienter kan have behov for yderligere fire ugers behandling.
Helicobacter pylori udryddelse for at reducere risikoen for tilbagefald af duodenalsår
Udryddelse af H. pylori har vist sig at reducere risikoen for tilbagefald af duodenalsår.
Tredobbelt terapi
PRILOSEC 40 mg i kombination med clarithromycin og amoxicillin er indiceret til behandling af patienter med H. pylori-infektion og duodenalsårsygdom (aktiv eller op til 1 års historie) for at udrydde H. pylori hos voksne.
Dobbelt terapi
PRILOSEC i kombination med clarithromycin er indiceret til behandling af patienter med H. pylori-infektion og duodenal ulcus sygdom for at udrydde H. pylori hos voksne.
Blandt patienter, som ikke behandles, er PRILOSEC med clarithromycin mere tilbøjelige til at være forbundet med udvikling af clarithromycinresistens sammenlignet med tripelbehandling. Hos patienter, der mislykkes i behandlingen, bør der udføres følsomhedstest. Hvis der påvises resistens over for clarithromycin, eller følsomhedstestning ikke er mulig, bør alternativ antimikrobiel behandling påbegyndes [se KLINISK FARMAKOLOGI og clarithromycin ordinationsinformation, mikrobiologi afsnit].
Behandling af aktivt godartet mavesår
PRILOSEC er indiceret til korttidsbehandling (4 til 8 uger) af aktivt godartet mavesår hos voksne.
Behandling af symptomatisk gastroøsofageal reflukssygdom (GERD)
PRILOSEC er indiceret til behandling af halsbrand og andre symptomer forbundet med GERD i op til 4 uger hos patienter på 1 år og ældre.
Behandling af erosiv øsofagitis (EE) på grund af syremedieret GERD
Pædiatriske patienter i alderen 1 år til voksne
PRILOSEC 20 mg er indiceret til korttidsbehandling (4 til 8 uger) af EE på grund af syremedieret GERD, som er blevet diagnosticeret ved endoskopi hos patienter på 1 år og ældre.
Effekten af PRILOSEC 10 mg brugt i mere end 8 uger hos patienter med EE er ikke blevet fastslået. Hvis en patient ikke reagerer på 8 ugers behandling, kan der gives yderligere 4 ugers behandling. Hvis der er gentagelse af EE- eller GERD-symptomer (f.eks. halsbrand), kan yderligere 4 til 8 ugers forløb med PRILOSEC overvejes.
Pædiatriske patienter fra 1 måned til under 1 år
PRILOSEC er indiceret til korttidsbehandling (op til 6 uger) af EE på grund af syremedieret GERD hos pædiatriske patienter i alderen 1 måned til under 1 år.
Vedligeholdelse af heling af EE på grund af syremedieret GERD
PRILOSEC 40mg er indiceret til vedligeholdelsesheling af EE på grund af syremedieret GERD hos patienter på 1 år og ældre.
Kontrollerede undersøgelser strækker sig ikke ud over 12 måneder.
Patologiske hypersekretoriske tilstande
PRILOSEC 40 mg er indiceret til langtidsbehandling af patologiske hypersekretoriske tilstande (f.eks. Zollinger-Ellisons syndrom, multiple endokrine adenomer og systemisk mastocytose) hos voksne.
DOSERING OG ADMINISTRATION
Anbefalet doseringsregime for voksne efter indikation
Tabel 1 viser den anbefalede dosis af PRILOSEC 40 mg til voksne patienter efter indikation.
Anbefalet pædiatrisk doseringsregime efter indikation
Tabel 2 viser den anbefalede dosis af PRILOSEC til pædiatriske patienter efter indikation.
Administrationsinstruktioner
- PRILOSEC 40mg er beregnet til at blive tilberedt i vand og indgivet oralt eller via en nasogastrisk (NG) eller gastrisk sonde.
- Tag PRILOSEC 40 mg før måltider.
- Antacida kan anvendes samtidig med PRILOSEC.
- Glemte doser: Hvis en dosis glemmes, indgives så hurtigt som muligt. Men hvis den næste planlagte dosis er på vej, skal du ikke tage den glemte dosis, og tage den næste dosis til tiden. Tag ikke to doser ad gangen for at kompensere for en glemt dosis.
Oral administration i vand
Administration med vand via en NG eller mavesonde (størrelse 6 eller større)
HVORDAN LEVERET
Doseringsformer og styrker
PRILOSEC til oral suspension med forsinket frigivelse: 2,5 mg og 10 mg omeprazol i enhedsdosispakker indeholdende et fint gult pulver, bestående af hvide til brunlige omeprazolmagnesiumgranulat og bleggule inaktive granulat.
Opbevaring og håndtering
PRILOSEC (omeprazolmagnesium) til oral suspension med forsinket frigivelse, 2,5 mg eller 10 mg omeprazol, leveres som en enhedsdosispakke indeholdende et fint gult pulver, bestående af hvide til brunlige omeprazolmagnesiumgranulater og bleggule inaktive granula. PRILOSEC enhedsdosispakker leveres som følger:
NDC 70515-625-01 enhedsdosispakninger á 30: 2,5 mg pakker NDC 70515-610–01 enhedsdosispakninger á 30: 10 mg pakker
Opbevaring
Opbevar PRILOSEC til oral suspension med forsinket frigivelse ved 25°C (77°F); udflugter tilladt til 15 – 30°C (59 – 86°F). [Se USP kontrolleret rumtemperatur .]
Fremstillet til: Covis Pharma, Zug, 6300 Schweiz. Revideret: Marts 2022
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i mærkningen:
- Akut Tubulointerstitiel nefritis [se ADVARSLER OG FORHOLDSREGLER ]
- Clostridium difficile-associeret diarré [se ADVARSLER OG FORHOLDSREGLER ]
- Knoglebrud [se ADVARSLER OG FORHOLDSREGLER ]
- Alvorlige kutane bivirkninger [se ADVARSLER OG FORHOLDSREGLER ]
- Kutan og systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ]
- Cyanocobalamin (vitamin B-12) mangel [se ADVARSLER OG FORHOLDSREGLER ]
- Hypomagnesæmi og mineralmetabolisme [se ADVARSLER OG FORHOLDSREGLER ]
- Fundiske kirtelpolypper [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg med PRILOSEC
Monoterapi
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Sikkerhedsdataene beskrevet nedenfor afspejler eksponering for omeprazolmagnesium kapsler med forsinket frigivelse hos 3096 patienter fra verdensomspændende kliniske forsøg (465 patienter fra amerikanske studier og 2631 patienter fra internationale studier). Klinisk undersøgte indikationer i amerikanske forsøg omfattede duodenalsår, resistente ulcus og Zollinger-Ellisons syndrom. De internationale kliniske forsøg var dobbeltblinde og åben-label i design. De mest almindelige rapporterede bivirkninger (dvs. med en incidensrate ≥2 %) fra PRILOSEC-behandlede patienter inkluderet i disse undersøgelser omfattede hovedpine (7 %), mavesmerter (5 %), kvalme (4 %), diarré (4 %). ), opkastning (3 %) og flatulens (3 %).
Yderligere bivirkninger, der blev rapporteret med en incidens på ≥1 % inkluderede sure opstød (2 %), øvre luftvejsinfektion (2 %), forstoppelse (2 %), svimmelhed (2 %), udslæt (2 %), asteni (1 % ), rygsmerter (1 %) og hoste (1 %).
Sikkerhedsprofilen i kliniske forsøg hos patienter over 65 år svarede til den hos patienter på 65 år eller derunder.
Sikkerhedsprofilen i kliniske forsøg hos pædiatriske patienter, som fik omeprazol-magnesium-kapsler med forsinket frigivelse, svarede til den hos voksne patienter. Unikt for den pædiatriske population blev der dog hyppigt rapporteret bivirkninger i luftvejene i aldersgruppen 1 måned til Brug i specifikke populationer ].
Erfaring med kliniske forsøg med PRILOSEC 20 mg i kombinationsterapi til udryddelse af H. pylori
kliniske undersøgelser med enten dobbeltbehandling med omeprazolmagnesium forsinket frigivelseskapsler og clarithromycin eller tredobbeltbehandling med omeprazolmagnesiumforsinket frigivelseskapsler, clarithromycin og amoxicillin, blev der ikke observeret bivirkninger unikke for disse lægemiddelkombinationer. De observerede bivirkninger var begrænset til dem, der tidligere er rapporteret med omeprazol, clarithromycin eller amoxicillin alene.
Dobbeltterapi (omeprazol magnesium kapsler med forsinket frigivelse/clarithromycin)
Bivirkninger observeret i kontrollerede kliniske forsøg med kombinationsbehandling med omeprazol-magnesium-kapsler med forsinket frigivelse og clarithromycin (n = 346), som afveg fra dem, der tidligere er beskrevet for omeprazol-magnesium-kapsler med forsinket frigivelse alene, var smagsforstyrrelser (15 %), misfarvning af tungen (2) %), rhinitis (2%), pharyngitis (1%) og influenzasyndrom (1%). (For mere information om clarithromycin henvises til clarithromycin ordinationsoplysninger, afsnittet Bivirkninger.)
Triple Therapy (omeprazol magnesium kapsler med forsinket frigivelse/clarithromycin/amoxicillin)
De hyppigste bivirkninger observeret i kliniske forsøg med kombinationsbehandling med omeprazol-magnesium-kapsler med forsinket frigivelse, clarithromycin og amoxicillin (n = 274) var diarré (14 %), smagsforstyrrelser (10 %) og hovedpine (7 %). Ingen af disse forekom med en højere frekvens end rapporteret af patienter, der tog antimikrobielle midler alene. (For mere information om clarithromycin eller amoxicillin henvises til de respektive ordinationsoplysninger, afsnittet Bivirkninger).
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af omeprazol efter godkendelse. Fordi disse reaktioner er frivilligt rapporteret fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres faktiske hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Kroppen som helhed: Overfølsomhedsreaktioner inklusive anafylaksi, anafylaktisk shock, angioødem, bronkospasme, interstitiel nefritis, nældefeber (se også Hud nedenfor); feber; smerte; træthed; utilpashed; systemisk lupus erythematosus
Kardiovaskulær: Brystsmerter eller angina, takykardi, bradykardi, hjertebanken, forhøjet blodtryk, perifert ødem
Endokrine: Gynækomasti
Gastrointestinale: Pancreatitis (nogle dødelig), anoreksi, irritabel tyktarm, fækal misfarvning, esophageal candidiasis, slimhindeatrofi af tungen, stomatitis, abdominal hævelse, mundtørhed, mikroskopisk colitis, fundic kirtel polypper.
Gastroduodenale carcinoider er blevet rapporteret hos patienter med ZE-syndrom i langtidsbehandling med omeprazol. Dette fund menes at være en manifestation af den underliggende tilstand, som vides at være forbundet med sådanne tumorer.
Hepatisk: Leversygdom, herunder leversvigt (nogle dødelige), levernekrose (nogle dødelige), hepatisk encefalopati hepatocellulær sygdom, kolestatisk sygdom, blandet hepatitis, gulsot og forhøjede leverfunktionsprøver [ALT, AST, GGT, alkalisk fosfatase og bilirubin]
Infektioner og angreb: Clostridium difficile-associeret diarré
Metabolisme og ernæringsforstyrrelser: Hypomagnesæmi, hypocalcæmi, hypokaliæmi [advarsler og forholdsregler 5.9], hyponatriæmi, hypoglykæmi, vægtøgning
Muskuloskeletale: Muskelsvaghed, myalgi, muskelkramper, ledsmerter, bensmerter, knoglebrud
Nervesystem/psykiatrisk: Psykiatriske forstyrrelser og søvnforstyrrelser, herunder depression, agitation, aggression, hallucinationer, forvirring, søvnløshed, nervøsitet, apati, somnolens, angst og drømmeabnormiteter; rysten, paræstesi; svimmelhed
Åndedræt: Epistaxis, svælgsmerter
Hud: Alvorlige generaliserede hudreaktioner inklusive toksisk SJS/TEN (nogle dødelig), DRESS, AGEP, kutan lupus erythematosus og erythema multiforme; lysfølsomhed; nældefeber; udslæt; hudbetændelse; kløe; petekkier; purpura; alopeci; tør hud; hyperhidrose
Særlige sanser: Tinnitus, smagsforstyrrelse
Okulært: Optisk atrofi, anterior iskæmisk optisk neuropati, optisk neuritis, tørre øjne syndrom, øjenirritation, sløret syn, dobbeltsyn
Urogenital: Interstitiel nefritis, hæmaturi, proteinuri, forhøjet serumkreatinin, mikroskopisk pyuri, urinvejsinfektion, glykosuri, vandladningsfrekvens, testikelsmerter
Hæmatologisk: Agranulocytose (nogle dødelig), hæmolytisk anæmi, pancytopeni, neutropeni, anæmi, trombocytopeni, leukopeni, leukocytose
DRUGSINTERAKTIONER
Tabel 3 og 4 inkluderer lægemidler med klinisk vigtige lægemiddelinteraktioner og interaktion med diagnostik, når de administreres samtidig med omeprazol og instruktioner til at forebygge eller håndtere dem.
Se mærkningen af samtidig anvendte lægemidler for at få yderligere oplysninger om interaktioner med PPI'er.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Tilstedeværelse af gastrisk malignitet
Hos voksne udelukker symptomatisk respons på behandling med PRILOSEC ikke tilstedeværelsen af gastrisk malignitet. Overvej yderligere opfølgning og diagnostisk testning hos voksne patienter, som har et suboptimalt respons eller et tidligt symptomatisk tilbagefald efter endt behandling med en PPI. Overvej også en endoskopi hos ældre patienter.
Akut Tubulointerstitiel nefritis
Akut tubulointerstitiel nefritis (TIN) er blevet observeret hos patienter, der tager PPI'er og kan forekomme på ethvert tidspunkt under PPI-behandling. Patienter kan vise sig med forskellige tegn og symptomer fra symptomatiske overfølsomhedsreaktioner til uspecifikke symptomer på nedsat nyrefunktion (f.eks. utilpashed, kvalme, anoreksi). I rapporterede tilfældeserier blev nogle patienter diagnosticeret på biopsi og i fravær af ekstrarenale manifestationer (f.eks. feber, udslæt eller artralgi). Seponer PRILOSEC 40 mg og evaluer patienter med mistanke om akut TIN [se KONTRAINDIKATIONER ].
Clostridium Difficile-associeret diarré
Publicerede observationsstudier tyder på, at PPI-behandling som PRILOSEC kan være forbundet med en øget risiko for Clostridium difficile-associeret diarré, især hos indlagte patienter. Denne diagnose bør overvejes for diarré, der ikke forbedres [se BIVIRKNINGER ].
Patienter bør anvende den laveste dosis og korteste varighed af PPI-behandling, der er passende til den tilstand, der behandles.
Clostridium difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler. For mere information, der er specifik for antibakterielle midler (clarithromycin og amoxicillin), der er indiceret til brug i kombination med PRILOSEC, henvises til afsnittet Advarsler og Forsigtighedsregler i den tilsvarende ordinationsinformation.
Knoglebrud
Adskillige publicerede observationsstudier tyder på, at behandling med protonpumpehæmmere (PPI) kan være forbundet med en øget risiko for osteoporose-relaterede frakturer i hofte, håndled eller rygsøjle. Risikoen for fraktur var øget hos patienter, der fik høje doser, defineret som flere daglige doser, og langvarig PPI-behandling (et år eller længere). Patienter bør anvende den laveste dosis og korteste varighed af PPI-behandling, der er passende til den tilstand, der behandles. Patienter med risiko for osteoporose-relaterede frakturer bør behandles i henhold til etablerede behandlingsretningslinjer [se DOSERING OG ADMINISTRATION , BIVIRKNINGER ].
Alvorlige kutane bivirkninger
Alvorlige kutane bivirkninger, herunder Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) og akut generaliseret eksantematøs pustulose (AGEP) er blevet rapporteret i forbindelse med brugen af PPI'er [se BIVIRKNINGER ]. Seponer PRILOSEC ved de første tegn eller symptomer på alvorlige kutane bivirkninger eller andre tegn på overfølsomhed og overvej yderligere evaluering.
Kutan og systemisk lupus erythematosus
Kutan lupus erythematosus (CLE) og systemisk lupus erythematosus (SLE) er blevet rapporteret hos patienter, der tager PPI'er, inklusive omeprazol. Disse hændelser er opstået som både nyopstået og en forværring af eksisterende autoimmun sygdom. Størstedelen af PPI-inducerede lupus erythematosus tilfælde var CLE.
Den mest almindelige form for CLE rapporteret hos patienter behandlet med PPI'er var subakut CLE (SCLE) og forekom inden for uger til år efter kontinuerlig lægemiddelbehandling hos patienter lige fra spædbørn til ældre. Generelt blev histologiske fund observeret uden organinvolvering.
Systemisk lupus erythematosus (SLE) er mindre almindeligt rapporteret end CLE hos patienter, der får PPI'er. PPI-associeret SLE er normalt mildere end ikke-lægemiddelinduceret SLE. Indtræden af SLE forekom typisk inden for dage til år efter påbegyndelse af behandling, primært hos patienter lige fra unge voksne til ældre. Størstedelen af patienterne fik udslæt; dog blev der også rapporteret om artralgi og cytopeni.
Undgå administration af PPI'er i længere tid end medicinsk indiceret. Hvis der konstateres tegn eller symptomer, der stemmer overens med CLE eller SLE, hos patienter, der får PRILOSEC 10 mg, skal lægemidlet seponeres og patienten henvises til den relevante specialist for evaluering. De fleste patienter forbedres ved seponering af PPI alene i 4 til 12 uger. Serologiske test (f.eks. ANA) kan være positive, og forhøjede serologiske testresultater kan tage længere tid at løse end kliniske manifestationer.
Interaktion med Clopidogrel
Undgå samtidig brug af PRILOSEC 10 mg og clopidogrel. Clopidogrel er et prodrug. Hæmning af trombocytaggregation af clopidogrel skyldes udelukkende en aktiv metabolit. Metabolismen af clopidogrel til dets aktive metabolit kan forringes ved brug sammen med samtidig medicin, såsom omeprazol, der hæmmer CYP2C19-aktivitet. Samtidig brug af clopidogrel og 80 mg omeprazol reducerer den farmakologiske aktivitet af clopidogrel, selv når det administreres med 12 timers mellemrum.
Når du bruger PRILOSEC, skal du overveje alternativ trombocythæmmende behandling [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
Cyanocobalamin (vitamin B-12) mangel
Daglig behandling med syrehæmmende medicin over en længere periode (f.eks. længere end 3 år) kan føre til malabsorption af cyanocobalamin (vitamin B-12) forårsaget af hypo- eller achlorhydri. Sjældne rapporter om cyanocobalaminmangel, der forekommer i forbindelse med syreundertrykkende behandling, er blevet rapporteret i litteraturen. Denne diagnose bør overvejes, hvis der observeres kliniske symptomer i overensstemmelse med cyanocobalaminmangel hos patienter behandlet med PRILOSEC.
Hypomagnesæmi og mineralmetabolisme
Hypomagnesæmi, symptomatisk og asymptomatisk, er sjældent blevet rapporteret hos patienter behandlet med PPI i mindst tre måneder, i de fleste tilfælde efter et års behandling. Alvorlige bivirkninger omfatter tetany, arytmier og anfald. Hypomagnesæmi kan føre til hypocalcæmi og/eller hypokaliæmi og kan forværre underliggende hypocalcæmi hos risikopatienter. Hos de fleste patienter krævede behandling af hypomagnesiæmi magnesiumerstatning og seponering af PPI.
For patienter, der forventes at være i langvarig behandling, eller som tager PPI'er sammen med medicin såsom digoxin eller lægemidler, der kan forårsage hypomagnesæmi (f.eks. diuretika), kan sundhedspersonale overveje at overvåge magnesiumniveauer før påbegyndelse af PPI-behandling og periodisk [se BIVIRKNINGER ].
Overvej at monitorere magnesium- og calciumniveauer før påbegyndelse af PRILOSEC og periodisk under behandling hos patienter med en allerede eksisterende risiko for hypocalcæmi (f.eks. hypoparathyroidisme). Suppler med magnesium og/eller calcium efter behov. Hvis hypocalcæmi er refraktær over for behandling, skal du overveje at seponere PPI.
Interaktion med perikon eller rifampin
Lægemidler, der inducerer CYP2C19 eller CYP3A4 (såsom perikon eller rifampin) kan nedsætte omeprazolkoncentrationerne væsentligt [se DRUGSINTERAKTIONER ]. Undgå samtidig brug af PRILOSEC og perikon eller rifampin.
Interaktioner med diagnostiske undersøgelser for neuroendokrine tumorer
Serumchromogranin A (CgA) niveauer stiger sekundært til lægemiddelinducerede fald i mavesyreindholdet. Det øgede CgA-niveau kan forårsage falske positive resultater i diagnostiske undersøgelser for neuroendokrine tumorer. Sundhedsudbydere bør midlertidigt stoppe behandlingen med PRILOSEC 20 mg mindst 14 dage før vurdering af CgA-niveauer og overveje at gentage testen, hvis de initiale CgA-niveauer er høje. Hvis der udføres serielle tests (f.eks. til overvågning), bør det samme kommercielle laboratorium bruges til test, da referenceintervaller mellem test kan variere [se DRUGSINTERAKTIONER ].
Interaktion med methotrexat
Litteraturen tyder på, at samtidig brug af PPI'er med methotrexat (primært i høje doser) kan hæve og forlænge serumniveauer af methotrexat og/eller dets metabolit, hvilket muligvis kan føre til methotrexattoksicitet. Ved højdosis methotrexatadministration kan en midlertidig seponering af PPI overvejes hos nogle patienter [se DRUGSINTERAKTIONER ].
Fundiske kirtelpolypper
PPI-brug er forbundet med en øget risiko for fundiske kirtelpolypper, der øges ved langvarig brug, især ud over et år. De fleste PPI-brugere, som udviklede fundiske kirtelpolypper, var asymptomatiske, og fundiske kirtelpolypper blev identificeret ved endoskopi. Brug den korteste varighed af PPI-behandling, der passer til den tilstand, der behandles.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( Medicinvejledning og brugsanvisning ).
Akut Tubulointerstitiel nefritis
Råd patienten eller plejepersonalet til straks at ringe til patientens sundhedsplejerske, hvis de oplever tegn og/eller symptomer forbundet med akut tubulointerstitiel nefritis [se ADVARSLER OG FORHOLDSREGLER ].
Clostridium Difficile-associeret diarré
Råd patienten eller plejepersonalet til straks at ringe til patientens sundhedsplejerske, hvis de oplever diarré, der ikke forbedres [se ADVARSLER OG FORHOLDSREGLER ].
Knoglebrud
Rådgiv patienten eller plejepersonalet om at rapportere eventuelle frakturer, især i hofte, håndled eller rygsøjle, til patientens sundhedsplejerske [se ADVARSLER OG FORHOLDSREGLER ].
Alvorlige kutane bivirkninger
Rådgive patienten eller omsorgspersonen om at seponere PRILOSEC 40 mg og rapportere til deres læge ved første tilsynekomst af en alvorlig kutan bivirkning eller andre tegn på overfølsomhed [se ADVARSLER OG FORHOLDSREGLER ].
Kutan og systemisk lupus erythematosus
Rådgiv patienten eller plejepersonalet om straks at ringe til patientens sundhedsplejerske for nye eller forværrede symptomer forbundet med kutan eller systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ]
Cyanocobalamin (vitamin B-12) mangel
Rådgiv patienten eller plejepersonalet om at rapportere alle kliniske symptomer, der kan være forbundet med cyanocobalaminmangel, til patientens sundhedsplejerske, hvis de har fået PRILOSEC i mere end 3 år [se ADVARSLER OG FORHOLDSREGLER ].
Hypomagnesæmi og mineralmetabolisme
Rådgiv patienten eller plejepersonalet om at rapportere alle kliniske symptomer, der kan være forbundet med hypomagnesæmi, hypocalcæmi og/eller hypokaliæmi, til patientens sundhedsplejerske, hvis de har fået PRILOSEC i mindst 3 måneder [se ADVARSLER OG FORHOLDSREGLER ].
Lægemiddelinteraktioner
Rådgive patienter om at rapportere til deres læge, hvis de starter behandling med rilpivirin-holdige produkter, clopidogrel, perikon eller rifampin; eller, hvis de tager højdosis methotrexat [se KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER ].
Administration
- PRILOSEC er beregnet til at blive tilberedt i vand og indgivet oralt eller via en nasogastrisk (NG) eller gastrisk sonde, som beskrevet i medicinvejledningen.
- Tag PRILOSEC før måltider.
- Antacida kan anvendes samtidig med PRILOSEC.
- Glemte doser: Hvis en dosis glemmes, indgives så hurtigt som muligt. Men hvis den næste planlagte dosis er på vej, skal du ikke tage den glemte dosis, og tage den næste dosis til tiden. Tag ikke to doser ad gangen for at kompensere for en glemt dosis.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
to 24-måneders carcinogenicitetsundersøgelser hos rotter, omeprazol i daglige doser på 1,7, 3,4, 13,8, 44,0 og 140,8 mg/kg/dag (ca. 0,4 til 34 gange en human dosis på 40 mg/dag, udtrykt på en kropsoverflade arealbasis) producerede gastriske ECL-cellecarcinoider på en dosisrelateret måde i både han- og hunrotter; forekomsten af denne effekt var markant højere hos hunrotter, som havde højere blodniveauer af omeprazol. Mavecarcinoider forekommer sjældent hos ubehandlede rotter. Derudover var ECL-cellehyperplasi til stede i alle behandlede grupper af begge køn. I en af disse undersøgelser blev hunrotter behandlet med 13,8 mg omeprazol/kg/dag (ca. 3,4 gange en human dosis på 40 mg/dag, baseret på kropsoverfladeareal) i et år, og derefter fulgt i yderligere et år uden medicin. Ingen carcinoider blev set hos disse rotter. En øget forekomst af behandlingsrelateret ECL-cellehyperplasi blev observeret ved udgangen af et år (94 % behandlede vs. 10 % kontroller). Ved det andet år var forskellen mellem behandlede og kontrolrotter meget mindre (46 % vs. 26 %), men udviste stadig mere hyperplasi i den behandlede gruppe. Gastrisk adenocarcinom blev set hos én rotte (2%). Ingen lignende tumor blev set hos han- eller hunrotter behandlet i to år. For denne rottestamme er der ikke historisk set nogen lignende tumor, men et fund, der kun involverer én tumor, er vanskeligt at fortolke. I et 52-ugers toksicitetsstudie i Sprague-Dawley-rotter blev hjerneastrocytomer fundet hos et lille antal hanner, der fik omeprazol i dosisniveauer på 0,4, 2 og 16 mg/kg/dag (ca. 0,1 til 3,9 gange den humane dosis) på 40 mg/dag, baseret på kropsoverfladebasis). Ingen astrocytomer blev observeret hos hunrotter i denne undersøgelse. I et 2-årigt carcinogenicitetsstudie i Sprague-Dawley-rotter blev der ikke fundet astrocytomer hos hanner eller hunner med den høje dosis på 140,8 mg/kg/dag (ca. 34 gange den humane dosis på 40 mg/dag på basis af kropsoverfladeareal) . En 78-ugers musekarcinogenicitetsundersøgelse af omeprazol viste ikke øget tumorforekomst, men undersøgelsen var ikke afgørende. En 26-ugers p53 (+/-) transgen mus carcinogenicitetsundersøgelse var ikke positiv.
Omeprazol var positiv for klastogene virkninger i en in vitro human lymfocytkromosomafvigelsesassay, i en af to in vivo muse mikronucleus tests og i en in vivo knoglemarvscelle kromosomafvigelsesanalyse. Omeprazol var negativ i in vitro Ames-testen, en in vitro muselymfomcelle-forlænsmutationsanalyse og en in vivo-test for rottelever-DNA-skade.
Omeprazol ved orale doser op til 138 mg/kg/dag hos rotter (ca. 34 gange en oral human dosis på 40 mg på basis af kropsoverfladeareal) viste sig ikke at have nogen effekt på fertilitet og reproduktionsevne.
I 24-måneders carcinogenicitetsundersøgelser hos rotter blev en dosisrelateret signifikant stigning i gastriske carcinoide tumorer og ECL-cellehyperplasi observeret hos både han- og hundyr [se ADVARSLER OG FORHOLDSREGLER ]. Carcinoide tumorer er også blevet observeret hos rotter, der er blevet udsat for fundektomi eller langtidsbehandling med andre protonpumpehæmmere eller høje doser af H2-receptorantagonister.
Brug i specifikke populationer
Graviditet
Risikooversigt
Der er ingen tilstrækkelige og velkontrollerede undersøgelser med omeprazol hos gravide kvinder. Tilgængelige epidemiologiske data viser ikke en øget risiko for alvorlige medfødte misdannelser eller andre uønskede graviditetsudfald ved brug af omeprazol i første trimester. Reproduktionsundersøgelser hos rotter og kaniner resulterede i dosisafhængig embryodødelighed ved omeprazoldoser, der var ca. 3,4 til 34 gange en oral human dosis på 40 mg (baseret på et kropsoverfladeareal for en person på 60 kg).
Teratogenicitet blev ikke observeret i dyrereproduktionsundersøgelser med administration af oral esomeprazol (en enantiomer af omeprazol) magnesium hos rotter og kaniner under organogenese med doser henholdsvis ca. 68 gange og 42 gange en oral human dosis på 40 mg esomeprazol eller 40 mg omeprazol baseret på kropsoverfladeareal for en person på 60 kg).
Ændringer i knoglemorfologi blev observeret hos afkom af rotter doseret gennem det meste af drægtighed og amning ved doser lig med eller større end ca. 34 gange en oral human dosis på 40 mg esomeprazol eller 40 mg omeprazol. Når moderens administration kun var begrænset til drægtighed, var der ingen virkninger på knoglefysisk morfologi hos afkommet på nogen alder [se Data ].
De estimerede baggrundsrisici for alvorlige fødselsdefekter og abort for den angivne population er ukendte. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Data
Menneskelige data
Fire offentliggjorte epidemiologiske undersøgelser sammenlignede hyppigheden af medfødte abnormiteter blandt spædbørn født af kvinder, der brugte omeprazol under graviditeten, med hyppigheden af abnormiteter blandt spædbørn af kvinder, der blev udsat for H2-receptorantagonister eller andre kontroller.
En populationsbaseret retrospektiv kohorte epidemiologisk undersøgelse fra det svenske medicinske fødselsregister, der dækkede ca. 99 % af graviditeterne, fra 1995 til 99, rapporterede om 955 spædbørn (824 eksponerede i første trimester med 39 af disse eksponeret efter første trimester, og 131 eksponerede efter første trimester), hvis mødre brugte omeprazol under graviditeten. Antallet af spædbørn, der blev eksponeret in utero for omeprazol, som havde nogen form for misdannelse, lav fødselsvægt, lav Apgar-score eller hospitalsindlæggelse svarede til det antal, der blev observeret i denne population. Antallet af spædbørn født med ventrikulære septumdefekter og antallet af dødfødte spædbørn var lidt højere hos de omeprazol-eksponerede spædbørn end det forventede antal i denne population.
Et populationsbaseret retrospektivt kohortestudie, der dækkede alle levendefødte i Danmark fra 1996 til 2009, rapporterede om 1.800 levendefødte, hvis mødre brugte omeprazol i graviditetens første trimester, og 837.317 levendefødte, hvis mødre ikke brugte nogen protonpumpehæmmer. Den samlede frekvens af fødselsdefekter hos spædbørn født af mødre med første trimester eksponering for omeprazol var 2,9 % og 2,6 % hos spædbørn født af mødre, der ikke blev udsat for nogen protonpumpehæmmer i første trimester.
En retrospektiv kohorteundersøgelse rapporterede om 689 gravide kvinder, der blev eksponeret for enten H2-blokkere eller omeprazol i første trimester (134 eksponerede for omeprazol) og 1.572 gravide kvinder, der ikke blev eksponeret for enten i første trimester. Den samlede misdannelsesrate hos afkom født af mødre med første trimester eksponering for omeprazol, en H2-blokker, eller var ueksponeret, var henholdsvis 3,6 %, 5,5 % og 4,1 %.
Et lille prospektivt observationelt kohortestudie fulgte 113 kvinder udsat for omeprazol under graviditeten (89 % med eksponeringer i første trimester). Den rapporterede hyppighed af alvorlige medfødte misdannelser var 4 % i omeprazolgruppen, 2 % i kontroller udsat for ikke-teratogener og 2,8 % i sygdomsparrede kontroller. Hyppigheden af spontane og elektive aborter, præmature fødsler, gestationsalder ved fødslen og gennemsnitlig fødselsvægt var ens blandt grupperne.
Adskillige undersøgelser har ikke rapporteret nogen synlige uønskede kortsigtede virkninger på spædbarnet, når enkeltdosis oral eller intravenøs omeprazol blev administreret til over 200 gravide kvinder som præmedicinering til kejsersnit under generel anæstesi.
Dyredata
Omeprazol
Reproduktionsundersøgelser udført med omeprazol hos rotter ved orale doser op til 138 mg/kg/dag (ca. 34 gange en oral human dosis på 40 mg på basis af kropsoverfladeareal) og i kaniner i doser op til 69,1 mg/kg/dag ( ca. 34 gange en oral human dosis på 40 mg på basis af kropsoverfladeareal) under organogenese afslørede ikke noget bevis for et teratogent potentiale af omeprazol. Hos kaniner gav omeprazol i et dosisområde på 6,9 til 69,1 mg/kg/dag (ca. 3,4 til 34 gange en oral human dosis på 40 mg på basis af kropsoverfladen) administreret under organogenese dosisrelaterede stigninger i embryodødelighed, føtale resorptioner og graviditetsforstyrrelser. Hos rotter blev dosisrelateret embryo/føtal toksicitet og postnatal udviklingstoksicitet observeret hos afkom som følge af forældre behandlet med omeprazol ved 13,8 til 138,0 mg/kg/dag (ca. 3,4 til 34 gange en oral human dose på 40 mg på en kropsoverflade arealbasis), indgivet før parring gennem laktationsperioden.
Esomeprazol
Dataene beskrevet nedenfor blev genereret fra undersøgelser med esomeprazol, en enantiomer af omeprazol. Dosismultipler fra dyr til mennesker er baseret på antagelsen om ensartet systemisk eksponering for esomeprazol hos mennesker efter oral administration af enten 40 mg esomeprazol eller 40 mg omeprazol.
Der blev ikke observeret nogen effekt på embryo-føtal udvikling i reproduktionsundersøgelser med esomeprazolmagnesium hos rotter ved orale doser op til 280 mg/kg/dag (ca. 68 gange en oral human dosis på 40 mg på basis af kropsoverfladeareal) eller hos kaniner kl. orale doser op til 86 mg/kg/dag (ca. 42 gange en oral human dosis på 40 mg esomeprazol eller 40 mg omeprazol på basis af kropsoverfladeareal) indgivet under organogenese.
Et præ- og postnatalt udviklingstoksicitetsstudie hos rotter med yderligere endepunkter for at evaluere knogleudvikling blev udført med esomeprazolmagnesium i orale doser på 14 til 280 mg/kg/dag (ca. 3,4 til 68 gange en oral human dosis på 40 mg esomeprazol eller 40 mg omeprazol på basis af kropsoverflade). Neonatal/tidlig postnatal (fødsel til fravænning) overlevelse blev reduceret ved doser lig med eller større end 138 mg/kg/dag (ca. 34 gange en oral human dosis på 40 mg esomeprazol eller 40 mg omeprazol på basis af kropsoverfladeareal). Kropsvægt og vægtøgning blev reduceret, og neuroadfærdsmæssige eller generelle udviklingsforsinkelser i den umiddelbare tidsramme efter fravænning var tydelige ved doser lig med eller større end 69 mg/kg/dag (ca. 17 gange en oral human dosis på 40 mg esomeprazol eller 40 mg omeprazol på basis af kropsoverflade). Derudover blev der observeret nedsat lårbenslængde, bredde og tykkelse af kortikal knogle, nedsat tykkelse af tibial vækstplade og minimal til mild knoglemarvshypocellularitet ved doser lig med eller større end 14 mg/kg/dag (ca. 3,4 gange et oralt menneske) dosis på 40 mg esomeprazol eller 40 mg omeprazol på basis af kropsoverflade). Fysisk dysplasi i lårbenet blev observeret hos afkom af rotter behandlet med orale doser af esomeprazolmagnesium i doser lig med eller større end 138 mg/kg/dag (ca. 34 gange en oral human dosis på 40 mg esomeprazol eller 40 mg omeprazol på en krop overfladeareal).
Effekter på moderens knogler blev observeret hos drægtige og diegivende rotter i det præ- og postnatale toksicitetsstudie, når esomeprazolmagnesium blev administreret i orale doser på 14 til 280 mg/kg/dag (ca. 3,4 til 68 gange en oral human dosis på 40 mg esomeprazol eller 40 mg omeprazol på basis af kropsoverflade). Når rotter blev doseret fra svangerskabsdag 7 til fravænning på postnatal dag 21, blev der observeret et statistisk signifikant fald i moderens lårbensvægt på op til 14 % (sammenlignet med placebobehandling) ved doser lig med eller større end 138 mg/kg/dag (ca. 34 gange en oral human dosis på 40 mg esomeprazol eller 40 mg omeprazol på basis af kropsoverfladeareal).
Et præ- og postnatalt udviklingsstudie med rotter med esomeprazol strontium (ved anvendelse af ækvimolære doser sammenlignet med esomeprazolmagnesiumundersøgelse) gav lignende resultater hos moderdyr og unger som beskrevet ovenfor.
En opfølgende udviklingstoksicitetsundersøgelse hos rotter med yderligere tidspunkter til evaluering af ungens knogleudvikling fra postnatal dag 2 til voksenalderen blev udført med esomeprazolmagnesium i orale doser på 280 mg/kg/dag (ca. 68 gange en oral human dosis på 40 mg på på basis af kropsoverfladeareal), hvor administration af esomeprazol var fra enten svangerskabsdag 7 eller svangerskabsdag 16 indtil fødslen. Når moderadministration kun var begrænset til graviditet, var der ingen virkninger på knoglefysisk morfologi hos afkommet på nogen alder.
Amning
Risikooversigt
Begrænsede data tyder på, at omeprazol kan være til stede i modermælk. Der er ingen kliniske data om virkningen af omeprazol på det ammede spædbarn eller på mælkeproduktionen. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for PRILOSEC 40mg og eventuelle negative virkninger på det ammede spædbarn fra PRILOSEC 20mg eller fra den underliggende moderens tilstand.
Pædiatrisk brug
Sikkerheden og effektiviteten af PRILOSEC 40 mg er blevet fastslået hos pædiatriske patienter 1 til 16 år til behandling af symptomatisk GERD, behandling af EE på grund af syremedieret GERD og vedligeholdelse af heling af EE på grund af syremedieret GERD. Brug af PRILOSEC 10 mg i denne aldersgruppe understøttes af tilstrækkelige og velkontrollerede undersøgelser hos voksne og ukontrollerede undersøgelser af sikkerhed, effekt og farmakokinetiske undersøgelser udført hos pædiatriske og unge patienter [se KLINISK FARMAKOLOGI , Kliniske Studier ].
Sikkerheden og effektiviteten af PRILOSEC 10 mg er blevet fastslået hos pædiatriske patienter i alderen 1 måned til under 1 år til behandling af EE på grund af syremedieret GERD og understøttes af tilstrækkelige og velkontrollerede undersøgelser hos voksne og sikkerhed, farmakokinetisk, og farmakodynamiske undersøgelser udført hos pædiatriske patienter [se KLINISK FARMAKOLOGI ].
I den pædiatriske population blev der hyppigt rapporteret bivirkninger i luftvejene i hele aldersgruppen (1 måned til 16 år). Mellemørebetændelse blev hyppigt rapporteret i aldersgruppen 1 måned til BIVIRKNINGER ].
Sikkerheden og effektiviteten af PRILOSEC er ikke blevet fastslået i:
- patienter under 1 år for:
- Behandling af symptomatisk GERD
- Vedligeholdelse af heling af EE på grund af syremedieret GERD
- pædiatriske patienter til:
- Behandling af aktivt duodenalsår
- H. pylori udryddelse for at reducere risikoen for tilbagefald af duodenalsår
- Behandling af aktivt godartet mavesår
- Patologiske hypersekretoriske tilstande
- patienter under 1 måned for enhver indikation.
Data om unge dyr
Esomeprazol, en enantiomer af omeprazol, viste sig at reducere kropsvægt, vægtøgning, lårbensvægt, lårbenslængde og overordnet vækst ved orale doser omkring 34 til 68 gange en daglig human dosis på 40 mg esomeprazol eller 40 mg omeprazol baseret på kroppen. overfladeareal i en toksicitetsundersøgelse af unge rotter. Dosismultipler fra dyr til mennesker er baseret på antagelsen om ensartet systemisk eksponering for esomeprazol hos mennesker efter oral administration af enten 40 mg esomeprazol eller 40 mg omeprazol.
Et 28-dages toksicitetsstudie med en 14-dages restitutionsfase blev udført i unge rotter med esomeprazolmagnesium i doser på 70 til 280 mg/kg/dag (ca. 17 til 68 gange en daglig oral human dosis på 40 mg esomeprazol eller 40 mg omeprazol på kropsoverfladebasis). En stigning i antallet af dødsfald ved den høje dosis på 280 mg/kg/dag blev observeret, når unge rotter fik esomeprazolmagnesium fra postnatal dag 7 til postnatal dag 35. Derudover doser lig med eller større end 140 mg/kg/ dag (ca. 34 gange en daglig oral human dosis på 40 mg esomeprazol eller 40 mg omeprazol på basis af kropsoverfladen), gav behandlingsrelaterede fald i kropsvægt (ca. 14%) og vægtøgning, fald i femurvægt og femur længde og påvirkede den samlede vækst. Sammenlignelige resultater beskrevet ovenfor er også blevet observeret i denne undersøgelse med et andet esomeprazolsalt, esomeprazol strontium, ved ækvimolære doser af esomeprazol.
Geriatrisk brug
Omeprazol blev givet til over 2000 ældre personer (≥ 65 år) i kliniske forsøg i USA og Europa. Der var ingen forskelle i sikkerhed og effektivitet mellem ældre og yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre forsøgspersoner, men større følsomhed hos nogle ældre individer kan ikke udelukkes.
Farmakokinetiske undersøgelser har vist, at eliminationshastigheden var noget nedsat hos ældre, og biotilgængeligheden var øget. Plasmaclearancen af omeprazol var 250 ml/min (ca. halvdelen af den for unge frivillige), og dens plasmahalveringstid var i gennemsnit en time, omkring det dobbelte af unge raske frivillige. Dog er dosisjustering ikke nødvendig hos ældre [se KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Hos patienter med nedsat leverfunktion (Child-Pugh klasse A, B eller C) steg eksponeringen for omeprazol væsentligt sammenlignet med raske forsøgspersoner. Dosisreduktion af PRILOSEC 10 mg til 10 mg én gang dagligt anbefales til patienter med nedsat leverfunktion for at opretholde heling af EE [se DOSERING OG ADMINISTRATION , KLINISK FARMAKOLOGI ].
Asiatisk befolkning
I undersøgelser af raske forsøgspersoner havde asiater ca. fire gange højere eksponering end kaukasiere. Dosisreduktion af PRILOSEC 20 mg til 10 mg én gang dagligt anbefales til asiatiske patienter til vedligeholdelse af heling af EE [se DOSERING OG ADMINISTRATION , KLINISK FARMAKOLOGI ].
OVERDOSIS
Der er modtaget rapporter om overdosering med omeprazol hos mennesker. Doserne varierede op til 2400 mg (120 gange den sædvanlige anbefalede kliniske dosis). Manifestationerne var varierende, men omfattede forvirring, døsighed, sløret syn, takykardi, kvalme, opkastning, diaforese, rødmen, hovedpine, mundtørhed og andre bivirkninger svarende til dem, der ses i normal klinisk erfaring [se BIVIRKNINGER ]. Symptomerne var forbigående, og der er ikke rapporteret noget alvorligt klinisk resultat, når PRILOSEC 20 mg blev taget alene. Der kendes ingen specifik modgift mod overdosering af omeprazol.
Omeprazol er udstrakt proteinbundet og er derfor ikke let dialyserbart. I tilfælde af overdosering skal behandlingen være symptomatisk og støttende.
Hvis der opstår overeksponering, skal du ringe til dit giftkontrolcenter på 1-800-222-1222 for aktuelle oplysninger om håndtering af forgiftning eller overdosering.
KONTRAINDIKATIONER
- PRILOSEC er kontraindiceret hos patienter med kendt overfølsomhed over for substituerede benzimidazoler eller over for enhver komponent i formuleringen. Overfølsomhedsreaktioner kan omfatte anafylaksi, anafylaktisk shock, angioødem, bronkospasme, akut tubulointerstitiel nefritis og nældefeber [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ].
- Protonpumpehæmmere (PPI'er), inklusive PRILOSEC 10mg, er kontraindiceret hos patienter, der får rilpivirinholdige produkter [se DRUGSINTERAKTIONER ].
- For information om kontraindikationer af antibakterielle midler (clarithromycin og amoxicillin), der er indiceret i kombination med PRILOSEC 40 mg, henvises til afsnittet KONTRAINDIKATIONER i deres indlægssedler.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Omeprazol tilhører en klasse af antisekretoriske forbindelser, de substituerede benzimidazoler, der undertrykker mavesyresekretion ved specifik inhibering af H+/K+ ATPase-enzymsystemet ved den sekretoriske overflade af maveparietalcellen. Fordi dette enzymsystem betragtes som syrepumpen (proton) i maveslimhinden, er omeprazol blevet karakteriseret som en mavesyrepumpehæmmer, idet det blokerer det sidste trin i syreproduktionen. Denne effekt er dosisrelateret og fører til hæmning af både basal og stimuleret syresekretion uanset stimulus.
Farmakodynamik
Antisekretorisk aktivitet
Efter oral administration indtræder den antisekretoriske virkning af omeprazol inden for en time, med den maksimale effekt inden for to timer. Hæmning af sekretion er omkring 50 % af maksimum efter 24 timer, og varigheden af hæmning varer op til 72 timer. Den antisekretoriske effekt varer således meget længere, end man ville forvente ud fra den meget korte (mindre end en time) plasmahalveringstid, tilsyneladende på grund af forlænget binding til parietal H+/K+ ATPase-enzymet. Når lægemidlet seponeres, vender den sekretoriske aktivitet gradvist tilbage over 3 til 5 dage. Den hæmmende effekt af omeprazol-onsyresekretion øges ved gentagen dosering én gang dagligt og når et plateau efter fire dage.
Resultater fra talrige undersøgelser af den antisekretoriske effekt af multiple doser på 20 mg og 40 mg omeprazol hos raske forsøgspersoner og patienter er vist nedenfor. "Max"-værdien repræsenterer bestemmelser på et tidspunkt med maksimal effekt (2 til 6 timer efter dosering), mens "min"-værdier er dem 24 timer efter den sidste dosis af omeprazol.
Enkelte daglige orale doser af omeprazol i området fra en dosis på 10 mg til 40 mg har frembragt 100 % hæmning af 24-timers intragastrisk surhedsgrad hos nogle patienter.
Serum Gastrin Effekter
undersøgelser, der involverede mere end 200 patienter, steg serumgastrinniveauerne i løbet af de første 1 til 2 uger af én gang daglig administration af terapeutiske doser af omeprazol parallelt med hæmning af syresekretion. Der forekom ingen yderligere stigning i serumgastrin ved fortsat behandling. Sammenlignet med histamin H2-receptorantagonister var medianstigningerne produceret af 20 mg doser af omeprazol højere (1,3 til 3,6 gange mod 1,1 til 1,8 gange stigning). Gastrinværdierne vendte tilbage til niveauerne før behandling, sædvanligvis inden for 1 til 2 uger efter seponering af behandlingen.
Øget gastrin forårsager enterochromaffin-lignende cellehyperplasi og øgede serumchromogranin A (CgA) niveauer. De øgede CgA-niveauer kan forårsage falske positive resultater i diagnostiske undersøgelser for neuroendokrine tumorer [se ADVARSLER OG FORHOLDSREGLER ].
Enterochromaffin-lignende (ECL) celleeffekter
Humane gastriske biopsiprøver er blevet opnået fra mere end 3000 patienter (både børn og voksne) behandlet med omeprazol i langsigtede kliniske forsøg. Forekomsten af ECL-cellehyperplasi i disse undersøgelser steg med tiden; der er dog ikke fundet tilfælde af ECL-cellecarcinoider, dysplasi eller neoplasi hos disse patienter. Disse undersøgelser er imidlertid af utilstrækkelig varighed og størrelse til at udelukke den mulige indflydelse af langvarig administration af omeprazol på udviklingen af præmaligne eller ondartede tilstande.
Andre effekter
Systemiske effekter af omeprazol i CNS, kardiovaskulære og respiratoriske systemer er ikke blevet fundet til dato. Omeprazol, givet i orale doser på 30 eller 40 mg i 2 til 4 uger, havde ingen effekt på skjoldbruskkirtelfunktionen, kulhydratmetabolismen eller cirkulerende niveauer af parathyreoideahormon, cortisol, østradiol, testosteron, prolaktin, cholecystokinin eller sekretin.
Ingen effekt på gastrisk tømning af de faste og flydende komponenter i et testmåltid blev påvist efter en enkelt dosis omeprazol 90 mg. Hos raske forsøgspersoner havde en enkelt intravenøs dosis omeprazol (0,35 mg/kg) ingen effekt på intrinsic factor sekretion. Der er ikke observeret nogen systematisk dosisafhængig effekt på basal eller stimuleret pepsinproduktion hos mennesker.
Men når intragastrisk pH holdes på 4,0 eller derover, er basal pepsinoutput lav, og pepsinaktiviteten er nedsat.
Ligesom andre midler, der hæver intragastrisk pH, frembragte omeprazol administreret i 14 dage hos raske forsøgspersoner en signifikant stigning i de intragastriske koncentrationer af levedygtige bakterier. Bakteriearternes mønster var uændret fra det, der almindeligvis findes i spyt. Alle ændringer forsvandt inden for tre dage efter behandlingens ophør.
Forløbet af Barretts øsofagus hos 106 patienter blev evalueret i et amerikansk dobbeltblindt kontrolleret studie med PRILOSEC 40 mg to gange dagligt i 12 måneder efterfulgt af 20 mg to gange dagligt i 12 måneder eller ranitidin 300 mg to gange dagligt i 24 måneder. Der blev ikke observeret nogen klinisk signifikant indvirkning på Barretts slimhinde ved antisekretorisk terapi. Selvom neosquamøst epitel udviklede sig under antisekretorisk terapi, blev fuldstændig eliminering af Barretts slimhinde ikke opnået. Der blev ikke observeret nogen signifikant forskel mellem behandlingsgrupper i udvikling af dysplasi i Barretts slimhinde, og ingen patient udviklede esophageal carcinom under behandlingen. Der blev ikke observeret signifikante forskelle mellem behandlingsgrupper i udvikling af ECL-cellehyperplasi, corpus atrofisk gastritis, corpus intestinal metaplasi eller colonpolypper med en diameter på over 3 mm.
Farmakokinetik
Absorption
PRILOSEC 20 mg til oral suspension med forsinket frigivelse indeholder omeprazol-magnesiumgranulat og inaktivt granulat, der skal administreres i vand. Absorption af omeprazol begynder først, efter at de gastro-resistente granulat forlader maven. Omeprazols farmakokinetik er tidsafhængig med højere plasmakoncentrationer ved steady state sammenlignet med efter en enkelt dosis. Den systemiske eksponering (AUC og Cmax) for omeprazol efter én gang daglig dosering af 20 mg oral suspension med forsinket frigivelse i 5 dage er henholdsvis 51 % og 58 % højere end efter den første dosis. Maksimal plasmakoncentration af omeprazol efter gentagne doser af oral suspension med forsinket frigivelse forekommer inden for 1,5 til 2 timer. Hos raske forsøgspersoner er plasmahalveringstiden 0,5 til 1 time.
Fordeling
Proteinbinding er cirka 95%.
Elimination
Metabolisme
Omeprazol metaboliseres i vid udstrækning af cytochrom P450 (CYP) enzymsystemet. Størstedelen af dets metabolisme er afhængig af det polymorfisk udtrykte CYP2C19, der er ansvarligt for dannelsen af hydroxyomeprazol, hovedmetabolitten i plasma. Den resterende del er afhængig af en anden specifik isoform, CYP3A4, der er ansvarlig for dannelsen af omeprazolsulfon.
Udskillelse
Efter oral indgift af enkeltdosis af en bufferopløsning af omeprazol udskilles kun lidt, hvis noget, uændret lægemiddel i urinen. Størstedelen af dosis (ca. 77%) blev elimineret i urinen som mindst seks metabolitter. To blev identificeret som hydroxyomeprazol og den tilsvarende carboxylsyre. Resten af dosis kunne genvindes i fæces. Dette indebærer en betydelig galdeudskillelse af metabolitterne af omeprazol. Tre metabolitter er blevet identificeret i plasma, sulfid- og sulfonderivaterne af omeprazol og hydroxyomeprazol. Disse metabolitter har meget lille eller ingen antisekretorisk aktivitet.
Kombinationsterapi med antimikrobielle stoffer
Omeprazol 40 mg dagligt blev givet i kombination med clarithromycin 500 mg hver 8. time til raske voksne mandlige forsøgspersoner. Steady state plasmakoncentrationerne af omeprazol blev øget (Cmax, AUC0-24 og T½ stigninger på henholdsvis 30 %, 89 % og 34 %) ved samtidig administration af clarithromycin. De observerede stigninger i plasmakoncentrationen af omeprazol var forbundet med følgende farmakologiske virkninger. Den gennemsnitlige 24-timers gastriske pH-værdi var, når omeprazol blev administreret alene og 5,7, når det blev administreret sammen med clarithromycin.
Plasmakoncentrationerne af clarithromycin og 14-hydroxy-clarithromycin blev øget ved samtidig administration af omeprazol. For clarithromycin var den gennemsnitlige Cmax 10 % større, den gennemsnitlige Cmin var 27 % større, og den gennemsnitlige AUC0-8 var 15 % højere, når clarithromycin blev administreret sammen med omeprazol, end når clarithromycin blev administreret alene. Lignende resultater blev set for 14-hydroxy-clarithromycin, den gennemsnitlige Cmax var 45 % større, den gennemsnitlige Cmin var 57 % større, og den gennemsnitlige AUC0-8 var 45 % større. Clarithromycinkoncentrationer i mavevæv og slim blev også øget ved samtidig administration af omeprazol.
Specifikke populationer
Geriatriske patienter
Elimineringshastigheden af omeprazol var noget nedsat hos ældre, og biotilgængeligheden var øget. Omeprazol var 76 % biotilgængeligt, når en enkelt 40 mg oral dosis omeprazol (bufferopløsning) blev administreret til raske ældre frivillige, mod 58 % hos unge frivillige, der fik samme dosis. Næsten 70 % af dosis blev genfundet i urinen som metabolitter af omeprazol, og der blev ikke påvist noget uforandret lægemiddel. Plasmaclearancen af omeprazol var 250 ml/min (ca. halvdelen af den for unge frivillige), og dens plasmahalveringstid var i gennemsnit en time, omkring det dobbelte af unge raske frivillige.
Pædiatriske patienter
2 til 16 år
Omeprazols farmakokinetik er blevet undersøgt hos pædiatriske patienter i alderen 2 til 16 år:
Efter sammenlignelige mg/kg doser af omeprazol har yngre børn (2 til 5 år) lavere AUC'er end børn i alderen 6 til 16 år eller voksne; AUC'er for de to sidstnævnte grupper var ikke forskellige [se DOSERING OG ADMINISTRATION ].
1 til 11 måneders alderen
En populationsfarmakokinetikmodel blev brugt til at bestemme passende doser af PRILOSEC 40 mg til pædiatriske patienter
1 måned til mindre end 1 år til behandling (op til 6 uger) af erosiv esophagitis på grund af syremedieret GERD. Modellen var baseret på data fra 64 børn i alderen 0,5 måned til 16 år. Kun begrænsede data var tilgængelige for børn under 1 år. Omeprazol blev administreret til de pædiatriske patienter i disse undersøgelser som en oral suspension fremstillet af kapslerne med forsinket frigivelse. Pædiatriske doser blev simuleret i aldersgruppen 1 til 11 måneder for at opnå sammenlignelige omeprazoleksponeringer med voksne efter behandling med 20 mg én gang dagligt [se DOSERING OG ADMINISTRATION ].
Race- eller etniske grupper
[Se KLINISK FARMAKOLOGI ].
Patienter med nedsat nyrefunktion
Hos patienter med kronisk nedsat nyrefunktion (kreatininclearance mellem 10 og 62 ml/min/1,73 m²) var disponeringen af omeprazol meget lig den hos raske forsøgspersoner, selvom der var en let stigning i biotilgængeligheden. Fordi urinudskillelse er en primær udskillelsesvej for omeprazolmetabolitter, blev deres elimination aftaget i forhold til den nedsatte kreatininclearance. Denne stigning i biotilgængelighed anses ikke for at være klinisk meningsfuld.
Patienter med nedsat leverfunktion
Hos patienter med kronisk leversygdom klassificeret som Child-Pugh klasse A (n=3), B (n=4) og C (n=1), steg biotilgængeligheden til ca. 100 % sammenlignet med raske forsøgspersoner, hvilket afspejler nedsat first-pass effekt, og plasmahalveringstiden for lægemidlet steg til næsten 3 timer sammenlignet med halveringstiden hos raske forsøgspersoner på 0,5 til 1 time. Plasmaclearance var i gennemsnit 70 ml/min sammenlignet med en værdi på 500 til 600 ml/min hos raske forsøgspersoner [se DOSERING OG ADMINISTRATION , Brug i specifikke populationer ].
Lægemiddelinteraktionsstudier
Virkning af omeprazol på andre lægemidler
Omeprazol er en tidsafhængig hæmmer af CYP2C19 og kan øge den systemiske eksponering af samtidig administrerede lægemidler, som er CYP2C19-substrater. Derudover øger administration af omeprazol den intragastriske pH og kan ændre den systemiske eksponering af visse lægemidler, der udviser pH-afhængig opløselighed.
Antiretrovirale midler
For nogle antiretrovirale lægemidler, såsom rilpivirin, atazanavir og nelfinavir, er nedsatte serumkoncentrationer blevet rapporteret, når de gives sammen med omeprazol [se DRUGSINTERAKTIONER ].
Rilpivirin: Efter flere doser af rilpivirin (150 mg, dagligt) og omeprazol (20 mg, dagligt), blev AUC reduceret med 40 %, Cmax med 40 % og Cmin med 33 % for rilpivirin.
Nelfinavir: Efter gentagne doser af nelfinavir (1250 mg, to gange dagligt) og omeprazol (40 mg dagligt), faldt AUC med 36 % og 92 %, Cmax med 37 % og 89 % og Cmin med henholdsvis 39 % og 75 % for nelfinavir og M8 .
Atazanavir: Efter flere doser af atazanavir (400 mg, dagligt) og omeprazol (40 mg, dagligt, 2 timer før atazanavir), faldt AUC med 94 %, Cmax med 96 % og Cmin med 95 %.
Saquinavir: Efter gentagen dosering af saquinavir/ritonavir (1000/100 mg) to gange dagligt i 15 dage med omeprazol 40 mg dagligt administreret samtidigt dag 11 til 15.
AUC blev øget med 82 %, Cmax med 75 % og Cmin med 106 %. Mekanismen bag denne interaktion er ikke fuldt belyst.
Clopidogrel
I en crossover klinisk undersøgelse fik 72 raske forsøgspersoner clopidogrel (300 mg startdosis efterfulgt af 75 mg dagligt) alene og med omeprazol (80 mg samtidig med clopidogrel) i 5 dage. Eksponeringen for den aktive metabolit af clopidogrel blev reduceret med 46 % (dag 1) og 42 % (dag 5), når clopidogrel og omeprazol blev administreret sammen.
Resultater fra et andet crossover-studie med raske forsøgspersoner viste en lignende farmakokinetisk interaktion mellem clopidogrel (300 mg startdosis/75 mg daglig vedligeholdelsesdosis) og omeprazol 80 mg dagligt, når det blev givet samtidig i 30 dage. Eksponering for den aktive metabolit af clopidogrel blev reduceret med 41 % til 46 % i løbet af denne periode.
I en anden undersøgelse fik 72 raske forsøgspersoner de samme doser af clopidogrel og 80 mg omeprazol, men lægemidlerne blev administreret med 12 timers mellemrum; resultaterne var ens, hvilket indikerer, at administration af clopidogrel og omeprazol på forskellige tidspunkter ikke forhindrer deres interaktion [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER ].
Mycophenolatmofetil
Administration af omeprazol 20 mg to gange dagligt i 4 dage og en enkelt 1000 mg dosis af MMF cirka en time efter den sidste dosis af omeprazol til 12 raske forsøgspersoner i en cross-over undersøgelse resulterede i en 52 % reduktion i Cmax og 23 % reduktion i AUC for MPA [se DRUGSINTERAKTIONER ].
Cilostazol
Omeprazol virker som en hæmmer af CYP2C19. Omeprazol, givet i doser på 40 mg dagligt i en uge til 20 raske forsøgspersoner i cross-over-undersøgelse, øgede Cmax og AUC for cilostazol med henholdsvis 18 % og 26 %. Cmax og AUC for en af de aktive metabolitter, 3,4-dihydro-cilostazol, som har 4-7 gange aktiviteten af cilostazol, blev øget med henholdsvis 29 % og 69 %. Samtidig administration af cilostazol og omeprazol forventes at øge koncentrationerne af cilostazol og den ovennævnte aktive metabolit [se DRUGSINTERAKTIONER ].
Diazepam
Samtidig administration af omeprazol 20 mg én gang dagligt og diazepam 0,1 mg/kg givet intravenøst resulterede i 27 % fald i clearance og 36 % stigning i diazepams halveringstid [se DRUGSINTERAKTIONER ].
Digoxin
Samtidig administration af omeprazol 20 mg én gang dagligt og digoxin hos raske forsøgspersoner øgede biotilgængeligheden af digoxin med 10 % (30 % hos to forsøgspersoner) [se DRUGSINTERAKTIONER ].
Virkning af andre lægemidler på omeprazol
Voriconazol
Samtidig administration af omeprazol og voriconazol (en kombineret hæmmer af CYP2C19 og CYP3A4) resulterede i mere end en fordobling af eksponeringen for omeprazol. Når voriconazol (400 mg hver 12. time i én dag, efterfulgt af 200 mg én gang dagligt i 6 dage) blev givet sammen med omeprazol (40 mg én gang dagligt i 7 dage) til raske forsøgspersoner, var steady-state Cmax og AUC0-24 for omeprazol. signifikant forøget: i gennemsnit henholdsvis 2 gange (90 % CI: 1,8, 2,6) og 4 gange (90 % CI: 3,3, 4,4) sammenlignet med når omeprazol blev givet uden voriconazol [se DRUGSINTERAKTIONER ].
Mikrobiologi
Omeprazol og clarithromycin dobbeltterapi og omeprazol, clarithromycin og amoxicillin tripelbehandling har vist sig at være aktive mod de fleste stammer af Helicobacter pylori in vitro og ved kliniske infektioner [se INDIKATIONER OG BRUG , Kliniske Studier ].
Helicobacter pylori
Følsomhedstest af H. pylori-isolater blev udført for amoxicillin og clarithromycin ved anvendelse af agarfortyndingsmetodologi1, og minimale hæmmende koncentrationer (MIC'er) blev bestemt.
Standardiserede følsomhedstestprocedurer kræver brug af laboratoriekontrolmikroorganismer til at kontrollere de tekniske aspekter af laboratorieprocedurerne.
Forbehandlingsmodstand
Clarithromycin forbehandlingsresistensrater var 3,5 % (4/113) i omeprazol/clarithromycin-dobbeltbehandlingsstudierne (4 og 5) og 9,3 % (41/439) i omeprazol/clarithromycin/amoxicillin tripelterapistudierne (1, 2 og 3).
Amoxicillin-forbehandlingsfølsomme isolater (≤ 0,25 μg/ml) blev fundet hos 99,3 % (436/439) af patienterne i omeprazol/clarithromycin/amoxicillin triple terapi undersøgelserne (1, 2 og 3). Amoxicillin førbehandlings mindste hæmmende koncentrationer (MIC'er) > 0,25 μg/ml forekom hos 0,7 % (3/439) af patienterne, som alle var i clarithromycin- og amoxicillinundersøgelsesarmen. En patient havde en ubekræftet forbehandling amoxicillin minimum hæmmende koncentration (MIC) på > 256 μg/mL af Etest®.
Patienter, der ikke er udryddet af H. pylori efter omeprazol/clarithromycin/amoxicillin-tredobbelt behandling eller omeprazol/clarithromycin-dobbeltbehandling, vil sandsynligvis have clarithromycin-resistente H. pylori-isolater. Derfor bør clarithromycin-følsomhedstest udføres, hvis det er muligt. Patienter med clarithromycin-resistent H. pylori bør ikke behandles med nogen af følgende: omeprazol/clarithromycin dobbeltbehandling, omeprazol/clarithromycin/amoxicillin tripelbehandling eller andre regimer, der inkluderer clarithromycin som det eneste antimikrobielle middel.
Amoxicillin-følsomhedstestresultater og kliniske/bakteriologiske resultater
de kliniske forsøg med tredobbelt terapi blev 84,9 % (157/185) af patienterne i omeprazol/clarithromycin/amoxicillin-behandlingsgruppen, som havde amoxicillin-følsomme MIC'er før behandling (≤ 0,25 μg/ml) udryddet af H. pylori og 185 % (185 μg/ml). /185) mislykket terapi. Ud af de 28 patienter, som mislykkedes med tripelbehandling, havde 11 ingen følsomhedstestresultater efter behandling, og 17 havde H. pylori-isolater efter behandling med amoxicillin-følsomme MIC'er. Elleve af de patienter, der mislykkedes med tripelbehandling, havde også H. pylori-isolater efter behandling med clarithromycin-resistente MIC'er.
Følsomhedstest for Helicobacter pylori
For information om følsomhedstest om Helicobacter pylori, se afsnittet Mikrobiologi i ordinationsinformation for clarithromycin og amoxicillin.
Effekter på gastrointestinal mikrobiel økologi
Nedsat mavesyreindhold på grund af nogen midler, herunder protonpumpehæmmere, øger mavetallet af bakterier, der normalt er til stede i mave-tarmkanalen. Behandling med protonpumpehæmmere kan medføre let øget risiko for mave-tarminfektioner som Salmonella og Campylobacter og, hos indlagte patienter, muligvis også Clostridium difficile.
Farmakogenomi
CYP2C19, et polymorft enzym, er involveret i metabolismen af omeprazol. CYP2C19*1-allelen er fuldt funktionel, mens CYP2C19*2- og *3-allelerne er ikke-funktionelle. Der er andre alleler forbundet med ingen eller nedsat enzymatisk funktion. Patienter, der bærer to fuldt funktionelle alleler, er omfattende metabolisatorer, og dem, der bærer to alleler med tab af funktion, er dårlige metabolisatorer. Hos ekstensive metabolisatorer metaboliseres omeprazol primært af CYP2C19.
Den systemiske eksponering for omeprazol varierer med en patients stofskiftestatus: dårlige metabolisatorer > mellemmetabolisatorer > omfattende metabolisatorer. Ca. 3 % af kaukasiere og 15 til 20 % af asiatere er CYP2C19-fattige metabolisatorer.
I et farmakokinetisk studie med en enkelt 20 mg omeprazoldosis var AUC for omeprazol hos asiatiske forsøgspersoner ca. fire gange så stor som hos kaukasiere [se DOSERING OG ADMINISTRATION , Brug i specifikke populationer ].
Kliniske Studier
Aktivt duodenalsår
et multicenter, dobbeltblindt, placebokontrolleret studie af 147 patienter med endoskopisk dokumenteret sår på tolvfingertarmen, var procentdelen af patienter helbredt (pr. protokol) efter 2 og 4 uger signifikant højere med omeprazol magnesium kapsler med forsinket frigivelse 20 mg én gang dagligt end med placebo (p ≤ 0,01).
Behandling af aktivt duodenalsår % af helbredte patienter
Fuldstændig smertelindring om dagen og om natten forekom signifikant hurtigere (p ≤ 0,01) hos patienter behandlet med omeprazol-magnesium-kapsler med forsinket frigivelse 20 mg end hos patienter behandlet med placebo. Ved afslutningen af undersøgelsen havde signifikant flere patienter, som havde fået omeprazolmagnesium-kapsler med forsinket frigivelse, fuldstændig lindring af smerter i dagtimerne (p ≤ 0,05) og smerter om natten (p ≤ 0,01).
et multicenter, dobbeltblindt studie af 293 patienter med endoskopisk dokumenteret sår på tolvfingertarmen, var procentdelen af patienter helbredt (pr. protokol) efter 4 uger signifikant højere med omeprazol-magnesium-kapsler med forsinket frigivelse 20 mg én gang dagligt end med ranitidin 150 mg to gange dagligt ( p
Behandling af aktivt duodenalsår % af helbredte patienter
Heling forekom signifikant hurtigere hos patienter behandlet med omeprazol-magnesium-kapsler med forsinket frigivelse end hos dem, der blev behandlet med ranitidin 150 mg to gange dagligt (p
I et udenlandsk multinationalt randomiseret, dobbeltblindt studie af 105 patienter med endoskopisk dokumenteret sår på tolvfingertarmen blev 20 mg og 40 mg omeprazol-magnesium-kapsler med forsinket frigivelse sammenlignet med 150 mg to gange dagligt ranitidin efter 2, 4 og 8 uger. Efter 2 og 4 uger var begge doser af PRILOSEC 10 mg statistisk overlegne (pr. protokol) i forhold til ranitidin, men 40 mg var ikke bedre end 20 mg omeprazol-magnesium-kapsler med forsinket frigivelse, og efter 8 uger var der ingen signifikant forskel mellem nogen af de aktive lægemidler.
Behandling af aktivt duodenalsår % af helbredte patienter
H. pylori udryddelse hos patienter med duodenalsår sygdom
Triple Therapy (omeprazol magnesium kapsler med forsinket frigivelse/clarithromycin/amoxicillin)
Tre amerikanske, randomiserede, dobbeltblindede kliniske undersøgelser af patienter med H. pylori-infektion og duodenalsårsygdom (n = 558) sammenlignede omeprazol-magnesium-kapsler med forsinket frigivelse plus clarithromycin plus amoxicillin med clarithromycin plus amoxicillin. To undersøgelser (1 og 2) blev udført med patienter med et aktivt sår på tolvfingertarmen, og det andet studie (3) blev udført på patienter med en anamnese med sår på tolvfingertarmen inden for de seneste 5 år, men uden et sår til stede på tidspunktet for indskrivningen . Dosisregimet i undersøgelserne var omeprazolmagnesium kapsler med forsinket frigivelse 20 mg to gange dagligt plus clarithromycin 500 mg to gange dagligt plus amoxicillin 1 g to gange dagligt i 10 dage; eller clarithromycin 500 mg to gange dagligt plus amoxicillin 1 g to gange dagligt i 10 dage. I undersøgelse 1 og 2 modtog patienter, der tog omeprazol-kuren, også yderligere 18 dage med omeprazol-magnesium-kapsler med forsinket frigivelse 20 mg én gang dagligt. Undersøgte endepunkter var udryddelse af H. pylori og heling af duodenalsår (kun undersøgelse 1 og 2). H. pylori-status blev bestemt af CLOtest®, histologi og kultur i alle tre undersøgelser. For en given patient blev H. pylori betragtet som udryddet, hvis mindst to af disse test var negative, og ingen var positiv.
Kombinationen af omeprazol plus clarithromycin plus amoxicillin var effektiv til at udrydde H. pylori.
Dobbeltterapi (omeprazol magnesium kapsler med forsinket frigivelse/clarithromycin)
Fire randomiserede, dobbeltblindede multicenterundersøgelser (4, 5, 6 og 7) evaluerede omeprazolmagnesium-kapsler med forsinket frigivelse 40 mg én gang dagligt plus clarithromycin 500 mg tre gange dagligt i 14 dage efterfulgt af omeprazolmagnesium forsinket frigivelse kapsler 20 mg én gang dagligt (undersøgelse 4, 5 og 7) eller med omeprazol magnesium kapsler med forsinket frigivelse 40 mg én gang dagligt (undersøgelse 6) i yderligere 14 dage hos patienter med aktivt duodenalsår forbundet med H. pylori. Studier 4 og 5 blev udført i USA og Canada og inkluderede henholdsvis 242 og 256 patienter. H. pylori-infektion og duodenalsår blev bekræftet hos 219 patienter i undersøgelse 4 og 228 patienter i undersøgelse 5. Disse undersøgelser sammenlignede kombinationsbehandlingen med omeprazol-magnesium-kapsler med forsinket frigivelse og clarithromycin-monoterapi. Studie 6 og 7 blev udført i Europa og inkluderede henholdsvis 154 og 215 patienter. H. pylori-infektion og duodenalsår blev bekræftet hos 148 patienter i undersøgelse 6 og 208 patienter i undersøgelse 7. Disse undersøgelser sammenlignede kombinationsregimet med omeprazol monoterapi. Resultaterne for effektivitetsanalyserne for disse undersøgelser er beskrevet nedenfor. H. pylori-udryddelse blev defineret som ingen positiv test (kultur eller histologi) 4 uger efter afslutningen af behandlingen, og to negative tests var påkrævet for at blive betragtet som udryddet af H. pylori. I pr-protokolanalysen blev følgende patienter udelukket: frafald, patienter med manglende H. pylori-test efter behandling og patienter, der ikke blev vurderet for H. pylori-udryddelse, fordi de viste sig at have et sår ved behandlingens afslutning .
Kombinationen af omeprazol og clarithromycin var effektiv til at udrydde H. pylori.
Heling af sår var ikke signifikant anderledes, når clarithromycin blev tilføjet til omeprazolbehandling sammenlignet med omeprazolbehandling alene.
Kombinationen af omeprazol og clarithromycin var effektiv til at udrydde H. pylori og reduceret duodenalsår tilbagefald.
Aktivt godartet mavesår
I et amerikansk multicenter, dobbeltblindt studie af omeprazol 40 mg én gang dagligt, 20 mg én gang dagligt og placebo hos 520 patienter med endoskopisk diagnosticeret mavesår, blev følgende resultater opnået.
Behandling af mavesår % af helbredte patienter (alle behandlede patienter)
For de stratificerede grupper af patienter med ulcusstørrelse mindre end eller lig med 1 cm blev der ikke påvist nogen forskel i helingshastigheder mellem 40 mg og 20 mg efter hverken 4 eller 8 uger. For patienter med ulcusstørrelse større end 1 cm var 40 mg signifikant mere effektivt end 20 mg efter 8 uger.
et udenlandsk, multinationalt, dobbeltblindt studie af 602 patienter med endoskopisk diagnosticeret mavesår, blev omeprazol 40 mg én gang dagligt, 20 mg én gang dagligt og ranitidin 150 mg to gange dagligt evalueret.
Behandling af mavesår % af helbredte patienter (alle behandlede patienter)
Symptomatisk GERD
Et placebokontrolleret studie blev udført i Skandinavien for at sammenligne effektiviteten af omeprazol 20 mg eller 10 mg én gang dagligt i op til 4 uger i behandlingen af halsbrand og andre symptomer hos GERD-patienter uden EE. Resultaterne er vist nedenfor.
% Vellykket symptomatisk resultat1
EE på grund af syremedieret GERD
I et amerikansk multicenter dobbeltblindt placebokontrolleret studie af 20 mg eller 40 mg omeprazol magnesium kapsler med forsinket frigivelse hos patienter med symptomer på GERD og endoskopisk diagnosticeret EE af grad 2 eller derover, var de procentvise helingsrater (pr. protokol) som følger :
denne undersøgelse var 40 mg-dosen ikke overlegen i forhold til 20 mg-dosen af omeprazol-magnesium-kapsler med forsinket frigivelse i den procentvise helingshastighed. Andre kontrollerede kliniske forsøg har også vist, at omeprazol-magnesium-kapsler med forsinket frigivelse er effektive ved svær GERD. Sammenlignet med histamin H2-receptorantagonister hos patienter med EE, grad 2 eller derover, var omeprazolmagnesium-kapsler med forsinket frigivelse i en dosis på 20 mg signifikant mere effektive end de aktive kontroller. Fuldstændig lindring af halsbrand om dagen og om natten forekom signifikant hurtigere (p
I dette og fem andre kontrollerede GERD-undersøgelser rapporterede signifikant flere patienter, der tog 20 mg omeprazol (84 %), fuldstændig lindring af GERD-symptomer end patienter, der fik placebo (12 %).
Vedligeholdelse af heling af EE på grund af syremedieret GERD
et amerikansk dobbeltblindt, randomiseret, multicenter, placebokontrolleret studie blev to dosisregimer af omeprazol-magnesium-kapsler med forsinket frigivelse undersøgt hos patienter med endoskopisk bekræftet helet esophagitis. Resultater for at bestemme vedligeholdelse af heling af EE er vist nedenfor.
Livstabelanalyse
I et internationalt multicenter dobbeltblindt studie blev omeprazolmagnesium-kapsler med forsinket frigivelse 20 mg dagligt og 10 mg dagligt sammenlignet med ranitidin 150 mg to gange dagligt hos patienter med endoskopisk bekræftet helbredt esophagitis. Tabellen nedenfor viser resultaterne af denne undersøgelse til opretholdelse af heling af EE.
Livstabelanalyse
Hos patienter, som oprindeligt havde grad 3 eller 4 erosiv esophagitis, til vedligeholdelse efter heling var 20 mg dagligt omeprazol-magnesium-kapsler med forsinket frigivelse effektiv, mens 10 mg ikke viste effektivitet.
Patologiske hypersekretoriske tilstande
åbne studier af 136 patienter med patologiske hypersekretoriske tilstande, såsom Zollinger-Ellison (ZE) syndrom med eller uden multiple endokrine adenomer, hæmmede omeprazolmagnesium kapsler med forsinket frigivelse markant mavesyresekretion og kontrollerede associerede symptomer på diarré, anoreksi og smerte. Doser varierende fra 20 mg hver anden dag til 360 mg pr. dag opretholdt basal syresekretion under 10 mEq/time hos patienter uden forudgående gastrisk operation og under 5 mEq/time hos patienter med tidligere gastrisk operation.
Startdoser blev titreret til den individuelle patientbehov, og justeringer var nødvendige med tiden hos nogle patienter [se DOSERING OG ADMINISTRATION ]. Omeprazol magnesium kapsler med forsinket frigivelse blev godt tolereret ved disse høje dosisniveauer i længere perioder (> 5 år hos nogle patienter). Hos de fleste ZE-patienter blev serumgastrinniveauer ikke ændret af omeprazol-magnesium-kapsler med forsinket frigivelse. Hos nogle patienter steg serumgastrin imidlertid til niveauer, der var højere end de, der var til stede før påbegyndelse af omeprazolbehandling. Mindst 11 patienter med ZE-syndrom i langtidsbehandling med omeprazol-magnesium-kapsler med forsinket frigivelse udviklede gastriske carcinoider. Disse fund menes at være en manifestation af den underliggende tilstand, som vides at være forbundet med sådanne tumorer, snarere end resultatet af administrationen af omeprazol-magnesium-kapsler med forsinket frigivelse [se BIVIRKNINGER ].
Pædiatriske undersøgelser til behandling af symptomatisk GERD, behandling af EE på grund af syremedieret GERD og vedligeholdelse af heling af EE på grund af syremedieret GERD
Behandling af symptomatisk GERD
Effektiviteten af omeprazolmagnesium-kapsler med forsinket frigivelse til behandling af symptomatisk GERD hos pædiatriske patienter i alderen 1 til 16 år er delvist baseret på data opnået fra 125 pædiatriske patienter i to ukontrollerede kliniske undersøgelser.
Den første undersøgelse inkluderede 12 pædiatriske patienter i alderen 1 til 2 år med en historie med klinisk diagnosticeret GERD. Patienterne fik en enkelt dosis omeprazol (0,5 mg/kg, 1 mg/kg eller 1,5 mg/kg) i 8 uger som en åben kapsel i 8,4 % natriumbicarbonatopløsning. Femoghalvfjerds procent (9/12) af patienterne havde opkastnings-/regurgitationsepisoder faldet fra baseline med mindst 50 %.
Den anden undersøgelse inkluderede 113 pædiatriske patienter i alderen 2 til 16 år med en historie med symptomer, der tyder på symptomatisk GERD. Patienterne fik en enkelt dosis omeprazol (10 mg eller 20 mg, baseret på kropsvægt) i 4 uger, enten som en intakt kapsel eller som en åben kapsel i æblemos. Succesfuld respons blev defineret som ingen moderate eller svære episoder af hverken smerterelaterede symptomer eller opkastning/regurgitation i løbet af de sidste 4 dages behandling. Resultaterne viste succesrater på henholdsvis 60 % (9/15; 10 mg omeprazol) og 59 % (58/98; 20 mg omeprazol).
Behandling af EE på grund af syremedieret GERD
et ukontrolleret, åbent dosistitreringsstudie til behandling af EE hos pædiatriske patienter i alderen 1 til 16 år krævede doser, der varierede fra 0,7 til 3,5 mg/kg/dag (80 mg/dag). Doserne blev påbegyndt med 0,7 mg/kg/dag. Doserne blev øget i trin på 0,7 mg/kg/dag (hvis intraesophageal pH viste en pH på
Vedligeholdelse af heling af EE på grund af syremedieret GERD
et ukontrolleret, åbent studie af opretholdelse af heling af EE hos 46 pædiatriske patienter i alderen 1 til 16 år krævede 54 % af patienterne halvdelen af helingsdosis. De resterende patienter øgede helingsdosis (0,7 til maksimalt 2,8 mg/kg/dag) enten i hele vedligeholdelsesperioden eller vendte tilbage til halvdelen af dosis før afslutning. Af de 46 patienter, der gik ind i vedligeholdelsesfasen, havde 19 (41%) intet tilbagefald under opfølgningen (interval 4 til 25 måneder). Derudover resulterede vedligeholdelsesbehandling hos EE-patienter i, at 63 % af patienterne ikke havde nogen generelle symptomer.
REFERENCER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder til fortynding Antimikrobielle følsomhedstests for bakterier, der vokser aerobt; Godkendt standard - tiende udgave. CLSI Document M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, USA 2015.
PATIENTOPLYSNINGER
PRILOSEC® (pry-lo-sec) (omeprazol magnesium) til oral suspension med forsinket frigivelse
Hvad er den vigtigste information, jeg bør vide om PRILOSEC?
PRILOSEC 10 mg kan hjælpe på dine syrerelaterede symptomer, men du kan stadig have alvorlige maveproblemer. Tal med din læge.
PRILOSEC kan forårsage alvorlige bivirkninger, herunder:
- En type nyreproblem (akut tubulointerstitiel nefritis). Nogle mennesker, der tager medicin med protonpumpehæmmere (PPI), inklusive PRILOSEC, kan udvikle et nyreproblem kaldet akut tubulointerstitiel nefritis, som kan opstå når som helst under behandlingen med PRILOSEC. Ring til din læge med det samme, hvis du har et fald i mængden af vand, eller hvis du har blod i urinen.
- Diarré forårsaget af en infektion (Clostridium difficile) i dine tarme. Ring til din læge med det samme, hvis du har vandig afføring eller mavesmerter, der ikke går væk. Du har måske eller måske ikke feber.
- Knoglebrud (hofte, håndled eller rygsøjle). Knoglebrud i hoften, håndleddet eller rygsøjlen kan forekomme hos personer, der tager flere daglige doser af PPI-medicin og i en længere periode (et år eller længere). Fortæl din læge, hvis du har knoglebrud, især i hoften, håndleddet eller rygsøjlen.
- Visse typer af lupus erythematosus. Lupus erythematosus er en autoimmun lidelse (kroppens immunceller angriber andre celler eller organer i kroppen). Nogle mennesker, der tager PPI-medicin, inklusive PRILOSEC 10mg, kan udvikle visse typer lupus erythematosus eller få en forværring af den lupus, de allerede har. Ring til din læge med det samme, hvis du har nye eller forværrede ledsmerter eller udslæt på dine kinder eller arme, der bliver værre i solen.
Tal med din læge om din risiko for disse alvorlige bivirkninger. PRILOSEC 10mg kan have andre alvorlige bivirkninger. Se "Hvad er de mulige bivirkninger af PRILOSEC 20mg?"
Hvad er PRILOSEC 20mg?
En receptpligtig medicin kaldet en protonpumpehæmmer (PPI), der bruges til at reducere mængden af syre i din mave.
Hos voksne, PRILOSEC 20mg bruges til:
- op til 8 uger til heling af duodenalsår.
- 10 til 14 dage med visse antibiotika til behandling af en infektion forårsaget af bakterier kaldet H. pylori. Hvis det er nødvendigt, kan din læge ordinere yderligere 14 til 18 dage med PRILOSEC efter behandling med antibiotika.
- op til 8 uger til heling af mavesår.
- op til 4 uger til at behandle halsbrand og andre symptomer, der opstår med gastroøsofageal reflukssygdom (GERD).
- op til 8 uger til heling og symptomlindring af syrerelateret skade på slimhinden i spiserøret (kaldet erosiv esophagitis eller EE). Din læge kan ordinere yderligere 4 uger med PRILOSEC 20 mg til patienter, hvis EE ikke heler.
- opretholdelse af heling af EE og for at hjælpe med at forhindre tilbagevenden af halsbrandssymptomer forårsaget af GERD. Det vides ikke, om PRILOSEC er sikkert og effektivt, når det bruges i mere end 12 måneder til dette formål.
- den langvarige behandling af tilstande, hvor din mave laver for meget syre. Dette omfatter en sjælden tilstand kaldet Zollinger-Ellison Syndrom.
Hos børn i alderen 1 til 16 år, PRILOSEC 20mg bruges til:
- op til 4 uger til at behandle halsbrand og andre symptomer, der opstår med GERD.
- op til 8 uger at behandle GERD med EE.
- opretholdelse af heling af EE og for at hjælpe med at forhindre tilbagevenden af halsbrandssymptomer forårsaget af GERD. Det vides ikke, om PRILOSEC er sikkert og effektivt, når det bruges i mere end 12 måneder til dette formål.
Hos børn fra 1 måned til under 12 måneder, PRILOSEC 10mg bruges til:
- op til 6 uger at behandle GERD med EE. Det vides ikke, om PRILOSEC er sikkert og effektivt til anden anvendelse til børn i alderen 1 måned til under 12 måneder eller til børn under 1 måned.
Tag ikke PRILOSEC, hvis du er:
- allergisk over for omeprazol, enhver anden PPI-medicin eller et af indholdsstofferne i PRILOSEC. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser.
- tager en medicin, der indeholder rilpivirin (EDURANT, COMPLERA, ODEFSEY), der bruges til at behandle HIV-1 (humant immundefektvirus).
Inden du tager PRILOSEC 20 mg, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du:
- har lave magnesiumniveauer, lave calciumniveauer og lave kaliumniveauer i dit blod.
- er gravid eller planlægger at blive gravid. Det vides ikke, om PRILOSEC 10mg vil skade dit ufødte barn.
- ammer eller planlægger at amme. PRILOSEC 40 mg kan passere over i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager PRILOSEC.
- Fortæl din læge om al den medicin du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. Fortæl det især din læge, hvis du tager et lægemiddel, der indeholder clarithromycin eller amoxicillin, clopidogrel (Plavix), methotrexat (Otrxup, Rasuvo, Trexall, XATMEP), digoxin (LANOXIN), en vandpille (vanddrivende), perikon (Hypericum perforatum) eller rifampin (Rimactane, Rifater, Rifamate).
Hvordan skal jeg tage PRILOSEC 20mg?
- Tag PRILOSEC 20 mg nøjagtigt som foreskrevet af din læge.
- Du må ikke ændre din dosis eller stoppe med PRILOSEC 40 mg uden at tale med din læge.
- PRILOSEC tages normalt 1 gang hver dag.
- Tag PRILOSEC 20 mg før et måltid.
- Antacida kan tages sammen med PRILOSEC.
- PRILOSEC blandes med vand og kan tages gennem munden eller gives gennem en nasogastrisk sonde (NG) eller mavesonde.
- Se den "Brugsvejledning" i slutningen af denne medicinvejledning for instruktioner om, hvordan man blander og tager PRILOSEC 10 mg gennem munden i vand, eller hvordan man blander og giver PRILOSEC gennem et NG-rør eller en mavesonde blandet i vand.
- Hvis du glemmer en dosis PRILOSEC, skal du tage den, så snart du husker det. Hvis det næsten er tid til din næste dosis, må du ikke tage den glemte dosis. Tag den næste dosis på dit normale tidspunkt. Tag ikke 2 doser på samme tid.
- Hvis du tager for meget PRILOSEC, skal du straks ringe til din læge eller dit giftkontrolcenter på 1-800-222-1222 eller gå til den nærmeste skadestue.
Hvad er de mulige bivirkninger af PRILOSEC 40mg?
PRILOSEC kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om PRILOSEC 40mg?"
- Lavt vitamin B-12 niveau din krop kan forekomme hos personer, der har taget PRILOSEC 40mg i lang tid (mere end 3 år). Fortæl din læge, hvis du har symptomer på lave vitamin B-12-niveauer, herunder åndenød, svimmelhed, uregelmæssig hjerterytme, muskelsvaghed, bleg hud, træthed, humørsvingninger og prikken eller følelsesløshed i arme og ben.
- Lavt magnesiumniveau og mineralstofskifte i din krop kan forekomme hos personer, der har taget PRILOSEC i mindst 3 måneder. Fortæl din læge, hvis du har symptomer på lave magnesiumniveauer, herunder kramper, svimmelhed, uregelmæssig hjerterytme, nervøsitet, muskelsmerter eller -svaghed og spasmer i hænder, fødder eller stemme.
- Mavevækster (fundiske kirtelpolypper). Personer, der tager PPI-medicin i lang tid, har en øget risiko for at udvikle en bestemt type mavevækst kaldet fundic gland polypper, især efter at have taget PPI-medicin i mere end 1 år.
- Alvorlige hudreaktioner. PRILOSEC kan forårsage sjældne, men alvorlige hudreaktioner, som kan påvirke enhver del af din krop. Disse alvorlige hudreaktioner skal muligvis behandles på et hospital og kan være livstruende:
- Hududslæt, som kan have blærer, afskalning eller blødning på nogen del af din hud (inklusive dine læber, øjne, mund, næse, kønsorganer, hænder eller fødder).
- Du kan også have feber, kulderystelser, smerter i kroppen, åndenød eller forstørrede lymfeknuder.
Stop med at tage PRILOSEC 20 mg og ring til din læge med det samme. Disse symptomer kan være det første tegn på en alvorlig hudreaktion.
De mest almindelige bivirkninger af PRILOSEC 40 mg hos voksne omfatter: hovedpine, mavesmerter (mave), kvalme, diarré, opkastning og gas.
De mest almindelige bivirkninger af PRILOSEC hos børn i alderen 1 til 16 år omfatter: øvre luftvejsinfektion, feber, hovedpine, mavesmerter (mave), kvalme, diarré, opkastning og gas. Disse er ikke alle de mulige bivirkninger af PRILOSEC. Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare PRILOSEC 40mg?
Opbevar PRILOSEC ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
Opbevar PRILOSEC 20mg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af PRILOSEC.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke PRILOSEC til en tilstand, som den ikke er ordineret til. Giv ikke PRILOSEC 40 mg til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem. Du kan bede din læge eller apoteket om oplysninger om PRILOSEC 20mg, der er skrevet til sundhedspersonale.
Hvad er ingredienserne i PRILOSEC?
Aktiv ingrediens: omeprazol magnesium
Inaktive ingredienser: glycerylmonostearat, hydroxypropylcellulose, hypromellose, magnesiumstearat, methacrylsyrecopolymer C, polysorbat, sukkerkugler, talkum og triethylcitrat og også inaktive granulat. De inaktive granula er sammensat af citronsyre, crospovidon, dextrose, hydroxypropylcellulose, jernoxid og xanthangummi.
BRUGSVEJLEDNING
PRILOSEC® (pry-lo-sec) (omeprazol magnesium) til oral suspension med forsinket frigivelse
Indtagelse af PRILOSEC 40 mg i vand:
Indgivelse af PRILOSEC med vand gennem en nasogastrisk (NG) sonde eller mavesonde:
Til personer, der har en NG-sonde eller mavesonde, der er størrelse 6 eller større, kan PRILOSEC gives som følger:
Denne medicinvejledning er godkendt af US Food and Drug Administration
