Nimotop 30mg Nimodipine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Nimotop 30mg, og hvordan bruges det?
Nimotop er en receptpligtig medicin, der bruges til at behandle symptomerne på aneurisme (subarachnoid blødning). Nimotop kan bruges alene eller sammen med andre lægemidler.
Nimotop tilhører en klasse af lægemidler kaldet Calcium Channel Blockers; Neurologi, Andet; Calciumkanalblokkere, Dihydrophyridin.
Det vides ikke, om Nimotop 30mg er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Nimotop?
Nimotop kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- svimmelhed,
- hurtig eller langsom puls, og
- hævelse eller dine ankler eller fødder
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Nimotop omfatter:
- lavt blodtryk (føler sig let i hovedet),
- kvalme,
- dårlig mave,
- langsomme hjerteslag, og
- muskelsmerter
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Nimotop. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
INDGIV IKKE NIMOTOP (nimodipin) INTRAVENØST ELLER VIA ANDRE PARENTERALE RUTER. DØDSFALD OG ALVORLIGE, LIVSTRUENDE BIVIRKNINGER ER OPKOMST, NÅR INDHOLDET AF NIMOTOP (nimodipin) KAPSLER ER BLEVET INJICERET PARENTERALT (se ADVARSLER og DOSERING OG ADMINISTRATION).
BESKRIVELSE
Nimotop® (nimodipin) tilhører klassen af farmakologiske midler kendt som calciumkanalblokkere. Nimodipin er isopropyl-2-methoxyethyl-1,4-dihydro-2,6-dimethyl-4-(m-nitrophenyl)-3,5-pyridindicarboxylat. Det har en molekylvægt på 418,5 og en molekylær formel på C21H26N2O7. Strukturformlen er:
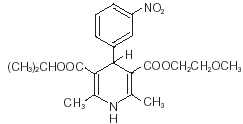
Nimodipin er et gult krystallinsk stof, praktisk talt uopløseligt i vand.
NIMOTOP® (nimodipin) kapsler er formuleret som bløde gelatinekapsler til oral administration. Hver væskefyldt kapsel indeholder 30 mg nimodipin i et vehikel af glycerin, pebermynteolie, renset vand og polyethylenglycol 400. Den bløde gelatinekapselskalle indeholder gelatine, glycerin, renset vand og titaniumdioxid.
INDIKATIONER
Nimotop® (nimodipin) er indiceret til forbedring af det neurologiske resultat ved at reducere forekomsten og sværhedsgraden af iskæmiske deficit hos patienter med subaraknoidal blødning fra sprængte intrakranielle bæraneurismer uanset deres post-ictus neurologiske tilstand (dvs. Hunt og Hess grad IV).
DOSERING OG ADMINISTRATION
INDGIV IKKE NIMOTOP (nimodipin) KAPSLER INTRAVENØST ELLER VIA ANDRE PARENTERALE VEJER (se ADVARSLER). Hvis Nimotop (nimodipin) utilsigtet administreres intravenøst, kan klinisk signifikant hypotension kræve kardiovaskulær støtte med pressormidler. Specifikke behandlinger for overdosis af calciumkanalblokkere bør også gives omgående.
Nimotop (nimodipin) gives oralt i form af elfenbensfarvet, blød gelatine 30 mg kapsler til subaraknoidal blødning.
Den orale dosis er 60 mg (to 30 mg kapsler) hver 4. time i 21 på hinanden følgende dage, helst ikke mindre end en time før eller to timer efter måltider. Oral Nimotop® (nimodipin) behandling bør påbegyndes inden for 96 timer efter subaraknoidalblødningen.
Hvis kapslen ikke kan sluges, f.eks. på operationstidspunktet, eller hvis patienten er bevidstløs, skal der laves et hul i begge ender af kapslen med en 18 gauge kanyle, og kapslens indhold ekstraheres i en sprøjte. En parenteral sprøjte kan bruges til at ekstrahere væsken inde i kapslen, men væsken skal altid overføres til en sprøjte, der ikke kan modtage en nål, og som er designet til oral administration eller via en naso-gastrisk sonde eller PEG. For at hjælpe med at minimere administrationsfejl anbefales det, at den sprøjte, der bruges til administration, er mærket "Not for IV Use". Indholdet skal derefter tømmes i patientens in situnaso-mavesonde og skylles ned i sonden med 30 ml normalt saltvand (0,9%). Effekten og sikkerheden af denne indgivelsesmetode er ikke blevet påvist i kliniske forsøg.
Patienter med levercirrose har væsentligt reduceret clearance og ca. fordoblet Cmax. Dosis bør reduceres til 30 mg hver 4. time under nøje overvågning af blodtryk og hjertefrekvens.
HVORDAN LEVERET
Hver elfenbensfarvet, blød gelatine NIMOTOP® (nimodipin) kapsel er præget med ordet Nimotop 30 mg og indeholder 30 mg nimodipin. 30 mg kapslerne er pakket i enhedsdosis folieposer og leveres i kartoner indeholdende 100 kapsler. Produktet er også tilgængeligt i børnesikre enhedsdosis sikkerhedspak folieposer indeholdende 30 kapsler pr. karton. Kapslerne skal opbevares i producentens originale foliepakke ved 25°C (77°F), ture tilladt til 15-30°C (59-86°F) [Se USP kontrolleret rumtemperatur.]
Kapsler skal beskyttes mod lys og frost.
Distribueret af: Bayer Pharmaceuticals Corporation, 400 Morgan Lane, West Haven, CT 06516. Fremstillet af: Catalent Pharma Solutions St. Petersburg, FL 33716. FDA revisionsdato: 20/1/2006
BIVIRKNINGER
Bivirkninger blev rapporteret af 92 ud af 823 patienter med subaraknoidal blødning (11,2%), som fik nimodipin. Den hyppigst rapporterede bivirkning var nedsat blodtryk hos 4,4 % af disse patienter. Niogtyve af 479 (6,1 %) placebobehandlede patienter rapporterede også bivirkninger. Hændelser rapporteret med en frekvens på mere end 1 % er vist nedenfor efter dosis.
DOSERING q4h Antal patienter (%) Nimodipin
Der var ingen andre bivirkninger rapporteret af patienterne, som fik 0,35 mg/kg 4. time, 30 mg q4. time eller 120 mg q4. time. Bivirkninger med en incidensrate på mindre end 1 % i 60 mg q4h-dosisgruppen var: hepatitis; kløe; gastrointestinal blødning; trombocytopeni; anæmi; hjertebanken; opkastning; rødmen; diaforese; hvæsende vejrtrækning; phenytoin toksicitet; svimmelhed; svimmelhed; rebound vasospasme; gulsot; forhøjet blodtryk; hæmatom.
Bivirkninger med en incidensrate på mindre end 1 % i 90 mg q4h-dosisgruppen var: kløe, gastrointestinal blødning; trombocytopeni; neurologisk forringelse; opkastning; diaforese; kongestiv hjertesvigt; hyponatriæmi; faldende blodpladetal; dissemineret intravaskulær koagulation; dyb venetrombose.
Som det kan ses af tabellen, inkluderede bivirkninger, der forekommer relateret til nimodipinbrug baseret på øget forekomst med højere dosis eller en højere rate sammenlignet med placebokontrol, nedsat blodtryk, ødem og hovedpine, som er kendte farmakologiske virkninger af calciumkanalblokkere. Det skal dog bemærkes, at SAH ofte er ledsaget af ændringer i bevidstheden, som fører til underrapportering af uønskede oplevelser. Patienter, der modtog nimodipin i kliniske forsøg for andre indikationer, rapporterede rødmen (2,1 %), hovedpine (4,1 %) og væskeretention (0,3 %), typiske reaktioner på calciumkanalblokkere. Som calciumkanalblokker kan nimodipin have potentiale til at forværre hjerteinsufficiens hos følsomme patienter eller interferere med AV-ledning, men disse hændelser blev ikke observeret.
Ingen klinisk signifikant effekt på hæmatologiske faktorer, nyre- eller leverfunktion eller kulhydratmetabolisme er blevet kausalt forbundet med oral nimodipin. Isolerede tilfælde af ikke-fastende forhøjede serumglukoseniveauer (0,8 %), forhøjede LDH-niveauer (0,4 %), faldende blodpladetal (0,3 %), forhøjede niveauer af alkalisk fosfatase (0,2 %) og forhøjede SGPT-niveauer (0,2 %) er blevet rapporteret. sjældent.

Stofmisbrug og afhængighed
Der har ikke været rapporteret tilfælde af stofmisbrug eller afhængighed af Nimotop® (nimodipin).
DRUGSINTERAKTIONER
Det er muligt, at den kardiovaskulære virkning af andre calciumkanalblokkere kan forstærkes ved tilsætning af Nimotop® (nimodipin).
I Europa er det observeret, at Nimotop® (nimodipin) lejlighedsvis forstærker virkningen af antihypertensive stoffer, der tages samtidig af patienter, der lider af hypertension; dette fænomen blev ikke observeret i nordamerikanske kliniske forsøg.
En undersøgelse med otte raske frivillige har vist en stigning på 50 % i den gennemsnitlige maksimale nimodipin-plasmakoncentration og en stigning på 90 % i det gennemsnitlige areal under kurven efter en uges kur med cimetidin med 1.000 mg/dag og nimodipin med 90 mg/dag. . Denne effekt kan medieres af den kendte hæmning af hepatisk cytokrom P-450 af cimetidin, hvilket kan nedsætte first-pass metabolisme af nimodipin.
ADVARSLER
DØDSFORHOLD VED UVÆLGENDE INTRAVENØS ADMINISTRATION: INDGIV IKKE NIMOTOP (nimodipin) INTRAVENØST ELLER VIA ANDRE PARENTERALE RUTER. DØDSFALD OG ALVORLIGE, LIVSTRUENDE BIVIRKNINGER, HERUNDER HJERTESTOP, Hjerte- og karkollaps, HYPOTENSION OG BRADYKARDI, ER FOREKOMST, NÅR INDHOLDET AF NIMOTOP (nimodipin) KAPSEL HAR BLEVET ADMINOS.
FORHOLDSREGLER
Generel: Blodtryk: Nimodipin har de hæmodynamiske virkninger, der forventes af en calciumkanalblokker, selvom de generelt ikke er markante. Imidlertid har intravenøs administration af indholdet af Nimotop (nimodipin) kapsler resulteret i alvorlige bivirkninger, herunder død, hjertestop, kardiovaskulær kollaps, hypotension og bradykardi. Hos patienter med subaraknoidal blødning, der fik Nimotop® (nimodipin) i kliniske undersøgelser, blev omkring 5 % rapporteret at have haft blodtrykssænkning, og omkring 1 % forlod undersøgelsen på grund af dette (ikke alle kunne tilskrives nimodipin). Ikke desto mindre bør blodtrykket overvåges nøje under behandling med Nimotop® (nimodipin) baseret på dets kendte farmakologi og de kendte virkninger af calciumkanalblokkere. (se ADVARSLER og DOSERING OG ADMINISTRATION )
Leversygdom: Metabolismen af Nimotop® (nimodipin) er nedsat hos patienter med nedsat leverfunktion. Sådanne patienter bør have deres blodtryk og puls overvåget nøje og bør have en lavere dosis (se DOSERING OG ADMINISTRATION ).
Intestinal pseudo-obstruktion og ileus er sjældent blevet rapporteret hos patienter behandlet med nimodipin. En årsagssammenhæng er ikke fastslået. Tilstanden har reageret på konservativ ledelse.
Laboratorietestinteraktioner: Ingen kendte.
Karcinogenese, mutagenese, svækkelse af fertilitet: en to-årig undersøgelse blev der observeret højere forekomster af adenokarcinom i uterus og Leydig-celle adenom i testiklerne hos rotter, der fik en diæt indeholdende 1800 ppm nimodipin (svarende til 91 til 121 mg/kg/dag nimodipin) end hos placebokontroller. . Forskellene var imidlertid ikke statistisk signifikante, og de højere rater lå godt inden for det historiske kontrolområde for disse tumorer i Wistar-stammen.
Nimodipin viste sig ikke at være kræftfremkaldende i et 91-ugers musestudie, men den høje dosis på 1800 ppm nimodipin-i-foder (546 til 774 mg/kg/dag) forkortede dyrenes forventede levetid. Mutagenicitetsundersøgelser, inklusive Ames, mikronucleus og dominant letale test var negative. Nimodipin svækkede ikke fertiliteten og den generelle reproduktionsevne hos Wistar-han- og hunrotter efter orale doser på op til 30 mg/kg/dag, når det blev administreret dagligt i mere end 10 uger hos hannerne og 3 uger hos hunnerne før parring og fortsatte. til dag 7 af graviditeten. Denne dosis i en rotte er ca. 4 gange den ækvivalente kliniske dosis på 60 mg hver fjerde time i en patient på 50 kg.
Graviditet: Graviditetskategori C. Nimodipin har vist sig at have en teratogene virkning hos Himalaya-kaniner. Forekomsten af misdannelser og forkrøplede fostre var øget ved orale doser på 1 og 10 mg/kg/dag administreret (ved sonde) fra dag 6 til dag 18 af graviditeten, men ikke med 3,0 mg/kg/dag i et af to identiske kaninundersøgelser. I den anden undersøgelse sås en øget forekomst af forkrøplede fostre ved 1,0 mg/kg/dag, men ikke ved højere doser. Nimodipin var embryotoksisk, hvilket forårsagede resorption og hæmmet vækst af fostre, hos Long Evans-rotter ved 100 mg/kg/dag indgivet med sonde fra dag 6 til dag 15 af graviditeten. I to andre rotteundersøgelser var doser på 30 mg/kg/dag nimodipin indgivet via sonde fra dag 16 af drægtighed og fortsatte indtil aflivning (dag 20 i graviditeten eller dag 21 efter fødslen) forbundet med højere forekomster af skeletvariation, hæmmede fostre og dødfødsler, men ingen misdannelser. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder til direkte at vurdere virkningen på humane fostre. Nimodipin bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Ammende mødre: Nimodipin og/eller dets metabolitter har vist sig at forekomme i rottemælk i koncentrationer, der er meget højere end i maternal plasma. Det vides ikke, om lægemidlet udskilles i modermælk. Da mange lægemidler udskilles i modermælk, rådes ammende mødre til ikke at amme deres babyer, når de tager lægemidlet.
Pædiatrisk brug: Sikkerhed og effektivitet hos børn er ikke blevet fastslået.
Geriatrisk brug: Kliniske undersøgelser af nimodipin omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Generelt bør dosering til ældre patienter være forsigtig, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling.
OVERDOSIS
Der har ikke været rapporter om overdosering efter oral administration af Nimotop® (nimodipin). Symptomer på overdosering forventes at være relateret til kardiovaskulære effekter såsom overdreven perifer vasodilatation med markant systemisk hypotension. Klinisk signifikant hypotension på grund af Nimotop® (nimodipin) overdosering kan kræve aktiv kardiovaskulær støtte med pressormidler. Specifikke behandlinger for overdosis af calciumkanalblokkere bør også gives omgående. Da Nimotop® (nimodipin) er stærkt proteinbundet, vil dialyse sandsynligvis ikke være til gavn.
KONTRAINDIKATIONER
Ingen kendte.
KLINISK FARMAKOLOGI
Virkningsmekanisme: Nimodipin er en calciumkanalblokker. De kontraktile processer af glatte muskelceller er afhængige af calciumioner, som kommer ind i disse celler under depolarisering som langsomme ioniske transmembrane strømme. Nimodipin hæmmer calciumionoverførsel til disse celler og hæmmer dermed kontraktioner af glat muskulatur. I dyreforsøg havde nimodipin en større effekt på cerebrale arterier end på arterier andre steder i kroppen, måske fordi det er meget lipofilt, hvilket tillader det at krydse blod-hjerne-barrieren; koncentrationer af nimodipin så høje som 12,5 ng/ml er blevet påvist i cerebrospinalvæsken hos nimodipin-behandlede subarachnoid blødning (SAH) patienter. Den præcise virkningsmekanisme af nimodipin hos mennesker er ukendt. Selvom de kliniske undersøgelser, der er beskrevet nedenfor, viser en gunstig effekt af nimodipin på sværhedsgraden af neurologiske underskud forårsaget af cerebral vasospasme efter SAH, er der ingen arteriografisk dokumentation for, at lægemidlet enten forhindrer eller lindrer spasmer i disse arterier. Hvorvidt den anvendte arteriografiske metodologi var tilstrækkelig til at påvise en klinisk meningsfuld effekt, hvis nogen, på vasospasme er imidlertid ukendt.
Farmakokinetik og stofskifte: Hos mennesker absorberes nimodipin hurtigt efter oral administration, og maksimale koncentrationer nås generelt inden for en time. Den terminale eliminationshalveringstid er ca. 8 til 9 timer, men tidligere eliminationshastigheder er meget hurtigere, svarende til en halveringstid på 1-2 timer; en konsekvens er behovet for hyppig (hver 4. time) dosering. Der var ingen tegn på ophobning, når nimodipin blev givet tre gange dagligt i syv dage. Nimodipin er over 95 % bundet til plasmaproteiner. Bindingen var koncentrationsuafhængig over området fra 10 ng/ml til 10 µg/ml. Nimodipin elimineres næsten udelukkende i form af metabolitter, og mindre end 1 % genfindes i urinen som uændret lægemiddel. Talrige metabolitter, som alle er enten inaktive eller betydeligt mindre aktive end moderforbindelsen, er blevet identificeret. På grund af et højt first-pass metabolisme er biotilgængeligheden af nimodipin i gennemsnit 13 % efter oral administration. Biotilgængeligheden er signifikant øget hos patienter med levercirrose, med Cmax ca. det dobbelte af Cmax hos normale patienter, hvilket gør det nødvendigt at sænke dosis hos denne gruppe patienter (se DOSERING OG ADMINISTRATION ). I et studie med 24 raske mandlige frivillige resulterede administration af nimodipinkapsler efter en standard morgenmad i en 68 % lavere maksimal plasmakoncentration og 38 % lavere biotilgængelighed i forhold til dosering under fastende forhold.
I et enkelt parallelgruppestudie med 24 ældre forsøgspersoner (i alderen 59-79) og 24 yngre forsøgspersoner (i alderen 22-40 år), var den observerede AUC og Cmax for nimodipin ca. 2 gange højere i den ældre population sammenlignet med den yngre undersøgelse. forsøgspersoner efter oral administration (givet som en enkelt dosis på 30 mg og doseret til steady-state med 30 mg tid i 6 dage). Det kliniske respons på disse aldersrelaterede farmakokinetiske forskelle blev dog ikke betragtet som signifikant. (Se FORHOLDSREGLER : Geriatrisk brug.)
Kliniske forsøg: Nimodipin har i 4 randomiserede, dobbeltblindede, placebo-kontrollerede undersøgelser vist sig at reducere sværhedsgraden af neurologiske mangler som følge af vasospasme hos patienter, som for nylig har haft en subaraknoidal blødning (SAH). Forsøgene brugte doser fra 20-30 mg til 90 mg hver 4. time, med lægemidlet givet i 21 dage i 3 undersøgelser og i mindst 18 dage i den anden. Tre af de fire forsøg fulgte patienter i 3-6 måneder. Tre af forsøgene undersøgte relativt godt patienter, med alle eller de fleste patienter i Hunt og Hess grad I - III (i det væsentlige fri for fokale underskud efter den indledende blødning). Den fjerde undersøgte meget syge patienter, Hunt og Hess grad III - V. To undersøgelser , en amerikansk, en fransk, var ens i design, med relativt uhæmmede SAH-patienter randomiseret til nimodipin eller placebo. I hver blev der foretaget en vurdering af, om et eventuelt sent udviklende underskud skyldtes spasmer eller andre årsager, og underskuddene blev graderet. Begge undersøgelser viste signifikant færre alvorlige underskud på grund af spasmer i nimodipingruppen; den anden (franske) undersøgelse viste færre spasme-relaterede underskud af alle sværhedsgrader. Der blev ikke set nogen effekt på underskud, der ikke var relateret til spasmer.
En tredje, stor undersøgelse blev udført i Det Forenede Kongerige med SAH-patienter med alle sværhedsgrader (men 89 % var i grad I-III). Nimodipin blev doseret 60 mg hver 4. time. Udfaldene blev ikke defineret som spasme-relaterede eller ej, men der var en signifikant reduktion i den samlede frekvens af infarkt og alvorligt invaliderende neurologiske udfald efter 3 måneder:
En canadisk undersøgelse indgik meget syge patienter (Hunt og Hess Grade III-V), som havde en høj rate af dødsfald og invaliditet, og brugte en dosis på 90 mg hver 4. time, men lignede ellers de to første undersøgelser. Analyse af forsinkede iskæmiske underskud, hvoraf mange skyldes spasmer, viste en signifikant reduktion i spasme-relaterede underskud. Blandt analyserede patienter (72 nimodipin, 82 placebo) var der følgende resultater.
Når data blev kombineret for de canadiske og britiske undersøgelser, var behandlingsforskellen på succesrate (dvs. god bedring) på Glasgow Outcome Scale 25,3 % (nimodipin) versus 10,9 % (placebo) for Hunt og Hess grad IV eller V. Tabellen nedenfor viser, at nimodipin har en tendens til at forbedre god bedring af SAH-patienter med dårlig neurologisk status post-ictus, samtidig med at det reducerer antallet med alvorligt handicap og vegetativ overlevelse.
Et dosisområdestudie, der sammenlignede 30, 60 og 90 mg doser, fandt en generelt lav frekvens af spasmerelateret neurologiske underskud, men ingen dosis-respons sammenhæng.
PATIENTOPLYSNINGER
Ingen oplysninger angivet. Der henvises til ADVARSLER og FORHOLDSREGLER sektioner.
