Micardis 20mg, 40mg, 80mg Telmisartan Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Micardis 40mg, og hvordan bruges det?
Micardis er en receptpligtig medicin, der bruges til at behandle symptomer på forhøjet blodtryk (hypertension) og til at reducere risikoen for hjerte-kar-sygdomme såsom slagtilfælde og hjerteanfald. Micardis 20mg kan bruges alene eller sammen med anden medicin.
Micardis 80mg tilhører en klasse af lægemidler kaldet ARB'er.
Det vides ikke, om Micardis er sikkert og effektivt til børn under 18 år.
Hvad er de mulige bivirkninger af Micardis?
Micardis 80mg kan forårsage alvorlige bivirkninger, herunder:
- svimmelhed,
- hævelse,
- hurtig vægtøgning,
- kvalme,
- svaghed,
- prikkende følelse,
- brystsmerter,
- uregelmæssige hjerteslag, og
- tab af bevægelse
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Micardis omfatter:
- tilstoppet næse,
- sinus smerter,
- rygsmerter, og
- diarré
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Micardis. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSICITET
- Når graviditet opdages, seponeres MICARDIS 40mg så hurtigt som muligt [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
- Lægemidler, der virker direkte på renin-angiotensin-systemet, kan forårsage skade og død på fosteret under udvikling [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
BESKRIVELSE
MICARDIS 40mg er anon-peptid angiotensin II receptor (type AT1) antagonist.
Telmisartan er kemisk beskrevet som 4'-[(1,4'-dimethyl-2'-propyl [2,6'-bi-1H-benzimidazol]-1'-yl)methyl ]-[1,1'-biphenyl]-2-carboxylsyre. Dens empiriske formel er C33H30N4O2, dens molekylvægt er 514,63, og dens strukturformler er:
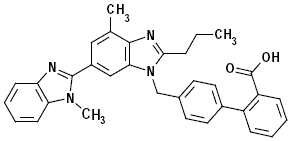
Telmisartan er et hvidt til let gulligt fast stof. Det er praktisk talt uopløseligt i vand og i pH-området fra 3 til 9, tungtopløseligt i stærk syre (undtagen uopløseligt i saltsyre) og opløseligt i stærk base.
MICARDIS 20mg fås som tabletter til oral administration, indeholdende 20 mg, 40 mg eller 80 mg telmisartan. Tabletterne indeholder følgende inaktive ingredienser: natriumhydroxid, meglumin, povidon, sorbitol og magnesiumstearat. MICARDIS tabletter er hygroskopiske og kræver beskyttelse mod fugt.
INDIKATIONER
MICARDIS HCT (telmisartan og hydrochlorthiazid) er indiceret til behandling af hypertension for at sænke blodtrykket. Sænkning af blodtrykket reducerer risikoen for fatale og ikke-dødelige kardiovaskulære hændelser, primært slagtilfælde og myokardieinfarkter. Disse fordele er blevet set i kontrollerede forsøg med antihypertensiva fra en lang række farmakologiske klasser, herunder de klasser, som dette lægemiddel hovedsageligt tilhører. Der er ingen kontrollerede forsøg, der viser risikoreduktion med MICARDIS HCT.
Kontrol af forhøjet blodtryk bør være en del af omfattende kardiovaskulær risikostyring, herunder, hvor det er relevant, lipidkontrol, diabetesbehandling, antitrombotisk behandling, rygestop, motion og begrænset natriumindtag. Mange patienter vil kræve mere end ét lægemiddel for at nå blodtryksmålene. For specifik rådgivning om mål og ledelse, se offentliggjorte retningslinjer, såsom dem fra National High Blood Pressure Education Program's Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Talrige antihypertensiva, fra en række farmakologiske klasser og med forskellige virkningsmekanismer, er i randomiserede kontrollerede forsøg blevet vist at reducere kardiovaskulær morbiditet og dødelighed, og det kan konkluderes, at det er blodtryksreduktion og ikke en anden farmakologisk egenskab ved stofferne, der i høj grad er ansvarlige for disse fordele. Den største og mest konsistente kardiovaskulære udfaldsfordel har været en reduktion i risikoen for slagtilfælde, men reduktioner i myokardieinfarkt og kardiovaskulær dødelighed er også set regelmæssigt.
Forhøjet systolisk eller diastolisk tryk forårsager øget kardiovaskulær risiko, og den absolutte risikostigning pr. mmHg er større ved højere blodtryk, så selv beskedne reduktioner af svær hypertension kan give væsentlige fordele. Relativ risikoreduktion fra blodtryksreduktion er ens på tværs af populationer med varierende absolut risiko, så den absolutte fordel er større hos patienter, der er i højere risiko uafhængigt af deres hypertension (f.eks. patienter med diabetes eller hyperlipidæmi), og sådanne patienter kan forventes at drage fordel af mere aggressiv behandling til et lavere blodtryksmål.
Nogle antihypertensiva har mindre blodtrykseffekter (som monoterapi) hos sorte patienter, og mange antihypertensiva har yderligere godkendte indikationer og virkninger (f.eks. på angina, hjertesvigt eller diabetisk nyresygdom). Disse overvejelser kan vejlede valg af terapi [se Kliniske Studier ].
MICARDIS 40mg HCT er ikke indiceret til initial behandling til behandling af hypertension [se DOSERING OG ADMINISTRATION ].
MICARDIS HCT kan anvendes alene eller i kombination med andre antihypertensiva.
DOSERING OG ADMINISTRATION
Doseringsoplysninger
Påbegynd en patient, hvis blodtryk ikke er tilstrækkeligt kontrolleret med telmisartan monoterapi 80 mg på MICARDIS 40 mg HCT, 80 mg/12,5 mg én gang dagligt. Dosis kan om nødvendigt titreres op til 160 mg/25 mg efter 2 til 4 uger.
Påbegynd en patient, hvis blodtryk ikke er tilstrækkeligt kontrolleret med 25 mg hydrochlorthiazid én gang dagligt, eller er kontrolleret, men som oplever hypokaliæmi, med denne behandling med MICARDIS HCT 80 mg/12,5 mg én gang dagligt. Dosis kan om nødvendigt titreres op til 160 mg/25 mg efter 2 til 4 uger.
Patienter titreret til de individuelle komponenter (telmisartan og hydrochlorthiazid) kan i stedet modtage den tilsvarende dosis MICARDIS 20 mg HCT.
MICARDIS 20mg HCT kan administreres sammen med andre antihypertensiva.
Dosisjustering for nedsat leverfunktion
Påbegynd patienter med galdevejsobstruktive lidelser eller leverinsufficiens under tæt medicinsk overvågning med 40 mg/12,5 mg kombinationen. MICARDIS 40mg HCT-tabletter anbefales ikke til patienter med svært nedsat leverfunktion [se Brug i specifikke populationer og KLINISK FARMAKOLOGI ].
Vigtige administrationsinstruktioner
MICARDIS HCT tabletter bør ikke fjernes fra blisterkort før umiddelbart før administration.
HVORDAN LEVERET
Doseringsformer og styrker
- 40 mg/12,5 mg, røde og hvide tabletter mærket med Boehringer Ingelheim-logoet og H4
- 80 mg/12,5 mg, røde og hvide tabletter mærket med Boehringer Ingelheim-logoet og H8
- 80 mg/25 mg, gule og hvide tabletter mærket med Boehringer Ingelheim-logoet og H9
Opbevaring og håndtering
MICARDIS 20mg HCT fås i tre styrker som bikonvekse tolags, aflange, uovertrukne tabletter indeholdende telmisartan og hydrochlorthiazid:
- 40 mg/12,5 mg tablet: rød og hvid (kan indeholde røde pletter) markeret med Boehringer Ingelheim firmasymbolet og H4; individuelt blisterforseglet i kartoner med 30 tabletter som 3 x 10 kort ( NDC 0597-0043-37)
- 80 mg/12,5 mg tablet: rød og hvid (kan indeholde røde pletter) markeret med Boehringer Ingelheim firmasymbolet og H8; individuelt blisterforseglet i kartoner med 30 tabletter som 3 x 10 kort ( NDC 0597-0044-37)
- 80 mg/25 mg tablet: gul og hvid (kan indeholde gule pletter) markeret med Boehringer Ingelheim firmasymbolet og H9; individuelt blisterforseglet i kartoner med 30 tabletter som 3 x 10 kort ( NDC 0597-0042-37)
Opbevaring
Opbevares ved 25°C (77°F); udflugter tilladt til 15°C-30°C (59°F-86°F) [se USP kontrolleret rumtemperatur]. Tabletter bør ikke fjernes fra blisterkort før umiddelbart før administration.
Distribueret af: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Revideret: oktober 2018
BIVIRKNINGER
Følgende bivirkninger er diskuteret andetsteds i mærkningen:
- Hypotension [se ADVARSLER OG FORHOLDSREGLER ]
- Nedsat nyrefunktion [se ADVARSLER OG FORHOLDSREGLER ]
- Elektrolytter og stofskifteforstyrrelser [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i praksis.
MICARDIS HCT er blevet evalueret for sikkerhed hos mere end 1700 patienter, herunder 716 behandlet for hypertension i mere end 6 måneder og 420 i mere end 1 år. Bivirkninger har været begrænset til dem, der tidligere er blevet rapporteret med telmisartan og/eller hydrochlorthiazid.
Bivirkninger, der forekommer med en incidens på ≥2 % hos patienter behandlet med telmisartan/hydrochlorthiazid og med en højere hastighed end hos patienter behandlet med placebo, er vist i tabel 1 [se Kliniske Studier ].
Andre bivirkninger observeret for telmisartan/hydrochlorthiazid var: smerter (inklusive ryg og abdominal), dyspepsi, erytem, opkastning, bronkitis og pharyngitis.
Bivirkninger forekom med omtrent samme hyppighed hos mænd og kvinder, ældre og yngre patienter og sorte og ikke-sorte patienter.
Telmisartan
Andre bivirkninger, der er blevet rapporteret med telmisartan, er anført nedenfor:
Autonome nervesystem: impotens, øget svedtendens, rødmen
Kroppen som helhed: allergi, feber, bensmerter, brystsmerter
Kardiovaskulær: hjertebanken, angina pectoris, unormalt EKG, hypertension, perifert ødem
Centralnervesystemet: søvnløshed, somnolens, migræne, paræstesi, ufrivillige muskelsammentrækninger, hypoæstesi
Gastrointestinale: flatulens, forstoppelse, gastritis, mundtørhed, hæmorider, gastroøsofageal refluks, tandpine
Hepato-galdevej: forhøjelser af leverenzymer eller serumbilirubin
Metabolisk: gigt, hyperkolesterolæmi, diabetes mellitus
Muskuloskeletale: gigt, artralgi, benkramper, myalgi
Psykiatrisk: angst, depression, nervøsitet
Modstandsmekanisme: infektion, byld, mellemørebetændelse
Åndedræt: astma, rhinitis, dyspnø, epistaxis
Hud: dermatitis, eksem, kløe
Urin: vandladningsfrekvens, blærebetændelse
Vaskulær: cerebrovaskulær lidelse
Særlige sanser: unormalt syn, conjunctivitis, tinnitus, ørepine
Hydrochlorthiazid
Andre bivirkninger, der er blevet rapporteret med hydrochlorthiazid, er anført nedenfor:
Kroppen som helhed: svaghed
Fordøjelse: pancreatitis, gulsot (intrahepatisk kolestatisk gulsot), sialadenitis, kramper, maveirritation
Hæmatologisk: aplastisk anæmi, agranulocytose, leukopeni, hæmolytisk anæmi, trombocytopeni
Overfølsomhed: purpura, lysfølsomhed, nældefeber, nekrotiserende angiitis (vaskulitis og kutan vaskulitis), feber, åndedrætsbesvær, herunder pneumonitis og lungeødem, anafylaktiske reaktioner
Metabolisk: hyperglykæmi, glykosuri
Muskuloskeletale: muskelspasme
Nervesystem/psykiatrisk: rastløshed
Nyre: interstitiel nefritis
Hud: erythema multiforme inklusive Stevens-Johnsons syndrom, eksfoliativ dermatitis inklusive toksisk epidermal nekrolyse
Særlige sanser: forbigående sløret syn, xantopsi
Kliniske laboratoriefund
Kreatinin, Blood Urea Nitrogen (BUN)
Forøgelser i BUN (≥11,2 mg/dL) og serumkreatinin (≥0,5 mg/dL) blev observeret hos henholdsvis 2,8 % og 1,4 % af patienter med essentiel hypertension behandlet med MICARDIS 80 mg HCT-tabletter i kontrollerede forsøg. Ingen patient afbrød behandlingen med MICARDIS 80 mg HCT-tabletter på grund af en stigning i BUN eller kreatinin [se ADVARSLER OG FORHOLDSREGLER ].
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af MICARDIS HCT efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at estimere deres hyppighed pålideligt eller etablere en årsagssammenhæng til lægemiddeleksponering.
Blod og lymfesystem lidelser: eosinofili
Hjertelidelser: atrieflimren, kongestiv hjertesvigt, myokardieinfarkt, takykardi, bradykardi
Øre- og labyrintlidelser: svimmelhed
Generelle lidelser og administrationsbetingelser: asteni, ødem
Hepato-galdevej: Unormal leverfunktion/leversygdom
Forstyrrelser i immunsystemet: anafylaktisk reaktion
Infektioner og angreb: urinvejsinfektion
Undersøgelser: øget CPK
Metabolisme og ernæringsforstyrrelser: hypoglykæmi (hos diabetespatienter)
Muskuloskeletale og bindevævslidelser: senesmerter (herunder senebetændelse, senehindebetændelse), rabdomyolyse
Forstyrrelser i nervesystemet: synkope, hovedpine
Nyre- og urinvejslidelser: nyresvigt, nedsat nyrefunktion inklusive akut nyresvigt
Reproduktionssystem og brystsygdomme: erektil dysfunktion
Åndedræts-, thorax- og mediastinale lidelser: hoste
Hud- og subkutane vævsforstyrrelser: lægemiddeludbrud (toksisk hududbrud oftest rapporteret som toksikoderma, udslæt og nældefeber), angioødem (med dødelig udgang)
Vaskulær lidelse: ortostatisk hypotension
DRUGSINTERAKTIONER
Midler, der øger serumkalium
Samtidig administration af telmisartan og andre lægemidler, der øger serumkaliumniveauet, kan resultere i hyperkaliæmi. Overvåg serumkalium hos sådanne patienter.
Lithium
Der er rapporteret stigninger i serumlithiumkoncentrationer og lithiumtoksicitet ved samtidig brug af thiaziddiuretika eller angiotensin II-receptorantagonister, inklusive telmisartan. Overvåg lithiumniveauer hos patienter, der får MICARDIS 80mg HCT og lithium.
Ikke-steroide antiinflammatoriske midler, herunder selektive cyclooxygenas E-2-hæmmere
Telmisartan
Ikke-steroide antiinflammatoriske midler, herunder selektive cyclooxygenase-2-hæmmere (COX-2-hæmmere): Hos ældre, volumen-depleterede (inklusive dem, der er i behandling med diuretika), eller med kompromitteret nyrefunktion, samtidig administration af NSAID'er, inkl. selektive COX-2-hæmmere med ARB'er, inklusive telmisartan, kan resultere i forringelse af nyrefunktionen, inklusive mulig akut nyresvigt. Disse virkninger er normalt reversible. Den antihypertensive virkning af ARB'er kan svækkes af NSAID'er. Overvåg derfor nyrefunktion og blodtryk periodisk hos patienter, der får MICARDIS 40 mg HCT og NSAID'er.
Hydrochlorthiazid
Administration af et ikke-steroidt antiinflammatorisk middel, herunder en selektiv COX2-hæmmer, kan reducere diuretikas diuretiske, natriuretiske og antihypertensive virkninger. Når MICARDIS HCT og ikke-steroide antiinflammatoriske midler, herunder selektive COX2-hæmmere anvendes samtidig, skal du derfor observere nøje for at bestemme, om den ønskede effekt af diuretikaet opnås.
Dobbelt blokade af Renin-Angiotens In-Aldosteron-systemet og ændringer i nyrefunktionen
Dobbelt blokade af renin-angiotensin-aldosteron-systemet (RAS) med angiotensinblokkere, ACE-hæmmere eller aliskiren er forbundet med øget risiko for hypotension, hyperkaliæmi og nedsat nyrefunktion. ONTARGET-studiet inkluderede 25.620 patienter ≥55 år gamle med aterosklerotisk sygdom eller diabetes med end-organ skader, randomiserede dem til kun telmisartan (ARB), ramipril (ACE-hæmmer) eller kombinationen, og fulgte dem i en median på 56 måneder . Patienter, der fik kombinationen af ARB og ACE-hæmmer, opnåede ingen yderligere fordele (ingen yderligere reduktion af risikoen for kardiovaskulær død, myokardieinfarkt, slagtilfælde eller indlæggelse på grund af hjertesvigt) sammenlignet med ARB-monoterapi eller ACE-hæmmer monoterapi, men oplevede en øget forekomst af nyreinsufficiens (f.eks. akut nyresvigt) sammenlignet med monoterapigrupper.
Undgå generelt kombineret brug af RAS-hæmmere. Overvåg nøje blodtryk, nyrefunktion og elektrolytter hos patienter på MICARDIS 40mg HCT og andre midler, der påvirker RAS.
Giv ikke aliskiren samtidig med MICARDIS HCT til patienter med diabetes. Undgå samtidig brug af aliskiren og MICARDIS HCT hos patienter med nedsat nyrefunktion (GFR
Digoxin
Når telmisartan blev administreret sammen med digoxin, blev der observeret mediane stigninger i digoxin peak plasmakoncentration (49 %) og dalkoncentration (20 %). Overvåg digoxinniveauer hos patienter, der samtidig tager MICARDIS 40mg HCT og digoxin.
Antidiabetiske lægemidler (orale midler og insulin)
Dosisjustering af antidiabetika kan være nødvendig, når det administreres sammen med hydrochlorthiazid.
Kolestyramin og Colestipol-harpikser
Absorptionen af hydrochlorthiazid er nedsat ved tilstedeværelse af anionbytterharpikser. Fordel doseringen af hydrochlorthiazid og harpiksen, således at hydrochlorthiazid administreres mindst 4 timer før eller 4 til 6 timer efter administration af harpiksen.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Føtal toksicitet
Telmisartan
Brug af lægemidler, der virker på renin-angiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død. Resulterende oligohydramnios kan være forbundet med føtal lungehypoplasi og skeletdeformationer. Potentielle neonatale bivirkninger omfatter kraniehypoplasi, anuri, hypotension, nyresvigt og død. Når graviditet opdages, seponeres MICARDIS HCT så hurtigt som muligt.
Hydrochlorthiazid
Thiazider krydser placentabarrieren og optræder i navlestrengsblod. Bivirkninger omfatter føtal eller neonatal gulsot og trombocytopeni [se Brug i specifikke populationer ].
Hypotension hos patienter med volumen-eller saltdepletering
Hos patienter med et aktiveret renin-angiotensin-system, såsom volumen- eller saltdepleterede patienter (f.eks. dem, der behandles med høje doser diuretika), kan symptomatisk hypotension forekomme efter initialisering af behandling med MICARDIS HCT. Korrekt volumen eller saltmangel før administration af MICARDIS 80 mg HCT.
Nedsat nyrefunktion
Ændringer i nyrefunktionen, herunder akut nyresvigt, kan være forårsaget af lægemidler, der hæmmer reninangiotensinsystemet, og af diuretika. Patienter, hvis nyrefunktion til dels kan afhænge af aktiviteten af renin-angiotensin-systemet (f.eks. patienter med nyrearteriestenose, kronisk nyresygdom, alvorlig kongestiv hjertesvigt eller volumendepletion) kan have særlig risiko for at udvikle oliguri, progressiv azotæmi , eller akut nyresvigt på MICARDIS HCT. Overvåg nyrefunktionen periodisk hos disse patienter. Overvej at tilbageholde eller afbryde behandlingen hos patienter, som udvikler et klinisk signifikant fald i nyrefunktionen på MICARDIS HCT.
Elektrolytter og stofskifteforstyrrelser
Lægemidler, herunder telmisartan, der hæmmer renin-angiotensin-systemet kan forårsage hyperkaliæmi, især hos patienter med nyreinsufficiens, diabetes eller kombinationsbrug med andre angiotensinreceptorblokkere eller ACE-hæmmere og samtidig brug af andre lægemidler, der hæver serumkaliumniveauet [se DRUGSINTERAKTIONER ].
Hydrochlorthiazid kan forårsage hypokaliæmi og hyponatriæmi. Thiazider har vist sig at øge urinudskillelsen af magnesium; dette kan resultere i hypomagnesæmi. Hypomagnesæmi kan resultere i hypokaliæmi, som kan være svær at behandle på trods af kaliumgenopfyldning. Overvåg serumelektrolytter med jævne mellemrum.
I kontrollerede forsøg med telmisartan/hydrochlorthiazid-kombinationsbehandlingen oplevede ingen patienter, der fik 40 mg/12,5 mg, 80 mg/12,5 mg eller 80 mg/25 mg, et fald i kalium ≥1,4 mEq/L, og ingen patienter oplevede hyperkaliæmi.
Hydrochlorthiazid nedsætter calciumudskillelsen i urinen og kan forårsage forhøjede serumcalcium.
Hydrochlorthiazid kan ændre glukosetolerancen og øge serumniveauet af kolesterol og triglycerider.
Hyperurikæmi kan forekomme, eller der kan udløses gigt hos visse patienter, der får thiazidbehandling. Fordi telmisartan reducerer urinsyre, dæmper telmisartan i kombination med hydrochlorthiazid den diuretika-inducerede hyperukæmi.
Overfølsomhedsreaktion
Hydrochlorthiazid
Overfølsomhedsreaktioner over for hydrochlorthiazid kan forekomme hos patienter med eller uden en anamnese med allergi eller bronkial astma, men er mere sandsynlige hos patienter med en sådan anamnese [se KONTRAINDIKATIONER ].
Akut nærsynethed og sekundær vinkel-lukkende glaukom
Hydrochlorthiazid, et sulfonamid, kan forårsage en idiosynkratisk reaktion, hvilket resulterer i akut forbigående nærsynethed og akut vinkel-lukkende glaukom. Symptomer omfatter akut indtræden af nedsat synsstyrke eller øjensmerter og opstår typisk inden for timer til uger efter lægemiddelinitiering. Ubehandlet akut vinkel-lukkende glaukom kan føre til permanent synstab. Den primære behandling er at seponere hydrochlorthiazid så hurtigt som muligt. Hurtige medicinske eller kirurgiske behandlinger skal muligvis overvejes, hvis det intraokulære tryk forbliver ukontrolleret. Risikofaktorer for udvikling af akut vinkellukket glaukom kan omfatte en historie med sulfonamid- eller penicillinallergi.
Systemisk Lupus erythematosus
Thiaziddiuretika er blevet rapporteret at forårsage eksacerbation eller aktivering af systemisk lupus erythematosus.
Postsympatektomipatienter
Den antihypertensive virkning af hydrochlorthiazid kan forstærkes hos postsympatiktomipatienter.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER ).
Graviditet
Rådgiv kvindelige patienter i den fødedygtige alder om konsekvenserne af eksponering for MICARDIS 40mg HCT under graviditet. Diskuter behandlingsmuligheder med kvinder, der planlægger at blive gravide. Fortæl patienterne om at rapportere graviditeter til deres læger så hurtigt som muligt [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Amning
Råd ammende kvinder om ikke at amme under behandling med MICARDIS HCT [se Brug i specifikke populationer ].
Symptomatisk hypotension og synkope
Rådgiv patienterne om, at svimmelhed kan opstå, især i løbet af de første dage af behandlingen, og at rapportere det til deres læge. Informér patienterne om, at utilstrækkelig væskeindtagelse, overdreven sved, diarré eller opkastning kan føre til et for stort blodtryksfald med de samme konsekvenser af svimmelhed og mulig synkope. Rådgive patienter om at kontakte deres læge, hvis der opstår synkope [se ADVARSLER OG FORHOLDSREGLER ].
Kaliumtilskud
Advis patienter til ikke at bruge kaliumtilskud eller salterstatninger, der indeholder kalium uden at konsultere den ordinerende læge [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ].
Akut nærsynethed og sekundær vinkel-lukkende glaukom
Rådgiv patienterne om at seponere MICARDIS 80mg HCT og søge øjeblikkelig lægehjælp, hvis de oplever symptomer på akut nærsynethed eller sekundær vinkellukket glaukom [se ADVARSLER OG FORHOLDSREGLER ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Telmisartan og hydrochlorthiazid
Der er ikke udført carcinogenicitet, mutagenicitet eller fertilitetsundersøgelser med kombinationen af telmisartan og hydrochlorthiazid.
Telmisartan
Der var ingen tegn på karcinogenicitet, når telmisartan blev administreret i kosten til mus og rotter i op til 2 år. De højeste doser administreret til mus (1000 mg/kg/dag) og rotter (100 mg/kg/dag) er, på mg/m2-basis, henholdsvis ca. 59 og 13 gange den maksimale anbefalede humane dosis (MRHD) af telmisartan. Disse samme doser har vist sig at give gennemsnitlig systemisk eksponering for telmisartan >100 gange og >25 gange, henholdsvis den systemiske eksponering hos mennesker, der modtager MRHD af telmisartan (80 mg/dag).
Genotoksicitetsassays afslørede ingen telmisartan-relaterede virkninger på hverken gen- eller kromosomniveau. Disse assays omfattede bakteriel mutagenicitetstest med Salmonella og E. coli (Ames), en genmutationstest med V79-celler fra kinesisk hamster, en cytogenetisk test med humane lymfocytter og en mikronukleustest hos mus.
Der blev ikke observeret nogen lægemiddelrelaterede virkninger på reproduktionsevnen hos han- og hunrotter ved 100 mg/kg/dag (den højeste administrerede dosis), ca. 13 gange, på mg/m2-basis, MRHD for telmisartan. Denne dosis hos rotter resulterede i en gennemsnitlig systemisk eksponering (telmisartan AUC som bestemt på dag 6 af graviditeten) mindst 50 gange den gennemsnitlige systemiske eksponering hos mennesker ved MRHD (80 mg/dag).
Hydrochlorthiazid
Toårige fodringsundersøgelser i mus og rotter udført i regi af National Toxicology Program (NTP) afslørede ingen tegn på et kræftfremkaldende potentiale af hydrochlorthiazid hos hunmus (ved doser på op til ca. 600 mg/kg/dag) eller hos hankøn. og hunrotter (ved doser på op til ca. 100 mg/kg/dag). NTP fandt imidlertid tvetydige beviser for hepatokarcinogenicitet hos hanmus.
Hydrochlorthiazid var ikke genotoksisk in vitro i Ames-mutagenicitetsanalysen af Salmonella typhimurium-stammer TA 98, TA 100, TA 1535, TA 1537 og TA 1538 og i den kinesiske hamsterovarie (CHO)-test for kromosomafvigelser ved brug af vibrationer, eller kimcellekromosomer fra mus, knoglemarvskromosomer fra kinesisk hamster og det kønsbundne recessive letale træk ved Drosophila. Positive testresultater blev opnået i in vitro CHO Sister Chromatid Exchange (klastogenicitet) assayet, i Muse Lymfom Celle (mutagenicitet) assayet og i Aspergillus nidulans non-disjunction assayet.
Hydrochlorthiazid havde ingen negative virkninger på fertiliteten hos mus og rotter af begge køn i undersøgelser, hvor disse arter via deres diæt blev eksponeret for doser på henholdsvis op til 100 og 4 mg/kg før parring og under hele graviditeten.
Brug i specifikke populationer
Graviditet
Risikooversigt
MICARDIS HCT kan forårsage fosterskader, når det administreres til en gravid kvinde. Brug af lægemidler, der virker på renin-angiotensin-systemet i andet og tredje trimester af graviditeten, reducerer føtal nyrefunktion og øger føtal og neonatal morbiditet og død (se Kliniske overvejelser ). De fleste epidemiologiske undersøgelser, der undersøgte føtale abnormiteter efter eksponering for antihypertensiv brug i første trimester, har ikke skelnet lægemidler, der påvirker renin-angiotensin-systemet, fra andre antihypertensiva. Undersøgelser på rotter og kaniner med telmisartan viste kun føtotoksicitet ved modertoksiske doser (se Data ). Når graviditet opdages, seponeres MICARDIS HCT så hurtigt som muligt.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske overvejelser
Sygdomsrelateret risiko for moder og/eller embryo/føtal
Hypertension under graviditet øger moderens risiko for præeklampsi, svangerskabsdiabetes, for tidlig fødsel og fødselskomplikationer (f.eks. behov for kejsersnit og blødning efter fødslen). Hypertension øger fosterets risiko for intrauterin vækstbegrænsning og intrauterin død. Gravide kvinder med hypertension bør overvåges omhyggeligt og behandles i overensstemmelse hermed.
Fetale/neonatale bivirkninger
Telmisartan
Brug af lægemidler, der virker på RAS i graviditetens andet og tredje trimester kan resultere i følgende: oligohydramnios, nedsat føtal nyrefunktion, der fører til anuri og nyresvigt, føtal lungehypoplasi, skeletdeformationer, herunder kraniehypoplasi, hypotension og død . I det usædvanlige tilfælde, hvor der ikke er noget passende alternativ til behandling med lægemidler, der påvirker renin-angiotensin-systemet for en bestemt patient, skal du informere moderen om den potentielle risiko for fosteret.
Hos patienter, der tager MICARDIS HCT under graviditet, udføres serielle ultralydsundersøgelser for at vurdere det intra-amniotiske miljø. Fostertest kan være passende, baseret på graviditetsugen. Hvis oligohydramnios observeres, seponeres MICARDIS HCT, medmindre det anses for at være livreddende for moderen. Patienter og læger skal dog være opmærksomme på, at oligohydramnios muligvis ikke vises, før fosteret har pådraget sig irreversibel skade.
Overvåg nøje spædbørn med historier om in utero eksponering for MICARDIS 20mg HCT for hypotension, oliguri og hyperkaliæmi. Hvis der opstår oliguri eller hypotension, støtte blodtryk og nyreperfusion. Udskiftningstransfusioner eller dialyse kan være påkrævet som et middel til at vende hypotension og erstatte nyrefunktionen [se Brug i specifikke populationer ].
Hydrochlorthiazid
Thiazider krydser placenta, og brug af thiazider under graviditet er forbundet med en risiko for føtal eller neonatal gulsot, trombocytopeni og mulige andre bivirkninger, der er opstået hos voksne.
Data
Dyredata
MICARDIS 40mg HCT
En udviklingstoksicitetsundersøgelse blev udført på rotter med telmisartan/hydrochlorthiazid-doser på 3,2/1,0, 15/4,7, 50/15,6 og 0/15,6 mg/kg/dag. Selvom de to højere dosiskombinationer så ud til at være mere toksiske (betydeligt fald i kropsvægtøgning) for moderdyrene end begge lægemidler alene, så der ikke ud til at være en stigning i toksicitet for de udviklende embryoner.
Telmisartan
Der blev ikke observeret teratogene virkninger, når telmisartan blev administreret til drægtige rotter i orale doser på op til 50 mg/kg/dag og til gravide kaniner i orale doser på op til 45 mg/kg/dag. Hos kaniner blev embryodødelighed forbundet med maternel toksicitet (reduceret kropsvægtøgning og fødeindtagelse) observeret ved 45 mg/kg/dag (ca. 12 gange den maksimalt anbefalede humane dosis [MRHD] på 80 mg på mg/m2 basis). Hos rotter blev der observeret, at maternelt toksiske (reduceret vægtøgning og fødeindtagelse) telmisartan-doser på 15 mg/kg/dag (ca. 1,9 gange MRHD på mg/m2-basis), indgivet under sen drægtighed og diegivning, gav bivirkninger. hos nyfødte, herunder nedsat levedygtighed, lav fødselsvægt, forsinket modning og nedsat vægtøgning. De ikke-observerede effektdoser for udviklingstoksicitet hos rotter og kaniner, henholdsvis 5 og 15 mg/kg/dag, er henholdsvis ca. 0,64 og 3,7 gange, på mg/m2-basis, MRHD for telmisartan (80 mg/dag) ).
Hydrochlorthiazid
Undersøgelser, hvor hydrochlorthiazid blev administreret til gravide mus og rotter i deres respektive perioder med større organogenese i doser op til henholdsvis 3000 og 1000 mg/kg/dag (ca. 600 og 400 gange MRHD), gav ingen tegn på skade på fosteret .
Thiazider kan krydse placenta, og koncentrationer, der nås i navlestrengen, nærmer sig dem i moderens plasma. Hydrochlorthiazid kan ligesom andre diuretika forårsage placenta hypoperfusion. Det akkumuleres i fostervandet med rapporterede koncentrationer op til 19 gange større end i navlestrengsveneplasma. Brug af thiazider under graviditet er forbundet med en risiko for føtal eller neonatal gulsot eller trombocytopeni. Da de ikke forhindrer eller ændrer forløbet af EPH (Ødem, Proteinuri, Hypertension) gestose (præeklampsi), bør disse lægemidler ikke bruges til at behandle hypertension hos gravide kvinder. Brug af hydrochlorthiazid til andre indikationer (f.eks. hjertesygdom) under graviditet bør undgås.
Amning
Risikooversigt
Der er ingen information om tilstedeværelsen af MICARDIS 20mg HCT eller telmisartan i modermælk, virkningerne på det ammede spædbarn eller virkningerne på mælkeproduktionen. Begrænsede publicerede undersøgelser rapporterer, at hydrochlorthiazid er til stede i modermælk. Der er imidlertid ikke tilstrækkelig information til at bestemme virkningerne af hydrochlorthiazid på det ammede spædbarn eller virkningerne af hydrochlorthiazid på mælkeproduktionen. Telmisartan findes i mælken fra diegivende rotter. (se Data ). På grund af risikoen for alvorlige bivirkninger hos det ammede spædbarn, herunder hypotension, hyperkaliæmi og nedsat nyrefunktion, rådes en ammende kvinde til ikke at amme under behandling med MICARDIS HCT.
Data
Telmisartan var til stede i mælken fra diegivende rotter i koncentrationer på 1,5 til 2 gange dem, der blev fundet i plasma fra 4 til 8 timer efter administration.
Pædiatrisk brug
Sikkerhed og effektivitet af MICARDIS HCT hos pædiatriske patienter er ikke blevet fastlagt.
Nyfødte med en historie med in utero eksponering for MICARDIS HCT
Hvis der opstår oliguri eller hypotension, støtte blodtryk og nyreperfusion. Udskiftningstransfusioner eller dialyse kan være påkrævet for at vende hypotension og/eller erstatte forstyrret nyrefunktion.
Geriatrisk brug
de kontrollerede kliniske forsøg (n=1017) var ca. 20 % af patienterne behandlet med telmisartan/hydrochlorthiazid 65 år eller ældre, og 5 % var 75 år eller ældre. Der blev ikke observeret nogen overordnede forskelle i effektivitet og sikkerhed af telmisartan/hydrochlorthiazid hos disse patienter sammenlignet med yngre patienter. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre personer kan ikke udelukkes. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidige sygdomme eller anden lægemiddelbehandling.
Anvendelse hos patienter med nedsat leverfunktion
Patienter med galdevejsobstruktive lidelser eller leverinsufficiens bør påbegynde behandling under tæt medicinsk overvågning med 40 mg/12,5 mg kombinationen.
Telmisartan
Da størstedelen af telmisartan elimineres ved galdeudskillelse, kan patienter med galdeobstruktive lidelser eller leverinsufficiens forventes at have reduceret clearance og højere blodniveauer.
Hydrochlorthiazid
Mindre ændringer i væske- og elektrolytbalancen kan fremkalde hepatisk koma hos patienter med nedsat leverfunktion eller progressiv leversygdom.
Anvendelse hos patienter med nedsat nyrefunktion
Sikkerhed og effektivitet af MICARDIS 40mg HCT hos patienter med svært nedsat nyrefunktion (CrCl ≤30 ml/min) er ikke blevet fastlagt. Hos patienter med svært nedsat nyrefunktion anbefales MICARDIS 80 mg HCT-tabletter ikke. Dosisjustering er ikke nødvendig hos patienter med let (CrCl 60 til 90 ml/min) eller moderat (CrCl 30 til 60 ml/min) nyreinsufficiens.
OVERDOSIS
Telmisartan
Begrænsede data er tilgængelige med hensyn til overdosering af telmisartan hos mennesker. De mest sandsynlige manifestationer af overdosering med telmisartan er hypotension, svimmelhed og takykardi; bradykardi kan opstå fra parasympatisk (vagal) stimulation. Hvis symptomatisk hypotension skulle opstå, bør understøttende behandling iværksættes. Telmisartan fjernes ikke ved hæmodialyse.
Hydrochlorthiazid
De mest almindelige tegn og symptomer observeret hos patienter med en overdosis af hydrochlorthiazid er dem, der er forårsaget af elektrolytmangel (hypokaliæmi, hypochloræmi, hyponatriæmi) og dehydrering som følge af overdreven diurese. Hvis digitalis også er blevet administreret, kan hypokaliæmi accentuere hjertearytmier. I hvilken grad hydrochlorthiazid fjernes ved hæmodialyse er ikke fastlagt. Den orale LD af hydrochlorthiazid er større end 10 g/kg hos både mus og rotter.
KONTRAINDIKATIONER
MICARDIS HCT er kontraindiceret:
- Hos patienter, der er overfølsomme over for en hvilken som helst komponent i dette produkt [se ADVARSLER OG FORHOLDSREGLER ].
- Hos patienter med anuri.
- Til samtidig administration med aliskiren til patienter med diabetes [se DRUGSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
MICARDIS 40mg HCT
MICARDIS 20mg HCT er en kombination af to lægemidler med antihypertensive egenskaber: et thiaziddiuretikum, hydrochlorthiazid og en angiotensin II-receptorblokker (ARB), telmisartan.
Telmisartan
Angiotensin II dannes ud fra angiotensin I i en reaktion katalyseret af angiotensin-konverterende enzym (ACE, kininase II). Angiotensin II er det primære pressormiddel i renin-angiotensin-systemet, med virkninger, der omfatter vasokonstriktion, stimulering af syntese og frigivelse af aldosteron, hjertestimulering og renal reabsorption af natrium. Telmisartan blokerer de vasokonstriktor- og aldosteronudskillende virkninger af angiotensin II ved selektivt at blokere bindingen af angiotensin II til AT1-receptoren i mange væv, såsom vaskulær glat muskulatur og binyrerne. Dets virkning er derfor uafhængig af veje til angiotensin II-syntese.
Der findes også en AT2-receptor i mange væv, men AT2 vides ikke at være forbundet med kardiovaskulær homeostase. Telmisartan har meget større affinitet (>3.000 gange) for AT1-receptoren end til AT2-receptoren.
Telmisartan hæmmer ikke ACE (kininase II) og binder heller ikke til eller blokerer andre hormonreceptorer eller ionkanaler, der vides at være vigtige i kardiovaskulær regulering.
Blokering af angiotensin II-receptoren hæmmer den negative regulatoriske feedback af angiotensin II på reninsekretion, men den resulterende øgede plasmareninaktivitet og angiotensin II-cirkulerende niveauer overvinder ikke virkningen af telmisartan på blodtrykket.
Hydrochlorthiazid
Hydrochlorthiazid er et thiaziddiuretikum. Thiazider påvirker de renale tubulære mekanismer for elektrolytreabsorption, hvilket direkte øger udskillelsen af natriumsalt og klorid i omtrent tilsvarende mængder. Indirekte reducerer hydrochlorthiazids diuretiske virkning plasmavolumen med deraf følgende stigninger i plasmareninaktivitet, stigninger i aldosteronsekretion, stigninger i urinkaliumtab og fald i serumkalium. Renin-aldosteron-forbindelsen medieres af angiotensin II, så samtidig administration af en ARB har en tendens til at vende kaliumtabet forbundet med disse diuretika. Mekanismen for den antihypertensive virkning af thiazider er ikke fuldt ud forstået.
Farmakodynamik
Telmisartan
Hos normale frivillige hæmmede en dosis telmisartan 80 mg pressorresponset på en intravenøs infusion af angiotensin II med ca. 90 % ved maksimale plasmakoncentrationer med ca. 40 % hæmning ved i 24 timer.
Plasmakoncentrationen af angiotensin II og plasmareninaktivitet steg på en dosisafhængig måde efter enkelt administration af telmisartan til raske forsøgspersoner og gentagen administration til hypertensive patienter. En gang daglig administration af op til 80 mg telmisartan til raske forsøgspersoner påvirkede ikke plasmaaldosteronkoncentrationerne. I undersøgelser med flere doser med hypertensive patienter var der ingen klinisk signifikante ændringer i elektrolytter (serumkalium eller natrium) eller i metabolisk funktion (inklusive serumniveauer af kolesterol, triglycerider, HDL, LDL, glucose eller urinsyre).
De antihypertensive virkninger af telmisartan er blevet undersøgt i seks placebokontrollerede kliniske undersøgelser, herunder i alt 1773 patienter med mild til moderat hypertension (diastolisk blodtryk på 95 til 114 mmHg), hvoraf 1031 blev behandlet med telmisartan. Efter administration af telmisartan én gang dagligt var størrelsen af blodtryksreduktionen fra baseline efter placebo-subtraktion ca. (SBP/DBP) 6-8/6 mmHg for 20 mg, 9-13/6-8 mmHg for 40 mg og 12 -13/7-8 mmHg for 80 mg. Større doser (op til 160 mg) så ikke ud til at forårsage et yderligere fald i blodtrykket.
Begyndelsen af antihypertensiv aktivitet indtræder inden for 3 timer med en maksimal reduktion på ca. 4 uger. Ved doser på 20, 40 og 80 mg blev den antihypertensive effekt ved administration af telmisartan én gang dagligt opretholdt i det fulde 24-timers dosisinterval.
Hos 30 hypertensive patienter med normal nyrefunktion behandlet i 8 uger med telmisartan 80 mg eller telmisartan 80 mg i kombination med hydrochlorthiazid 12,5 mg, var der ingen klinisk signifikante ændringer fra baseline i renal blodgennemstrømning, glomerulær filtrationshastighed, filtrationsfraktion, renovaskulær modstand, eller kreatininclearance.
Hydrochlorthiazid
Efter oral administration af hydrochlorthiazid begynder diurese inden for 2 timer, topper efter ca. 4 timer og varer ca. 6 til 12 timer.
Lægemiddelinteraktioner
Hydrochlorthiazid
Alkohol, barbiturater eller narkotika
Potentiering af ortostatisk hypotension kan forekomme.
Skeletmuskelafslappende midler
Mulig øget reaktionsevne over for muskelafslappende midler såsom curare-derivater.
Kortikosteroider, ACTH
Forstærket elektrolytudtømning, især hypokaliæmi.
Pressoraminer (f.eks. noradrenalin)
Mulig nedsat respons på pressoraminer, men ikke tilstrækkelig til at udelukke deres anvendelse.
Farmakokinetik
Telmisartan
Absorption:
Efter oral administration nås maksimale koncentrationer (Cmax ) af telmisartan 0,5 til 1 time efter dosering. Mad reducerer biotilgængeligheden af telmisartan en smule med en reduktion i arealet under plasmakoncentration-tid-kurven (AUC) på ca. 6 % med 40 mg og ca. 20 % efter en dosis på 160 mg. MICARDIS 20mg HCT kan indgives med eller uden mad. Telmisartans absolutte biotilgængelighed er dosisafhængig. Ved 40 og 160 mg var biotilgængeligheden henholdsvis 42 % og 58 %. Telmisartans farmakokinetik med oralt administreret MICARDIS 20 mg er ikke-lineær over dosisområdet 20 til 160 mg, med større end proportionale stigninger af plasmakoncentrationer (Cmax og AUC) med stigende doser. Telmisartan viser bi-eksponentiel henfaldskinetik med en terminal eliminationshalveringstid på ca. 24 timer. De laveste plasmakoncentrationer af telmisartan ved dosering én gang dagligt er ca. 10 % til 25 % af maksimale plasmakoncentrationer. Telmisartan har et akkumuleringsindeks i plasma på 1,5 til 2,0 ved gentagen dosering én gang dagligt.
Fordeling:
Telmisartan er stærkt bundet til plasmaproteiner (>99,5%), hovedsageligt albumin og α1-syreglycoprotein. Plasmaproteinbinding er konstant over det koncentrationsområde, der opnås med anbefalede doser. Fordelingsvolumen for telmisartan er ca. 500 liter, hvilket indikerer yderligere vævsbinding.
Metabolisme:
Telmisartan metaboliseres ved konjugering til dannelse af et farmakologisk inaktivt acylglucuronid; glucuronid af moderforbindelsen er den eneste metabolit, der er blevet identificeret i humant plasma og urin. Efter en enkelt dosis repræsenterer glucuronid ca. 11 % af den målte radioaktivitet i plasma. Cytokrom P450 isoenzymer er ikke involveret i metabolismen af telmisartan.
Elimination:
Efter enten intravenøs eller oral administration af 14C-mærket telmisartan blev det meste af den administrerede dosis (>97%) elimineret uændret i fæces via galdeudskillelse; der blev kun fundet små mængder i urinen (henholdsvis 0,91 % og 0,49 % af den samlede radioaktivitet).
Total plasmaclearance af telmisartan er >800 ml/min. Terminal halveringstid og total clearance synes at være uafhængig af dosis.
Hydrochlorthiazid
Hydrochlorthiazid metaboliseres ikke, men elimineres hurtigt via nyrerne. Når plasmaniveauer er blevet fulgt i mindst 24 timer, er plasmahalveringstiden blevet observeret at variere mellem 5,6 og 14,8 timer. Mindst 61 % af den orale dosis elimineres uændret inden for 24 timer.
Hydrochlorthiazid krydser placenta, men ikke blod-hjerne-barrieren og udskilles i modermælken.
Specifikke populationer
Telmisartan
Nyreinsufficiens
Telmisartan fjernes ikke fra blodet ved hæmofiltrering [se ADVARSLER OG FORHOLDSREGLER , og Brug i specifikke populationer ].
Leverinsufficiens
Hos patienter med leverinsufficiens er plasmakoncentrationerne af telmisartan øget, og den absolutte biotilgængelighed nærmer sig 100 % [se Brug i specifikke populationer ].
Køn
Plasmakoncentrationer af telmisartan er generelt 2 til 3 gange højere hos kvinder end hos mænd. I kliniske forsøg blev der dog ikke fundet nogen signifikant stigning i blodtryksrespons eller i forekomsten af ortostatisk hypotension hos kvinder. Ingen dosisjustering er nødvendig.
Geriatriske patienter
Telmisartans farmakokinetik adskiller sig ikke mellem ældre og personer under 65 år.
Lægemiddelinteraktionsstudier
Telmisartan
Ramipril
Samtidig administration af telmisartan 80 mg én gang dagligt og ramipril 10 mg én gang dagligt til raske forsøgspersoner øger steady-state Cmax og AUC for ramipril henholdsvis 2,3 og 2,1 gange og Cmax og AUC for ramiprilat henholdsvis 2,4 og 1,5 gange. . I modsætning hertil falder Cmax og AUC for telmisartan med henholdsvis 31 % og 16 %. Ved samtidig administration af telmisartan og ramipril kan responsen være større på grund af de mulige additive farmakodynamiske virkninger af de kombinerede lægemidler, og også på grund af den øgede eksponering for ramipril og ramiprilat i nærværelse af telmisartan.
Andre stoffer
Samtidig administration af telmisartan resulterede ikke i en klinisk signifikant interaktion med acetaminophen, amlodipin, glyburid, simvastatin, hydrochlorthiazid, warfarin eller ibuprofen. Telmisartan metaboliseres ikke af cytokrom P450-systemet og havde ingen virkning in vitro på cytokrom P450-enzymer, bortset fra en vis hæmning af CYP2C19. Telmisartan forventes ikke at interagere med lægemidler, der hæmmer cytokrom P450-enzymer; det forventes heller ikke at interagere med lægemidler, der metaboliseres af cytochrom P450-enzymer, bortset fra mulig hæmning af metabolismen af lægemidler, der metaboliseres af CYP2C19.
Kliniske Studier
Telmisartan og hydrochlorthiazid
kontrollerede kliniske forsøg med mere end 2500 hypertensive patienter blev 1017 patienter eksponeret for telmisartan (20 mg til 160 mg) og samtidig hydrochlorthiazid (6,25 mg til 25 mg). Disse undersøgelser omfattede et faktorielt forsøg (studie 1) med kombinationer af telmisartan (20 mg, 40 mg, 80 mg, 160 mg eller placebo) og hydrochlorthiazid (6,25 mg, 12,5 mg, 25 mg og placebo). Det faktorielle forsøg randomiserede 818 patienter, herunder 493 (60%) mænd; 596 (73 %) ikke-sorte og 222 (27 %) sorte; og 143 (18%) ≥65 år (medianalderen var 53 år). Det gennemsnitlige liggende blodtryk ved baseline for den samlede population var 154/101 mmHg.
Kombinationen af telmisartan og hydrochlorthiazid resulterede i additive placebo-justerede fald i systolisk og diastolisk blodtryk ved laveste 16-21/9-11 mmHg for doser mellem 40 mg/12,5 mg og 80 mg/25 mg sammenlignet med 9-13 /7-8 mmHg for telmisartan 40 mg til 80 mg monoterapi og 4/4 mmHg for hydrochlorthiazid 12,5 mg monoterapi. Den antihypertensive effekt var uafhængig af alder eller køn. Der var stort set ingen ændring i hjertefrekvensen hos patienter behandlet med kombinationen af telmisartan og hydrochlorthiazid i det placebokontrollerede forsøg.
Fire andre undersøgelser af hypertensive patienter af mindst seks måneders varighed tillod tilføjelse af hydrochlorthiazid til patienter, som enten ikke var tilstrækkeligt kontrolleret med den randomiserede telmisartan-monoterapidosis eller ikke havde opnået tilstrækkeligt blodtryksrespons efter at have afsluttet optitreringen af telmisartan. I aktivt kontrollerede undersøgelser reducerede tilføjelsen af 12,5 mg hydrochlorthiazid til titrerede doser af telmisartan hos patienter, som ikke opnåede eller vedligeholdt tilstrækkeligt respons med telmisartan monoterapi, det systoliske og diastoliske blodtryk yderligere.
PATIENTOPLYSNINGER
MICARDIS® HCT (my-CAR-dis HCT) (telmis artan og hydrochlorthiazid) Tabletter
Læs denne patientinformation, før du begynder at tage MICARDIS HCT-tabletter, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din læge om din medicinske tilstand eller din behandling.
Hvad er den vigtigste information, jeg bør vide om MICARDIS 20mg HCT-tabletter?
MICARDIS HCT kan forårsage skade eller død på et ufødt barn. Tal med din læge om andre måder at sænke dit blodtryk på, hvis du planlægger at blive gravid. Hvis du bliver gravid, mens du tager MICARDIS 20mg HCT, skal du straks fortælle det til din læge.
Hvad er MICARDIS HCT?
MICARDIS 40mg HCT er en receptpligtig medicin, der bruges til at behandle forhøjet blodtryk (hypertension).
MICARDIS 40mg HCT indeholder:
- telmisartan, en angiotensinreceptorblokker (ARB)
- hydrochlorthiazid, en vandpille eller vanddrivende middel
Din læge kan ordinere anden medicin, som du kan tage sammen med MICARDIS 80mg HCT for at behandle dit forhøjede blodtryk.
Det vides ikke, om MICARDIS 40mg HCT er sikkert og effektivt til børn.
Tag ikke MICARDIS 20 mg HCT tabletter, hvis du:
- har lav eller ingen urinproduktion
- er allergisk (overfølsom) over for de aktive ingredienser (telmisartan eller hydrochlorthiazid) eller et af de øvrige indholdsstoffer, der er anført i slutningen af denne indlægsseddel
Hvad skal jeg fortælle min læge, før jeg bruger MICARDIS 40mg HCT-tabletter?
Inden du tager MICARDIS 20mg HCT tabletter, skal du fortælle det til din læge, hvis du:
- er gravid eller planlægger at blive gravid. Se "Hvad er den vigtigste information, jeg bør vide om MICARDIS 20mg HCT-tabletter?"
- ammer eller planlægger at amme. MICARDIS 80mg HCT kan passere over i din modermælk og kan skade din baby. Du og din læge bør beslutte, om du vil tage MICARDIS HCT eller amme. Du bør ikke gøre begge dele. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager MICARDIS HCT-tabletter.
- har fået at vide, at du har unormale niveauer af kropssalt (elektrolytter) i dit blod
- har leverproblemer
- har astma eller tidligere astma
- har lupus
- har diabetes
- har nyreproblemer
- har andre medicinske tilstande
Fortæl din læge om al den medicin du tager, herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. Fortæl det også til din læge, hvis du drikker alkohol.
MICARDIS 20mg HCT kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke, hvordan MICARDIS 20mg HCT virker. Fortæl det især din læge, hvis du tager:
- aliskiren
- digoxin (Lanoxin®)
- lithium (Lithobid®, lithiumcarbonat, lithiumcitrat)
- anden medicin, der bruges til at behandle dit forhøjede blodtryk eller et hjerteproblem
- vandpiller (vanddrivende)
- aspirin eller andre ikke-steroide antiinflammatoriske lægemidler (NSAID'er)
- kaliumtilskud eller en salterstatning indeholdende kalium
- medicin, der bruges til at behandle diabetes, herunder insulin
- narkotiske smertestillende medicin
- sovepiller
- steroid medicin eller adrenokortikotrofisk hormon (ACTH)
- barbiturater
- visse kolesterolsænkende lægemidler (harpikser, der bruges til kolesterolreduktion, f.eks. kolestyramin og colestipolharpikser)
Spørg din læge, hvis du ikke er sikker på, om du tager en af de ovennævnte lægemidler.
Kend den medicin du tager. Hold en liste over dem, og vis den til din læge eller apotek, når du får en ny medicin.
Hvordan skal jeg tage MICARDIS HCT tabletter?
- Tag MICARDIS 40mg HCT tabletter nøjagtigt som din læge fortæller dig at tage det.
- Din læge vil fortælle dig, hvor meget MICARDIS HCT du skal tage, og hvornår du skal tage det.
- Du må ikke ændre din dosis, medmindre din læge fortæller dig det.
- Tag MICARDIS HCT én gang dagligt.
- Tag MICARDIS 20 mg HCT tabletter med eller uden mad.
- Hvis du tager for meget MICARDIS HCT, skal du kontakte din læge eller gå til den nærmeste skadestue med det samme.
- Læs "Sådan åbner du blisteren" sidst i denne indlægsseddel, før du bruger MICARDIS 20mg HCT. Tal med din læge, hvis du ikke forstår instruktionerne.
Hvad er de mulige bivirkninger af MICARDIS 80mg HCT-tabletter?
MICARDIS 20mg HCT tabletter kan forårsage alvorlige bivirkninger, herunder:
- Skade eller død på dit ufødte barn. Se "Hvad er den vigtigste information, jeg bør vide om MICARDIS HCT-tabletter?"
- Lavt blodtryk (hypotenser ion) er mest sandsynligt, hvis du også:
- tage vandpiller (diuretika)
- er på saltfattig diæt
- få dialysebehandlinger
- har hjerteproblemer
- blive syg med opkastning eller diarré
- ikke drikke nok væske
- sveder meget
- Nyreproblemer, som kan blive værre, hvis du allerede har en nyresygdom. Du kan have ændringer i dine nyretestresultater, og du kan have brug for en lavere dosis af MICARDIS 40mg HCT-tabletter. Ring til din læge, hvis du får:
- hævelse i dine fødder, ankler eller hænder
- uforklarlig vægtøgning
- Leverproblemer, som kan blive værre hos personer, der allerede har leverproblemer og tager MICARDIS 40mg HCT.
- Øjenproblemer. Et af lægemidlerne i MICARDIS HCT kan forårsage øjenproblemer, der kan føre til synstab. Symptomer på øjenproblemer kan opstå inden for timer til uger efter start af MICARDIS
HCT. Fortæl din læge med det samme, hvis du har:
- fald i synet
- øjensmerter
- Allergiske reaktioner. Fortæl din læge med det samme, hvis du får nogle af disse symptomer:
- hævelse af ansigt, tunge, hals
- åndedrætsbesvær
- Værre slutning af lupus. Fortæl din læge, hvis din lupus bliver værre eller bliver aktiv, mens du tager MICARDIS 20mg HCT.
- Ændring i kropssalte (elektrolyt) niveau i dit blod og væskeproblemer. Din læge kan tage prøver for at kontrollere dit blod. Ring til din læge med det samme, hvis du har:
- tør mund
- tørst
- træthed
- søvnighed
- rastløshed
- forvirring
- anfald
- hurtige hjerteslag
- svaghed
- muskelsmerter eller kramper
- meget lav urinproduktion
- kvalme eller opkastning
Hvis du føler dig besvimet eller svimmel, så læg dig ned og ring til din læge med det samme.
Ring til din læge med det samme, hvis du får nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af MICARDIS 80mg HCT-tabletter omfatter:
- øvre luftvejsinfektioner, herunder bihulesmerter/overbelastning og ondt i halsen
- svimmelhed
- træthedsfornemmelse
- influenzalignende symptomer
- rygsmerte
- diarré
- kvalme
Disse er ikke alle de mulige bivirkninger ved MICARDIS 20mg HCT-tabletter. Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder. Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare MICARDIS 80mg HCT-tabletter?
- Opbevar MICARDIS HCT-tabletter ved stuetemperatur 68°F til 77°F (20°C til 25°C).
- Fjern ikke MICARDIS 40mg HCT-tabletter fra blisterkort, før du tager dem.
Opbevar MICARDIS 80mg HCT-tabletter og al medicin utilgængeligt for børn.
Generel information om MICARDIS 40mg HCT tabletter:
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en patientinformationsfolder. Brug ikke MICARDIS HCT tabletter til en tilstand, som den ikke er ordineret til. Giv ikke MICARDIS 20mg HCT-tabletter til andre mennesker, heller ikke selvom de har samme lidelse, som du har. Det kan skade dem.
Denne indlægsseddel opsummerer de vigtigste oplysninger om MICARDIS HCT-tabletter. Hvis du vil have mere information, så tal med din læge. Du kan spørge din apoteker eller læge om information om MICARDIS 20mg HCT-tabletter, der er skrevet til sundhedspersonale.
For aktuelle ordinationsoplysninger skal du scanne koden nedenfor eller ringe til Boehringer Ingelheim Pharmaceuticals, Inc. på 1-800-542-6257 eller (TTY) 1-800-459-9906.
Hvad er indholdsstofferne i MICARDIS 20mg HCT tabletter?
Aktive ingredienser: telmisartan og hydrochlorthiazid
Inaktive ingredienser: natriumhydroxid, meglumin, povidon, sorbitol, magnesiumstearat, lactosemonohydrat, mikrokrystallinsk cellulose, majsstivelse og natriumstivelsesglycolat
40 mg/12,5 mg og 80 mg/12,5 mg tabletterne indeholder også: rød jernoxid.
80 mg/25 mg tabletterne indeholder også: jernoxidgul.
Hvad er forhøjet blodtryk (hypertension)?
Blodtrykket er kraften i dine blodkar, når dit hjerte slår, og når dit hjerte hviler. Du har forhøjet blodtryk, når kraften er for stor. Medicin, der sænker dit blodtryk, nedsætter din chance for at få et slagtilfælde eller hjerteanfald.
Forhøjet blodtryk får hjertet til at arbejde hårdere for at pumpe blod gennem kroppen og forårsager skader på blodkarrene. MICARDIS 80mg HCT-tabletter kan hjælpe dine blodkar med at slappe af, så dit blodtryk er lavere.
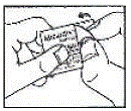
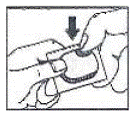
Sådan åbner du blisteren:
Denne patientinformation er blevet godkendt af US Food and Drug Administration.
