Cartia XT 180mg Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Cartia, og hvordan bruges det?
Cartia er en receptpligtig medicin, der bruges til at behandle symptomerne på brystsmerter (angina), højt blodtryk (hypertension), paroksysmal supraventrikulær takykardi og atrieflimren (flutter). Cartia kan bruges alene eller sammen med anden medicin.
Cartia tilhører en klasse af lægemidler kaldet Antidysrhythmics, IV; Calciumkanalblokkere; Calciumkanalblokkere, ikke-dihydropyridin.
Hvad er de mulige bivirkninger af Cartia?
Cartia kan forårsage alvorlige bivirkninger, herunder:
- brystsmerter,
- langsomme hjerteslag,
- bankende hjerteslag,
- flagrende i dit bryst,
- svimmelhed,
- hævelse,
- hurtig vægtøgning,
- stakåndet,
- feber,
- ondt i halsen,
- brændende øjne,
- hudsmerter og
- rødt eller lilla hududslæt med blærer og afskalning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Cartia omfatter:
- mild hovedpine,
- let svimmelhed og
- forkølelsessymptomer (tilstoppet næse, nysen, ondt i halsen)
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Cartia. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Diltiazemhydrochlorid er en cellulær calciumion-influxhæmmer (langsom kanalblokker eller calciumantagonist). Kemisk er diltiazemhydrochlorid 1,5-benzothiazepin-4(5H)on,3-(acetyloxy)-5-[2-(dimethylamino)ethyl]-2,3-dihydro-2-(4-methoxyphenyl)-, monohydrochlorid ,(+)-cis-. Den kemiske struktur er:
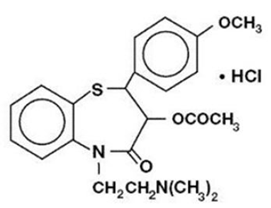
Diltiazem hydrochlorid er et hvidt til råhvidt krystallinsk pulver med en bitter smag. Det er opløseligt i vand, methanol og chloroform. Det har en molekylvægt på 450,98. Diltiazem hydrochlorid depotkapsel (en gang daglig dosis) er formuleret som en en gang dagligt forlænget frigivelseskapsel indeholdende 120 mg, 180 mg, 240 mg eller 300 mg diltiazem hydrochlorid.
Derudover indeholder hver kapsel følgende inaktive ingredienser: acetyltributylcitrat, ammoniomethacrylat copolymer-NF, D & C Red #28, D & C Yellow #10, D & C Yellow #10 Aluminium Lake, ethylcellulose, FD & C Blue #1 Aluminium Lake, FD & C Blue #2 Aluminium Lake, FD & C Red #40, FD & C Red #40 Aluminium Lake, gelatine-NF, magnesiumstearat, methacrylsyre copolymer-NF, propylenglycol, polysorbat 80-NF, stivelse , saccharose, talkum USP og titaniumdioxid. 180 mg og 240 mg kapslerne indeholder gult jernoxid. Derudover indeholder 240 mg kapslen også sort jernoxid og rød jernoxid.
Til oral administration.
Dette lægemiddel opfylder USP Drug Release 9.
INDIKATIONER
Diltiazem hydrochlorid depotkapsler USP (en gang dagligt dosis) er indiceret til behandling af hypertension. Det kan bruges alene eller i kombination med andre antihypertensive lægemidler.
Diltiazemhydrochlorid-depotkapsler USP (en gang dagligt dosis) er indiceret til behandling af kronisk stabil angina og angina på grund af kranspulsårespasmer.
DOSERING OG ADMINISTRATION
Patienter kontrolleret på diltiazem alene eller i kombination med anden medicin kan skiftes til diltiazemhydrochlorid-depotkapsler USP (en gang dagligt dosis) ved den nærmeste ækvivalente totale daglige dosis. Højere doser af diltiazemhydrochlorid depotkapsler USP (en gang dagligt dosis) kan være nødvendige hos nogle patienter. Patienter bør overvåges nøje. Efterfølgende titrering til højere eller lavere doser kan være nødvendig og bør påbegyndes som klinisk berettiget. Der er begrænset generel klinisk erfaring med doser over 360 mg, men doser til 540 mg er blevet undersøgt i kliniske forsøg. Forekomsten af bivirkninger stiger, efterhånden som dosis øges med førstegrads AV-blokering, svimmelhed og sinusbradykardi, der har det stærkeste forhold til dosis.
Forhøjet blodtryk
Dosis skal justeres ved titrering til individuelle patientbehov. Når det anvendes som monoterapi, er rimelige startdoser 180 til 240 mg én gang dagligt, selvom nogle patienter kan reagere på lavere doser. Maksimal antihypertensiv effekt observeres normalt ved 14 dages kronisk behandling; derfor skal dosisjusteringer planlægges i overensstemmelse hermed. Det sædvanlige dosisområde undersøgt i kliniske forsøg var 240 til 360 mg én gang dagligt. Individuelle patienter kan reagere på højere doser på op til 480 mg én gang dagligt.
Angina
Doser til behandling af angina bør justeres til hver patients behov, begyndende med en dosis på 120 eller 180 mg én gang dagligt. Individuelle patienter kan reagere på højere doser på op til 480 mg én gang dagligt. Om nødvendigt kan titrering udføres over en periode på 7 til 14 dage.
Diltiazem Hydrochloride Extended-release Capsules USP (Dosis én gang om dagen)
Samtidig brug med andre kardiovaskulære midler
HVORDAN LEVERET
BEMÆRK: PRODUKTET KAN HA EN LUGT.
Opbevaringsbetingelser
Opbevares ved 20° til 25°C (68° til 77°F) [Se USP kontrolleret rumtemperatur ].
Undgå for høj luftfugtighed.
Dispenser i tæt, lysbestandig beholder som defineret i USP.
Fremstillet af: Actavis Laboratories FL, Inc., Fort Lauderdale, FL 33314 USA. Distribueret af: Actavis Pharma, Inc., Parsippany, NJ 07054 USA. Revideret: december 2014
BIVIRKNINGER
Alvorlige bivirkninger har været sjældne i undersøgelser udført til dato, men det skal erkendes, at patienter med nedsat ventrikulær funktion og hjerteledningsabnormaliteter normalt er blevet udelukket fra disse undersøgelser.
Følgende tabel viser de mest almindelige bivirkninger, der er rapporteret i placebokontrollerede angina- og hypertensionsforsøg hos patienter, der fik diltiazemhydrochlorid-depotkapsel (en gang dagligt dosering) produkt op til 360 mg med frekvenser hos placebopatienter vist til sammenligning.
Diltiazem Hydrochloride-kapsel med forlænget frigivelse (en gang dagligt) placebokontrollerede angina- og hypertensionsforsøg kombineret
kliniske forsøg med diltiazemhydrochlorid-depotkapsler (en gang dagligt dosis), diltiazemhydrochlorid-tabletter og diltiazemhydrochlorid-depotkapsler, der involverede over 3200 patienter, var de mest almindelige hændelser (dvs. mere end 1%) ødem (4,6 %) , hovedpine (4,6 %), svimmelhed (3,5 %), asteni (2,6 %), førstegrads AV-blok (2,4 %), bradykardi (1,7 %), rødmen (1,4 %), kvalme (1,4 %) og udslæt ( 1,2 %).
Derudover blev følgende hændelser rapporteret sjældent (mindre end 1%) i angina- eller hypertensionsforsøg:
Kardiovaskulær: Angina, arytmi, AV-blok (anden eller tredje grad), bundtgrenblok, kongestiv hjertesvigt, EKG-abnormiteter, hypotension, hjertebanken, synkope, takykardi, ventrikulære ekstrasystoler.
Nervesystem: Unormale drømme, hukommelsestab, depression, gangabnormitet, hallucinationer, søvnløshed, nervøsitet, paræstesi, personlighedsændring, somnolens, tinnitus, tremor.
Gastrointestinale: Anoreksi, forstoppelse, diarré, mundtørhed, dysgeusi, dyspepsi, milde forhøjelser af SGOT, SGPT, LDH og alkalisk fosfatase (se ADVARSLER , Akut leverskade ), tørst, opkastning, vægtstigning.
Dermatologisk: Petekkier, lysfølsomhed, pruritus, nældefeber.
Andet: Amblyopi, CPK-stigning, dyspnø, næseblødning, øjenirritation, hyperglykæmi, hyperurikæmi, impotens, muskelkramper, tilstoppet næse, nocturi, osteoartikulær smerte, polyuri, seksuelle vanskeligheder.
Følgende postmarketing-hændelser er sjældent blevet rapporteret hos patienter, der får diltiazem: akut generaliseret eksantematøs pustulose, allergiske reaktioner, alopeci, angioødem (inklusive ansigts- eller periorbitalt ødem), asystoli, erythema multiforme (inklusive Stevens-Johns-Johnson syndrome syndrom), exfolnecrotoxic dermalitis syndrom, , ekstrapyramidale symptomer, gingival hyperplasi, hæmolytisk anæmi, øget blødningstid, leukopeni, lysfølsomhed (inklusive lichenoid keratose og hyperpigmentering i soleksponerede hudområder), purpura, retinopati, myopati og trombocytopeni. Derudover er hændelser såsom myokardieinfarkt blevet observeret, som ikke umiddelbart kan skelnes fra sygdommens naturlige historie hos disse patienter. En række veldokumenterede tilfælde af generaliseret udslæt, nogle karakteriseret som leukocytoklastisk vaskulitis, er blevet rapporteret. Der er dog endnu ikke etableret en endelig årsag og virkning mellem disse hændelser og diltiazembehandling.
Kontakt Actavis på 1-800-272-5525 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch for at rapportere FORSINKTE BIVIRKNINGER.
DRUGSINTERAKTIONER
På grund af potentialet for additive virkninger er forsigtighed og omhyggelig titrering berettiget hos patienter, der får diltiazem samtidig med andre midler, der vides at påvirke hjertets kontraktilitet og/eller ledning (se ADVARSLER ). Farmakologiske undersøgelser tyder på, at der kan være additive virkninger ved at forlænge AV-ledning ved brug af betablokkere eller digitalis samtidig med diltiazem (se ADVARSLER ).
Som med alle lægemidler skal der udvises forsigtighed ved behandling af patienter med flere lægemidler. Diltiazem er både et substrat og en hæmmer af cytochrom P-450 3A4 enzymsystemet. Andre lægemidler, der er specifikke substrater, inhibitorer eller inducere af dette enzymsystem, kan have en betydelig indvirkning på effektiviteten og bivirkningsprofilen af diltiazem. Patienter, der tager andre lægemidler, der er substrater for CYP450 3A4, især patienter med nedsat nyre- og/eller leverfunktion, kan kræve dosisjustering, når man starter eller stopper samtidig indgift af diltiazem for at opretholde optimale terapeutiske blodniveauer.
Bedøvelsesmidler
Nedsættelsen af hjertets kontraktilitet, ledningsevne og automatik såvel som den vaskulære udvidelse i forbindelse med anæstetika kan forstærkes af calciumkanalblokkere. Ved samtidig brug bør anæstetika og calciumblokkere titreres omhyggeligt.
Benzodiazepiner
Undersøgelser viste, at diltiazem øgede AUC for midazolam og triazolam med 3 til 4 gange og Cmax med 2 gange sammenlignet med placebo. Eliminationshalveringstiden for midazolam og triazolam steg også (1,5- til 2,5 gange) under samtidig administration med diltiazem. Disse farmakokinetiske virkninger, der ses under samtidig administration af diltiazem, kan resultere i øgede kliniske virkninger (f.eks. forlænget sedation) af både midazolam og triazolam.
Beta-blokkere
Kontrollerede og ukontrollerede indenlandske undersøgelser tyder på, at samtidig brug af diltiazem og betablokkere normalt tolereres godt, men tilgængelige data er ikke tilstrækkelige til at forudsige virkningerne af samtidig behandling hos patienter med venstre ventrikel dysfunktion eller hjerteledningsabnormiteter.
Administration af diltiazemhydrochlorid samtidig med propranolol hos fem normale frivillige resulterede i øgede propranololniveauer hos alle forsøgspersoner, og biotilgængeligheden af propranolol var øget med ca. 50 %. In vitro synes propranolol at blive fortrængt fra dets bindingssteder af diltiazem. Hvis kombinationsbehandling påbegyndes eller seponeres i forbindelse med propranolol, kan en justering af propranololdosis være berettiget (se ADVARSLER ).
Buspiron
Hos ni raske forsøgspersoner øgede diltiazem den gennemsnitlige buspiron AUC 5,5 gange og Cmax 4,1 gange signifikant sammenlignet med placebo. T½ og Tmax for buspiron var ikke signifikant påvirket af diltiazem. Forstærkede effekter og øget toksicitet af buspiron kan være mulig ved samtidig administration med diltiazem. Efterfølgende dosisjusteringer kan være nødvendige under samtidig administration og bør være baseret på klinisk vurdering.
Carbamazepin
Samtidig administration af diltiazem og carbamazepin er blevet rapporteret at resultere i forhøjede serumniveauer af carbamazepin (40 % til 72 % stigning), hvilket resulterer i toksicitet i nogle tilfælde. Patienter, der får disse lægemidler samtidigt, bør overvåges for en potentiel lægemiddelinteraktion.
Cimetidin
En undersøgelse med seks raske frivillige har vist en signifikant stigning i maksimale diltiazem-plasmaniveauer (58 %) og area-under-kurven (53 %) efter en 1-uges behandling med cimetidin på 1200 mg dagligt og en enkelt dosis af diltiazem 60 mg. Ranitidin producerede mindre, ikke-signifikante stigninger. Virkningen kan medieres af cimetidins kendte hæmning af hepatisk cytochrom P-450, det enzymsystem, der er ansvarlig for first-pass metabolismen af diltiazem. Patienter, der i øjeblikket får diltiazem-behandling, bør overvåges nøje for en ændring i farmakologisk effekt, når behandlingen med cimetidin påbegyndes og seponeres. En justering af diltiazemdosis kan være berettiget.
Clonidin
Sinusbradykardi, der resulterer i hospitalsindlæggelse og pacemakerindsættelse, er blevet rapporteret i forbindelse med brug af clonidin samtidig med diltiazem. Overvåg hjertefrekvens hos patienter, der samtidig får diltiazem og clonidin.
Cyclosporin
En farmakokinetisk interaktion mellem diltiazem og cyclosporin er blevet observeret under undersøgelser med nyre- og hjertetransplanterede patienter. Hos nyre- og hjertetransplanterede patienter var en reduktion af cyclosporindosis i området fra 15 % til 48 % nødvendig for at opretholde ciclosporin-dalkoncentrationer svarende til dem, der blev set før tilsætning af diltiazem. Hvis disse midler skal administreres samtidigt, bør ciclosporinkoncentrationerne monitoreres, især når diltiazembehandling påbegyndes, justeres eller seponeres.
Virkningen af cyclosporin på plasmakoncentrationer af diltiazem er ikke blevet evalueret.
Digitalis
Administration af diltiazem med digoxin hos 24 raske mandlige forsøgspersoner øgede plasmadigoxinkoncentrationerne med ca. 20 %. En anden efterforsker fandt ingen stigning i digoxinniveauer hos 12 patienter med koronararteriesygdom. Da der har været modstridende resultater med hensyn til virkningen af digoxinniveauer, anbefales det, at digoxinniveauer overvåges, når diltiazembehandling påbegyndes, justeres og seponeres for at undgå mulig over- eller underdigitalisering (se ADVARSLER ).
Quinidin
Diltiazem øger signifikant AUC(0-→) af quinidin med 51 %, T½ med 36 % og reducerer dets CL oralt med 33 %. Overvågning for quinidin-bivirkninger kan være berettiget, og dosis justeres i overensstemmelse hermed.
Rifampin
Samtidig administration af rifampin og diltiazem sænkede plasmakoncentrationerne af diltiazem til upåviselige niveauer. Samtidig administration af diltiazem med rifampin eller enhver kendt CYP3A4-inducer bør undgås, når det er muligt, og alternativ behandling bør overvejes.
Statiner
Diltiazem er en hæmmer af CYP3A4 og har vist sig at øge AUC signifikant for nogle statiner. Risikoen for myopati og rabdomyolyse med statiner metaboliseret af CYP3A4 kan øges ved samtidig brug af diltiazem. Når det er muligt, skal du bruge et ikke-CYP3A4-metaboliseret statin sammen med diltiazem; ellers bør dosisjusteringer for både diltiazem og statinet overvejes sammen med tæt monitorering for tegn og symptomer på statinrelaterede bivirkninger.
et krydsningsstudie med raske frivillige (N=10) resulterede samtidig administration af en enkelt 20 mg dosis simvastatin i slutningen af et 14-dages regime med 120 mg to gange dagligt diltiazem SR i en 5-fold stigning i gennemsnitlig simvastatin AUC versus simvastatin alene. Forsøgspersoner med øget gennemsnitlig steady-state eksponering for diltiazem viste en større fold stigning i simvastatin eksponering. Computerbaserede simuleringer viste, at der ved en daglig dosis på 480 mg diltiazem kan forventes en 8- til 9 gange gennemsnitlig stigning i simvastatin AUC. Hvis samtidig administration af simvastatin og diltiazem er påkrævet, begrænses de daglige doser af simvastatin til 10 mg og diltiazem til 240 mg.
et randomiseret, åbent, 4-vejs cross-over-studie med ti forsøgspersoner resulterede samtidig administration af diltiazem (120 mg Diltiazem SR 2 gange dagligt i 2 uger) med en enkelt dosis på 20 mg lovastatin i en 3- til 4-dobling af gennemsnittet lovastatin AUC og versus lovastatin alene. I samme undersøgelse var der ingen signifikant ændring i 20 mg enkeltdosis pravastatin AUC og under samtidig administration af diltiazem. Diltiazem plasmaniveauer blev ikke signifikant påvirket af lovastatin eller pravastatin.
ADVARSLER
Hjerteledning
Diltiazem forlænger AV-knude-refraktære perioder uden væsentligt at forlænge sinusknude-restitutionstiden, undtagen hos patienter med sick sinus syndrome. Denne effekt kan sjældent resultere i unormalt langsomme hjertefrekvenser (især hos patienter med sick sinus syndrome) eller anden- eller tredjegrads AV-blok (13 ud af 3290 patienter eller 0,40%). Samtidig brug af diltiazem og betablokkere eller digitalis kan resultere i additive effekter på hjerteledning. En patient med Prinzmetals angina udviklede perioder med asystoli (2 til 5 sekunder) efter en enkelt dosis på 60 mg diltiazem (se BIVIRKNINGER ).
Kongestiv hjertesvigt
Selvom diltiazem har en negativ inotrop effekt i isolerede dyrevævspræparater, har hæmodynamiske undersøgelser hos mennesker med normal ventrikulær funktion ikke vist en reduktion i hjerteindeks eller konsekvente negative effekter på kontraktilitet (dp/dt). En akut undersøgelse af oral diltiazem hos patienter med nedsat ventrikulær funktion (ejektionsfraktion 24 % ± 6 %) viste forbedring i indeks for ventrikulær funktion uden signifikant fald i kontraktil funktion (dp/dt). Forværring af kongestiv hjerteinsufficiens er blevet rapporteret hos patienter med allerede eksisterende svækkelse af ventrikulær funktion. Erfaring med brug af diltiazemhydrochlorid i kombination med betablokkere hos patienter med nedsat ventrikulær funktion er begrænset. Der skal udvises forsigtighed ved brug af denne kombination.
Hypotension
Fald i blodtrykket forbundet med diltiazem-behandling kan lejlighedsvis resultere i symptomatisk hypotension.
Akut leverskade
Milde forhøjelser af transaminaser med og uden samtidig forhøjelse af alkalisk fosfatase og bilirubin er blevet observeret i kliniske undersøgelser. Sådanne forhøjelser var sædvanligvis forbigående og forsvandt ofte selv ved fortsat diltiazembehandling. I sjældne tilfælde er der observeret signifikante stigninger i enzymer såsom alkalisk fosfatase, LDH, SGOT, SGPT og andre fænomener i overensstemmelse med akut leverskade. Disse reaktioner havde en tendens til at opstå tidligt efter behandlingsstart (1 til 8 uger) og har været reversible efter seponering af lægemiddelbehandling. Forholdet til diltiazem er usikkert i nogle tilfælde, men sandsynligt i nogle (se FORHOLDSREGLER ).
FORHOLDSREGLER
Generel
Diltiazem hydrochlorid metaboliseres i vid udstrækning i leveren og udskilles af nyrerne og i galden. Som med ethvert lægemiddel givet over længere perioder, bør laboratorieparametre for nyre- og leverfunktion monitoreres med regelmæssige intervaller. Lægemidlet bør anvendes med forsigtighed til patienter med nedsat nyre- eller leverfunktion. I subakutte og kroniske hunde- og rottestudier designet til at producere toksicitet, var høje doser af diltiazem forbundet med leverskade. I særlige subakutte leverundersøgelser var orale doser på 125 mg/kg og højere hos rotter forbundet med histologiske forandringer i leveren, som var reversible, da lægemidlet blev seponeret. Hos hunde var doser på 20 mg/kg også forbundet med leverforandringer; disse ændringer var dog reversible ved fortsat dosering.
Dermatologiske hændelser (se BIVIRKNINGER kan være forbigående og kan forsvinde på trods af fortsat brug af diltiazem. Imidlertid er hududbrud, der udvikler sig til erythema multiforme og/eller eksfoliativ dermatitis, også sjældent blevet rapporteret. Hvis en dermatologisk reaktion fortsætter, bør lægemidlet seponeres.
Karcinogenese, mutagenese, svækkelse af fertilitet
Et 24-måneders studie med rotter ved orale dosisniveauer på op til 100 mg/kg/dag og et 21-måneders studie med mus med orale dosisniveauer på op til 30 mg/kg/dag viste ingen tegn på carcinogenicitet. Der var heller ingen mutagen respons in vitro eller in vivo i pattedyrcelleassays eller in vitro i bakterier. Der blev ikke observeret tegn på nedsat fertilitet i en undersøgelse udført med han- og hunrotter ved orale doser på op til 100 mg/kg/dag.
Graviditet
Kategori C. Reproduktionsundersøgelser er blevet udført på mus, rotter og kaniner. Administration af doser fra fem til ti gange større (på mg/kg basis) end den daglige anbefalede terapeutiske dosis har resulteret i embryo- og fosterdødelighed. Disse doser er i nogle undersøgelser blevet rapporteret at forårsage skeletabnormiteter. I de perinatale/postnatale undersøgelser var der en øget forekomst af dødfødsler ved doser på 20 gange den humane dosis eller mere.
Der er ingen velkontrollerede undersøgelser af gravide kvinder; Brug derfor kun diltiazem til gravide kvinder, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Ammende mødre
Diltiazem udskilles i modermælk. En rapport tyder på, at koncentrationer i modermælk kan nærme sig serumniveauer. Hvis brug af diltiazem anses for at være nødvendig, bør en alternativ metode til spædbørnsernæring anvendes.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Kliniske undersøgelser af diltiazem omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling.
OVERDOSIS
De orale LD50'er hos mus og rotter varierer fra henholdsvis 415 til 740 mg/kg og fra 560 til 810 mg/kg. De intravenøse LD50'er i disse arter var henholdsvis 60 og 38 mg/kg. Den orale LD50 hos hunde anses for at være over 50 mg/kg, mens dødelighed blev set hos aber ved 360 mg/kg.
Den toksiske dosis hos mennesker kendes ikke. På grund af omfattende stofskifte kan blodniveauer efter en standarddosis diltiazem variere over tidoblet, hvilket begrænser nytten af blodniveauer i tilfælde af overdosis.
Der har været rapporter om overdosering af diltiazem i mængder fra
Hændelser observeret efter overdosering af diltiazem omfattede bradykardi, hypotension, hjerteblokade og hjertesvigt. De fleste indberetninger om overdosering beskrev en understøttende medicinsk foranstaltning og/eller lægemiddelbehandling. Bradykardi reagerede ofte positivt på atropin, ligesom hjerteblokade gjorde, selvom hjertestimulering også ofte blev brugt til at behandle hjerteblokade. Væsker og vasopressorer blev brugt til at opretholde blodtrykket, og i tilfælde af hjertesvigt blev der givet inotrope midler. Derudover fik nogle patienter behandling med ventilatorisk støtte, maveskylning, aktivt kul og/eller intravenøs calcium.
Effektiviteten af intravenøs calciumadministration til at vende de farmakologiske virkninger af diltiazem-overdosis har været inkonsekvent. I nogle få rapporterede tilfælde blev overdosering med calciumkanalblokkere forbundet med hypotension og bradykardi, som oprindeligt var refraktær over for atropin, mere responsiv over for atropin, efter at patienterne fik intravenøs calcium. I nogle tilfælde er intravenøst calcium blevet administreret (1 g calciumchlorid eller 3 g calciumgluconat) over 5 minutter og gentaget hvert 10. til 20. minut efter behov. Calciumgluconat er også blevet administreret som en kontinuerlig infusion med en hastighed på 2 g pr. time i 10 timer. Infusioner af calcium i 24 timer eller mere kan være påkrævet. Patienter bør overvåges for tegn på hypercalcæmi.
tilfælde af overdosering eller overdrevet respons bør passende støttende foranstaltninger anvendes ud over gastrointestinal dekontaminering. Diltiazem ser ikke ud til at blive fjernet ved peritoneal eller hæmodialyse. Begrænsede data tyder på, at plasmaferese eller kulhæmoperfusion kan fremskynde eliminering af diltiazem efter overdosering. Baseret på de kendte farmakologiske virkninger af diltiazem og/eller rapporterede kliniske erfaringer, kan følgende foranstaltninger overvejes:
Bradykardi: Administrer atropin (0,6 til 1 mg). Hvis der ikke er nogen reaktion på vagal blokade, administreres isoproterenol med forsigtighed.
Højgrads AV-blok: Behandl som for bradykardi ovenfor. Fast højgrads AV-blok bør behandles med hjertestimulering.
Hjertesvigt: Administrer inotrope midler (isoproterenol, dopamin eller dobutamin) og diuretika.
Hypotension: Vasopressorer (f.eks. dopamin eller noradrenalin).
Faktisk behandling og dosering bør afhænge af sværhedsgraden af den kliniske situation og den behandlende læges vurdering og erfaring.
KONTRAINDIKATIONER
Diltiazem er kontraindiceret hos (1) patienter med syg sinus-syndrom undtagen ved tilstedeværelse af en fungerende ventrikulær pacemaker, (2) patienter med anden- eller tredjegrads AV-blokering undtagen ved tilstedeværelse af en fungerende ventrikulær pacemaker, (3) patienter med hypotension (mindre end 90 mm Hg systolisk), (4) patienter, der har udvist overfølsomhed over for lægemidlet, og (5) patienter med akut myokardieinfarkt og lungekongestion dokumenteret ved røntgen ved indlæggelsen.
KLINISK FARMAKOLOGI
De terapeutiske virkninger af diltiazemhydrochlorid-depotkapsler USP (en gang dagligt dosis) menes at være relateret til dets evne til at hæmme den cellulære tilstrømning af calciumioner under membrandepolarisering af hjerte- og vaskulær glat muskulatur.
Virkningsmekanismer
Forhøjet blodtryk
Diltiazem hydrochlorid depotkapsler USP (en gang dagligt dosis) frembringer sin antihypertensive effekt primært ved afslapning af vaskulær glat muskulatur og det deraf følgende fald i perifer vaskulær modstand. Størrelsen af blodtryksreduktion er relateret til graden af hypertension; således oplever hypertensive personer en antihypertensiv effekt, hvorimod der kun er et beskedent blodtryksfald hos normotensive.
Angina
Diltiazem hydrochlorid depotkapsler USP (en gang dagligt dosis) har vist sig at give stigninger i træningstolerance, sandsynligvis på grund af dets evne til at reducere myokardiets iltbehov. Dette opnås via reduktioner i hjertefrekvens og systemisk blodtryk ved submaksimale og maksimale arbejdsbelastninger. Diltiazem har vist sig at være en potent dilatator af kranspulsårer, både epikardiel og subendokardie. Spontan og ergonovin-induceret koronararterie spasmer hæmmes af diltiazem.
dyremodeller interfererer diltiazem med den langsomme indadgående (depolariserende) strøm i exciterbart væv. Det forårsager excitation-kontraktionsafkobling i forskellige myokardievæv uden ændringer i konfigurationen af aktionspotentialet. Diltiazem frembringer afslapning af den glatte muskulatur i koronar vaskulær og udvidelse af både store og små kranspulsårer ved lægemiddelniveauer, som forårsager ringe eller ingen negativ inotrop effekt. De resulterende stigninger i koronar blodgennemstrømning (epicardie og subendokardie) forekommer i iskæmiske og ikke-iskæmiske modeller og er ledsaget af dosisafhængige fald i systemisk blodtryk og fald i perifer modstand.
Hæmodynamiske og elektrofysiologiske effekter
Som andre calciumkanalantagonister nedsætter diltiazem sinoatrial og atrioventrikulær ledning i isolerede væv og har en negativ inotrop effekt i isolerede præparater. Hos det intakte dyr kan forlængelse af AH-intervallet ses ved højere doser.
Hos mennesker forhindrer diltiazem spontane og ergonovin-provokerede kranspulsårer. Det forårsager et fald i perifer vaskulær modstand og et beskedent blodtryksfald hos normotensive personer, og i træningstoleranceundersøgelser hos patienter med iskæmisk hjertesygdom reducerer det puls-blodtryksproduktet for enhver given arbejdsbyrde. Undersøgelser til dato, primært hos patienter med god ventrikulær funktion, har ikke afsløret tegn på en negativ inotrop effekt; hjertevolumen, ejektionsfraktion og venstre ventrikulære endediastoliske tryk er ikke blevet påvirket. Sådanne data har ingen prædiktiv værdi med hensyn til virkninger hos patienter med dårlig ventrikulær funktion, og øget hjertesvigt er blevet rapporteret hos patienter med allerede eksisterende svækkelse af ventrikulær funktion. Der er endnu få data om interaktionen mellem diltiazem og betablokkere hos patienter med dårlig ventrikulær funktion. Hvilepuls reduceres normalt lidt af diltiazem.
Hos hypertensive patienter frembringer diltiazemhydrochlorid-depotkapsler USP (en gang dagligt) antihypertensive virkninger både i liggende og stående stilling. I et dobbeltblindt, parallelt dosis-respons-studie, hvor der blev anvendt doser fra 90 til 540 mg én gang dagligt, sænkede diltiazemhydrochlorid-depotkapsel (dosis én gang dagligt) det diastoliske blodtryk på en tilsyneladende lineær måde over hele dosisområde undersøgt. Ændringerne i det diastoliske blodtryk, målt ved bundfald, for placebo, 90 mg, 180 mg, 360 mg og 540 mg var henholdsvis -2,9, -4,5, -6,1, -9,5 og -10,5 mm Hg. Postural hypotension ses sjældent, når man pludselig indtager en oprejst stilling. Ingen reflekstakykardi er forbundet med de kroniske antihypertensive virkninger. Diltiazem hydrochlorid depotkapsler USP (en gang dagligt dosis) reducerer vaskulær modstand, øger hjertevolumen (ved at øge slagvolumen); og giver et lille fald eller ingen ændring i hjertefrekvensen. Under dynamisk træning hæmmes stigninger i det diastoliske tryk, mens det maksimalt opnåelige systoliske tryk normalt reduceres. Kronisk behandling med diltiazemhydrochlorid-depotkapsler USP (en gang dagligt dosis) giver ingen ændring eller en stigning i plasmakatekolaminer. Der er ikke observeret øget aktivitet af renin-angiotensin-aldosteron-aksen. Diltiazem hydrochlorid depotkapsler USP (en gang dagligt dosis) reducerer de renale og perifere virkninger af angiotensin II. Hypertensive dyremodeller reagerer på diltiazem med reduktioner i blodtryk og øget urinproduktion og natriurese uden ændring i urinens natrium/kalium-forhold.
et dobbeltblindt, parallelt dosis-respons-studie af doser fra 60 mg til 480 mg én gang dagligt, forlængede diltiazemhydrochlorid-depotkapsel (en gang dagligt dosis) tiden til afbrydelse af træning på en lineær måde over hele dosen rækkevidde studeret. Forbedringen i tid til afbrydelse af træning ved brug af en Bruce-træningsprotokol, målt ved lavpunkt, for placebo, 60 mg, 120 mg, 240 mg, 360 mg og 480 mg var 29, 40, 56, 51, 69 og 68 sekunder , henholdsvis. Efterhånden som doser af diltiazemhydrochlorid depotkapsel (dosis én gang dagligt) blev øget, faldt den generelle anginafrekvens. Diltiazemhydrochlorid-depotkapsel (dosis én gang dagligt), 180 mg én gang dagligt eller placebo blev administreret i et dobbeltblindt studie til patienter, der fik samtidig behandling med langtidsvirkende nitrater og/eller betablokkere. Der blev observeret en signifikant stigning i tid til afbrydelse af træning og et signifikant fald i den samlede anginafrekvens. I dette forsøg var den samlede hyppighed af bivirkninger i behandlingsgruppen med diltiazemhydrochlorid-depotkapsler (en gang dagligt) den samme som i placebogruppen.
Intravenøs diltiazem i doser på 20 mg forlænger AH-ledningstiden og AV-knudefunktionelle og effektive refraktære perioder med ca. 20 %. I en undersøgelse, der involverede enkelt orale doser på 300 mg diltiazemhydrochlorid hos seks normale frivillige, var den gennemsnitlige maksimale PR-forlængelse 14 % uden tilfælde af større end førstegrads AV-blok. Diltiazem-associeret forlængelse af AH-intervallet er ikke mere udtalt hos patienter med førstegrads hjerteblokade. Hos patienter med syg sinus-syndrom forlænger diltiazem sinuscykluslængden betydeligt (op til 50 % i nogle tilfælde).
Kronisk oral administration af diltiazemhydrochlorid til patienter i doser på op til 540 mg/dag har resulteret i små stigninger i PR-intervallet og giver lejlighedsvis unormal forlængelse (se ADVARSLER ).
Farmakokinetik og metabolisme
Diltiazem absorberes godt fra mave-tarmkanalen og er udsat for en omfattende first-pass-effekt, hvilket giver en absolut biotilgængelighed (sammenlignet med intravenøs administration) på omkring 40 %. Diltiazem gennemgår omfattende metabolisme, hvor kun 2% til 4% af det uændrede lægemiddel vises i urinen. Lægemidler, som inducerer eller hæmmer levermikrosomale enzymer, kan ændre diltiazem-disposition.
Total radioaktivitetsmåling efter kort IV-administration hos raske frivillige tyder på tilstedeværelsen af andre uidentificerede metabolitter, som opnår højere koncentrationer end diltiazem og elimineres langsommere; halveringstid af total radioaktivitet er omkring 20 timer sammenlignet med 2 til 5 timer for diltiazem.
In vitro bindingsundersøgelser viser, at diltiazem er 70 % til 80 % bundet til plasmaproteiner. Konkurrerende in vitro ligandbindingsstudier har også vist, at diltiazembinding ikke ændres af terapeutiske koncentrationer af digoxin, hydrochlorthiazid, phenylbutazon, propranolol, salicylsyre eller warfarin. Plasmaelimineringshalveringstiden efter enkelt- eller multipel lægemiddeladministration er ca. 3,0 til 4,5 timer. Desacetyldiltiazem er også til stede i plasmaet i niveauer på 10% til 20% af moderlægemidlet og er 25% til 50% så potent som en koronar vasodilator som diltiazem. Minimum terapeutiske plasmadiltiazemkoncentrationer synes at være i området 50 til 200 ng/ml. Der er en afvigelse fra linearitet, når dosisstyrkerne øges; halveringstiden øges lidt med dosis. En undersøgelse, der sammenlignede patienter med normal leverfunktion med patienter med cirrhose, fandt en stigning i halveringstid og en 69 % stigning i biotilgængelighed hos de leversvigte patienter. Et enkelt studie med ni patienter med alvorligt nedsat nyrefunktion viste ingen forskel i den farmakokinetiske profil af diltiazem sammenlignet med patienter med normal nyrefunktion.
Diltiazem Hydrochloride Extended-Release-kapsler (en gang dagligt dosis)
Sammenlignet med et regime med diltiazem-tabletter ved steady-state, absorberes mere end 95 % af lægemidlet fra formuleringen af diltiazemhydrochlorid-depotkapsler (en gang dagligt). En enkelt dosis på 360 mg af kapslen resulterer i påviselige plasmaniveauer inden for 2 timer og maksimale plasmaniveauer mellem 10 og 14 timer; absorption sker gennem hele doseringsintervallet. Når diltiazem hydrochlorid depotkapsel (en gang dagligt dosis) blev administreret sammen med en morgenmad med højt fedtindhold, blev omfanget af diltiazem absorption ikke påvirket. Dosisdumping forekommer ikke. Den tilsyneladende eliminationshalveringstid efter en enkelt eller gentagen dosering er 5 til 8 timer. En afvigelse fra linearitet svarende til den, der ses med diltiazem tabletter og diltiazem hydrochlorid kapsler (to gange dagligt) er observeret. Da dosis af diltiazemhydrochlorid depotkapsler (en gang dagligt dosis) øges fra en daglig dosis på 120 mg til 240 mg, er der en stigning i arealet under kurven på 2,7 gange. Når dosis øges fra 240 mg til 360 mg, er der en stigning i arealet-under-kurven på 1,6 gange.
PATIENTOPLYSNINGER
Ingen oplysninger angivet. Der henvises til ADVARSLER og FORHOLDSREGLER sektioner.
