Medicin mod mave-tarm sygdomme : Nexium 20mg, 40mg Esomeprazole Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Nexium, og hvordan bruges det?
Nexium er en receptpligtig medicin, der bruges til at behandle symptomerne på gastroøsofageal reflukssygdom (GERD) og andre tilstande, hvor der er for høj mavesyre, såsom Zollinger-Ellison syndrom. Nexium kan bruges alene eller sammen med anden medicin.
Nexium 20mg er en protonpumpehæmmer.
Det vides ikke, om Nexium 20mg er sikkert og effektivt til børn under 1 måned til intravenøs medicin og 1 år til oral medicin.
Hvad er bivirkninger af Nexium 40mg?
Nexium kan forårsage alvorlige bivirkninger, herunder:
- stærke mavesmerter,
- diarré, der er vandig eller blodig,
- krampeanfald (kramper),
- lidt eller ingen vandladning,
- blod i urinen,
- hævelse,
- hurtig vægtøgning,
- svimmelhed,
- hurtig eller uregelmæssig puls,
- rysten eller rykkende muskelbevægelser,
- føler sig nervøs,
- muskelkramper,
- muskelspasmer i dine hænder og fødder,
- hoste eller kvælningsfølelse,
- ledsmerter, og
- hududslæt på kinder eller arme, som forværres i solen
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Nexium 40mg omfatter:
- hovedpine,
- døsighed,
- mild diarré,
- kvalme,
- mavesmerter,
- gas,
- forstoppelse, og
- tør mund
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Nexium. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
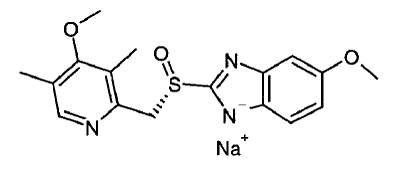
Den aktive ingrediens i NEXIUM® IV (esomeprazolnatrium) til injektion er (S)-5-methoxy-2[[(4-methoxy-3,5-dimethyl-2-pyridinyl)-methyl]sulfinyl]-1 H-benzimidazol natrium, en protonpumpehæmmer, der hæmmer mavesyresekretion. Esomeprazol er S-isomeren af omeprazol, som er en blanding af S- og R-isomererne. Dens empiriske formel er C17H18N3O3SNa med en molekylvægt på 367,4 g/mol (natriumsalt) og 345,4 g/mol (moderforbindelse).
Esomeprazolnatrium er meget opløseligt i vand og frit opløseligt i ethanol (95%). Strukturformlen er:
NEXIUM 20mg IV til injektion leveres som en steril, frysetørret, hvid til råhvid, porøs kage eller pulver i et 5 ml hætteglas, beregnet til intravenøs administration efter rekonstitution med 0,9 % natriumchloridinjektion, USP; Lactat Ringer's Injection, USP eller 5% Dextrose Injection, USP. NEXIUM IV til injektion indeholder esomeprazolnatrium 21,3 mg eller 42,5 mg svarende til esomeprazol 20 mg eller 40 mg, dinatriumedetat 1,5 mg og natriumhydroxid qs til pH-justering. pH-værdien af rekonstitueret opløsning af NEXIUM IV til injektion afhænger af rekonstitutionsvolumenet og er i pH-området fra 9 til 11. Stabiliteten af esomeprazolnatrium i vandig opløsning er stærkt pH-afhængig. Nedbrydningshastigheden stiger med faldende pH.
INDIKATIONER
Behandling af gastroøsofageal reflukssygdom (GERD) med erosiv esophagitis (EE)
NEXIUM IV er indiceret til korttidsbehandling af GERD med EE hos voksne og pædiatriske patienter i alderen 1 måned til 17 år, inklusive som et alternativ til oral behandling, når oral NEXIUM 40 mg ikke er mulig eller passende.
Risikoreduktion af genblødning af mave- eller duodenalsår efter terapeutisk endoskopi hos voksne
NEXIUM 40mg IV er indiceret til risikoreduktion af genblødning af mavesår eller duodenalsår efter terapeutisk endoskopi for akut blødende mavesår eller duodenalsår hos voksne.
DOSERING OG ADMINISTRATION
Dosering for GERD med EE
Voksne patienter
Den anbefalede voksendosis er enten 20 mg eller 40 mg NEXIUM 40 mg IV givet én gang dagligt ved intravenøs injektion (over mindst 3 minutter) eller intravenøs infusion (10 minutter til 30 minutter) i op til 10 dage [se DOSERING OG ADMINISTRATION ].
Pædiatriske patienter
Den anbefalede dosis til pædiatriske patienter er baseret på alder og kropsvægt som vist i tabel 1 nedenfor. Indgives som en intravenøs infusion over 10 til 30 minutter én gang dagligt i op til 10 dage [se DOSERING OG ADMINISTRATION ].
Afslutning af behandling
- Sikkerheden og effektiviteten af NEXIUM 20mg IV i mere end 10 dage er ikke blevet påvist.
- Så snart oral behandling er mulig eller passende, afbrydes intravenøs behandling med NEXIUM 40 mg IV og fortsættes med oral NEXIUM 20 mg behandling.
Dosering til risikoreduktion af genblødning af mave- eller duodenalsår efter terapeutisk endoskopi hos voksne
Den anbefalede voksendosis er 80 mg NEXIUM IV administreret som en intravenøs infusion over 30 minutter efterfulgt af en kontinuerlig infusion på 8 mg/time i en samlet behandlingsvarighed på 72 timer (dvs. inkluderer initial 30-minutters startdosis plus 71,5 timers kontinuerlig infusion) [se DOSERING OG ADMINISTRATION ].
Intravenøs behandling er udelukkende rettet mod den akutte indledende behandling af blødende mavesår eller duodenalsår og udgør ikke fuld behandling. Administrer oral syreundertrykkende behandling efter intravenøs behandling i et fuldt behandlingsforløb.
Dosisjustering for nedsat leverfunktion
GERD Med EE
For patienter med svært nedsat leverfunktion (Child-Pugh klasse C) er den maksimale dosis 20 mg én gang dagligt [se Brug i specifikke populationer ].
Risikoreduktion af genblødning af mave- eller duodenalsår efter terapeutisk endoskopi hos voksne
Til patienter med let til moderat nedsat leverfunktion (henholdsvis Child-Pugh klasse A og B), administreret 80 mg som en intravenøs infusion over 30 minutter, efterfulgt af en kontinuerlig infusion på 6 mg/time i 71,5 timer.
Til patienter med svært nedsat leverfunktion (Child-Pugh klasse C), administreret 80 mg som en intravenøs infusion over 30 minutter, efterfulgt af en kontinuerlig infusion på 4 mg/time i 71,5 timer [se Brug i specifikke populationer ].
Forberedelse og administrationsvejledning til GERD med EE
Indgiv ikke NEXIUM 40mg IV samtidig med anden medicin gennem det samme intravenøse sted og/eller slange.
Orale antacida kan anvendes under behandling med NEXIUM 20mg IV
Intravenøs injektion over mindst 3 minutter hos voksne patienter
Intravenøs infusion over 10 minutter til 30 minutter hos voksne og pædiatriske patienter
Opbevaring
Opbevar den endelige (fortyndede) NEXIUM IV-opløsning ved stuetemperatur op til 30°C (86°F) og administrer inden for det angivne tidsrum som angivet i tabel 2 nedenfor.
Forberedelse og administration Instruktioner til risikoreduktion af genblødning af mave- eller duodenalsår hos voksne
Indgiv ikke NEXIUM 40mg IV samtidig med anden medicin gennem det samme intravenøse sted og/eller slange.
Orale antacida kan anvendes under behandling med NEXIUM IV
Loading dosis (80 mg)
Kontinuerlig infusion
Opbevaring
- Opbevar den endelige (fortyndede) NEXIUM IV-opløsning ved stuetemperatur op til 30°C (86°F) og administrer inden for 12 timer.
HVORDAN LEVERET
Doseringsformer og styrker
Til injektion: 40 mg esomeprazol som et hvidt til råhvidt frysetørret pulver i et enkeltdosis hætteglas til rekonstitution.
Opbevaring og håndtering
NEXIUM 20mg IV leveres i et enkeltdosis hætteglas som et hvidt til råhvidt frysetørret pulver til rekonstitution indeholdende 40 mg esomeprazol.
NEXIUM 40mg IV . er tilgængelig som følger:
Opbevaring
Opbevares ved 25°C (77°F); udflugter tilladt til 15° til 30°C (59° til 86°F). [Se USP kontrolleret rumtemperatur .] Beskyt mod lys. Opbevares i karton indtil brug.
Efter rekonstitution og administration kasseres enhver ubrugt portion esomeprazolopløsning [se DOSERING OG ADMINISTRATION ].
Fremstillet for: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revideret: Mar 2022
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i mærkningen:
- Akut Tubulointerstitiel nefritis [se ADVARSLER OG FORHOLDSREGLER ]
- Clostridium difficile-associeret diarré [se ADVARSLER OG FORHOLDSREGLER ]
- Knoglebrud [se ADVARSLER OG FORHOLDSREGLER ]
- Alvorlige kutane bivirkninger [se ADVARSLER OG FORHOLDSREGLER ]
- Kutan og systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ]
- Hypomagnesæmi og mineralmetabolisme [se ADVARSLER OG FORHOLDSREGLER ]
- Fundiske kirtelpolypper [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Symptomatisk GERD og EE
Voksne
Sikkerheden af NEXIUM IV er baseret på resultater fra kliniske forsøg udført i fire forskellige populationer, herunder raske forsøgspersoner (n=204) og patienter med blødende mavesår eller duodenalsår (n=375). Dataene beskrevet nedenfor afspejler eksponering for NEXIUM 20 mg IV hos 359 patienter i aktivt kontrollerede forsøg: symptomatisk GERD med eller uden en historie med EE (n=199) og patienter med EE (n=160). Befolkningen var 18 til 77 år gammel; 45 % mænd, 52 % kaukasiske, 17 % sorte, 3 % asiatiske og 28 % anden race. De fleste patienter fik doser på enten 20 eller 40 mg enten som en infusion eller en injektion. Bivirkninger, der forekommer hos mindst 1 % af patienterne, er angivet nedenfor i tabel 3:
Intravenøs behandling med NEXIUM 20 mg IV 20 og 40 mg administreret som en injektion eller som en infusion viste sig at have en sikkerhedsprofil svarende til den for oral esomeprazol.
Pædiatri
Et randomiseret, åbent, multinationalt studie for at evaluere farmakokinetikken af gentagne intravenøse doser af NEXIUM IV én gang dagligt hos pædiatriske patienter fra 1 måned til 17 år inklusive blev udført [se KLINISK FARMAKOLOGI ]. Sikkerhedsresultaterne er i overensstemmelse med den kendte sikkerhedsprofil for esomeprazol, og ingen uventede sikkerhedssignaler blev identificeret.
Risikoreduktion af genblødning af mave- eller duodenalsår hos voksne
Dataene beskrevet i tabel 4 nedenfor afspejler eksponering for NEXIUM 20mg IV hos 375 patienter, som fik endoskopisk bekræftet mave- eller duodenalsårblødning i et placebokontrolleret forsøg. Befolkningen var 18 til 98 år gammel; 68 % mænd, 87 % kaukasiske, 1 % sorte, 7 % asiatiske og 4 % anden race. Efter endoskopisk hæmostase fik patienterne enten placebo eller 80 mg NEXIUM IV som en intravenøs infusion over 30 minutter efterfulgt af en kontinuerlig infusion på 8 mg/time i en samlet behandlingsvarighed på 72 timer. Efter den indledende 72-timers periode fik alle patienter en oral PPI i 27 dage.
Med undtagelse af reaktioner på injektionsstedet beskrevet ovenfor, viste det sig, at intravenøs behandling med NEXIUM 20 mg IV administreret som en injektion eller som en infusion har en sikkerhedsprofil svarende til den for oral esomeprazol.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af esomeprazol efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Blod og lymfesystem lidelser: agranulocytose, pancytopeni;
Øjenlidelser: sløret syn;
Gastrointestinale lidelser: pancreatitis; stomatitis; mikroskopisk colitis; fundic kirtel polypper;
Lever og galdeveje: leversvigt, hepatitis med eller uden gulsot;
Forstyrrelser i immunsystemet: anafylaktisk reaktion/chok; systemisk lupus erythematosus;
Infektioner og angreb: GI candidiasis;
Metabolisme og ernæringsforstyrrelser: hypomagnesæmi (kan føre til hypocalcæmi og/eller hypokaliæmi) [se ADVARSLER OG FORHOLDSREGLER ], hyponatriæmi;
Muskuloskeletale og bindevævslidelser: muskelsvaghed, myalgi, knoglebrud;
Forstyrrelser i nervesystemet: hepatisk encefalopati, smagsforstyrrelse;
Psykiatriske lidelser: aggression, agitation, depression, hallucinationer;
Nyre- og urinvejslidelser: interstitiel nefritis;
Reproduktionssystem og brystsygdomme: gynækomasti;
Åndedræts-, thorax- og mediastinale lidelser: bronkospasme;
Hud- og subkutane vævsforstyrrelser: alopeci, erythema multiforme, hyperhidrose, lysfølsomhed, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse (TEN, nogle dødelige), lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) og akut generaliseret eksantematøs pustulose (AGEP), kutan lupus erythematosus.
Bivirkninger forbundet med omeprazol kan også forventes at forekomme med NEXIUM IV Se den fulde ordinationsinformation for oral omeprazol for fuldstændig sikkerhedsinformation.
DRUGSINTERAKTIONER
Tabel 5 og 6 inkluderer lægemidler med klinisk vigtige lægemiddelinteraktioner og interaktion med diagnostik, når de administreres samtidig med esomeprazol og instruktioner til at forebygge eller håndtere dem.
Se mærkningen af samtidig anvendte lægemidler for at få yderligere oplysninger om interaktioner med PPI'er.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Tilstedeværelse af gastrisk malignitet
Hos voksne udelukker symptomatisk respons på behandling med NEXIUM IV ikke tilstedeværelsen af gastrisk malignitet. Overvej yderligere opfølgning og diagnostisk testning hos voksne patienter, som har suboptimalt respons eller et tidligt symptomatisk tilbagefald efter endt behandling med en PPI. Hos ældre patienter overveje også en endoskopi.
Akut Tubulointerstitiel nefritis
Akut tubulointerstitiel nefritis (TIN) er blevet observeret hos patienter, der tager PPI'er og kan forekomme på ethvert tidspunkt under PPI-behandling. Patienter kan vise sig med forskellige tegn og symptomer fra symptomatiske overfølsomhedsreaktioner til uspecifikke symptomer på nedsat nyrefunktion (f.eks. utilpashed, kvalme, anoreksi). I rapporterede tilfældeserier blev nogle patienter diagnosticeret på biopsi og i fravær af ekstrarenale manifestationer (f.eks. feber, udslæt eller artralgi). Seponer NEXIUM 20mg IV og evaluer patienter med mistanke om akut TIN [se KONTRAINDIKATIONER ].
Clostridium Difficile-associeret diarré
Publicerede observationsstudier tyder på, at PPI-behandling som NEXIUM 20mg IV kan være forbundet med en øget risiko for Clostridium difficile-associeret diarré, især hos indlagte patienter. Denne diagnose bør overvejes for diarré, der ikke forbedres [se BIVIRKNINGER ].
Patienter bør anvende den laveste dosis og korteste varighed af PPI-behandling, der er passende til den tilstand, der behandles.
Knoglebrud
Adskillige publicerede observationsstudier tyder på, at behandling med protonpumpehæmmere (PPI) kan være forbundet med en øget risiko for osteoporose-relaterede frakturer i hofte, håndled eller rygsøjle. Risikoen for fraktur var øget hos patienter, der fik høje doser, defineret som flere daglige doser, og langvarig PPI-behandling (et år eller længere). Patienter bør anvende den laveste dosis og korteste varighed af PPI-behandling, der er passende til den tilstand, der behandles. Patienter med risiko for osteoporose-relaterede frakturer bør behandles i henhold til etablerede behandlingsretningslinjer [se DOSERING OG ADMINISTRATION , BIVIRKNINGER ].
Alvorlige kutane bivirkninger
Alvorlige kutane bivirkninger, herunder Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) og akut generaliseret eksantematøs pustulose (AGEP) er blevet rapporteret i forbindelse med brugen af PPI'er [se BIVIRKNINGER ]. Seponer NEXIUM IV ved de første tegn eller symptomer på alvorlige kutane bivirkninger eller andre tegn på overfølsomhed og overvej yderligere evaluering.
Kutan og systemisk lupus erythematosus
Kutan lupus erythematosus (CLE) og systemisk lupus erythematosus (SLE) er blevet rapporteret hos patienter, der tager PPI'er, inklusive esomeprazol. Disse hændelser er opstået som både nyopstået og en forværring af eksisterende autoimmun sygdom. Størstedelen af PPI-inducerede lupus erythematosus tilfælde var CLE.
Den mest almindelige form for CLE rapporteret hos patienter behandlet med PPI'er var subakut CLE (SCLE) og forekom inden for uger til år efter kontinuerlig lægemiddelbehandling hos patienter lige fra spædbørn til ældre. Generelt blev histologiske fund observeret uden organinvolvering.
Systemisk lupus erythematosus (SLE) er mindre almindeligt rapporteret end CLE hos patienter, der får PPI'er. PPI-associeret SLE er normalt mildere end ikke-lægemiddelinduceret SLE. Indtræden af SLE forekom typisk inden for dage til år efter påbegyndelse af behandling, primært hos patienter lige fra unge voksne til ældre. Størstedelen af patienterne fik udslæt; dog blev der også rapporteret om artralgi og cytopeni.
Undgå administration af PPI'er i længere tid end medicinsk indiceret. Hvis der observeres tegn eller symptomer, der stemmer overens med CLE eller SLE hos patienter, der får NEXIUM 20mg IV, skal du seponere lægemidlet og henvise patienten til den relevante specialist for evaluering. De fleste patienter forbedres ved seponering af PPI alene i 4 til 12 uger. Serologiske test (f.eks. ANA) kan være positive, og forhøjede serologiske testresultater kan tage længere tid at løse end kliniske manifestationer.
Interaktion med Clopidogrel
Undgå samtidig brug af NEXIUM IV og clopidogrel. Clopidogrel er et prodrug. Hæmning af trombocytaggregation af clopidogrel skyldes udelukkende en aktiv metabolit. Metabolismen af clopidogrel til dets aktive metabolit kan forringes ved brug sammen med samtidig medicin, såsom esomeprazol, der hæmmer CYP2C19-aktivitet. Samtidig brug af clopidogrel og 40 mg esomeprazol reducerer den farmakologiske aktivitet af clopidogrel. Overvej alternativ trombocythæmmende behandling ved brug af NEXIUM IV [se DRUGSINTERAKTIONER ].
Hypomagnesæmi og mineralmetabolisme
Hypomagnesæmi, symptomatisk og asymptomatisk, er sjældent blevet rapporteret hos patienter behandlet med PPI i mindst tre måneder, i de fleste tilfælde efter et års behandling. Alvorlige bivirkninger omfatter tetany, arytmier og anfald. Hypomagnesæmi kan føre til hypocalcæmi og/eller hypokaliæmi og kan forværre underliggende hypocalcæmi hos risikopatienter. Hos de fleste patienter krævede behandling af hypomagnesiæmi magnesiumerstatning og seponering af PPI.
For patienter, der forventes at være i langvarig behandling, eller som tager PPI'er sammen med medicin såsom digoxin eller lægemidler, der kan forårsage hypomagnesæmi (f.eks. diuretika), kan sundhedspersonale overveje at overvåge magnesiumniveauer før påbegyndelse af PPI-behandling og periodisk [se BIVIRKNINGER ].
Overvej at monitorere magnesium- og calciumniveauer før påbegyndelse af NEXIUM IV og periodisk under behandling hos patienter med en allerede eksisterende risiko for hypocalcæmi (f.eks. hypoparathyroidisme). Suppler med magnesium og/eller calcium efter behov. Hvis hypocalcæmi er refraktær over for behandling, skal du overveje at seponere PPI.
Interaktion med perikon eller rifampin
Lægemidler, der inducerer CYP2C19 eller CYP3A4 (såsom perikon eller rifampin) kan nedsætte esomeprazol-koncentrationerne væsentligt [se DRUGSINTERAKTIONER ]. Undgå samtidig brug af NEXIUM 40mg IV med perikon eller rifampin.
Interaktioner med diagnostiske undersøgelser for neuroendokrine tumorer
Serumchromogranin A (CgA) niveauer stiger sekundært til lægemiddelinducerede fald i mavesyreindholdet. Det øgede CgA-niveau kan forårsage falske positive resultater i diagnostiske undersøgelser for neuroendokrine tumorer. Sundhedsudbydere bør midlertidigt stoppe behandlingen med esomeprazol mindst 14 dage før vurdering af CgA-niveauer og overveje at gentage testen, hvis de initiale CgA-niveauer er høje. Hvis der udføres serielle tests (f.eks. til overvågning), bør det samme kommercielle laboratorium bruges til test, da referenceintervaller mellem test kan variere [se DRUGSINTERAKTIONER ].
Interaktion med methotrexat
Litteraturen tyder på, at samtidig brug af PPI'er med methotrexat (primært i høje doser; se methotrexat-receptinformation) kan forhøje og forlænge serumniveauer af methotrexat og/eller dets metabolit, hvilket muligvis kan føre til methotrexat-toksicitet. Ved højdosis methotrexatadministration kan en midlertidig seponering af PPI overvejes hos nogle patienter [se DRUGSINTERAKTIONER ].
Fundiske kirtelpolypper
PPI-brug er forbundet med en øget risiko for fundiske kirtelpolypper, der øges ved langvarig brug, især ud over et år. De fleste PPI-brugere, som udviklede fundiske kirtelpolypper, var asymptomatiske, og fundiske kirtelpolypper blev identificeret ved endoskopi. Brug den korteste varighed af PPI-behandling, der passer til den tilstand, der behandles.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Esomeprazols karcinogene potentiale blev vurderet ved hjælp af omeprazolundersøgelser. I to 24-måneders orale karcinogenicitetsundersøgelser hos rotter, omeprazol i daglige doser på 1,7, 3,4, 13,8, 44,0 og 140,8 mg/kg/dag (ca. 0,4 til 34 gange den humane dosis på 40 mg/dag udtrykt på en kropsoverflade arealbasis) producerede gastriske ECL-cellecarcinoider på en dosisrelateret måde i både han- og hunrotter; forekomsten af denne effekt var markant højere hos hunrotter, som havde højere blodniveauer af omeprazol. Mavecarcinoider forekommer sjældent hos ubehandlede rotter. Derudover var ECL-cellehyperplasi til stede i alle behandlede grupper af begge køn. I en af disse undersøgelser blev hunrotter behandlet med 13,8 mg omeprazol/kg/dag (ca. 3,4 gange den humane dosis på 40 mg/dag på basis af kropsoverfladeareal) i 1 år, derefter fulgt i yderligere et år uden lægemidlet . Ingen carcinoider blev set hos disse rotter. En øget forekomst af behandlingsrelateret ECL-cellehyperplasi blev observeret i slutningen af 1 år (94 % behandlede vs. 10 % kontroller). Ved det andet år var forskellen mellem behandlede og kontrolrotter meget mindre (46 % vs. 26 %), men udviste stadig mere hyperplasi i den behandlede gruppe. Gastrisk adenocarcinom blev set hos én rotte (2%). Ingen lignende tumor blev set hos han- eller hunrotter behandlet i 2 år. For denne rottestamme er der ikke historisk set nogen lignende tumor, men et fund, der kun involverer én tumor, er vanskeligt at fortolke. En 78-ugers karcinogenicitetsundersøgelse med oral mus af omeprazol viste ikke øget tumorforekomst, men undersøgelsen var ikke afgørende.
Esomeprazol var negativ i Ames-mutationstesten, i in vivo-kromosomafvigelsestesten for rotteknoglemarvsceller og in vivo-mus mikronukleustesten. Esomeprazol var imidlertid positivt i in vitro human lymfocytkromosomafvigelsestest. Omeprazol var positiv i in vitro human lymfocytkromosomafvigelsestest, in vivo museknoglemarvscellekromosomafvigelsestest og in vivo musemikronukleustest.
De potentielle virkninger af esomeprazol på fertilitet og reproduktionsevne blev vurderet ved hjælp af omeprazolundersøgelser. Omeprazol ved orale doser på op til 138 mg/kg/dag hos rotter (ca. 34 gange den humane dosis på 40 mg/dag på basis af kropsoverfladeareal) viste sig ikke at have nogen effekt på reproduktionsevnen hos forældredyr.
Brug i specifikke populationer
Graviditet
Risikooversigt
Der er ingen tilstrækkelige og velkontrollerede undersøgelser med esomeprazol hos gravide kvinder. Esomeprazol er s-isomeren af omeprazol. Tilgængelige epidemiologiske data viser ikke en øget risiko for alvorlige medfødte misdannelser eller andre uønskede graviditetsudfald ved brug af omeprazol i første trimester. Reproduktionsundersøgelser hos rotter og kaniner resulterede i dosisafhængig embryodødelighed ved omeprazoldoser, der var ca. 3,4 til 34 gange en oral human dosis på 40 mg (baseret på et kropsoverfladeareal for en person på 60 kg).
Teratogenicitet blev ikke observeret i dyrereproduktionsundersøgelser med administration af oral esomeprazolmagnesium til rotter og kaniner med doser på henholdsvis ca. 68 gange og 42 gange en oral human dosis på 40 mg (baseret på kropsoverfladebasis for en person på 60 kg) . Ændringer i knoglemorfologi blev observeret hos afkom af rotter, der blev doseret gennem det meste af drægtighed og amning ved doser lig med eller større end ca. 34 gange en oral human dosis på 40 mg. Når moderens administration kun var begrænset til drægtighed, var der ingen virkninger på knoglefysisk morfologi hos afkommet på nogen alder (se Data ).
De estimerede baggrundsrisici for alvorlige fødselsdefekter og abort for den angivne population er ukendte. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Data
Menneskelige data
Esomeprazol er S-isomeren af omeprazol. Fire epidemiologiske undersøgelser sammenlignede hyppigheden af medfødte abnormiteter blandt spædbørn født af kvinder, der brugte omeprazol under graviditeten, med hyppigheden af abnormiteter blandt spædbørn af kvinder, der blev eksponeret for H2-receptorantagonister eller andre kontroller.
En populationsbaseret retrospektiv kohorte epidemiologisk undersøgelse fra det svenske medicinske fødselsregister, der dækkede ca. 99 % af graviditeterne, fra 1995 til 99, rapporterede om 955 spædbørn (824 eksponerede i første trimester, hvoraf 39 blev eksponeret efter første trimester, og 131 blev eksponeret efter første trimester), hvis mødre brugte omeprazol under graviditeten. Antallet af spædbørn, der blev eksponeret in utero for omeprazol, som havde nogen form for misdannelse, lav fødselsvægt, lav Apgar-score eller hospitalsindlæggelse svarede til det antal, der blev observeret i denne population. Antallet af spædbørn født med ventrikulære septumdefekter og antallet af dødfødte spædbørn var lidt højere hos de omeprazol-eksponerede spædbørn end det forventede antal i denne population.

Et populationsbaseret retrospektivt kohortestudie, der dækkede alle levendefødte i Danmark fra 1996 til 2009, rapporterede om 1.800 levendefødte, hvis mødre brugte omeprazol i graviditetens første trimester, og 837.317 levendefødte, hvis mødre ikke brugte nogen protonpumpehæmmer. Den samlede frekvens af fødselsdefekter hos spædbørn født af mødre med første trimester eksponering for omeprazol var 2,9 % og 2,6 % hos spædbørn født af mødre, der ikke blev udsat for nogen protonpumpehæmmer i første trimester.
En retrospektiv kohorteundersøgelse rapporterede om 689 gravide kvinder, der blev eksponeret for enten H2-blokkere eller omeprazol i første trimester (134 eksponerede for omeprazol) og 1.572 gravide kvinder, der ikke blev eksponeret for enten i første trimester. Den samlede misdannelsesrate hos afkom født af mødre med første trimester eksponering for omeprazol, en H2-blokker, eller var ueksponeret, var henholdsvis 3,6 %, 5,5 % og 4,1 %.
Et lille prospektivt observationelt kohortestudie fulgte 113 kvinder udsat for omeprazol under graviditeten (89 % med eksponeringer i første trimester). Den rapporterede hyppighed af større medfødte misdannelser var 4 % i omeprazolgruppen, 2 % i kontroller udsat for ikke-teratogener og 2,8 % i sygdomsparrede kontroller. Hyppigheden af spontane og elektive aborter, præmature fødsler, gestationsalder ved fødslen og gennemsnitlig fødselsvægt var ens blandt grupperne.
Adskillige undersøgelser har ikke rapporteret nogen synlige uønskede kortsigtede virkninger på spædbarnet, når enkeltdosis oral eller intravenøs omeprazol blev administreret til over 200 gravide kvinder som præmedicinering til kejsersnit under generel anæstesi.
Dyredata
Omeprazol
Reproduktionsundersøgelser udført med omeprazol hos rotter ved orale doser op til 138 mg/kg/dag (ca. 34 gange en oral human dosis på 40 mg på basis af kropsoverfladeareal) og i kaniner i doser op til 69,1 mg/kg/dag ( ca. 34 gange en oral human dosis på 40 mg på basis af kropsoverfladeareal) under organogenese afslørede ikke noget bevis for et teratogent potentiale af omeprazol. Hos kaniner gav omeprazol i et dosisområde på 6,9 til 69,1 mg/kg/dag (ca. 3,4 til 34 gange en oral human dosis på 40 mg på basis af kropsoverfladen) administreret under organogenese dosisrelaterede stigninger i embryodødelighed, føtale resorptioner og graviditetsforstyrrelser. Hos rotter blev dosisrelateret embryo/føtal toksicitet og postnatal udviklingstoksicitet observeret hos afkom som følge af forældre behandlet med omeprazol med 13,8 til 138,0 mg/kg/dag (ca. 3,4 til 34 gange en oral human dosis på 40 mg på en kropsoverflade arealbasis), indgivet før parring gennem laktationsperioden.
Esomeprazol
Der blev ikke observeret nogen effekt på embryo-føtal udvikling i reproduktionsundersøgelser med esomeprazolmagnesium hos rotter ved orale doser op til 280 mg/kg/dag (ca. 68 gange en oral human dosis på 40 mg på basis af kropsoverfladeareal) eller hos kaniner kl. orale doser op til 86 mg/kg/dag (ca. 41 gange den humane dosis på basis af kropsoverfladen) administreret under organogenese.
En præ- og postnatal udviklingstoksicitetsundersøgelse hos rotter med yderligere endepunkter for at evaluere knogleudvikling blev udført med esomeprazolmagnesium i orale doser på 14 til 280 mg/kg/dag (ca. 3,4 til 68 gange en oral human dosis på 40 mg på en krop overfladeareal). Neonatal/tidlig postnatal (fødsel til fravænning) overlevelse blev nedsat ved doser lig med eller større end 138 mg/kg/dag (ca. 34 gange en oral human dosis på 40 mg på basis af kropsoverfladeareal). Kropsvægt og kropsvægtforøgelse blev reduceret, og neuroadfærdsmæssige eller generelle udviklingsforsinkelser i den umiddelbare tidsramme efter fravænning var tydelige ved doser lig med eller større end 69 mg/kg/dag (ca. 17 gange en oral human dosis på 40 mg på en krop overfladeareal). Derudover blev der observeret nedsat lårbenslængde, bredde og tykkelse af kortikal knogle, nedsat tykkelse af tibial vækstplade og minimal til mild knoglemarvshypocellularitet ved doser lig med eller større end 14 mg/kg/dag (ca. 3,4 gange et oralt menneske) dosis på 40 mg på basis af kropsoverflade). Fysisk dysplasi i lårbenet blev observeret hos afkom fra rotter behandlet med orale doser af esomeprazolmagnesium i doser lig med eller større end 138 mg/kg/dag (ca. 34 gange en oral human dosis på 40 mg på basis af kropsoverfladeareal).
Effekter på moderens knogler blev observeret hos drægtige og diegivende rotter i et præ- og postnatalt toksicitetsstudie, når esomeprazolmagnesium blev administreret i orale doser på 14 til 280 mg/kg/dag (ca. 3,4 til 68 gange en oral human dosis på 40 mg pr. på basis af kropsoverfladeareal). Når rotter blev doseret fra svangerskabsdag 7 til fravænning på postnatal dag 21, blev der observeret et statistisk signifikant fald i moderens lårbensvægt på op til 14 % (sammenlignet med placebobehandling) ved doser lig med eller større end 138 mg/kg/dag (ca. 34 gange en oral human dosis på 40 mg på basis af kropsoverflade).
Et præ- og postnatalt udviklingsstudie med rotter med esomeprazol strontium (ved anvendelse af ækvimolære doser sammenlignet med esomeprazolmagnesiumundersøgelse) gav lignende resultater hos moderdyr og unger som beskrevet ovenfor.
En opfølgende udviklingstoksicitetsundersøgelse hos rotter med yderligere tidspunkter til evaluering af ungens knogleudvikling fra postnatal dag 2 til voksenalderen blev udført med esomeprazolmagnesium i orale doser på 280 mg/kg/dag (ca. 68 gange en oral human dosis på 40 mg på på basis af kropsoverfladeareal), hvor administration af esomeprazol var fra enten svangerskabsdag 7 eller svangerskabsdag 16 indtil fødslen. Når moderadministration kun var begrænset til graviditet, var der ingen virkninger på knoglefysisk morfologi hos afkommet på nogen alder.
Amning
Risikooversigt
Esomeprazol er S-isomeren af omeprazol, og begrænsede data tyder på, at omeprazol kan være til stede i human mælk. Der er ingen kliniske data om virkningen af esomeprazol på det ammede spædbarn eller på mælkeproduktionen. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for NEXIUM 20mg og eventuelle negative virkninger på det ammede spædbarn fra NEXIUM eller fra den underliggende moderens tilstand.
Pædiatrisk brug
Sikkerheden og effektiviteten af NEXIUM 20 mg IV er blevet fastslået hos pædiatriske patienter i alderen 1 måned til 17 år til korttidsbehandling af GERD med EE, som et alternativ til oral behandling, når oral NEXIUM 40 mg ikke er mulig eller passende.
Anvendelse af NEXIUM 40mg IV i denne aldersgruppe er baseret på ekstrapolering af virkning hos voksne til børn og udvælgelse af dosis baseret på eksponeringsmatchning af pædiatri til voksne understøttet af følgende evidens: a) resultater observeret fra en farmakokinetisk (PK) undersøgelse på NEXIUM 20mg IV til injektion hos pædiatriske patienter, b) forudsigelser fra en populations-PK-model, der sammenligner IV PK-data mellem voksne og pædiatriske patienter, og c) sammenhæng mellem eksponering og farmakodynamiske resultater opnået fra voksen IV og pædiatriske orale data og d) PK-resultater fra tilstrækkelige og velkontrollerede undersøgelser, der understøttede godkendelsen af NEXIUM 40mg IV hos voksne [se BIVIRKNINGER , KLINISK FARMAKOLOGI , Kliniske Studier ].
Sikkerheden og effektiviteten af NEXIUM IV er ikke blevet fastslået hos patienter under 1 måned til behandling af GERD med EE eller til risikoreduktion af genblødning af mavesår eller duodenalsår efter terapeutisk endoskopi.
Data om unge dyr
I et toksicitetsstudie for juvenile rotter blev esomeprazol administreret sammen med både magnesium- og strontiumsalte i orale doser ca. 34 til 68 gange en daglig dosis på 40 mg til mennesker baseret på kropsoverfladeareal. Forøgelser i dødsfald blev set ved den høje dosis, og ved alle doser af esomeprazol var der fald i kropsvægt, vægtøgning, lårbensvægt og lårbenslængde og fald i den samlede vækst [se Ikke-klinisk toksikologi ].
Geriatrisk brug
et klinisk forsøg med patienter med blødende mavesår eller duodenalsår var 52 % af 375 patienter randomiseret til NEXIUM IV 65 år og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed og effekt mellem ældre og yngre personer, og anden rapporteret klinisk erfaring med NEXIUM 40mg IV og oral esomeprazol har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre personer kan ikke påvises. udelukket.
Nedsat leverfunktion
GERD Med EE
Eksponering for esomeprazol var øget væsentligt hos patienter med svært nedsat leverfunktion (Child-Pugh klasse C), men ikke hos patienter med let til moderat nedsat leverfunktion (Child-Pugh Klasse A og B) sammenlignet med patienter med normal leverfunktion [se KLINISK FARMAKOLOGI ].
For voksne patienter er dosisjustering ikke nødvendig for let til moderat nedsat leverfunktion. For patienter med svært nedsat leverfunktion er den maksimalt anbefalede dosis 20 mg én gang dagligt [se DOSERING OG ADMINISTRATION ].
Risikoreduktion af genblødning af mave- eller duodenalsår efter terapeutisk endoskopi
Der er ingen tilgængelige farmakokinetiske data for NEXIUM 20mg IV administreret som kontinuerlig intravenøs administration til patienter med nedsat leverfunktion. Eksponering for intravenøs omeprazol, hvoraf esomeprazol er en enantiomer, steg hos patienter med alle grader af nedsat leverfunktion sammenlignet med personer med normal leverfunktion [se KLINISK FARMAKOLOGI ].
For voksne patienter er dosisjustering af den initiale NEXIUM IV 80 mg startdosis ikke nødvendig for patienter med nogen grad af nedsat leverfunktion. Reducer hastigheden af den kontinuerlige infusion til 6 mg/time for patienter med let til moderat nedsat leverfunktion (Child-Pugh klasse A og B) og til 4 mg/time for patienter med svært nedsat leverfunktion (Child-Pugh klasse C) [se DOSERING OG ADMINISTRATION ].
OVERDOSIS
Symptomerne beskrevet i forbindelse med bevidst NEXIUM 40 mg overdosis (begrænset erfaring med doser over 240 mg/dag) er forbigående. Rapporter om overdosering med omeprazol hos mennesker kan også være relevante. Doserne varierede op til 2.400 mg (120 gange den sædvanlige anbefalede kliniske dosis). Manifestationerne var varierende, men omfattede forvirring, døsighed, sløret syn, takykardi, kvalme, diaforese, rødmen, hovedpine, mundtørhed og andre bivirkninger svarende til dem, der ses ved anbefalede doser. Se den fulde ordinationsinformation for oral omeprazol for fuldstændig sikkerhedsinformation. Der kendes ingen specifik modgift til esomeprazol. Da esomeprazol er udstrakt proteinbundet, forventes det ikke at blive fjernet ved dialyse. I tilfælde af overdosering skal behandlingen være symptomatisk og støttende.
Hvis der opstår overeksponering, skal du ringe til dit giftkontrolcenter på 1-800-222-1222 for aktuelle oplysninger om håndtering af forgiftning eller overdosering.
KONTRAINDIKATIONER
- NEXIUM 20mg IV er kontraindiceret til patienter med kendt overfølsomhed over for substituerede benzimidazoler eller over for en hvilken som helst komponent i formuleringen. Overfølsomhedsreaktioner kan omfatte anafylaksi, anafylaktisk shock, angioødem, bronkospasme, akut tubulointerstitiel nefritis og nældefeber [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ].
- Protonpumpehæmmere (PPI'er), inklusive NEXIUM 20mg IV, er kontraindiceret hos patienter, der får rilpivirinholdige produkter [se DRUGSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Esomeprazol tilhører en klasse af antisekretoriske forbindelser, de substituerede benzimidazoler, som undertrykker mavesyresekretion ved specifik inhibering af H+/K+ ATPase-enzymsystemet ved den sekretoriske overflade af maveparietalcellen. Esomeprazol protoneres og omdannes i den sure del af parietalcellen og danner den aktive hæmmer, det achirale sulfenamid. Fordi dette enzymsystem betragtes som syrepumpen (proton) i maveslimhinden, er esomeprazol blevet karakteriseret som en mavesyrepumpehæmmer, idet det blokerer det sidste trin i syreproduktionen. Denne effekt er dosisrelateret og fører til hæmning af både basal og stimuleret syresekretion uanset stimulus.
Farmakodynamik
Antisekretorisk aktivitet
Effekten af esomeprazol på 24-timers intragastrisk pH hos raske forsøgspersoner blev evalueret i to undersøgelser med 20 mg og 40 mg NEXIUM 20 mg IV infunderet intravenøst én gang dagligt over 30 minutter i 5 dage, som vist i tabel 7.
Effekten af esomeprazol på 24-timers intragastrisk pH efter administration af en intravenøs infusion af 80 mg NEXIUM.IV over 30 minutter efterfulgt af en kontinuerlig infusion på 8 mg/time i 23,5 timer blev evalueret i to undersøgelser.
Hos H. pylori-negative raske kaukasiske forsøgspersoner (n=24), var den procentvise tid over 24 timer (95 % CI), når den intragastriske pH var > 6 og > 7, 52,3 % (40,3, 64,4) og 4,8 % (1,8, 7.8).
Hos H. pylori-positive (n=8) og H. pylori-negative (n=11) raske kinesiske forsøgspersoner var den procentvise tid over 24 timer (95 % CI), når den intragastriske pH var > 6 og > 7, 53 % ( 45,6, 60,3) og 15,1 % (9,5, 20,7). Procentdelen af tid med intragastrisk pH > 6 [59 % vs. 47 %] og med pH > 7 [17 % vs. 11 %] havde en tendens til at være større hos de H. pylori-positive forsøgspersoner sammenlignet med H. pylori-negative forsøgspersoner.
Serum Gastrin Effekter
Effekten af esomeprazol på serumgastrinkoncentrationer blev evalueret hos ca. 2.700 patienter i kliniske forsøg med oral esomeprazol i op til 8 uger og hos over 1.300 patienter behandlet i op til 12 måneder. Det gennemsnitlige fastende gastrinniveau steg på en dosisrelateret måde. Stigningen i serumgastrinkoncentrationer nåede et plateau inden for to til tre måneder efter behandlingen og vendte tilbage til baseline-niveauer inden for fire uger efter seponering af behandlingen.
Øget gastrin forårsager enterochromaffin-lignende cellehyperplasi og øgede serumchromogranin A (CgA) niveauer. De øgede CgA-niveauer kan forårsage falske positive resultater i diagnostiske undersøgelser for neuroendokrine tumorer [se ADVARSLER OG FORHOLDSREGLER ].
Enterochromaffin-lignende (ECL) celleeffekter
Der er ingen tilgængelige data om virkningen af intravenøs esomeprazol på ECL-celler.
Human gastrisk biopsiprøver er blevet opnået fra mere end 3.000 patienter (både børn og voksne) behandlet oralt med omeprazol i langtids kliniske forsøg. Forekomsten af ECL-cellehyperplasi i disse undersøgelser steg med tiden; dog er der ikke fundet nogen tilfælde af ECL-celle carcinoider, dysplasi eller neoplasi hos disse patienter [se Ikke-klinisk toksikologi ].
Hos over 1.000 patienter behandlet med oral esomeprazol (10 mg, 20 mg eller 40 mg/dag) i op til 12 måneder, steg prævalensen af ECL-cellehyperplasi med tiden og dosis. Ingen patient udviklede ECL-cellecarcinoider, dysplasi eller neoplasi i maveslimhinden.
Endokrine virkninger
Esomeprazol havde ingen effekt på skjoldbruskkirtelfunktionen, når det blev givet i orale doser på 20 mg eller 40 mg i 4 uger. Andre virkninger af esomeprazol på det endokrine system blev vurderet i undersøgelser af omeprazol. Orale doser af omeprazol 30 mg eller 40 mg dagligt i 2 til 4 uger havde ingen effekt på kulhydratmetabolisme, cirkulerende niveauer af parathyreoideahormon, cortisol, østradiol, testosteron, prolaktin, cholecystokinin eller sekretin.
Farmakokinetik
Absorption
Esomeprazols farmakokinetik hos raske forsøgspersoner efter administration af NEXIUM IV 20 mg og 40 mg én gang dagligt som intravenøs infusion over 30 minutter i 5 dage er vist i tabel 8.
Efter intravenøs administration af NEXIUM 40 mg IV til 24 raske forsøgspersoner som en startdosis på 80 mg over 30 minutter efterfulgt af en kontinuerlig infusion på 8 mg/time i 23,5 timer (i alt 24 timer), esomeprazols farmakokinetiske parametre [geometrisk middelværdi (95 % CI)] var som følger: AUCt 111,1 mikromol*t/L (100,5, 122,7 mikromol*t/L), Cmax 15,0 mikromol/L (13,5, 16,6 mikromol/L) og steady state plasmakoncentration (Css) 3,9 mikromol/L (3,5, 4,5 mikromol/L). I en anden undersøgelse af raske kaukasiske forsøgspersoner fik samme behandlingsregime.
Esomeprazol er en tidsafhængig hæmmer af CYP2C19, hvilket resulterer i autohæmning og ikke-lineær farmakokinetik. Den systemiske eksponering stiger mere end dosisproportionalt efter flere orale doser af esomeprazol. Sammenlignet med den første dosis steg den systemiske eksponering (Cmax og AUC0-24 timer) ved steady state efter dosering én gang dagligt med henholdsvis 43 % og 90 % sammenlignet med efter den første dosis for 20 mg dosis og steg med 95 %. og 159 % for 40 mg dosis.
Fordeling
Esomeprazol er 97 % bundet til plasmaproteiner. Plasmaproteinbinding er konstant over koncentrationsområdet fra 2 til 20 mikromol/L. Det tilsyneladende distributionsvolumen ved steady state hos raske forsøgspersoner er ca. 16 l.
Elimination
Metabolisme
Esomeprazol metaboliseres i vid udstrækning i leveren af cytochrom P450 (CYP) enzymsystemet. Metabolitterne af esomeprazol mangler antisekretorisk aktivitet. Størstedelen af esomeprazols metabolisme er afhængig af CYP2C19 isoenzymet, som danner hydroxy- og desmethylmetabolitterne. Den resterende mængde er afhængig af CYP3A4, som danner sulfonmetabolitten.
Udskillelse
Esomeprazol udskilles som metabolitter primært i urinen, men også i fæces. Mindre end 1% af moderlægemidlet udskilles i urinen. Esomeprazol elimineres fuldstændigt fra plasma, og der er ingen akkumulering ved administration én gang daglig. Plasmaelimineringshalveringstiden for esomeprazol efter intravenøs administration af NEXIUM IV er ca. 1,1 til 1,4 timer og forlænges med stigende doser.
Plasmaclearance (CL) er ca. 5,9 til 7,2 l/time under administration af NEXIUM 40 mg IV som en intravenøs infusion på 80 mg over 30 minutter efterfulgt af en kontinuerlig infusion på 8 mg/time i 23,5 timer.
Specifikke populationer
Geriatriske patienter
AUC- og Cmax-værdierne for esomeprazol var lidt højere (henholdsvis 25 % og 18 %) hos ældre sammenlignet med yngre forsøgspersoner ved steady state. Denne stigning i eksponering anses ikke for at være klinisk relevant.
Pædiatriske patienter
Esomeprazols farmakokinetik blev evalueret hos 50 pædiatriske patienter fra fødslen til 17 år inklusive (hvoraf 44 pædiatriske patienter var 1 måned til 17 år) i et randomiseret, åbent, multinationalt flerdosisstudie på 20 mg NEXIUM 40 mg IV indgivet som en 3-minutters intravenøs injektion én gang dagligt. Esomeprazols plasma-AUC-værdier var 183 % og 60 % højere hos pædiatriske patienter i alderen henholdsvis 6 til 11 år og 12 til 17 år sammenlignet med voksne.
Efterfølgende farmakokinetiske analyser forudsagde, at følgende doseringsregimer ville opnå sammenlignelige steady-state plasmaeksponeringer (AUC0-24) med dem, der blev observeret hos voksne patienter administreret 20 mg NEXIUM IV én gang dagligt: 0,5 mg/kg én gang dagligt for pædiatriske patienter 1 måned til 11 måneder alder, 10 mg én gang dagligt for pædiatriske patienter 1 år til 17 år med en kropsvægt på mindre end 55 kg og 20 mg én gang dagligt for pædiatriske patienter på 1 år til 17 år med en kropsvægt på 55 kg og derover. Forøgelse af infusionsvarigheden fra 3 minutter til 10 minutter eller 30 minutter blev forudsagt at give steady-state Cmax-værdier, der var sammenlignelige med dem, der blev observeret hos voksne patienter ved henholdsvis 40 mg og 20 mg NEXIUM IV-doser [se Brug i specifikke populationer ].
Mandlige og kvindelige patienter
AUC- og Cmax-værdierne for esomeprazol var lidt højere (13 %) hos kvinder end hos mænd ved steady state, når de blev doseret oralt. Lignende forskelle er set for intravenøs administration af esomeprazol. Denne stigning i eksponering anses ikke for at være klinisk relevant.
Patienter med nedsat nyrefunktion
Esomeprazols farmakokinetik hos patienter med nedsat nyrefunktion forventes ikke at blive ændret i forhold til raske forsøgspersoner, da mindre end 1 % af esomeprazol udskilles uændret i urinen.
Patienter med nedsat leverfunktion
Esomeprazols steady state-farmakokinetik opnået efter administration af 40 mg oralt én gang dagligt til 4 patienter hver med let (Child-Pugh Klasse A), moderat (Child-Pugh Klasse B) og svær (Child-Pugh Klasse C) leverinsufficiens var sammenlignet med dem opnået hos 36 mandlige og kvindelige GERD-patienter med normal leverfunktion. Hos patienter med let og moderat nedsat leverfunktion var AUC'erne inden for det område, der kunne forventes hos patienter med normal leverfunktion. Hos patienter med svært nedsat leverfunktion var AUC'erne 2 til 3 gange højere end hos patienter med normal leverfunktion. [se Brug i specifikke populationer ].
Der er ingen tilgængelige farmakokinetiske data for esomeprazol administreret som kontinuerlig intravenøs administration til patienter med nedsat leverfunktion. Farmakokinetikken for intravenøs omeprazol 80 mg infunderet over 30 minutter efterfulgt af 8 mg/time over 47,5 timer hos patienter med mild (Child-Pugh Klasse A; n=5), moderat (Child-Pugh Klasse B; n=4) og alvorlig (Child-Pugh klasse C; n=3) nedsat leverfunktion blev sammenlignet med dem, der blev opnået hos 24 mandlige og kvindelige raske forsøgspersoner. Hos patienter med let og moderat nedsat leverfunktion var omeprazol-clearance og steady state-plasmakoncentrationen henholdsvis ca. 35 % lavere og 50 % højere end hos raske forsøgspersoner. Hos patienter med svær leverinsufficiens var omeprazolclearance 50 % af clearance hos raske forsøgspersoner, og steady state plasmakoncentrationen var dobbelt så stor som hos raske forsøgspersoner [se Brug i specifikke populationer ].
Lægemiddelinteraktionsstudier
Effekt af Esomeprazol/Omeprazol på andre lægemidler
In vitro og in vivo undersøgelser har vist, at esomeprazol sandsynligvis ikke hæmmer CYP 1A2, 2A6, 2C9, 2D6, 2E1 og 3A4.
Antiretrovirale midler
For nogle antiretrovirale lægemidler, såsom rilpivirin, atazanavir og nelfinavir, er nedsatte serumkoncentrationer blevet rapporteret, når de gives sammen med omeprazol [se DRUGSINTERAKTIONER ].
Rilpivirin
Efter flere doser af rilpivirin (150 mg, dagligt) og omeprazol (20 mg, dagligt), blev AUC reduceret med 40 %, Cmax med 40 % og Cmin med 33 % for rilpivirin [se KONTRAINDIKATIONER ].
Nelfinavir
Efter gentagne doser af nelfinavir (1250 mg, to gange dagligt) og omeprazol (40 mg dagligt), faldt AUC med 36 % og 92 %, Cmax med 37 % og 89 % og Cmin med henholdsvis 39 % og 75 % for nelfinavir og M8 .
Atazanavir
Efter flere doser af atazanavir (400 mg, dagligt) og omeprazol (40 mg, dagligt, 2 timer før atazanavir), faldt AUC med 94 %, Cmax med 96 % og Cmin med 95 %.
Saquinavir
Efter gentagen dosering af saquinavir/ritonavir (1000/100 mg) to gange dagligt i 15 dage med omeprazol 40 mg dagligt administreret samtidigt dag 11 til 15. AUC blev øget med 82 %, Cmax med 75 % og Cmin med 106 %. Mekanismen bag denne interaktion er ikke fuldt belyst.
Clopidogrel
I et crossover-studie fik raske forsøgspersoner clopidogrel (300 mg startdosis efterfulgt af 75 mg dagligt som vedligeholdelsesdosis i 28 dage) alene og sammen med esomeprazol (40 mg oralt én gang dagligt på samme tid som clopidogrel) i 29 dage. Eksponering for den aktive metabolit af clopidogrel blev reduceret med 35 % til 40 % i løbet af denne periode, når clopidogrel og esomeprazol blev administreret sammen. Farmakodynamiske parametre blev også målt og viste, at ændringen i hæmning af trombocytaggregation var relateret til ændringen i eksponeringen for den aktive clopidogrel-metabolit [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER ].
Mycophenolatmofetil
Administration af omeprazol 20 mg to gange dagligt i 4 dage og en enkelt 1000 mg dosis af MMF cirka en time efter den sidste dosis af omeprazol til 12 raske forsøgspersoner i en cross-over undersøgelse resulterede i en 52 % reduktion i Cmax og 23 % reduktion i AUC for MPA [se DRUGSINTERAKTIONER ].
Cilostazol
Omeprazol virker som en hæmmer af CYP2C19. Omeprazol, givet i doser på 40 mg dagligt i en uge til 20 raske forsøgspersoner i cross-over-undersøgelse, øgede Cmax og AUC for cilostazol med henholdsvis 18 % og 26 %. Cmax og AUC for en af de aktive metabolitter, 3,4-dihydro-cilostazol, som har 4-7 gange aktiviteten af cilostazol, blev øget med henholdsvis 29 % og 69 %. Samtidig administration af cilostazol og omeprazol forventes at øge koncentrationerne af cilostazol og den ovennævnte aktive metabolit [se DRUGSINTERAKTIONER ].
Diazepam
Samtidig administration af esomeprazol 30 mg og diazepam, et CYP2C19-substrat, resulterede i et fald på 45 % i clearance af diazepam. Forhøjede plasmaniveauer af diazepam blev observeret 12 timer efter dosering og fremefter. På det tidspunkt var plasmaniveauerne af diazepam imidlertid under det terapeutiske interval, og det er derfor usandsynligt, at denne interaktion er af klinisk relevans.
Digoxin
Samtidig administration af omeprazol 20 mg én gang dagligt og digoxin hos raske forsøgspersoner øgede biotilgængeligheden af digoxin med 10 % (30 % hos to forsøgspersoner) [se DRUGSINTERAKTIONER ].
Andre stoffer
Samtidig administration af esomeprazol og enten naproxen (ikke-selektivt NSAID) identificerede ingen klinisk relevante ændringer i de farmakokinetiske profiler af disse NSAID'er.
Virkning af andre lægemidler på Esomeprazol/Omeprazol
St. John's Wort
et cross-over-studie med 12 raske mandlige forsøgspersoner reducerede perikon (300 mg tre gange dagligt i 14 dage) signifikant den systemiske eksponering af omeprazol hos CYP2C19-fattige metabolisatorer (Cmax og AUC faldt med 37,5 % og 37,9 %) og omfattende metabolisatorer (Cmax og AUC faldt med henholdsvis 49,6 % og 43,9 %) [se DRUGSINTERAKTIONER ].
Voriconazol
Samtidig administration af omeprazol og voriconazol (en kombineret hæmmer af CYP2C19 og CYP3A4) resulterede i mere end en fordobling af eksponeringen for omeprazol. Når voriconazol (400 mg hver 12. time i én dag, efterfulgt af 200 mg én gang dagligt i 6 dage) blev givet sammen med omeprazol (40 mg én gang dagligt i 7 dage) til raske forsøgspersoner, var steady-state Cmax og AUC0-24 for omeprazol. signifikant forøget: i gennemsnit henholdsvis 2 gange (90 % CI: 1,8, 2,6) og 4 gange (90 % CI: 3,3, 4,4) sammenlignet med når omeprazol blev givet uden voriconazol [se DRUGSINTERAKTIONER ].
Andre stoffer
Samtidig administration af esomeprazol og orale præventionsmidler, diazepam, phenytoin, quinidin, naproxen (ikke-selektivt NSAID) så ikke ud til at ændre den farmakokinetiske profil af esomeprazol.
Mikrobiologi
Effekter på gastrointestinal mikrobiel økologi
Nedsat mavesyreindhold på grund af nogen midler, herunder protonpumpehæmmere, øger mavetallet af bakterier, der normalt er til stede i mave-tarmkanalen. Behandling med protonpumpehæmmere kan medføre let øget risiko for mave-tarminfektioner som Salmonella og Campylobacter og, hos indlagte patienter, muligvis også Clostridium difficile.
Farmakogenomi
CYP2C19, et polymorft enzym, er involveret i metabolismen af esomeprazol. CYP2C19*1-allelen er fuldt funktionel, mens CYP2C19*2- og *3-allelerne er ikke-funktionelle. Der er andre alleler forbundet med ingen eller nedsat enzymatisk funktion. Patienter, der bærer to fuldt funktionelle alleler, er omfattende metabolisatorer, og dem, der bærer to alleler med tab af funktion, er dårlige metabolisatorer. Den systemiske eksponering for esomeprazol varierer med en patients stofskiftestatus: dårlige metabolisatorer > intermediære metabolisatorer > omfattende metabolisatorer. Ca. 3 % af kaukasiere og 15 til 20 % af asiatere er CYP2C19-fattige metabolisatorer.
Systemisk eksponering for esomeprazol var beskedent højere (ca. 17 %) hos CYP2C19-mellemmetabolisatorer (IM; n=6) sammenlignet med omfattende metabolisatorer (EM; n=17) af CYP2C19. Lignende farmakokinetiske forskelle blev noteret på tværs af disse genotyper i en undersøgelse af kinesiske raske forsøgspersoner, der inkluderede 7 EM'er og 11 IM'er. Der er meget begrænset farmakokinetisk information for dårlige metabolisatorer (PM) fra disse undersøgelser.
Ved steady state efter én gang daglig administration af NEXIUM 40 mg IV 40 mg er forholdet mellem AUC i dårlige metabolisatorer og AUC i resten af befolkningen (EM'er) ca. 1,5. Denne ændring i eksponering anses ikke for at være klinisk meningsfuld.
Dyretoksikologi og/eller farmakologi
Reproduktionsstudier
Reproduktionsundersøgelser er blevet udført på rotter ved orale doser op til 280 mg/kg/dag (ca. 68 gange en oral human dosis på 40 mg på basis af kropsoverfladeareal) og på kaniner ved orale doser op til 86 mg/kg/dag (ca. 42 gange en oral human dosis på 40 mg på kropsoverfladebasis) og har ikke afsløret tegn på nedsat fertilitet eller skade på fosteret på grund af esomeprazol [se Brug i specifikke populationer ].
Undersøgelse af unge dyr
Et 28-dages toksicitetsstudie med en 14-dages restitutionsfase blev udført i unge rotter med esomeprazolmagnesium i doser på 70 til 280 mg/kg/dag (ca. 17 til 68 gange en daglig oral human dosis på 40 mg på en kropsoverflade arealgrundlag). En stigning i antallet af dødsfald ved den høje dosis på 280 mg/kg/dag blev observeret, når unge rotter fik esomeprazolmagnesium fra postnatal dag 7 til postnatal dag 35. Derudover doser lig med eller større end 140 mg/kg/ dag (ca. 34 gange en daglig oral human dosis på 40 mg på basis af kropsoverfladeareal), gav behandlingsrelaterede fald i kropsvægt (ca. 14 %) og vægtøgning, fald i lårbensvægt og lårbenslængde og påvirkede generelt vækst. Sammenlignelige resultater beskrevet ovenfor er også blevet observeret i denne undersøgelse med et andet esomeprazolsalt, esomeprazol strontium, ved ækvimolære doser af esomeprazol.
Kliniske Studier
Syreundertrykkelse i GERD
Fire multicenter, open-label, to-perioders crossover-studier blev udført for at sammenligne de farmakodynamiske virkninger af esomeprazol efter intravenøs eller oral administration på syreundertrykkelse hos 206 patienter med symptomer på GERD med eller uden erosiv esophagitis. Patienterne blev randomiseret til at modtage enten 20 eller 40 mg NEXIUM 40 mg IV eller oral esomeprazol én gang dagligt i 10 dage (periode 1), og blev derefter skiftet i periode 2 til den anden formulering i 10 dage, hvilket matchede deres respektive dosis fra periode 1. NEXIUM 40 mg IV 20 mg og 40 mg blev administreret som en 3-minutters injektion i to af undersøgelserne og som en 15-minutters infusion i de to andre undersøgelser.
Patientpopulationen varierede fra 18 til 72 år gammel; 54 % var kvinder; 53 % kaukasiske, 24 % sorte, 5 % asiatiske og 17 % anden race. Basalsyreproduktion (BAO) og maksimal syreproduktion (MAO) blev bestemt 22 til 24 timer efter dosis på periode 1, dag 11; på periode 2, dag 3; og på periode 2, dag 11. BAO og MAO blev estimeret ud fra 1-times kontinuerlige opsamlinger af maveindhold før og efter (henholdsvis) subkutan injektion af 6,0 mcg/kg pentagastrin.
I disse undersøgelser svarede NEXIUM IV 20 mg og 40 mg efter 10 dages administration én gang dagligt til den tilsvarende orale dosis af esomeprazol i deres evne til at undertrykke BAO og MAO hos disse GERD-patienter (se tabel 9 nedenfor).
Der var ingen større ændringer i syreundertrykkelsen ved skift mellem intravenøse og orale doseringsformer.
Blødende mave- eller duodenalsår
Et randomiseret, dobbeltblindt, placebokontrolleret klinisk studie blev udført med 764 patienter, som fik endoskopisk bekræftet mave- eller duodenalsårblødning. Befolkningen var 18 til 98 år gammel; 68 % var mænd, 87 % kaukasiske, 1 % sorte, 7 % asiatiske og 4 % anden race. Efter endoskopisk hæmostase blev patienterne randomiseret til enten placebo eller NEXIUM IV 80 mg som en intravenøs infusion over 30 minutter efterfulgt af en kontinuerlig infusion på 8 mg/time i i alt 72 timer. Efter den indledende 72-timers periode fik alle patienter en oral PPI i 27 dage. Forekomsten af genblødning inden for 3 dage efter randomisering var 5,9 % i den NEXIUM 20 mg IV-behandlede gruppe sammenlignet med 10,3 % for placebogruppen (behandlingsforskel -4,4 %; 95 % konfidensinterval: -8,3 %, -0,6 %; p=0,03 ). Denne behandlingsforskel svarede til den, der blev observeret på dag 7 og dag 30, hvor alle patienter modtog en oral PPI.
Et randomiseret, dobbeltblindt, placebokontrolleret enkeltcenter-studie udført i Hong Kong viste også en reduktion sammenlignet med placebo i risikoen for genblødning inden for 72 timer hos patienter med blødende mavesår eller duodenalsår, som fik racemisk omeprazol, hvoraf 50 % er S-enantiomeren esomeprazol.
PATIENTOPLYSNINGER
Bivirkninger
Rådgiv patienterne om at rapportere til deres sundhedsplejerske, hvis de oplever tegn eller symptomer i overensstemmelse med:
- Overfølsomhedsreaktioner [se KONTRAINDIKATIONER ]
- Akut Tubulointerstitiel nefritis [se ADVARSLER OG FORHOLDSREGLER ]
- Clostridium difficile-associeret diarré [se ADVARSLER OG FORHOLDSREGLER ]
- Knoglebrud [se ADVARSLER OG FORHOLDSREGLER ]
- Alvorlige kutane bivirkninger [se ADVARSLER OG FORHOLDSREGLER ].
- Kutan og systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ]
- Hypomagnesæmi og mineralmetabolisme [se ADVARSLER OG FORHOLDSREGLER ]
Lægemiddelinteraktioner
Rådgive patienter om at rapportere til deres sundhedsplejerske, før de starter behandling med nogen af følgende:
- Rilpivirin-holdige produkter [se KONTRAINDIKATIONER ]
- Clopidogrel [se ADVARSLER OG FORHOLDSREGLER ]
- Perikum eller rifampin [se ADVARSLER OG FORHOLDSREGLER ]
- Højdosis methotrexat [se ADVARSLER OG FORHOLDSREGLER ]
Administration
- Informer patienterne om, at antacida kan anvendes, mens de tager NEXIUM 40mg IV
