Rhinocort 100mcg Budesonide Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Rhinocort Aqua, og hvordan bruges det?
Rhinocort Aqua (budesonid) næsespray er et steroid, der bruges til at behandle næsesymptomer såsom tilstopning, nysen og løbende næse forårsaget af sæsonbestemt eller året rundt allergi. Rhinocort Aqua næsespray bruges også til at forhindre næsepolypper i at vende tilbage efter kirurgisk fjernelse.
Hvad er bivirkninger af Rhinocort 100mcg Aqua?
Almindelige bivirkninger af Rhinocort Aqua næsespray omfatter:
- tør næse/hals eller irritation,
- ondt i halsen,
- hoste,
- nyser,
- næseblod,
- ubehagelig smag/lugt,
- sår eller hvide pletter inde i eller omkring din næse, eller
- smerte, hævelse, svie, kløe eller irritation omkring din næse.
Fortæl din læge, hvis du har sjældne, men alvorlige bivirkninger af Rhinocort Aqua næsespray, herunder:
- tab af smag eller lugt, eller
- smerter eller sår i næsen.
BESKRIVELSE
Budesonid, den aktive ingrediens i RHINOCORT AQUA (budesonid) næsespray, er et anti-inflammatorisk syntetisk kortikosteroid.
Det er kemisk betegnet som (RS)-11-beta, 16-alpha, 17, 21-tetrahydroxypregna-l,4-dien-3,20-dion cyklisk 16, 17-acetal med butyraldehyd.
Budesonid leveres som blandingen af to epimerer (22R og 22S).
Den empiriske formel for budesonid er C25H34O6 og dens molekylvægt er 430,5.
Dens strukturformel er:
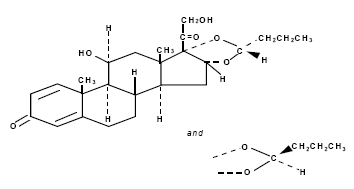
Budesonid er et hvidt til råhvidt, lugtfrit pulver, der er praktisk talt uopløseligt i vand og heptan, tungtopløseligt i ethanol og let opløseligt i chloroform.
Dens fordelingskoefficient mellem octanol og vand ved pH 5 er 1,6 x 103.
RHINOCORT AQUA (budesonid) næsespray er en uparfumeret, afmålt dosis, manuel pumpesprayformulering, der indeholder en mikroniseret suspension af budesonid i et vandigt medium. Mikrokrystallinsk cellulose og carboxymethylcellulosenatrium, vandfri dextrose, polysorbat 80, dinatriumedetat, kaliumsorbat og renset vand er indeholdt i dette medium; saltsyre tilsættes for at justere pH til et mål på 4,5.
RHINOCORT 100 mcg AQUA næsespray giver 32 mcg budesonid pr. spray.
Hver flaske RHINOCORT 100 mcg AQUA (budesonid) næsespray 32 mcg indeholder 120 afmålte sprays efter indledende priming.
Inden første brug skal beholderen rystes forsigtigt, og pumpen skal spædes ved at aktivere otte gange. Hvis den bruges dagligt, skal pumpen ikke genopfyldes. Hvis den ikke har været brugt i to på hinanden følgende dage, skal den genoprettes med én spray, eller indtil der kommer en fin spray. Hvis den ikke er brugt i mere end 14 dage, skylles applikatoren og sprayes igen med to sprays eller indtil en fin spray kommer til syne.
INDIKATIONER
Behandling af sæsonbetinget eller flerårig allergisk rhinitis
RHINOCORT AQUA (budesonid) næsespray er indiceret til behandling af næsesymptomer på sæsonbetinget eller flerårig allergisk rhinitis hos voksne og børn fra seks år og ældre.
DOSERING OG ADMINISTRATION
Den anbefalede startdosis for voksne og børn fra 6 år og ældre er 64 mcg dagligt givet som én spray pr. næsebor af RHINOCORT AQUA (budesonid) næsespray 32 mcg én gang dagligt. Nogle patienter, som ikke opnår symptomkontrol ved den anbefalede startdosis, kan have gavn af en øget dosis. Den maksimale anbefalede dosis til voksne (12 år og ældre) er 256 mcg dagligt givet som fire sprays pr. næsebor én gang dagligt af RHINOCORT AQUA (budesonid) næsespray 32 mcg og den maksimalt anbefalede dosis til pædiatriske patienter (6 til
Det er altid ønskeligt at titrere en individuel patient til den mindste effektive dosis for at reducere muligheden for bivirkninger. En forbedring af næsesymptomer kan ses hos patienter inden for 10 timer efter første gangs brug af RHINOCORT 100mcg AQUA (budesonid) næsespray, dog tager klinisk bedring normalt 1-2 dage med maksimal fordel på ca. 2 uger. Når den maksimale fordel er opnået, og symptomerne er blevet kontrolleret, kan en reduktion af dosis være effektiv til at opretholde kontrollen over symptomerne på allergisk rhinitis hos patienter, som oprindeligt blev kontrolleret med højere doser.
Inden første brug skal beholderen rystes forsigtigt, og pumpen skal spædes ved at aktivere otte gange. Hvis den bruges dagligt, skal pumpen ikke genopfyldes. Hvis den ikke har været brugt i to på hinanden følgende dage, skal den genoprettes med én spray, eller indtil der kommer en fin spray. Hvis den ikke er brugt i mere end 14 dage, skylles applikatoren og sprayes igen med to sprays eller indtil en fin spray kommer til syne. Ryst beholderen forsigtigt før hver brug.
Illustreret Patientens brugsanvisning ledsage hver pakke RHINOCORT AQUA (budesonid) næsespray 32 mcg.
HVORDAN LEVERET
Doseringsformer og styrker
RHINOCORT AQUA (budesonid) næsespray er en næsespraysuspension. Hver spray giver 32 mcg budesonid. Hver flaske RHINOCORT 100 mcg AQUA (budesonid) næsespray 32 mcg indeholder 120 afmålte sprays efter indledende priming.
RHINOCORT 100 mcg AQUA (budesonid) næsespray 32 mcg fås i en ravgul glasflaske med en pumpespray med afmålt dosis og en grøn beskyttelseslåg. RHINOCORT 100 mcg AQUA (budesonid) næsespray 32 mcg ( NDC 0186-1070-08) giver 120 afmålte sprays efter indledende priming; nettofyldvægt 8,6 g. RHINOCORT 100 mcg AQUA (budesonid) næsespray 32 mcg flasken er blevet fyldt med et overskud for at imødekomme priming-aktiviteten. Flasken skal kasseres efter 120 sprays efter indledende priming, da mængden af budesonid leveret pr. spray derefter kan være væsentligt mindre end den mærkede dosis. Hver spray afgiver 32 mcg budesonid til patienten.
RHINOCORT 100mcg AQUA (budesonid) næsespray skal opbevares ved kontrolleret stuetemperatur, 20 til 25°C (68 til 77°F) med ventilen oppe. Må ikke fryses. Beskyt mod lys. Ryst forsigtigt før brug. Spray ikke i øjnene.
Distribueret af: AstraZeneca LP, Wilmington, DE 19850. Revideret: 12/2010
BIVIRKNINGER
Anvendelse af systemiske og intranasale kortikosteroider kan resultere i følgende:
- Epistaxis, Candida albicans-infektion, perforering af næseskillevæggen og nedsat sårheling [se ADVARSLER OG FORHOLDSREGLER ].
- Overfølsomhed, herunder anafylaksi [se ADVARSLER OG FORHOLDSREGLER ].
- Immunsuppression [se ADVARSLER OG FORHOLDSREGLER ].
- Hyperkorticisme og binyrebarksuppression [se ADVARSLER OG FORHOLDSREGLER ].
- Væksteffekt [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
- Grøn stær og grå stær [se ADVARSLER OG FORHOLDSREGLER ].
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Hyppigheden af almindelige bivirkninger i tabel 1 er baseret på to amerikansk og fem ikke-amerikansk kontrollerede kliniske forsøg med 1.526 patienter med sæsonbetinget eller perennial rhinitis hos voksne og børn ≥ 6 år behandlet med RHINOCORT AQUA (budesonid) næsespray i doser op til 400 mcg én gang dagligt i 3-6 uger. Denne population omfattede 745 kvinder og 781 mænd med en gennemsnitsalder på 31 år (interval på 6-85 år, 349 var 6
En lignende bivirkningsprofil blev observeret i undergruppen af pædiatriske patienter i alderen 6 til 12 år. Disse patienter er inkluderet i tabel 1.
To til tre procent (2-3%) af patienterne i kliniske forsøg afbrød behandlingen på grund af bivirkninger. Systemiske kortikosteroidbivirkninger blev ikke rapporteret under kontrollerede kliniske undersøgelser med RHINOCORT AQUA (budesonid) næsespray.
Hvis de anbefalede doser overskrides, eller hvis individer er særligt følsomme, kan der opstå symptomer på hyperkorticisme, dvs. Gushings syndrom og binyrebarksuppression.
Post-marketing oplevelse
Følgende bivirkninger er blevet rapporteret under brug af RHINOCORT AQUA (budesonid) næsespray efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Forstyrrelser i immunsystemet: øjeblikkelige og forsinkede overfølsomhedsreaktioner (herunder anafylaktisk reaktion, nældefeber, udslæt, dermatitis, angioødem og kløe), [se ADVARSLER OG FORHOLDSREGLER og KONTRAINDIKATIONER ]
Øjenlidelser: glaukom, øget intraokulært tryk, grå stær [se ADVARSLER OG FORHOLDSREGLER ]
Åndedræts-, thorax- og mediastinumsygdomme: perforering af næseseptum, anosmi, svælglidelser (halsirritation, halssmerter, hævet hals, brændende hals og kløende hals) og hvæsen
Hjertelidelser: hjertebanken
Sygdomme i bevægeapparatet og bindevæv: væksthæmning [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ]
DRUGSINTERAKTIONER
Hæmmere af Cytochrom P450 3A4
Hovedmetabolismen af kortikosteroider, inklusive budesonid, er via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4). Efter oral administration af ketoconazol, en stærk hæmmer af CYP3A4, steg den gennemsnitlige plasmakoncentration af oralt administreret budesonid. Samtidig administration af CYP3A4 kan hæmme metabolismen af og øge den systemiske eksponering for budesonid. Der bør udvises forsigtighed, når man overvejer samtidig administration af RHINOCORT AQUA (budesonid) næsespray med langvarig ketoconazol og andre kendte stærke CYP3A4-hæmmere (f.eks. ritonavir, atazanavir clarithromycin, indinavir itraconazol, nefazodon nelfinavir-saquinavir, telithromycin) ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Lokale næseeffekter
Epistaxis
I kliniske undersøgelser af 3 til 52 ugers varighed blev næseblødning observeret hyppigere hos patienter behandlet med RHINOCORT 100mcg AQUA (budesonid) næsespray end hos dem, der fik placebo [se BIVIRKNINGER ].
Candida infektion
kliniske undersøgelser med budesonid administreret intranasalt er der opstået udvikling af lokaliserede infektioner i næse og svælg med Candida albicans. Når en sådan infektion udvikler sig, kan det kræve behandling med passende lokal eller systemisk behandling og seponering af behandling med RHINOCORT AQUA (budesonid) næsespray. Patienter, der bruger RHINOCORT AQUA (budesonid) næsespray over flere måneder eller længere, bør undersøges med jævne mellemrum for tegn på Candida-infektion eller andre tegn på bivirkninger på næseslimhinden.
Perforering af næseseptum
Forekomster af perforering af nasal septum er blevet rapporteret efter intranasal påføring af kortikosteroider, inklusive budesonid [se BIVIRKNINGER ].
Nedsat sårheling
På grund af kortikosteroiders hæmmende virkning på sårheling bør patienter, som for nylig har oplevet næseseptumsår, nasal kirurgi eller nasal traume, ikke bruge et nasalt kortikosteroid, før heling er sket.
Overfølsomhedsreaktioner, herunder anafylaksi
Overfølsomhedsreaktioner inklusive anafylaktisk reaktion, nældefeber, udslæt, dermatitis, angioødem og kløe kan forekomme [se KONTRAINDIKATIONER og BIVIRKNINGER, oplevelse efter markedsføring ].
Immunsuppression
Patienter, der er på medicin, der undertrykker immunsystemet, er mere modtagelige for infektioner end raske personer. Skoldkopper og mæslinger kan for eksempel have et mere alvorligt eller endda dødeligt forløb hos modtagelige børn eller voksne, der bruger kortikosteroider. Hos sådanne børn eller voksne, som ikke har haft disse sygdomme eller er blevet ordentligt immuniseret, skal der udvises særlig forsigtighed for at undgå eksponering. Hvordan dosis, vej og varighed af indgivelse af kortikosteroider påvirker risikoen for at udvikle en spredt infektion vides ikke. Bidraget fra den underliggende sygdom og/eller tidligere kortikosteroidbehandling til risikoen er heller ikke kendt. Hvis de udsættes for skoldkopper, kan behandling med varicella zoster immunglobulin (VZIG) eller poolet intravenøst immunglobulin (WIG), alt efter hvad der er relevant, være indiceret. Ved eksponering for mæslinger kan profylakse med puljet intramuskulært immunglobulin (IG) være indiceret. (Se de respektive indlægssedler for fuldstændig VZIG og IG ordinationsinformation ). Hvis der udvikles skoldkopper, kan behandling med antivirale midler overvejes.
Det kliniske forløb af skoldkopper eller mæslingeinfektion hos patienter på intranasale eller inhalerede kortikosteroider er ikke blevet undersøgt. Selvom der ikke er data med intranasale kortikosteroider, har en klinisk undersøgelse undersøgt immunresponsen over for skoldkoppevaccinen hos astmapatienter i alderen 12 måneder til 8 år, som blev behandlet med budesonid-inhalationssuspension.
Et åbent, ikke-randomiseret klinisk studie undersøgte immunresponsen over for skoldkoppevaccine hos 243 astmapatienter i alderen 12 måneder til 8 år, som blev behandlet med budesonid inhalationssuspension 0,25 mg til 1 mg dagligt (n=151) eller ikke-kortikosteroid astmaterapi (n=92) (dvs. beta-agonister, leukotrienreceptorantagonister eller cromoner). Procentdelen af patienter, der udviklede en seroprotektiv antistoftiter ≥ 5,0 (gpELISA-værdi) som respons på vaccinationen, var ens hos patienter behandlet med budesonid-inhalationssuspension (85 %) sammenlignet med patienter behandlet med astmabehandling uden kortikosteroider (90 %). Ingen patient behandlet med budesonid-inhalationssuspension udviklede skoldkopper som følge af vaccination.
Kortikosteroider bør anvendes med forsigtighed, hvis overhovedet, til patienter med aktiv eller hvilende tuberkuloseinfektion, ubehandlede svampe-, bakterie-, systemiske virus- eller parasitinfektioner; eller okulær herpes simplex.
Hypothalamus-hypofyse-binyreakse effekter
Hyperkorticisme og binyrebarksuppression: Når intranasale steroider anvendes i højere end anbefalede doser eller til modtagelige personer ved anbefalede doser, kan systemiske kortikosteroideffekter såsom hyperkorticisme og binyrebarksuppression forekomme. Hvis sådanne ændringer forekommer, bør doseringen af RHINOCORT 100mcg AQUA (budesonid) næsespray seponeres langsomt, i overensstemmelse med accepterede procedurer for seponering af oral kortikosteroidbehandling.
Udskiftning af et systemisk kortikosteroid med et topisk kortikosteroid kan ledsages af tegn på binyrebarkinsufficiens, og desuden kan nogle patienter opleve symptomer på kortikosteroidabstinenser, f.eks. led- og/eller muskelsmerter, træthed, svaghed, kvalme, opkastning, hypotension, træthed og depression. Patienter, der tidligere er blevet behandlet i længere perioder med systemiske kortikosteroider, bør vænnes langsomt fra, når de overføres til topikale kortikosteroider og nøje overvåges for akut binyrebarkinsufficiens som reaktion på stress. Hos de patienter, som har astma eller andre kliniske tilstande, der kræver langvarig systemisk kortikosteroidbehandling, kan et for hurtigt fald i systemiske kortikosteroider forårsage en alvorlig forværring af deres symptomer.
Interaktioner med stærke Cytokrom P450 3A4-hæmmere
Der skal udvises forsigtighed, når man overvejer samtidig administration af RHINOCORT AQUA næsespray med ketoconazol og andre kendte stærke CYP3A4-hæmmere (f.eks. ritonavir, atazanavir, clarithromycin, indinavir, itraconazol, nefazodon, nelfinavir, saquinavir-effekt relateret til, telithromycin) systemisk eksponering for budesonid kan forekomme [se LÆGEMIDDELINTERAKTIONER, KLINISK FARMAKOLOGI ].
Effekt på vækst
Intranasale kortikosteroider, inklusive budesonid, kan forårsage en reduktion i væksthastigheden, når de administreres til pædiatriske patienter. Overvåg væksten rutinemæssigt hos pædiatriske patienter, der modtager langtidsbehandling med RHINOCORT 100mcg AQUA (budesonid) næsespray. For at minimere de systemiske virkninger af intranasale kortikosteroider, inklusive RHINOCORT AQUA (budesonid) næsespray, titreres hver patients dosis til den laveste dosis, der effektivt kontrollerer hans/hendes symptomer [se Anvendelse i specifikke populationer, pædiatrisk brug ].
Grøn stær og grå stær
Grøn stær, øget intraokulært tryk og grå stær er blevet rapporteret efter intranasal applikation af kortikosteroider, inklusive budesonid. Derfor er tæt overvågning berettiget hos patienter med en ændring i synet eller med en anamnese med forhøjet intraokulært tryk, glaukom og/eller grå stær [se BIVIRKNINGER ].
Patientrådgivningsinformation
[Se FDA-godkendt patientmærkning ]
Patienter, der behandles med RHINOCORT 100mcg AQUA (budesonid) næsespray, skal modtage følgende information og instruktioner. Denne information er beregnet til at hjælpe patienten med sikker og effektiv brug af medicinen. Det er ikke en afsløring af alle mulige negative eller tilsigtede virkninger. For korrekt brug af RHINOCORT 100mcg AQUA (budesonid) næsespray og for at opnå maksimal forbedring, bør patienten læse og følge den medfølgende FDA-godkendte patientmærkning.
Lokale næseeffekter
Patienter bør informeres om, at epistaxis og lokaliserede infektioner med Candida albicans forekom i næse og svælg hos nogle patienter. Hvis der udvikles candidiasis, skal den behandles med passende lokal eller systemisk terapi og afbryde behandlingen med RHINOCORT 100mcg AQUA (budesonid) næsespray. Derudover er nasale kortikosteroider forbundet med perforering af næseseptum og nedsat sårheling. Patienter, der for nylig har oplevet næsesår, næseoperationer eller nasal traumer, bør ikke bruge RHINOCORT AQUA (budesonid) næsespray, før heling er sket [se ADVARSLER OG FORHOLDSREGLER ].
Overfølsomhed inklusive anafylaksi
Patienter bør informeres om, at der er rapporteret overfølsomhedsreaktioner, herunder anafylaktisk reaktion, nældefeber, udslæt, dermatitis, angioødem og kløe ved brug af RHINOCORT AQUA (budesonid) næsespray. Afbryde
RHINOCORT AQUA (budesonid) næsespray, hvis sådanne reaktioner opstår [se KONTRAINDIKATIONER, ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Immunsuppression
Patienter, der er på immunsuppressive doser af kortikosteroider, skal advares om at undgå eksponering for skoldkopper eller mæslinger og, hvis de bliver udsat, at konsultere deres læge straks. Patienter bør informeres om potentiel forværring af eksisterende tuberkulose, svampe-, bakterie-, virus- eller parasitinfektion eller okulær herpes simplex [se ADVARSLER OG FORHOLDSREGLER ].
Reduceret væksthastighed
Patienter bør informeres om, at intranasale kortikosteroider, inklusive budesonid, kan forårsage en reduktion i væksthastigheden, når de administreres til pædiatriske patienter. Læger bør nøje følge væksten hos børn og unge, der tager kortikosteroider ad enhver vej [se ADVARSLER OG FORHOLDSREGLER ].
Grøn stær og grå stær
Patienter bør informeres om, at langvarig brug af intranasale kortikosteroider, inklusive budesonid, kan øge risikoen for visse øjenproblemer (grå stær og glaukom). Patienter bør informere sin læge, hvis der bemærkes en ændring i synet, mens de bruger RHINOCORT AQUA (budesonid) næsespray [se ADVARSLER OG FORHOLDSREGLER ].
Brug dagligt
Patienter bør bruge RHINOCORT 100mcg AQUA (budesonid) næsespray med jævne mellemrum, da dens effektivitet afhænger af dens regelmæssige brug. Patienter kan bemærke en forbedring af næsesymptomer inden for 10 timer efter første gangs brug af RHINOCORT AQUA (budesonid) næsespray. Maksimal fordel opnås muligvis ikke før cirka 2 uger efter påbegyndelse af behandlingen [se DOSERING OG ADMINISTRATION ].
Patienter bør tage medicinen som anvist og bør ikke overskride den foreskrevne dosis. Patienten bør kontakte lægen, hvis symptomerne ikke forbedres efter to uger, eller hvis tilstanden forværres. Patienter, der oplever tilbagevendende episoder med epistaxis (næseblod) eller ubehag i næseskillevæggen, mens de tager denne medicin, bør kontakte deres læge. For korrekt brug af RHINOCORT AQUA (budesonid) næsespray og for at opnå maksimal forbedring, bør patienten læse og følge den medfølgende patientinformation omhyggeligt. Brug ikke RHINOCORT 100mcg AQUA (budesonid) næsespray efter det angivne antal sprays er blevet brugt (inkluderer ikke priming) eller efter udløbsdatoen vist på kartonen eller flaskens etiket.
Sådan bruger du RHINOCORT 100mcg AQUA (budesonid) næsespray
Patienter bør omhyggeligt instrueres i brugen af dette lægemiddel for at sikre optimal dosisafgivelse [se PATIENTOPLYSNINGER ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
et 104-ugers oralt studie med Sprague-Dawley-rotter blev der observeret en statistisk signifikant stigning i forekomsten af gliomer hos hanrotter, der fik en oral dosis budesonid på 50 mcg/kg/dag (ca. to gange den maksimale anbefalede daglige intranasale dosis i voksne og børn på mcg/m2 basis). Der blev ikke set tumorigenicitet hos hanrotter ved orale doser op til 25 mcg/kg (ca. lig med den maksimalt anbefalede daglige intranasale dosis til voksne og børn på mcg/m2-basis og hos hunrotter ved orale doser op til 50 mcg/kg ca. to gange den maksimalt anbefalede daglige intranasale dosis til voksne og børn på mcg/m2-basis). I yderligere to toårige undersøgelser med Fischer- og Sprague-Dawley-hanrotter forårsagede budesonid ingen gliomer ved en oral dosis på 50 mcg/kg (ca. to gange den maksimale anbefalede daglige intranasale dosis til voksne og børn på en mcg/m2-basis). Hos Sprague-Dawley hanrotter forårsagede budesonid imidlertid en statistisk signifikant stigning i forekomsten af hepatocellulære tumorer ved en oral dosis på 50 mcg/kg (ca. to gange den maksimale anbefalede daglige intranasale dosis til voksne og børn på en mcg/m2 basis ). De samtidige referencekortikosteroider (prednisolon og triamcinolonacetonid) i disse to undersøgelser viste lignende resultater.
Der var ingen tegn på en kræftfremkaldende effekt, når budesonid blev administreret oralt i 91 uger til mus i doser på op til 200 mcg/kg/dag (ca. 3 gange den maksimale anbefalede daglige intranasale dosis til voksne og børn på en mcg/m2 basis) .
Budesonid var ikke mutagent eller klastogent i seks forskellige testsystemer: Ames Salmonella/mikrosompladetest, mikronukleustest hos mus, lymfomtest hos mus, kromosomafvigelsestest i humane lymfocytter, kønsbundet recessiv letal test i Drosophila melanogaster og DNA-reparationsanalyse hos rotter hepatocytkultur.
Hos rotter havde budesonid ingen effekt på fertiliteten ved subkutane doser på op til 80 mcg/kg (ca. 3 gange den maksimalt anbefalede daglige intranasale dosis til voksne på mcg/m2-basis).
Ved en subkutan dosis på 20 mcg/kg/dag (mindre end den maksimalt anbefalede daglige intranasale dosis til voksne på en mcg/m2-basis), fald i moderens kropsvægtforøgelse, prænatal levedygtighed og levedygtighed af ungerne ved fødslen og under amning blev observeret. Ingen sådanne virkninger blev noteret ved 5 mcg/kg (mindre end den maksimalt anbefalede daglige intranasale dosis hos voksne på en mcg/m2 basis).
Brug i specifikke populationer
Graviditet
Teratogene virkninger: Graviditetskategori B. Budesonids indvirkning på graviditetsresultater hos mennesker er blevet evalueret gennem vurderinger af fødselsregistre forbundet med moderens brug af inhaleret budesonid (dvs. PULMICORT TURBUHALER) og intranasalt administreret budesonid (dvs. RHINOCORT 100mcg AQUA) Nabudesonid. Resultaterne fra befolkningsbaserede prospektive kohorte epidemiologiske undersøgelser, der gennemgår data fra tre svenske registre, der dækker ca. 99 % af graviditeterne fra 1995-2001 (dvs. det svenske medicinske fødselsregister; register over medfødte misdannelser; børnekardiologisk register) indikerer ingen øget risiko for samlet set medfødte misdannelser fra brug af inhaleret eller intranasal budesonid under tidlig graviditet.
Medfødte misdannelser blev undersøgt hos 2.014 spædbørn født af mødre, der rapporterede brugen af inhaleret budesonid til astma tidligt i graviditeten (sædvanligvis 10-12 uger efter den sidste menstruation), den periode, hvor de fleste større organmisdannelser forekommer.1 Hyppigheden af overordnede medfødte misdannelser var ens sammenlignet med den generelle befolkningsrate (henholdsvis 3,8 % vs. 3,5 %). Antallet af spædbørn født med orofaciale spalter og hjertedefekter svarede til det forventede antal i den generelle befolkning (hhv. 4 børn mod 3,3 og 18 børn mod 17-18). I en opfølgende undersøgelse, der bragte det samlede antal spædbørn op på 2.534, var frekvensen af overordnede medfødte misdannelser blandt spædbørn, hvis mødre blev udsat for inhaleret budesonid under tidlig graviditet, ikke forskellig fra frekvensen for alle nyfødte babyer i samme periode (3,6 % ).2 En tredje undersøgelse fra det svenske medicinske fødselsregister af 2.968 graviditeter udsat for inhaleret budesonid, hvoraf størstedelen var eksponeringer i første trimester, rapporteret gestationsalder, fødselsvægt, fødselslængde, dødfødsler og flergangsfødsler svarende til eksponerede spædbørn sammenlignet med ikke-eksponerede spædbørn.3
Medfødte misdannelser blev undersøgt hos 2.113 spædbørn født af mødre, der rapporterede brugen af intranasal budesonid tidligt i graviditeten. Hyppigheden af overordnede medfødte misdannelser var ens sammenlignet med den generelle befolkningsrate (henholdsvis 4,5 % vs. 3,5 %). Den justerede odds ratio (OR) var 1,06 (95 % CI 0,86-1,31). Antallet af spædbørn født med orofaciale kløfter svarede til det forventede antal i den generelle befolkning (henholdsvis 3 børn vs. 3). Antallet af spædbørn født med hjertefejl oversteg det forventede i den generelle befolkning (henholdsvis 28 børn mod 17,8). Den systemiske eksponering fra intranasal budesonid er 6 gange mindre end fra inhaleret budesonid, og en sammenhæng mellem hjertedefekter blev ikke set med højere eksponeringer af budesonid.
På trods af dyrefundene ser det ud til, at muligheden for fosterskader er fjern, hvis stoffet bruges under graviditeten. Ikke desto mindre, fordi undersøgelser på mennesker ikke kan udelukke muligheden for skade, bør RHINOCORT AQUA (budesonid) næsespray kun anvendes under graviditet, hvis det er klart nødvendigt.
Budesonid gav fostertab, nedsatte hvalpevægte og skeletabnormiteter ved en subkutan dosis hos kaniner, der var ca. 2 gange den maksimalt anbefalede daglige intranasale dosis hos voksne på en mcg/m2-basis og ved en subkutan dosis hos rotter, der var ca. maksimal anbefalet daglig intranasal dosis til voksne på en mcg/m2 basis. Der blev ikke observeret teratogene eller embryocidale virkninger hos rotter, når budesonid blev administreret ved inhalation i doser op til ca. 8 gange den maksimalt anbefalede daglige intranasale dosis til voksne på en mcg/m2-basis.
Erfaring med orale kortikosteroider siden deres introduktion i farmakologiske, i modsætning til fysiologiske doser tyder på, at gnavere er mere tilbøjelige til teratogene virkninger fra kortikosteroider end mennesker.
Ikke-ratogene virkninger: Hypoadrenalisme kan forekomme hos spædbørn født af mødre, der får kortikosteroider under graviditeten. Sådanne spædbørn bør observeres nøje.
Ammende mødre
Budesonid udskilles i modermælk. Data med budesonid leveret via tørpulverinhalator indikerer, at den samlede daglige orale dosis af budesonid, der er tilgængelig i modermælk til spædbarnet, er ca. 0,3 % til 1 % af den dosis, som moderen inhalerer [se KLINISK FARMAKOLOGI, Farmakokinetik, Specialpopulationer, Sygepleje ]. Der er ikke udført undersøgelser af ammende kvinder specifikt med RHINOCORT 100mcg AQUA næsespray; dog forventes den dosis af budesonid, der er tilgængelig for spædbarnet i modermælk, som en procentdel af moderens dosis at være ens. RHINOCORT AQUA (budesonid) næsespray bør kun anvendes til ammende kvinder, hvis det er klinisk relevant. Ordinerende læger bør afveje de kendte fordele ved amning for moderen og spædbarnet mod de potentielle risici ved minimal eksponering for budesonid hos spædbarnet. Doseringsovervejelser omfatter ordination eller titrering til den laveste klinisk effektive dosis og brug af RHINOCORT 100mcg AQUA (budesonid) næsespray umiddelbart efter amning for at maksimere tidsintervallet mellem dosering og amning for at minimere spædbørns eksponering.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter under 6 år er ikke blevet fastslået.
Kontrollerede kliniske undersøgelser har vist, at intranasale kortikosteroider kan forårsage en reduktion i væksthastigheden hos pædiatriske patienter. Denne effekt er blevet observeret i fravær af laboratoriebeviser for hypothalamus-hypofyse-binyre (HPA)-aksesuppression, hvilket tyder på, at væksthastighed er en mere følsom indikator for systemisk kortikosteroideksponering hos pædiatriske patienter end nogle almindeligt anvendte test af HPA-aksefunktion. . De langsigtede virkninger af denne reduktion i væksthastighed forbundet med intranasale kortikosteroider, herunder indvirkningen på den endelige voksenhøjde, er ukendte. Potentialet for "catch-up" vækst efter seponering af behandling med intranasale kortikosteroider er ikke blevet tilstrækkeligt undersøgt.
Væksten hos pædiatriske patienter, der får intranasale kortikosteroider, inklusive RHINOCORT 100mcg AQUA (budesonid) næsespray, bør overvåges rutinemæssigt (f.eks. via stadiometri). De potentielle væksteffekter af langvarig behandling bør afvejes i forhold til opnåede kliniske fordele og risici og fordele forbundet med alternative behandlinger. For at minimere den systemiske virkning af intranasale kortikosteroider, inklusive RHINOCORT AQUA (budesonid) næsespray, bør hver patient titreres til den laveste dosis, der effektivt kontrollerer hans/hendes symptomer.
Et etårigt placebokontrolleret klinisk vækststudie blev udført med 229 pædiatriske patienter (i alderen 4 til 8 år) for at vurdere effekten af RHINOCORT AQUA (budesonid) næsespray (enkelt daglig dosis på 64 mcg, den anbefalede startdosis for børn i alderen 6 år og derover) på væksthastighed. Fra en population på 141 patienter, der fik RHINOCORT 100 mcg AQUA (budesonid) næsespray og 67, der fik placebo, var punktestimatet for væksthastighed med RHINOCORT AQUA (budesonid) næsespray 0,25 cm/år lavere end det, der blev noteret med placebo (95 % konfidensinterval) spænder fra 0,59 cm/år lavere end placebo til 0,08 cm/år højere end placebo).
en undersøgelse af astmatiske børn i alderen 5-12 år havde dem, der blev behandlet med budesonid administreret via en tørpulverinhalator 200 mcg to gange dagligt (n=311), en reduktion på 1,1 centimeter (0,433 tommer) i vækst sammenlignet med dem, der fik placebo ( n=418) ved udgangen af et år; forskellen mellem disse to behandlingsgrupper steg ikke yderligere over tre års yderligere behandling. Ved udgangen af fire år havde børn behandlet med budesonid-tørpulverinhalator og børn behandlet med placebo lignende væksthastigheder. Konklusionerne fra denne undersøgelse kan forvirres af den ulige brug af kortikosteroider i behandlingsgrupperne og inklusion af data fra patienter, der når puberteten i løbet af undersøgelsen.
De systemiske virkninger af inhalerede kortikosteroider er relateret til den systemiske eksponering for sådanne lægemidler. Farmakokinetiske undersøgelser har vist, at hos både voksne og børn forventes systemisk eksponering for budesonid ved de højest anbefalede doser af RHINOCORT AQUA (budesonid) næsespray ikke at være større end eksponering ved de laveste anbefalede doser via en tørpulverinhalator. Derfor forventes de systemiske virkninger (HPA-akse og vækst) af budesonid leveret fra RHINOCORT AQUA (budesonid) næsespray ikke at være større end det, der er rapporteret for inhaleret budesonid, når det administreres via tørpulverinhalatoren.
Potentialet for, at RHINOCORT 100 mcg AQUA (budesonid) næsespray forårsager væksthæmning hos følsomme patienter, eller når det gives i doser over 64 mcg dagligt, kan ikke udelukkes. Det anbefalede dosisområde til patienter i alderen 6 til 11 år er 64 til 128 mikrogram dagligt [se DOSERING OG ADMINISTRATION ].
Geriatrisk brug
Af de 2.461 patienter i kliniske undersøgelser af RHINOCORT 100 mcg AQUA (budesonid) næsespray var 5 % 60 år og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, bortset fra en bivirkning, der rapporterede hyppigheden af næseblod, som steg med alderen. Yderligere har anden rapporteret klinisk erfaring ikke identificeret andre forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes.
Nedsat leverfunktion
Formelle farmakokinetiske undersøgelser med RHINOCORT 100mcg AQUA (budesonid) næsespray er ikke blevet udført hos patienter med nedsat leverfunktion. Men da budesonid overvejende udskilles af levermetabolisme, kan nedsat leverfunktion føre til akkumulering af budesonid i plasma. Derfor bør patienter med leversygdom overvåges nøje.
OVERDOSIS
Akut overdosering med denne doseringsform er usandsynlig, da en 120 sprayflaske RHINOCORT 100 mcg AQUA (budesonid) næsespray 32 mcg kun indeholder ca. 5,4 mg budesonid. Kronisk overdosering kan resultere i tegn/symptomer på hyperkorticisme [se ADVARSLER OG FORHOLDSREGLER ].
KONTRAINDIKATIONER
RHINOCORT AQUA (budesonid) næsespray er kontraindiceret til patienter med overfølsomhed over for et eller flere af dets indholdsstoffer [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Virkningsmekanisme
Budesonid er et antiinflammatorisk kortikosteroid, der udviser potent glukokortikoid aktivitet og svag mineralokortikoid aktivitet. I standard in vitro- og dyremodeller har budesonid ca. en 200 gange højere affinitet for glukokortikoidreceptoren og en 1000 gange højere topisk antiinflammatorisk styrke end cortisol (rottekrotonolie-øreødemanalyse). Som et mål for systemisk aktivitet er budesonid 40 gange mere potent end cortisol, når det administreres subkutant og 25 gange mere potent, når det administreres oralt i rottethymus-involutionsanalysen. Den kliniske betydning af dette er ukendt.
Aktiviteten af RHINOCORT 100mcg AQUA næsespray skyldes moderlægemidlet budesonid. I glukokortikoidreceptoraffinitetsundersøgelser var 22R-formen to gange så aktiv som 22S-epimeren. In vitro undersøgelser viste, at de to former for budesonid ikke interkonverterer.
Den præcise mekanisme for kortikosteroidvirkninger på inflammation ved sæsonbestemt og flerårig allergisk rhinitis er ikke velkendt. Inflammation er en vigtig komponent i patogenesen af sæsonbestemt og flerårig allergisk rhinitis. Kortikosteroider har en bred vifte af hæmmende aktiviteter mod flere celletyper (f.eks. mastceller, eosinofiler, neutrofiler, makrofager og lymfocytter) og mediatorer (f.eks. histamin, eicosanoider, leukotriener og cytokiner) involveret i allergiske og ikke-allergisk-medierede betændelse. Disse antiinflammatoriske virkninger af kortikosteroider kan bidrage til deres effektivitet ved sæsonbestemt og flerårig allergisk rhinitis.
Farmakodynamik
Et 3-ugers klinisk studie i sæsonbetinget rhinitis, der sammenlignede RHINOCORT 100mcg næseinhalator, oralt indtaget budesonid og placebo hos 98 patienter med allergisk rhinitis på grund af birkepollen, viste, at den terapeutiske effekt af RHINOCORT næseinhalator kan tilskrives topiske effekter budesonid.

HPA-akseeffekter
Virkningerne af RHINOCORT 100mcg AQUA (budesonid) næsespray på binyrefunktionen er blevet evalueret i flere kliniske forsøg. I et fire ugers klinisk forsøg påviste 61 voksne patienter, som fik 256 mikrogram dagligt RHINOCORT AQUA (budesonid) næsespray, ingen signifikante forskelle fra patienter, der fik placebo, i plasmakortisolniveauer målt før og 60 minutter efter 0,25 mg intramuskulært cosyntropin. Der var ingen konsistente forskelle i 24-timers urinkortisolmålinger hos patienter, der fik op til 400 mcg dagligt. Lignende resultater blev set i en undersøgelse af 150 børn og unge i alderen 6 til 17 med perennial rhinitis, som blev behandlet med 256 mcg dagligt i op til 12 måneder.
Efter behandling med den anbefalede maksimale daglige dosis af RHINOCORT AQUA (budesonid) næsespray (256 mcg) i syv dage var der et lille, men statistisk signifikant fald i arealet under plasmakortisol-tidskurven over 24 timer (AUC0-24 timer) ) hos raske voksne frivillige.
En dosisrelateret suppression af 24-timers kortisoludskillelse i urinen blev observeret efter administration af RHINOCORT AQUA (budesonid) næsespray doser varierende fra 100-800 mcg dagligt i op til fire dage hos 78 raske voksne frivillige. Den kliniske relevans af disse resultater er ukendt.
Farmakokinetik
Absorption
Efter intranasal administration af en enkelt dosis RHINOCORT AQUA (budesonid) næsespray (128 mcg), forekommer den gennemsnitlige maksimale plasmakoncentration på ca. 0,3 nmol/L ca. 0,5 timer efter dosis. Sammenlignet med en intravenøs dosis når ca. 34 % af den afgivne intranasale dosis det systemiske kredsløb, hvoraf det meste absorberes gennem næseslimhinden. Mens budesonid absorberes godt fra mave-tarmkanalen, er den orale biotilgængelighed af budesonid lav (~10%), primært på grund af omfattende first-pass metabolisme i leveren.
Fordeling
Fordelingsvolumenet af budesonid var ca. 2-3 l/kg. Det var 85-90 % bundet til plasmaproteiner. Fordelingsvolumenet for 22R-epimeren er næsten det dobbelte af 22S-epimeren. Proteinbindingen var konstant over et koncentrationsområde (1-100 nmol/L) opnået med og overskredet anbefalede doser af RHINOCORT 100mcg AQUA næsespray. Budesonid viste ringe eller ingen binding til kortikosteroidbindende globulin. Budesonid ækvilibrerede hurtigt med røde blodlegemer på en koncentrationsuafhængig måde med et blod/plasma-forhold på ca. 0,8.
Metabolisme
In vitro undersøgelser med humane leverhomogenater har vist, at budesonid metaboliseres hurtigt og omfattende. To hovedmetabolitter dannet via cytochrom P450 (CYP) isoenzym 3A4 (CYP3A4)-katalyseret biotransformation er blevet isoleret og identificeret som 16α-hydroxyprednisolon og 6p-hydroxybudesonid. Kortikosteroidaktiviteten af hver af disse to metabolitter er mindre end 1 % af moderforbindelsens. Der er ikke påvist nogen kvalitativ forskel mellem in vitro og in vivo metaboliske mønstre. Ubetydelig metabolisk inaktivering blev observeret i humane lunge- og serumpræparater.
Udskillelse/Eliminering
22R-formen af budesonid blev fortrinsvis elimineret af leveren med systemisk clearance på 1,4 l/min vs. 1,0 l/min for 22S-formen. Den terminale halveringstid, 2 til 3 timer, var den samme for begge epimerer og var uafhængig af dosis. Budesonid blev udskilt i urin og fæces i form af metabolitter. Cirka 2/3 af en intranasal radioaktivt mærket dosis blev genfundet i urinen og resten i fæces. Der blev ikke påvist uændret budesonid i urinen.
Specifikke populationer
Geriatrisk
Farmakokinetikken af RHINOCORT 100mcg AQUA (budesonid) næsespray hos geriatriske patienter er ikke blevet specifikt undersøgt.
Pædiatrisk
Efter administration af RHINOCORT 100mcg AQUA (budesonid) næsespray var tiden til at nå maksimale lægemiddelkoncentrationer og plasmahalveringstid ens hos børn og voksne. Børn havde plasmakoncentrationer omkring det dobbelte af dem, der blev observeret hos voksne, primært på grund af forskelle i vægt mellem børn og voksne.
Køn
Der er ikke udført nogen specifik farmakokinetisk undersøgelse for at evaluere effekten af køn på budesonids farmakokinetik. Efter administration af 400 mcg RHINOCORT 100 mcg AQUA (budesonid) næsespray til 7 mandlige og 8 kvindelige frivillige i en farmakokinetisk undersøgelse blev der imidlertid ikke fundet nogen større kønsforskelle i de farmakokinetiske parametre.
Race
Der er ikke foretaget nogen specifik undersøgelse for at evaluere effekten af race på budesonids farmakokinetik.
Ammende mødre
Fordelingen af budesonid ved oral inhalation fra en tørpulverinhalator i doser på 200 eller 400 mcg to gange dagligt i mindst 3 måneder blev undersøgt hos otte ammende kvinder med astma fra 1 til 6 måneder efter fødslen. Systemisk eksponering for budesonid hos disse kvinder synes at være sammenlignelig med den hos ikke-ammende kvinder med astma fra andre undersøgelser. Modermælk opnået over otte timer efter dosis afslørede, at den maksimale koncentration af budesonid for 400 og 800 mcg doser var henholdsvis 0,39 og 0,78 nmol/L og forekom inden for 45 minutter efter dosering. Den estimerede orale daglige dosis af budesonid fra modermælk til spædbarnet var ca. 0,007 og 0,014 mcg/kg/dag for de to dosisregimer, der blev brugt i denne undersøgelse, hvilket repræsenterer ca. 0,3 % til 1 % af den dosis, som moderen inhalerede. Budesonidniveauer i plasmaprøver opnået fra fem spædbørn ca. 90 minutter efter amning (og ca. 140 minutter efter lægemiddeladministration til moderen) var under kvantificerbare niveauer ( Brug i specifikke populationer, ammende mødre ].
Nyre- eller leverinsufficiens
Budesonids farmakokinetik er ikke blevet undersøgt hos patienter med nedsat nyrefunktion. Nedsat leverfunktion kan påvirke eliminationen af kortikosteroider. Budesonids farmakokinetik blev påvirket af kompromitteret leverfunktion, hvilket fremgår af en fordoblet systemisk tilgængelighed efter oral indtagelse. Relevansen af dette fund for intranasalt administreret budesonid er ikke blevet fastslået.
Lægemiddel-lægemiddelinteraktioner
Hæmmere af cytochrom P450 enzymer
Ketoconazol: Ketoconazol, en stærk hæmmer af cytochrom P450 (CYP) isoenzym 3A4 (CYP3A4), det vigtigste metaboliske enzym for kortikosteroider, øgede plasmaniveauer af oralt indtaget budesonid [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ].
Cimetidin: Ved anbefalede doser havde cimetidin, en uspecifik hæmmer af CYP-enzymer, en lille, men klinisk ubetydelig effekt på farmakokinetikken af oralt budesonid.
dyretoksikologi og/eller farmakologi
Budesonid var teratogent og embryocidal hos kaniner og rotter. Budesonid gav fostertab, nedsatte hvalpevægte og skeletabnormiteter ved en subkutan dosis på 25 mcg/kg hos kaniner (ca. 2 gange den maksimalt anbefalede daglige intranasale dosis hos voksne på en mcg/m2-basis) og ved en subkutan dosis på 500 mcg /kg hos rotter (ca. 16 gange den maksimalt anbefalede daglige intranasal dosis til voksne på en mcg/m2 basis). Der blev ikke observeret teratogene eller embryocidale virkninger hos rotter, når budesonid blev administreret ved inhalationsdoser på op til 250 mcg/kg (ca. 8 gange den maksimale anbefalede daglige intranasale dosis til voksne på en mcg/m2 basis).
Kliniske Studier
Den terapeutiske effekt af RHINOCORT AQUA (budesonid) næsespray er blevet evalueret i placebokontrollerede kliniske forsøg med sæsonbestemt og flerårig allergisk rhinitis af 3-6 ugers varighed.
Antallet af patienter behandlet med budesonid i disse undersøgelser var 90 mænd og 51 kvinder i alderen 6-12 år og 691 mænd og 694 kvinder 12 år og derover. Patienterne var overvejende kaukasiske.
Samlet set viste resultaterne af disse kliniske forsøg, at RHINOCORT AQUA (budesonid) næsespray administreret én gang dagligt giver statistisk signifikant reduktion i sværhedsgraden af næsesymptomer på sæsonbetinget og flerårig allergisk rhinitis, herunder løbende næse, nysen og tilstoppet næse.
En forbedring af næsesymptomer kan ses hos patienter inden for 10 timer efter første behandling med RHINOCORT 100 mcg AQUA (budesonid) næsespray. Denne tid til start understøttes af et miljøeksponeringsenhedsstudie i sæsonbestemt allergisk rhinitis-patienter, der viste, at RHINOCORT 100mcg AQUA (budesonid) næsespray førte til en statistisk signifikant forbedring af næsesymptomer sammenlignet med placebo med 10 timer. Yderligere støtte kommer fra et klinisk studie af patienter med perennial allergisk rhinitis, som viste en statistisk signifikant forbedring af næsesymptomer for både RHINOCORT AQUA (budesonid) næsespray og for den aktive komparator (mometasonfuroat) sammenlignet med placebo med 8 timer. Debut blev også vurderet i denne undersøgelse med maksimal nasal inspiratorisk flowhastighed, og dette endepunkt viste ikke effektivitet for nogen af de aktive behandlinger. Selvom statistisk signifikante forbedringer i næsesymptomer sammenlignet med placebo blev bemærket inden for 8-10 timer i disse undersøgelser, sker omkring halvdelen til to tredjedele af den ultimative kliniske forbedring med RHINOCORT 100mcg AQUA (budesonid) næsespray i løbet af de første 1-2 dage, og maksimal fordel opnås muligvis ikke før ca. 2 uger efter påbegyndelse af behandlingen.
REFERENCER
Kallen B, Rydhstroem H, Aberg A. Medfødte misdannelser efter brug af inhaleret budesonid tidligt i graviditeten. Obstet Gynecol 1999; 93:392-395.
2 Ericson A, Kallen B. Brug af lægemidler under graviditet: unik svensk registreringsmetode, der kan forbedres. Sveriges Läkemedelsverk 1999; 1:8-11.
3 Norjavaara E, Gerhardsson de Verdier M. Normale graviditetsresultater i en befolkningsbaseret undersøgelse, der omfattede 2968 gravide kvinder, der blev udsat for budesonid. J Allergy Clin Immunol 2003;! 11:736-742.
PATIENTOPLYSNINGER
RHINOCORT 100mcg AQUA (budesonid) ® (RINE-o-cort AH-kwa) (budesonid) Næsespray
Kun til brug i din næse
Læs patientinformationen, der følger med RHINOCORT 100mcg AQUA (budesonid) næsespray, før du begynder at bruge den, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller behandling. Spørg din læge eller apotek, hvis du har spørgsmål om RHINOCORT AQUA (budesonid) næsespray.
Hvad er RHINOCORT 100mcg AQUA (budesonid) næsespray?
RHINOCORT AQUA (budesonid) næsespray er en receptpligtig medicin, der bruges til at behandle sæsonbestemte og året rundt allergisymptomer hos voksne og børn fra 6 år og ældre.
RHINOCORT AQUA Næsespray indeholder budesonid, som er et menneskeskabt (syntetisk) kortikosteroid. Intranasale kortikosteroider er naturlige hormoner, der findes i kroppen, og som reducerer hævelse af næseslimhinden. Når du sprayer RHINOCORT 100mcg AQUA (budesonid) næsespray ind i din næse, hjælper det med at reducere næsesymptomer på allergisk rhinitis (betændelse i næseslimhinden), såsom tilstoppet næse, løbende næse, kløe og nysen.
Sikkerheden og effektiviteten af RHINOCORT 100mcg AQUA (budesonid) næsespray er ikke blevet vist hos børn under 6 år.
Hvem bør ikke bruge RHINOCORT AQUA (budesonid) næsespray?
Brug ikke RHINOCORT 100mcg AQUA (budesonid) næsespray:
- hvis du er allergisk over for budesonid eller et af indholdsstofferne i RHINOCORT AQUA næsespray. Se slutningen af denne indlægsseddel for en komplet liste over ingredienserne i RHINOCORT AQUA (budesonid) næsespray.
Hvad skal jeg fortælle min sundhedsplejerske, før jeg bruger RHINOCORT 100mcg AQUA (budesonid) næsespray?
Inden du bruger RHINOCORT AQUA (budesonid) næsespray, skal du fortælle det til din læge eller på apoteket, hvis du:
- har for nylig været omkring nogen med skoldkopper eller mæslinger
- har leverproblemer
- har ubehandlede infektioner
- nogensinde har haft en infektion kaldet tuberkulose
- har en øjenbetændelse
- for nylig er blevet opereret eller en skade på din næse
- har andre medicinske tilstande
- er gravid eller planlægger at blive gravid. Det vides ikke, om RHINOCORT 100mcg AQUA (budesonid) næsespray vil skade dit ufødte barn. Tal med din læge, hvis du er gravid eller planlægger at blive gravid.
- ammer eller planlægger at amme. RHINOCORT 100mcg AQUA (budesonid) næsespray kan passere over i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager RHINOCORT AQUA (budesonid) næsespray.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler.
RHINOCORT AQUA (budesonid) næsespray kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke, hvordan RHINOCORT 100mcg AQUA (budesonid) næsespray virker.
Kend den medicin du tager. Hav en liste over dine lægemidler med dig for at vise din læge og apotek, når du får en ny medicin.
Hvordan skal jeg bruge RHINOCORT 100mcg AQUA (budesonid) næsespray?
- RHINOCORT 100mcg AQUA (budesonid) næsespray er kun til brug i din næse. Spray det ikke i dine øjne eller mund.
- Brug RHINOCORT AQUA (budesonid) næsespray nøjagtigt som din læge fortæller dig at bruge den.
- Det er meget vigtigt, at du bruger RHINOCORT AQUA (budesonid) næsespray regelmæssigt. Du må ikke stoppe med at bruge RHINOCORT AQUA (budesonid) næsespray eller ændre din dosis uden at tale med din læge, heller ikke selvom du har det bedre.
- Tal med din læge, hvis dine symptomer ikke forbedres efter at have taget RHINOCORT AQUA (budesonid) næsespray i 2 uger, eller hvis dine symptomer bliver værre.
- En voksen bør hjælpe et lille barn med at bruge denne medicin.
- Se patientbrugsanvisningen i slutningen af denne indlægsseddel for fuldstændig information om, hvordan du bruger RHINOCORT AQUA (budesonid) næsespray.
Hvad er de mulige bivirkninger af RHINOCORT AQUA (budesonid) næsespray?
RHINOCORT 100mcg AQUA (budesonid) næsespray kan forårsage alvorlige bivirkninger, herunder:
- hul i brusken inde i næsen (næseseptumperforering). Fortæl det til din læge, hvis du får en fløjtende lyd fra næsen, når du trækker vejret.
- langsom sårheling. Du bør ikke bruge RHINOCORT 100mcg AQUA (budesonid) næsespray, før din næse er helet, hvis du har et sår i næsen, hvis du er blevet opereret i næsen, eller hvis din næse er blevet skadet.
- svampeinfektion i din næse.
- allergiske reaktioner. Fortæl det til din læge eller få lægehjælp med det samme, hvis du har:
- hududslæt, rødme eller hævelse
- svær kløe
- hævelse af ansigt, mund og tunge
- immunsystemproblemer, der kan øge din risiko for infektioner. Du er mere tilbøjelig til at få infektioner, hvis du tager medicin, der svækker din krops evne til at bekæmpe infektioner. Undgå kontakt med personer, der har smitsomme sygdomme som skoldkopper eller mæslinger, mens de bruger RHINOCORT AQUA (budesonid) næsespray. Symptomer på infektion kan omfatte feber, smerter, ømhed, kulderystelser, træthed, kvalme og opkastning.
- binyrebarkinsufficiens, Binyrebarkinsufficiens er en tilstand, hvor binyrerne ikke danner nok steroidhormoner. Symptomer på binyrebarkinsufficiens kan omfatte træthed, svaghed, kvalme, opkastning og lavt blodtryk.
- forsinket eller forsinket vækst hos børn. Et barns vækst bør kontrolleres regelmæssigt, mens du bruger RHINOCORT 100mcg AQUA (budesonid) næsespray.
- øjenproblemer, såsom glaukom og grå stær. Fortæl din læge, hvis du har en ændring i synet eller har en historie med øget intraokulært tryk, glaukom og/eller grå stær.
Ring til din læge eller få lægehjælp med det samme, hvis du har symptomer på nogen af de alvorlige bivirkninger, der er nævnt ovenfor.
De mest almindelige bivirkninger af RHINOCORT 100mcg AQUA (budesonid) næsespray omfatter:
- næseblod
- ondt i halsen
- vejrtrækningsbesvær såsom hvæsende vejrtrækning eller opstramning af brystet
- hoste
- irritation af din næse
Fortæl din læge, hvis du har en bivirkning, der generer dig eller ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af RHINOCORT 100mcg AQUA (budesonid) næsespray. For mere information, spørg din læge eller apotek.
Ring til din læge for at få medicinsk rådgivning om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
Du kan rapportere bivirkninger til AstraZeneca på 1-800-236-9933.
Hvad skal jeg vide om allergisk rhinitis?
"Rhinitis" betyder betændelse i næseslimhinden. Det kaldes nogle gange "høfeber." Allergisk rhinitis kan være forårsaget af allergi over for pollen, dyreskæl, husstøvmider og skimmelsporer. Hvis du har allergisk rhinitis, bliver din næse tilstoppet, løbende og kløende. Du kan også nyse meget. Du kan have røde, kløende, rindende øjne; kløende hals; eller blokerede, kløende ører.
RHINOCORT AQUA (budesonid) næsespray hjælper med at lindre dine næsesymptomer.
Hvis du også har kløende, rindende øjne, bør du fortælle det til din læge. Han eller hun kan ordinere yderligere medicin til behandling af disse symptomer.
Hvordan skal jeg opbevare RHINOCORT AQUA (budesonid) næsespray?
- Opbevar RHINOCORT AQUA (budesonid) næsespray ved 68°F til 77°F (20°C til 25°C).
- Frys ikke RHINOCORT AQUA (budesonid) næsespray.
- Beskyt RHINOCORT 100mcg AQUA (budesonid) næsespray mod lys.
- Brug ikke RHINOCORT 100mcg AQUA (budesonid) næsespray efter det angivne antal sprays er blevet brugt (inkluderer ikke priming) eller efter udløbsdatoen vist på kartonen eller flaskens etiket.
- Opbevar den grønne beskyttelseshætte på RHINOCORT AQUA (budesonid) næsespray, når den ikke er i brug. (Se venligst Før brug på bagsiden ).
- Opbevar RHINOCORT 100mcg AQUA (budesonid) næsespray og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af RHINOCORT AQUA (budesonid) næsespray:
Brug ikke RHINOCORT 100mcg AQUA (budesonid) næsespray til en tilstand, som den ikke er ordineret til. Giv ikke RHINOCORT AQUA (budesonid) næsespray til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne indlægsseddel opsummerer de vigtigste oplysninger om RHINOCORT 100mcg AQUA (budesonid) næsespray. Hvis du vil have mere information, så tal med din sundhedsplejerske. Du kan spørge din apoteker eller sundhedsudbyder om oplysninger om RHINOCORT 100mcg AQUA (budesonid) næsespray, der er skrevet til sundhedspersonale.
For mere information, gå til www.astrazeneca-us.com eller ring til AstraZeneca på 1-800-236-9933.
Hvad er ingredienserne i RHINOCORT AQUA (budesonid) næsespray?
Aktiv ingrediens: budesonid
Inaktive ingredienser: Mikrokrystallinsk cellulose og carboxymethylcellulosenatrium, vandfri dextrose, polysorbat 80, dinatriumedetat, kaliumsorbat og renset vand og saltsyre.
Patientbrugsanvisning
Kun til brug i din næse. Spray ikke i dine øjne eller mund.
Læs patientens brugsanvisning omhyggeligt, før du begynder at bruge RHINOCORT 100mcg AQUA (budesonid) næsespray. Spørg din læge, hvis du har spørgsmål
Figur A 
Sådan primer du din RHINOCORT AQUA (budesonid) næsespray
Før du bruger RHINOCORT AQUA (budesonid) næsespray, skal flasken primes. For at prime RHINOCORT 100mcg AQUA (budesonid) næsespray:
1. Træk for at fjerne den grønne beskyttelseshætte fra næsesprayenheden.
2. Ryst flasken forsigtigt i et par sekunder før hver brug.
3. Hold godt fast i flasken, som vist i figur B, med din pege- og langfinger på hver side af sprøjtespidsen og din tommelfinger under flasken.
Figur B 
4. Aktiver pumpen ved hurtigt og fast at trykke ned på den hvide krave, mens du holder i bunden af flasken med tommelfingeren.
5. Inden din første brug af RHINOCORT AQUA (budesonid) næsespray, ryst flasken forsigtigt. Pumpen skal primes ved at trykke den hvide krave ned 8 gange. Pumpen er nu klar til brug. Hvis den bruges dagligt, behøver pumpen ikke at blive genopfyldt. Hvis den ikke har været brugt i 2 dage i træk, skal den sprayes igen med 1 spray eller indtil en fin spray kommer til syne. Hvis den ikke har været brugt i mere end 14 dage, skylles sprøjtedysen af pumpen ved at bruge de rengøringstrin, der er angivet i slutningen af denne indlægsseddel. Efter rengøring genprimes med 2 sprays eller indtil en fin spray vises.
Hver flaske RHINOCORT AQUA (budesonid) næsespray indeholder nok medicin til, at du kan sprøjte medicin fra flasken 120 gange efter, at flasken er spædet.
Du bør ikke bruge flasken med RHINOCORT 100mcg AQUA (budesonid) næsespray efter 120 sprays. Yderligere sprays efter 120 indeholder muligvis ikke den rigtige mængde medicin. Du bør holde styr på antallet af sprays, du bruger fra hver flaske RHINOCORT 100mcg AQUA næsespray og smide enhver resterende medicin, der måtte være tilbage i flasken. Genopfyld din recept hver måned.
Sådan bruger du din RHINOCORT 100mcg AQUA (budesonid) næsespray
Følg disse instruktioner til daglig brug af RHINOCORT AQUA (budesonid) næsespray:
Figur C 
4. Sæt sprayspidsen ind i dit næsebor (spidsen må ikke nå langt ind i din næse). Luk det andet næsebor med en finger og læn hovedet lidt fremad, så sprayen vil rette sig mod næseryggen (se Figur D ).
Figur D 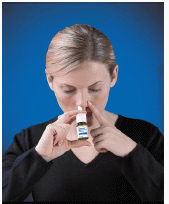
5. For hver spray aktiveres pumpen ved hurtigt og fast at trykke ned på den hvide krave, mens du holder bunden af flasken med tommelfingeren. Træk vejret blidt indad gennem næseboret.
6. Efter at have sprøjtet ind i dit næsebor, læn hovedet bagud i et par sekunder (se Figur E ).
Figur E 
7. Hvis der er behov for en anden spray i det samme næsebor, gentages trin 3 til 6.
8. Gentag trin 3 til 7 for dit andet næsebor.
9. Undgå at pudse næsen i 15 minutter efter du har brugt RHINOCORT 100mcg AQUA (budesonid) næsespray.
10. Tør sprøjtedysen af med en ren serviet (se Figur F ), og sæt den grønne beskyttelseshætte på igen. Opbevar flasken i opretstående stilling.
Figur F 
Sådan rengør du din RHINOCORT 100mcg AQUA (budesonid) næsespray
Figur G 
Skyl den grønne beskyttelseshætte og sprøjtedysen regelmæssigt. At gøre dette:
For yderligere oplysninger om RHINOCORT 100mcg AQUA (budesonid) ® næsespray, ring venligst til AstraZeneca Informationscenter, mandag til fredag kl. 8.00-18.00 ET, undtagen helligdage kl. 1-800-236-9933.
