Flonase Nasal Spray 50mcg Fluticasone Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Flonase, og hvordan bruges det?
Flonase er en receptpligtig medicin, der bruges til at behandle symptomer på allergisk rhinitis (nysen, løbende næse og kløende eller rindende øjne) og næsepolypper. Flonase kan bruges alene eller sammen med anden medicin.
Flonase tilhører en klasse af lægemidler kaldet kortikosteroider, intranasale, immunsuppressiva, PHD.
Det vides ikke, om Flonase er sikkert og effektivt til børn under 4 år.
Hvad er de mulige bivirkninger af Flonase?
Flonase kan forårsage alvorlige bivirkninger, herunder:
- alvorlige eller vedvarende næseblod,
- støjende vejrtrækning,
- løbende næse,
- skorpe omkring dine næsebor,
- rødme, sår eller hvide pletter i din mund eller hals,
- feber,
- kuldegysninger,
- kropssmerter,
- sløret syn,
- øjensmerter,
- ser glorier omkring lys,
- sår, der ikke vil hele,
- forværring af træthed,
- muskelsvaghed,
- svimmelhed,
- kvalme, og
- opkastning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Flonase omfatter:
- mindre næseblod,
- brændende eller kløe i næsen,
- sår eller hvide pletter inde i eller omkring din næse,
- hoste,
- vejrtrækningsbesvær,
- hovedpine,
- rygsmerte,
- sinus smerter,
- ondt i halsen,
- feber,
- kvalme, og
- opkastning
BESKRIVELSE
Den aktive komponent i FLONASE næsespray 50mcg er fluticasonpropionat, et kortikosteroid med det kemiske navn S-(fluormethyl) 6α,9-difluoro-11β,17-dihydroxy-16α-methyl-3oxoandrosta-1,4-dien-17β-carbothioat , 17-propionat og følgende kemiske struktur:
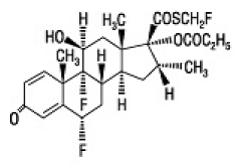
Fluticasonpropionat er et hvidt pulver med en molekylvægt på 500,6, og den empiriske formel er C25H31F3O5S. Det er praktisk talt uopløseligt i vand, frit opløseligt i dimethylsulfoxid og dimethylformamid og let opløseligt i methanol og 95 % ethanol.
FLONASE Næsespray, 50 mcg er en vandig suspension af mikrofin fluticasonpropionat til topisk administration til næseslimhinden ved hjælp af en afmålende, forstøvningsspraypumpe. FLONASE Næsespray 50mcg indeholder også mikrokrystallinsk cellulose og carboxymethylcellulosenatrium, dextrose, 0,02% w/w benzalkoniumchlorid, polysorbat 80 og 0,25% w/w phenylethylalkohol og har en pH mellem 5 og 7.
Efter indledende priming afgiver hver aktivering 50 mcg fluticasonpropionat i 100 mg formulering gennem næseadapteren.
INDIKATIONER
FLONASE® næsespray er indiceret til behandling af næsesymptomer på flerårig ikke-allergisk rhinitis hos voksne og pædiatriske patienter i alderen 4 år og ældre.
DOSERING OG ADMINISTRATION
Administrer kun FLONASE næsespray ad den intranasale vej. Prime FLONASE næsespray før brug for første gang eller efter en periode uden brug (1 uge eller mere) ved at ryste indholdet godt og frigive 6 sprays i luften væk fra ansigtet. Ryst FLONASE næsespray forsigtigt før hver brug.
Patienter bør bruge FLONASE næsespray med jævne mellemrum, da dens effektivitet afhænger af dens regelmæssige brug. Maksimal effekt kan tage flere dage, og individuelle patienter vil opleve en variabel tid til debut og forskellig grad af symptomlindring.
Voksne
Den anbefalede startdosis til voksne er 2 sprays (50 mcg fluticasonpropionat hver) i hvert næsebor én gang dagligt (samlet daglig dosis, 200 mcg). Den samme samlede daglige dosis, 1 spray i hvert næsebor indgivet to gange dagligt (f.eks. kl. 8 og kl. 20) er også effektiv. Efter de første par dage kan patienterne muligvis reducere deres dosis til 1 spray i hvert næsebor én gang dagligt til vedligeholdelsesbehandling.
Den maksimale samlede daglige dosis bør ikke overstige 2 sprays i hvert næsebor (samlet dosis, 200 mcg/dag). Der er ingen beviser for, at overskridelse af den anbefalede dosis er mere effektivt.
Unge og børn (i alderen 4 år og ældre)
Den anbefalede startdosis til unge og børn i alderen 4 år og ældre er 1 spray i hvert næsebor én gang dagligt (samlet daglig dosis, 100 mcg). Patienter, der ikke reagerer tilstrækkeligt på 1 spray i hvert næsebor, kan bruge 2 spray i hvert næsebor én gang dagligt (samlet daglig dosis, 200 mcg). Når tilstrækkelig kontrol er opnået, skal dosis nedsættes til 1 spray i hvert næsebor én gang dagligt.
Den maksimale totale daglige dosis bør ikke overstige 2 sprays i hvert næsebor (200 mcg/dag). Der er ingen beviser for, at overskridelse af den anbefalede dosis er mere effektivt.
HVORDAN LEVERET
Doseringsformer og styrker
FLONASE Næsespray er en næsespraysuspension. Hver 100 mg spray giver 50 mcg fluticasonpropionat.
Opbevaring og håndtering
FLONASE Næsespray, 50 mcg leveres i en ravgul glasflaske udstyret med en hvid doseringsforstøvningspumpe, hvid næseadapter og grønt støvdæksel i en æske med 1 ( NDC 0173-0453-01) med FDA-godkendt Patientmærkning (se Patientbrugsanvisning til korrekt aktivering af enheden ). Hver flaske har en nettofyldningsvægt på 16 g og giver 120 aktiveringer. Hver aktivering afgiver 50 mcg fluticasonpropionat i 100 mg formulering gennem næseadapteren. Den korrekte mængde medicin i hver spray kan ikke sikres efter 120 sprays, selvom flasken ikke er helt tom. Flasken skal kasseres, når det mærkede antal aktiveringer er blevet brugt.
Opbevares mellem 4° og 30°C (39° og 86°F).
GlaxoSmithKline Research Triangle Park, NC 27709. Revideret: Jan 2015
BIVIRKNINGER
Systemisk og lokal kortikosteroidbrug kan resultere i følgende:
- Epistaxis, nasal ulceration, Candida albicans infektion, nasal septal perforation og nedsat sårheling [se ADVARSLER OG FORHOLDSREGLER ]
- Grå stær og glaukom [se ADVARSLER OG FORHOLDSREGLER ]
- Immunsuppression [se ADVARSLER OG FORHOLDSREGLER ]
- Hypercorticisme og binyrebarksuppression [se ADVARSLER OG FORHOLDSREGLER ]
- Virkning på vækst [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan de bivirkninger, der er observeret i de kliniske forsøg med et lægemiddel, ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
I kontrollerede amerikanske kliniske forsøg modtog mere end 3.300 forsøgspersoner med allergisk og ikke-allergisk rhinitis behandling med intranasal fluticasonpropionat. Generelt har bivirkninger i kliniske forsøg primært været forbundet med irritation af næseslimhinderne, og bivirkningerne blev rapporteret med omtrent samme hyppighed af forsøgspersoner behandlet med placebo. Mindre end 2 % af forsøgspersonerne i kliniske forsøg afbrød behandlingen på grund af bivirkninger; denne rate var ens for vehikelplacebo og aktive komparatorer.
Sikkerhedsdataene beskrevet nedenfor er baseret på 7 placebokontrollerede kliniske forsøg med personer med allergisk rhinitis. De 7 forsøg omfattede 536 forsøgspersoner (57 piger og 108 drenge i alderen 4 til 11 år, 137 kvinder og 234 mandlige unge og voksne) behandlet med FLONASE 200 mcg én gang dagligt over 2 til 4 uger og 2 placebokontrollerede kliniske forsøg, som omfattede 246 (119 kvinder og 127 mandlige unge og voksne) behandlet med FLONASE 200 mcg én gang dagligt over 6 måneder (tabel 1). Også inkluderet i tabel 1 er bivirkninger fra 2 forsøg, hvor 167 børn (45 piger og 122 drenge i alderen 4 til 11 år) blev behandlet med FLONASE 100 mcg én gang dagligt i 2 til 4 uger.
Andre bivirkninger med FLONASE næsespray 50mcg observeret med en forekomst på mindre end eller lig med 3%, men større end eller lig med 1% og mere almindelige end med placebo inkluderet: blod i næseslim, løbende næse, mavesmerter, diarré, feber, influenzalignende symptomer, ømhed og smerter, svimmelhed og bronkitis.
Postmarketing oplevelse
Ud over bivirkninger rapporteret fra kliniske forsøg, er følgende bivirkninger blevet identificeret under post-godkendelse brug af intranasal fluticasonpropionat. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering. Disse hændelser er blevet valgt til inklusion på grund af enten deres alvor, hyppighed af rapportering eller årsagssammenhæng til fluticasonpropionat eller en kombination af disse faktorer.
Generelle lidelser og betingelser for administrationsstedet
Overfølsomhedsreaktioner, herunder angioødem, hududslæt, ødem i ansigt og tunge, kløe, nældefeber, bronkospasme, hvæsen, dyspnø og anafylaksi/anafylaktoide reaktioner, som i sjældne tilfælde var alvorlige.
Øre- og labyrintlidelser
Ændring eller tab af smags- og/eller lugtesans og sjældent perforering af næseseptum, næsesår, ondt i halsen, irritation og tørhed i halsen, hoste, hæshed og stemmeændringer.
Øjenlidelser
Tørhed og irritation, conjunctivitis, sløret syn, glaukom, øget intraokulært tryk og grå stær.
Tilfælde af væksthæmning er blevet rapporteret for intranasale kortikosteroider, inklusive FLONASE [se ADVARSLER OG FORHOLDSREGLER ].
DRUGSINTERAKTIONER
Hæmmere af Cytochrom P450 3A4
Fluticasonpropionat er et substrat for CYP3A4. Anvendelse af stærke CYP3A4-hæmmere (f.eks. ritonavir, atazanavir, clarithromycin, indinavir, itraconazol, nefazodon, nelfinavir, saquinavir, ketoconazol, telithromycin, conivaptan, lopinavir, nefazodon, voriconazol, voriconazol, fordi øget nasal effekt af FLONASE ikke anbefales) med øget nasal effekt af FLONASE i systemet. kan ske.
Ritonavir
Et lægemiddelinteraktionsforsøg med fluticasonpropionat vandig næsespray hos raske forsøgspersoner har vist, at ritonavir (en stærk CYP3A4-hæmmer) signifikant kan øge plasmafluticasonpropionateksponeringen, hvilket resulterer i signifikant reducerede serumkortisolkoncentrationer [se KLINISK FARMAKOLOGI ]. Under postmarketingbrug har der været rapporter om klinisk signifikante lægemiddelinteraktioner hos patienter, der får fluticasonpropionatprodukter, inklusive FLONASE, med ritonavir, hvilket resulterer i systemiske kortikosteroidvirkninger, herunder Cushings syndrom og binyrebarksuppression.
Ketoconazol
Samtidig administration af oralt inhaleret fluticasonpropionat (1.000 mcg) og ketoconazol (200 mg én gang dagligt) resulterede i en 1,9 gange stigning i plasma fluticasonpropionat eksponering og et 45 % fald i plasma cortisol area under curve (AUC), men havde ingen effekt. på urinudskillelse af kortisol.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Lokale næseeffekter
Epistaxis
kliniske forsøg af 2 til 26 ugers varighed blev epistaxis observeret hyppigere hos forsøgspersoner behandlet med FLONASE næsespray end dem, der fik placebo [se BIVIRKNINGER ].
Nasal Ulceration
Postmarketing tilfælde af nasal ulceration er blevet rapporteret hos patienter behandlet med FLONASE næsespray [se BIVIRKNINGER ].
Candida infektion
I kliniske forsøg med fluticasonpropionat administreret intranasalt er der opstået udvikling af lokaliserede infektioner i næse og svælg med Candida albicans. Når en sådan infektion udvikler sig, kan det kræve behandling med passende lokal terapi og seponering af FLONASE næsespray. Patienter, der bruger FLONASE næsespray over flere måneder eller længere, bør undersøges periodisk for tegn på Candida-infektion eller andre tegn på bivirkninger på næseslimhinden.
Perforering af næseseptum
Postmarketing tilfælde af nasal septal perforation er blevet rapporteret hos patienter behandlet med FLONASE næsespray [se BIVIRKNINGER ].
Nedsat sårheling
På grund af kortikosteroiders hæmmende virkning på sårheling, bør patienter, som for nylig har oplevet næsesår, næseoperationer eller næsetraumer, undgå at bruge FLONASE næsespray, indtil heling er sket.
Grøn stær og grå stær
Brug af intranasale og inhalerede kortikosteroider kan resultere i udvikling af glaukom og/eller grå stær. Derfor er tæt overvågning berettiget hos patienter med en ændring i synet eller med en anamnese med forhøjet intraokulært tryk, glaukom og/eller grå stær.
Overfølsomhedsreaktioner inklusive anafylaksi
Overfølsomhedsreaktioner (f.eks. anafylaksi, angioødem, nældefeber, kontaktdermatitis og udslæt) er blevet rapporteret efter administration af FLONASE næsespray. Afbryd FLONASE
Næsespray, hvis sådanne reaktioner opstår [se KONTRAINDIKATIONER ]. I sjældne tilfælde kan der opstå øjeblikkelige overfølsomhedsreaktioner efter administration af FLONASE næsespray.
Immunsuppression
Personer, der bruger lægemidler, der undertrykker immunsystemet, er mere modtagelige for infektioner end raske personer. Skoldkopper og mæslinger kan for eksempel have et mere alvorligt eller endda dødeligt forløb hos modtagelige børn eller voksne, der bruger kortikosteroider. Hos sådanne børn eller voksne, som ikke har haft disse sygdomme eller er blevet ordentligt immuniseret, skal der udvises særlig forsigtighed for at undgå eksponering. Hvordan dosis, vej og varighed af indgivelse af kortikosteroider påvirker risikoen for at udvikle en spredt infektion vides ikke. Bidraget fra den underliggende sygdom og/eller tidligere kortikosteroidbehandling til risikoen er heller ikke kendt. Hvis en patient er udsat for skoldkopper, kan profylakse med varicella zoster immunglobulin (VZIG) være indiceret. Hvis en patient er udsat for mæslinger, kan profylakse med puljet intramuskulært immunglobulin (IG) være indiceret. (Se den komplette ordinationsinformation for VZIG og IG. Hvis der udvikles skoldkopper, kan behandling med antivirale midler overvejes.
Intranasale kortikosteroider bør anvendes med forsigtighed, hvis overhovedet, til patienter med aktive eller hvilende tuberkuløse infektioner i luftvejene; systemiske svampe-, bakterie-, virus- eller parasitinfektioner; eller okulær herpes simplex.
Hyperkorticisme og binyrebarksuppression
Når intranasale kortikosteroider anvendes i højere doser end anbefalet eller til modtagelige personer i anbefalede doser, kan systemiske kortikosteroideffekter såsom hyperkorticisme og binyrebarksuppression forekomme. Hvis sådanne ændringer forekommer, skal doseringen af FLONASE næsespray seponeres langsomt i overensstemmelse med accepterede procedurer for seponering af oral kortikosteroidbehandling.
Udskiftning af et systemisk kortikosteroid med et topisk kortikosteroid kan være ledsaget af tegn på binyrebarkinsufficiens. Derudover kan nogle patienter opleve symptomer på kortikosteroidabstinenser (f.eks. led- og/eller muskelsmerter, træthed, depression). Patienter, der tidligere er blevet behandlet i længere perioder med systemiske kortikosteroider og overført til topikale kortikosteroider, bør overvåges omhyggeligt for akut binyrebarkinsufficiens som reaktion på stress. Hos patienter, som har astma eller andre kliniske tilstande, der kræver langvarig systemisk kortikosteroidbehandling, kan hurtige fald i systemiske kortikosteroiddoseringer forårsage en alvorlig forværring af deres symptomer.
Lægemiddelinteraktioner med stærke cytokrom P450 3A4-hæmmere
Anvendelse af stærke cytokrom P450 3A4 (CYP3A4) hæmmere (f.eks. ritonavir, atazanavir, clarithromycin, indinavir, itraconazol, nefazodon, nelfinavir, saquinavir, ketoconazol, telithromycin, conivaptan, lopinavir, lopinavir, nefconazodon, fordi det ikke anbefales sammen med vor FL nefconazodon) øgede systemiske kortikosteroidbivirkninger kan forekomme [se DRUGSINTERAKTIONER , KLINISK FARMAKOLOGI ].
Effekt på vækst
Intranasale kortikosteroider kan forårsage en reduktion i væksthastigheden, når de administreres til pædiatriske patienter [se Brug i specifikke populationer ]. Overvåg væksten rutinemæssigt hos pædiatriske patienter, der får FLONASE næsespray. For at minimere de systemiske virkninger af intranasale kortikosteroider, inklusive FLONASE næsespray, titreres hver patients dosis til den laveste dosis, der effektivt kontrollerer hans/hendes symptomer [se DOSERING OG ADMINISTRATION , Brug i specifikke populationer ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTINFORMATION og brugsanvisning ).
Lokale næseeffekter
Informer patienterne om, at behandling med FLONASE næsespray 50mcg kan føre til bivirkninger, som omfatter næseblod og næsesår. Candida-infektion kan også forekomme ved behandling med FLONASE næsespray. Derudover er FLONASE næsespray 50mcg blevet forbundet med perforering af næseseptum og nedsat sårheling. Patienter, som for nylig har oplevet næsesår, næsekirurgi eller nasal traume, bør ikke bruge FLONASE næsespray 50mcg, før heling er sket [se ADVARSLER OG FORHOLDSREGLER ].
Grøn stær og grå stær
Informer patienterne om, at glaukom og grå stær er forbundet med nasal og inhaleret kortikosteroidbrug. Rådgive patienter om at underrette deres sundhedspersonale, hvis der bemærkes en ændring i synet, mens de bruger FLONASE næsespray [se ADVARSLER OG FORHOLDSREGLER ].
Overfølsomhedsreaktioner, herunder anafylaksi
Informer patienterne om, at overfølsomhedsreaktioner, herunder anafylaksi, angioødem, nældefeber, kontaktdermatitis og udslæt, kan forekomme efter administration af FLONASE næsespray. Hvis sådanne reaktioner opstår, skal patienterne holde op med at bruge FLONASE næsespray [se ADVARSLER OG FORHOLDSREGLER ].
Immunsuppression
Advar patienter, der er på immunsuppressive doser af kortikosteroider, for at undgå eksponering for skoldkopper eller mæslinger, og hvis de udsættes for at konsultere deres sundhedsplejerske uden forsinkelse. Informer patienter om potentiel forværring af eksisterende tuberkulose; svampe-, bakterie-, virus- eller parasitinfektioner; eller okulær herpes simplex [se ADVARSLER OG FORHOLDSREGLER ].
Reduceret væksthastighed
Rådfør forældrene om, at FLONASE næsespray 50mcg kan forårsage en reduktion i væksthastigheden, når den administreres til pædiatriske patienter. Læger bør nøje følge væksten hos børn og unge, der tager kortikosteroider ad enhver vej [se ADVARSLER OG FORHOLDSREGLER , Pædiatrisk brug ].
Brug dagligt for den bedste effekt
Informer patienterne om, at de skal bruge FLONASE næsespray 50mcg regelmæssigt. FLONASE Næsespray 50mcg har ligesom andre kortikosteroider ikke en umiddelbar effekt på rhinitis symptomer. Maksimal fordel kan ikke nås før flere dage. Patienter bør ikke øge den ordinerede dosis, men bør kontakte deres læge, hvis symptomerne ikke forbedres, eller hvis tilstanden forværres.
Hold spray ude af øjne og mund
Informer patienterne om at undgå at sprøjte FLONASE næsespray i deres øjne og mund.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Fluticasonpropionat viste intet tumorogent potentiale hos mus ved orale doser op til 1.000 mcg/kg (ca. 20 gange MRHDID hos voksne og ca. 10 gange MRHDID hos børn på mcg/m² basis) i 78 uger eller hos rotter ved inhalationsdoser op. til 57 mcg/kg (ca. 2 gange MRHDID hos voksne og omtrent svarende til MRHDID hos børn på en mcg/m² basis) i 104 uger.
Fluticasonpropionat inducerede ikke genmutation i prokaryote eller eukaryote celler in vitro. Der blev ikke set nogen signifikant klastogen effekt i dyrkede humane perifere lymfocytter in vitro eller i mikronukleustesten hos mus.
Der blev ikke observeret tegn på svækkelse af fertilitet hos han- og hunrotter ved subkutane doser op til 50 mcg/kg (ca. 2 gange MRHDID hos voksne på en mcg/m²-basis). Prostatavægten blev signifikant reduceret ved en subkutan dosis på 50 mcg/kg.
Kliniske Studier
Flerårig ikke-allergisk rhinitis
Tre randomiserede, dobbeltblindede, parallelgruppe, placebokontrollerede vehikelforsøg blev udført i 1.191 forsøgspersoner for at undersøge regelmæssig brug af FLONASE næsespray 50 mcg hos forsøgspersoner med flerårig ikke-allergisk rhinitis. Disse forsøg evaluerede forsøgsperson-vurderede total nasale symptomscore (TNSS), der inkluderede nasal obstruktion, postnasal drop, rhinoré hos forsøgspersoner, der blev behandlet i 28 dage med dobbeltblind terapi og i 1 af de 3 forsøg i 6 måneders åben behandling. To af disse forsøg viste, at forsøgspersoner behandlet med FLONASE næsespray (100 mcg to gange dagligt) udviste statistisk signifikante fald i TNSS sammenlignet med forsøgspersoner behandlet med vehikel.
Brug i specifikke populationer
Graviditet
Teratogene virkninger
Graviditetskategori C. Der er ingen tilstrækkelige og velkontrollerede forsøg med FLONASE næsespray hos gravide kvinder. Kortikosteroider har vist sig at være teratogene hos laboratoriedyr, når de administreres systemisk i relativt lave dosisniveauer. Da reproduktionsstudier på dyr ikke altid er forudsigelige for human respons, bør FLONASE næsespray kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret. Kvinder bør rådes til at kontakte deres læge, hvis de bliver gravide, mens de tager FLONASE næsespray.
Mus og rotter ved fluticasonpropionat-doser henholdsvis ca. 1 og 4 gange den maksimalt anbefalede humane daglige intranasale dosis (MRHDID) til voksne (på mg/m²-basis ved maternelle subkutane doser på henholdsvis 45 og 100 mcg/kg/dag) viste føtal toksicitet karakteristisk for potente kortikosteroidforbindelser, herunder embryonal vækstretardering, omphalocele, ganespalte og retarderet kranieforbening. Der blev ikke set teratogenicitet hos rotter ved doser op til 3 gange MRHDID (på mg/m² basis ved inhalationsdoser op til 68,7 mcg/kg/dag hos moderen).
Hos kaniner blev føtal vægtreduktion og ganespalte observeret ved en fluticasonpropionatdosis på ca. 0,3 gange MRHDID for voksne (på mg/m² basis ved en maternal subkutan dosis på 4 mcg/kg/dag). Der blev dog ikke rapporteret teratogene virkninger ved fluticasonpropionat-doser op til ca. 20 gange MRHDID for voksne (på mg/m²-basis ved en moder oral dosis op til 300 mcg/kg/dag). Der blev ikke påvist fluticasonpropionat i plasma i denne undersøgelse, hvilket stemmer overens med den etablerede lave biotilgængelighed efter oral administration [se KLINISK FARMAKOLOGI ].
Fluticasonpropionat krydsede placenta efter subkutan administration til mus og rotter og oral administration til kaniner.
Erfaring med orale kortikosteroider siden deres introduktion i farmakologiske, i modsætning til fysiologiske doser tyder på, at gnavere er mere tilbøjelige til teratogene virkninger fra kortikosteroider end mennesker. Fordi der er en naturlig stigning i kortikosteroidproduktionen under graviditeten, vil de fleste kvinder desuden have behov for en lavere eksogen kortikosteroiddosis, og mange vil ikke have behov for kortikosteroidbehandling under graviditeten.
Ikke-ratatogene virkninger
Hypoadrenalisme kan forekomme hos spædbørn født af mødre, der får kortikosteroider under graviditeten. Sådanne spædbørn bør overvåges nøje.
Ammende mødre
Det vides ikke, om fluticasonpropionat udskilles i human modermælk. Andre kortikosteroider er dog blevet påvist i modermælk. Subkutan administration til diegivende rotter af tritieret fluticasonpropionat i en dosis på ca. 0,4 gange MRHDID for voksne på mg/m²-basis resulterede i målbar radioaktivitet i mælk.
Da der ikke er data fra kontrollerede undersøgelser om brug af intranasal FLONASE næsespray 50mcg af ammende mødre, bør der udvises forsigtighed, når FLONASE næsespray 50mcg administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerheden og effektiviteten af FLONASE næsespray til børn i alderen 4 år og ældre er blevet fastslået [se BIVIRKNINGER , KLINISK FARMAKOLOGI ].Seks hundrede og halvtreds (650) forsøgspersoner i alderen 4 til 11 år og 440 forsøgspersoner i alderen 12 til 17 år blev undersøgt i amerikanske kliniske forsøg med fluticasonpropionat næsespray. Sikkerheden og effektiviteten af FLONASE næsespray 50mcg hos børn under 4 år er ikke blevet fastslået.
Effekter på vækst
Kontrollerede kliniske forsøg har vist, at intranasale kortikosteroider kan forårsage en reduktion i væksthastigheden, når de administreres til pædiatriske patienter. Denne effekt blev observeret i fravær af laboratoriebeviser for hypothalamus-hypofyse-binyre (HPA) aksesuppression, hvilket tyder på, at væksthastighed er en mere følsom indikator for systemisk kortikosteroideksponering hos pædiatriske patienter end nogle almindeligt anvendte test af HPA-aksefunktion. De langsigtede virkninger af denne reduktion i væksthastighed forbundet med intranasale kortikosteroider, herunder indvirkningen på den endelige voksenhøjde, er ukendte. Potentialet for "catch-up" vækst efter seponering af behandling med intranasale kortikosteroider er ikke blevet tilstrækkeligt undersøgt. Væksten hos pædiatriske patienter, der får intranasale kortikosteroider, inklusive FLONASE næsespray, bør overvåges rutinemæssigt (f.eks. via stadiometri). De potentielle væksteffekter af langvarig behandling bør afvejes i forhold til de opnåede kliniske fordele og risici forbundet med alternative behandlinger. For at minimere de systemiske virkninger af intranasale kortikosteroider, inklusive FLONASE næsespray, bør hver patients dosis titreres til den laveste dosis, der effektivt kontrollerer hans/hendes symptomer.
Et 1-årigt placebokontrolleret forsøg blev udført med 150 pædiatriske forsøgspersoner (i alderen 3 til 9 år) for at vurdere effekten af FLONASE næsespray (enkelt daglig dosis på 200 mcg) på væksthastigheden. Fra den primære population, der fik FLONASE næsespray (n = 56) og placebo (n = 52), var punktestimatet for væksthastighed med FLONASE næsespray 50 mcg 0,14 cm/år lavere end placebo (95 % CI: -0,54, 0,27 cm) /år). Der blev således ikke observeret nogen statistisk signifikant effekt på væksten sammenlignet med placebo. Der blev ikke observeret nogen evidens for klinisk relevante ændringer i HPA-aksefunktion eller knoglemineraltæthed som vurderet ved henholdsvis 12-timers kortisoludskillelse i urinen og dobbelt-energi røntgenabsorptiometri.
Potentialet for, at FLONASE næsespray 50mcg forårsager væksthæmning hos følsomme patienter, eller når det gives i højere end anbefalede doser, kan ikke udelukkes.
Geriatrisk brug
Et begrænset antal forsøgspersoner i alderen 65 år og ældre (n = 129) eller 75 år og ældre (n = 11) er blevet behandlet med FLONASE næsespray i kliniske forsøg. Mens antallet af forsøgspersoner er for lille til at tillade separat analyse af effektivitet og sikkerhed, svarede de rapporterede bivirkninger i denne population til dem, der blev rapporteret af yngre patienter. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling.
Nedsat leverfunktion
Formelle farmakokinetiske forsøg med FLONASE næsespray 50mcg er ikke blevet udført hos personer med nedsat leverfunktion. Da fluticasonpropionat overvejende udskilles ved levermetabolisme, kan nedsat leverfunktion føre til akkumulering af fluticasonpropionat i plasma. Derfor bør patienter med leversygdom overvåges nøje.

Nedsat nyrefunktion
Formelle farmakokinetiske undersøgelser med FLONASE næsespray er ikke blevet udført hos personer med nedsat nyrefunktion.
OVERDOSIS
Kronisk overdosering kan resultere i tegn/symptomer på hyperkorticisme (se FORHOLDSREGLER ). Intranasal administration af 2 mg (10 gange den anbefalede dosis) fluticasonpropionat to gange dagligt i 7 dage til raske frivillige forsøgspersoner var veltolereret. Enkelte orale doser op til 16 mg er blevet undersøgt hos frivillige forsøgspersoner uden rapporterede akutte toksiske effekter. Gentag orale doser op til 80 mg dagligt i 10 dage hos frivillige og gentagne orale doser op til 10 mg dagligt i 14 dage hos patienter var veltolereret. Bivirkningerne var af mild eller moderat sværhedsgrad, og forekomsten var ens i aktiv- og placebobehandlingsgrupper. Akut overdosering med denne doseringsform er usandsynlig, da 1 flaske FLONASE (fluticasonpropionat) næsespray indeholder ca. 8 mg fluticasonpropionat.
De orale og subkutane median letale doser hos mus og rotter var >1.000 mg/kg (henholdsvis >20.000 og >41.000 gange den maksimalt anbefalede daglige intranasale dosis til voksne og henholdsvis >10.000 og >20.000 gange den maksimalt anbefalede daglige intranasale dosis dosis til børn på mg/m2-basis).
KONTRAINDIKATIONER
FLONASE (fluticasonpropionat) næsespray er kontraindiceret til patienter med overfølsomhed over for nogen af dets ingredienser.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Fluticasonpropionat er et syntetisk trifluoreret kortikosteroid med antiinflammatorisk aktivitet. Fluticasonpropionat har vist sig in vitro at udvise en bindingsaffinitet for den humane glukokortikoidreceptor, der er 18 gange større end dexamethason, næsten dobbelt så stor som beclomethason-17-monopropionat (BMP), den aktive metabolit af beclomethasondipropionat, og over 3 gange så stor som af budesonid. Data fra McKenzie vasokonstriktoranalysen hos mennesker er i overensstemmelse med disse resultater. Den kliniske betydning af disse fund er ukendt.
Den præcise mekanisme, hvorigennem fluticasonpropionat påvirker rhinitissymptomer, er ikke kendt. Kortikosteroider har vist sig at have en bred vifte af virkninger på flere celletyper (f.eks. mastceller, eosinofiler, neutrofiler, makrofager, lymfocytter) og mediatorer (f.eks. histamin, eicosanoider, leukotriener, cytokiner) involveret i inflammation. I 7 forsøg med voksne har FLONASE næsespray nedsat eosinofiler i næseslimhinden hos 66 % af patienterne (35 % for placebo) og basofiler hos 39 % af patienterne (28 % for placebo). Det direkte forhold mellem disse fund og langsigtet symptomlindring er ikke kendt.
Farmakodynamik
HPA-akseeffekt
De potentielle systemiske effekter af FLONASE næsespray 50mcg på HPA-aksen blev evalueret. FLONASE Næsespray 50 mcg givet som 200 mcg én gang dagligt eller 400 mcg to gange dagligt blev sammenlignet med placebo eller oral prednison 7,5 eller 15 mg givet om morgenen. FLONASE Næsespray i begge doser i 4 uger påvirkede ikke binyreresponsen på 6-timers cosyntropin-stimulering, mens begge doser af oral prednison reducerede responset på cosyntropin signifikant.
Hjerteelektrofysiologi
Der er ikke udført et studie specifikt designet til at evaluere effekten af FLONASE på QT-intervallet.
Farmakokinetik
Aktiviteten af FLONASE næsespray 50mcg skyldes moderlægemidlet, fluticasonpropionat. På grund af den lave biotilgængelighed ad den intranasale vej blev størstedelen af de farmakokinetiske data opnået via andre administrationsveje.
Absorption
Indirekte beregninger indikerer, at fluticasonpropionat leveret ad den intranasale vej har en absolut biotilgængelighed på i gennemsnit mindre end 2 %. Forsøg med oral dosering af mærket og umærket lægemiddel har vist, at den orale systemiske biotilgængelighed af fluticasonpropionat er ubetydelig (
Fordeling
Efter intravenøs administration var den indledende dispositionsfase for fluticasonpropionat hurtig og i overensstemmelse med dets høje lipidopløselighed og vævsbinding. Fordelingsvolumenet var i gennemsnit 4,2 l/kg.
Procentdelen af fluticasonpropionat bundet til humane plasmaproteiner var i gennemsnit 99 %. Fluticasonpropionat er svagt og reversibelt bundet til erytrocytter og er ikke signifikant bundet til humant transcortin.
Elimination
Efter intravenøs dosering udviste fluticasonpropionat polyeksponentiel kinetik og havde en terminal eliminationshalveringstid på ca. 7,8 timer. Den totale blodclearance af fluticasonpropionat er høj (gennemsnit: 1.093 ml/min), med renal clearance, der udgør mindre end 0,02 % af den totale.
Metabolisme: Den eneste cirkulerende metabolit påvist hos mennesker er 17β-carboxylsyrederivatet af fluticasonpropionat, som dannes gennem CYP3A4-vejen. Denne metabolit havde mindre affinitet (ca. 1/2.000) end moderlægemidlet til glukokortikoidreceptoren i human lungecytosol in vitro og ubetydelig farmakologisk aktivitet i dyreforsøg. Andre metabolitter påvist in vitro ved hjælp af dyrkede humane hepatomceller er ikke blevet påvist hos mennesker.
Udskillelse: Mindre end 5 % af en radioaktivt mærket oral dosis blev udskilt i urinen som metabolitter, mens resten udskilt i fæces som moderlægemiddel og metabolitter.
Særlige Populationer
Fluticasonpropionat næsespray blev ikke undersøgt i nogen særlige populationer, og der er ikke opnået kønsspecifikke farmakokinetiske data.
Lægemiddelinteraktioner
Hæmmere af Cytochrom P450 3A4: Ritonavir: Fluticasonpropionat er et substrat for CYP3A4. Samtidig administration af fluticasonpropionat og den stærke CYP3A4-hæmmer, ritonavir, anbefales ikke baseret på et multiple-dosis, crossover lægemiddelinteraktionsforsøg hos 18 raske forsøgspersoner. Fluticasonpropionat vandig næsespray (200 mcg én gang dagligt) blev administreret samtidigt i 7 dage med ritonavir (100 mg to gange dagligt). Plasmakoncentrationer af fluticasonpropionat efter vandig næsespray af fluticasonpropionat alene var upåviselige (
Ketoconazol: Samtidig administration af oralt inhaleret fluticasonpropionat (1.000 mcg) og ketoconazol (200 mg én gang dagligt) resulterede i en 1,9 gange stigning i plasma fluticasonpropionateksponering og et 45 % fald i plasmakortisol AUC, men havde ingen effekt på urinudskillelse af cortisol.
Erythromycin: I et lægemiddelinteraktionsstudie med flere doser påvirkede samtidig administration af oralt inhaleret fluticasonpropionat (500 mcg to gange dagligt) og erythromycin (333 mg 3 gange dagligt) ikke fluticasonpropionats farmakokinetik.
PATIENTOPLYSNINGER
FLONASE® [flow'naz] (fluticasonpropionat) næsespray, 50 mcg
Læs patientinformationen, der følger med FLONASE næsespray, før du begynder at bruge den, og hver gang du får en refill. Der kan være nye oplysninger. Denne patientinformation træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller behandling.
Hvad er FLONASE næsespray?
FLONASE Næsespray 50mcg er en receptpligtig medicin, der bruges til at behandle ikke-allergiske næsesymptomer såsom løbende næse, tilstoppet næse, nysen og næsekløe hos voksne og børn i alderen 4 år og ældre.
Det vides ikke, om FLONASE næsespray 50mcg er sikkert og effektivt til børn under 4 år.
Hvem bør ikke bruge FLONASE næsespray 50mcg?
Brug ikke FLONASE næsespray 50mcg, hvis du er allergisk over for fluticasonpropionat eller nogen af ingredienserne i FLONASE næsespray. Se "Hvad er ingredienserne i FLONASE næsespray 50mcg?" nedenfor for en komplet liste over ingredienser.
Hvad skal jeg fortælle min læge, før jeg bruger FLONASE næsespray 50mcg?
Fortæl din sundhedsplejerske om alle dine helbredstilstande, herunder hvis du:
- har eller har haft næsesår, næseoperation eller næseskade.
- har øjenproblemer, såsom grå stær eller glaukom.
- har et immunsystemproblem.
- er allergisk over for nogen af ingredienserne i FLONASE næsespray, enhver anden medicin eller fødevareprodukter. Se "Hvad er ingredienserne i FLONASE næsespray?" nedenfor for en komplet liste over ingredienser.
- har nogen form for viral, bakteriel eller svampeinfektion.
- er udsat for skoldkopper eller mæslinger.
- har andre medicinske tilstande.
- er gravid eller planlægger at blive gravid. Det vides ikke, om FLONASE næsespray kan skade dit ufødte barn.
- ammer eller planlægger at amme. Det vides ikke, om FLONASE næsespray 50mcg går over i din modermælk, og om det kan skade din baby.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. FLONASE næsespray og visse andre lægemidler kan interagere med hinanden. Dette kan forårsage alvorlige bivirkninger. Fortæl især din læge, hvis du tager medicin mod svamp eller HIV.
Kend den medicin du tager. Hold en liste over dem for at vise din læge og apotek, når du får en ny medicin.
Hvordan skal jeg bruge FLONASE næsespray?
Læs trin-for-trin instruktionerne for brug af FLONASE næsespray i slutningen af denne patientinformation.
- FLONASE næsespray er kun til brug i din næse. Spray det ikke i dine øjne eller mund.
- Børn bør bruge FLONASE næsespray med en voksens hjælp, som instrueret af barnets sundhedsplejerske.
- Brug FLONASE næsespray 50mcg nøjagtigt som din læge fortæller dig. Brug ikke FLONASE næsespray oftere end foreskrevet.
- FLONASE Næsespray kan tage flere dages regelmæssig brug, før dine rhinitis-symptomer bliver bedre. Ring til din læge, hvis dine symptomer ikke forbedres eller forværres.
- Du får de bedste resultater, hvis du fortsætter med at bruge FLONASE næsespray regelmæssigt hver dag uden at gå glip af en dosis. Når du begynder at føle dig bedre, kan din læge muligvis reducere din dosis. Lade være med stop med at bruge FLONASE næsespray 50mcg, medmindre din læge fortæller dig at gøre det.
Hvad er de mulige bivirkninger af FLONASE Næsespray 50mcg?
FLONASE Næsespray 50mcg kan forårsage alvorlige bivirkninger, herunder:
- næseproblemer. Næseproblemer kan omfatte:
- næseblod.
- sår (sår) i din næse.
- en vis svampeinfektion i din næse, mund og/eller svælg (trøske).
- hul i brusken i din næse (perforering af næseskillevæggen). Symptomer på perforering af næseseptum kan omfatte:
- skorper i næsen
- næseblod
- løbende næse
- fløjtende lyd, når du trækker vejret
- langsom sårheling. Du bør ikke bruge FLONASE næsespray, før din næse er helet, hvis du har et sår i næsen, er blevet opereret i næsen, eller hvis din næse er blevet skadet.
- øjenproblemer, herunder glaukom og grå stær. Du bør have regelmæssige øjenundersøgelser, mens du bruger FLONASE næsespray.
- alvorlige allergiske reaktioner. Ring til din læge eller få akut lægehjælp, hvis du får nogle af følgende tegn på en alvorlig allergisk reaktion:
- udslæt
- nældefeber
- hævelse af dit ansigt, mund og tunge
- vejrtrækningsproblemer
- svækket immunsystem og øget chance for at få infektioner (immunsuppression). Hvis du tager medicin, der svækker dit immunsystem, øges risikoen for at få infektioner og kan forværre visse infektioner. Disse infektioner kan omfatte tuberkulose (TB), okulær herpes simplex-infektion og infektioner forårsaget af svampe, bakterier, vira og parasitter. Undgå kontakt med personer, der har en smitsom sygdom såsom skoldkopper eller mæslinger, mens de bruger FLONASE næsespray. Hvis du kommer i kontakt med en person, der har skoldkopper eller mæslinger, skal du kontakte din læge med det samme. Symptomer på en infektion kan omfatte:
- feber
- træthedsfornemmelse
- smerte
- kvalme
- smerter
- opkastning
- kuldegysninger
- nedsatte steroidhormonniveauer (binyrebarkinsufficiens). Binyrebarkinsufficiens opstår, når dine binyrer ikke producerer nok steroidhormoner. Dette kan ske, når du holder op med at tage orale kortikosteroidmedicin (såsom prednison) og begynder at tage medicin, der indeholder et inhaleret steroid (såsom FLONASE næsespray). Symptomer på binyrebarkinsufficiens kan omfatte:
- træthedsfornemmelse
- mangel på energi
- svaghed
- kvalme og opkast
- lavt blodtryk
- nedsat vækst hos børn. Et barns vækst bør kontrolleres ofte.
De mest almindelige bivirkninger af FLONASE næsespray 50mcg omfatter:
- hovedpine
- kvalme og opkast
- ondt i halsen
- vejrtrækningsbesvær
- næseblod
- hoste
- næse brændende eller kløe
Fortæl din læge om enhver bivirkning, der generer dig eller ikke forsvinder.
Disse er ikke alle bivirkningerne med FLONASE næsespray. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan opbevarer jeg FLONASE næsespray 50mcg?
- Opbevar FLONASE mellem 39°F og 86°F (4°C og 30°C).
Opbevar FLONASE næsespray 50mcg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af FLONASE næsespray.
Lægemidler ordineres nogle gange til formål, der ikke er nævnt i en patientinformationsfolder. Brug ikke FLONASE næsespray til en tilstand, som den ikke er ordineret til. Giv ikke din FLONASE næsespray til andre mennesker, selvom de har samme tilstand, som du har. Det kan skade dem.
Denne patientinformationsfolder opsummerer de vigtigste oplysninger om FLONASE næsespray. Hvis du vil have mere information, så tal med din sundhedsplejerske. Du kan bede din apoteker eller sundhedsudbyder om oplysninger om FLONASE næsespray, der er skrevet til sundhedspersonale.
For mere information om FLONASE næsespray, ring på 1-888-825-5249.
Hvad er ingredienserne i FLONASE næsespray 50mcg?
Aktiv ingrediens: fluticasonpropionat.
Inaktive ingredienser: mikrokrystallinsk cellulose, carboxymethylcellulosenatrium, dextrose, 0,02 % w/w benzalkoniumchlorid, polysorbat 80 og 0,25 % w/w phenylethylalkohol.
Brugsanvisning
FLONASE® [flow'naz] (fluticasonpropionat) Næsespray, 50 mcg
FLONASE Næsespray 50mcg er kun til brug i din næse.
Læs denne information, før du begynder at bruge din FLONASE næsespray.
Dele af din FLONASE næsespray (Se figur A)
Figur A 
Din FLONASE næsespray 50mcg skal primes, før du bruger den første gang, og når du ikke har brugt den i en uge eller mere.
Sådan primer du din FLONASE næsespray
- Ryst flasken forsigtigt, og fjern derefter støvdækslet (se figur B).
Figur B 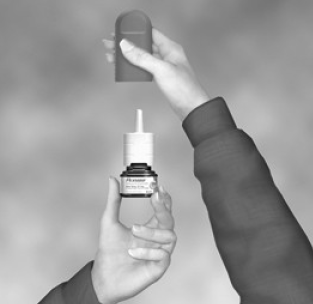
- Hold flasken som vist (se figur C) med næseapplikatoren pegende væk fra dig og med pegefinger og langfinger på hver side af næseapplikatoren og tommelfingeren under flasken.
- Tryk ned og slip 6 gange, indtil der kommer en fin spray (se figur C). Pumpen er nu klar til brug.
Figur C 
Brug af din FLONASE næsespray:
Trin 1 . Puds din næse for at rense dine næsebor.
Trin 2 . Luk 1 næsebor. Vip hovedet lidt fremad, og hold flasken oprejst, og indfør forsigtigt næseapplikatoren i det andet næsebor (se figur D).
Figur D 
Trin 3 Begynd at trække vejret ind gennem næsen, og mens du trækker vejret ind, tryk fast og hurtigt ned 1 gang på applikatoren for at frigive sprayen. For at få en fuld dosis, brug pegefinger og langfinger til at spraye, mens du støtter bunden af flasken med tommelfingeren. Undgå at sprøjte i øjnene. Træk vejret blidt ind gennem næseboret (se figur E).
Figur E 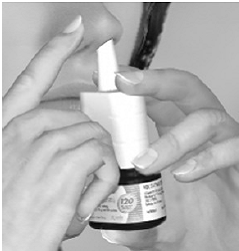
Trin 4 . Træk vejret ud gennem munden.
Trin 5 . Hvis der kræves en anden spray i det næsebor, gentag trin 2 til 4.
Trin 6 . Gentag trin 2 til 5 i det andet næsebor.
Trin 7 . Tør næseapplikatoren af med en ren serviet, og sæt støvdækslet på igen (se figur F).
Figur F 
Brug ikke denne flaske til mere end det mærkede antal sprays, selvom flasken ikke er helt tom. Inden du smider flasken væk, bør du tale med din læge for at se, om der er behov for genopfyldning. Tag ikke ekstra doser eller stop med at tage FLONASE næsespray 50mcg uden at tale med din læge.
Rengøring af din FLONASE næsespray:
Din næsespray skal renses mindst 1 gang om ugen.
1. Fjern støvdækslet og træk derefter forsigtigt opad for at frigøre næseapplikatoren.
2. Vask applikatoren og støvdækslet under varmt postevand. Lad tørre ved stuetemperatur.
3. Sæt applikatoren og støvdækslet tilbage på flasken.
4. Hvis næseapplikatoren bliver tilstoppet, kan den fjernes og efterlades i blød i varmt vand. Skyl næseapplikatoren med koldt postevand. Tør næseapplikatoren og sæt den tilbage på flasken. Forsøg ikke at fjerne blokeringen af næseapplikatoren ved at indsætte en stift eller en anden skarp genstand.
Opbevaring af din FLONASE næsespray:
- Opbevar FLONASE næsespray 50mcg mellem 39°F og 86°F (4°C og 30°C).
- Brug ikke din FLONASE næsespray efter datoen vist som "EXP" på etiketten eller æsken.
