Aristocort 4mg Triamcinolone Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Aristocort, og hvordan bruges det?
Aristocort 4mg er en receptpligtig medicin, der bruges til at behandle symptomer på allergiske lidelser, gigt, blodsygdomme, . Aristocort 4mg kan bruges alene eller sammen med anden medicin.
Aristocort tilhører en klasse af lægemidler kaldet kortikosteroid; Glukokortikoid.
Det vides ikke, om Aristocort 4mg er sikkert og effektivt til børn under 1 år.
Hvad er de mulige bivirkninger af Aristocort?
Aristocort kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- forværring af din hudtilstand,
- rødme, varme, hævelse, siver eller alvorlig irritation af enhver behandlet hud,
- sløret syn,
- tunnelsyn,
- øjensmerter,
- ser glorier omkring lys,
- øget tørst,
- øget vandladning,
- tør mund,
- frugtig ånde lugt,
- vægtøgning (især i dit ansigt eller din øvre ryg og torso),
- langsom sårheling,
- tyndere eller misfarvet hud,
- øget kropsbehåring,
- muskelsvaghed,
- kvalme,
- diarré,
- træthed,
- humørsvingninger,
- menstruationsændringer, og
- seksuelle ændringer
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Aristocort omfatter:
- svie, kløe, tørhed eller anden irritation af behandlet hud,
- rødme eller skorpedannelse omkring dine hårsække,
- rødme eller kløe omkring munden,
- allergisk hudreaktion,
- strækmærker,
- acne,
- øget kropshårvækst,
- tyndere hud eller misfarvning, og
- hvidt eller "beskæret" udseende af huden (forårsaget af belægning behandlet med en stram bandage eller anden belægning)
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Aristocort. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
IKKE TIL BRUG HOS NYBØRNE
IKKE TIL INTRAVENØS BRUG
INDEHOLDER BENZYLALKOHOL
BESKRIVELSE
Aristocort® Forte er en steril suspension af 40 mg/ml triamcinolondiacetat (mikroniseret) suspenderet i et vehikel bestående af:
Saltsyre og/eller natriumhydroxid kan anvendes under fremstillingen for at justere suspensionens pH til ca. 6.
Triamcinolondiacetat er praktisk talt uopløseligt i vand; opløselig i chloroform; tungtopløselig i alkohol og methanol; og let opløselig i ether. Dette præparat er velegnet til parenteral administration gennem en 23-gauge nål (eller større), men IKKE egnet til intravenøs brug. Det kan administreres intramuskulært, intraartikulært eller intrasynovialt, afhængigt af situationen.
Irreversibel klumpning opstår, når dette produkt er frosset.
Kemisk er triamcinolondiacetat 9-fluor-11ß,16',17,21-tetrahydroxypregna-1,4-dien-3,20-dion 16,21-diacetat.
Molekylvægten er 478,51. Dens strukturformel er:
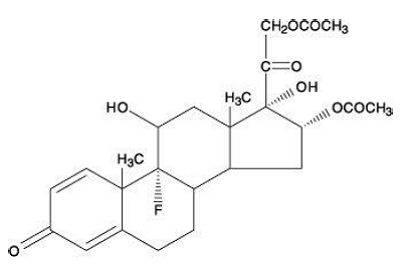
Triamcinolondiacetat forekommer som et hvidt til råhvidt, mikrokrystallinsk pulver.
INDIKATIONER
Hvor oral behandling ikke er mulig, er Aristocort® Forte (triamcinolondiacetat injicerbar suspension), 40 mg/ml, indiceret til intramuskulær brug som følger:
Allergiske tilstande
Bekæmpelse af alvorlige eller invaliderende allergiske tilstande, der er vanskelige at behandle med tilstrækkelige forsøg med konventionel behandling af astma, atopisk dermatitis, kontaktdermatitis, lægemiddeloverfølsomhedsreaktioner, flerårig eller sæsonbestemt allergisk rhinitis, serumsyge, transfusionsreaktioner.
Dermatologiske sygdomme
Bulløs dermatitis herpetiformis, eksfoliativ erythroderma, mycosis fungoides, pemphigus, svær erythema multiforme (Stevens-Johnsons syndrom).
Endokrine lidelser
Primær eller sekundær binyrebarkinsufficiens (hydrocortison eller kortison er det foretrukne lægemiddel; syntetiske analoger kan anvendes sammen med mineralokortikoider, hvor det er relevant; i spædbarnsalderen er mineralokortikoidtilskud af særlig betydning), medfødt binyrehyperplasi, hypercalcæmi forbundet med cancer, nonsuppurativ thyroiditis.
Gastrointestinal sygdom
At tide patienten over en kritisk periode af sygdommen i regional enteritis og ulcerøs colitis.
Hæmatologiske lidelser
Erhvervet (autoimmun) hæmolytisk anæmi, Diamond-Blackfan anæmi, pure red cell aplasia, udvalgte tilfælde af sekundær trombocytopeni.
Diverse
Trikinose med neurologisk eller myokardiepåvirkning, tuberkuløs meningitis med subaraknoidal blokering eller forestående blokering, når det anvendes sammen med passende antituberkuløs kemoterapi.
Neoplastiske sygdomme
Til palliativ behandling af leukæmier og lymfomer.
Nervesystem
Akutte eksacerbationer af multipel sklerose; cerebralt ødem forbundet med primær eller metastatisk hjernetumor eller kraniotomi.
Oftalmiske sygdomme
Sympatisk oftalmi, uveitis og okulære inflammatoriske tilstande, der ikke reagerer på topikale kortikosteroider.
Nyresygdomme
At inducere diurese eller remission af proteinuri ved idiopatisk nefrotisk syndrom eller det, der skyldes lupus erythematosus.
Luftvejssygdomme
Berylliose, fulminerende eller dissemineret lungetuberkulose, når det bruges samtidig med passende antituberkuløs kemoterapi, idiopatiske eosinofile pneumonier, symptomatisk sarkoidose.
Reumatiske lidelser
Som supplerende terapi til kortvarig administration (for at få patienten over en akut episode eller eksacerbation) ved akut gigtarthritis; akut reumatisk carditis; ankyloserende spondylitis; psoriasisgigt; rheumatoid arthritis, herunder juvenil rheumatoid arthritis (udvalgte tilfælde kan kræve lavdosis vedligeholdelsesbehandling). Til behandling af dermatomyositis, polymyositis og systemisk lupus erythematosus.
Til intraartikulær eller blødt vævsadministration
Den intraartikulære eller bløde vævsadministration af Aristocort® Forte er indiceret som supplerende terapi til kortvarig administration (for at få patienten over en akut episode eller forværring) ved akut gigtarthritis, akut og subakut bursitis, akut uspecifik senehindebetændelse, epicondylitis, rheumatoid arthritis, synovitis af slidgigt.
Til intralæsional administration
Intralæsionel administration af Aristocort® Forte er indiceret til alopecia areata; discoid lupus erythematosus; keloider; lokaliserede hypertrofiske, infiltrerede, inflammatoriske læsioner af granuloma annulare, lichen planus, lichen simplex chronicus (neurodermatitis) og psoriatiske plaques; necrobiosis lipoidica diabeticorum.
Det kan også være nyttigt i cystiske tumorer af en aponeurose eller sene (ganglier).
DOSERING OG ADMINISTRATION
BEMÆRK: INDEHOLDER BENZYLALKOHOL (se ADVARSLER og FORHOLDSREGLER: Pædiatrisk brug)
På grund af mulig fysisk uforenelighed bør Aristocort® Forte Sterile Vandig Suspension ikke fortyndes eller blandes med andre opløsninger.
Generel
Den initiale intramuskulære dosis af triamcinolondiacetat injicerbar suspension kan variere fra 3 til 48 mg pr. dag afhængigt af den specifikke sygdomsenhed, der behandles. Men i visse overvældende, akutte, livstruende situationer kan administration i doser, der overstiger de sædvanlige doser, være berettiget og kan være i multiple af de orale doser.
Det bør understreges, at doseringskravene er variable og skal individualiseres på grundlag af den sygdom, der behandles, og patientens reaktion. Efter et gunstigt respons er bemærket, bør den korrekte vedligeholdelsesdosis bestemmes ved at reducere den initiale lægemiddeldosis i små trin med passende tidsintervaller, indtil den laveste dosis, som vil opretholde et tilstrækkeligt klinisk respons, er nået. Situationer, der kan gøre dosisjusteringer nødvendige, er ændringer i klinisk status sekundært til remissioner eller eksacerbationer i sygdomsprocessen, patientens individuelle lægemiddelrespons og virkningen af patientens eksponering for stressende situationer, der ikke er direkte relateret til sygdomsenheden under behandling. I denne sidstnævnte situation kan det være nødvendigt at øge dosis af kortikosteroidet i en periode, der stemmer overens med patientens tilstand. Hvis lægemidlet skal stoppes efter langtidsbehandling, anbefales det, at det seponeres gradvist i stedet for brat.
Til behandling af akutte forværringer af dissemineret sklerose anbefales daglige doser på 160 mg triamcinolon i en uge efterfulgt af 64 mg hver anden dag i en måned (se FORHOLDSREGLER : Neurologisk/psykiatrisk ).
Hos pædiatriske patienter kan startdosis af triamcinolon variere afhængigt af den specifikke sygdomsenhed, der behandles. Intervallet for startdoser er 0,11 til 1,6 mg/kg/dag fordelt på tre eller fire doser (3,2 til 48 mg/m² bsa/dag).
Til sammenligning er følgende den ækvivalente milligramdosis af de forskellige glukokortikoider:
Disse dosisforhold gælder kun for oral eller intravenøs administration af disse forbindelser. Når disse stoffer eller deres derivater injiceres intramuskulært eller i ledrum, kan deres relative egenskaber blive meget ændret.
Bestemt
Aristocort® Forte Parenteral er triamcinolondiacetat injicerbar suspension (40 mg/ml) suspenderet i en egnet vehikel. Ophænget i fuld styrke kan anvendes. Topisk ethylchloridspray kan anvendes lokalt før injektion.
Da dette produkt er designet til nem administration, kan en kanyle med lille boring (ikke mindre end 23 gauge) bruges.
Intramuskulært
Selvom Aristocort® Forte Parenteral kan administreres intramuskulært til indledende behandling, foretrækker de fleste læger at justere dosis oralt, indtil tilstrækkelig kontrol er opnået. Intramuskulær administration tilvejebringer en vedvarende eller depotvirkning, som kan anvendes til at supplere eller erstatte initial oral terapi. Med intramuskulær terapi er større overvågning af mængden af anvendt steroid muliggjort hos patienten, som ikke er konsekvent i at følge et oralt doseringsskema. Ved vedligeholdelsesbehandling er patient-til-patient-responsen ikke ensartet, og derfor skal dosis individualiseres for optimal kontrol.
Den gennemsnitlige dosis er 40 mg (1 ml) administreret intramuskulært én gang om ugen til tilstande, hvor der ønskes anti-inflammatorisk virkning.
Generelt kan en enkelt parenteral dosis 4 til 7 gange den orale daglige dosis forventes at kontrollere patienten fra 4 til 7 dage op til 3 til 4 uger. Dosis bør justeres til det punkt, hvor der opnås tilstrækkelig, men ikke nødvendigvis fuldstændig lindring af symptomer.
Intraartikulær og Intrasynovial
Den sædvanlige dosis varierer fra 5 til 40 mg. Gennemsnittet for knæet er for eksempel 25 mg. Virkningens varighed varierer fra en uge til 2 måneder. Akut betændte led kan dog kræve hyppigere injektioner.
Et mindre indledende dosisområde af triamcinolondiacetat injicerbar suspension kan give den ønskede effekt, når lægemidlet administreres for at give en lokaliseret koncentration. Injektionsstedet og injektionsvolumenet bør nøje overvejes, når triamcinolondiacetat indgives til dette formål.
En specifik dosis afhænger i høj grad af leddets størrelse.
Streng kirurgisk asepsis er obligatorisk. Lægen bør være bekendt med anatomiske sammenhænge som beskrevet i standard lærebøger. Aristocort® Forte Parenteral kan bruges i ethvert tilgængeligt led undtagen intervertebralerne. Generelt anbefales intrasynovial terapi under følgende omstændigheder:
En sådan behandling bør ikke anses for at udgøre en kur, for selvom denne metode vil lindre ledsymptomerne, udelukker den ikke behovet for de konventionelle foranstaltninger, der normalt anvendes.
Det foreslås, at infiltration af det bløde væv ved lokalbedøvelse går forud for intraartikulær injektion. En 24 gauge eller større nål på en tør sprøjte kan indsættes i leddet og overskydende væske aspireres. I de første par timer efter injektionen kan der være lokalt ubehag i leddet, men dette efterfølges normalt hurtigt af effektiv smertelindring og forbedring af lokal funktion.
HVORDAN LEVERET
Aristocort® Forte (triamcinolondiacetat injicerbar suspension), 40 mg/ml, parenteral, ikke til intravenøs brug, leveres som følger:
NDC 0781-3037-71 40 mg/mL (1 mL Fyld et 2 mL hætteglas), æsker med 1 NDC 0781-3037-75 40 mg/mL (5 mL Fyld et 10 mL hætteglas), æsker med 1
Beskyt mod lys.
FRYS IKKE
RYST GODT
Opbevares ved 20°-25°C (68°-77°F) [se USP kontrolleret rumtemperatur ].
Irreversibel klumpning opstår, når produktet er frosset.
Fremstillet i Canada af: Sandoz Canada Inc. for Sandoz Inc., Princeton, NJ 08540
BIVIRKNINGER
(angivet alfabetisk under hvert underafsnit)
Allergiske reaktioner
Allergiske eller overfølsomhedsreaktioner, anafylaktoide reaktioner, anafylaksi, angioødem.
Kardiovaskulær
Bradykardi, hjertestop, hjertearytmier, hjerteforstørrelse, kredsløbskollaps, kongestiv hjertesvigt, fedtemboli, hypertension, hypertrofisk kardiomyopati hos præmature spædbørn, myokardieruptur efter nyligt myokardieinfarkt (se ADVARSLER ), lungeødem, synkope, takykardi, tromboembolisme, tromboflebitis, vaskulitis.
Dermatologisk
Akne, allergisk dermatitis, kutan og subkutan atrofi, tør skællende hud, ekkymoser og petekkier, ødem, erytem, hyperpigmentering, hypopigmentering, nedsat sårheling, øget svedtendens, udslæt, steril byld, striae, undertrykte reaktioner på hudprøver, tynd skrøbelig hud, tyndere hovedhår, nældefeber.
Endokrine
Nedsat kulhydrat- og glukosetolerance, udvikling af cushingoid tilstand, glykosuri, hirsutisme, hypertrichose, øget behov for insulin eller orale hypoglykæmiske midler ved diabetes, manifestationer af latent diabetes mellitus, menstruationsuregelmæssigheder, sekundær binyrebark og hypofyse manglende reaktion (især som i stressperioder) ved traumer, kirurgi eller sygdom), undertrykkelse af vækst hos pædiatriske patienter.
Væske- og elektrolytforstyrrelser
Kongestiv hjertesvigt hos følsomme patienter, væskeretention, hypokalæmisk alkalose, kaliumtab, natriumretention.
Gastrointestinale
Abdominal udspilning, dysfunktion af tarm/blære (efter intrathekal administration), forhøjede leverenzymer i serum (normalt reversible ved seponering), hepatomegali, øget appetit, kvalme, pancreatitis, mavesår med mulig perforation og blødning, perforering af tynd- og tyktarmen (især hos patienter med inflammatorisk tarmsygdom), ulcerøs esophagitis.
Metabolisk
Negativ nitrogenbalance på grund af proteinkatabolisme.
Muskuloskeletale
Aseptisk nekrose af lårbens- og humerushoveder, calcinose (efter intraartikulær eller intralæsionel brug), Charcot-lignende artropati, tab af muskelmasse, muskelsvaghed, osteoporose, patologisk fraktur af lange knogler, opblussen efter injektion (efter intraartikulær brug ), steroid myopati, seneruptur, vertebrale kompressionsfrakturer.
Neurologisk/psykiatrisk
Kramper, depression, følelsesmæssig ustabilitet, eufori, hovedpine, øget intrakranielt tryk med papilleødem (pseudotumor cerebri) sædvanligvis efter afbrydelse af behandlingen, søvnløshed, humørsvingninger, neuritis, neuropati, paræstesi, personlighedsændringer, psykiske lidelser, vertigo. Arachnoiditis, meningitis, paraparese/paraplegi og føleforstyrrelser er opstået efter intratekal administration (se ADVARSLER : Neurologisk ).
Oftalmisk
Exophthalmos, glaukom, øget intraokulært tryk, posterior subkapsulær grå stær, sjældne tilfælde af blindhed forbundet med periokulære injektioner.
Andet
Unormale fedtdepoter, nedsat modstandsdygtighed over for infektion, hikke, øget eller nedsat bevægelighed og antal sædceller, infektioner på injektionsstedet efter ikke-steril administration (se ADVARSLER ), utilpashed, måneansigt, vægtøgning.
DRUGSINTERAKTIONER
Aminoglutethimid
Aminoglutethimid kan føre til tab af kortikosteroid-induceret binyrebarksuppression.
Amphotericin B-injektions- og kaliumnedbrydende midler
Når kortikosteroider administreres samtidig med kaliumnedbrydende midler (dvs. amphotericin B, diuretika), skal patienterne observeres nøje for udvikling af hypokaliæmi. Der har været rapporteret tilfælde, hvor samtidig brug af amphotericin B og hydrocortison blev efterfulgt af hjerteforstørrelse og kongestiv hjerteinsufficiens.
Antibiotika
Makrolidantibiotika er blevet rapporteret at forårsage et signifikant fald i corticosteroid clearance (se DRUGSINTERAKTIONER : Hepatiske enzymhæmmere ).
Anticholinesteraser
Samtidig brug af anticholinesterase-midler og kortikosteroider kan forårsage alvorlig svaghed hos patienter med myasthenia gravis. Hvis det er muligt, bør anticholinesterase-midler seponeres mindst 24 timer før påbegyndelse af kortikosteroidbehandling.
Antikoagulantia, Oral
Samtidig administration af kortikosteroider og warfarin resulterer normalt i hæmning af respons på warfarin, selvom der har været nogle modstridende rapporter. Derfor bør koagulationsindekser overvåges hyppigt for at opretholde den ønskede antikoagulerende effekt.
Antidiabetika
Fordi kortikosteroider kan øge blodsukkerkoncentrationen, kan dosisjustering af antidiabetika være nødvendig.
Antituberkulære lægemidler
Serumkoncentrationer af isoniazid kan være nedsat.
Kolestyramin
Kolestyramin kan øge clearance af kortikosteroider.
Cyclosporin
Øget aktivitet af både cyclosporin og kortikosteroider kan forekomme, når de to bruges samtidigt. Kramper er blevet rapporteret ved denne samtidige brug.
Digitalis glycosider
Patienter på digitalisglykosider kan have øget risiko for arytmier på grund af hypokaliæmi.
Østrogener, herunder orale præventionsmidler
Østrogener kan nedsætte levermetabolismen af visse kortikosteroider og derved øge deres virkning.
Hepatiske enzyminducere (f.eks. barbiturater, phenytoin, carbamazepin, rifampin)
Lægemidler, som inducerer cytochrom P450 3A4 enzymaktivitet, kan øge metabolismen af kortikosteroider og kræve, at dosis af kortikosteroidet øges.
Hepatiske enzymhæmmere (f.eks. ketoconazol, makrolidantibiotika såsom erythromycin og troleandomycin)
Lægemidler, der hæmmer cytochrom P450 3A4 enzymaktivitet, har potentiale til at resultere i øgede plasmakoncentrationer af kortikosteroider.
Ketoconazol
Ketoconazol er blevet rapporteret at reducere metabolismen af visse kortikosteroider signifikant med op til 60 %, hvilket fører til en øget risiko for kortikosteroidbivirkninger.
Ikke-steroide antiinflammatoriske midler (NSAID'er)
Samtidig brug af aspirin (eller andre ikke-steroide antiinflammatoriske midler) og kortikosteroider øger risikoen for gastrointestinale bivirkninger. Aspirin bør anvendes med forsigtighed i forbindelse med kortikosteroider ved hypoprotrombinæmi. Clearance af salicylater kan øges ved samtidig brug af kortikosteroider.
Hudtests
Kortikosteroider kan undertrykke reaktioner på hudprøver.
Vacciner
Patienter i langvarig kortikosteroidbehandling kan udvise et formindsket respons på toksoider og levende eller inaktiverede vacciner på grund af hæmning af antistofrespons. Kortikosteroider kan også forstærke replikationen af nogle organismer indeholdt i levende svækkede vacciner. Rutinemæssig administration af vacciner eller toksoider bør udskydes, indtil behandling med kortikosteroider seponeres, hvis det er muligt (se ADVARSLER : Vaccination ).
ADVARSLER
Alvorlige neurologiske bivirkninger ved epidural administration
Alvorlige neurologiske hændelser, nogle med døden til følge, er blevet rapporteret ved epidural injektion af kortikosteroider. Specifikke rapporterede hændelser omfatter, men er ikke begrænset til, rygmarvsinfarkt, paraplegi, quadriplegi, kortikal blindhed og slagtilfælde. Disse alvorlige neurologiske hændelser er blevet rapporteret med og uden brug af fluoroskopi. Sikkerheden og effektiviteten af epidural administration af kortikosteroider er ikke blevet fastslået, og kortikosteroider er ikke godkendt til denne anvendelse
Generel
Dette produkt indeholder benzylalkohol, som er potentielt giftigt, når det administreres lokalt til neuralt væv. Eksponering for store mængder benzylalkohol er blevet forbundet med toksicitet (hypotension, metabolisk acidose), især hos nyfødte, og en øget forekomst af kernicterus, især hos små præmature spædbørn. Der har været sjældne rapporter om dødsfald, primært hos præmature spædbørn, forbundet med eksponering for store mængder benzylalkohol. Administration af høje doser af medicin, der indeholder dette konserveringsmiddel, skal tage højde for den samlede mængde af indgivet benzylalkohol. Mængden af benzylalkohol, ved hvilken toksicitet kan forekomme, kendes ikke. Hvis patienten har brug for mere end de anbefalede doser eller anden medicin, der indeholder dette konserveringsmiddel, skal lægen overveje den daglige metaboliske belastning af benzylalkohol fra disse kombinerede kilder (se FORHOLDSREGLER : Pædiatrisk brug ).
Det er afgørende, at der under administration af Aristocort® Forte anvendes passende teknik, og at man sørger for at sikre korrekt placering af lægemidlet.
Sjældne tilfælde af anafylaktoide reaktioner er forekommet hos patienter, der får kortikosteroidbehandling (se BIVIRKNINGER ).
Øget dosis af hurtigtvirkende kortikosteroider er indiceret hos patienter i kortikosteroidbehandling, der er udsat for usædvanlig stress før, under og efter den stressende situation.
Resultater fra et multicenter, randomiseret, placebokontrolleret studie med methylprednisolonhemisuccinat, et IV-kortikosteroid, viste en stigning i tidlig (ved 2 uger) og sen (ved 6 måneder) dødelighed hos patienter med kranietraume, som var fast besluttet på ikke at have andre klare indikationer til kortikosteroidbehandling. Høje doser af systemiske kortikosteroider, inklusive Aristocort®, bør ikke anvendes til behandling af traumatisk hjerneskade.
Cardio-renal
Gennemsnitlige og store doser af kortikosteroider kan forårsage forhøjet blodtryk, salt- og vandophobning og øget udskillelse af kalium. Disse virkninger er mindre tilbøjelige til at forekomme med de syntetiske derivater, undtagen når de anvendes i store doser. Saltbegrænsning i kosten og kaliumtilskud kan være nødvendigt. Alle kortikosteroider øger calciumudskillelsen.
Litteraturrapporter tyder på en tilsyneladende sammenhæng mellem brug af kortikosteroider og brud på venstre ventrikels frie væg efter et nyligt myokardieinfarkt; derfor bør behandling med kortikosteroider anvendes med stor forsigtighed hos disse patienter.
Endokrine
Kortikosteroider kan give reversibel hypothalamus-hypofyse-binyreakse (HPA) aksesuppression med potentiale for glukokortikosteroidinsufficiens efter seponering af behandlingen. Lægemiddelinduceret sekundær binyrebarkinsufficiens kan minimeres ved gradvis reduktion af dosis. Denne form for relativ insufficiens kan vare ved i måneder efter seponering af behandlingen; Derfor bør hormonbehandling genoptages i enhver situation med stress, der opstår i denne periode.
Metabolisk clearance af kortikosteroider er nedsat hos hypothyreoideapatienter og øget hos hyperthyreoideapatienter. Ændringer i patientens skjoldbruskkirtelstatus kan nødvendiggøre justering af dosis.
Infektioner
Generel
Patienter, der tager kortikosteroider, er mere modtagelige for infektioner end raske personer. Der kan være nedsat resistens og manglende evne til at lokalisere infektion, når der anvendes kortikosteroider. Infektion med et hvilket som helst patogen (viralt, bakterielt, svampe-, protozo- eller helmintisk) på et hvilket som helst sted i kroppen kan være forbundet med brugen af kortikosteroider alene eller i kombination med andre immunsuppressive midler. Disse infektioner kan være milde, men kan være alvorlige og til tider dødelige. Med stigende doser af kortikosteroider stiger forekomsten af infektiøse komplikationer. Kortikosteroider kan også maskere nogle tegn på nuværende infektion.
Svampeinfektioner
Kortikosteroider kan forværre systemiske svampeinfektioner og bør derfor ikke anvendes i nærvær af sådanne infektioner, medmindre de er nødvendige for at kontrollere lægemiddelreaktioner. Der har været rapporteret tilfælde, hvor samtidig brug af amphotericin B og hydrocortison blev efterfulgt af hjerteforstørrelse og kongestiv hjerteinsufficiens (se FORHOLDSREGLER : DRUGSINTERAKTIONER : Amphotericin B-injektions- og kaliumnedbrydende midler ).
Særlige patogener
Latent sygdom kan aktiveres, eller der kan være en forværring af interkurrente infektioner på grund af patogener, herunder dem, der er forårsaget af Amøbe, Candida, Cryptococcus, Mycobacterium, Nocardia, Pneumocystis, Toxoplasma.
Det anbefales, at latent amebiasis eller aktiv amebiasis udelukkes før påbegyndelse af kortikosteroidbehandling hos enhver patient, der har tilbragt tid i troperne, eller hos enhver patient med uforklarlig diarré.
Tilsvarende bør kortikosteroider anvendes med stor forsigtighed hos patienter med kendt eller formodet Strongyloides (trådorm) angreb. Hos sådanne patienter kan kortikosteroid-induceret immunsuppression føre til Strongyloides hyperinfektion og disseminering med udbredt larve migration, ofte ledsaget af svær enterocolitis og potentielt fatal gram-negativ septikæmi.
Kortikosteroider bør ikke anvendes ved cerebral malaria.
Tuberkulose
Brugen af kortikosteroider ved aktiv tuberkulose bør begrænses til de tilfælde af fulminerende eller dissemineret tuberkulose, hvor kortikosteroidet anvendes til behandling af sygdommen i forbindelse med et passende antituberkuløst regime.
Hvis kortikosteroider er indiceret til patienter med latent tuberkulose eller tuberkulinreaktivitet, er nøje observation nødvendig, da reaktivering af sygdommen kan forekomme. Under langvarig kortikosteroidbehandling bør disse patienter modtage kemoprofylakse.
Vaccination
Administration af levende eller levende svækkede vacciner er kontraindiceret hos patienter, der får immunsuppressive doser af kortikosteroider. Dræbte eller inaktiverede vacciner kan administreres. Imidlertid kan responsen på sådanne vacciner ikke forudsiges. Immuniseringsprocedurer kan udføres hos patienter, der får kortikosteroider som erstatningsterapi, f.eks. mod Addisons sygdom.
Virale infektioner
Skoldkopper og mæslinger kan have et mere alvorligt eller endda dødeligt forløb hos pædiatriske og voksne patienter på kortikosteroider. Hos pædiatriske og voksne patienter, som ikke har haft disse sygdomme, skal der udvises særlig forsigtighed for at undgå eksponering. Bidraget fra den underliggende sygdom og/eller tidligere kortikosteroidbehandling til risikoen er heller ikke kendt. Hvis de udsættes for skoldkopper, kan profylakse med varicella zoster immunglobulin (VZIG) være indiceret. Ved eksponering for mæslinger kan profylakse med immunglobulin (IG) være indiceret. (Se de respektive indlægssedler for fuldstændig VZIG og IG ordinationsinformation .) Hvis der udvikles skoldkopper, bør behandling med antivirale midler overvejes.
Neurologisk
Rapporter om alvorlige bivirkninger er blevet forbundet med den intratekale administrationsvej (se BIVIRKNINGER : Neurologisk/psykiatrisk ).
Oftalmisk
Brug af kortikosteroider kan fremkalde posterior subkapsulær katarakt, glaukom med mulig skade på synsnerverne og kan øge etableringen af sekundære øjeninfektioner på grund af bakterier, svampe eller vira. Anvendelse af systemiske kortikosteroider anbefales ikke til behandling af optisk neuritis og kan føre til en stigning i risikoen for nye episoder. Kortikosteroider bør anvendes med forsigtighed hos patienter med okulær herpes simplex på grund af mulig hornhindeperforation. Kortikosteroider bør ikke anvendes til aktiv okulær herpes simplex.
FORHOLDSREGLER
Generel
Dette produkt er ligesom mange andre steroidformuleringer følsomt over for varme. Derfor bør det ikke autoklaveres, når det er ønskeligt at sterilisere det ydre af hætteglasset.
Den lavest mulige dosis kortikosteroid bør anvendes til at kontrollere tilstanden under behandling. Når reduktion i dosis er mulig, bør reduktionen ske gradvis.
Da komplikationer ved behandling med glukokortikoider er afhængige af dosisstørrelsen og behandlingens varighed, skal der i hvert enkelt tilfælde tages en risiko/benefit-beslutning om dosis og varighed af behandlingen og om der skal anvendes daglig eller intermitterende behandling. .
Kaposis sarkom er blevet rapporteret at forekomme hos patienter, der får kortikosteroidbehandling, oftest for kroniske tilstande. Seponering af kortikosteroider kan resultere i klinisk forbedring.
Atrofi på injektionsstedet er blevet rapporteret.
Cardio-renal
Da natriumretention med resulterende ødem og kaliumtab kan forekomme hos patienter, der får kortikosteroider, bør disse midler anvendes med forsigtighed hos patienter med kongestiv hjerteinsufficiens, hypertension eller nyreinsufficiens.
Endokrine
Lægemiddelinduceret sekundær binyrebarkinsufficiens kan minimeres ved gradvis reduktion af dosis. Denne form for relativ insufficiens kan vare ved i måneder efter seponering af behandlingen; Derfor bør hormonbehandling genoptages i enhver situation med stress, der opstår i denne periode. Da mineralokortikoidsekretion kan være nedsat, bør salt og/eller et mineralokortikoid administreres samtidigt.
Gastrointestinale
Steroider bør anvendes med forsigtighed ved aktivt eller latent mavesår, diverticulitis, friske intestinale anastomoser og uspecifik colitis ulcerosa, da de kan øge risikoen for en perforation.
Tegn på peritoneal irritation efter gastrointestinal perforation hos patienter, der får kortikosteroider, kan være minimale eller fraværende.
Der er en forstærket effekt på grund af øget metabolisme af kortikosteroider hos patienter med cirrhose.
Intraartikulær og blødt vævsadministration
Intraartikulært injicerede kortikosteroider kan absorberes systemisk.
En passende undersøgelse af eventuel tilstedeværende ledvæske er nødvendig for at udelukke en septisk proces.
En markant stigning i smerte ledsaget af lokal hævelse, yderligere begrænsning af ledbevægelser, feber og utilpashed tyder på septisk arthritis. Hvis denne komplikation opstår, og diagnosen sepsis er bekræftet, bør passende antimikrobiel behandling iværksættes.
Injektion af et steroid på et inficeret sted skal undgås. Lokal injektion af et steroid i et tidligere inficeret led anbefales normalt ikke.
Muskuloskeletale
Kortikosteroider nedsætter knogledannelsen og øger knogleresorptionen både gennem deres effekt på calciumregulering (dvs. mindsket absorption og øget udskillelse) og hæmning af osteoblastfunktionen. Dette sammen med et fald i knoglernes proteinmatrix sekundært til en stigning i proteinkatabolisme og nedsat kønshormonproduktion kan føre til hæmning af knoglevækst hos pædiatriske patienter og udvikling af osteoporose i alle aldre. Der bør tages særlig hensyn til patienter med øget risiko for osteoporose (dvs. postmenopausale kvinder), før kortikosteroidbehandling påbegyndes.
Neurologisk/psykiatrisk
Selvom kontrollerede kliniske forsøg har vist, at kortikosteroider er effektive til at fremskynde løsningen af akutte forværringer af dissemineret sklerose, viser de ikke, at de påvirker det endelige resultat eller den naturlige historie af sygdommen. Undersøgelserne viser, at relativt høje doser af kortikosteroider er nødvendige for at påvise en signifikant effekt. (Se DOSERING OG ADMINISTRATION .)
En akut myopati er blevet observeret ved brug af høje doser kortikosteroider, som oftest forekommer hos patienter med forstyrrelser i neuromuskulær transmission (f.eks. myasthenia gravis), eller hos patienter, der får samtidig behandling med neuromuskulært blokerende lægemidler (f.eks. pancuronium). Denne akutte myopati er generaliseret, kan involvere okulære og respiratoriske muskler og kan resultere i quadriparese. Forhøjelse af kreatininkinase kan forekomme. Klinisk forbedring eller bedring efter seponering af kortikosteroider kan kræve uger til år.
Psykiske forstyrrelser kan forekomme, når kortikosteroider bruges, lige fra eufori, søvnløshed, humørsvingninger, personlighedsændringer og svær depression til ærlige psykotiske manifestationer. Også eksisterende følelsesmæssig ustabilitet eller psykotiske tendenser kan forværres af kortikosteroider.
Oftalmisk
Det intraokulære tryk kan blive forhøjet hos nogle individer. Hvis steroidbehandling fortsættes i mere end 6 uger, bør det intraokulære tryk overvåges.
Karcinogenese, mutagenese, svækkelse af fertilitet
Der er ikke udført tilstrækkelige undersøgelser på dyr for at bestemme, om kortikosteroider har et potentiale for karcinogenese eller mutagenese.
Steroider kan øge eller mindske motiliteten og antallet af spermatozoer hos nogle patienter.
Graviditet
Teratogene virkninger
Graviditetskategori C
Kortikosteroider har vist sig at være teratogene hos mange arter, når de gives i doser svarende til den humane dosis. Dyreforsøg, hvor kortikosteroider er blevet givet til gravide mus, rotter og kaniner, har givet en øget forekomst af ganespalte hos afkommet. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Kortikosteroider bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret. Spædbørn født af mødre, der har fået kortikosteroider under graviditeten, bør observeres omhyggeligt for tegn på hypoadrenalisme.
Ammende mødre
Systemisk administrerede kortikosteroider forekommer i modermælk og kan undertrykke vækst, interferere med endogen kortikosteroidproduktion eller forårsage andre uheldige virkninger. På grund af risikoen for alvorlige bivirkninger hos ammende spædbørn fra kortikosteroider, bør der tages en beslutning om at fortsætte amningen eller seponere lægemidlet under hensyntagen til lægemidlets betydning for moderen.
Pædiatrisk brug
Dette produkt indeholder benzylalkohol som konserveringsmiddel. Benzylalkohol, en komponent i dette produkt, er blevet forbundet med alvorlige bivirkninger og død, især hos pædiatriske patienter. Det "gispende syndrom" (kendetegnet ved depression af centralnervesystemet, metabolisk acidose, gispende vejrtrækninger og høje niveauer af benzylalkohol og dets metabolitter fundet i blodet og urinen) er blevet forbundet med benzylalkoholdoser > 99 mg/kg/dag hos nyfødte og nyfødte med lav fødselsvægt. Yderligere symptomer kan omfatte gradvis neurologisk forværring, kramper, intrakraniel blødning, hæmatologiske abnormiteter, hudnedbrydning, lever- og nyresvigt, hypotension, bradykardi og kardiovaskulær kollaps. Selvom normale terapeutiske doser af dette produkt giver mængder af benzylalkohol, der er væsentligt lavere end dem, der er rapporteret i forbindelse med "gispende syndrom", kendes den minimumsmængde af benzylalkohol, hvor toksicitet kan forekomme, ikke. For tidligt fødte spædbørn og spædbørn med lav fødselsvægt samt patienter, der får høje doser, kan være mere tilbøjelige til at udvikle toksicitet. Læger, der administrerer denne og andre lægemidler, der indeholder benzylalkohol, bør overveje den kombinerede daglige metaboliske belastning af benzylalkohol fra alle kilder.
Effekten og sikkerheden af kortikosteroider i den pædiatriske population er baseret på det veletablerede effektforløb af kortikosteroider, som er ens i pædiatriske og voksne populationer. Publicerede undersøgelser giver bevis for effektivitet og sikkerhed hos pædiatriske patienter til behandling af nefrotisk syndrom (> 2 år) og aggressive lymfomer og leukæmier (> 1 måneds alderen). Andre indikationer for pædiatrisk brug af kortikosteroider, f.eks. svær astma og hvæsende vejrtrækning, er baseret på tilstrækkelige og velkontrollerede forsøg udført hos voksne, ud fra den forudsætning, at sygdomsforløbet og deres patofysiologi anses for at være væsentligt ens i begge populationer.
Bivirkningerne af kortikosteroider hos pædiatriske patienter ligner dem hos voksne (se BIVIRKNINGER ). Som voksne bør pædiatriske patienter observeres omhyggeligt med hyppige målinger af blodtryk, vægt, højde, intraokulært tryk og klinisk evaluering for tilstedeværelse af infektion, psykosociale forstyrrelser, tromboembolisme, mavesår, grå stær og osteoporose. Pædiatriske patienter, der behandles med kortikosteroider ad en hvilken som helst måde, inklusive systemisk administrerede kortikosteroider, kan opleve et fald i deres væksthastighed. Denne negative påvirkning af kortikosteroider på væksten er blevet observeret ved lave systemiske doser og i fravær af laboratoriebeviser for HPA-aksesuppression (dvs. cosyntropinstimulering og basale cortisolplasmaniveauer). Væksthastighed kan derfor være en mere følsom indikator for systemisk kortikosteroideksponering hos pædiatriske patienter end nogle almindeligt anvendte test af HPA-aksefunktion. Den lineære vækst hos pædiatriske patienter behandlet med kortikosteroider bør overvåges, og de potentielle væksteffekter af forlænget behandling bør afvejes i forhold til opnåede kliniske fordele og tilgængeligheden af behandlingsalternativer. For at minimere de potentielle væksteffekter af kortikosteroider bør pædiatriske patienter titreres til den laveste effektive dosis.
Geriatrisk brug
Kliniske undersøgelser omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling.
OVERDOSIS
Behandling af akut overdosering er støttende og symptomatisk behandling. Ved kronisk overdosering i lyset af alvorlig sygdom, der kræver kontinuerlig steroidbehandling, kan dosis af kortikosteroidet kun reduceres midlertidigt, eller der kan indføres alternativ dagbehandling.
KONTRAINDIKATIONER
Aristocort® Forte er kontraindiceret til patienter, der er overfølsomme over for nogen af komponenterne i dette produkt.
Intramuskulære kortikosteroidpræparater er kontraindiceret til idiopatisk trombocytopenisk purpura.
Aristocort® Forte er kontraindiceret til intratekal administration. Rapporter om alvorlige medicinske hændelser er blevet forbundet med denne administrationsvej.
Arisotcort Forte er kontraindiceret til brug til præmature spædbørn, fordi formuleringen indeholder benzylalkohol (se ADVARSLER og FORHOLDSREGLER : Pædiatrisk brug ).
Arisotcort Forte er kontraindiceret ved systemiske svampeinfektioner, undtagen når det administreres som en intraartikulær injektion til lokaliserede ledtilstande (se ADVARSLER : Infektioner : Svampeinfektioner ).
KLINISK FARMAKOLOGI
Glukokortikoider, naturligt forekommende og syntetiske, er binyrebarksteroider, der let adsorberes fra mave-tarmkanalen.
Naturligt forekommende glukokortikoider (hydrocortison og kortison), som også har salttilbageholdende egenskaber, anvendes som erstatningsterapi ved binyrebarkmangel. Deres syntetiske analoger bruges primært til deres anti-inflammatoriske virkninger ved lidelser i mange organsystemer.
Triamcinolondiacetat er i det væsentlige blottet for mineralokortikoid aktivitet, når det administreres i terapeutiske doser, hvilket forårsager ringe eller ingen natriumretention med minimal eller fraværende kaliumudskillelse.
PATIENTOPLYSNINGER
Patienter skal advares om ikke at stoppe brugen af kortikosteroider brat eller uden lægeligt tilsyn, at informere eventuelle læger om, at de tager kortikosteroider, og at søge læge med det samme, hvis de udvikler feber eller andre tegn på infektion.
Personer, der er på kortikosteroider, bør advares om at undgå eksponering for skoldkopper eller mæslinger. Patienter bør også informeres om, at hvis de bliver eksponeret, skal der straks søges lægehjælp.
