Clarinex 5mg Desloratadine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
CLARINEX® (desloratadin) Tabletter
BESKRIVELSE
CLARINEX (desloratadin) tabletter er lyseblå, runde, filmovertrukne tabletter indeholdende 5 mg desloratadin, et antihistamin, der skal administreres oralt. CLARINEX 5mg tabletter indeholder også følgende hjælpestoffer: dibasisk calciumphosphatdihydrat USP, mikrokrystallinsk cellulose NF, majsstivelse NF, talkum USP, carnaubavoks NF, hvid voks NF, coatingmateriale bestående af laktosemonohydrat, hypromellose, polyethylendioxid, polyethylendioxid, FD&C Blue #2 Aluminium Lake.
CLARINEX oral opløsning er en klar orangefarvet væske, der indeholder 0,5 mg/1 ml desloratadin. Den orale opløsning indeholder følgende inaktive ingredienser: propylenglycol USP, sorbitolopløsning USP, citronsyre (vandfri) USP, natriumcitratdihydrat USP, natriumbenzoat NF, dinatriumedetat USP, renset vand USP. Den indeholder også granuleret sukker, naturlig og kunstig smag til tyggegummi og FDC Yellow #6 farvestof.
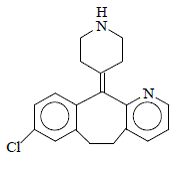
Desloratadin er et hvidt til råhvidt pulver, der er lidt opløseligt i vand, men meget opløseligt i ethanol og propylenglycol. Det har en empirisk formel: C19H19ClN2 og en molekylvægt på 310,8. Det kemiske navn er 8-chlor-6,11-dihydro-11-(4-piperdinyliden)-5H-benzo[5,6]cyclohepta[1,2-b]pyridin og har følgende struktur:
INDIKATIONER
Sæsonbestemt allergisk rhinitis
CLARINEX® er indiceret til lindring af de nasale og ikke-nasale symptomer på sæsonbestemt allergisk rhinitis hos patienter på 2 år og ældre.
Flerårig allergisk rhinitis
CLARINEX er indiceret til lindring af de nasale og ikke-nasale symptomer på perennial allergisk rhinitis hos patienter på 6 måneder og ældre.
Kronisk idiopatisk nældefeber
CLARINEX 5mg er indiceret til symptomatisk lindring af kløe, reduktion i antallet af nældefeber og størrelse af nældefeber hos patienter med kronisk idiopatisk nældefeber fra 6 måneders alderen og ældre.
DOSERING OG ADMINISTRATION
Selvom en oralt disintegrerende tabletformulering af desloratadin kan være tilgængelig på markedet, markedsføres CLARINEX® RediTabs®-tabletter ikke længere.
CLARINEX 5 mg tabletter, oral opløsning eller RediTabs tabletter kan tages uden hensyntagen til måltider. Placer CLARINEX (desloratadine) RediTabs tabletter på tungen og lad det gå i opløsning, før det sluges. Tabletternes opløsning sker hurtigt. Indgives med eller uden vand. Tag tabletten umiddelbart efter åbning af blisterpakningen.
Den alderssvarende dosis af CLARINEX oral opløsning skal administreres med en kommercielt tilgængelig måledråbe eller sprøjte, der er kalibreret til at levere 2 ml og 2,5 ml (½ teskefuld).
Voksne og unge fra 12 år og derover
Den anbefalede dosis af CLARINEX tabletter eller CLARINEX RediTabs tabletter er én 5 mg tablet én gang dagligt. Den anbefalede dosis af CLARINEX oral opløsning er 2 teskefulde (5 mg i 10 ml) én gang dagligt.
Børn i alderen 6 til 11 år
Den anbefalede dosis af CLARINEX oral opløsning er 1 teskefuld (2,5 mg i 5 ml) én gang dagligt. Den anbefalede dosis af CLARINEX RediTabs tabletter er én 2,5 mg tablet én gang dagligt.
Børn fra 12 måneder til 5 år
Den anbefalede dosis af CLARINEX 5 mg oral opløsning er ½ teskefuld (1,25 mg i 2,5 ml) én gang dagligt.
Børn i alderen 6 til 11 måneder
Den anbefalede dosis af CLARINEX oral opløsning er 2 ml (1 mg) én gang dagligt.
Voksne med nedsat lever- eller nyrefunktion
Hos voksne patienter med nedsat lever- eller nyrefunktion anbefales en startdosis på én 5 mg tablet hver anden dag baseret på farmakokinetiske data. Dosisanbefaling til børn med nedsat lever- eller nyrefunktion kan ikke gives på grund af manglende data [se KLINISK FARMAKOLOGI ].
HVORDAN LEVERET
Doseringsformer og styrker
CLARINEX tabletter er lyseblå, filmovertrukne tabletter præget med "C5" indeholdende 5 mg desloratadin. CLARINEX oral opløsning er en klar orangefarvet væske, der indeholder 0,5 mg desloratadin/1 ml.
Opbevaring og håndtering
CLARINEX 5mg tabletter: Prægede "C5", lyseblå, filmovertrukne tabletter, der er pakket i højdensitets polyethylen plastikflasker på 100 ( NDC 0085-1264-01).
CLARINEX 5mg oral opløsning: Klar orangefarvet væske indeholdende 0,5 mg/1 ml desloratadin i en 16-ounce Amber glasflaske ( NDC 0085-1334-01) og en 4-ounce Amber glasflaske ( NDC 0085-1334-02).
Opbevaring
CLARINEX tabletter: Beskyt Unit-of-Use-emballage og Unit-Dose Hospital Pack mod overdreven fugt. Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F) [se USP kontrolleret rumtemperatur ]. Varmefølsom. Undgå eksponering ved eller over 30°C (86°F).
CLARINEX oral opløsning: Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F) [se USP kontrolleret rumtemperatur ]. Beskyt mod lys.
Fremstillet for: Merck Sharp & Dohme Corp., et datterselskab af MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revideret: Marts 2019
BIVIRKNINGER
Følgende bivirkninger er beskrevet mere detaljeret i andre sektioner af etiketten:
- Overfølsomhedsreaktioner. [Se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan frekvenser af bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
Voksne og unge
Allergisk rhinitis
I multiple-dosis placebo-kontrollerede forsøg fik 2834 patienter i alderen 12 år eller ældre CLARINEX tabletter i doser på 2,5 mg til 20 mg dagligt, hvoraf 1655 patienter fik den anbefalede daglige dosis på 5 mg. Hos patienter, der fik 5 mg dagligt, var frekvensen af bivirkninger ens mellem CLARINEX 5 mg og placebobehandlede patienter. Procentdelen af patienter, der trak sig for tidligt på grund af uønskede hændelser, var 2,4 % i CLARINEX 5 mg-gruppen og 2,6 % i placebogruppen. Der var ingen alvorlige bivirkninger i disse undersøgelser hos patienter, der fik desloratadin. Alle bivirkninger, der blev rapporteret af mere end eller lig med 2 % af patienterne, som fik den anbefalede daglige dosis af CLARINEX 5 mg tabletter (5 mg én gang dagligt), og som var mere almindelige med CLARINEX tabletter end placebo, er anført i tabel 1.
Hyppigheden og omfanget af laboratorie- og elektrokardiografiske abnormiteter var ens hos CLARIINEX og placebo-behandlede patienter.
Der var ingen forskelle i bivirkninger for undergrupper af patienter som defineret efter køn, alder eller race.
Kronisk idiopatisk nældefeber
I placebo-kontrollerede multiple-dosis forsøg med kronisk idiopatisk nældefeber fik 211 patienter i alderen 12 år eller ældre CLARINEX 5 mg tabletter, og 205 fik placebo. Bivirkninger, der blev rapporteret af mere end eller lig med 2 % af patienterne, der fik CLARINEX 5 mg tabletter, og som var mere almindelige med CLARINEX 5 mg end placebo, var (hyppigheder for henholdsvis CLARINEX 5 mg og placebo): hovedpine (14 %, 13 %) , kvalme (5 %, 2 %), træthed (5 %, 1 %), svimmelhed (4 %, 3 %), pharyngitis (3 %, 2 %), dyspepsi (3 %, 1 %) og myalgi (3 %, 1 %).
Pædiatri
To hundrede og seksogfyrre pædiatriske forsøgspersoner i alderen 6 måneder til 11 år fik CLARINEX oral opløsning i 15 dage i tre placebokontrollerede kliniske forsøg. Pædiatriske forsøgspersoner i alderen 6 til 11 år fik 2,5 mg én gang dagligt, forsøgspersoner i alderen 1 til 5 år fik 1,25 mg én gang dagligt, og forsøgspersoner i alderen 6 til 11 måneder fik 1,0 mg én gang dagligt.
Hos forsøgspersoner i alderen 6 til 11 år blev ingen individuel uønsket hændelse rapporteret af 2 procent eller flere af forsøgspersonerne.
Hos forsøgspersoner i alderen 2 til 5 år var bivirkninger rapporteret for CLARINEX og placebo hos mindst 2 procent af forsøgspersonerne, der fik CLARINEX 5 mg oral opløsning og med en frekvens højere end placebo feber (5,5 %, 5,4 %), urinvejsinfektion (3,6 %). %, 0 %) og skoldkopper (3,6 %, 0 %).
Hos forsøgspersoner i alderen 12 måneder til 23 måneder var bivirkninger rapporteret for CLARINEX 5 mg-produktet og placebo hos mindst 2 procent af forsøgspersonerne, der fik CLARINEX oral opløsning og med en frekvens højere end placebo feber (16,9 %, 12,9 %), diarré ( 15,4%, 11,3%), øvre luftvejsinfektioner (10,8%, 9,7%), hoste (10,8%, 6,5%), øget appetit (3,1%, 1,6%), følelsesmæssig labilitet (3,1%, 0%), epistaxis ( 3,1%, 0%), parasitisk infektion (3,1%, 0%), pharyngitis (3,1%, 0%), makulopapulær udslæt (3,1%, 0%).
Hos forsøgspersoner i alderen 6 måneder til 11 måneder var bivirkninger rapporteret for CLARINEX 5 mg og placebo hos mindst 2 procent af forsøgspersonerne, der fik CLARINEX 5 mg oral opløsning og med en frekvens, der var større end placebo, øvre luftvejsinfektioner (21,2 %, 12,9 %). diarré (19,7 %, 8,1 %), feber (12,1 %, 1,6 %), irritabilitet (12,1 %, 11,3 %), hoste (10,6 %, 9,7 %), døsighed (9,1 %, 8,1 %), bronkitis (6,1 %, 0%), mellemørebetændelse (6,1%, 1,6%), opkastning (6,1%, 3,2%), anoreksi (4,5%, 1,6%), pharyngitis (4,5%, 1,6%), søvnløshed (4,5%, 0%), rhinoré (4,5 %, 3,2 %), erytem (3,0 %, 1,6 %) og kvalme (3,0 %, 0 %).
Der var ingen klinisk betydningsfulde ændringer i nogen elektrokardiografisk parameter, inklusive QTc-intervallet. Kun én af de 246 pædiatriske forsøgspersoner, der fik CLARINEX 5 mg oral opløsning i de kliniske forsøg, afbrød behandlingen på grund af en bivirkning.
Post-marketing oplevelse
Fordi uønskede hændelser rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering. Følgende spontane bivirkninger er blevet rapporteret under markedsføringen af desloratadin:
Hjertelidelser: takykardi, hjertebanken
Åndedræts-, thorax- og mediastinumsygdomme: dyspnø
Hud- og subkutane vævssygdomme: udslæt, kløe
Forstyrrelser i nervesystemet: psykomotorisk hyperaktivitet, bevægelsesforstyrrelser (herunder dystoni, tics og ekstrapyramidale symptomer), krampeanfald (rapporteret hos patienter med og uden en kendt anfaldsforstyrrelse)
Forstyrrelser i immunsystemet: overfølsomhedsreaktioner (såsom nældefeber, ødem og anafylaksi)
Undersøgelser: forhøjede leverenzymer inklusive bilirubin
Lever og galdevejslidelser: hepatitis
Metabolisme og ernæringsforstyrrelser: øget appetit
DRUGSINTERAKTIONER
Hæmmere af Cytochrom P450 3A4
kontrollerede kliniske undersøgelser resulterede samtidig administration af desloratadin og ketoconazol, erythromycin eller azithromycin i øgede plasmakoncentrationer af desloratadin og 3-hydroxydesloratadin, men der var ingen klinisk relevante ændringer i sikkerhedsprofilen for desloratadin. [Se KLINISK FARMAKOLOGI ]
Fluoxetin
I kontrollerede kliniske studier resulterede samtidig administration af desloratadin og fluoxetin, en selektiv serotoningenoptagelseshæmmer (SSRI), i øgede plasmakoncentrationer af desloratadin og 3-hydroxydesloratadin, men der var ingen klinisk relevante ændringer i sikkerhedsprofilen for desloratadin. [Se KLINISK FARMAKOLOGI ]
Cimetidin
I kontrollerede kliniske studier resulterede samtidig administration af desloratadin og cimetidin, en histamin H2-receptorantagonist, i øgede plasmakoncentrationer af desloratadin og 3 hydroxydesloratadin, men der var ingen klinisk relevante ændringer i sikkerhedsprofilen for desloratadin. [Se KLINISK FARMAKOLOGI ]
Stofmisbrug og afhængighed
Der er ingen information, der indikerer, at misbrug eller afhængighed forekommer med CLARINEX tabletter.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Overfølsomhedsreaktioner
Overfølsomhedsreaktioner inklusive udslæt, pruritus, nældefeber, ødem, dyspnø og anafylaksi er blevet rapporteret efter administration af desloratadin. Hvis en sådan reaktion opstår, skal behandlingen med CLARIINEX 5 mg stoppes, og alternativ behandling bør overvejes. [Se BIVIRKNINGER ]
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER ).
Information til patienter
- Patienter skal instrueres i at bruge CLARIINEX 5 mg som anvist.
- Da der ikke er nogen fødevarepåvirkning på biotilgængeligheden, kan patienter instrueres i, at CLARINEX 5 mg tabletter, oral opløsning eller RediTabs tabletter kan tages uden hensyntagen til måltider.
- Patienter bør rådes til ikke at øge dosis eller doseringshyppighed, da undersøgelser ikke har vist øget effektivitet ved højere doser, og somnolens kan forekomme.
- Fenylketonurika: CLARINEX RediTabs tabletter indeholder phenylalanin.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Kræftfremkaldende undersøgelser
Det karcinogene potentiale af desloratadin blev vurderet ved hjælp af en loratadin undersøgelse i rotter og en desloratadin undersøgelse i mus. I et 2-årigt studie med rotter blev loratadin indgivet i kosten i doser op til 25 mg/kg/dag (estimeret desloratadin- og desloratadinmetaboliteksponering var ca. 30 gange AUC hos mennesker ved den anbefalede daglige orale dosis). En signifikant højere forekomst af hepatocellulære tumorer (kombinerede adenomer og karcinomer) blev observeret hos mænd, der fik 10 mg/kg/dag loratadin og hos mænd og kvinder, der fik 25 mg/kg/dag loratadin. De estimerede desloratadin- og desloratadinmetaboliteksponeringer hos rotter, der fik 10 mg/kg loratadin, var ca. 7 gange AUC hos mennesker ved den anbefalede daglige orale dosis. Den kliniske betydning af disse fund under langvarig brug af desloratadin er ikke kendt.
et 2-årigt diætstudie med mus, viste hanner og hunner givet op til henholdsvis 16 mg/kg/dag og 32 mg/kg/dag desloratadin ingen signifikant stigning i forekomsten af nogen tumorer. De estimerede desloratadin- og desloratadinmetaboliteksponeringer hos mus ved disse doser var henholdsvis 12 og 27 gange AUC hos mennesker ved den anbefalede daglige orale dosis.
Genotoksicitetsundersøgelser
I genotoksicitetsundersøgelser med desloratadin var der ingen tegn på genotoksisk potentiale i et omvendt mutationsassay (Salmonella/E. coli pattedyrsmikrosom bakteriel mutagenicitetsassay) eller i 2 assays for kromosomafvigelser (humant perifert blod lymfocyt clastogenicitetsassay og muse-bovelmarv-assay ).
Forringelse af fertilitet
Der var ingen effekt på kvindelig fertilitet hos rotter ved doser af desloratadin op til 24 mg/kg/dag (estimeret desloratadin- og desloratadinmetaboliteksponering var ca. 130 gange AUC hos mennesker ved den anbefalede daglige orale dosis). Et specifikt mandligt fald i fertilitet, påvist ved reducerede kvindelige undfangelsesrater, nedsat sædtal og bevægelighed samt histopatologiske testikelforandringer, forekom ved en oral desloratadin-dosis på 12 mg/kg hos rotter (estimeret desloratadin- og desloratadin-metaboliteksponering var ca. 45 gange højere end AUC hos mennesker ved den anbefalede daglige orale dosis). Desloratadin havde ingen effekt på fertiliteten hos rotter ved en oral dosis på 3 mg/kg/dag (estimeret desloratadin- og desloratadin-metaboliteksponering var ca. 8 gange AUC hos mennesker ved den anbefalede daglige orale dosis).
Brug i specifikke populationer
Graviditet
Graviditetskategori C
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør desloratadin kun anvendes under graviditet, hvis det er klart nødvendigt.
Desloratadin var ikke teratogent hos rotter eller kaniner ved henholdsvis ca. 210 og 230 gange arealet under koncentration-tid-kurven (AUC) hos mennesker ved den anbefalede daglige orale dosis. En stigning i præimplantationstab og et fald i antallet af implantationer og fostre blev dog bemærket i et separat studie med hunrotter på ca. 120 gange AUC hos mennesker ved den anbefalede daglige orale dosis. Reduceret kropsvægt og langsom opretningsrefleks blev rapporteret hos unger ved ca. 50 gange eller højere end AUC hos mennesker ved den anbefalede daglige orale dosis. Desloratadin havde ingen effekt på ungernes udvikling ved ca. 7 gange AUC hos mennesker ved den anbefalede daglige orale dosis. AUC'erne i sammenligning refererede til henholdsvis desloratadineksponeringen hos kaniner og summen af eksponeringen for desloratadin og dets metabolitter hos rotter. [Se Ikke-klinisk toksikologi ]
Ammende mødre
Desloratadin går over i modermælken; derfor bør der træffes en beslutning om, hvorvidt amningen skal afbrydes eller desloratadin skal seponeres under hensyntagen til fordelene ved lægemidlet for den ammende mor og den mulige risiko for barnet.
Pædiatrisk brug
Den anbefalede dosis af CLARINEX 5mg oral opløsning til den pædiatriske population er baseret på krydsstudiesammenligning af plasmakoncentrationen af CLARINEX 5mg hos voksne og pædiatriske forsøgspersoner. Sikkerheden af CLARINEX oral opløsning er blevet fastslået hos 246 pædiatriske forsøgspersoner i alderen 6 måneder til 11 år i tre placebokontrollerede kliniske undersøgelser. Da forløbet af sæsonbestemt og perennial allergisk rhinitis og kronisk idiopatisk nældefeber og virkningerne af CLARINEX er tilstrækkeligt ens i den pædiatriske og voksne population, tillader det ekstrapolering fra de voksnes effektdata til pædiatriske patienter. Effektiviteten af CLARINEX 5 mg oral opløsning i disse aldersgrupper understøttes af beviser fra tilstrækkelige og velkontrollerede undersøgelser af CLARINEX 5 mg tabletter hos voksne. Sikkerheden og effektiviteten af CLARINEX 5 mg tabletter eller CLARINEX 5 mg oral opløsning er ikke blevet påvist hos pædiatriske patienter under 6 måneder. [Se KLINISK FARMAKOLOGI ]
CLARINEX RediTabs 2,5 mg tabletten er ikke blevet evalueret hos pædiatriske patienter. Bioækvivalens af CLARINEX 5 mg RediTabs tablet og den tidligere markedsførte RediTabs tablet blev etableret hos voksne. Sammen med de beskrevne dosisfindende undersøgelser inden for pædiatri understøtter de farmakokinetiske data for CLARINEX 5 mg RediTabs brugen af dosisstyrken på 2,5 mg til pædiatriske patienter i alderen 6 til 11 år.
Geriatrisk brug
Kliniske undersøgelser af desloratadin inkluderede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle mellem ældre og yngre patienter. Generelt bør dosisvalg for en ældre patient være forsigtigt, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling. [Se KLINISK FARMAKOLOGI ]
Nedsat nyrefunktion
Dosisjustering til patienter med nedsat nyrefunktion anbefales [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Dosisjustering til patienter med nedsat leverfunktion anbefales [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
OVERDOSIS
I tilfælde af overdosering skal du overveje standardforanstaltninger for at fjerne uabsorberet lægemiddel. Symptomatisk og understøttende behandling anbefales. Desloratadin og 3-hydroxydesloratadin elimineres ikke ved hæmodialyse.
Oplysninger om akut overdosering er begrænset til erfaring fra post-marketing bivirkningsrapporter og fra kliniske undersøgelser udført under udviklingen af CLARINEX 5mg produktet. I et dosisvarierende forsøg blev der rapporteret søvnighed ved doser på 10 mg og 20 mg/dag.
I en anden undersøgelse blev der ikke rapporteret klinisk relevante bivirkninger hos normale mandlige og kvindelige frivillige, som fik daglige enkeltdoser af CLARINEX 45 mg i 10 dage [se KLINISK FARMAKOLOGI ].

Dødelighed forekom hos rotter ved orale doser på 250 mg/kg eller mere (estimeret desloratadin- og desloratadinmetaboliteksponering var ca. 120 gange AUC hos mennesker ved den anbefalede daglige orale dosis). Den orale gennemsnitlige dødelige dosis hos mus var 353 mg/kg (estimeret desloratadineksponering var ca. 290 gange den humane daglige orale dosis på mg/m²-basis). Der forekom ingen dødsfald ved orale doser på op til 250 mg/kg hos aber (estimeret eksponering for desloratadin var ca. 810 gange den humane daglige orale dosis på mg/m²-basis).
KONTRAINDIKATIONER
CLARINEX 5mg tabletter, RediTabs og oral opløsning er kontraindiceret til patienter, der er overfølsomme over for denne medicin eller over for nogen af dens indholdsstoffer eller over for loratadin [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Desloratadin er en langtidsvirkende tricyklisk histaminantagonist med selektiv H1-receptor histaminantagonistaktivitet. Receptorbindingsdata indikerer, at ved en koncentration på 2-3 ng/ml (7 nanomolær) viser desloratadin signifikant interaktion med den humane histamin H1-receptor. Desloratadin hæmmede histaminfrigivelse fra humane mastceller in vitro. Resultater af et radiomærket vævsfordelingsstudie i rotter og et radioligand H1-receptorbindingsstudie i marsvin viste, at desloratadin ikke let krydsede blod-hjernebarrieren. Den kliniske betydning af dette fund er ukendt.
Farmakodynamik
Wheal Og Flare
Human histamin hud wheal undersøgelser efter enkelte og gentagne 5-mg doser af desloratadin har vist, at lægemidlet udviser en antihistaminisk virkning efter 1 time; denne aktivitet kan vare så længe som 24 timer. Der var ingen tegn på histamin-induceret hudhvaltakyfylakse i desloratadin 5-mg-gruppen i løbet af den 28-dages behandlingsperiode. Den kliniske relevans af histamin-hvalhudtest er ukendt.
Effekter på QTc
Enkelte daglige doser på 45 mg blev givet til normale mandlige og kvindelige frivillige i 10 dage. Alle EKG'er opnået i denne undersøgelse blev manuelt aflæst på en blind måde af en kardiolog. Hos CLARINEX-behandlede forsøgspersoner var der en stigning i gennemsnitlig hjertefrekvens på 9,2 slag/min i forhold til placebo. QT-intervallet blev korrigeret for hjertefrekvens (QTc) ved både Bazett- og Fridericia-metoderne. Ved brug af QTc (Bazett) var der en gennemsnitlig stigning på 8,1 msek hos CLARIINEX-behandlede forsøgspersoner i forhold til placebo. Ved brug af QTc (Fridericia) var der en gennemsnitlig stigning på 0,4 msek hos CLARIINEX-behandlede forsøgspersoner i forhold til placebo. Ingen klinisk relevante bivirkninger blev rapporteret.
Farmakokinetik
Absorption
Efter oral administration af en desloratadin 5 mg tablet én gang dagligt i 10 dage til normale raske frivillige, forekom den gennemsnitlige tid til maksimal plasmakoncentration (Tmax) ca. 3 timer efter dosis og gennemsnitlige steady state peak plasmakoncentrationer (Cmax) og AUC af Der blev observeret henholdsvis 4 ng/ml og 56,9 ng.time/ml. Hverken mad eller grapefrugtjuice havde en effekt på biotilgængeligheden (Cmax og AUC) af desloratadin.
Den farmakokinetiske profil af CLARINEX oral opløsning blev evalueret i et tre-vejs crossover-studie med 30 voksne frivillige. En enkelt dosis på 10 ml CLARINEX oral opløsning indeholdende 5 mg desloratadin var bioækvivalent med en enkelt dosis på 5 mg CLARINEX tablet. Fødevarer havde ingen effekt på biotilgængeligheden (AUC og Cmax) af CLARINEX 5 mg oral opløsning.
Den farmakokinetiske profil af CLARINEX 5 mg RediTabs-tabletter blev evalueret i et tre-vejs crossover-studie med 24 voksne frivillige. En enkelt CLARINEX RediTabs-tablet indeholdende 5 mg desloratadin var bioækvivalent med en enkelt 5-mg CLARINEX RediTabs-tablet (original formulering) for både desloratadin og 3-hydroxydesloratadin. Mad og vand havde ingen effekt på biotilgængeligheden (AUC og Cmax) af CLARIINEX RediTabs tabletter.
Fordeling
Desloratadin og 3-hydroxydesloratadin er henholdsvis ca. 82 % til 87 % og 85 % til 89 % bundet til plasmaproteiner. Proteinbinding af desloratadin og 3-hydroxydesloratadin var uændret hos personer med nedsat nyrefunktion.
Metabolisme
Desloratadin (en hovedmetabolit af loratadin) metaboliseres i vid udstrækning til 3-hydroxydesloratadin, en aktiv metabolit, som efterfølgende glucuronideres. Det eller de enzymer, der er ansvarlige for dannelsen af 3-hydroxydesloratadin, er ikke blevet identificeret. Data fra kliniske forsøg indikerer, at en undergruppe af den generelle befolkning har en nedsat evne til at danne 3hydroxydesloratadin og er dårlige omsættere af desloratadin. I farmakokinetiske undersøgelser (n=3748) var ca. 6% af forsøgspersonerne dårlige metabolisatorer af desloratadin (defineret som et forsøgsperson med et AUC-forhold på 3-hydroxydesloratadin til desloratadin på mindre end 0,1, eller et forsøgsperson med en desloratadinhalveringstid på over 50 timer ). Disse farmakokinetiske undersøgelser omfattede forsøgspersoner i alderen 2 til 70 år, herunder 977 forsøgspersoner i alderen 2 til 5 år, 1575 forsøgspersoner i alderen 6 til 11 år og 1196 forsøgspersoner i alderen 12 til 70 år. Der var ingen forskel i forekomsten af dårlige stofskiftere på tværs af aldersgrupper. Hyppigheden af dårlige metabolisatorer var højere hos sorte (17 %, n=988) sammenlignet med kaukasiere (2 %, n=1.462) og latinamerikanere (2 %, n=1.063). Medianeksponeringen (AUC) for desloratadin hos de dårlige metabolisatorer var ca. 6 gange større end hos de forsøgspersoner, der ikke er dårlige metabolisatorer. Forsøgspersoner, som metaboliserer dårligt desloratadin, kan ikke identificeres prospektivt og vil blive udsat for højere niveauer af desloratadin efter dosering med den anbefalede dosis desloratadin. I multidosis kliniske sikkerhedsundersøgelser, hvor metabolisatorstatus blev identificeret, blev i alt 94 dårlige metabolisatorer og 123 normale metabolisatorer inkluderet og behandlet med CLARINEX oral opløsning i 15-35 dage. I disse undersøgelser blev der ikke observeret nogen overordnede forskelle i sikkerhed mellem dårlige metabolisatorer og normale metabolisatorer. Selvom det ikke er set i disse undersøgelser, kan en øget risiko for eksponeringsrelaterede bivirkninger hos patienter, der er dårlige metabolisatorer, ikke udelukkes.
Elimination
Den gennemsnitlige plasmaelimineringshalveringstid for desloratadin var ca. 27 timer. Cmax og AUC-værdier steg dosisproportionalt efter enkelt orale doser mellem 5 og 20 mg. Graden af akkumulering efter 14 dages dosering var i overensstemmelse med halveringstiden og doseringshyppigheden. En human massebalanceundersøgelse dokumenterede en genvinding på ca. 87 % af 14C-desloratadin-dosis, som var ligeligt fordelt i urin og fæces som metaboliske produkter. Analyse af plasma 3hydroxydesloratadin viste lignende Tmax og halveringstid værdier sammenlignet med desloratadin.
Særlige Populationer
Geriatriske fag
Hos ældre forsøgspersoner (≥65 år gamle; n=17) efter administration af flere doser af CLARINEX 5 mg tabletter var de gennemsnitlige Cmax- og AUC-værdier for desloratadin 20 % højere end hos yngre forsøgspersoner (
Pædiatriske emner
Hos forsøgspersoner i alderen 6 til 11 år resulterede en enkelt dosis på 5 ml CLARINEX oral opløsning indeholdende 2,5 mg desloratadin i plasmakoncentrationer af desloratadin svarende til dem, der blev opnået hos voksne, der fik en enkelt 5 mg CLARINEX-tablet. Hos forsøgspersoner i alderen 2 til 5 år resulterede en enkelt dosis på 2,5 ml CLARINEX oral opløsning indeholdende 1,25 mg desloratadin i plasmakoncentrationer af desloratadin svarende til dem, der blev opnået hos voksne, der fik en enkelt 5 mg CLARINEX tablet. Imidlertid var Cmax og AUC for metabolitten (3-hydroxydesloratadin) 1,27 og 1,61 gange højere for 5 mg oral opløsning administreret til voksne sammenlignet med Cmax og AUC opnået hos børn i alderen 2 til 11 år, der fik 1,25- 2,5 mg CLARINEX oral opløsning.
En enkelt dosis på enten 2,5 ml eller 1,25 ml CLARINEX 5 mg oral opløsning indeholdende henholdsvis 1,25 mg eller 0,625 mg desloratadin blev administreret til forsøgspersoner i alderen 6 til 11 måneder og i alderen 12 til 23 måneder. Resultaterne af en populationsfarmakokinetisk analyse indikerede, at en dosis på 1 mg til forsøgspersoner i alderen 6 til 11 måneder og 1,25 mg til forsøgspersoner i alderen 12 til 23 måneder er påkrævet for at opnå desloratadin plasmakoncentrationer svarende til dem, der opnås hos voksne, der administreres en enkelt 5- mg dosis af CLARINEX oral opløsning.
CLARINEX 5 mg RediTabs 2,5 mg tabletten er ikke blevet evalueret hos pædiatriske patienter. Bioækvivalens af CLARINEX 5mg RediTabs-tabletten og de originale CLARINEX 5mg RediTabs-tabletter blev etableret hos voksne. Sammen med de beskrevne dosisfindende undersøgelser i pædiatrien understøtter de farmakokinetiske data for CLARINEX 5 mg RediTabs tabletter brugen af dosisstyrken på 2,5 mg til pædiatriske patienter i alderen 6 til 11 år.
Nedsat nyrefunktion
Desloratadins farmakokinetik efter en enkelt dosis på 7,5 mg blev karakteriseret hos patienter med mild (n=7; kreatininclearance 51-69 mL/min/1,73 m²), moderat (n=6; kreatininclearance 34-43 mL/min/1,73 m²) ), og alvorlige (n=6; kreatininclearance 5-29 ml/min/1,73 m²) nedsat nyrefunktion eller hæmodialyse-afhængige (n=6) patienter. Hos patienter med let og moderat nedsat nyrefunktion steg mediane Cmax- og AUC-værdier med henholdsvis ca. 1,2 og 1,9 gange i forhold til personer med normal nyrefunktion. Hos patienter med svært nedsat nyrefunktion, eller som var hæmodialyseafhængige, steg Cmax- og AUC-værdierne med henholdsvis ca. 1,7 og 2,5 gange. Der blev observeret minimale ændringer i 3-hydroxydesloratadin-koncentrationer. Desloratadin og 3-hydroxydesloratadin blev dårligt fjernet ved hæmodialyse. Plasmaproteinbinding af desloratadin og 3-hydroxydesloratadin var uændret af nedsat nyrefunktion. Dosisjustering til patienter med nedsat nyrefunktion anbefales [se DOSERING OG ADMINISTRATION ].
Leversvigt
Desloratadins farmakokinetik blev karakteriseret efter en enkelt oral dosis hos patienter med mild (n=4), moderat (n=4) og svær (n=4) leverinsufficiens som defineret af Child-Pugh-klassificeringen af leverfunktion og 8 forsøgspersoner med normal leverfunktion. Patienter med nedsat leverfunktion, uanset sværhedsgrad, havde en stigning på ca. 2,4 gange i AUC sammenlignet med normale forsøgspersoner. Den tilsyneladende orale clearance af desloratadin hos patienter med mild, moderat og svær leverinsufficiens var henholdsvis 37 %, 36 % og 28 % af clearance hos normale forsøgspersoner. Der blev observeret en stigning i den gennemsnitlige eliminationshalveringstid for desloratadin hos patienter med nedsat leverfunktion. For 3-hydroxydesloratadin var de gennemsnitlige Cmax- og AUC-værdier for patienter med nedsat leverfunktion ikke statistisk signifikant forskellige fra forsøgspersoner med normal leverfunktion. Dosisjustering til patienter med nedsat leverfunktion anbefales [se DOSERING OG ADMINISTRATION ].
Køn
Kvindelige forsøgspersoner behandlet i 14 dage med CLARINEX 5 mg tabletter havde henholdsvis 10 % og 3 % højere desloratadin Cmax og AUC værdier sammenlignet med mandlige forsøgspersoner. Cmax- og AUC-værdierne for 3-hydroxydesloratadin blev også øget med henholdsvis 45 % og 48 % hos kvinder sammenlignet med mænd. Det er dog ikke sandsynligt, at disse tilsyneladende forskelle er klinisk relevante, og derfor anbefales ingen dosisjustering.
Race
Efter 14 dages behandling med CLARINEX-tabletter var Cmax- og AUC-værdierne for desloratadin henholdsvis 18 % og 32 % højere hos sorte sammenlignet med kaukasiere. For 3-hydroxydesloratadin var der en tilsvarende 10 % reduktion i Cmax og AUC-værdier hos sorte sammenlignet med kaukasiere. Disse forskelle er sandsynligvis ikke klinisk relevante, og derfor anbefales ingen dosisjustering.
Lægemiddelinteraktioner
to kontrollerede crossover kliniske farmakologiske undersøgelser med raske mandlige (n=12 i hver undersøgelse) og kvindelige (n=12 i hver undersøgelse) frivillige, blev desloratadin 7,5 mg (1,5 gange den daglige dosis) én gang dagligt administreret sammen med erythromycin 500 mg hver 8. timer eller ketoconazol 200 mg hver 12. time i 10 dage. I tre separate kontrollerede, parallelle gruppe kliniske farmakologiske undersøgelser er desloratadin i den kliniske dosis på 5 mg blevet administreret sammen med azithromycin 500 mg efterfulgt af 250 mg én gang dagligt i 4 dage (n=18) eller med fluoxetin 20 mg én gang dagligt i 7 dage efter en 23-dages forbehandlingsperiode med fluoxetin (n=18) eller med cimetidin 600 mg hver 12. time i 14 dage (n=18) under steady-state forhold til normale raske mandlige og kvindelige frivillige. Selvom der blev observeret øgede plasmakoncentrationer (Cmax og AUC0-24 timer) af desloratadin og 3hydroxydesloratadin (se tabel 2), var der ingen klinisk relevante ændringer i sikkerhedsprofilen for desloratadin, vurderet ved elektrokardiografiske parametre (inklusive det korrigerede QT-interval). kliniske laboratorietests, vitale tegn og bivirkninger.
Dyretoksikologi og/eller farmakologi Reproduktionstoksikologiske undersøgelser
Desloratadin var ikke teratogent hos rotter ved doser op til 48 mg/kg/dag (estimerede desloratadin- og desloratadin-metaboliteksponeringer var ca. 210 gange AUC hos mennesker ved den anbefalede daglige orale dosis) eller hos kaniner ved doser op til 60 mg/kg/ dag (estimeret eksponering for desloratadin var ca. 230 gange AUC hos mennesker ved den anbefalede daglige orale dosis). I en separat undersøgelse blev der observeret en stigning i præ-implantationstab og et fald i antal implantationer og fostre hos hunrotter ved 24 mg/kg (estimeret desloratadin- og desloratadin-metaboliteksponering var ca. 120 gange AUC hos mennesker ved den anbefalede daglige orale dosis). Reduceret kropsvægt og langsom opretningsrefleks blev rapporteret hos unger ved doser på 9 mg/kg/dag eller mere (estimeret desloratadin- og desloratadin-metaboliteksponering var ca. 50 gange eller større end AUC hos mennesker ved den anbefalede daglige orale dosis). Desloratadin havde ingen effekt på hvalpenes udvikling ved en oral dosis på 3 mg/kg/dag (estimeret desloratadin- og desloratadinmetaboliteksponering var ca. 7 gange AUC hos mennesker ved den anbefalede daglige orale dosis).
Kliniske Studier
Sæsonbestemt allergisk rhinitis
Den kliniske effekt og sikkerhed af CLARINEX tabletter blev evalueret hos over 2300 patienter i alderen 12 til 75 år med sæsonbetinget allergisk rhinitis. I alt 1838 patienter modtog 2,5 til 20 mg/dag af CLARINEX i 4 dobbeltblindede, randomiserede, placebokontrollerede kliniske forsøg af 2 til 4 ugers varighed udført i USA. Resultaterne af disse undersøgelser viste effektiviteten og sikkerheden af CLARINEX 5 mg til behandling af voksne og unge patienter med sæsonbetinget allergisk rhinitis. I et dosisvarierende forsøg blev CLARINEX 2,5 til 20 mg/dag undersøgt. Doser på 5, 7,5, 10 og 20 mg/dag var bedre end placebo; og ingen yderligere fordel blev set ved doser over 5,0 mg. I samme undersøgelse blev der observeret en stigning i forekomsten af somnolens ved doser på 10 mg/dag og 20 mg/dag (henholdsvis 5,2 % og 7,6 %) sammenlignet med placebo (2,3 %).
to 4-ugers undersøgelser af 924 patienter (i alderen 15 til 75 år) med sæsonbetinget allergisk rhinitis og samtidig astma, forbedrede CLARINEX 5 mg tabletter 5 mg én gang daglig rhinitissymptomer uden nedsat lungefunktion. Dette understøtter sikkerheden ved at administrere CLARIINEX 5 mg tabletter til voksne patienter med sæsonbestemt allergisk rhinitis med mild til moderat astma.
CLARINEX tabletter 5 mg én gang dagligt reducerede den totale symptomscore (summen af individuelle scorer af nasale og ikke-nasale symptomer) signifikant hos patienter med sæsonbestemt allergisk rhinitis. Se tabel 3.
Der var ingen signifikante forskelle i effektiviteten af CLARINEX 5 mg tabletter 5 mg på tværs af undergrupper af patienter defineret efter køn, alder eller race.
Flerårig allergisk rhinitis
Den kliniske effekt og sikkerhed af CLARINEX tabletter 5 mg blev evalueret hos over 1300 patienter i alderen 12 til 80 år med perennial allergisk rhinitis. I alt 685 patienter fik 5 mg/dag af CLARINEX 5 mg i to dobbeltblindede, randomiserede, placebokontrollerede kliniske forsøg af 4 ugers varighed udført i USA og internationalt. I en af disse undersøgelser viste det sig, at CLARINEX 5 mg tabletter 5 mg én gang dagligt signifikant reducerede den samlede symptomscore hos patienter med perennial allergisk rhinitis (tabel 4).
Kronisk idiopatisk nældefeber
Effekten og sikkerheden af CLARINEX 5 mg tabletter 5 mg én gang dagligt blev undersøgt hos 416 patienter med kronisk idiopatisk nældefeber i alderen 12 til 84 år, hvoraf 211 fik CLARINEX. I to dobbeltblindede, placebokontrollerede, randomiserede kliniske undersøgelser af seks ugers varighed, ved den forudspecificerede en-uges primære evalueringstidspunkt, reducerede CLARINEX tabletter signifikant sværhedsgraden af pruritus sammenlignet med placebo (tabel 5). Sekundære endepunkter blev også evalueret, og i løbet af den første uge af behandlingen reducerede CLARIINEX 5 mg tabletter 5 mg de sekundære endepunkter, "Antal nældefeber" og "Størrelsen af den største bistade" sammenlignet med placebo.
Den kliniske sikkerhed af CLARINEX oral opløsning blev dokumenteret i tre, 15-dages, dobbeltblindede, placebokontrollerede sikkerhedsundersøgelser hos pædiatriske forsøgspersoner med en dokumenteret anamnese med allergisk rhinitis, kronisk idiopatisk nældefeber eller forsøgspersoner, der var kandidater til antihistaminbehandling. I den første undersøgelse blev 2,5 mg CLARINEX oral opløsning administreret til 60 pædiatriske forsøgspersoner i alderen 6 til 11 år. Den anden undersøgelse evaluerede 1,25 mg CLARINEX oral opløsning administreret til 55 pædiatriske forsøgspersoner i alderen 2 til 5 år. I den tredje undersøgelse blev 1,25 mg CLARINEX 5 mg oral opløsning administreret til 65 pædiatriske forsøgspersoner i alderen 12 til 23 måneder, og 1,0 mg CLARINEX oral opløsning blev administreret til 66 pædiatriske forsøgspersoner i alderen 6 til 11 måneder. Resultaterne af disse undersøgelser påviste sikkerheden af CLARINEX 5 mg oral opløsning hos pædiatriske forsøgspersoner i alderen 6 måneder til 11 år.
PATIENTOPLYSNINGER
CLARINEX® (CLA-RI-NEX) (desloratadin) tabletter, RediTabs® og oral opløsning
Læs patientinformationen, der følger med CLARIINEX®, før du begynder at tage den, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Denne folder er et resumé af informationen til patienter. Din læge eller apotek kan give dig yderligere oplysninger. Denne indlægsseddel træder ikke i stedet for at tale med din læge om din medicinske tilstand eller behandling.
Hvad er Clarinex 5mg?
CLARINEX er et receptpligtigt lægemiddel, der indeholder lægemidlet desloratadin (et antihistamin).
CLARINEX bruges til at hjælpe med at kontrollere symptomerne på:
- sæsonbetinget allergisk rhinitis (nysen, tilstoppet næse, løbende næse og kløe i næsen) hos personer på 2 år og ældre.
- flerårig allergisk rhinitis (nysen, tilstoppet næse, løbende næse og kløe i næsen) hos personer på 6 måneder og ældre.
- kronisk idiopatisk nældefeber (langvarig kløe) og for at reducere antallet og størrelsen af nældefeber hos personer 6 måneder og ældre.
CLARINEX er ikke til børn under 6 måneder.
Hvem bør ikke tage Clarinex?
Tag ikke Clarinex 5 mg, hvis du:
- er allergisk over for desloratadin eller et af indholdsstofferne i CLARINEX tabletter, CLARINEX RediTabs® eller CLARINEX oral opløsning. Se slutningen af denne folder for en komplet liste over ingredienser.
- er allergiske over for loratadin (Alavert, Claritin).
Tal med din læge, før du tager denne medicin, hvis du har spørgsmål om, hvorvidt du skal tage denne medicin.
Hvad skal jeg fortælle min læge, før jeg tager CLARINEX 5mg?
Inden du tager CLARINEX 5mg, skal du fortælle det til din læge, hvis du:
- har lever- eller nyreproblemer.
- har andre medicinske tilstande.
- er gravid eller planlægger at blive gravid. Det vides ikke, om CLARINEX 5mg vil skade dit ufødte barn. Tal med din læge, hvis du er gravid eller planlægger at blive gravid.
- ammer eller planlægger at amme. CLARINEX 5mg kan passere over i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, hvis du tager CLARIINEX.
Fortæl din læge om al den medicin du tager, herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. CLARINEX 5mg kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke, hvordan CLARINEX 5mg virker. Fortæl det især din læge, hvis du tager:
- ketoconazol (Nizoral)
- erythromycin (Ery-tab, Eryc, PCE)
- azithromycin (Zithromax, Zmax)
- antihistaminer
- fluoxetin (Prozac)
- cimetidin (Tagamet)
Kend den medicin du tager. Hold en liste over din medicin og vis den til din læge og apotek, når du får en ny medicin.
Hvordan skal jeg tage Clarinex?
- Tag CLARINEX 5mg nøjagtigt som din læge fortæller dig at tage det.
- Du må ikke ændre din dosis af CLARINEX 5 mg eller tage oftere end foreskrevet.
- CLARINEX 5 mg kan tages med eller uden mad.
- Placer CLARINEX RediTabs Tablet på din tunge og lad den opløses, før den synkes. CLARINEX 5mg RediTabs kan tages med eller uden vand. Tag din CLARINEX 5mg RediTabs tablet med det samme efter åbning af blisterpakningen.
- Tag CLARINEX oral opløsning med en målende dråbe eller oral sprøjte, der kan måle 2 mL eller 2,5 mL. Spørg på apoteket om en dråbe eller sprøjte, hvis du ikke har en.
- Hvis du tager for meget CLARINEX, skal du kontakte din læge eller søge læge med det samme.
Hvad er de mulige bivirkninger af CLARINEX tabletter?
CLARINEX 5mg kan forårsage alvorlige bivirkninger, herunder:
- Allergiske reaktioner. Stop med at tage CLARINEX 5mg og ring med det samme til din læge eller få akut hjælp, hvis du har nogle af disse symptomer:
- udslæt
- kløe
- nældefeber
- hævelse af dine læber, tunge, ansigt og hals
- åndenød eller åndedrætsbesvær
De mest almindelige bivirkninger af CLARINEX hos voksne og børn på 12 år og ældre med allergisk rhinitis omfatter:
- ondt i halsen
- tør mund
- muskelsmerter
- træthed
- søvnighed
- menstruationssmerter
Øget søvnighed eller træthed kan forekomme, hvis du tager mere CLARINEX, end din læge har ordineret til dig.
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af CLARIINEX. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare Clarinex 5mg?
- butik CLARINEX tabletter mellem 59°F til 86°F (15°C til 30°C).
- CLARINEX tabletter er følsomme over for varme. Må ikke opbevares over 86°F (30°C).
- Beskytte CLARINEX 5mg tabletter fra fugt.
- butik CLARINEX 5mg oral opløsning mellem 59°F til 86°F (15°C til 30°C). Beskyt CLARINEX 5mg oral opløsning mod lys.
Holde CLARINEX tabletter, RediTabs tabletter , og Oral løsning og al medicin uden for børns rækkevidde.
Generel information om CLARINEX
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en patientinformationsfolder. Brug ikke CLARINEX 5mg til en tilstand, som det ikke er ordineret til. Giv ikke Clarinex 5 mg til andre mennesker, heller ikke selvom de har samme lidelse, som du har. Det kan skade dem.
Denne indlægsseddel opsummerer de vigtigste oplysninger om CLARIINEX. Hvis du vil have mere information, så tal med din læge. Du kan bede din apotekspersonale eller læge om oplysninger om CLARINEX, som er skrevet til sundhedspersonale.
For mere information, gå til www.CLARINEX.com
Hvad er ingredienserne i Clarinex 5mg?
Aktiv ingrediens: desloratadin
Patienter med phenylketonuri: CLARINEX RediTabs tabletter indeholder phenylalanin.
Inaktive ingredienser i CLARINEX 5mg tabletter: dibasisk calciumphosphatdihydrat USP, mikrokrystallinsk cellulose NF, majsstivelse NF, talkum USP, carnaubavoks NF, hvid voks NF, coatingmateriale bestående af lactosemonohydrat, hypromellose, titaniumdioxid, polyethylenglycol og FD&C Blue #2 Aluminium Lake.
Inaktive ingredienser i CLARINEX 5mg oral opløsning: propylenglycol USP, sorbitolopløsning USP, citronsyre (vandfri) USP, natriumcitratdihydrat USP, natriumbenzoat NF, dinatriumedetat USP, renset vand USP. Den indeholder også granuleret sukker, naturlig og kunstig smag til tyggegummi og FDC Yellow #6 farvestof.
