Prandin 0.5mg, 1mg, 2mg Repaglinide Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Prandin 2mg, og hvordan bruges det?
Prandin 1mg er en receptpligtig medicin, der bruges til at behandle symptomerne på type 2-diabetes mellitus. Prandin kan bruges alene eller sammen med anden medicin.
Prandin tilhører en klasse af lægemidler kaldet Antidiabetika, Maglitinides Derivater.
Det vides ikke, om Prandin 1mg er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Prandin?
Prandin kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- stærke smerter i din øvre mave breder sig til ryggen,
- kvalme,
- opkastning,
- hurtig puls,
- bleg eller gulnet hud,
- mørk farvet urin,
- feber,
- forvirring,
- svaghed,
- ondt i halsen,
- brændende i dine øjne,
- hudsmerter og
- efterfulgt af et rødt eller lilla hududslæt, der breder sig (især i ansigtet eller overkroppen) og forårsager blærer og afskalning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Prandin omfatter:
- lavt blodsukker,
- kvalme,
- diarré,
- hovedpine,
- rygsmerte,
- ledsmerter, og
- forkølelsessymptomer (tilstoppet næse, nysen, ondt i halsen)
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Prandin. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
PRANDIN (repaglinid) er et oralt blodsukkersænkende lægemiddel af glinidklassen. Repaglinid, S(+)2-ethoxy-4(2((3-methyl-1-(2-(1piperidinyl)phenyl)-butyl)amino)-2-oxoethyl)benzoesyre, er kemisk ikke relateret til oralt sulfonylurinstofinsulin sekretagoger.
Strukturel formel for repaglinid
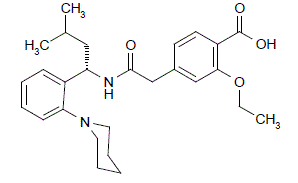
Repaglinid er et hvidt til råhvidt pulver med molekylformel C27H36N2O4 og en molekylvægt på 452,6. PRANDIN tabletter indeholder 0,5 mg, 1 mg eller 2 mg repaglinid. Derudover indeholder hver tablet følgende inaktive ingredienser: calciumhydrogenphosphat (vandfri), mikrokrystallinsk cellulose, majsstivelse, polacrilin-kalium, povidon, glycerol (85%), magnesiumstearat, meglumin og poloxamer. 1 mg og 2 mg tabletterne indeholder jernoxider (henholdsvis gule og røde) som farvestoffer.
INDIKATIONER
PRANDIN er indiceret som et supplement til diæt og motion for at forbedre den glykæmiske kontrol hos voksne med type 2-diabetes mellitus.
Begrænsning af brug
PRANDIN bør ikke anvendes til patienter med type 1-diabetes mellitus eller til behandling af diabetisk ketoacidose.
DOSERING OG ADMINISTRATION
Anbefalet dosering og administration
Den anbefalede startdosis for patienter, hvis HbA1c er mindre end 8 %, er 0,5 mg oralt før hvert måltid. For patienter, hvis HbA1c er 8 % eller højere, er startdosis 1 eller 2 mg oralt før hvert måltid.
Det anbefalede dosisområde er 0,5 mg til 4 mg før måltider, med en maksimal daglig dosis på 16 mg. Patientens dosis bør fordobles op til 4 mg med hvert måltid, indtil tilfredsstillende glykæmisk kontrol er opnået. Der bør gå mindst en uge for at vurdere respons efter hver dosisjustering.
Instruer patienterne i at tage PRANDIN inden for 30 minutter før måltider. PRANDIN 2 mg kan doseres 2, 3 eller 4 gange dagligt som reaktion på ændringer i patientens måltidsmønster.
Hos patienter, der springer måltider over, instruer patienterne i at springe den planlagte dosis af PRANDIN 1 mg over for at reducere risikoen for hypoglykæmi. Hos patienter, som oplever hypoglykæmi, bør dosis af PRANDIN 1 mg reduceres [se ADVARSLER OG FORHOLDSREGLER ].
Patienter med svært nedsat nyrefunktion
Hos patienter med svær nyreinsufficiens (CrCl = 20 til 40 ml/min) initieres PRANDIN 0,5 mg oralt før hvert måltid. Titrér dosis gradvist, hvis det er nødvendigt for at opnå glykæmisk kontrol.
Dosisændringer for lægemiddelinteraktioner
Dosisjustering anbefales til patienter, der samtidig tager stærke CYP3A4- eller CYP2C8-hæmmere eller stærke CYP3A4- eller CYP2C8-inducere [se DRUGSINTERAKTIONER , KLINISK FARMAKOLOGI ].
Samtidig brug med gemfibrozil er kontraindiceret [se KONTRAINDIKATIONER ].
Undgå samtidig brug af PRANDIN 2mg og clopidogrel. Hvis samtidig brug ikke kan undgås, start PRANDIN med 0,5 mg før hvert måltid og overskrid ikke en samlet daglig dosis på 4 mg [se DRUGSINTERAKTIONER , KLINISK FARMAKOLOGI ].
Overskrid ikke en samlet daglig dosis på 6 mg PRANDIN 2 mg hos patienter, der får ciclosporin [se DRUGSINTERAKTIONER , KLINISK FARMAKOLOGI ].
HVORDAN LEVERET
Doseringsformer og styrker
- mg tabletter (gule, runde, bikonvekse tabletter, præget med "745" på den ene side og 'C' på den anden side)
- 2 mg tabletter (lyserøde, runde, bikonvekse tabletter, præget med "747" på den ene side og 'C' på den anden side)
PRANDIN (repaglinid) tabletter, 1 mg , leveres som gule, runde, bikonvekse tabletter, præget med "745" på den ene side og 'C' på den anden side. De er tilgængelige som følger:
100 flasker NDC 60846-882-01
PRANDIN (repaglinid) tabletter, 2 mg , leveres som lyserøde, runde, bikonvekse tabletter, præget med "747" på den ene side og 'C' på den anden side. De er tilgængelige som følger:
100 flasker NDC 60846-884-01
Opbevares ved 20° til 25°C (68° til 77°F) [se USP kontrolleret rumtemperatur]. Beskyt mod fugt. Hold flaskerne tæt lukkede.
Dispenser i tætte beholdere med sikkerhedslukninger.
Distribueret af: Amneal Specialty, en afdeling af Amneal Pharmaceuticals LLC Bridgewater, NJ 08807. Revideret: Mar 2019
BIVIRKNINGER
Følgende alvorlige bivirkning er også beskrevet andetsteds i mærkningen:
Hypoglykæmi [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige designs, kan de bivirkninger, der er rapporteret i et klinisk forsøg, muligvis ikke sammenlignes med de rater, der er rapporteret i et andet klinisk forsøg, og afspejler muligvis ikke de rater, der faktisk observeres i klinisk praksis.
PRANDIN 1mg er blevet administreret til 2931 personer under kliniske forsøg. Cirka 1500 af disse personer med type 2-diabetes er blevet behandlet i mindst 3 måneder, 1000 i mindst 6 måneder og 800 i mindst 1 år. Størstedelen af disse personer (1228) modtog PRANDIN i et af fem 1-årige, aktivt kontrollerede forsøg. I løbet af et år blev 13 % af PRANDIN 1 mg patienterne seponeret på grund af bivirkninger. De mest almindelige bivirkninger, der førte til abstinenser, var hyperglykæmi, hypoglykæmi og relaterede symptomer.
Tabel 1 viser de almindelige bivirkninger for PRANDIN-patienter sammenlignet med placebo i forsøg med en varighed på 12 til 24 uger.
Hypoglykæmi
I kliniske forsøg med PRANDIN 1 mg er hypoglykæmi den hyppigst observerede bivirkning. Mild eller moderat hypoglykæmi forekom hos 31 % af PRANDIN 1 mg behandlede patienter og 7 % af placebobehandlede patienter [se ADVARSLER OG FORHOLDSREGLER ].
Hypoglykæmi blev rapporteret hos 16 % af 1228 PRANDIN-patienter, 20 % af 417 glyburidpatienter og 19 % af 81 glipizidpatienter i 1-års kontrollerede forsøg. Af PRANDIN-behandlede patienter med symptomatisk hypoglykæmi udviklede ingen koma eller krævede hospitalsindlæggelse.
I et 24-ugers placebokontrolleret forsøg havde patienter, der var naive til oral behandling med hypoglykæmi og patienter med en HbA1c under 8 % ved baseline, en højere hyppighed af hypoglykæmi.
Vægtøgning
Der var ingen gennemsnitlig vægtstigning, når patienter, der tidligere var behandlet med orale hypoglykæmiske midler, blev skiftet til PRANDIN. Den gennemsnitlige vægtøgning hos patienter behandlet med PRANDIN 0,5 mg og ikke tidligere behandlet med sulfonylurinstof var 3,3 %.
Kardiovaskulære begivenheder
Incidensen af samlede alvorlige kardiovaskulære bivirkninger, inklusive iskæmi, var højere for PRANDIN (51/1228 eller 4 %) end for sulfonylurinstoflægemidler (13/498 eller 3 %) i kontrollerede kliniske sammenlignende studier.
Syv kontrollerede kliniske forsøg inkluderede PRANDIN kombinationsbehandling med NPH-insulin (n=431), insulinformuleringer alene (n=388) eller andre kombinationer (sulfonylurinstof plus NPH-insulin eller PRANDIN 1mg plus metformin) (n=120). Der var seks alvorlige bivirkninger af myokardieiskæmi hos patienter behandlet med PRANDIN 0,5 mg plus NPH-insulin fra to undersøgelser, og en hændelse hos patienter, der brugte insulinformuleringer alene fra en anden undersøgelse [se ADVARSLER OG FORHOLDSREGLER ].
Kombinationsterapi med thiazolidindioner
Hypoglykæmi
løbet af 24-ugers behandlings kliniske forsøg med PRANDIN-rosiglitazon eller PRANDIN-pioglitazon kombinationsbehandling (i alt 250 patienter i kombinationsbehandling), forekom hypoglykæmi (blodsukker
Perifert ødem og hjertesvigt
Perifert ødem blev rapporteret hos 12 ud af 250 (4,8 %) PRANDIN-thiazolidindion-kombinationsbehandlingspatienter og 3 ud af 124 (2,4 %) thiazolidindion-monoterapipatienter, uden tilfælde rapporteret i disse forsøg for PRANDIN-monoterapi. Der var rapporter hos 2 ud af 250 patienter (0,8%) behandlet med PRANDIN-thiazolidindion-behandling af episoder med ødem med kongestiv hjertesvigt. Begge patienter havde en tidligere koronararteriesygdom i anamnesen og kom sig efter behandling med diuretika. Der blev ikke rapporteret sammenlignelige tilfælde i monoterapibehandlingsgrupperne.
Vægtøgning
Gennemsnitlig vægtstigning forbundet med kombinations-, PRANDIN- og pioglitazonbehandling var henholdsvis 5,5 kg, 0,3 kg og 2,0 kg. Gennemsnitlig vægtstigning forbundet med kombinations-, PRANDIN- og rosiglitazonbehandling var henholdsvis 4,5 kg, 1,3 kg og 3,3 kg.
Sjældne bivirkninger (
Mindre almindelige uønskede kliniske eller laboratoriemæssige hændelser observeret i kliniske forsøg omfattede forhøjede leverenzymer, trombocytopeni, leukopeni og anafylaktoide reaktioner.
Postmarketing oplevelse
Følgende yderligere bivirkninger er blevet identificeret under brug af PRANDIN efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det generelt ikke muligt pålideligt at estimere deres hyppighed eller en årsagssammenhæng til lægemiddeleksponering.
- Alopeci
- Hæmolytisk anæmi
- Pancreatitis
- Stevens-Johnsons syndrom
- Alvorlig leverdysfunktion inklusive gulsot og hepatitis
DRUGSINTERAKTIONER
Klinisk vigtige lægemiddelinteraktioner med PRANDIN
Tabel 3 indeholder en liste over lægemidler med klinisk vigtige lægemiddelinteraktioner, når de administreres samtidig med PRANDIN 1 mg og instruktioner til at forebygge eller håndtere dem.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Hypoglykæmi
Alle glinider, inklusive PRANDIN 0,5 mg, kan forårsage hypoglykæmi [se BIVIRKNINGER ]. Alvorlig hypoglykæmi kan forårsage anfald, kan være livstruende eller forårsage død. Hypoglykæmi kan forringe koncentrationsevnen og reaktionstiden; dette kan sætte en person og andre i fare i situationer, hvor disse evner er vigtige (f.eks. at køre bil eller betjene andre maskiner).
Hypoglykæmi kan opstå pludseligt, og symptomerne kan variere i hvert individ og ændre sig over tid hos det samme individ. Symptomatisk bevidsthed om hypoglykæmi kan være mindre udtalt hos patienter med langvarig diabetes, hos patienter med diabetisk nervesygdom, hos patienter, der bruger medicin, der blokerer det sympatiske nervesystem (f.eks. betablokkere) [se DRUGSINTERAKTIONER ], eller hos patienter, som oplever tilbagevendende hypoglykæmi.
Faktorer, der kan øge risikoen for hypoglykæmi, omfatter ændringer i måltidsmønster (f.eks. indhold af makronæringsstoffer), ændringer i fysisk aktivitetsniveau, ændringer i samtidig administreret medicin [se DRUGSINTERAKTIONER ], og samtidig brug med andre antidiabetika. Patienter med nedsat nyre- eller leverfunktion kan have højere risiko for hypoglykæmi [se Brug i specifikke populationer ].
Patienter skal administrere PRANDIN 0,5 mg før måltider og instrueres i at springe PRANDIN-dosis over, hvis et måltid springes over. Hos patienter, som oplever hypoglykæmi, bør dosis af PRANDIN reduceres [se DOSERING OG ADMINISTRATION ]. Patienter og plejere skal uddannes til at genkende og håndtere hypoglykæmi. Selvkontrol af blodsukker spiller en væsentlig rolle i forebyggelsen og behandlingen af hypoglykæmi. Hos patienter med højere risiko for hypoglykæmi og patienter, som har nedsat symptomatisk bevidsthed om hypoglykæmi, anbefales øget frekvens af blodsukkerovervågning.
Alvorlige kardiovaskulære bivirkninger ved samtidig brug med NPH-insulin
På tværs af syv kontrollerede undersøgelser var der seks alvorlige bivirkninger af myokardieiskæmi hos patienter behandlet med PRANDIN 0,5 mg plus NPH-insulin fra to undersøgelser, og en hændelse hos patienter, der brugte insulinformuleringer alene fra en anden undersøgelse [se BIVIRKNINGER ]. PRANDIN er ikke indiceret til brug i kombination med NPH-insulin.
Makrovaskulære resultater
Der har ikke været nogen kliniske undersøgelser, der påviser endegyldige beviser for makrovaskulær risikoreduktion med PRANDIN.

Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
et 104-ugers karcinogenicitetsstudie med rotter i doser op til 120 mg/kg/dag, hvilket er ca. 60 gange den kliniske eksponering på mg/m2-basis, var forekomsten af benigne adenomer i skjoldbruskkirtlen og leveren øget hos hanrotter. Der blev ikke fundet tegn på carcinogenicitet hos hunrotter. Den højere forekomst af skjoldbruskkirtel- og levertumorer hos hanrotter blev ikke set ved en lavere dosis på henholdsvis 30 mg/kg/dag og 60 mg/kg/dag (som er over henholdsvis 15 og 30 gange klinisk eksponering på en mg/m2 basis). I et 104-ugers carcinogenicitetsstudie med mus i doser op til 500 mg/kg/dag blev der ikke fundet tegn på carcinogenicitet hos mus (hvilket er ca. 125 gange den kliniske eksponering på mg/m2-basis).
Repaglinid var ikke-gentoksisk i en række in vivo- og in vitro-undersøgelser: bakteriel mutagenese (Ames-test), in vitro fremad cellemutationsanalyse i V79-celler (HGPRT), in vitro kromosomafvigelsesanalyse i humane lymfocytter, uplanlagt og replikerende DNA-syntese i rottelever og in vivo mikronukleustests hos mus og rotter.
I et fertilitetsstudie med rotter blev repaglinid givet til han- og hunrotter i doser på henholdsvis 300 og 80 mg/kg/dag. Der blev ikke observeret nogen bivirkninger på fertiliteten (som er over 40 gange den kliniske eksponering på mg/m2-basis).
Brug i specifikke populationer
Graviditet
Risikooversigt
Begrænsede data med brug af PRANDIN og repaglinid hos gravide kvinder er utilstrækkelige til at informere om en lægemiddelrelateret risiko for alvorlige fødselsdefekter eller abort. Der er risici for moderen og fosteret forbundet med dårligt kontrolleret diabetes under graviditeten [se Kliniske overvejelser ].
Repaglidin har vist sig ikke at være teratogent i dyreforsøg (rotter og kaniner). Embryotoksicitet, unormal udvikling af lemmer hos rottefoster blev observeret hos hunrotter, der blev udsat for høje doser i det sidste stadium af graviditeten.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter er 6 % til 10 % hos kvinder med præ-gestationel diabetes med en HbA1c >7 og er blevet rapporteret at være så høj som 20 % til 25 % hos kvinder med en HbA1c >10. Den estimerede baggrundsrisiko for abort for den angivne population er ukendt. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske overvejelser
Sygdomsrelateret risiko for moder og/eller embryo/føtal
Dårligt kontrolleret diabetes under graviditet øger moderens risiko for diabetisk ketoacidose, præeklampsi, spontane aborter, præmatur fødsel, dødfødsel og fødselskomplikationer. Dårligt kontrolleret diabetes øger fosterets risiko for større fødselsdefekter, dødfødsel og makrosomi-relateret sygelighed.
Data
Menneskelige data
Der er ikke tilstrækkelige data om udviklingsrisici forbundet med brug af PRANDIN 2mg hos gravide kvinder.
Dyredata
Repaglinid var ikke teratogent hos rotter eller kaniner ved doser 40 gange (rotter) og ca. 0,8 gange (kanin) klinisk eksponering (på mg/m2-basis) gennem hele graviditeten. Afkom af rottemødre, der blev udsat for repaglinid ved 15 gange klinisk eksponering på mg/m2-basis i løbet af dag 17 til 22 af drægtighed og under diegivning, udviklede ikke-teratogene skeletdeformiteter bestående af forkortning, fortykkelse og bøjning af humerus i den postnatale periode. Denne effekt sås ikke ved doser op til 2,5 gange den kliniske eksponering (på mg/m2-basis) på dag 1 til 22 af graviditeten eller ved højere doser givet på dag 1 til 16 af graviditeten.
Amning
Risikooversigt
Der er ingen information om tilstedeværelsen af PRANDIN 0,5 mg i modermælk, virkningerne på det ammende spædbarn eller virkningerne på mælkeproduktionen. Repaglinid blev påvist i rottemælk, men på grund af artsspecifikke forskelle i laktationsfysiologi kan dyredata muligvis ikke pålideligt forudsige lægemiddelniveauer i human mælk. Udviklingen og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for PRANDIN og eventuelle negative virkninger på det ammede spædbarn fra PRANDIN eller fra underliggende moderens tilstand.
Kliniske overvejelser
Selvom det ikke vides, om repaglinid udskilles i modermælk, er nogle orale midler kendt for at blive udskilt ad denne vej. Fordi der kan være mulighed for hypoglykæmi hos ammende spædbørn, og på grund af virkningerne på diende dyr, bør der tages stilling til, om PRANDIN skal seponeres hos ammende mødre, eller om mødre skal ophøre med amningen. Hvis PRANDIN seponeres, og hvis diæt alene er utilstrækkelig til at kontrollere blodsukkeret, bør insulinbehandling overvejes.
Data
I undersøgelser af reproduktion af rotter blev målbare niveauer af repaglinid påvist i modermælken hos moderdyrene, og der blev observeret nedsatte blodsukkerniveauer hos ungerne. Krydsfostringsundersøgelser indikerede, at skeletforandringer [se Graviditet ] kunne induceres i kontrolunger, der blev ammet af behandlede moderdyr, selvom dette skete i mindre grad end de unger, der blev behandlet in utero.
Pædiatrisk brug
Sikkerhed og effektivitet er ikke blevet fastslået hos pædiatriske patienter.
Geriatrisk brug
kliniske undersøgelser af 24 uger eller længere varighed var 415 patienter over 65 år, og ingen patienter var ældre end 75 år. I et-årige, aktivt kontrollerede forsøg blev der ikke set forskelle i effektivitet eller bivirkninger mellem disse forsøgspersoner og dem under 65. Der var ingen stigning i hyppigheden eller sværhedsgraden af hypoglykæmi hos ældre forsøgspersoner, men større følsomhed hos nogle ældre personer over for PRANDIN 0,5 mg-behandling kan ikke udelukkes.
Nedsat nyrefunktion
Farmakokinetiske undersøgelser af repaglinid blev udført hos patienter med let til moderat nedsat nyrefunktion (CrCl = 40 til 80 ml/min) og svært nedsat nyrefunktion (CrCl = 20 til 40 ml/min). Initial dosisjustering er ikke nødvendig hos patienter med mild til moderat nyreinsufficiens. Patienter med svært nedsat nyrefunktion bør dog påbegynde PRANDIN-behandling med 0,5 mg dosis og omhyggeligt titreres [se DOSERING OG ADMINISTRATION ].
Der blev ikke udført undersøgelser med patienter med kreatininclearance under 20 ml/min eller patienter med nyresvigt, der kræver hæmodialyse.
Nedsat leverfunktion
En enkeltdosis undersøgelse blev udført med 12 patienter med kronisk leversygdom. Patienter med moderat til svær nedsat leverfunktion havde højere og længerevarende serumkoncentrationer. Derfor bør PRANDIN 0,5 mg anvendes med forsigtighed til patienter med nedsat leverfunktion. Længere intervaller mellem dosisjusteringer kan være nødvendige for at muliggøre fuld vurdering af respons.
OVERDOSIS
Alvorlige hypoglykæmiske reaktioner med koma, anfald eller anden neurologisk svækkelse kan forekomme og udgøre medicinske nødsituationer, der kræver øjeblikkelig hospitalsindlæggelse. Hypoglykæmiske symptomer uden tab af bevidsthed eller neurologiske fund bør behandles aggressivt med oral glukose og justeringer i lægemiddeldosering og/eller måltidsmønstre. Tæt overvågning kan fortsætte, indtil lægen er sikker på, at patienten er uden for fare. Patienter bør overvåges nøje i mindst 24 til 48 timer, da hypoglykæmi kan opstå igen efter tilsyneladende klinisk bedring. Der er ingen evidens for, at PRANDIN kan dialyseres ved hjælp af hæmodialyse.
KONTRAINDIKATIONER
PRANDIN er kontraindiceret til patienter med:
- Samtidig brug af gemfibrozil [se DRUGSINTERAKTIONER ]
- Kendt overfølsomhed over for repaglinid eller andre inaktive ingredienser
KLINISK FARMAKOLOGI
Handlingsmekanisme
Repaglinid sænker blodsukkerniveauet ved at stimulere frigivelsen af insulin fra bugspytkirtlen. Denne handling er afhængig af fungerende beta (ß) celler i bugspytkirtlens øer. Insulinfrigivelsen er glukoseafhængig og aftager ved lave glukosekoncentrationer.
Repaglinid lukker ATP-afhængige kaliumkanaler i ß-cellemembranen ved at binde på karakteriserbare steder. Denne kaliumkanalblokade depolariserer ß-cellen, hvilket fører til en åbning af calciumkanaler. Den resulterende øgede calciumtilstrømning inducerer insulinsekretion. Ionkanalmekanismen er meget vævsselektiv med lav affinitet til hjerte- og skeletmuskulatur.
Farmakodynamik
Et fire-ugers, dobbeltblindt, placebo-kontrolleret dosis-respons-forsøg blev udført med 138 patienter med type 2-diabetes med doser fra 0,25 (ikke en godkendt dosis) til 4 mg taget med hvert af tre måltider. PRANDIN-behandling resulterede i dosis-proportional glukosesænkning over hele dosisområdet. Plasmainsulinniveauer steg efter måltider og vendte tilbage mod baseline før næste måltid. Det meste af den fastende blodsukkersænkende effekt blev påvist inden for 1 til 2 uger.
et dobbeltblindt, placebo-kontrolleret, 3-måneders dosistitreringsstudie blev PRANDIN 0,5 mg eller placebo doser for hver patient øget ugentligt fra 0,25 mg (ikke en godkendt dosis) gennem 0,5, 1 og 2 mg til et maksimum på 4 mg, indtil et fastende plasmaglucoseniveau (FPG)
Doseringen af PRANDIN 0,5 mg i forhold til måltidsrelateret insulinfrigivelse blev undersøgt i tre forsøg med 58 patienter. Glykæmisk kontrol blev opretholdt i en periode, hvor måltidet og doseringsmønsteret var varieret (2, 3 eller 4 måltider om dagen; før måltider x 2, 3 eller 4) sammenlignet med en periode på 3 almindelige måltider og 3 doser om dagen ( før måltider x 3). Den blodsukkersænkende effekt afveg ikke, når PRANDIN 0,5 mg blev administreret i starten af et måltid, 15 minutter før eller 30 minutter før måltidet.
Farmakokinetik
De farmakokinetiske parametre for repaglinid opnået fra en enkeltdosis, crossover-undersøgelse i raske forsøgspersoner og fra en multiple-dosis, parallel, dosisproportionalitetsundersøgelse (0,5, 1, 2 og 4 mg) hos patienter med type 2-diabetes er opsummeret i tabeller 5 og 6. Disse data indikerer, at repaglinid ikke akkumuleredes i serum. Clearance af oral repaglinid ændrede sig ikke over dosisområdet på 0,5 til 4 mg, hvilket indikerer en lineær sammenhæng mellem dosis og plasmaniveauer af lægemiddel.
Absorption
Efter oral administration absorberes repaglinid fuldstændigt fra mave-tarmkanalen. Efter enkelte og multiple orale doser til raske forsøgspersoner eller hos patienter optræder maksimale plasmalægemiddelniveauer (Cmax) inden for 1 time (Tmax). Repaglinid elimineres fra blodbanen med en halveringstid på ca. 1 time. Den gennemsnitlige absolutte biotilgængelighed er 56%. Når repaglinid blev givet sammen med mad, blev den gennemsnitlige Tmax ikke ændret, men den gennemsnitlige Cmax og AUC (areal under tids-/plasmakoncentrationskurven) blev reduceret med henholdsvis 20 % og 12,4 %.
Fordeling
Efter intravenøs (IV) dosering til raske forsøgspersoner var distributionsvolumenet ved steady-state (Vss) 31 l, og den totale kropsclearance (CL) var 38 l/time. Proteinbinding og binding til humant serumalbumin var større end 98%.
Metabolisme og eliminering
Repaglinid metaboliseres fuldstændigt ved oxidativ biotransformation og direkte konjugering med glucuronsyre efter enten en IV eller oral dosis. De vigtigste metabolitter er en oxideret dicarboxylsyre (M2), den aromatiske amin (M1) og acylglucuronid (M7). Cytokrom P-450 enzymsystemet, specifikt 2C8 og 3A4, har vist sig at være involveret i N-dealkyleringen af repaglinid til M2 og den yderligere oxidation til M1. Metabolitter bidrager ikke til den glukosesænkende effekt af repaglinid. Inden for 96 timer efter dosering med 14C-repaglinid som en enkelt oral dosis blev ca. 90 % af radiomærket genfundet i fæces og ca. 8 % i urinen. Kun 0,1 % af dosis udskilles i urinen som moderstof. Hovedmetabolitten (M2) udgjorde 60 % af den administrerede dosis. Mindre end 2% af moderlægemidlet blev genfundet i fæces. Repaglinid ser ud til at være et substrat for aktiv hepatisk optagelsestransportør (organisk aniontransporterende protein OATP1B1).
Variabilitet af eksponering
Repaglinid AUC efter flere doser på 0,25 til 4 mg med hvert måltid varierer over et bredt område. De intra-individuelle og interindividuelle variationskoefficienter var henholdsvis 36 % og 69 %. AUC over det terapeutiske dosisinterval inkluderede 69 til 1005 ng/ml*time, men AUC-eksponering op til 5417 ng/ml*time blev nået i dosiseskaleringsstudier uden tilsyneladende negative konsekvenser.
Specifikke populationer
Geriatrisk
Raske frivillige blev behandlet med et regime på 2 mg PRANDIN 0,5 mg taget før hvert af 3 måltider. Der var ingen signifikante forskelle i repaglinids farmakokinetik mellem gruppen af patienter Brug i specifikke populationer ].
Køn
En sammenligning af farmakokinetik hos mænd og kvinder viste, at AUC over dosisområdet 0,5 mg til 4 mg var 15 % til 70 % højere hos kvinder med type 2-diabetes. Denne forskel afspejles ikke i hyppigheden af hypoglykæmiske episoder (mænd: 16 %; kvinder: 17 %) eller andre bivirkninger.
Race
Der er ikke udført farmakokinetiske undersøgelser til at vurdere virkningerne af race, men i et amerikansk 1-årigt studie med patienter med type 2-diabetes var den blodsukkersænkende effekt sammenlignelig mellem kaukasiere (n=297) og afroamerikanere (n= 33). I et amerikansk dosis-respons-studie var der ingen tydelig forskel i eksponering (AUC) mellem kaukasiere (n=74) og latinamerikanere (n=33).
Nedsat nyrefunktion
Enkeltdosis og steady-state farmakokinetik af repaglinid blev sammenlignet mellem patienter med type 2-diabetes og normal nyrefunktion (CrCl > 80 ml/min), let til moderat nedsat nyrefunktion (CrCl = 40 til 80 ml/min) og alvorligt nedsat nyrefunktion. nedsat nyrefunktion (CrCl = 20 til 40 ml/min). Både AUC og Cmax for repaglinid var ens hos patienter med normal og let til moderat nedsat nyrefunktion (gennemsnitsværdier henholdsvis 56,7 ng/mL*time vs 57,2 ng/mL*time og 37,5 ng/mL vs 37,7 ng/mL). med stærkt nedsat nyrefunktion havde forhøjede gennemsnitlige AUC- og Cmax-værdier (henholdsvis 98,0 ng/ml*time og 50,7 ng/ml), men denne undersøgelse viste kun en svag sammenhæng mellem repaglinidniveauer og kreatininclearance.
Nedsat leverfunktion
Et enkelt-dosis, åbent studie blev udført med 12 raske forsøgspersoner og 12 patienter med kronisk leversygdom (CLD) klassificeret efter Child-Pugh skala og koffeinclearance. Patienter med moderat til alvorlig svækkelse af leverfunktionen havde højere og længerevarende serumkoncentrationer af både totalt og ubundet repaglinid end raske forsøgspersoner (AUChealthy: 91,6 ng/ml*time; AUCCLD-patienter: 368,9 ng/ml*time; Cmax, raske: 46,7 ng/ml; Cmax, CLD-patienter: 105,4 ng/ml). AUC var statistisk korreleret med koffeinclearance. Der blev ikke observeret nogen forskel i glukoseprofiler på tværs af patientgrupper.
Lægemiddel-lægemiddelinteraktioner
Lægemiddelinteraktionsundersøgelser udført hos raske frivillige viser, at PRANDIN 0,5 mg ikke havde nogen klinisk relevant effekt på de farmakokinetiske egenskaber af digoxin, theophyllin eller warfarin. Samtidig administration af cimetidin og PRANDIN 1 mg ændrede ikke signifikant absorptionen og disponeringen af repaglinid.
Derudover blev følgende lægemidler undersøgt hos raske frivillige med samtidig administration af PRANDIN.
Kliniske Studier
Monoterapi forsøg
Et dobbeltblindt, placebokontrolleret forsøg blev udført med 362 patienter behandlet i 24 uger. HbA1c for de PRANDIN-behandlede grupper (1 og 4 mg-grupper kombineret) ved afslutningen af undersøgelsen var reduceret sammenlignet med den placebo-behandlede gruppe hos behandlingsnaive patienter og hos patienter, der tidligere var behandlet med orale hypoglykæmiske midler, med 2,1 % og 1,7 %. henholdsvis. I dette forsøg med faste doser viste patienter, som var behandlingsnaive over for oral hypoglykæmisk behandling, og patienter med en HbA1c under 8 % ved baseline en større blodsukkersænkning.
Kombinationsforsøg
PRANDIN i kombination med metformin
PRANDIN blev undersøgt i kombination med metformin hos 83 patienter, der ikke var tilfredsstillende kontrolleret på motion, diæt og metformin alene. PRANDIN 2 mg dosis blev titreret i 4 til 8 uger efterfulgt af en 3-måneders vedligeholdelsesperiode. Kombinationsbehandling med PRANDIN 1 mg og metformin resulterede i statistisk signifikant forbedring af HbA1c og fastende plasmaglukose (FPG) sammenlignet med PRANDIN 2 mg eller metformin monoterapi (tabel 8). I denne undersøgelse, hvor metformindosis blev holdt konstant, viste kombinationsbehandlingen af PRANDIN og metformin dosisbesparende virkninger med hensyn til PRANDIN. Forbedringen i HbA1c og FPG i kombinationsgruppen blev opnået ved en lavere daglig PRANDIN 0,5 mg dosis end i PRANDIN monoterapigruppen (tabel 8).
PRANDIN 1mg i kombination med pioglitazon
Et kombinationsbehandlingsregime med PRANDIN og pioglitazon (N=123) blev sammenlignet med PRANDIN alene (N=61) og pioglitazon alene (N=62) i et 24-ugers forsøg, der inkluderede 246 patienter tidligere behandlet med sulfonylurinstof eller metformin monoterapi (HbA1c) > 7,0 %). PRANDIN 1 mg dosis blev titreret i løbet af de første 12 uger, efterfulgt af en 12-ugers vedligeholdelsesperiode. Kombinationsterapi resulterede i statistisk signifikant forbedring i HbA1c og FPG sammenlignet med monoterapi (figur 1). Ændringerne fra baseline for fuldførere i henholdsvis FPG (mg/dL) og HbA1c (%) var: -39,8 mg/dL og -0,1% for PRANDIN, -35,3 mg/dL og -0,1% for pioglitazon og -92,4 mg/ dL og -1,9 % for kombinationen. I denne undersøgelse, hvor pioglitazon-dosis blev holdt konstant, viste kombinationsterapigruppen dosisbesparende effekter med hensyn til PRANDIN (se figur 1-forklaring). Forbedringen i HbA1c og FPG i kombinationsgruppen blev opnået ved en lavere daglig PRANDIN-dosis end i PRANDIN monoterapigruppen.
Figur 1: PRANDIN i kombination med pioglitazon: HbA1c-værdier
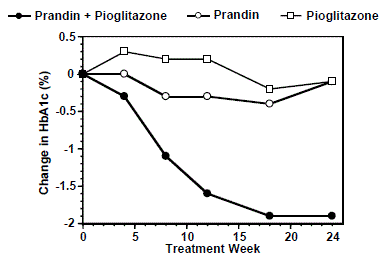
LEGENDE
HbA1c-værdier efter undersøgelsesuge for patienter, der fuldførte undersøgelsen (kombination, N = 101; PRANDIN 1 mg, N = 35, pioglitazon, N = 26). Forsøgspersoner med FPG over 270 mg/dL blev trukket tilbage fra undersøgelsen.
Pioglitazon dosis: fastsat til 30 mg/dag; PRANDIN 1 mg median slutdosis: 6 mg/dag for kombination og 10 mg/dag for monoterapi.
PRANDIN i kombination med rosiglitazon
Et kombinationsbehandlingsregime med PRANDIN og rosiglitazon blev sammenlignet med monoterapi med begge midler alene i et 24-ugers forsøg, der inkluderede 252 patienter tidligere behandlet med sulfonylurinstof eller metformin (HbA1c > 7,0 %). Kombinationsterapi resulterede i statistisk signifikant forbedring i HbA1c og FPG sammenlignet med monoterapi (tabel 9 nedenfor). De glykæmiske virkninger af kombinationsbehandlingen var dosisbesparende med hensyn til både total daglig PRANDIN 1 mg-dosis og total daglig rosiglitazon-dosis (se Tabel 9 Legend). Forbedringen i HbA1c og FPG i kombinationsterapigruppen blev opnået med en lavere daglig dosis af PRANDIN 1 mg og rosiglitazon sammenlignet med de respektive monoterapigrupper.
PATIENTOPLYSNINGER
Hypoglykæmi
Informer patienterne om, at PRANDIN 2mg kan forårsage hypoglykæmi, og instruer patienterne og deres pårørende om selvstyringsprocedurer, herunder glukosemonitorering og håndtering af hypoglykæmi. Informer patienterne om, at deres evne til at koncentrere sig og reagere kan blive svækket som følge af hypoglykæmi. Hos patienter med højere risiko for hypoglykæmi og patienter, som har nedsat symptomatisk bevidsthed om hypoglykæmi, anbefales øget frekvens af blodsukkerovervågning [se ADVARSLER OG FORHOLDSREGLER ].
Administration
Instruer patienterne i at tage PRANDIN 0,5 mg inden for 30 minutter før måltider. Instruer patienterne i at springe deres dosis af PRANDIN over, når et måltid springes over [se DOSERING OG ADMINISTRATION ].
Lægemiddelinteraktioner
Diskuter potentielle lægemiddelinteraktioner med patienter og informer dem om potentielle lægemiddelinteraktioner med PRANDIN [se DRUGSINTERAKTIONER ].
