Actos 15mg, 30mg Pioglitazone Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Actos, og hvordan bruges det?
Actos 15mg er en receptpligtig medicin, der bruges til at behandle symptomerne på type 2-diabetes mellitus. Actos kan bruges alene eller sammen med anden medicin.
Actos er et antidiabetisk, thiazolidindion-lægemiddel.
Det vides ikke, om Actos 15mg er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Actos 15mg?
Actos kan forårsage alvorlige bivirkninger, herunder:
- åndenød (især når du ligger ned),
- usædvanlig træthed,
- hævelse,
- hurtig vægtøgning,
- lyserød eller rød urin,
- smertefuld eller vanskelig vandladning,
- ny eller forværret vandladningstrang,
- synsforandringer, og
- pludselige, usædvanlige smerter i din hånd, arm eller fod
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Actos omfatter:
- hovedpine,
- muskelsmerter og
- forkølelsessymptomer (tilstoppet næse, bihulesmerter, nysen, ondt i halsen)
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
Disse er ikke alle de mulige bivirkninger af Actos. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
KONGESTIV HJERTESVILLE
- Thiazolidindioner, inklusive ACTOS 15mg, forårsager eller forværrer kongestiv hjertesvigt hos nogle patienter [se ADVARSLER OG FORHOLDSREGLER ].
- Efter påbegyndelse af ACTOS 30 mg og efter dosisstigninger skal patienterne overvåges omhyggeligt for tegn og symptomer på hjertesvigt (f.eks. overdreven, hurtig vægtøgning, dyspnø og/eller ødem). Hvis der udvikles hjertesvigt, skal det behandles i overensstemmelse med gældende standarder for pleje, og seponering eller dosisreduktion af ACTOS 15 mg skal overvejes.
- ACTOS anbefales ikke til patienter med symptomatisk hjertesvigt.
- Påbegyndelse af ACTOS hos patienter med etableret New York Heart Association (NYHA) klasse III eller IV hjertesvigt er kontraindiceret [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
BESKRIVELSE
ACTOS-tabletter er en thiazolidindion og en agonist for peroxisomproliferator-aktiveret receptor (PPAR) gamma, der indeholder en oral antidiabetisk medicin: pioglitazon.
Pioglitazon [(±)-5-[[4-[2-(5-ethyl-2-pyridinyl)ethoxy]phenyl]methyl]-2,4-]thiazolidindionmonohydrochlorid indeholder et asymmetrisk kulstof, og forbindelsen syntetiseres og anvendes som den racemiske blanding. De to enantiomerer af pioglitazon omdannes indbyrdes in vivo. Der blev ikke fundet forskelle i den farmakologiske aktivitet mellem de to enantiomerer. Strukturformlen er som vist:
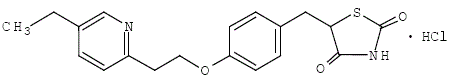
Pioglitazonhydrochlorid er et lugtfrit hvidt krystallinsk pulver, der har en molekylformel på C19H20N2O3S•HCl og en molekylvægt på 392,90 dalton. Det er opløseligt i N,Ndimethylformamid, lidt opløseligt i vandfri ethanol, meget lidt opløseligt i acetone og acetonitril, praktisk talt uopløseligt i vand og uopløseligt i ether.
ACTOS er tilgængelig som en tablet til oral administration indeholdende 15 mg, 30 mg eller 45 mg pioglitazon (som base) formuleret med følgende hjælpestoffer: lactos 30mge monohydrat NF, hydroxypropylcellulose NF, carboxymethylcellulose calcium NF og magnesiumstearat NF.
INDIKATIONER
Monoterapi og kombinationsterapi
ACTOS 30mg er indiceret som et supplement til diæt og motion for at forbedre den glykæmiske kontrol hos voksne med type 2-diabetes mellitus i flere kliniske omgivelser [se Kliniske Studier ].
Vigtige brugsbegrænsninger
ACTOS 15mg udøver kun sin antihyperglykæmiske virkning i nærværelse af endogen insulin. ACTOS 30mg bør ikke bruges til at behandle type 1-diabetes eller diabetisk ketoacidose, da det ikke ville være effektivt i disse indstillinger.
Vær forsigtig hos patienter med leversygdom [se ADVARSLER OG FORHOLDSREGLER ].
DOSERING OG ADMINISTRATION
Anbefalinger til alle patienter
ACTOS 15 mg bør tages én gang dagligt og kan tages uden hensyntagen til måltider.
Den anbefalede startdosis for patienter uden kongestiv hjerteinsufficiens er 15 mg eller 30 mg én gang dagligt.
Den anbefalede startdosis til patienter med kongestiv hjerteinsufficiens (NYHA klasse I eller II) er 15 mg én gang dagligt.
Dosis kan titreres i trin på 15 mg op til et maksimum på 45 mg én gang dagligt baseret på glykæmisk respons som bestemt af HbA1c.
Efter påbegyndelse af ACTOS 30 mg eller med dosisforøgelse skal patienterne overvåges omhyggeligt for bivirkninger relateret til væskeretention såsom vægtøgning, ødem og tegn og symptomer på kongestiv hjertesvigt [se KASSE ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
Leverprøver (serumalanin og aspartataminotransferaser, alkalisk phosphatase og total bilirubin) bør udføres før påbegyndelse af ACTOS. Rutinemæssig periodisk monitorering af leverprøver under behandling med ACTOS 30 mg anbefales ikke til patienter uden leversygdom. Patienter, der har abnorme leverprøver før påbegyndelse af ACTOS, eller som viser sig at have unormale leverprøver, mens de tager ACTOS, skal behandles som beskrevet under Advarsler og forholdsregler [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Samtidig brug med en insulinsekretagog eller insulin
Hvis der opstår hypoglykæmi hos en patient, der administreres samtidigt med ACTOS 30 mg og en insulinsekretagog (f.eks. sulfonylurinstof), skal dosis af insulinsekretagogen reduceres.
Hvis der opstår hypoglykæmi hos en patient, der samtidig administreres ACTOS 30 mg og insulin, skal insulindosis reduceres med 10 % til 25 %. Yderligere justeringer af insulindosis bør individualiseres baseret på glykæmisk respons.
Samtidig brug med stærke CYP2C8-hæmmere
Samtidig administration af ACTOS 30 mg og gemfibrozil, en stærk CYP2C8-hæmmer, øger pioglitazoneksponeringen ca. 3 gange. Derfor er den maksimalt anbefalede dosis af ACTOS 15 mg dagligt, når det bruges i kombination med gemfibrozil eller andre stærke CYP2C8-hæmmere [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
HVORDAN LEVERET
Doseringsformer og styrker
Rund tablet indeholder pioglitazon som følger:
- 15 mg: Hvid til råhvid, præget med "ACTOS" på den ene side og "15" på den anden side
- 30 mg: Hvid til råhvid, præget med "ACTOS" på den ene side og "30" på den anden side
- 45 mg: Hvid til råhvid, præget med "ACTOS" på den ene side og "45" på den anden side
Opbevaring og håndtering
ACTOS er tilgængelig i 15 mg, 30 mg og 45 mg tabletter som følger:
15 mg tablet : Hvid til råhvid, rund, konveks tablet uden delekærv med "ACTOS" på den ene side og "15" på den anden, tilgængelig i:
NDC 64764-151-04 Flasker á 30 stk NDC 64764-151-05 Flasker á 90 stk NDC 64764-151-06 Flasker á 500 stk
30 mg tablet Hvid til råhvid, rund, flad tablet uden delekærv med "ACTOS" på den ene side og "30" på den anden, tilgængelig i:
NDC 64764-301-14 flasker med 30 stk NDC 64764-301-15 flasker med 90 stk NDC 64764-301-16 Flasker á 500 stk
45 mg tablet : Hvid til råhvid, rund, flad tablet uden delekærv med "ACTOS" på den ene side og "45" på den anden, tilgængelig i:
NDC 64764-451-24 flasker med 30 stk NDC 64764-451-25 flasker med 90 stk NDC 64764-451-26 Flasker á 500 stk
Opbevaring
Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F) [se USP kontrolleret rumtemperatur]. Hold beholderen tæt lukket og beskyt mod lys, fugt og fugt.
Distribueret af: Takeda Pharmaceuticals America, Inc. Deerfield, IL 60015. Revideret: Dec 2017
BIVIRKNINGER
Følgende alvorlige bivirkninger er omtalt andetsteds i mærkningen:
- Kongestiv hjertesvigt [se KASSE ADVARSEL og ADVARSLER OG FORHOLDSREGLER ]
- Ødem [se ADVARSLER OG FORHOLDSREGLER ]
- Brud [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Over 8500 patienter med type 2-diabetes er blevet behandlet med ACTOS i randomiserede, dobbeltblindede, kontrollerede kliniske forsøg, herunder 2605 patienter med type 2-diabetes og makrovaskulær sygdom behandlet med ACTOS 30 mg i det kliniske PROactive-studie. I disse forsøg er over 6000 patienter blevet behandlet med ACTOS i seks måneder eller længere, over 4500 patienter er blevet behandlet med ACTOS 15 mg i et år eller længere, og over 3000 patienter er blevet behandlet med ACTOS i mindst to år.
seks poolede 16- til 26-ugers placebokontrollerede monoterapi- og 16- til 24-ugers supplerende kombinationsbehandlingsforsøg var forekomsten af seponeringer på grund af bivirkninger 4,5 % for patienter behandlet med ACTOS 30 mg og 5,8 % for komparator- behandlede patienter. De mest almindelige bivirkninger, der førte til seponering, var relateret til utilstrækkelig glykæmisk kontrol, selvom forekomsten af disse hændelser var lavere (1,5 %) med ACTOS 30 mg end med placebo (3,0 %).
I PROactive-studiet var forekomsten af seponeringer på grund af bivirkninger 9,0 % for patienter behandlet med ACTOS 30 mg og 7,7 % for placebobehandlede patienter. Kongestiv hjerteinsufficiens var den mest almindelige alvorlige bivirkning, der førte til abstinenser hos 1,3 % af patienterne behandlet med ACTOS 30 mg og 0,6 % af patienterne behandlet med placebo.
Almindelige bivirkninger: 16-til 26-ugers monoterapiforsøg
En oversigt over forekomsten og typen af almindelige bivirkninger rapporteret i tre poolede 16- til 26-ugers placebokontrollerede monoterapiforsøg med ACTOS er angivet i tabel 1. Termer, der er rapporteret, repræsenterer dem, der opstod med en incidens på >5 % og mere almindeligt hos patienter behandlet med ACTOS 15 mg end hos patienter, der fik placebo. Ingen af disse bivirkninger var relateret til ACTOS-dosis.
Almindelige uønskede hændelser: 16-til 24-ugers tilføjelseskombinationsterapiforsøg
Et resumé af den overordnede forekomst og typer af almindelige bivirkninger rapporteret i forsøg med ACTOS add-on til sulfonylurinstof findes i tabel 2. De rapporterede udtryk repræsenterer dem, der opstod med en forekomst på >5 % og mere almindeligt med de højest testede dosis af ACTOS.
Et resumé af den overordnede forekomst og typer af almindelige bivirkninger rapporteret i forsøg med ACTOS 30 mg tilføjelse til metformin findes i tabel 3. Begreber, der er rapporteret, repræsenterer dem, der opstod med en forekomst på >5 % og mere almindeligt med den højeste testet dosis af ACTOS.
Tabel 4 opsummerer forekomsten og typerne af almindelige bivirkninger rapporteret i forsøg med ACTOS-tillæg til insulin. Termer, der er rapporteret, repræsenterer dem, der forekom med en incidens på >5 % og mere almindeligt med den højeste testede dosis af ACTOS.
En oversigt over den overordnede forekomst og typer af almindelige uønskede hændelser rapporteret i PROactive-studiet findes i tabel 5. De rapporterede udtryk repræsenterer dem, der forekom med en incidens på >5 % og mere almindeligt hos patienter behandlet med ACTOS end hos patienter, som fik placebo.
Kongestiv hjertesvigt
En oversigt over forekomsten af uønskede hændelser relateret til kongestiv hjertesvigt er angivet i tabel 6 for 16- til 24-ugers tilføjelse til sulfonylurinstof-forsøg, for 16- til 24-ugers tilføjelse til insulinundersøgelser og for 16- til 24-ugers tilføjelse til metforminforsøg. Ingen af begivenhederne var fatale.
Patienter med type 2 diabetes og NYHA klasse II eller tidlig klasse III kongestiv hjerteinsufficiens blev randomiseret til at modtage 24 ugers dobbeltblind behandling med enten ACTOS 30 mg i daglige doser på 30 mg til 45 mg (n=262) eller glyburid i daglige doser på 10 mg til 15 mg (n=256). En oversigt over forekomsten af uønskede hændelser relateret til kongestivt hjertesvigt rapporteret i denne undersøgelse findes i tabel 7.
Kongestive hjertesvigthændelser, der førte til hospitalsindlæggelse, som fandt sted under PROactive-forsøget, er opsummeret i tabel 8.
Kardiovaskulær sikkerhed
PROactive-studiet blev 5238 patienter med type 2-diabetes og en historie med makrovaskulær sygdom randomiseret til ACTOS (N=2605), tvangstitreret op til 45 mg dagligt eller placebo (N=2633) ud over standardbehandling. Næsten alle patienter (95%) fik kardiovaskulær medicin (betablokkere, ACE-hæmmere, angiotensin II-receptorblokkere, calciumkanalblokkere, nitrater, diuretika, aspirin, statiner og fibrater). Ved baseline havde patienterne en gennemsnitsalder på 62 år, en gennemsnitlig varighed af diabetes på 9,5 år og en gennemsnitlig HbA1c på 8,1 %. Den gennemsnitlige varighed af opfølgningen var 34,5 måneder. Det primære formål med dette forsøg var at undersøge effekten af ACTOS på mortalitet og makrovaskulær morbiditet hos patienter med type 2-diabetes mellitus, som havde høj risiko for makrovaskulære hændelser. Den primære effektvariabel var tiden til den første forekomst af enhver hændelse i et kardiovaskulært sammensat endepunkt, der omfattede mortalitet af alle årsager, ikke-fatalt myokardieinfarkt (MI) inklusive stille hjerteinfarkt, slagtilfælde, akut koronarsyndrom, hjerteintervention inklusive koronar bypasstransplantation eller perkutan indgreb, større benamputation over anklen og bypass-operation eller revaskularisering i benet. I alt 514 (19,7 %) patienter behandlet med ACTOS 15 mg og 572 (21,7 %) placebobehandlede patienter oplevede mindst én hændelse fra det primære sammensatte endepunkt (hazard ratio 0,90; 95 % konfidensinterval: 0,80, 1,02; p=0,10 ).
Selvom der ikke var nogen statistisk signifikant forskel mellem ACTOS og placebo for den treårige forekomst af en første hændelse inden for denne sammensætning, var der ingen stigning i mortalitet eller i totale makrovaskulære hændelser med ACTOS. Antallet af første forekomster og samlede individuelle hændelser, der bidrager til det primære sammensatte endepunkt, er vist i tabel 9.
Vægtøgning
Dosisrelateret vægtøgning opstår, når ACTOS 30 mg anvendes alene eller i kombination med andre antidiabetiske lægemidler. Mekanismen for vægtøgning er uklar, men involverer sandsynligvis en kombination af væskeophobning og fedtophobning.
Tabel 10 og 11 opsummerer ændringerne i kropsvægt med ACTOS og placebo i de 16- til 26-ugers randomiserede, dobbeltblindede monoterapi- og 16- til 24-ugers kombinationsbehandlingsforsøg og i PROactive-studiet.
Ødem
Ødem forårsaget af at tage ACTOS er reversibelt, når ACTOS seponeres. Ødemet kræver normalt ikke hospitalsindlæggelse, medmindre der er sideløbende kongestiv hjerteinsufficiens. En oversigt over hyppigheden og typerne af uønskede hændelser for ødem, der forekommer i kliniske undersøgelser af ACTOS 30 mg, findes i tabel 12.
Leverpåvirkninger
Der har hidtil ikke været tegn på induceret hepatotoksicitet med ACTOS i databasen med ACTOS kontrollerede kliniske forsøg. Et randomiseret, dobbeltblindt 3-årigt forsøg, der sammenlignede ACTOS 15mg med glyburid som tilføjelse til metformin og insulinbehandling, var specifikt designet til at evaluere forekomsten af serum-ALAT-forhøjelse til mere end tre gange den øvre grænse for referenceområdet, målt pr. otte uger i de første 48 uger af forsøget og derefter hver 12. uge. I alt 3/1051 (0,3 %) patienter behandlet med ACTOS og 9/1046 (0,9 %) patienter behandlet med glyburid udviklede ALAT-værdier større end tre gange den øvre grænse for referenceområdet. Ingen af patienterne behandlet med ACTOS i ACTOS kontrollerede kliniske forsøgsdatabase til dato har haft en serum-ALAT større end tre gange den øvre grænse for referenceområdet og en tilsvarende total bilirubin større end to gange den øvre grænse for referenceområdet, en kombination, der forudsiger potentialet for alvorlig lægemiddelinduceret leverskade.
Hypoglykæmi
I de kliniske ACTOS 15 mg-studier blev bivirkninger af hypoglykæmi rapporteret baseret på undersøgelsens kliniske vurdering og krævede ikke bekræftelse med fingerstik-glucosetest.
I det 16-ugers tilføjelsesstudie til sulfonylurinstof var forekomsten af rapporteret hypoglykæmi 3,7 % med ACTOS 30 mg og 0,5 % med placebo. I det 16-ugers supplerende insulinforsøg var forekomsten af rapporteret hypoglykæmi 7,9 % med ACTOS 15 mg, 15,4 % med ACTOS 30 mg og 4,8 % med placebo.
Hyppigheden af rapporteret hypoglykæmi var højere med ACTOS 45 mg sammenlignet med ACTOS 30 mg i både 24-ugers-tillægsstudiet til sulfonylurinstof (15,7 % vs. 13,4 %) og i 24-ugers-tillægsstudiet til insulin (47,8). % mod 43,5 %).
Tre patienter i disse fire forsøg blev indlagt på hospitalet på grund af hypoglykæmi. Alle tre patienter fik ACTOS 30 mg (0,9 %) i det 24-ugers supplement til insulinstudiet. Yderligere 14 patienter rapporterede om alvorlig hypoglykæmi (defineret som at forårsage betydelig interferens med patientens sædvanlige aktiviteter), som ikke krævede hospitalsindlæggelse. Disse patienter fik ACTOS 45 mg i kombination med sulfonylurinstof (n=2) eller ACTOS 30 mg eller 45 mg i kombination med insulin (n=12).
Urinblæretumorer
Tumorer blev observeret i urinblæren hos hanrotter i det to-årige carcinogenicitetsstudie [se Ikke-klinisk toksikologi ]. I løbet af det treårige PROactive kliniske forsøg blev 14 patienter ud af 2605 (0,54 %) randomiseret til ACTOS og 5 ud af 2633 (0,19 %) randomiserede til placebo diagnosticeret med blærekræft. Efter at have ekskluderet patienter, hvor eksponeringen for undersøgelseslægemidlet var mindre end et år på tidspunktet for diagnosticering af blærekræft, var der 6 (0,23 %) tilfælde på ACTOS 15 mg og to (0,08 %) tilfælde på placebo. Efter afslutningen af forsøget blev en stor delmængde af patienter observeret i op til 10 yderligere år med ringe yderligere eksponering for ACTOS. I løbet af de 13 år med både PROaktiv og observationel opfølgning var forekomsten af blærekræft ikke forskellig mellem patienter randomiseret til ACTOS eller placebo (HR = 1,00; 95 % CI: 0,59-1,72) [se ADVARSLER OG FORHOLDSREGLER ].
Laboratorieabnormiteter
Hæmatologiske virkninger
ACTOS 15mg kan forårsage fald i hæmoglobin og hæmatokrit. I placebokontrollerede monoterapiforsøg faldt de gennemsnitlige hæmoglobinværdier med 2 % til 4 % hos patienter behandlet med ACTOS sammenlignet med en gennemsnitlig ændring i hæmoglobin på -1 % til +1 % hos placebobehandlede patienter. Disse ændringer forekom primært inden for de første 4 til 12 uger af behandlingen og forblev relativt konstante derefter. Disse ændringer kan være relateret til øget plasmavolumen forbundet med ACTOS 30 mg-behandling og er sandsynligvis ikke forbundet med nogen klinisk signifikant hæmatologisk effekt.
Kreatinfosfokinase
Under protokolspecificeret måling af serum kreatinfosphokinase (CPK) i ACTOS 15 mg kliniske forsøg, blev en isoleret stigning i CPK til mere end 10 gange den øvre grænse for referenceområdet noteret hos ni (0,2 %) patienter behandlet med ACTOS (værdier af 2150 til 11400 IE/L) og hos ingen komparatorbehandlede patienter. Seks af disse ni patienter fortsatte med at modtage ACTOS 15 mg, to patienter blev noteret for at have CPK-forhøjelsen på den sidste dag af doseringen, og en patient afbrød ACTOS på grund af forhøjelsen. Disse stigninger forsvandt uden nogen tilsyneladende kliniske følgesygdomme. Forholdet mellem disse hændelser og ACTOS 30 mg-behandling er ukendt.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af ACTOS efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det generelt ikke muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
- Nyopstået eller forværret diabetisk makulaødem med nedsat synsstyrke [se ADVARSLER OG FORHOLDSREGLER ].
- Fatalt og ikke-fatalt leversvigt [se ADVARSLER OG FORHOLDSREGLER ].
Postmarketing-rapporter om kongestiv hjertesvigt er blevet rapporteret hos patienter behandlet med ACTOS, både med og uden tidligere kendt hjertesygdom og både med og uden samtidig insulinadministration.
Efter markedsføringserfaring har der været rapporter om usædvanlig hurtige vægtstigninger og stigninger ud over det, der generelt er observeret i kliniske forsøg. Patienter, der oplever sådanne stigninger, bør vurderes for væskeophobning og volumen-relaterede hændelser såsom overdreven ødem og kongestiv hjertesvigt [se KASSE ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
DRUGSINTERAKTIONER
Stærke CYP2C8-hæmmere
En hæmmer af CYP2C8 (f.eks. gemfibrozil) øger eksponeringen (arealet under serumkoncentration-tidskurven eller AUC) og halveringstiden (t½) af pioglitazon signifikant. Derfor er den maksimalt anbefalede dosis af ACTOS 15 mg dagligt, hvis det bruges i kombination med gemfibrozil eller andre stærke CYP2C8-hæmmere [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
CYP2C8 inducere
En inducer af CYP2C8 (f.eks. rifampin) kan reducere eksponeringen (AUC) af pioglitazon signifikant. Derfor, hvis en inducer af CYP2C8 startes eller stoppes under behandling med ACTOS 30 mg, kan ændringer i diabetesbehandlingen være nødvendige baseret på klinisk respons uden at overskride den maksimalt anbefalede daglige dosis på 45 mg for ACTOS [se KLINISK FARMAKOLOGI ].
Topiramat
Et fald i eksponeringen af pioglitazon og dets aktive metabolitter blev observeret ved samtidig administration af pioglitazon og topiramat [se KLINISK FARMAKOLOGI ]. Den kliniske relevans af dette fald er ukendt; Men når ACTOS og topiramat anvendes samtidig, skal patienterne overvåges for tilstrækkelig glykæmisk kontrol.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Kongestiv hjertesvigt
ACTOS 15mg kan ligesom andre thiazolidindioner forårsage dosisrelateret væskeretention, når det bruges alene eller i kombination med andre antidiabetiske lægemidler og er mest almindeligt, når ACTOS 30mg anvendes i kombination med insulin. Væskeretention kan føre til eller forværre kongestiv hjerteinsufficiens. Patienter bør observeres for tegn og symptomer på kongestiv hjerteinsufficiens. Hvis der udvikles kongestivt hjertesvigt, skal det behandles i overensstemmelse med gældende standarder for pleje, og seponering eller dosisreduktion af ACTOS skal overvejes [se KASSE ADVARSEL , KONTRAINDIKATIONER , og BIVIRKNINGER ].
Hypoglykæmi
Patienter, der får ACTOS i kombination med insulin eller andre antidiabetiske lægemidler (især insulinsekretagoger, såsom sulfonylurinstoffer), kan have risiko for hypoglykæmi. En reduktion i dosis af den samtidige antidiabetiske medicin kan være nødvendig for at reducere risikoen for hypoglykæmi [se DOSERING OG ADMINISTRATION ].
Leverpåvirkninger
Der har efter markedsføring været rapporter om fatalt og ikke-fatalt leversvigt hos patienter, der tager ACTOS 15 mg, selvom rapporterne ikke indeholder tilstrækkelig information, der er nødvendig til at fastslå den sandsynlige årsag. Der har hidtil ikke været tegn på lægemiddelinduceret levertoksicitet i ACTOS 30 mg kontrollerede kliniske forsøgsdatabase [se BIVIRKNINGER ].
Patienter med type 2-diabetes kan have fedtleversygdom eller hjertesygdom med episodisk kongestiv hjerteinsufficiens, som begge kan forårsage abnormiteter i leverprøver, og de kan også have andre former for leversygdomme, hvoraf mange kan behandles eller behandles. Derfor anbefales det at indhente et levertestpanel (serumalaninaminotransferase [ALT], aspartataminotransferase [AST], alkalisk phosphatase og total bilirubin) og vurdere patienten, før ACTOS-behandling påbegyndes. Hos patienter med unormale leverprøver bør ACTOS 15 mg initieres med forsigtighed.
Mål leverprøver omgående hos patienter, der rapporterer symptomer, der kan indikere leverskade, herunder træthed, anoreksi, ubehag i højre øvre del af maven, mørk urin eller gulsot. I denne kliniske sammenhæng, hvis patienten viser sig at have unormale leverprøver (ALT større end 3 gange den øvre grænse for referenceområdet), bør ACTOS 15 mg-behandling afbrydes og undersøgelse udføres for at fastslå den sandsynlige årsag. ACTOS bør ikke genoptages hos disse patienter uden en anden forklaring på abnormiteterne i leveren.
Patienter, der har serum-ALAT større end tre gange referenceområdet med serum totalt bilirubin større end to gange referenceområdet uden alternative ætiologier, er i risiko for alvorlig lægemiddelinduceret leverskade og bør ikke genstartes med ACTOS. Til patienter med mindre forhøjelser af serum-ALAT eller bilirubin og med en alternativ sandsynlig årsag, kan behandling med ACTOS anvendes med forsigtighed.
Urinblæretumorer
Tumorer blev observeret i urinblæren hos hanrotter i det to-årige carcinogenicitetsstudie [se Ikke-klinisk toksikologi ]. Derudover blev 14 patienter ud af 2605 (0,54 %) randomiseret til ACTOS 15 mg og 5 ud af 2633 (0,19 %) randomiserede til placebo diagnosticeret med blærekræft i løbet af det treårige kliniske forsøg med PROactive. Efter at have ekskluderet patienter, hvor eksponeringen for undersøgelseslægemidlet var mindre end et år på tidspunktet for diagnosticering af blærekræft, var der 6 (0,23 %) tilfælde på ACTOS 30 mg og to (0,08 %) tilfælde på placebo. Efter afslutningen af forsøget blev en stor delmængde af patienter observeret i op til 10 yderligere år med ringe yderligere eksponering for ACTOS. I løbet af de 13 år med både PROaktiv og observationel opfølgning var forekomsten af blærekræft ikke forskellig mellem patienter randomiseret til ACTOS 30 mg eller placebo (HR = 1,00; [95 % CI: 0,59-1,72]).
Resultater vedrørende risikoen for blærekræft hos patienter udsat for ACTOS varierer mellem observationsstudier; nogle fandt ikke en øget risiko for blærekræft forbundet med ACTOS 30mg, mens andre gjorde.
Et stort prospektivt 10-årigt observationelt kohortestudie udført i USA fandt ingen statistisk signifikant stigning i risikoen for blærekræft hos diabetespatienter, der nogensinde har været udsat for ACTOS, sammenlignet med dem, der aldrig har været udsat for ACTOS (HR = 1,06 [95 % CI 0,89-1,26) ]).
En retrospektiv kohorteundersøgelse udført med data fra Det Forenede Kongerige fandt en statistisk signifikant sammenhæng mellem nogensinde eksponering for ACTOS og blærekræft (HR: 1,63; [95 % CI: 1,22-2,19]).
Forbindelser mellem kumulativ dosis eller kumulativ varighed af eksponering for ACTOS 15mg og blærekræft blev ikke påvist i nogle undersøgelser, inklusive det 10-årige observationsstudie i USA, men i andre. Inkonsekvente resultater og begrænsninger, der er iboende i disse og andre undersøgelser, udelukker endelige fortolkninger af observationsdataene.
ACTOS kan være forbundet med en stigning i risikoen for urinblæretumorer. Der er utilstrækkelige data til at afgøre, om pioglitazon er en tumorpromotor for urinblæretumorer.
Derfor bør ACTOS ikke anvendes til patienter med aktiv blærekræft, og fordelene ved glykæmisk kontrol versus ukendte risici for kræfttilbagefald med ACTOS bør overvejes hos patienter med en tidligere historie med blærekræft.
Ødem
I kontrollerede kliniske forsøg blev ødem rapporteret hyppigere hos patienter behandlet med ACTOS 30 mg end hos placebobehandlede patienter og er dosisrelateret [se BIVIRKNINGER ]. Efter markedsføringserfaring er der modtaget rapporter om nyopstået eller forværret ødem.
ACTOS 15 mg bør anvendes med forsigtighed til patienter med ødem. Da thiazolidindioner, inklusive ACTOS, kan forårsage væskeretention, som kan forværre eller føre til kongestiv hjerteinsufficiens, bør ACTOS 30 mg anvendes med forsigtighed til patienter med risiko for kongestiv hjerteinsufficiens. Patienter behandlet med ACTOS bør overvåges for tegn og symptomer på kongestiv hjerteinsufficiens [se KASSE ADVARSEL , Kongestiv hjertesvigt og PATIENTOPLYSNINGER ].
Brud
PROactive (det prospektive Pioglitazon Clinical Trial in Macrovascular Events) blev 5238 patienter med type 2-diabetes og en historie med makrovaskulær sygdom randomiseret til ACTOS (N=2605), tvangstitreret op til 45 mg dagligt eller placebo (N=2633) ud over standardpleje. I løbet af en gennemsnitlig opfølgning på 34,5 måneder var forekomsten af knoglebrud hos kvinder 5,1 % (44/870) for ACTOS 30 mg versus 2,5 % (23/905) for placebo. Denne forskel blev bemærket efter det første års behandling og varede ved i løbet af undersøgelsen. Størstedelen af de frakturer, der blev observeret hos kvindelige patienter, var ikke-vertebrale frakturer inklusive underekstremitet og distale overekstremitet. Der blev ikke observeret nogen stigning i forekomsten af frakturer hos mænd behandlet med ACTOS (1,7 %) versus placebo (2,1 %). Risikoen for fraktur bør overvejes i plejen af patienter, især kvindelige patienter, behandlet med ACTOS, og der bør lægges vægt på at vurdere og vedligeholde knoglesundhed i overensstemmelse med gældende standarder for pleje.
Makulaødem
Makulært ødem er blevet rapporteret efter markedsføring hos diabetespatienter, som tog ACTOS eller en anden thiazolidindion. Nogle patienter præsenterede med sløret syn eller nedsat synsstyrke, men andre blev diagnosticeret ved rutinemæssig oftalmologisk undersøgelse.
De fleste patienter havde perifert ødem på det tidspunkt, hvor makulaødem blev diagnosticeret. Nogle patienter havde bedring i deres makulaødem efter seponering af thiazolidindion.
Patienter med diabetes bør have regelmæssige øjenundersøgelser af en øjenlæge i henhold til gældende standarder for pleje. Patienter med diabetes, som rapporterer visuelle symptomer, bør omgående henvises til en øjenlæge, uanset patientens underliggende medicin eller andre fysiske fund [se BIVIRKNINGER ].
Makrovaskulære resultater
Der har ikke været nogen kliniske undersøgelser, der påviser endegyldige beviser for makrovaskulær risikoreduktion med ACTOS.
Patientrådgivningsinformation
Se FDA-godkendt patientmærkning ( PATIENTOPLYSNINGER ).
- Det er vigtigt at instruere patienterne i at overholde diætinstruktionerne og at få testet blodsukker og glykosyleret hæmoglobin regelmæssigt. I perioder med stress som feber, traumer, infektion eller operation kan medicinbehovet ændre sig, og patienter bør mindes om at søge læge omgående.
- Patienter, som oplever en usædvanlig hurtig stigning i vægt eller ødem, eller som udvikler åndenød eller andre symptomer på hjertesvigt, mens de er i behandling med ACTOS, bør straks rapportere disse symptomer til en læge.
- Fortæl patienterne omgående at stoppe med at tage ACTOS og søge omgående lægehjælp, hvis der er uforklarlig kvalme, opkastning, mavesmerter, træthed, anoreksi eller mørk urin, da disse symptomer kan skyldes hepatotoksicitet.
- Fortæl patienterne omgående at rapportere ethvert tegn på makroskopisk hæmaturi eller andre symptomer såsom dysuri eller urintrang, der udvikler sig eller øges under behandlingen, da disse kan skyldes blærekræft.
- Fortæl patienterne at tage ACTOS 15 mg én gang dagligt. ACTOS 15 mg kan tages med eller uden måltider. Hvis en dosis glemmes på én dag, bør dosis ikke fordobles den følgende dag.
- Ved anvendelse af kombinationsbehandling med insulin eller anden antidiabetisk medicin, bør risikoen for hypoglykæmi, dens symptomer og behandling samt tilstande, der disponerer for udviklingen, forklares for patienter og deres familiemedlemmer.
- Informer kvindelige patienter om, at behandling med ACTOS 30 mg, ligesom andre thiazolidindioner, kan resultere i en utilsigtet graviditet hos nogle præmenopausale anovulatoriske kvinder på grund af dets effekt på ægløsning [se Brug i specifikke populationer ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Et toårigt karcinogenicitetsstudie blev udført i han- og hunrotter ved orale doser op til 63 mg/kg (ca. 14 gange den maksimale anbefalede orale dosis til mennesker på 45 mg baseret på mg/m2). Lægemiddelinducerede tumorer blev ikke observeret i noget organ bortset fra urinblæren hos hanrotter. Godartede og/eller maligne overgangscelle-neoplasmer blev observeret hos hanrotter ved 4 mg/kg/dag og derover (ca. lig med den maksimalt anbefalede orale humane dosis baseret på mg/m2). Urinsten med efterfølgende irritation og hyperplasi blev postuleret som mekanismen for blæretumorer observeret hos hanrotter. Et to-årigt mekanistisk studie i hanrotter, der brugte diætforsuring til at reducere dannelsen af tandsten, blev afsluttet i 2009. Kostforsuring faldt, men afskaffede ikke de hyperplastiske ændringer i blæren. Tilstedeværelsen af tandsten forværrede den hyperplastiske respons på pioglitazon, men blev ikke betragtet som den primære årsag til de hyperplastiske ændringer.
Relevansen for mennesker af blærefundene hos hanrotter kan ikke udelukkes.
Et toårigt karcinogenicitetsstudie blev også udført i han- og hunmus ved orale doser op til 100 mg/kg/dag (ca. 11 gange den maksimalt anbefalede orale humane dosis baseret på mg/m2). Ingen lægemiddel-inducerede tumorer blev observeret i noget organ.
Pioglitazonhydrochlorid var ikke mutagent i en række genetiske toksikologiske undersøgelser, herunder Ames-bakterieanalysen, en pattedyrcelle-forward-genmutationsanalyse (CHO/HPRT og AS52/XPRT), en in vitro cytogenetisk analyse, der anvender CHL-celler, et uplanlagt DNA-synteseassay og et in vivo mikronukleusassay.
Der blev ikke observeret bivirkninger på fertiliteten hos han- og hunrotter ved orale doser på op til 40 mg/kg pioglitazonhydrochlorid dagligt før og gennem hele parring og drægtighed (ca. ni gange den maksimale anbefalede orale dosis til mennesker baseret på mg/m2).
Brug i specifikke populationer
Graviditet
Risikooversigt
Begrænsede data med ACTOS hos gravide kvinder er ikke tilstrækkelige til at bestemme en lægemiddelassocieret risiko for alvorlige fødselsdefekter eller abort. Der er risici for moderen og fosteret forbundet med dårligt kontrolleret diabetes under graviditeten [se Kliniske overvejelser ].
I dyrereproduktionsstudier blev der ikke observeret uønskede udviklingsmæssige virkninger, når pioglitazon blev administreret til drægtige rotter og kaniner under organogenese ved eksponeringer op til henholdsvis 5 og 35 gange den kliniske dosis på 45 mg, baseret på kropsoverfladeareal [se Data ].
Den estimerede baggrundsrisiko for større fødselsdefekter er 6-10 % hos kvinder med præ-gestational diabetes med et HbA1c >7 og er blevet rapporteret at være så høj som 20-25 % hos kvinder med et HbA1c >10. Den estimerede baggrundsrisiko for abort for den angivne population er ukendt. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2-4 % og 15-20 %.
Kliniske overvejelser
Sygdomsrelateret risiko for moder og/eller embryo/føtal
Dårligt kontrolleret diabetes under graviditet øger moderens risiko for diabetisk ketoacidose, præeklampsi, spontane aborter, præmatur fødsel, dødfødsel og fødselskomplikationer. Dårligt kontrolleret diabetes øger fosterets risiko for større fødselsdefekter, dødfødsel og makrosomi-relateret sygelighed.
Data
Dyredata
Pioglitazon administreret til gravide rotter under organogenese forårsagede ikke uønskede udviklingseffekter ved en dosis på 20 mg/kg (~5 gange den kliniske dosis på 45 mg), men forsinket fødslen og reduceret embryoføtal levedygtighed ved 40 og 80 mg/kg eller ≥ 9 gange den kliniske dosis på 45 mg efter kropsoverfladeareal. Hos gravide kaniner, der fik pioglitazon under organogenese, blev der ikke observeret uønskede udviklingsmæssige virkninger ved 80 mg/kg (~35 gange den kliniske dosis på 45 mg), men reduceret embryoføtal levedygtighed ved 160 mg/kg eller ~69 gange den kliniske dosis på 45 mg. dosis efter kropsoverfladeareal. Når drægtige rotter modtog pioglitazon under sen drægtighed og laktation, forekom forsinket postnatal udvikling, som skyldtes nedsat kropsvægt, hos afkom ved maternelle doser på 10 mg/kg og derover eller ≥2 gange den kliniske dosis på 45 mg efter kropsoverfladeareal.
Amning
Risikooversigt
Der er ingen information om tilstedeværelsen af pioglitazon i modermælk, virkningerne på det ammede spædbarn eller virkningerne på mælkeproduktionen. Pioglitazon findes i rottemælk; men på grund af artsspecifikke forskelle i laktationsfysiologi kan dyredata muligvis ikke pålideligt forudsige lægemiddelniveauer i human mælk. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for ACTOS 15 mg og eventuelle negative virkninger på det ammede spædbarn fra ACTOS 30 mg eller fra den underliggende moderens tilstand.
Hunner og mænd med reproduktionspotentiale
Diskuter potentialet for utilsigtet graviditet med præmenopausale kvinder, da behandling med ACTOS, ligesom andre thiazolidindioner, kan resultere i ægløsning hos nogle anovulatoriske kvinder.
Pædiatrisk brug
Sikkerhed og effektivitet af ACTOS hos pædiatriske patienter er ikke blevet fastslået.
ACTOS 15mg anbefales ikke til brug til pædiatriske patienter baseret på bivirkninger observeret hos voksne, herunder væskeretention og kongestiv hjertesvigt, frakturer og urinblæretumorer [se ADVARSLER OG FORHOLDSREGLER ].
Geriatrisk brug
I alt 92 patienter (15,2 %) behandlet med ACTOS i de tre poolede 16- til 26-ugers dobbeltblindede, placebokontrollerede monoterapiforsøg var ≥65 år gamle, og to patienter (0,3%) var ≥75 år. I de to poolede 16- til 24-ugers tilføjelsesstudier til sulfonylurinstof var 201 patienter (18,7%) behandlet med ACTOS 30 mg ≥65 år og 19 (1,8%) var ≥75 år. I de to poolede 16- til 24-ugers add-on til metformin-forsøg var 155 patienter (15,5%) behandlet med ACTOS ≥65 år og 19 (1,9%) var ≥75 år. I de to poolede 16- til 24-ugers supplerende insulinundersøgelser var 272 patienter (25,4%) behandlet med ACTOS ≥65 år og 22 (2,1%) var ≥75 år.
I PROactive var 1068 patienter (41,0%) behandlet med ACTOS ≥65 år og 42 (1,6%) var ≥75 år.
farmakokinetiske undersøgelser med pioglitazon blev der ikke observeret signifikante forskelle i farmakokinetiske parametre mellem ældre og yngre patienter [se KLINISK FARMAKOLOGI ].
Selvom kliniske erfaringer ikke har identificeret forskelle i effektivitet og sikkerhed mellem ældre (≥65 år) og yngre patienter, er disse konklusioner begrænset af små stikprøvestørrelser for patienter ≥75 år.
OVERDOSIS
Under kontrollerede kliniske forsøg blev der rapporteret et tilfælde af overdosering med ACTOS 30 mg. En mandlig patient tog 120 mg om dagen i fire dage, derefter 180 mg om dagen i syv dage. Patienten nægtede nogen kliniske symptomer i denne periode.
I tilfælde af overdosering bør passende understøttende behandling påbegyndes i henhold til patientens kliniske tegn og symptomer.
KONTRAINDIKATIONER
- Start hos patienter med etableret NYHA klasse III eller IV hjertesvigt [se KASSE ADVARSEL ].
- Anvendes til patienter med kendt overfølsomhed over for pioglitazon eller enhver anden komponent i ACTOS.
KLINISK FARMAKOLOGI
Handlingsmekanisme
ACTOS 15mg er en thiazolidindion, der afhænger af tilstedeværelsen af insulin for dets virkningsmekanisme. ACTOS nedsætter insulinresistens i periferien og i leveren, hvilket resulterer i øget insulinafhængig glukosebortskaffelse og nedsat leverglukoseoutput. Pioglitazon er ikke en insulinsekretagog. Pioglitazon er en agonist for peroxisomproliferator-aktiveret receptor-gamma (PPAR?). PPAR-receptorer findes i væv, der er vigtige for insulinvirkning, såsom fedtvæv, skeletmuskulatur og lever. Aktivering af PPAR? nukleare receptorer modulerer transkriptionen af en række insulinresponsive gener involveret i kontrollen af glucose og lipidmetabolisme.
dyremodeller af diabetes reducerer pioglitazon hyperglykæmi, hyperinsulinemi og hypertriglyceridæmi, der er karakteristisk for insulinresistente tilstande såsom type 2-diabetes. De metaboliske ændringer produceret af pioglitazon resulterer i øget reaktionsevne af insulinafhængigt væv og observeres i adskillige dyremodeller for insulinresistens.
Fordi pioglitazon forstærker virkningerne af cirkulerende insulin (ved at mindske insulinresistens), sænker det ikke blodsukkeret i dyremodeller, der mangler endogent insulin.
Farmakodynamik
Kliniske undersøgelser viser, at ACTOS 15 mg forbedrer insulinfølsomheden hos insulinresistente patienter. ACTOS øger cellulær reaktion på insulin, øger insulinafhængig glukosebortskaffelse og forbedrer leverens følsomhed over for insulin. Hos patienter med type 2-diabetes resulterer den nedsatte insulinresistens produceret af ACTOS i lavere plasmaglukosekoncentrationer, lavere plasmainsulinkoncentrationer og lavere HbA1c-værdier. I kontrollerede kliniske forsøg havde ACTOS en additiv effekt på glykæmisk kontrol, når det blev brugt i kombination med et sulfonylurinstof, metformin eller insulin [se Kliniske Studier ].
Patienter med lipid-abnormiteter blev inkluderet i kliniske forsøg med ACTOS. Samlet set havde patienter behandlet med ACTOS 15 mg gennemsnitlige fald i serumtriglycerider, gennemsnitlige stigninger i HDL-kolesterol og ingen konsistente gennemsnitlige ændringer i LDL og totalt kolesterol. Der er ingen afgørende beviser for makrovaskulær fordel ved ACTOS [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
et 26-ugers, placebokontrolleret, dosisvarierende monoterapistudie faldt gennemsnitlige serumtriglycerider i dosisgrupperne 15 mg, 30 mg og 45 mg ACTOS 15 mg sammenlignet med en gennemsnitlig stigning i placebogruppen. Gennemsnitlig HDL-kolesterol steg i højere grad hos patienter behandlet med ACTOS 30 mg end hos placebobehandlede patienter. Der var ingen konsistente forskelle for LDL og totalt kolesterol hos patienter behandlet med ACTOS sammenlignet med placebo (se tabel 14).
I de to andre monoterapistudier (16 uger og 24 uger) og i kombinationsterapistudier med sulfonylurinstof (16 uger og 24 uger), metformin (16 uger og 24 uger) eller insulin (16 uger og 24 uger), var resultaterne generelt i overensstemmelse med ovenstående data.
Farmakokinetik
Efter en gang daglig administration af ACTOS 15 mg opnås steady-state serumkoncentrationer af både pioglitazon og dets vigtigste aktive metabolitter, M-III (ketoderivat af pioglitazon) og M-IV (hydroxylderivat af pioglitazon), inden for syv dage. Ved steady-state når M-III og M-IV serumkoncentrationer lig med eller større end pioglitazon. Ved steady-state, hos både raske frivillige og patienter med type 2-diabetes, udgør pioglitazon ca. 30 % til 50 % af de maksimale totale pioglitazon-serumkoncentrationer (pioglitazon plus aktive metabolitter) og 20 % til 25 % af den totale AUC.
Cmax, AUC og laveste serumkoncentrationer (Cmin) for pioglitazon og M-III og M-IV steg proportionalt med administrerede doser på 15 mg og 30 mg dagligt.
Absorption
Efter oral administration af pioglitazon var Tmax for pioglitazon inden for to timer. Mad forsinker Tmax til tre til fire timer, men ændrer ikke graden af absorption (AUC).
Fordeling
Det gennemsnitlige tilsyneladende fordelingsvolumen (Vd/F) af pioglitazon efter enkeltdosisadministration er 0,63 ± 0,41 (gennemsnit ± SD) L/kg legemsvægt. Pioglitazon er i vid udstrækning proteinbundet (>99%) i humant serum, primært til serumalbumin. Pioglitazon binder sig også til andre serumproteiner, men med lavere affinitet. M-III og M-IV er også i vid udstrækning bundet (>98%) til serumalbumin.
Metabolisme
Pioglitazon metaboliseres i vid udstrækning ved hydroxylering og oxidation; metabolitterne omdannes også delvist til glucuronid- eller sulfatkonjugater. Metabolitterne M-III og M-IV er de vigtigste cirkulerende aktive metabolitter hos mennesker.
In vitro-data viser, at flere CYP-isoformer er involveret i metabolismen af pioglitazon, som inkluderer CYP2C8 og, i mindre grad, CYP3A4 med yderligere bidrag fra en række andre isoformer, herunder den hovedsageligt ekstrahepatiske CYP1A1. In vivo-studie af pioglitazon i kombination med gemfibrozil, en stærk CYP2C8-hæmmer, viste, at pioglitazon er et CYP2C8-substrat [se DOSERING OG ADMINISTRATION og DRUGSINTERAKTIONER ]. Urin 6β-hydroxycortisol/cortisol-forhold målt hos patienter behandlet med ACTOS 30mg viste, at pioglitazon ikke er en stærk CYP3A4-enzyminducer.
Udskillelse og eliminering
Efter oral administration genfindes ca. 15 % til 30 % af pioglitazondosis i urinen. Renal elimination af pioglitazon er ubetydelig, og lægemidlet udskilles primært som metabolitter og deres konjugater. Det formodes, at det meste af den orale dosis udskilles i galden enten uændret eller som metabolitter og elimineres i fæces.
Den gennemsnitlige serumhalveringstid (t1/2) for pioglitazon og dets metabolitter (M-III og M-IV) varierer fra henholdsvis tre til syv timer og 16 til 24 timer. Pioglitazon har en tilsyneladende clearance, CL/F, beregnet til at være fem til syv l/time.
Nedsat nyrefunktion
Serum-elimineringshalveringstiden for pioglitazon, M-III og M-IV forbliver uændret hos patienter med moderat (kreatininclearance [CLcr] 30 til 50 ml/min) og svær (CLcr
Nedsat leverfunktion
Sammenlignet med raske kontroller har forsøgspersoner med nedsat leverfunktion (Child-Turcotte-Pugh Grade B/C) en ca. 45 % reduktion i pioglitazon og total pioglitazon (pioglitazon, M-III og M-IV) gennemsnitlig Cmax, men ingen ændring i de gennemsnitlige AUC-værdier. Derfor er dosisjustering ikke nødvendig hos patienter med nedsat leverfunktion.
Der er postmarketing rapporter om leversvigt med ACTOS, og kliniske forsøg har generelt udelukket patienter med serum-ALAT >2,5 gange den øvre grænse for referenceområdet. Vær forsigtig hos patienter med leversygdom [se ADVARSLER OG FORHOLDSREGLER ].
Geriatriske patienter
Hos raske ældre forsøgspersoner var Cmax for pioglitazon ikke signifikant anderledes, men AUC-værdierne var ca. 21 % højere end dem, der blev opnået hos yngre forsøgspersoner. Den gennemsnitlige t1/2 af pioglitazon var også forlænget hos ældre forsøgspersoner (ca. ti timer) sammenlignet med yngre forsøgspersoner (ca. syv timer). Disse ændringer var ikke af en størrelsesorden, der ville blive betragtet som klinisk relevante.
Pædiatriske patienter
Sikkerhed og effekt af pioglitazon hos pædiatriske patienter er ikke blevet fastlagt. ACTOS 15mg anbefales ikke til brug til pædiatriske patienter [se Brug i specifikke populationer ].
Køn
De gennemsnitlige Cmax- og AUC-værdier for pioglitazon blev øget med 20 % til 60 % hos kvinder sammenlignet med mænd. I kontrollerede kliniske forsøg var HbA1c-fald fra baseline generelt større for kvinder end for mænd (gennemsnitlig forskel i HbA1c 0,5%). Da behandlingen bør individualiseres til hver patient for at opnå glykæmisk kontrol, anbefales ingen dosisjustering baseret på køn alene.
Etnicitet
Farmakokinetiske data for forskellige etniske grupper er ikke tilgængelige.
Lægemiddel-lægemiddelinteraktioner
Dyretoksikologi og/eller farmakologi
Hjerteforstørrelse er blevet observeret hos mus (100 mg/kg), rotter (4 mg/kg og derover) og hunde (3 mg/kg) behandlet oralt med pioglitazonhydrochlorid (ca. 11, 1 og 2 gange det maksimalt anbefalede orale orale menneske). dosis til henholdsvis mus, rotter og hunde baseret på mg/m2). I et etårigt rottestudie forekom lægemiddelrelateret tidlig død på grund af tilsyneladende hjertedysfunktion ved en oral dosis på 160 mg/kg/dag (ca. 35 gange den maksimale anbefalede orale dosis til mennesker baseret på mg/m2). Hjerteforstørrelse blev set i et 13-ugers studie med aber ved orale doser på 8,9 mg/kg og derover (ca. fire gange den maksimale anbefalede humane orale dosis baseret på mg/m2), men ikke i et 52-ugers studie med orale doser op til 32 mg/kg (ca. 13 gange den maksimalt anbefalede orale dosis til mennesker baseret på mg/m2).
Kliniske Studier
Monoterapi
Tre randomiserede, dobbeltblindede, placebokontrollerede forsøg med varighed fra 16 til 26 uger blev udført for at evaluere brugen af ACTOS som monoterapi hos patienter med type 2-diabetes. Disse forsøg undersøgte ACTOS 15 mg i doser op til 45 mg eller placebo én gang dagligt hos i alt 865 patienter.
I et 26-ugers dosisvarierende monoterapiforsøg blev 408 patienter med type 2-diabetes randomiseret til at modtage 7,5 mg, 15 mg, 30 mg eller 45 mg ACTOS eller placebo én gang dagligt. Behandling med et hvilket som helst tidligere antidiabetisk middel blev afbrudt otte uger før den dobbeltblinde periode. Behandling med 15 mg, 30 mg og 45 mg ACTOS 30 mg gav statistisk signifikante forbedringer i HbA1c og fastende plasmaglucose (FPG) ved endepunktet sammenlignet med placebo (se figur 1, tabel 17).
Figur 1 viser tidsforløbet for ændringer i HbA1c i denne 26-ugers undersøgelse.
Figur 1. Gennemsnitlig ændring fra baseline for HbA1c i en 26-ugers placebokontrolleret dosis-range undersøgelse (observerede værdier)
et 24-ugers placebokontrolleret monoterapiforsøg blev 260 patienter med type 2-diabetes randomiseret til en af to ACTOS-behandlingsgrupper med tvungen titrering eller en placebogruppe med simuleret titrering. Behandling med et hvilket som helst tidligere antidiabetisk middel blev afbrudt seks uger før den dobbeltblinde periode. I en ACTOS 15 mg-behandlingsgruppe fik patienterne en startdosis på 7,5 mg én gang dagligt. Efter fire uger blev dosis øget til 15 mg én gang dagligt, og efter yderligere fire uger blev dosis øget til 30 mg én gang dagligt i resten af forsøget (16 uger). I den anden ACTOS-behandlingsgruppe fik patienterne en startdosis på 15 mg én gang dagligt og blev titreret til 30 mg én gang dagligt og 45 mg én gang dagligt på lignende måde. Behandling med ACTOS 15 mg, som beskrevet, gav statistisk signifikante forbedringer i HbA1c og FPG ved endpoint sammenlignet med placebo (se tabel 18).
et 16-ugers monoterapiforsøg blev 197 patienter med type 2-diabetes randomiseret til behandling med 30 mg ACTOS eller placebo én gang dagligt. Behandling med et hvilket som helst tidligere antidiabetisk middel blev afbrudt seks uger før den dobbeltblinde periode. Behandling med 30 mg ACTOS gav statistisk signifikante forbedringer i HbA1c og FPG ved endpoint sammenlignet med placebo (se tabel 19).
Kombinationsterapi
Tre 16-ugers, randomiserede, dobbeltblindede, placebokontrollerede kliniske forsøg blev udført for at evaluere virkningerne af ACTOS (15 mg og/eller 30 mg) på glykæmisk kontrol hos patienter med type 2-diabetes, som var utilstrækkeligt kontrolleret (HbA1c ≥8) %) trods nuværende behandling med et sulfonylurinstof, metformin eller insulin. Derudover blev der udført tre 24-ugers randomiserede, dobbeltblindede kliniske forsøg for at evaluere virkningerne af ACTOS 30 mg vs. ACTOS 45 mg på glykæmisk kontrol hos patienter med type 2-diabetes, som var utilstrækkeligt kontrolleret (HbA1c ≥8%) på trods af nuværende behandling med et sulfonylurinstof, metformin eller insulin. Tidligere diabetesbehandling kan have været monoterapi eller kombinationsbehandling.
Tilføjelse til sulfonylurinstofforsøg
To kliniske forsøg blev udført med ACTOS i kombination med et sulfonylurinstof. Begge undersøgelser omfattede patienter med type 2-diabetes på enhver dosis af et sulfonylurinstof, enten alene eller i kombination med et andet antidiabetisk middel. Alle andre antidiabetiske midler blev seponeret mindst tre uger før påbegyndelse af undersøgelsesbehandling.
I den første undersøgelse blev 560 patienter randomiseret til at modtage 15 mg eller 30 mg ACTOS 30 mg eller placebo én gang dagligt i 16 uger ud over deres nuværende sulfonylurinstof-kur. Behandling med ACTOS som tilføjelse til sulfonylurinstof gav statistisk signifikante forbedringer i HbA1c og FPG ved endepunktet sammenlignet med placebotillæg til sulfonylurinstof (se tabel 20).
det andet forsøg blev 702 patienter randomiseret til at modtage 30 mg eller 45 mg ACTOS én gang dagligt i 24 uger ud over deres nuværende sulfonylurinstofkur. Den gennemsnitlige reduktion fra baseline ved uge 24 i HbA1c var 1,6 % for 30 mg-dosis og 1,7 % for 45 mg-dosis (se tabel 21). Den gennemsnitlige reduktion fra baseline ved uge 24 i FPG var 52 mg/dL for 30 mg dosis og 56 mg/dL for 45 mg dosis.
Den terapeutiske effekt af ACTOS i kombination med sulfonylurinstof blev observeret hos patienter uanset sulfonylurinstofdosis.
Tilføjelse til metforminforsøg
To kliniske forsøg blev udført med ACTOS 30 mg i kombination med metformin. Begge forsøg omfattede patienter med type 2-diabetes på enhver dosis metformin, enten alene eller i kombination med et andet antidiabetisk middel. Alle andre antidiabetiske midler blev seponeret mindst tre uger før påbegyndelse af undersøgelsesbehandling.
det første forsøg blev 328 patienter randomiseret til at modtage enten 30 mg ACTOS eller placebo én gang dagligt i 16 uger ud over deres nuværende metforminbehandling. Behandling med ACTOS 30 mg som tilføjelse til metformin gav statistisk signifikante forbedringer i HbA1c og FPG ved endpoint sammenlignet med placebo-tillæg til metformin (se tabel 22).
I det andet forsøg blev 827 patienter randomiseret til at modtage enten 30 mg eller 45 mg ACTOS 30 mg én gang dagligt i 24 uger ud over deres nuværende metforminbehandling. Den gennemsnitlige reduktion fra baseline ved uge 24 i HbA1c var 0,8 % for 30 mg dosis og 1,0 % for 45 mg dosis (se tabel 23). Den gennemsnitlige reduktion fra baseline ved uge 24 i FPG var 38 mg/dL for 30 mg dosis og 51 mg/dL for 45 mg dosis.
Den terapeutiske effekt af ACTOS i kombination med metformin blev observeret hos patienter uanset metformindosis.
Tilføjelse til insulinforsøg
To kliniske forsøg blev udført med ACTOS 15 mg i kombination med insulin. Begge forsøg omfattede patienter med type 2-diabetes på insulin, enten alene eller i kombination med et andet antidiabetisk middel. Alle andre antidiabetiske midler blev seponeret før påbegyndelse af undersøgelsesbehandling. I det første forsøg blev 566 patienter randomiseret til at modtage enten 15 mg eller 30 mg ACTOS 15 mg eller placebo én gang dagligt i 16 uger ud over deres insulinbehandling. Behandling med ACTOS 30 mg som tillæg til insulin gav statistisk signifikante forbedringer i HbA1c og FPG ved endepunktet sammenlignet med placebotillæg til insulin (se tabel 24). Den gennemsnitlige daglige insulindosis ved baseline i hver behandlingsgruppe var ca. 70 enheder. Størstedelen af patienterne (75 % samlet, 86 % behandlet med placebo, 77 % behandlet med ACTOS 15 mg og 61 % behandlet med ACTOS 30 mg) havde ingen ændring i deres daglige insulindosis fra baseline til det sidste studiebesøg. Den gennemsnitlige ændring fra baseline i daglig insulindosis (inklusive patienter uden insulindosisændringer) var -3 enheder hos patienterne behandlet med ACTOS 15 mg, -8 enheder hos patienterne behandlet med ACTOS 30 mg og -1 enhed hos patienter behandlet med placebo.
det andet forsøg blev 690 patienter, der fik en median på 60 enheder insulin pr. dag, randomiseret til at modtage enten 30 mg eller 45 mg ACTOS én gang dagligt i 24 uger ud over deres nuværende insulinbehandling. Den gennemsnitlige reduktion fra baseline ved uge 24 i HbA1c var 1,2 % for 30 mg dosis og 1,5 % for 45 mg dosis. Den gennemsnitlige reduktion fra baseline ved uge 24 i FPG var 32 mg/dL for 30 mg dosis og 46 mg/dL for 45 mg dosis (se tabel 25). Den gennemsnitlige daglige insulindosis ved baseline i begge behandlingsgrupper var ca. 70 enheder. Størstedelen af patienterne (55 % samlet, 58 % behandlet med ACTOS 30 mg og 52 % behandlet med ACTOS 45 mg) havde ingen ændring i deres daglige insulindosis fra baseline til det sidste studiebesøg. Den gennemsnitlige ændring fra baseline i daglig insulindosis (inklusive patienter uden insulindosisændringer) var -5 enheder hos patienterne behandlet med ACTOS 30 mg og -8 enheder hos patienterne behandlet med ACTOS 45 mg.
Den terapeutiske effekt af ACTOS i kombination med insulin blev observeret hos patienter uanset insulindosis.
PATIENTOPLYSNINGER
ACTOS (ak-TOS) (pioglitazon) Tabletter
Læs denne medicinvejledning omhyggeligt, før du begynder at tage ACTOS 15mg, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din læge om din medicinske tilstand eller din behandling. Spørg din læge eller apoteket, hvis du har spørgsmål om ACTOS.
Hvad er den vigtigste information, jeg bør vide om ACTOS?
ACTOS kan forårsage alvorlige bivirkninger, herunder ny eller værre hjertesvigt.
- ACTOS 15mg kan få din krop til at holde på ekstra væske (væskeophobning), hvilket fører til hævelse (ødem) og vægtøgning. Ekstra kropsvæske kan gøre nogle hjerteproblemer værre eller føre til hjertesvigt. Hjertesvigt betyder, at dit hjerte ikke pumper blod godt nok
- Tag ikke ACTOS, hvis du har alvorlig hjertesvigt
- Hvis du har hjertesvigt med symptomer (såsom åndenød eller hævelse), selvom disse symptomer ikke er alvorlige, er ACTOS muligvis ikke det rigtige for dig
Ring til din læge med det samme, hvis du har nogen af følgende:
- hævelse eller væskeophobning, især i ankler eller ben
- åndenød eller åndedrætsbesvær, især når du ligger ned
- en usædvanlig hurtig vægtstigning
- usædvanlig træthed
ACTOS kan have andre alvorlige bivirkninger. Se "Hvad er de mulige bivirkninger af ACTOS?"
Hvad er ACTOS?
ACTOS 15mg er en receptpligtig medicin, der bruges sammen med diæt og motion for at forbedre blodsukkerkontrollen (glukose) hos voksne med type 2-diabetes. ACTOS er en diabetesmedicin kaldet pioglitazon, som kan tages alene eller sammen med anden diabetesmedicin.
Det vides ikke, om ACTOS er sikkert og effektivt til børn under 18 år. ACTOS anbefales ikke til børn.
ACTOS er ikke til personer med type 1-diabetes.
ACTOS 30mg er ikke til personer med diabetisk ketoacidose (forhøjede ketoner i dit blod eller urin).
Hvem bør ikke tage ACTOS?
Se "Hvad er den vigtigste information, jeg bør vide om ACTOS 15mg?"
Tag ikke ACTOS 15 mg, hvis du:
- har alvorlig hjertesvigt
- er allergisk over for nogen af indholdsstofferne i ACTOS. Se slutningen af denne medicinvejledning for en komplet liste over ingredienser i ACTOS
Tal med din læge, før du tager ACTOS, hvis du har en af disse tilstande.
Hvad skal jeg fortælle min læge, før jeg tager ACTOS 30mg?
Inden du tager ACTOS, skal du fortælle det til din læge, hvis du:
- har hjertesvigt
- har type 1 ("juvenil") diabetes eller haft diabetisk ketoacidose
- har en type diabetisk øjensygdom, der forårsager hævelse i den bagerste del af øjet (makulaødem)
- har leverproblemer
- har eller har haft kræft i blæren
- er gravid eller planlægger at blive gravid. Det vides ikke, om ACTOS 15mg kan skade dit ufødte barn. Tal med din læge, hvis du er gravid eller planlægger at blive gravid, om den bedste måde at kontrollere dit blodsukkerniveau på, mens du er gravid
- er en præmenopausal kvinde (før "livsskiftet"), som ikke har menstruation regelmæssigt eller overhovedet. ACTOS 30mg kan øge din chance for at blive gravid. Tal med din læge om præventionsvalg, mens du tager ACTOS. Fortæl din læge med det samme, hvis du bliver gravid, mens du tager ACTOS
- ammer eller planlægger at amme. Det vides ikke, om ACTOS udskilles i din mælk, og om det kan skade din baby. Tal med din læge om den bedste måde at kontrollere dit blodsukkerniveau, mens du ammer
Fortæl din læge om al den medicin, du tager herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler.
ACTOS 30mg og nogle af dine andre lægemidler kan påvirke hinanden. Du skal muligvis have ændret din dosis af ACTOS 15 mg eller visse andre lægemidler.
Kend den medicin du tager. Hold en liste over din medicin, og vis den til din læge og apotek, før du begynder på en ny medicin. De vil fortælle dig, om det er i orden at tage ACTOS 15 mg sammen med anden medicin.
Hvordan skal jeg tage ACTOS 15mg?
- Tag ACTOS 15 mg nøjagtigt som din læge fortæller dig at tage det
- Din læge kan ændre din dosis af ACTOS. Du må ikke ændre din ACTOS-dosis, medmindre din læge fortæller dig det
- ACTOS kan ordineres alene eller sammen med anden diabetesmedicin. Dette afhænger af, hvor godt dit blodsukker er kontrolleret
- Tag ACTOS 15 mg én gang hver dag, med eller uden mad
- Hvis du glemmer en dosis ACTOS 15 mg, skal du tage din næste dosis som foreskrevet, medmindre din læge fortæller dig anderledes. Tag ikke to doser ad gangen den næste dag
- Hvis du tager for meget ACTOS, skal du straks ringe til din læge eller gå til den nærmeste skadestue
- Hvis din krop er under stress som f.eks. feber, infektion, ulykke eller operation, skal dosis af din diabetesmedicin muligvis ændres. Ring til din læge med det samme
- Følg dine kost- og træningsprogrammer, og test dit blodsukker regelmæssigt, mens du tager ACTOS
- Din læge bør tage visse blodprøver, før du begynder, og mens du tager ACTOS
- Din læge bør også tage hæmoglobin A1C-test for at kontrollere, hvor godt dit blodsukker er kontrolleret med ACTOS
- Din læge bør tjekke dine øjne regelmæssigt, mens du tager ACTOS
Hvad er de mulige bivirkninger af ACTOS?
ACTOS kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om ACTOS?"
- lavt blodsukker (hypoglykæmi). Dette kan ske, hvis du springer måltider over, hvis du også bruger anden medicin, der sænker blodsukkeret, eller hvis du har visse medicinske problemer. Stivhed, svimmelhed, rystelser eller sult kan forekomme, hvis dit blodsukker er for lavt. Ring til din læge, hvis lavt blodsukker er et problem for dig
- leverproblemer. Ring til din læge med det samme, hvis du har:
- kvalme eller opkastning
- mavesmerter
- usædvanlig eller uforklarlig træthed
- mistet appetiten
- mørk urin
- gulfarvning af din hud eller det hvide i dine øjne
- blærekræft. Der kan være en øget chance for at få blærekræft, når du tager ACTOS. Du bør ikke tage ACTOS 15 mg, hvis du er i behandling for blærekræft. Fortæl din læge med det samme, hvis du har nogle af følgende symptomer på blærekræft:
- blod eller en rød farve i din urin
- et øget vandladningsbehov
- smerte, mens du tisser
- brækkede knogler (brud). Normalt i hånden, overarmen eller foden hos kvinder. Tal med din læge for at få råd om, hvordan du holder dine knogler sunde.
- diabetisk øjensygdom med hævelse bagerst i øjet (makulaødem). Fortæl din læge med det samme, hvis du har ændringer i dit syn. Din læge bør tjekke dine øjne regelmæssigt
- frigivelse af et æg fra en æggestok hos en kvinde (ægløsning), hvilket fører til graviditet. Ægløsning kan ske, når præmenopausale kvinder, der ikke har regelmæssige månedlige menstruationer, tager ACTOS. Dette kan øge din chance for at blive gravid
- forkølelseslignende symptomer (øvre luftvejsinfektion)
- hovedpine
- sinus infektion
- muskelsmerter
- ondt i halsen
De mest almindelige bivirkninger af ACTOS omfatter:
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle bivirkningerne af ACTOS. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare ACTOS 15mg?
- Opbevar ACTOS 15mg ved 68°F til 77°F (20°C til 25°C). Opbevar ACTOS i den originale beholder og beskyt mod lys
- Hold ACTOS-flasken tæt lukket, og hold tabletterne tørre
- Opbevar ACTOS og al medicin utilgængeligt for børn
Generel information om sikker og effektiv brug af ACTOS
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke ACTOS til en tilstand, som den ikke er ordineret til. Giv ikke ACTOS til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne medicinvejledning opsummerer de vigtigste oplysninger om ACTOS. Hvis du vil have mere information, så tal med din læge. Du kan bede din læge eller apoteket om oplysninger om ACTOS, som er skrevet til sundhedspersonale. For mere information, gå til www.actos.com eller ring på 1-877-825-3327.
Hvad er ingredienserne i ACTOS 15mg?
Aktiv ingrediens: pioglitazon Inaktive ingredienser: lactos 15mge monohydrat, hydroxypropylcellulose, carboxymethylcellulose calcium og magnesiumstearat
Denne medicinvejledning er godkendt af US Food and Drug Administration.
