Amaryl 1mg, 2mg, 4mg Glimepiride Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Amaryl 1mg, og hvordan bruges det?
Amaryl 4mg er en receptpligtig medicin, der bruges til at behandle symptomerne på type 2-diabetes mellitus. Amaryl 4mg kan bruges alene eller sammen med anden medicin.
Amaryl 2mg tilhører en klasse af lægemidler kaldet antidiabetika, sulfonylurinstoffer.
Det vides ikke, om Amaryl er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Amaryl?
Amaryl kan forårsage alvorlige bivirkninger, herunder:
- bleg eller gulnet hud,
- mørk farvet urin,
- forvirring,
- svaghed, og
- feber
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Amaryl omfatter:
- hovedpine,
- svimmelhed,
- svaghed,
- kvalme, og
- lavt blodsukker
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Amaryl. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
AMARYL er et oralt sulfonylurinstof, der indeholder det aktive stof glimepirid. Kemisk identificeres glimepirid som 1-[[p-[2-(3-ethyl-4-methyl-2-oxo-3-pyrrolin-1-carboxamido)ethyl]phenyl]sulfonyl]-3-(trans-4- methylcyclohexyl)urinstof (C24H34N4O5S) med en molekylvægt på 490,62. Glimepirid er et hvidt til gulligt-hvidt, krystallinsk, lugtfrit til praktisk taget lugtløst pulver og er praktisk talt uopløseligt i vand. Strukturformlen er:
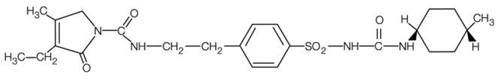
AMARYL tabletter indeholder den aktive ingrediens glimepirid og følgende inaktive ingredienser: laktose (vandfri), natriumstivelsesglykolat, povidon, mikrokrystallinsk cellulose og magnesiumstearat. Derudover indeholder AMARYL 1 mg tabletter jernoxidrød, AMARYL 2 mg tabletter indeholder jernoxidgul og FD&C Blue #2 Aluminium Lake, og AMARYL 4 mg tabletter indeholder FD&C Blue #2 Aluminium Lake.
INDIKATIONER
AMARYL 2mg er indiceret som et supplement til diæt og motion for at forbedre glykæmisk kontrol hos voksne med type 2-diabetes mellitus [se Kliniske Studier ].
Vigtige brugsbegrænsninger
AMARYL bør ikke anvendes til behandling af type 1 diabetes mellitus eller diabetisk ketoacidose, da det ikke ville være effektivt i disse situationer.
DOSERING OG ADMINISTRATION
Anbefalet dosering
AMARYL 1mg bør indgives sammen med morgenmad eller dagens første hovedmåltid.
Den anbefalede startdosis af AMARYL er 1 mg eller 2 mg én gang dagligt. Patienter med øget risiko for hypoglykæmi (f.eks. ældre eller patienter med nedsat nyrefunktion) bør startes med 1 mg én gang dagligt [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Efter at have nået en daglig dosis på 2 mg, kan yderligere dosisforøgelser foretages i trin på 1 mg eller 2 mg baseret på patientens glykæmiske respons. Uptitrering bør ikke forekomme hyppigere end hver 1-2 uge. Et konservativt titreringsskema anbefales til patienter med øget risiko for hypoglykæmi [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Den maksimale anbefalede dosis er 8 mg én gang dagligt.
Patienter, der bliver overført til AMARYL 1 mg fra sulfonylurinstoffer med længere halveringstid (f.eks. chlorpropamid), kan have overlappende lægemiddeleffekt i 1-2 uger og bør monitoreres passende for hypoglykæmi.
Når colesevelam administreres sammen med glimepirid, reduceres maksimal plasmakoncentration og total eksponering for glimepirid. Derfor bør AMARYL 2 mg administreres mindst 4 timer før colesevelam.
HVORDAN LEVERET
Doseringsformer og styrker
AMARYL 4mg er formuleret som tabletter af:
- 1 mg (lyserød, flad, aflang med indhakkede sider ved dobbelt halvering, præget med "AMA RYL" på den ene side)
- 2 mg (grøn, flad, aflang med indhakkede sider ved dobbelt halvering, præget med "AMA RYL" på den ene side)
- 4 mg (blå, flad, aflang med indhakkede sider i dobbelt halvering, præget med "AMA RYL" på den ene side)
Opbevaring og håndtering
AMARYL tabletter fås i følgende styrker og pakningsstørrelser:
1 mg (lyserød, flad, aflang med hak i siderne i dobbelt halvering, præget med "AMA RYL" på den ene side) i flasker á 100 stk. NDC 0039-0221-10)
2 mg (grøn, flad, aflang med hak i siderne i dobbelt halvering, præget med "AMA RYL" på den ene side) i flasker á 100 stk. NDC 0039-0222-10)
4 mg (blå, flad, aflang med indhakkede sider ved dobbelt halvering, præget med "AMA RYL" på den ene side) i flasker á 100 stk. NDC 0039-0223-10)
Opbevares ved 25°C (77°F); udflugter tilladt til 20 - 25°C (68 - 77°F) (se USP kontrolleret rumtemperatur ).
Dispenser i godt lukkede beholdere med sikkerhedslukninger.
sanofi-aventis US LLC, Bridgewater, NJ 08807, A SANOFI COMPANY. Revideret dec 2016
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet mere detaljeret nedenfor og andetsteds i mærkningen:
- Hypoglykæmi [se ADVARSLER OG FORHOLDSREGLER ]
- Hæmolytisk anæmi [se ADVARSLER OG FORHOLDSREGLER ]
I kliniske forsøg var de mest almindelige bivirkninger ved AMARYL 4 mg hypoglykæmi, svimmelhed, asteni, hovedpine og kvalme.
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Ca. 2.800 patienter med type 2-diabetes er blevet behandlet med AMARYL 4mg i de kontrollerede kliniske forsøg. I disse forsøg blev ca. 1.700 patienter behandlet med AMARYL i mindst 1 år.
Tabel 1 opsummerer andre bivirkninger end hypoglykæmi, der blev rapporteret i 11 poolede placebokontrollerede forsøg, uanset om de anses for at være muligvis eller sandsynligvis relateret til undersøgelsesmedicin. Behandlingsvarighed varierede fra 13 uger til 12 måneder. Termer, der er rapporteret, repræsenterer dem, der forekom med en incidens på ≥ 5 % blandt AMARYL-behandlede patienter og mere almindeligt end hos patienter, der fik placebo.
Hypoglykæmi
I et randomiseret, dobbeltblindt, placebokontrolleret monoterapiforsøg af 14 ugers varighed gennemgik patienter, der allerede var i behandling med sulfonylurinstof, en 3-ugers udvaskningsperiode og blev derefter randomiseret til AMARYL 1 mg, 4 mg, 8 mg eller placebo. Patienter randomiseret til AMARYL 4 mg eller 8 mg gennemgik tvungen titrering fra en startdosis på 1 mg til disse endelige doser, som tolereret [se Kliniske Studier ]. Den samlede forekomst af mulig hypoglykæmi (defineret ved tilstedeværelsen af mindst ét symptom, som investigator mente kunne være relateret til hypoglykæmi; en samtidig glukosemåling var ikke nødvendig) var 4 % for AMARYL 1 mg, 17 % for AMARYL 4 mg, 16 % for AMARYL 8 mg og 0 % for placebo. Alle disse begivenheder var selvbehandlede.
I et randomiseret, dobbeltblindt, placebokontrolleret monoterapiforsøg af 22 ugers varighed fik patienterne en startdosis på enten 1 mg AMARYL eller placebo dagligt. Dosis af AMARYL 2 mg blev titreret til et fastende plasmaglucosemål på 90-150 mg/dL. De endelige daglige doser af AMARYL 2 mg var 1, 2, 3, 4, 6 eller 8 mg [se Kliniske Studier ]. Den samlede forekomst af mulig hypoglykæmi (som defineret ovenfor for det 14-ugers forsøg) for AMARYL vs. placebo var 19,7% vs. 3,2%. Alle disse begivenheder var selvbehandlet.
Vægtøgning: AMARYL kan, som alle sulfonylurinstoffer, forårsage vægtøgning [se Kliniske Studier ].
Allergiske reaktioner: kliniske forsøg forekom allergiske reaktioner, såsom kløe, erytem, nældefeber og morbilliforme eller makulopapulære udbrud hos mindre end 1 % af AMARYL-behandlede patienter. Disse kan forsvinde trods fortsat behandling med AMARYL. Der er postmarketing rapporter om mere alvorlige allergiske reaktioner (f.eks. dyspnø, hypotension, shock) [se ADVARSLER OG FORHOLDSREGLER ].
Laboratorieprøver
Forhøjet serumalaninaminotransferase (ALT): I 11 poolede placebokontrollerede forsøg med AMARYL udviklede 1,9 % af AMARYL-behandlede patienter og 0,8 % af placebo-behandlede patienter serum-ALAT større end 2 gange den øvre grænse for referenceområdet.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af AMARYL efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
- Alvorlige overfølsomhedsreaktioner, herunder anafylaksi, angioødem og Stevens-Johnsons syndrom [se ADVARSLER OG FORHOLDSREGLER ]
- Hæmolytisk anæmi hos patienter med og uden G6PD-mangel [se ADVARSLER OG FORHOLDSREGLER ]
- Nedsat leverfunktion (f.eks. med kolestase og gulsot) samt hepatitis, som kan udvikle sig til leversvigt.
- Porphyria cutanea tarda, lysfølsomhedsreaktioner og allergisk vaskulitis
- Leukopeni, agranulocytose, aplastisk anæmi og pancytopeni
- Trombocytopeni (herunder alvorlige tilfælde med blodpladetal mindre end 10.000/μL) og trombocytopenisk purpura
- Hepatiske porfyri-reaktioner og disulfiram-lignende reaktioner
- Hyponatriæmi og syndrom af uhensigtsmæssig antidiuretisk hormonsekretion (SIADH), oftest hos patienter, der er på anden medicin, eller som har medicinske tilstande, der vides at forårsage hyponatriæmi eller øge frigivelsen af antidiuretisk hormon
- Dysgeusi
- Alopeci
DRUGSINTERAKTIONER
Lægemidler, der påvirker glukosemetabolismen
En række medikamenter påvirker glukosemetabolismen og kan kræve AMARYL 4 mg dosisjustering og særlig tæt overvågning for hypoglykæmi eller forværret glykæmisk kontrol.
Følgende er eksempler på medicin, der kan øge den glukosesænkende effekt af sulfonylurinstoffer, herunder AMARYL 2mg, hvilket øger modtageligheden for og/eller intensiteten af hypoglykæmi: oral antidiabetisk medicin, pramlintidacetat, insulin, angiotensin-konverterende enzym (ACE)-hæmmere, H2-receptorantagonister, fibrater, propoxyphen, pentoxifyllin, somatostatinanaloger, anabolske steroider og androgener, cyclophosphamid, phenyramidol, guanethidin, fluconazol, sulfinpyrazon, tetracycliner, clarithromycin, disopyramid, quinolo- cin, disopyramid og quinolotin, som er stærkt bundet til protein, ikke-steroide antiinflammatoriske lægemidler, salicylater, sulfonamider, chloramphenicol, coumariner, probenecid og monoaminoxidasehæmmere. Når disse lægemidler administreres til en patient, der får AMARYL, skal patienten overvåges nøje for hypoglykæmi. Når disse lægemidler udtages fra en patient, der får AMARYL 2 mg, skal patienten overvåges nøje for forværring af den glykæmiske kontrol.
Følgende er eksempler på medicin, der kan reducere den glukosesænkende virkning af sulfonylurinstoffer, inklusive AMARYL, hvilket fører til forværring af glykæmisk kontrol: danazol, glucagon, somatropin, proteasehæmmere, atypiske antipsykotiske lægemidler (f.eks. olanzapin og clozapin), barbiturater, diazoxid, laxativ, , rifampin, thiazider og andre diuretika, kortikosteroider, phenothiaziner, thyreoideahormoner, østrogener, orale præventionsmidler, phenytoin, nikotinsyre, sympatomimetika (f.eks. epinephrin, albuterol, terbutalin) og isoniazid. Når disse lægemidler administreres til en patient, der får AMARYL 2 mg, skal patienten overvåges nøje for forværring af den glykæmiske kontrol. Når disse lægemidler seponeres fra en patient, der får AMARYL 2 mg, skal patienten overvåges nøje for hypoglykæmi.
Betablokkere, clonidin og reserpin kan føre til enten forstærkning eller svækkelse af AMARYL's glukosesænkende effekt.
Både akut og kronisk alkoholindtagelse kan forstærke eller svække den glukosesænkende virkning af AMARYL 1 mg på en uforudsigelig måde.
Tegnene på hypoglykæmi kan være reduceret eller fraværende hos patienter, der tager sympatolytiske lægemidler, såsom betablokkere, clonidin, guanethidin og reserpin.
Miconazol
En potentiel interaktion mellem oral miconazol og sulfonylurinstoffer, der fører til alvorlig hypoglykæmi, er blevet rapporteret. Om denne interaktion også forekommer med andre doseringsformer af miconazol vides ikke.
Cytokrom P450 2C9 Interaktioner
Der kan være en interaktion mellem glimepirid og hæmmere (f.eks. fluconazol) og inducere (f.eks. rifampin) af cytokrom P450 2C9. Fluconazol kan hæmme metabolismen af glimepirid, hvilket kan forårsage øgede plasmakoncentrationer af glimepirid, hvilket kan føre til hypoglykæmi. Rifampin kan inducere metabolismen af glimepirid, hvilket kan forårsage nedsatte plasmakoncentrationer af glimepirid, hvilket kan føre til forværring af den glykæmiske kontrol.
Samtidig administration af Colesevelam
Colesevelam kan reducere den maksimale plasmakoncentration og total eksponering af glimepirid, når de to administreres samtidigt. Absorptionen reduceres dog ikke, når glimepirid administreres 4 timer før colesevelam. Derfor bør AMARYL administreres mindst 4 timer før colesevelam.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Hypoglykæmi
Alle sulfonylurinstoffer, inklusive AMARYL, kan forårsage alvorlig hypoglykæmi [se BIVIRKNINGER ]. Patientens evne til at koncentrere sig og reagere kan blive svækket som følge af hypoglykæmi. Disse svækkelser kan udgøre en risiko i situationer, hvor disse evner er særligt vigtige, såsom at køre bil eller betjene andre maskiner. Alvorlig hypoglykæmi kan føre til bevidstløshed eller kramper og kan resultere i midlertidig eller permanent svækkelse af hjernefunktionen eller død.
Patienter skal uddannes til at genkende og håndtere hypoglykæmi. Vær forsigtig, når du starter og øger AMARYL 2 mg doser hos patienter, som kan være disponeret for hypoglykæmi (f.eks. ældre, patienter med nedsat nyrefunktion, patienter på anden antidiabetisk medicin). Svækkede eller underernærede patienter og dem med binyre-, hypofyse- eller leverinsufficiens er særligt modtagelige for den hypoglykæmiske virkning af glukosesænkende medicin. Hypoglykæmi er også mere tilbøjelige til at opstå, når kalorieindtaget er mangelfuldt, efter hård eller langvarig træning, eller når alkohol indtages.
Tidlige advarselssymptomer på hypoglykæmi kan være anderledes eller mindre udtalte hos patienter med autonom neuropati, ældre og hos patienter, der tager beta-adrenerge blokerende medicin eller andre sympatolytiske midler. Disse situationer kan resultere i alvorlig hypoglykæmi, før patienten er opmærksom på hypoglykæmien.
Overfølsomhedsreaktioner
Der har efter markedsføring været rapporter om overfølsomhedsreaktioner hos patienter behandlet med AMARYL, herunder alvorlige reaktioner såsom anafylaksi, angioødem og Stevens-Johnsons syndrom. Hvis der er mistanke om en overfølsomhedsreaktion, skal du straks seponere AMARYL, vurdere for andre potentielle årsager til reaktionen og igangsætte alternativ behandling for diabetes.
Hæmolytisk anæmi
Sulfonylurinstoffer kan forårsage hæmolytisk anæmi hos patienter med glucose 6-phosphat dehydrogenase (G6PD) mangel. Da AMARYL 4mg er et sulfonylurinstof, skal du udvise forsigtighed hos patienter med G6PD-mangel og overveje brugen af et ikke-sulfonylurinstof-alternativ. Der er også postmarketing rapporter om hæmolytisk anæmi hos patienter, der fik AMARYL 1mg, som ikke havde kendt G6PD-mangel [se BIVIRKNINGER ].
Øget risiko for kardiovaskulær dødelighed med sulfonylurinstoffer
Administration af orale hypoglykæmiske lægemidler er blevet rapporteret at være forbundet med øget kardiovaskulær dødelighed sammenlignet med behandling med diæt alene eller diæt plus insulin. Denne advarsel er baseret på undersøgelsen udført af University Group Diabetes Program (UGDP), et langsigtet, prospektivt klinisk forsøg designet til at evaluere effektiviteten af glukosesænkende lægemidler til at forebygge eller forsinke vaskulære komplikationer hos patienter med ikke-insulinafhængige diabetes. Undersøgelsen involverede 823 patienter, der blev tilfældigt tildelt en af fire behandlingsgrupper. UGDP rapporterede, at patienter behandlet i 5 til 8 år med diæt plus en fast dosis tolbutamid (1,5 gram pr. dag) havde en kardiovaskulær dødelighed på ca. 2-½ gange patienter behandlet med diæt alene. En signifikant stigning i total dødelighed blev ikke observeret, men brugen af tolbutamid blev afbrudt på grund af stigningen i kardiovaskulær dødelighed, hvilket begrænsede muligheden for undersøgelsen for at vise en stigning i den samlede dødelighed. På trods af uenighed om fortolkningen af disse resultater giver resultaterne af UGDP-undersøgelsen et tilstrækkeligt grundlag for denne advarsel. Patienten skal informeres om de potentielle risici og fordele ved AMARYL 4 mg og om alternative behandlingsformer. Selvom kun ét lægemiddel i sulfonylurinstofklassen (tolbutamid) blev inkluderet i denne undersøgelse, er det klogt ud fra et sikkerhedssynspunkt at overveje, at denne advarsel også kan gælde for andre orale hypoglykæmiske lægemidler i denne klasse i lyset af deres tætte ligheder med hensyn til måden virkning og kemisk struktur.
Makrovaskulære resultater
Der har ikke været kliniske undersøgelser, der har fastslået afgørende beviser for makrovaskulær risikoreduktion med AMARYL eller noget andet antidiabetisk lægemiddel.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese og svækkelse af fertilitet
Undersøgelser med rotter i doser på op til 5000 ppm i fuldfoder (ca. 340 gange den maksimalt anbefalede humane dosis baseret på overfladeareal) i 30 måneder viste ingen tegn på carcinogenese. Hos mus resulterede administration af glimepirid i 24 måneder i en stigning i dannelsen af benign pancreas-adenom, som var dosisrelateret og menes at være resultatet af kronisk pancreasstimulering. Der blev ikke observeret adenomdannelse hos mus ved en dosis på 320 ppm i fuldfoder eller 46-54 mg/kg legemsvægt/dag. Dette er omkring 35 gange den maksimale humane anbefalede dosis på 8 mg én gang dagligt baseret på overfladeareal.
Glimepirid var ikke-mutagent i en række af in vitro og in vivo mutagenicitetsundersøgelser (Ames-test, somatisk cellemutation, kromosomafvigelse, ikke-planlagt DNA-syntese og muse-mikronkernetest).
Der var ingen effekt af glimepirid på fertilitet hos hanmus hos dyr eksponeret op til 2500 mg/kg legemsvægt (> 1.700 gange den maksimalt anbefalede humane dosis baseret på overfladeareal). Glimepirid havde ingen effekt på fertiliteten hos han- og hunrotter givet op til 4000 mg/kg legemsvægt (ca. 4.000 gange den maksimalt anbefalede humane dosis baseret på overfladeareal).
Brug i specifikke populationer
Graviditet
Graviditetskategori C
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af AMARYL 2mg hos gravide kvinder. I dyreforsøg var der ingen stigning i medfødte anomalier, men en stigning i føtale dødsfald forekom hos rotter og kaniner ved glimepiriddoser 50 gange (rotter) og 0,1 gange (kaniner) den maksimalt anbefalede humane dosis (baseret på kropsoverfladeareal). Denne føtotoksicitet, der kun observeres ved doser, der inducerer maternel hypoglykæmi, menes at være direkte relateret til den farmakologiske (hypoglykæmiske) virkning af glimepirid og er på lignende måde blevet observeret med andre sulfonylurinstoffer. AMARYL bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret. Da data tyder på, at unormalt blodsukker under graviditet er forbundet med en højere forekomst af medfødte abnormiteter, bør diabetesbehandling under graviditet holde blodsukkeret så tæt på det normale som muligt.
Ikke-ratatogene virkninger
Længerevarende alvorlig hypoglykæmi (4 til 10 dage) er blevet rapporteret hos nyfødte født af mødre, der fik sulfonylurinstof på tidspunktet for fødslen.
Ammende mødre
Det vides ikke, om AMARYL 1mg udskilles i modermælk. Under præ- og postnatale undersøgelser med rotter var signifikante koncentrationer af glimepirid til stede i modermælk og ungernes serum. Afkom af rotter, der blev udsat for høje niveauer af glimepirid under graviditet og amning, udviklede skeletdeformiteter bestående af forkortning, fortykkelse og bøjning af humerus i den postnatale periode. Disse skeletdeformationer blev bestemt til at være resultatet af amning fra mødre udsat for glimepirid. Baseret på disse dyredata og potentialet for hypoglykæmi hos et ammende spædbarn, bør der træffes en beslutning om, hvorvidt amningen skal afbrydes eller AMARYL 2 mg skal seponeres, under hensyntagen til vigtigheden af AMARYL for moderen.
Pædiatrisk brug
Farmakokinetikken, effektiviteten og sikkerheden af AMARYL 4mg er blevet evalueret hos pædiatriske patienter med type 2-diabetes som beskrevet nedenfor. AMARYL 4mg anbefales ikke til pædiatriske patienter på grund af dets negative virkninger på kropsvægt og hypoglykæmi.
Farmakokinetikken af en enkeltdosis på 1 mg AMARYL blev evalueret hos 30 patienter med type 2-diabetes (mænd = 7; kvinder = 23) mellem 10 og 17 år. Den gennemsnitlige (± SD) AUC (339±203 ng·time/mL), Cmax (102±48 ng/mL) og t½ (3,1±1,7 timer) for glimepirid var sammenlignelige med historiske data fra voksne (AUC(0-sidste) ) 315±96 ng·time/ml, Cmax 103±34 ng/mL og t½ 5,3±4,1 timer).
Sikkerheden og effekten af AMARYL hos pædiatriske patienter blev evalueret i et enkelt-blindt, 24-ugers forsøg, der randomiserede 272 patienter (8-17 år) med type 2-diabetes til AMARYL (n=135) eller metformin (n=137) ). Både behandlingsnaive patienter (dem, der kun blev behandlet med diæt og motion i mindst 2 uger før randomisering) og tidligere behandlede patienter (dem, der tidligere er behandlet eller i øjeblikket behandles med anden oral antidiabetisk medicin i mindst 3 måneder) var berettiget til at deltage. Patienter, der modtog orale antidiabetika på tidspunktet for studiestart, ophørte med disse lægemidler før randomisering uden en udvaskningsperiode. AMARYL blev påbegyndt med 1 mg og derefter titreret op til 2, 4 eller 8 mg (gennemsnitlig sidste dosis 4 mg) til og med uge 12, målrettet mod en selvovervåget fastende blodsukker i fingerstik
Efter 24 uger var den overordnede gennemsnitlige behandlingsforskel i HbA1c mellem AMARYL 4 mg og metformin 0,2 %, hvilket favoriserede metformin (95 % konfidensinterval -0,3 % til +0,6 %). Baseret på disse resultater opfyldte forsøget ikke sit primære mål om at vise en tilsvarende reduktion i HbA1c med AMARYL 4 mg sammenlignet med metformin.
Bivirkningsprofilen hos pædiatriske patienter behandlet med AMARYL 2 mg svarede til den, der blev observeret hos voksne [se BIVIRKNINGER ].
Hypoglykæmiske hændelser dokumenteret ved blodsukkerværdier
Geriatrisk brug
kliniske forsøg med AMARYL 2 mg var 1053 ud af 3491 patienter (30%) > 65 år. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse patienter og yngre patienter, men større følsomhed hos nogle ældre personer kan ikke udelukkes.
Der var ingen signifikante forskelle i glimepirids farmakokinetik mellem patienter med type 2-diabetes ≤ 65 år (n=49) og patienter > 65 år (n=42) [se KLINISK FARMAKOLOGI ].
Glimepirid udskilles i det væsentlige via nyrerne. Ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion. Derudover kan hypoglykæmi være svær at genkende hos ældre [se DOSERING OG ADMINISTRATION og ADVARSLER OG FORHOLDSREGLER ]. Vær forsigtig, når du starter AMARYL og øger dosis af AMARYL 1 mg i denne patientpopulation.
Nedsat nyrefunktion
For at minimere risikoen for hypoglykæmi er den anbefalede startdosis af AMARYL 1 mg dagligt til alle patienter med type 2-diabetes og nedsat nyrefunktion [se DOSERING OG ADMINISTRATION og ADVARSLER OG FORHOLDSREGLER ].
Et titreringsstudie med multiple doser blev udført med 16 patienter med type 2-diabetes og nedsat nyrefunktion ved brug af doser fra 1 mg til 8 mg dagligt i 3 måneder. Baseline kreatininclearance varierede fra 10-60 ml/min. Farmakokinetikken af AMARYL blev evalueret i multiple-dosis-titreringsundersøgelsen, og resultaterne var i overensstemmelse med dem, der blev observeret hos patienter inkluderet i et enkelt-dosis studie. I begge undersøgelser steg den relative totale clearance af AMARYL, når nyrefunktionen var nedsat. Begge undersøgelser viste også, at eliminationen af de to hovedmetabolitter var reduceret hos patienter med nedsat nyrefunktion [se KLINISK FARMAKOLOGI ].
OVERDOSIS
En overdosis af AMARYL 2 mg, som med andre sulfonylurinstoffer, kan forårsage alvorlig hypoglykæmi. Milde episoder af hypoglykæmi kan behandles med oral glucose. Alvorlige hypoglykæmiske reaktioner udgør medicinske nødsituationer, der kræver øjeblikkelig behandling. Alvorlig hypoglykæmi med koma, krampeanfald eller neurologisk svækkelse kan behandles med glukagon eller intravenøs glucose. Fortsat observation og yderligere kulhydratindtagelse kan være nødvendig, fordi hypoglykæmi kan opstå igen efter tilsyneladende klinisk bedring [se ADVARSLER OG FORHOLDSREGLER ].
KONTRAINDIKATIONER
AMARYL er kontraindiceret til patienter med en historie med en overfølsomhedsreaktion over for:
- Glimepirid eller nogen af produktets ingredienser [se ADVARSLER OG FORHOLDSREGLER ].
Sulfonamidderivater: Patienter, der har udviklet en allergisk reaktion over for sulfonamidderivater, kan udvikle en allergisk reaktion over for AMARYL. Brug ikke AMARYL 4mg til patienter, som tidligere har haft en allergisk reaktion over for sulfonamidderivater.
Rapporterede overfølsomhedsreaktioner omfatter kutane eruptioner med eller uden kløe samt mere alvorlige reaktioner (f.eks. anafylaksi, angioødem, Stevens-Johnsons syndrom, dyspnø) [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Glimepirid sænker primært blodsukkeret ved at stimulere frigivelsen af insulin fra pancreas betaceller. Sulfonylurinstoffer binder sig til sulfonylurinstof-receptoren i pancreas beta-celle plasmamembran, hvilket fører til lukning af den ATP-følsomme kaliumkanal, hvorved frigivelsen af insulin stimuleres.
Farmakodynamik
Hos raske forsøgspersoner var tiden til at nå maksimal effekt (minimum blodsukkerkoncentrationer) ca. 2-3 timer efter enkelt orale doser af AMARYL. Effekten af AMARYL på HbA1c, fastende plasmaglukose og post-prandial glucose er blevet vurderet i kliniske forsøg [se Kliniske Studier ].
Farmakokinetik
Absorption
Undersøgelser med enkelt orale doser af glimepirid hos raske forsøgspersoner og med multiple orale doser hos patienter med type 2 diabetes viste maksimale lægemiddelkoncentrationer (Cmax) 2 til 3 timer efter dosis. Når glimepirid blev givet sammen med måltider, faldt den gennemsnitlige Cmax og AUC (areal under kurven) med henholdsvis 8 % og 9 %.
Glimepirid akkumuleres ikke i serum efter gentagen dosering. Glimepirids farmakokinetik adskiller sig ikke mellem raske forsøgspersoner og patienter med type 2-diabetes. Clearance af glimepirid efter oral administration ændres ikke over dosisområdet 1 mg til 8 mg, hvilket indikerer lineær farmakokinetik.
Hos raske forsøgspersoner var de intra- og interindividuelle variationer af glimepirids farmakokinetiske parametre henholdsvis 15-23 % og 24-29 %.
Fordeling
Efter intravenøs dosering til raske forsøgspersoner var distributionsvolumenet (Vd) 8,8 l (113 ml/kg), og den totale kropsclearance (CL) var 47,8 ml/min. Proteinbindingen var større end 99,5 %.
Metabolisme
Glimepirid metaboliseres fuldstændigt ved oxidativ biotransformation efter enten en intravenøs eller oral dosis. De vigtigste metabolitter er cyclohexylhydroxymethylderivatet (M1) og carboxylderivatet (M2). Cytokrom P450 2C9 er involveret i biotransformationen af glimepirid til M1. M1 metaboliseres yderligere til M2 af et eller flere cytosoliske enzymer. M2 er inaktiv. Hos dyr besidder M1 omkring en tredjedel af glimepirids farmakologiske aktivitet, men det er uklart, om M1 resulterer i klinisk betydningsfulde effekter på blodsukker hos mennesker.
Udskillelse
Når 14C-glimepirid blev givet oralt til 3 raske mandlige forsøgspersoner, blev ca. 60 % af den samlede radioaktivitet genfundet i urinen på 7 dage. M1 og M2 udgjorde 80-90 % af den genfundne radioaktivitet i urinen. Forholdet mellem M1 og M2 i urinen var ca. 3:2 hos to forsøgspersoner og 4:1 hos én forsøgsperson. Ca. 40 % af den samlede radioaktivitet blev genfundet i fæces. M1 og M2 tegnede sig for ca. 70 % (forholdet mellem M1 og M2 var 1:3) af den genfundne radioaktivitet i fæces. Intet moderlægemiddel blev genfundet fra urin eller afføring. Efter intravenøs dosering til patienter blev der ikke observeret nogen signifikant galdeudskillelse af glimepirid eller dets M1-metabolit.
Geriatriske patienter
En sammenligning af glimepirids farmakokinetik hos patienter med type 2-diabetes ≤ 65 år og patienter > 65 år blev evalueret i et flerdosisstudie med AMARYL 6 mg dagligt. Der var ingen signifikante forskelle i glimepirids farmakokinetik mellem de to aldersgrupper. Den gennemsnitlige AUC ved steady state for de ældre patienter var ca. 13 % lavere end for de yngre patienter; den gennemsnitlige vægtjusterede clearance for de ældre patienter var ca. 11 % højere end for de yngre patienter.
Køn
Der var ingen forskelle mellem mænd og kvinder i glimepirids farmakokinetik, når der blev justeret for forskelle i kropsvægt.
Race
Der er ikke udført undersøgelser for at vurdere effekten af race på glimepirids farmakokinetik, men i placebokontrollerede forsøg med AMARYL 2mg hos patienter med type 2-diabetes var reduktionen i HbA sammenlignelig hos kaukasiere (n = 536), sorte (n = 63) , og latinamerikanere (n = 63).
Nedsat nyrefunktion
Et enkelt-dosis, åbent studie AMARYL 3 mg blev administreret til patienter med mild, moderat og svær nyreinsufficiens som estimeret ved kreatininclearance (CLcr): Gruppe I bestod af 5 patienter med let nedsat nyrefunktion (CLcr > 50 ml/min. ), gruppe II bestod af 3 patienter med moderat nedsat nyrefunktion (CLcr = 20-50 ml/min) og gruppe III bestod af 7 patienter med alvorligt nedsat nyrefunktion (CLcr
Nedsat leverfunktion
Det vides ikke, om der er en effekt af nedsat leverfunktion på AMARYL 1 mg farmakokinetik, fordi farmakokinetikken af AMARYL 1 mg ikke er blevet tilstrækkeligt evalueret hos patienter med nedsat leverfunktion.
Overvægtige patienter
Farmakokinetikken af glimepirid og dets metabolitter blev målt i et enkeltdosisstudie med 28 patienter med type 2-diabetes, som enten havde normal kropsvægt eller var sygeligt overvægtige. Mens tmax, clearance og distributionsvolumen af glimepirid hos de sygeligt overvægtige patienter svarede til dem i normalvægtsgruppen, havde de sygeligt overvægtige lavere Cmax og AUC end dem med normal kropsvægt. De gennemsnitlige Cmax, AUC0-24, AUC0-∞-værdier for glimepirid hos normale vs. sygeligt overvægtige patienter var 547 ± 218 ng/ml vs. 410 ± 124 ng/ml, 3210 ± 1030 timer·ng/ml vs. ± 11200 timer. hhv. timer·ng/ml og 4000 ± 1320 timer·ng/ml vs. 3280 ± 1360 timer·ng/ml.
Lægemiddelinteraktioner
Aspirin: et randomiseret, dobbeltblindt, to-perioders crossover-studie, fik raske forsøgspersoner enten placebo eller aspirin 1 gram tre gange dagligt i en samlet behandlingsperiode på 5 dage. På dag 4 i hver undersøgelsesperiode blev en enkelt dosis på 1 mg AMARYL 4 mg administreret. AMARYL 4 mg-doserne blev adskilt af en 14-dages udvaskningsperiode. Samtidig administration af aspirin og AMARYL 4 mg resulterede i et fald på 34 % i den gennemsnitlige AUC for glimepirid og et fald på 4 % i den gennemsnitlige Cmax for glimepirid.
Colesevelam: Samtidig administration af colesevelam og glimepirid resulterede i reduktioner i glimepirid AUC0-∞ og Cmax på henholdsvis 18 % og 8 %. Når glimepirid blev administreret 4 timer før colesevelam, var der ingen signifikant ændring i glimepirid AUC0-∞ og Cmax, henholdsvis -6 % og 3 % [se DOSERING OG ADMINISTRATION og DRUGSINTERAKTIONER ].
Cimetidin og Ranitidin: et randomiseret, åbent, 3-vejs crossover-studie modtog raske forsøgspersoner enten en enkelt 4 mg dosis AMARYL alene, AMARYL med ranitidin (150 mg to gange dagligt i 4 dage; AMARYL 2 mg blev administreret på dag 3) eller AMARYL 2 mg med cimetidin (800 mg dagligt i 4 dage; AMARYL blev administreret på dag 3). Samtidig administration af cimetidin eller ranitidin med en enkelt 4 mg oral dosis af AMARYL 4 mg ændrede ikke signifikant absorptionen og dispositionen af glimepirid.
Propranolol: et randomiseret, dobbeltblindt, to-perioders crossover-studie, fik raske forsøgspersoner enten placebo eller propranolol 40 mg tre gange dagligt i en samlet behandlingsperiode på 5 dage. På dag 4 eller hver undersøgelsesperiode blev en enkelt dosis på 2 mg AMARYL 4 mg administreret. AMARYL 4 mg-doserne blev adskilt af en 14-dages udvaskningsperiode. Samtidig administration af propranolol og AMARYL 1 mg øgede glimepirid Cmax, AUC og T½ signifikant med henholdsvis 23 %, 22 % og 15 % og reducerede glimepirid CL/f med 18 %. Genfindelsen af M1 og M2 fra urin blev ikke ændret.
Warfarin: et åbent, tovejs crossover-studie fik raske forsøgspersoner 4 mg AMARYL 2 mg dagligt i 10 dage. Enkelte 25 mg doser af warfarin blev administreret 6 dage før start af AMARYL og på dag 4 af AMARYL administration. Samtidig administration af AMARYL ændrede ikke farmakokinetikken af R- og S-warfarin-enantiomerer. Der blev ikke observeret ændringer i warfarins plasmaproteinbinding. AMARYL 1 mg resulterede i et statistisk signifikant fald i den farmakodynamiske respons på warfarin. Reduktionerne i middelareal under protrombintid (PT)-kurven og maksimale PT-værdier under AMARYL-behandling var henholdsvis 3,3 % og 9,9 %, og det er usandsynligt, at de er klinisk relevante.
Kliniske Studier
Monoterapi
alt 304 patienter med type 2-diabetes, der allerede var behandlet med sulfonylurinstofbehandling, deltog i et 14-ugers, multicenter, randomiseret, dobbeltblindet, placebokontrolleret forsøg, der evaluerede sikkerheden og effekten af AMARYL 1 mg monoterapi. Patienterne afbrød deres sulfonylurinstofbehandling og gik derefter ind i en 3-ugers placebo-udvaskningsperiode efterfulgt af randomisering i 1 ud af 4 behandlingsgrupper: placebo (n=74), AMARYL 1 mg (n=78), AMARYL 4 mg (n=76) og AMARYL 8 mg (n=76). Alle patienter randomiseret til AMARYL 4 mg startede 1 mg dagligt. Patienter randomiseret til AMARYL 4 mg eller 8 mg havde blindet, tvungen titrering af AMARYL 2 mg dosis med ugentlige intervaller, først til 4 mg og derefter til 8 mg, så længe dosis blev tolereret, indtil den randomiserede dosis var nået. Patienter randomiseret til 4 mg-dosis nåede den tildelte dosis i uge 2. Patienter randomiseret til 8 mg-dosis nåede den tildelte dosis i uge 3. Når det randomiserede dosisniveau var nået, skulle patienterne holdes ved denne dosis indtil uge 14. Ca. 66 % af de placebobehandlede patienter gennemførte forsøget sammenlignet med 81 % af patienterne behandlet med glimepirid 1 mg og 92 % af patienterne behandlet med glimepirid 4 mg eller 8 mg. Sammenlignet med placebo gav behandling med AMARYL 1 mg, 4 mg og 8 mg dagligt statistisk signifikante forbedringer i HbA1c sammenlignet med placebo (tabel 3).
alt 249 patienter, som var behandlingsnaive, eller som tidligere havde modtaget begrænset behandling med antidiabetisk behandling, blev randomiseret til at modtage 22 ugers behandling med enten AMARYL (n=123) eller placebo (n=126) i et multicenter, randomiseret , dobbeltblindt, placebokontrolleret, dosistitreringsforsøg. Startdosis af AMARYL var 1 mg daglig og blev titreret opad eller nedad med 2-ugers intervaller til et mål FPG på 90-150 mg/dL. Blodsukkerniveauer for både FPG og PPG blev analyseret i laboratoriet. Efter 10 ugers dosisjustering blev patienterne fastholdt i deres optimale dosis (1, 2, 3, 4, 6 eller 8 mg) i de resterende 12 uger af forsøget. Behandling med AMARYL 2 mg gav statistisk signifikante forbedringer i HbA1c og FPG sammenlignet med placebo (tabel 4).
PATIENTOPLYSNINGER
Informer patienterne om vigtigheden af at overholde diætinstruktioner, af et regelmæssigt træningsprogram og af regelmæssig test af blodsukker.
Informer patienterne om de potentielle bivirkninger af AMARYL 1mg, herunder hypoglykæmi og vægtøgning.
Forklar symptomer og behandling af hypoglykæmi samt tilstande, der disponerer for hypoglykæmi. Patienter bør informeres om, at evnen til at koncentrere sig og reagere kan blive svækket som følge af hypoglykæmi. Dette kan udgøre en risiko i situationer, hvor disse evner er særligt vigtige, såsom at køre bil eller betjene andre maskiner.
Patienter med diabetes bør rådes til at informere deres læge, hvis de er gravide, overvejer graviditet, ammer eller overvejer at amme.
