Medicin mod diabetes: Glucophage 500mg, 850mg, 1000mg Metformin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Glucophage, og hvordan bruges det?
Glucophage er en receptpligtig medicin, der bruges til at behandle for at forbedre blodsukkerkontrollen hos voksne med type 2-diabetes mellitus. Glucophage kan bruges alene eller sammen med andre lægemidler.
Glucophage 850mg tilhører en klasse af lægemidler kaldet antidiabetika.
Det vides ikke, om Glucophage er sikkert og effektivt til børn under 10 år.
Hvad er de mulige bivirkninger af Glucophage?
- usædvanlige muskelsmerter,
- føler sig kold,
- vejrtrækningsbesvær,
- svimmelhed eller svimmelhed,
- træthed,
- svaghed,
- mavesmerter,
- opkastning, og
- langsom eller uregelmæssig puls
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Glucophage omfatter:
- lavt blodsukker,
- kvalme,
- ondt i maven, og
- diarré
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Glucophage. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
MÆLKESYRE
Postmarketing tilfælde af metformin-associeret laktatacidose har resulteret i død, hypotermi, hypotension og resistente bradyarytmier. Begyndelsen af metforminassocieret laktatacidose er ofte subtil, kun ledsaget af uspecifikke symptomer såsom utilpashed, myalgi, åndedrætsbesvær, somnolens og mavesmerter. Metforminassocieret laktatacidose var karakteriseret ved forhøjede laktatniveauer i blodet (>5 mmol/liter), aniongab-acidose (uden tegn på ketonuri eller ketonemi), et øget laktat/pyruvat-forhold; og metformin plasmaniveauer generelt >5 mcg/ml [se ADVARSLER OG FORHOLDSREGLER].
Risikofaktorer for metformin-associeret laktatacidose omfatter nedsat nyrefunktion, samtidig brug af visse lægemidler (f.eks. kulsyreanhydrasehæmmere såsom topiramat), alder 65 år eller derover, gennemgang af en radiologisk undersøgelse med kontrast, kirurgi og andre procedurer, hypoksiske tilstande (f.eks. , akut kongestiv hjertesvigt), overdreven alkoholindtagelse og nedsat leverfunktion.
Der er trin til at reducere risikoen for og håndtere metformin-associeret laktatacidose i disse højrisikogrupper [se DOSERING OG ADMINISTRATION, KONTRAINDIKATIONER, ADVARSLER OG FORHOLDSREGLER].
Hvis der er mistanke om metformin-associeret laktacidose, skal du øjeblikkeligt seponere GLUCOPHAGE eller GLUCOPHAGE XR og iværksætte generelle støtteforanstaltninger på et hospital. Hurtig hæmodialyse anbefales [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
GLUCOPHAGE/GLUCOPHAGE 500mg XR indeholder det antihyperglykæmiske middel metformin, som er et biguanid, i form af monohydrochlorid. Det kemiske navn på metforminhydrochlorid er N,N-dimethylimidodicarbonimiddiamidhydrochlorid. Strukturformlen er som vist nedenfor:
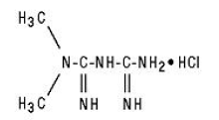
Metforminhydrochlorid er en hvid til råhvid krystallinsk forbindelse med en molekylformel på C4H11N5 • HCl og en molekylvægt på 165,63. Det er frit opløseligt i vand og er praktisk talt uopløseligt i acetone, ether og chloroform. pKa af metformin er 12,4. pH-værdien af en 1% vandig opløsning af metforminhydrochlorid er 6,68.
GLUCOPHAGE tabletter indeholder 500 mg, 850 mg eller 1000 mg metforminhydrochlorid, hvilket svarer til henholdsvis 389,93 mg, 662,88 mg, 779,86 mg metforminbase. Hver tablet indeholder de inaktive ingredienser povidon og magnesiumstearat. Derudover indeholder coatingen til 500 mg og 850 mg tabletterne hypromellose, og coatingen til 1000 mg tabletten indeholder hypromellose og polyethylenglycol.
GLUCOPHAGE 500mg XR indeholder 500 mg eller 750 mg metforminhydrochlorid, hvilket svarer til henholdsvis 389,93 mg, 584,90 mg metforminbase.
GLUCOPHAGE XR 500 mg tabletter indeholder de inaktive ingredienser hypromellose, mikrokrystallinsk cellulose, natriumcarboxymethylcellulose og magnesiumstearat.
GLUCOPHAGE 850mg XR 750 mg tabletter indeholder de inaktive ingredienser hypromellose, natriumcarboxymethylcellulose, magnesiumstearat og rødt jernoxidpigment.
INDIKATIONER
GLUCOPHAGE 850mg er indiceret som et supplement til diæt og motion for at forbedre den glykæmiske kontrol hos voksne og pædiatriske patienter i alderen 10 år og ældre med type 2-diabetes mellitus.
GLUCOPHAGE XR er indiceret som et supplement til diæt og motion for at forbedre den glykæmiske kontrol hos voksne med type 2-diabetes mellitus.
DOSERING OG ADMINISTRATION
Voksen dosering
Glucophage
- Den anbefalede startdosis af GLUCOPHAGE 850 mg er 500 mg oralt to gange dagligt eller 850 mg én gang dagligt, givet sammen med måltider.
- Forøg dosis i trin på 500 mg ugentligt eller 850 mg hver 2. uge på basis af glykæmisk kontrol og tolerabilitet, op til en maksimal dosis på 2550 mg dagligt, givet i opdelte doser.
- Doser over 2000 mg kan bedre tolereres givet 3 gange dagligt sammen med måltider.
Glucophage XR
- Synk GLUCOPHAGE XR tabletter hele og aldrig knus, skær eller tyg.
- Den anbefalede startdosis af GLUCOPHAGE XR er 500 mg oralt én gang dagligt sammen med aftensmåltidet.
- Forøg dosis i trin på 500 mg ugentligt på basis af glykæmisk kontrol og tolerabilitet, op til et maksimum på 2000 mg én gang dagligt med aftensmåltidet.
- Hvis der ikke opnås glykæmisk kontrol med GLUCOPHAGE XR 2000 mg én gang dagligt, overvej et forsøg med GLUCOPHAGE 850mg XR 1000 mg to gange dagligt. Hvis højere doser er påkrævet, skal du skifte til GLUCOPHAGE 500 mg med samlede daglige doser op til 2550 mg indgivet i opdelte daglige doser som beskrevet ovenfor.
- Patienter, der får GLUCOPHAGE 1000mg, kan skiftes til GLUCOPHAGE 850mg XR én gang dagligt med den samme samlede daglige dosis, op til 2000 mg én gang dagligt.
Pædiatrisk dosering for Glucophage
- Den anbefalede startdosis af GLUCOPHAGE 850 mg til pædiatriske patienter på 10 år og ældre er 500 mg oralt to gange dagligt, givet sammen med måltider.
- Forøg dosis i trin på 500 mg ugentligt på basis af glykæmisk kontrol og tolerabilitet, op til et maksimum på 2000 mg dagligt, givet i opdelte doser to gange dagligt.
Anbefalinger til brug ved nedsat nyrefunktion
- Vurder nyrefunktionen før påbegyndelse af GLUCOPHAGE/GLUCOPHAGE 500mg XR og periodisk derefter.
- GLUCOPHAGE/GLUCOPHAGE 500mg XR er kontraindiceret til patienter med en estimeret glomerulær filtrationshastighed (eGFR) under 30 ml/minut/1,73 m2.
- Påbegyndelse af GLUCOPHAGE/GLUCOPHAGE 850mg XR hos patienter med en eGFR mellem 30 – 45 ml/minut/1,73 m2 anbefales ikke.
- Hos patienter, der tager GLUCOPHAGE/GLUCOPHAGE 1000 mg XR, hvis eGFR senere falder til under 45 ml/min/1,73 m2, vurderes fordelen ved at fortsætte behandlingen.
- Afbryd GLUCOPHAGE/GLUCOPHAGE 1000mg XR, hvis patientens eGFR senere falder til under 30 ml/minut/1,73 m2 [se ADVARSLER OG FORHOLDSREGLER ].
Seponering for ioderede kontrastbilledbehandlingsprocedurer
Afbryd GLUCOPHAGE/GLUCOPHAGE XR på tidspunktet for eller før en iodiseret kontrastbilledbehandlingsprocedure hos patienter med en eGFR mellem 30 og 60 ml/min/1,73 m2; hos patienter med en historie med leversygdom, alkoholisme eller hjertesvigt; eller hos patienter, der vil blive administreret intraarteriel joderet kontrast. Reevaluer eGFR 48 timer efter billedbehandlingsproceduren; genstart GLUCOPHAGE/GLUCOPHAGE XR, hvis nyrefunktionen er stabil.
HVORDAN LEVERET
Doseringsformer og styrker
GLUCOPHAGE 850mg fås som:
- Tabletter: 500 mg runde, hvide til råhvide, filmovertrukne præget med "BMS 6060" rundt om periferien på den ene side og "500" præget på tværs af forsiden af den anden side.
- Tabletter: 850 mg runde, hvide til råhvide, filmovertrukne præget med "BMS 6070" rundt om periferien på den ene side og "850" præget på tværs af forsiden af den anden side.
- Tabletter: 1000 mg hvide, ovale, bikonvekse, filmovertrukne med "BMS 6071" præget på den ene side og "1000" præget på den modsatte side og med en halveret linje på begge sider.
GLUCOPHAGE XR fås som:
- Tabletter med forlænget frigivelse: 500 mg hvide til råhvide, kapselformede, bikonvekse, med "BMS 6063" præget på den ene side og "500" præget på tværs af forsiden af den anden side.
- Tabletter med forlænget frigivelse: 750 mg blegrøde og kan have et plettet udseende, kapselformede, bikonvekse, med "BMS 6064" præget på den ene side og "750" præget på den anden side.
Opbevaring og håndtering
Opbevaring
Opbevares ved 20°–25°C (68°–77°F); udflugter tilladt til 15°–30°C (59°–86°F). [Se USP-kontrolleret rumtemperatur.]
Dispenser i lysbestandige beholdere.
Distribueret af: Bristol-Myers Squibb Company Princeton, NJ 08543 USA. Revideret: maj 2018.
BIVIRKNINGER
Følgende bivirkninger er også diskuteret andetsteds i mærkningen:
- Mælkesyreacidose [se KASSE ADVARSEL og ADVARSLER OG FORHOLDSREGLER ]
- Vitamin B12-mangel [se ADVARSLER OG FORHOLDSREGLER ]
- Hypoglykæmi [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske studier
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Glucophage
I et amerikansk klinisk forsøg med GLUCOPHAGE 850 mg hos patienter med type 2-diabetes mellitus fik i alt 141 patienter GLUCOPHAGE 1000 mg op til 2550 mg dagligt. Bivirkninger rapporteret hos mere end 5 % af GLUCOPHAGE 500 mg-behandlede patienter, og som var mere almindelige end hos placebo-behandlede patienter, er anført i tabel 1.
Diarré førte til seponering af GLUCOPHAGE 500 mg hos 6 % af patienterne. Derudover blev følgende bivirkninger rapporteret hos ≥1 % til ≤5 % af GLUCOPHAGE-behandlede patienter og var mere almindeligt rapporteret med GLUCOPHAGE end placebo: unormal afføring, hypoglykæmi, myalgi, svimmelhed, dyspnø, neglelidelse, udslæt, øget sveden, smag lidelse, ubehag i brystet, kulderystelser, influenzasyndrom, rødmen, hjertebanken.
I GLUCOPHAGE 500 mg kliniske forsøg af 29 ugers varighed blev der observeret et fald til subnormale niveauer af tidligere normale serum-vitamin B12-niveauer hos ca. 7 % af patienterne.
Pædiatriske patienter
kliniske forsøg med GLUCOPHAGE hos pædiatriske patienter med type 2-diabetes mellitus svarede bivirkningsprofilen til den, der blev observeret hos voksne.
Glucopage XR
I placebokontrollerede forsøg fik 781 patienter GLUCOPHAGE 1000mg XR. Bivirkninger rapporteret hos mere end 5 % af GLUCOPHAGE 850 mg XR-patienterne, og som var mere almindelige hos GLUCOPHAGE XR- end placebobehandlede patienter, er anført i tabel 2.
Diarré førte til seponering af GLUCOPHAGE XR hos 0,6 % af patienterne. Derudover blev følgende bivirkninger rapporteret hos ≥1,0 % til ≤5,0 % af GLUCOPHAGE XR-patienter og blev mere almindeligt rapporteret med GLUCOPHAGE XR end placebo: mavesmerter, forstoppelse, udspilet mave, dyspepsi/halsbrand, flatulens, svimmelhed, hovedpine, øvre luftvejsinfektion, smagsforstyrrelse.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af metformin efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Kolestatisk, hepatocellulær og blandet hepatocellulær leverskade er blevet rapporteret efter brug af metformin efter markedsføring.
DRUGSINTERAKTIONER
Tabel 3 viser klinisk signifikante lægemiddelinteraktioner med GLUCOPHAGE/GLUCOPHAGE XR.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Mælkesyreacidose
Der har efter markedsføring været tilfælde af metformin-associeret laktatacidose, herunder dødelige tilfælde. Disse tilfælde havde en subtil begyndelse og blev ledsaget af uspecifikke symptomer såsom utilpashed, myalgi, mavesmerter, åndedrætsbesvær eller øget somnolens; hypotension og resistente bradyarytmier er dog forekommet med svær acidose. Metforminassocieret laktatacidose var karakteriseret ved forhøjede lactatkoncentrationer i blodet (>5 mmol/L), aniongab-acidose (uden tegn på ketonuri eller ketonemi) og et øget laktat:pyruvat-forhold; plasmaniveauer af metformin var generelt >5 mcg/ml. Metformin nedsætter leverens optagelse af laktat, hvilket øger laktatniveauet i blodet, hvilket kan øge risikoen for laktatacidose, især hos risikopatienter.
Hvis der er mistanke om metformin-associeret laktacidose, bør generelle støtteforanstaltninger iværksættes omgående på et hospital, sammen med øjeblikkelig seponering af GLUCOPHAGE/GLUCOPHAGE 500mg XR. Hos GLUCOPHAGE/GLUCOPHAGE XR-behandlede patienter med en diagnose eller stærk mistanke om laktatacidose anbefales hurtig hæmodialyse for at korrigere acidosen og fjerne akkumuleret metformin (metforminhydrochlorid kan dialyseres med en clearance på op til 170 ml/min under gode hæmodynamiske forhold). Hæmodialyse har ofte resulteret i vending af symptomer og bedring.
Undervis patienter og deres familier om symptomerne på laktatacidose, og hvis disse symptomer opstår, instruer dem i at seponere GLUCOPHAGE/GLUCOPHAGE 1000mg XR og rapportere disse symptomer til deres læge.
For hver af de kendte og mulige risikofaktorer for metformin-associeret laktatacidose er anbefalingerne til at reducere risikoen for og håndtere metformin-associeret laktacidose nedenfor:
- Nedsat nyrefunktion – De metformin-associerede tilfælde af laktatacidose efter markedsføring forekom primært hos patienter med signifikant nedsat nyrefunktion.
Risikoen for ophobning af metformin og metformin-associeret laktacidose øges med sværhedsgraden af nedsat nyrefunktion, fordi metformin i det væsentlige udskilles af nyrerne. Kliniske anbefalinger baseret på patientens nyrefunktion omfatter [se DOSERING OG ADMINISTRATION , KLINISK FARMAKOLOGI ]:
- Inden påbegyndelse af GLUCOPHAGE/GLUCOPHAGE 850mg XR, opnås en estimeret glomerulær filtrationshastighed (eGFR).
- GLUCOPHAGE/GLUCOPHAGE XR er kontraindiceret til patienter med en eGFR mindre end 30 ml/min/1,73 m2 [se KONTRAINDIKATIONER ].
- Påbegyndelse af GLUCOPHAGE/GLUCOPHAGE XR anbefales ikke til patienter med eGFR mellem 30-45 ml/min/1,73 m2.
- Opnå en eGFR mindst årligt hos alle patienter, der tager GLUCOPHAGE/GLUCOPHAGE 1000mg XR. Hos patienter med risiko for udvikling af nedsat nyrefunktion (f.eks. ældre), bør nyrefunktionen vurderes hyppigere.
- Hos patienter, der tager GLUCOPHAGE/GLUCOPHAGE 500 mg XR, hvis eGFR falder til under 45 ml/min/1,73 m2, skal fordele og risiko ved at fortsætte behandlingen vurderes.
- Lægemiddelinteraktioner — Samtidig brug af GLUCOPHAGE/GLUCOPHAGE XR med specifikke lægemidler kan øge risikoen for metformin-associeret laktatacidose: dem, der forringer nyrefunktionen, resulterer i signifikant hæmodynamisk ændring, interfererer med syre-base-balancen eller øger metforminakkumulering. Overvej hyppigere monitorering af patienter.
- Alder 65 eller derover — Risikoen for metformin-associeret laktacidose stiger med patientens alder, fordi ældre patienter har større sandsynlighed for at have nedsat lever-, nyre- eller hjertefunktion end yngre patienter. Vurder nyrefunktionen hyppigere hos ældre patienter.
- Radiologiske undersøgelser med kontrast — Administration af intravaskulære jodholdige kontrastmidler til metforminbehandlede patienter har ført til et akut fald i nyrefunktionen og forekomsten af laktatacidose. Stop GLUCOPHAGE/GLUCOPHAGE XR på tidspunktet for eller før en iodiseret kontrastbilledbehandlingsprocedure hos patienter med en eGFR mellem 30 og 60 ml/min/1,73 m2; hos patienter med en historie med nedsat leverfunktion, alkoholisme eller hjertesvigt; eller hos patienter, der vil blive administreret intraarteriel joderet kontrast. Reevaluer eGFR 48 timer efter billedbehandlingsproceduren, og genstart GLUCOPHAGE/GLUCOPHAGE XR, hvis nyrefunktionen er stabil.
- Kirurgi og andre procedurer — Tilbageholdelse af mad og væske under kirurgiske eller andre procedurer kan øge risikoen for volumenmangel, hypotension og nyreinsufficiens. GLUCOPHAGE/GLUCOPHAGE XR bør seponeres midlertidigt, mens patienterne har begrænset føde- og væskeindtag.
- Hypoksiske tilstande — Adskillige af postmarketingtilfældene af metformin-associeret laktatacidose forekom i forbindelse med akut kongestiv hjertesvigt (især når det var ledsaget af hypoperfusion og hypoxæmi). Kardiovaskulær kollaps (chok), akut myokardieinfarkt, sepsis og andre tilstande forbundet med hypoxæmi er blevet forbundet med laktatacidose og kan forårsage prærenal azotæmi. Når en sådan hændelse opstår, skal du seponere GLUCOPHAGE/GLUCOPHAGE 1000mg XR.
- Overdreven alkoholindtagelse — Alkohol forstærker virkningen af metformin på laktatmetabolisme. Patienter skal advares mod overdreven alkoholindtagelse, mens de får GLUCOPHAGE/GLUCOPHAGE XR.
- Nedsat leverfunktion — Patienter med nedsat leverfunktion har udviklet tilfælde af metformin-associeret laktatacidose. Dette kan skyldes nedsat laktatclearance, hvilket resulterer i højere laktatniveauer i blodet. Undgå derfor brug af GLUCOPHAGE/GLUCOPHAGE XR hos patienter med kliniske eller laboratoriemæssige tegn på leversygdom.
Vitamin B12 mangel
I GLUCOPHAGE 1000 mg kliniske forsøg af 29 ugers varighed blev der observeret et fald til subnormale niveauer af tidligere normale serum vitamin B12 niveauer hos ca. 7 % af patienterne. Et sådant fald, muligvis på grund af interferens med B12-absorption fra B12-intrinsic factor-komplekset, kan være forbundet med anæmi, men ser ud til at være hurtigt reversibel med seponering af GLUCOPHAGE eller vitamin B12-tilskud. Visse individer (dem med utilstrækkeligt vitamin B12 eller calciumindtag eller -absorption) ser ud til at være disponerede for at udvikle subnormale vitamin B12-niveauer. Mål hæmatologiske parametre på årsbasis og vitamin B12 med 2 til 3 års intervaller hos patienter på GLUCOPHAGE/GLUCOPHAGE 500 mg XR og håndter eventuelle abnormiteter [se BIVIRKNINGER ].
Hypoglykæmi ved samtidig brug med insulin og insulin
Sekretagoger
Insulin og insulinsekretagoger (f.eks. sulfonylurinstof) er kendt for at forårsage hypoglykæmi. GLUCOPHAGE/GLUCOPHAGE XR kan øge risikoen for hypoglykæmi, når det kombineres med insulin og/eller en insulinsekretagog. Derfor kan det være nødvendigt med en lavere dosis insulin eller insulinsekretagog for at minimere risikoen for hypoglykæmi, når det bruges i kombination med GLUCOPHAGE/GLUCOPHAGE XR [se DRUGSINTERAKTIONER ].
Makrovaskulære resultater
Der har ikke været nogen kliniske undersøgelser, der påviser endegyldige beviser for makrovaskulær risikoreduktion med GLUCOPHAGE/GLUCOPHAGE 850 mg XR.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER ).
Mælkesyreacidose
Forklar risikoen for laktatacidose, dens symptomer og tilstande, der disponerer for dens udvikling. Rådgiv patienterne om at seponere GLUCOPHAGE/GLUCOPHAGE XR med det samme og omgående underrette deres læge, hvis der opstår uforklarlig hyperventilation, myalgi, utilpashed, usædvanlig døsighed eller andre uspecifikke symptomer. Rådgiv patienterne mod overdreven alkoholindtagelse og informer patienterne om vigtigheden af regelmæssig test af nyrefunktionen, mens de får GLUCOPHAGE/GLUCOPHAGE XR. Instruer patienterne i at informere deres læge om, at de tager GLUCOPHAGE/GLUCOPHAGE 500mg XR før enhver kirurgisk eller radiologisk procedure, da midlertidig seponering kan være påkrævet [se ADVARSLER OG FORHOLDSREGLER ].
Hypoglykæmi
Informer patienterne om, at hypoglykæmi kan forekomme, når GLUCOPHAGE/GLUCOPHAGE XR administreres sammen med orale sulfonylurinstoffer og insulin. Forklar patienter, der får samtidig behandling, risikoen for hypoglykæmi, dets symptomer og behandling og tilstande, der disponerer for dets udvikling [se ADVARSLER OG FORHOLDSREGLER ].
Vitamin B12 mangel
Informer patienterne om vigtigheden af regelmæssige hæmatologiske parametre, mens de får GLUCOPHAGE/GLUCOPHAGE XR [se ADVARSLER OG FORHOLDSREGLER ].
Kvinder i den reproduktive alder
Informer kvinder om, at behandling med GLUCOPHAGE/GLUCOPHAGE XR kan resultere i ægløsning hos nogle præmenopausale anovulatoriske kvinder, hvilket kan føre til utilsigtet graviditet [se Brug i specifikke populationer ].
Glucophage XR administrationsoplysninger
Informer patienterne om, at GLUCOPHAGE 500mg XR skal synkes hel og ikke knuses, skæres eller tygges, og at de inaktive ingredienser lejlighedsvis kan udskilles i fæces som en blød masse, der kan ligne den originale tablet.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Langtidskarcinogenicitetsundersøgelser er blevet udført på rotter (dosisvarighed på 104 uger) og mus (dosisvarighed på 91 uger) i doser op til og med henholdsvis 900 mg/kg/dag og 1500 mg/kg/dag. Disse doser er begge cirka 3 gange den maksimale anbefalede daglige dosis på 2550 mg baseret på sammenligninger af kropsoverfladearealer. Der blev ikke fundet tegn på carcinogenicitet med metformin hos hverken han- eller hunmus. På samme måde blev der ikke observeret tumorogent potentiale med metformin hos hanrotter. Der var dog en øget forekomst af benigne stromale uteruspolypper hos hunrotter behandlet med 900 mg/kg/dag.
Der var ingen tegn på et mutagent potentiale af metformin i følgende in vitro-tests: Ames-test (S. typhimurium), genmutationstest (muslymfomceller) eller kromosomafvigelsestest (humane lymfocytter). Resultaterne i in vivo muse mikronukleustest var også negative.
Fertilitet hos han- eller hunrotter var upåvirket af metformin, når det blev administreret i doser så høje som 600 mg/kg/dag, hvilket er ca. 2 gange den maksimale anbefalede humane daglige dosis på 2550 mg baseret på sammenligninger af kropsoverfladearealer.
Brug i specifikke populationer
Graviditet
Risikooversigt
Begrænsede data med GLUCOPHAGE/GLUCOPHAGE XR hos gravide kvinder er ikke tilstrækkelige til at bestemme en lægemiddelrelateret risiko for alvorlige fødselsdefekter eller abort. Publicerede undersøgelser med metforminbrug under graviditet har ikke rapporteret en klar sammenhæng med metformin og risiko for større fødselsdefekter eller abort [se Data ]. Der er risici for moderen og fosteret forbundet med dårligt kontrolleret diabetes mellitus under graviditeten [se Kliniske overvejelser ].
Der blev ikke observeret uønskede udviklingsmæssige virkninger, når metformin blev administreret til drægtige Sprague Dawley-rotter og kaniner i løbet af organogeneseperioden i doser op til henholdsvis 2 og 5 gange en klinisk dosis på 2550 mg baseret på kropsoverfladeareal [se Data ].
Den estimerede baggrundsrisiko for større fødselsdefekter er 6-10% hos kvinder med præ-gestationel diabetes mellitus med et HbA1C >7 og er blevet rapporteret at være så høj som 20-25% hos kvinder med et HbA1C >10. Den estimerede baggrundsrisiko for abort for den angivne population er ukendt. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2-4% og 15-20%.
Kliniske overvejelser
Sygdomsrelateret risiko for moder og/eller embryo/føtal
Dårligt kontrolleret diabetes mellitus under graviditet øger moderens risiko for diabetisk ketoacidose, præeklampsi, spontane aborter, præmatur fødsel, dødfødsel og fødselskomplikationer. Dårligt kontrolleret diabetes mellitus øger fosterets risiko for alvorlige fødselsdefekter, dødfødsel og makrosomi-relateret sygelighed.
Data
Menneskelige data
Publicerede data fra post-marketing undersøgelser har ikke rapporteret en klar sammenhæng med metformin og større fødselsdefekter, abort eller uønskede maternale eller føtale resultater, når metformin blev brugt under graviditet. Disse undersøgelser kan dog ikke med sikkerhed fastslå fraværet af nogen metformin-associeret risiko på grund af metodiske begrænsninger, herunder lille prøvestørrelse og inkonsistente sammenligningsgrupper.
Dyredata
Metforminhydrochlorid påvirkede ikke udviklingsresultaterne negativt, når det blev givet til gravide rotter og kaniner i doser op til 600 mg/kg/dag. Dette repræsenterer en eksponering på ca. 2 og 5 gange en 2550 mg klinisk dosis baseret på kropsoverfladesammenligninger for henholdsvis rotter og kaniner. Bestemmelse af føtale koncentrationer viste en delvis placentabarriere over for metformin.
Amning
Risikooversigt
Begrænsede publicerede undersøgelser rapporterer, at metformin er til stede i modermælk [se Data ]. Der er dog utilstrækkelig information til at bestemme virkningen af metformin på det ammede spædbarn og ingen tilgængelig information om virkningen af metformin på mælkeproduktionen. Derfor bør de udviklingsmæssige og sundhedsmæssige fordele ved amning overvejes sammen med moderens kliniske behov for GLUCOPHAGE/GLUCOPHAGE 500mg XR og eventuelle negative virkninger på det ammede barn fra GLUCOPHAGE/GLUCOPHAGE 850mg XR eller fra den underliggende moderens tilstand.
Data
Publicerede kliniske amningsundersøgelser rapporterer, at metformin er til stede i modermælk, hvilket resulterede i spædbørnsdoser på ca. 0,11 % til 1 % af moderens vægtjusterede dosis og et mælk/plasma-forhold på mellem 0,13 og 1. Studierne var dog ikke designet til at klart fastslå risikoen ved brug af metformin under amning på grund af lille prøvestørrelse og begrænsede data om bivirkninger indsamlet hos spædbørn.
Hunner og mænd med reproduktionspotentiale
Diskuter potentialet for utilsigtet graviditet med præmenopausale kvinder, da behandling med GLUCOPHAGE/GLUCOPHAGE XR kan resultere i ægløsning hos nogle anovulatoriske kvinder.
Pædiatrisk brug
Glucophage
Sikkerheden og effektiviteten af GLUCOPHAGE til behandling af type 2-diabetes mellitus er blevet fastslået hos pædiatriske patienter i alderen 10 til 16 år. Sikkerhed og effektivitet af GLUCOPHAGE er ikke blevet fastslået hos pædiatriske patienter under 10 år.
Brug af GLUCOPHAGE 850 mg til pædiatriske patienter 10 til 16 år til behandling af type 2 diabetes mellitus understøttes af evidens fra tilstrækkelige og velkontrollerede undersøgelser af GLUCOPHAGE hos voksne med yderligere data fra et kontrolleret klinisk studie med pædiatriske patienter 10 til 16 år gammel med type 2-diabetes mellitus, som viste en lignende reaktion i glykæmisk kontrol som den, der ses hos voksne [se Kliniske Studier ]. I denne undersøgelse lignede bivirkningerne dem, der er beskrevet hos voksne. En maksimal daglig dosis på 2000 mg GLUCOPHAGE 1000 mg anbefales. [Se DOSERING OG ADMINISTRATION .]
Glucophage 1000mg XR
Sikkerhed og effektivitet af GLUCOPHAGE XR hos pædiatriske patienter er ikke blevet fastlagt.
Geriatrisk brug
Kontrollerede kliniske undersøgelser af GLUCOPHAGE/GLUCOPHAGE XR inkluderede ikke et tilstrækkeligt antal ældre patienter til at afgøre, om de reagerer anderledes end yngre patienter. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling og den højere risiko af mælkesyreacidose. Vurder nyrefunktionen hyppigere hos ældre patienter [se ADVARSLER OG FORHOLDSREGLER ].
Nedsat nyrefunktion
Metformin udskilles i det væsentlige via nyrerne, og risikoen for ophobning af metformin og laktatacidose øges med graden af nedsat nyrefunktion. GLUCOPHAGE/GLUCOPHAGE 850mg XR er kontraindiceret ved svært nedsat nyrefunktion, patienter med en estimeret glomerulær filtrationshastighed (eGFR) under 30 ml/min/1,73 m2 [se DOSERING OG ADMINISTRATION , KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER , og KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Brug af metformin til patienter med nedsat leverfunktion er blevet forbundet med nogle tilfælde af laktatacidose. GLUCOPHAGE/GLUCOPHAGE 500mg XR anbefales ikke til patienter med nedsat leverfunktion. [se ADVARSLER OG FORHOLDSREGLER ].
OVERDOSIS
Overdosering af metforminhydrochlorid er forekommet, herunder indtagelse af mængder på mere end 50 gram. Hypoglykæmi blev rapporteret i ca. 10 % af tilfældene, men der er ikke påvist nogen årsagssammenhæng med metformin. Laktacidose er blevet rapporteret i ca. 32 % af tilfældene af metforminoverdosering [se ADVARSLER OG FORHOLDSREGLER ]. Metformin er dialyserbart med en clearance på op til 170 ml/min under gode hæmodynamiske forhold. Derfor kan hæmodialyse være nyttig til fjernelse af akkumuleret lægemiddel fra patienter, hvor der er mistanke om metforminoverdosering.
KONTRAINDIKATIONER
GLUCOPHAGE 1000mg og GLUCOPHAGE 850mg XR er kontraindiceret til patienter med:
- Alvorligt nedsat nyrefunktion (eGFR under 30 ml/min/1,73 m2) [se ADVARSLER OG FORHOLDSREGLER ].
- Overfølsomhed over for metformin.
- Akut eller kronisk metabolisk acidose, herunder diabetisk ketoacidose, med eller uden koma.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Metformin er et antihyperglykæmisk middel, som forbedrer glukosetolerancen hos patienter med type 2-diabetes mellitus, og sænker både basal og postprandial plasmaglucose. Metformin nedsætter hepatisk glukoseproduktion, nedsætter intestinal absorption af glucose og forbedrer insulinfølsomheden ved at øge perifer glucoseoptagelse og -udnyttelse. Ved metforminbehandling forbliver insulinsekretionen uændret, mens fastende insulinniveauer og en dagslang plasmainsulinrespons kan falde.
Farmakokinetik
Absorption
Den absolutte biotilgængelighed af en GLUCOPHAGE 500 mg tablet givet under fastende forhold er ca. 50 % til 60 %. Undersøgelser med enkelte orale doser af GLUCOPHAGE 500 til 1500 mg og 850 til 2550 mg indikerer, at der er mangel på dosisproportionalitet ved stigende doser, hvilket skyldes nedsat absorption snarere end en ændring i elimination. Ved sædvanlige kliniske doser og doseringsskemaer af GLUCOPHAGE nås steady state plasmakoncentrationer af metformin inden for 24 til 48 timer og er generelt
Efter en enkelt oral dosis af GLUCOPHAGE 500 mg XR opnås Cmax med en medianværdi på 7 timer og et interval på 4 til 8 timer. Maksimal plasmaniveauer er ca. 20 % lavere sammenlignet med den samme dosis af GLUCOPHAGE 1000 mg, dog er absorptionsgraden (målt ved AUC) sammenlignelig med GLUCOPHAGE.
Ved steady state er AUC og Cmax mindre end dosisproportionalt for GLUCOPHAGE XR inden for intervallet 500 til 2000 mg administreret én gang dagligt. Maksimal plasmaniveauer er ca. 0,6, 1,1, 1,4 og 1,8 mcg/ml for henholdsvis 500, 1000, 1500 og 2000 mg én gang dagligt. Omfanget af metforminabsorption (målt ved AUC) fra GLUCOPHAGE 500 mg XR ved en dosis på 2000 mg én gang dagligt svarer til den samme samlede daglige dosis administreret som GLUCOPHAGE 850 mg tabletter 1000 mg to gange dagligt. Efter gentagen administration af GLUCOPHAGE XR akkumuleredes metformin ikke i plasma.
Effekt af mad:
Mad nedsætter absorptionsgraden og forsinker absorptionen af metformin en smule, som vist ved en ca. 40 % lavere gennemsnitlig maksimal plasmakoncentration (Cmax), et 25 % lavere areal under plasmakoncentrationen versus tidskurven (AUC) og en 35- minut forlængelse af tiden til maksimal plasmakoncentration (Tmax) efter administration af en enkelt 850 mg tablet GLUCOPHAGE sammen med mad sammenlignet med samme tabletstyrke administreret fastende.
Selvom omfanget af metforminabsorption (målt ved AUC) fra GLUCOPHAGE XR-tabletten steg med ca. 50 %, når det blev givet sammen med mad, var der ingen effekt af mad på Cmax og Tmax af metformin. Både høj- og fedtfattige måltider havde samme effekt på farmakokinetikken af GLUCOPHAGE XR.
Fordeling
Det tilsyneladende distributionsvolumen (V/F) af metformin efter enkelt orale doser af GLUCOPHAGE 850 mg var i gennemsnit 654 ± 358 l. Metformin er ubetydeligt bundet til plasmaproteiner. Metformin opdeles i erytrocytter, højst sandsynligt som en funktion af tiden.
Metabolisme
Intravenøse enkeltdosisundersøgelser hos normale forsøgspersoner viser, at metformin udskilles uændret i urinen og ikke undergår levermetabolisme (ingen metabolitter er blevet identificeret hos mennesker) eller galdeudskillelse.
Elimination
Renal clearance (se tabel 4) er ca. 3,5 gange større end kreatininclearance, hvilket indikerer, at tubulær sekretion er den vigtigste udskillelsesvej for metformin. Efter oral administration elimineres ca. 90 % af det absorberede lægemiddel via nyrerne inden for de første 24 timer med en plasmaelimineringshalveringstid på ca. 6,2 timer. I blod er eliminationshalveringstiden ca. 17,6 timer, hvilket tyder på, at erytrocytmassen kan være et distributionskompartment.
Specifikke populationer
Nedsat nyrefunktion
Hos patienter med nedsat nyrefunktion er plasma- og blodhalveringstiden for metformin forlænget, og nyreclearance er nedsat (se tabel 3) [Se DOSERING OG ADMINISTRATION , KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Nedsat leverfunktion
Der er ikke udført farmakokinetiske undersøgelser af metformin hos patienter med nedsat leverfunktion [Se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Geriatri
Begrænsede data fra kontrollerede farmakokinetiske undersøgelser af GLUCOPHAGE 1000mg hos raske ældre forsøgspersoner tyder på, at den totale plasmaclearance af metformin er nedsat, halveringstiden forlænges, og Cmax er øget sammenlignet med raske unge forsøgspersoner. Det ser ud til, at ændringen i metformins farmakokinetik med aldring primært skyldes en ændring i nyrefunktionen (se tabel 4). [Se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Pædiatri
Efter administration af en enkelt oral GLUCOPHAGE 500 mg tablet sammen med mad, varierede geometrisk gennemsnitlig Cmax og AUC for metformin med mindre end 5 % mellem pædiatriske type 2-diabetespatienter (12-16 år) og køns- og vægtmatchede raske voksne (20- 45 år), alle med normal nyrefunktion.
Køn
Metformins farmakokinetiske parametre afveg ikke signifikant mellem normale forsøgspersoner og patienter med type 2-diabetes mellitus, når de blev analyseret efter køn (mænd=19, kvinder=16).
Race
Der er ikke udført studier af metformins farmakokinetiske parametre i henhold til race.
Lægemiddelinteraktioner
In vivo vurdering af lægemiddelinteraktioner
Kliniske Studier
Glucophage
Voksen kliniske undersøgelser
Et dobbeltblindt, placebokontrolleret, multicenter amerikansk klinisk forsøg med overvægtige patienter med type 2-diabetes mellitus, hvis hyperglykæmi ikke var tilstrækkeligt kontrolleret med diætbehandling alene (baseline fastende plasmaglucose [FPG] på ca. 240 mg/dL) blev udført. Patienterne blev behandlet med GLUCOPHAGE (op til 2550 mg/dag) eller placebo i 29 uger. Resultaterne er vist i tabel 7.
Den gennemsnitlige baseline kropsvægt var 201 lbs og 206 lbs i henholdsvis GLUCOPHAGE 850 mg og placebo-armen. Gennemsnitlig ændring i kropsvægt fra baseline til uge 29 var -1,4 lbs og -2,4 lbs i henholdsvis GLUCOPHAGE 1000 mg og placebo-armene. En 29-ugers, dobbeltblind, placebokontrolleret undersøgelse af GLUCOPHAGE og glyburid, alene og i kombination , blev udført hos overvægtige patienter med type 2-diabetes mellitus, som ikke havde opnået tilstrækkelig glykæmisk kontrol, mens de fik maksimale doser af glyburid (baseline FPG på ca. 250 mg/dL). Patienter randomiseret til kombinationsarmen startede behandling med GLUCOPHAGE 500 mg og glyburid 20 mg. I slutningen af hver uge af de første 4 uger af forsøget fik disse patienter deres doser af GLUCOPHAGE 500 mg øget med 500 mg, hvis de ikke havde nået målet fastende plasmaglucose. Efter uge 4 blev sådanne dosisjusteringer foretaget månedligt, selvom ingen patient fik lov til at overstige GLUCOPHAGE 2500 mg. Patienter i GLUCOPHAGE-armen (metformin plus placebo) ophørte med glyburid og fulgte samme titreringsskema. Patienter i glyburid-armen fortsatte med den samme dosis glyburid. Ved afslutningen af forsøget tog ca. 70 % af patienterne i kombinationsgruppen GLUCOPHAGE 2000 mg/glyburid 20 mg eller GLUCOPHAGE 2500 mg/glyburid 20 mg. Resultaterne er vist i tabel 8.
Den gennemsnitlige baseline kropsvægt var 202 lbs, 203 lbs og 204 lbs i henholdsvis GLUCOPHAGE/glyburid-, glyburid- og GLUCOPHAGE 500 mg-armene. Gennemsnitlig ændring i kropsvægt fra baseline til uge 29 var 0,9 lbs, -0,7 lbs og -8,4 lbs i henholdsvis GLUCOPHAGE/glyburid-, glyburid- og GLUCOPHAGE 850mg-armene.
Pædiatriske kliniske undersøgelser
Et dobbeltblindt, placebo-kontrolleret studie med pædiatriske patienter i alderen 10 til 16 år med type 2 diabetes mellitus (gennemsnitlig FPG 182,2 mg/dL), behandling med GLUCOPHAGE (op til 2000 mg/dag) i op til 16 uger (gennemsnitlig varighed af behandling 11 uger) blev udført. Resultaterne er vist i tabel 9.
Den gennemsnitlige baseline kropsvægt var 205 lbs og 189 lbs i henholdsvis GLUCOPHAGE 850 mg og placebo-armen. Gennemsnitlig ændring i kropsvægt fra baseline til uge 16 var -3,3 lbs og -2,0 lbs i henholdsvis GLUCOPHAGE 500 mg og placebo-armen.
Glucophage XR
En 24-ugers, dobbeltblind, placebokontrolleret undersøgelse af GLUCOPHAGE 1000mg XR, taget én gang dagligt sammen med aftensmåltidet, blev udført hos patienter med type 2-diabetes mellitus, som ikke havde opnået glykæmisk kontrol med diæt og motion. Patienter, der deltog i undersøgelsen, havde en gennemsnitlig baseline HbA1c på 8,0 % og en gennemsnitlig baseline FPG på 176 mg/dL. Behandlingsdosis blev øget til 1500 mg én gang dagligt, hvis HbA1c ved uge 12 var ≥7,0 % men
En 16-ugers, dobbeltblind, placebokontrolleret, dosis-respons undersøgelse af GLUCOPHAGE 500mg XR, taget en gang dagligt sammen med aftensmåltidet eller to gange dagligt med måltider, blev udført hos patienter med type 2 diabetes mellitus, som ikke havde opnået glykæmisk kontrol med kost og motion. Resultaterne er vist i tabel 10.
Den gennemsnitlige baseline kropsvægt var 193 lbs, 192 lbs, 188 lbs, 196 lbs, 193 lbs og 194 lbs i GLUCOPHAGE XR 500 mg, 1000 mg, 1500 mg og 2000 mg én gang dagligt, 10 gange dagligt, respektivt 10 mg dagligt, 10 gange dagligt. . Gennemsnitlig ændring i kropsvægt fra baseline til uge 16 var henholdsvis -1,3 lbs, -1,3 lbs, -0,7 lbs, -1,5 lbs, -2,2 lbs og -1,8 lbs.
En 24-ugers, dobbeltblind, randomiseret undersøgelse af GLUCOPHAGE XR, taget én gang dagligt sammen med aftensmåltidet, og GLUCOPHAGE 500 mg, taget to gange dagligt (med morgenmad og aftensmåltid), blev udført hos patienter med type 2-diabetes mellitus, som havde været behandlet med GLUCOPHAGE 500 mg to gange dagligt i mindst 8 uger før studiestart. Resultaterne er vist i tabel 11.
Den gennemsnitlige baseline kropsvægt var henholdsvis 210 lbs, 203 lbs og 193 lbs i GLUCOPHAGE 500 mg to gange dagligt og GLUCOPHAGE XR 1000 mg og 1500 mg en gang dagligt arme. Gennemsnitlig ændring i kropsvægt fra baseline til uge 24 var henholdsvis 0,9 lbs, 1,1 lbs og 0,9 lbs.
PATIENTOPLYSNINGER
GLUCOPHAGE® [gloo-ko-fahzh] (metforminhydrochlorid) Tabletter
og
GLUCOPHAGE® XR [gloo-ko-fahzh XR] (metforminhydrochlorid) tabletter med forlænget frigivelse
Læs patientinformationen, der følger med GLUCOPHAGE og GLUCOPHAGE 1000mg XR, før du begynder at tage det, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Denne folder træder ikke i stedet for at tale med din læge om din medicinske tilstand eller behandling.
Hvad er den vigtigste information, jeg bør vide om GLUCOPHAGE 1000mg og GLUCOPHAGE 500mg XR?
Alvorlige bivirkninger kan forekomme hos personer, der tager GLUCOPHAGE eller GLUCOPHAGE 1000mg XR, herunder:
Mælkesyreacidose. Metforminhydrochlorid, medicinen i GLUCOPHAGE 500mg og GLUCOPHAGE XR, kan forårsage en sjælden, men alvorlig bivirkning kaldet laktatacidose (en ophobning af mælkesyre i blodet), som kan forårsage død. Laktacidose er en medicinsk nødsituation og skal behandles på et hospital.
Stop med at tage GLUCOPHAGE eller GLUCOPHAGE 500mg XR og ring med det samme til din læge, hvis du får nogle af følgende symptomer på laktatacidose:
- føler mig meget svag og træt
- har usædvanlige (ikke normale) muskelsmerter
- har problemer med at trække vejret
- har usædvanlig søvnighed eller sover længere end normalt
- har uforklarlige mave- eller tarmproblemer med kvalme og opkastning eller diarré
- føler dig kold, især i dine arme og ben
- føler sig svimmel eller svimmel
- har en langsom eller uregelmæssig hjerterytme
Du har større chance for at få laktatacidose, hvis du:
- har nyreproblemer. Personer, hvis nyrer ikke fungerer korrekt, bør ikke tage GLUCOPHAGE 850mg ELLER GLUCOPHAGE XR.
- har leverproblemer.
- har kongestiv hjertesvigt, der kræver behandling med medicin.
- drikker meget alkohol (meget ofte eller kortvarigt "overstadig"-drikning).
- bliver dehydreret (taber en stor mængde kropsvæsker). Dette kan ske, hvis du er syg med feber, opkastning eller diarré. Dehydrering kan også ske, når du sveder meget med aktivitet eller motion og ikke drikker nok væske.
- have visse røntgenundersøgelser med injicerbare farvestoffer eller kontrastmidler.
- blive opereret.
- har et hjerteanfald, alvorlig infektion eller slagtilfælde.
- er 80 år eller ældre og ikke har fået testet din nyrefunktion.
Hvad er GLUCOPHAGE og GLUCOPHAGE 1000mg XR?
- GLUCOPHAGE og GLUCOPHAGE XR er receptpligtig medicin, der indeholder metforminhydrochlorid. GLUCOPHAGE 500mg og GLUCOPHAGE 1000mg XR bruges sammen med diæt og motion for at hjælpe med at kontrollere højt blodsukker (hyperglykæmi) hos voksne med type 2-diabetes.
- GLUCOPHAGE 850mg og GLUCOPHAGE 500mg XR er ikke til personer med type 1-diabetes.
- GLUCOPHAGE 850mg og GLUCOPHAGE 500mg XR er ikke til personer med diabetisk ketoacidose (øgede ketoner i dit blod eller urin).
GLUCOPHAGE 850mg og GLUCOPHAGE 1000mg XR har den samme aktive ingrediens. GLUCOPHAGE XR virker dog længere i din krop. Begge disse lægemidler hjælper med at kontrollere dit blodsukker på en række måder. Disse omfatter at hjælpe din krop med at reagere bedre på den insulin, den producerer naturligt, at reducere mængden af sukker, din lever laver, og at mindske mængden af sukker, som dine tarme absorberer. GLUCOPHAGE 1000mg og GLUCOPHAGE 850mg XR får ikke din krop til at lave mere insulin.
Hvem bør ikke tage GLUCOPHAGE eller GLUCOPHAGE 850mg XR?
Nogle tilstande øger din chance for at få laktatacidose eller forårsager andre problemer, hvis du tager nogen af disse lægemidler. De fleste af tilstandene nedenfor kan øge din chance for at få laktatacidose.
Tag ikke GLUCOPHAGE 1000mg eller GLUCOPHAGE 500mg XR, hvis du:
- har nyreproblemer
- er allergisk over for metforminhydrochlorid i GLUCOPHAGE eller GLUCOPHAGE 850mg XR eller et af indholdsstofferne i GLUCOPHAGE eller GLUCOPHAGE XR. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i GLUCOPHAGE og GLUCOPHAGE XR.
- vil få en indsprøjtning med farvestof eller kontrastmidler til en røntgenprocedure, eller hvis du skal opereres og ikke kan spise eller drikke meget. I disse situationer skal GLUCOPHAGE 1000mg eller GLUCOPHAGE XR stoppes i kort tid. Tal med din læge om, hvornår du skal stoppe med GLUCOPHAGE 850mg eller GLUCOPHAGE 850mg XR, og hvornår du skal starte med GLUCOPHAGE eller GLUCOPHAGE XR igen. Se "Hvad er den vigtigste information, jeg bør vide om GLUCOPHAGE eller GLUCOPHAGE XR?"
Hvad skal jeg fortælle min læge, før jeg tager GLUCOPHAGE eller GLUCOPHAGE 1000mg XR?
Inden du tager GLUCOPHAGE 500mg eller GLUCOPHAGE XR, skal du fortælle din læge, hvis du:
- har type 1 diabetes. GLUCOPHAGE 850mg eller GLUCOPHAGE 500mg XR bør ikke bruges til at behandle personer med type 1-diabetes.
- har en historie eller risiko for diabetisk ketoacidose (høje niveauer af visse syrer, kendt som ketoner, i blodet eller urinen). GLUCOPHAGE 1000mg eller GLUCOPHAGE XR bør ikke anvendes til behandling af diabetisk ketoacidose.
- har nyreproblemer.
- har leverproblemer.
- har hjerteproblemer, herunder kongestiv hjertesvigt.
- er ældre end 80 år. Hvis du er over 80 år, bør du ikke tage GLUCOPHAGE 1000mg eller GLUCOPHAGE XR, medmindre dine nyrer er blevet kontrolleret, og de er normale.
- drik alkohol meget ofte, eller drik meget alkohol i kortvarigt "binge"-drikning.
- tager insulin.
- har andre medicinske tilstande.
- er gravid eller planlægger at blive gravid. Det vides ikke, om GLUCOPHAGE eller GLUCOPHAGE 850mg XR vil skade dit ufødte barn. Hvis du er gravid, skal du tale med din læge om den bedste måde at kontrollere dit blodsukker på, mens du er gravid.
- ammer eller planlægger at amme. Det vides ikke, om GLUCOPHAGE 850mg eller GLUCOPHAGE XR udskilles i din modermælk. Tal med din læge om den bedste måde at fodre din baby på, mens du tager GLUCOPHAGE 500mg eller GLUCOPHAGE 500mg XR.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. Kend den medicin du tager. Hold en liste over dem for at vise din læge og apotek, når du får en ny medicin.
- GLUCOPHAGE eller GLUCOPHAGE XR kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke, hvordan GLUCOPHAGE eller GLUCOPHAGE XR virker.
Kan GLUCOPHAGE eller GLUCOPHAGE 500mg XR bruges til børn?
GLUCOPHAGE 1000mg har vist sig effektivt at sænke glukoseniveauet hos børn (i alderen 10-16 år) med type 2-diabetes. GLUCOPHAGE 1000mg er ikke blevet undersøgt hos børn under 10 år. GLUCOPHAGE 500mg er ikke blevet undersøgt i kombination med andre orale glukosekontrollerende lægemidler eller insulin hos børn. Hvis du har spørgsmål om brugen af GLUCOPHAGE 1000mg til børn, så tal med din læge eller anden sundhedsplejerske.
GLUCOPHAGE XR er ikke blevet undersøgt hos børn.
Hvordan skal jeg tage GLUCOPHAGE eller GLUCOPHAGE XR?
- Tag GLUCOPHAGE 850mg eller GLUCOPHAGE 850mg XR nøjagtigt som din læge fortæller dig.
- GLUCOPHAGE eller GLUCOPHAGE 850mg XR bør tages sammen med måltider for at hjælpe med at mindske en mavebesvær.
- Synk GLUCOPHAGE eller GLUCOPHAGE 500mg XR hele. Må ikke knuse, skære eller tygge GLUCOPHAGE 1000mg XR.
- Du kan nogle gange passere en blød masse i din afføring (afføring), der ligner GLUCOPHAGE 850mg eller GLUCOPHAGE XR-tabletter. Dette er ikke skadeligt og vil ikke påvirke den måde, GLUCOPHAGE 850mg XR virker for at kontrollere din diabetes.
- Når din krop er under visse former for stress, såsom feber, traumer (såsom en bilulykke), infektion eller operation, kan mængden af diabetesmedicin, du har brug for, ændre sig. Fortæl din læge med det samme, hvis du har nogle af disse problemer.
- Din læge bør tage blodprøver for at kontrollere, hvor godt dine nyrer fungerer før og under din behandling med GLUCOPHAGE 1000mg eller GLUCOPHAGE 500mg XR.
- Din læge vil tjekke din diabetes med regelmæssige blodprøver, herunder dit blodsukkerniveau og dit hæmoglobin A1C.
- Følg din læges anvisninger for behandling af for lavt blodsukker (hypoglykæmi). Tal med din læge, hvis lavt blodsukker er et problem for dig. Se "Hvad er de mulige bivirkninger af GLUCOPHAGE eller GLUCOPHAGE XR?"
- Tjek dit blodsukker, som din læge fortæller dig.
- Bliv på din ordinerede diæt og træningsprogram, mens du tager GLUCOPHAGE 850mg eller GLUCOPHAGE 850mg XR.
- Hvis du glemmer en dosis af GLUCOPHAGE 1000mg eller GLUCOPHAGE 850mg XR, skal du tage din næste dosis som foreskrevet, medmindre din læge fortæller dig anderledes. Tag ikke en ekstra dosis næste dag.
- Hvis du tager for meget GLUCOPHAGE 500mg eller GLUCOPHAGE 500mg XR, skal du ringe til din læge, det lokale giftkontrolcenter eller gå til den nærmeste skadestue på hospitalet med det samme.
Hvad skal jeg undgå, mens jeg tager GLUCOPHAGE eller GLUCOPHAGE 1000mg XR?
Drik ikke mange alkoholiske drikke, mens du tager GLUCOPHAGE eller GLUCOPHAGE XR. Det betyder, at du ikke bør overspise i korte perioder, og du bør ikke drikke meget alkohol på regelmæssig basis. Alkohol kan øge chancen for at få mælkesyreacidose.
Hvad er bivirkningerne af GLUCOPHAGE og GLUCOPHAGE XR?
- Laktatacidose. Metformin, den aktive ingrediens i GLUCOPHAGE 1000mg og GLUCOPHAGE 500mg XR, kan forårsage en sjælden, men alvorlig tilstand kaldet laktatacidose (en ophobning af en syre i blodet), som kan forårsage død. Laktatacidose er en medicinsk nødsituation og skal behandles på hospitalet.
Ring til din læge med det samme, hvis du har nogle af følgende symptomer, som kan være tegn på laktatacidose:
- du føler dig kold i dine hænder eller fødder
- du føler dig svimmel eller svimmel
- du har en langsom eller uregelmæssig hjerterytme
- du føler dig meget svag eller træt
- du har problemer med at trække vejret
- du føler dig søvnig eller døsig
- du har mavesmerter, kvalme eller opkastning
De fleste, der har haft mælkesyreacidose med metformin, har andre ting, der sammen med metformin førte til mælkesyreacidose. Fortæl det til din læge, hvis du har noget af følgende, fordi du har større chance for at få laktatacidose med GLUCOPHAGE 850mg eller GLUCOPHAGE 500mg XR, hvis du:
- har alvorlige nyreproblemer, eller dine nyrer er påvirket af visse røntgenundersøgelser, der bruger injicerbart farvestof
- har leverproblemer
- drik alkohol meget ofte, eller drik meget alkohol i kortvarigt "binge"-drikning
- bliver dehydreret (taber en stor mængde kropsvæsker). Dette kan ske, hvis du er syg med feber, opkastning eller diarré. Dehydrering kan også ske, når du sveder meget med aktivitet eller motion og ikke drikker nok væske
- blive opereret
- har et hjerteanfald, alvorlig infektion eller slagtilfælde
Almindelige bivirkninger af GLUCOPHAGE 500mg og GLUCOPHAGE 1000mg XR omfatter diarré, kvalme og mavebesvær. Disse bivirkninger forsvinder generelt, når du har taget medicinen i et stykke tid. At tage din medicin sammen med et måltid kan hjælpe med at reducere disse bivirkninger. Fortæl din læge, hvis bivirkningerne generer dig meget, varer i mere end et par uger, kommer tilbage efter at de er gået væk, eller starter senere i behandlingen. Du kan have brug for en lavere dosis eller nødt til at stoppe med at tage medicinen i en kort periode eller for altid.
Omkring 3 ud af hver 100 personer, der tager GLUCOPHAGE eller GLUCOPHAGE 1000mg XR, har en ubehagelig metallisk smag, når de begynder at tage medicinen. Det varer i kort tid.
GLUCOPHAGE 850mg og GLUCOPHAGE 500mg XR forårsager sjældent hypoglykæmi (lavt blodsukker) i sig selv. Hypoglykæmi kan dog forekomme, hvis du ikke spiser nok, hvis du drikker alkohol, eller hvis du tager anden medicin for at sænke blodsukkeret.
Hvordan skal jeg opbevare GLUCOPHAGE 500mg og GLUCOPHAGE XR?
Opbevar GLUCOPHAGE og GLUCOPHAGE 850mg XR ved 68°F til 77°F (20°C til 25°C).
Opbevar GLUCOPHAGE 850mg og GLUCOPHAGE 500mg XR og al medicin utilgængeligt for børn.
Generel information om brugen af GLUCOPHAGE 850mg og GLUCOPHAGE 850mg XR
Hvis du har spørgsmål eller problemer, så tal med din læge eller anden sundhedsplejerske. Du kan spørge din læge eller apoteket om oplysningerne om GLUCOPHAGE 850mg og GLUCOPHAGE 500mg XR, som er skrevet til sundhedspersonale. Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en patientinformationsfolder. Brug ikke GLUCOPHAGE 1000mg eller GLUCOPHAGE 1000mg XR til en tilstand, som den ikke er ordineret til. Del ikke din medicin med andre mennesker.
Hvad er ingredienserne i GLUCOPHAGE og GLUCOPHAGE 500mg XR?
Aktive ingredienser i GLUCOPHAGE: metforminhydrochlorid.
Inaktive ingredienser i hver tablet af GLUCOPHAGE: povidon og magnesiumstearat. Derudover indeholder coatingen til 500 mg og 850 mg tabletterne hypromellose, og coatingen til 1000 mg tabletten indeholder hypromellose og polyethylenglycol.
Aktive ingredienser i GLUCOPHAGE 1000mg XR: metforminhydrochlorid.
Inaktive ingredienser i hver tablet af GLUCOPHAGE 1000mg XR 500 mg: natriumcarboxymethylcellulose, hypromellose, mikrokrystallinsk cellulose og magnesiumstearat.
Inaktive ingredienser i hver tablet af GLUCOPHAGE XR 750 mg: natriumcarboxymethylcellulose, hypromellose og magnesiumstearat.
Hvad er type 2 diabetes?
Type 2-diabetes er en tilstand, hvor din krop ikke laver nok insulin, og den insulin, som din krop producerer, ikke virker så godt, som den burde. Din krop kan også lave for meget sukker. Når dette sker, ophobes sukker (glukose) i blodet. Dette kan føre til alvorlige medicinske problemer.
Hovedmålet med behandling af diabetes er at sænke dit blodsukker til et normalt niveau.
Højt blodsukker kan sænkes ved diæt og motion, og med visse lægemidler, når det er nødvendigt.
Tal med din sundhedsplejerske om, hvordan du forebygger, genkender og tager hånd om lavt blodsukker (hypoglykæmi), højt blodsukker (hyperglykæmi) og problemer, du har på grund af din diabetes.
