Zofran 4mg, 8mg Ondansetron Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Zofran, og hvordan bruges det?
Zofran 4mg er en receptpligtig medicin, der bruges som profylakse og til behandling af symptomer på kvalme og opkastning på grund af visse medikamenter eller postoperativt. Zofran 8mg kan bruges alene eller sammen med anden medicin.
Zofran tilhører en klasse af lægemidler kaldet antiemetika, selektiv 5-HT3-antagonist.
Det vides ikke, om Zofran 4mg er sikkert og effektivt til børn under 1 måned.
Hvad er de mulige bivirkninger af Zofran?
Zofran kan forårsage alvorlige bivirkninger, herunder:
- svær forstoppelse,
- mavesmerter,
- oppustethed,
- hovedpine med brystsmerter og svær svimmelhed,
- besvimelse,
- hurtige eller bankende hjerteslag,
- gulfarvning af huden eller øjnene (gulsot)
- sløret syn,
- midlertidigt synstab,
- agitation,
- hallucinationer,
- feber,
- hurtig puls,
- overaktive reflekser,
- kvalme,
- opkastning,
- diarré,
- tab af koordination, og
- besvimelse
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Zofran omfatter:
- diarré,
- forstoppelse,
- døsighed, og
- træt følelse
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Zofran. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Den aktive ingrediens i ZOFRAN 4 mg tabletter og ZOFRAN oral opløsning er ondansetronhydrochlorid som dihydratet, den racemiske form af ondansetron og et selektivt blokeringsmiddel af serotonin 5-HT3-receptortypen. Kemisk er det (±) 1, 2, 3, 9-tetrahydro-9-methyl-3-[(2-methyl-1H-imidazol-1-yl)methyl]-4H-carbazol-4-on, monohydrochlorid, dihydrat . Den har følgende strukturformel:
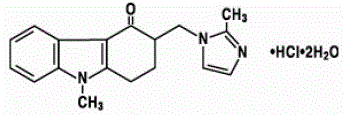
Den empiriske formel er C18H19N3O·HCl·2H2O, hvilket repræsenterer en molekylvægt på 365,9.
Ondansetronhydrochloriddihydrat er et hvidt til råhvidt pulver, der er opløseligt i vand og normalt saltvand.
Den aktive ingrediens i ZOFRAN 4mg ODT oralt desintegrerende tabletter er ondansetronbase, den racemiske form af ondansetron og et selektivt blokeringsmiddel af serotonin 5-HT3-receptortypen. Kemisk er det (±) 1,2,3,9tetrahydro-9-methyl-3-[(2-methyl-1H-imidazol-1-yl)methyl]-4H-carbazol-4-on. Den har følgende strukturformel:
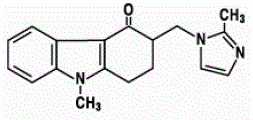
Den empiriske formel er C18H19N3O, der repræsenterer en molekylvægt på 293,4.
Hver 4 mg ZOFRAN 8 mg tablet til oral administration indeholder ondansetronhydrochloriddihydrat svarende til 4 mg ondansetron. Hver 8 mg ZOFRAN 8 mg tablet til oral administration indeholder ondansetronhydrochloriddihydrat svarende til 8 mg ondansetron. Hver tablet indeholder også de inaktive ingredienser hypromellose, gul jernoxid (kun 8 mg tablet), laktose, magnesiumstearat, mikrokrystallinsk cellulose, prægelatineret stivelse, triacetin og titaniumdioxid.
Hver 4 mg ZOFRAN 8 mg ODT oralt desintegrerende tablet til oral administration indeholder 4 mg ondansetronbase. Hver 8 mg ZOFRAN 4 mg ODT oralt desintegrerende tablet til oral administration indeholder 8 mg ondansetronbase. Hver ZOFRAN ODT-tablet indeholder også de inaktive ingredienser aspartam, gelatine, mannitol, methylparabennatrium, propylparabennatrium og jordbærsmag. ZOFRAN ODT-tabletter er en frysetørret, oralt administreret formulering af ondansetron, som desintegrerer på tungen og ikke kræver vand for at hjælpe med opløsning eller synke.
Hver 5 ml ZOFRAN oral opløsning indeholder 5 mg ondansetronhydrochloriddihydrat svarende til 4 mg ondansetron. ZOFRAN 8 mg oral opløsning indeholder de inaktive ingredienser, vandfri citronsyre, renset vand, natriumbenzoat, natriumcitrat, sorbitol og jordbærsmag.
INDIKATIONER
ZOFRAN er indiceret til forebyggelse af kvalme og opkastning forbundet med:
- stærkt emetogen cancerkemoterapi, inklusive cisplatin større end eller lig med 50 mg/m²
- indledende og gentagne forløb med moderat emetogen cancerkemoterapi
- strålebehandling hos patienter, der modtager enten total kropsbestråling, enkelt højdosis fraktion til maven eller daglige fraktioner til maven
ZOFRAN er også indiceret til forebyggelse af postoperativ kvalme og/eller opkastning.
DOSERING OG ADMINISTRATION
Dosering
De anbefalede doseringsregimer til voksne og pædiatriske patienter er beskrevet i henholdsvis tabel 1 og tabel 2. Tilsvarende doser af ZOFRAN tabletter, ZOFRAN ODT® oralt desintegrerende tabletter og ZOFRAN oral opløsning kan anvendes i flæng.
Dosering ved nedsat leverfunktion
Hos patienter med svært nedsat leverfunktion (Child-Pugh-score på 10 eller derover), må en samlet daglig dosis på 8 mg ikke overskrides [se Brug i specifikke populationer , KLINISK FARMAKOLOGI ].
Administrationsvejledning til ZOFRAN ODT oralt disintegrerende tabletter
Forsøg ikke at skubbe ZOFRAN ODT oralt desintegrerende tabletter gennem foliebagsiden. Med tørre hænder, SKÆR du foliebagsiden af 1 blister tilbage og fjern forsigtigt tabletten. Placer STRAKS ZOFRAN 4mg ODT oralt desintegrerende tablet oven på tungen, hvor den vil opløses på få sekunder, og synk derefter med spyt. Administration med væske er ikke nødvendig.
HVORDAN LEVERET
Doseringsformer og styrker
ZOFRAN tabletter er ovale, filmovertrukne tabletter præget med "Zofran" på den ene side og fås i følgende styrker:
- 4 mg - hvid tablet med "4" indgraveret på den anden side.
- 8 mg - gul tablet med "8" indgraveret på den anden side.
ZOFRAN ODT oralt desintegrerende tabletter er hvide, runde og plankonvekse tabletter, der fås i følgende styrker:
- 4 mg - præget med "Z4" på den ene side.
- 8 mg - præget med "Z8" på den ene side.
ZOFRAN 4mg oral opløsning 4 mg/5 ml, er en klar, farveløs til lysegul væske med en karakteristisk jordbærlugt tilgængelig i en 50 ml flaske.
Opbevaring og håndtering
ZOFRAN Tabletter
4 mg (ondansetronhydrochloriddihydrat svarende til 4 mg ondansetron) er hvide, ovale, filmovertrukne tabletter præget med "Zofran" på den ene side og "4" på den anden i flasker med 30 tabletter (NDC 0078-0675-15) ).
Opbevares mellem 2°C og 30°C (36°F og 86°F). Beskyt mod lys. Dispenser i tæt, lysbestandig beholder som defineret i USP.
8 mg (ondansetronhydrochloriddihydrat svarende til 8 mg ondansetron) er gule, ovale, filmovertrukne tabletter præget med "Zofran" på den ene side og "8" på den anden i flasker med 30 tabletter (NDC 0078-0676-15 ).
Opbevares mellem 2°C og 30°C (36°F og 86°F). Beskyt mod lys. Dispenser i tæt, lysbestandig beholder som defineret i USP.
ZOFRAN 8mg ODT oralt desintegrerende tabletter
4 mg (som 4 mg ondansetronbase) er hvide, runde og plankonvekse tabletter præget med "Z4" på den ene side i enhedsdosispakninger med 30 tabletter (NDC 0078-0679-19).
mg (som 8 mg ondansetronbase) er hvide, runde og plankonvekse tabletter præget med et "Z8" på den ene side i enhedsdosispakninger med 30 tabletter (NDC 0078-0680-19).
Opbevares mellem 2°C og 30°C (36°F og 86°F).
ZOFRAN 4mg oral opløsning
en klar, farveløs til lysegul væske med en karakteristisk jordbærlugt, indeholder 5 mg ondansetronhydrochloriddihydrat svarende til 4 mg ondansetron pr. 5 ml i ravfarvede glasflasker på 50 ml med børnesikrede lukninger (NDC 0078-0677-22) .
Opbevares opretstående mellem 15°C og 30°C (59°F og 86°F). Beskyt mod lys. Opbevar flasker stående i kartoner.
Distribueret af: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936. Revideret: apr 2021
BIVIRKNINGER
Følgende klinisk signifikante bivirkninger er beskrevet andetsteds i mærkningen:
- Overfølsomhedsreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- QT-forlængelse [se ADVARSLER OG FORHOLDSREGLER ]
- Serotonin syndrom [se ADVARSLER OG FORHOLDSREGLER ]
- Maskering af progressiv ileus og gastrisk udspiling [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan de bivirkninger, der er observeret i de kliniske forsøg med et lægemiddel, ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Følgende bivirkninger er blevet rapporteret i kliniske forsøg med patienter behandlet med ondansetron, det aktive stof i ZOFRAN. En årsagssammenhæng til behandling med ZOFRAN var i mange tilfælde uklar.
Forebyggelse af kemoterapi-induceret kvalme og opkastning
De mest almindelige bivirkninger rapporteret hos mere end eller lig med 4 % af 300 voksne, der fik en enkelt 24 mg dosis ZOFRAN 4 mg oralt i 2 forsøg til forebyggelse af kvalme og opkastning forbundet med stærkt emetogen kemoterapi (cisplatin større end eller lig med 50 mg /m²) var: hovedpine (11%) og diarré (4%).
De mest almindelige bivirkninger rapporteret i 4 forsøg hos voksne til forebyggelse af kvalme og opkastning forbundet med moderat emetogen kemoterapi (primært cyclophosphamid-baserede regimer) er vist i tabel 3.
Mindre almindelige bivirkninger
Centralnervesystemet
Ekstrapyramidale reaktioner (mindre end 1 % af patienterne).
Hepatisk
Værdierne for aspartattransaminase (AST) og/eller alanintransaminase (ALAT) overskred det dobbelte af den øvre normalgrænse hos ca. 1 % til 2 % af 723 patienter, der fik ZOFRAN 8 mg og cyclophosphamid-baseret kemoterapi i amerikanske kliniske forsøg. Forøgelserne var forbigående og så ikke ud til at være relateret til dosis eller varighed af behandlingen. Ved gentagen eksponering forekom lignende forbigående stigninger i transaminaseværdier i nogle forløb, men symptomatisk leversygdom forekom ikke. Kræftkemoterapiens rolle i disse biokemiske ændringer er uklar.
Leversvigt og død er blevet rapporteret hos cancerpatienter, der samtidig får medicin, herunder potentielt hepatotoksisk cytotoksisk kemoterapi og antibiotika. Ætiologien af leversvigt er uklar.
Integumentær
Udslæt (ca. 1 % af patienterne).
Andet (mindre end 2 %)
Anafylaksi, bronkospasme, takykardi, angina, hypokaliæmi, elektrokardiografiske ændringer, vaskulære okklusive hændelser og grand mal-anfald. Bortset fra bronkospasme og anafylaksi er forholdet til ZOFRAN 4mg uklart.
Forebyggelse af strålingsinduceret kvalme og opkastning
De mest almindelige bivirkninger (større end eller lig med 2%) rapporteret hos patienter, der fik ZOFRAN og samtidig strålebehandling, svarede til dem, der blev rapporteret hos patienter, der fik ZOFRAN og samtidig kemoterapi og var hovedpine, forstoppelse og diarré.
Forebyggelse af postoperativ kvalme og opkastning
De mest almindelige bivirkninger rapporteret hos voksne i forsøg med forebyggelse af postoperativ kvalme og opkastning er vist i tabel 4. I disse forsøg fik patienter flere samtidige perioperative og postoperative medicin i begge behandlingsgrupper.
en crossover-undersøgelse med 25 forsøgspersoner blev der rapporteret hovedpine hos 6 forsøgspersoner, der fik ZOFRAN 8 mg ODT oralt desintegrerende tablet med vand (24%) sammenlignet med 2 forsøgspersoner, der fik ZOFRAN 8mg ODT oralt desintegrerende tablet uden vand (8%).
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af ondansetron efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Kardiovaskulær
Arytmier (herunder ventrikulær og supraventrikulær takykardi, præmature ventrikulære kontraktioner og atrieflimren), bradykardi, elektrokardiografiske ændringer (inklusive andengrads hjerteblokering, forlængelse af QT/QTc-interval og ST-segmentdepression), hjertebanken og synkope. Sjældent og overvejende med intravenøs ondansetron er forbigående EKG-forandringer, inklusive forlængelse af QT-intervallet, blevet rapporteret.
Generel
Skylning
Sjældne tilfælde af overfølsomhedsreaktioner, nogle gange alvorlige (f.eks. anafylaktiske reaktioner, angioødem, bronkospasme, åndenød, hypotension, larynxødem, stridor) er også blevet rapporteret. Laryngospasme, shock og hjerte-lungestop er forekommet under allergiske reaktioner hos patienter, der får injicerbar ondansetron.
Hepatobiliært
Leverenzym abnormiteter.
Nedre luftveje
Hikke.
Neurologi
Oculogyrisk krise, der optræder alene, såvel som med andre dystoniske reaktioner.
Hud
Nældefeber, Stevens-Johnsons syndrom og toksisk epidermal nekrolyse.
Øjenlidelser
Tilfælde af forbigående blindhed, overvejende under intravenøs administration, er blevet rapporteret. Disse tilfælde af forbigående blindhed blev rapporteret at forsvinde inden for få minutter op til 48 timer.
DRUGSINTERAKTIONER
Serotonerge lægemidler
Serotonergt syndrom (herunder ændret mental status, autonom ustabilitet og neuromuskulære symptomer) er blevet beskrevet efter samtidig brug af 5-HT3-receptorantagonister og andre serotonerge lægemidler, herunder SSRI'er og SNRI'er. Overvåg for fremkomsten af serotonergt syndrom. Hvis der opstår symptomer, skal du afbryde behandlingen med ZOFRAN 4 mg og påbegynde understøttende behandling [se ADVARSLER OG FORHOLDSREGLER ].
Lægemidler, der påvirker cytokrom P-450 enzymer
Ondansetron ser ikke ud til i sig selv at inducere eller hæmme det cytochrom P-450 lægemiddelmetaboliserende enzymsystem i leveren [se KLINISK FARMAKOLOGI ]. Da ondansetron metaboliseres af hepatiske cytochrom P450 lægemiddelmetaboliserende enzymer (CYP3A4, CYP2D6, CYP1A2), kan inducere eller hæmmere af disse enzymer ændre clearance og dermed halveringstiden for ondansetron. Hos patienter behandlet med potente inducere af CYP3A4 (dvs. phenytoin, carbamazepin og rifampin), var clearance af ondansetron signifikant øget, og ondansetrons blodkoncentrationer blev reduceret. Men på grundlag af tilgængelige data anbefales ingen dosisjustering af ZOFRAN 8mg til patienter på disse lægemidler [se KLINISK FARMAKOLOGI ].
Tramadol
Selvom der ikke er observeret nogen farmakokinetisk lægemiddelinteraktion mellem ondansetron og tramadol, tyder data fra 2 små forsøg på, at ZOFRAN 8mg, når det bruges sammen, kan øge patientkontrolleret administration af tramadol. Overvåg patienter for at sikre tilstrækkelig smertekontrol, når ondansetron administreres sammen med tramadol.
Kemoterapi
Carmustin, etoposid og cisplatin påvirker ikke farmakokinetikken af ondansetron.
et crossover-forsøg med 76 pædiatriske patienter øgede intravenøs ondansetron ikke de systemiske koncentrationer af højdosis methotrexat.
Alfentanil og atracurium
ZOFRAN 4mg ændrer ikke de respiratoriske depressive virkninger produceret af alfentanil eller graden af neuromuskulær blokade produceret af atracurium. Interaktioner med generel eller lokalbedøvelse er ikke blevet undersøgt.
Stofmisbrug og afhængighed
Dyreforsøg har vist, at ondansetron ikke diskrimineres som et benzodiazepin og heller ikke erstatter benzodiazepiner i direkte afhængighedsstudier.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Overfølsomhedsreaktioner
Overfølsomhedsreaktioner, herunder anafylaksi og bronkospasme, er blevet rapporteret hos patienter, som har udvist overfølsomhed over for andre selektive 5-HT3-receptorantagonister. Hvis der opstår overfølsomhedsreaktioner, skal du stoppe brugen af ZOFRAN; behandles omgående efter standard pleje og monitor, indtil tegn og symptomer forsvinder [se KONTRAINDIKATIONER ].
QT forlængelse
Ændringer i elektrokardiogram (EKG), inklusive forlængelse af QT-intervallet, er set hos patienter, der får ondansetron. Derudover er der efter markedsføring blevet rapporteret tilfælde af Torsade de Pointes hos patienter, der bruger ZOFRAN. Undgå ZOFRAN 8mg hos patienter med medfødt langt QT-syndrom. EKG-monitorering anbefales til patienter med elektrolytforstyrrelser (f.eks. hypokaliæmi eller hypomagnesæmi), kongestiv hjertesvigt, bradyarytmier eller patienter, der tager andre lægemidler, der fører til QT-forlængelse [se KLINISK FARMAKOLOGI ].
Serotonin syndrom
Udviklingen af serotonergt syndrom er blevet rapporteret med 5-HT3-receptorantagonister alene. De fleste rapporter er blevet forbundet med samtidig brug af serotonerge lægemidler (f.eks. selektive serotoningenoptagelseshæmmere (SSRI'er), serotonin- og noradrenalin-genoptagelseshæmmere (SNRI'er), monoaminoxidasehæmmere, mirtazapin, fentanyl, lithium, tramadolenblåt og intravenøst). Nogle af de rapporterede tilfælde var dødelige. Serotonergt syndrom, der opstår ved overdosering af ZOFRAN 4 mg alene, er også blevet rapporteret. Størstedelen af rapporterne om serotoninsyndrom relateret til brug af 5-HT3-receptorantagonister forekom på en post-anæstesiafdeling eller et infusionscenter.
Symptomer forbundet med serotonergt syndrom kan omfatte følgende kombination af tegn og symptomer: ændringer i mental status (f.eks. agitation, hallucinationer, delirium og koma), autonom ustabilitet (f.eks. takykardi, labilt blodtryk, svimmelhed, diaforese, rødmen, hypertermi) , neuromuskulære symptomer (f.eks. tremor, stivhed, myoklonus, hyperrefleksi, inkoordination), kramper, med eller uden gastrointestinale symptomer (f.eks. kvalme, opkastning, diarré). Patienter bør overvåges for forekomsten af serotonergt syndrom, især ved samtidig brug af ZOFRAN 4 mg og andre serotonerge lægemidler. Hvis der opstår symptomer på serotonergt syndrom, skal du afbryde behandlingen med ZOFRAN og påbegynde understøttende behandling. Patienterne skal informeres om den øgede risiko for serotonergt syndrom, især hvis ZOFRAN anvendes samtidig med andre serotonerge lægemidler [se DRUGSINTERAKTIONER , OVERDOSERING ].
Maskering af progressiv ileus og gastrisk udspiling
Brugen af ZOFRAN til patienter efter abdominal kirurgi eller til patienter med kemoterapi-induceret kvalme og opkastning kan maskere en progressiv ileus og/eller gastrisk udspiling. Overvåg for nedsat tarmaktivitet, især hos patienter med risikofaktorer for gastrointestinal obstruktion.
ZOFRAN 8mg er ikke et lægemiddel, der stimulerer mave- eller tarmperistaltikken. Det bør ikke bruges i stedet for nasogastrisk sugning.
Fenylketonuri
Fenylketonuriske patienter skal informeres om, at ZOFRAN ODT oralt desintegrerende tabletter indeholder phenylalanin (en komponent i aspartam). Hver 4-mg og 8-mg oralt desintegrerende tablet indeholder mindre end 0,03 mg phenylalanin.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Kræftfremkaldende virkninger blev ikke set i 2-årige undersøgelser med rotter og mus med orale ondansetrondoser på op til henholdsvis 10 mg/kg dagligt og 30 mg/kg dagligt (ca. 4 og 6 gange den maksimale anbefalede orale humane dosis på 24 mg dag, baseret på kropsoverfladeareal).
Ondansetron var ikke mutagent i standardtests for mutagenicitet.
Oral administration af ondansetron op til 15 mg/kg pr. dag (ca. 6 gange den maksimalt anbefalede humane orale dosis på 24 mg pr. dag, baseret på kropsoverfladeareal) påvirkede ikke fertiliteten eller den generelle reproduktionsevne hos han- og hunrotter.
Brug i specifikke populationer
Graviditet
Risikooversigt
Publicerede epidemiologiske undersøgelser af sammenhængen mellem brug af ondansetron og større fødselsdefekter har rapporteret inkonsistente fund og har vigtige metodiske begrænsninger, der udelukker konklusioner om sikkerheden ved brug af ondansetron under graviditet (se Data ). Tilgængelige postmarketing-data har ikke identificeret en lægemiddelrelateret risiko for abort eller uønskede moderresultater. Reproduktionsundersøgelser med rotter og kaniner viste ikke tegn på skade på fosteret, når ondansetron blev administreret under organogenese med henholdsvis ca. 6 og 24 gange den maksimalt anbefalede orale dosis til mennesker på 24 mg/dag baseret på kropsoverfladeareal (se Data ).
Baggrundsrisikoen for alvorlige fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, aborter eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og aborter i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Data
Menneskelige data
Tilgængelige data om brug af ondansetron hos gravide kvinder fra adskillige publicerede epidemiologiske undersøgelser udelukker en vurdering af en lægemiddelassocieret risiko for uønskede føtale udfald på grund af vigtige metodiske begrænsninger, herunder usikkerheden om, hvorvidt kvinder, der udfyldte en recept, faktisk tog medicinen, den samtidige brug. af andre medikamenter eller behandlinger, recall bias og andre ujusterede konfoundere.
Ondansetroneksponering in utero er ikke blevet forbundet med overordnede større medfødte misdannelser i aggregerede analyser. Et stort retrospektivt kohortestudie undersøgte 1970 kvinder, der modtog en recept på ondansetron under graviditeten og rapporterede ingen sammenhæng mellem eksponering for ondansetron og større medfødte misdannelser, abort, dødfødsel, for tidlig fødsel, spædbørn med lav fødselsvægt eller spædbørn, der er små i forhold til svangerskabsalderen.
To store retrospektive kohortestudier og et case-kontrolstudie har vurderet ondansetroneksponering i første trimester og risiko for kardiovaskulære defekter med inkonsistente fund. Relative risici (RR) varierede fra 0,97 (95 % CI 0,86 til 1,10) til 1,62 (95 % CI 1,04, 2,54). En undergruppeanalyse i et af kohortestudierne observerede, at ondansetron var specifikt forbundet med hjerteseptumdefekter (RR 2,05, 95 % CI 1,19, 3,28); denne sammenhæng blev dog ikke bekræftet i andre undersøgelser.
Adskillige undersøgelser har vurderet ondansetron og risikoen for mundspalter med inkonsistente fund. Et retrospektivt kohortestudie af 1,8 millioner graviditeter i den amerikanske Medicaid-database viste en øget risiko for orale spalter blandt 88.467 graviditeter, hvor oral ondansetron blev ordineret i første trimester (RR 1,24, 95 % CI 1,03, 1,48), men der var ingen sådan sammenhæng. rapporteret med intravenøs ondansetron i 23.866 graviditeter (RR 0,95, 95 % CI 0,63, 1,43). I undergruppen af kvinder, der fik begge administrationsformer, var RR 1,07 (95 % CI 0,59, 1,93). To case-kontrolstudier, der brugte data fra fødselsdefektovervågningsprogrammer, rapporterede modstridende sammenhænge mellem moderens brug af ondansetron og isoleret ganespalte (OR 1,6 [95 % CI 1,1, 2,3] og 0,5 [95 % CI 0,3, 1,0]). Det er ukendt, om ondansetroneksponering in utero i tilfælde af ganespalte fandt sted i løbet af ganens dannelsestid (ganen dannes mellem 6. og 9. graviditetsuge).
Dyredata
undersøgelser af embryo-føtale udvikling hos rotter og kaniner fik drægtige dyr orale doser af ondansetron på op til henholdsvis 15 mg/kg/dag og 30 mg/kg/dag i løbet af organogeneseperioden. Med undtagelse af et let fald i moderens kropsvægtøgning hos kaninerne, var der ingen signifikant effekt af ondansetron på moderens dyr eller udviklingen af afkommet. Ved doser på 15 mg/kg/dag hos rotter og 30 mg/kg/dag hos kaniner var moderens eksponeringsmargin ca. 6 og 24 gange den maksimalt anbefalede orale dosis til mennesker på henholdsvis 24 mg/dag baseret på kropsoverfladeareal .
et præ- og postnatalt udviklingstoksicitetsstudie modtog gravide rotter orale doser af ondansetron på op til 15 mg/kg/dag fra dag 17 af drægtighed til kuld dag 21. Med undtagelse af en lille reduktion i moderens vægtøgning var der ingen virkninger på de drægtige rotter og den præ- og postnatale udvikling af deres afkom, inklusive reproduktionsevnen hos den parrede F1-generation. Ved en dosis på 15 mg/kg/dag til rotter var moderens eksponeringsmargin ca. 6 gange den maksimale anbefalede orale dosis til mennesker på 24 mg/dag baseret på kropsoverfladeareal.
Amning
Risikooversigt
Det vides ikke, om ondansetron er til stede i human mælk. Der er ingen data om virkningerne af ZOFRAN 8mg på det ammede spædbarn eller virkningerne på mælkeproduktionen. Det er dog blevet påvist, at ondansetron er til stede i mælken hos rotter. Når et lægemiddel er til stede i animalsk mælk, er det sandsynligt, at lægemidlet vil være til stede i human mælk.
De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for ZOFRAN 4mg og eventuelle negative virkninger på det ammede spædbarn fra ZOFRAN eller fra den underliggende moderens tilstand.
Pædiatrisk brug
Sikkerheden og effektiviteten af oralt administreret ZOFRAN er blevet fastslået hos pædiatriske patienter 4 år og ældre til forebyggelse af kvalme og opkastning forbundet med moderat emetogen cancerkemoterapi. Brug af ZOFRAN 4 mg i disse aldersgrupper understøttes af beviser fra tilstrækkelige og velkontrollerede undersøgelser af ZOFRAN hos voksne med yderligere data fra 3 åbne, ukontrollerede, ikke-amerikanske forsøg med 182 pædiatriske patienter i alderen 4 til 18 år med cancer som fik en række forskellige cisplatin- eller noncisplatin-regimer [se DOSERING OG ADMINISTRATION , Kliniske Studier ].
Yderligere information om brugen af ondansetron til pædiatriske patienter kan findes i ZOFRAN Injection ordinationsinformation.
Sikkerheden og effektiviteten af oralt administreret ZOFRAN 4 mg er ikke blevet fastslået hos pædiatriske patienter for:
- forebyggelse af kvalme og opkastning forbundet med stærkt emetogen cancerkemoterapi
- forebyggelse af kvalme og opkastning i forbindelse med strålebehandling
- forebyggelse af postoperativ kvalme og/eller opkastning
Geriatrisk brug
Af det samlede antal forsøgspersoner, der var indskrevet i cancerkemoterapi-induceret og postoperativ kvalme og opkastning i amerikansk- og udenlandsk-kontrollerede kliniske forsøg, for hvilke der var undergruppeanalyser, var 938 (19%) i alderen 65 år og ældre.
Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem forsøgspersoner 65 år og ældre og yngre forsøgspersoner. En reduktion i clearance og stigning i eliminationshalveringstid blev set hos patienter over 75 år sammenlignet med yngre forsøgspersoner [se KLINISK FARMAKOLOGI ]. Der var et utilstrækkeligt antal patienter over 75 år og ældre i de kliniske forsøg til at tillade sikkerheds- eller effektkonklusioner i denne aldersgruppe. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre personer kan ikke udelukkes. Dosisjustering er ikke nødvendig hos ældre patienter.
Nedsat leverfunktion
Dosisjustering er ikke nødvendig hos patienter med let eller moderat nedsat leverfunktion.
Hos patienter med svært nedsat leverfunktion er clearance reduceret, og det tilsyneladende distributionsvolumen øges, hvilket resulterer i en signifikant stigning i halveringstiden for ondansetron. Overskrid derfor ikke en samlet daglig dosis på 8 mg til patienter med svært nedsat leverfunktion (Child-Pugh-score på 10 eller højere) [se DOSERING OG ADMINISTRATION , KLINISK FARMAKOLOGI ].
Nedsat nyrefunktion
Ingen dosisjustering anbefales til patienter med nogen grad af nedsat nyrefunktion (mild, moderat eller svær). Der er ingen erfaring ud over den første dags administration af ondansetron [se KLINISK FARMAKOLOGI ].
OVERDOSIS
Der er ingen specifik modgift mod overdosering af ondansetron. Patienter bør behandles med passende understøttende terapi.
Ud over de ovennævnte bivirkninger er følgende bivirkninger blevet beskrevet i forbindelse med overdosering af ondansetron: "Pludselig blindhed" (amaurose) af 2 til 3 minutters varighed plus alvorlig forstoppelse forekom hos en patient, der fik 72 mg ondansetron intravenøst som en enkelt dosis. Hypotension (og besvimelse) forekom hos en patient, der tog 48 mg ZOFRAN-tabletter. Efter infusion af 32 mg over kun en 4-minutters periode blev der observeret en vasovagal episode med forbigående andengrads hjerteblokade. I alle tilfælde forsvandt bivirkningerne fuldstændigt.
Pædiatriske tilfælde i overensstemmelse med serotonergt syndrom er blevet rapporteret efter utilsigtet oral overdosering af ondansetron (over estimeret indtagelse på 5 mg pr. kg) hos små børn. Rapporterede symptomer omfattede somnolens, agitation, takykardi, takypnø, hypertension, rødmen, mydriasis, diaforese, myokloniske bevægelser, horisontal nystagmus, hyperrefleksi og krampeanfald. Patienterne krævede understøttende behandling, inklusive intubation i nogle tilfælde, med fuldstændig bedring uden følgesygdomme inden for 1 til 2 dage.
KONTRAINDIKATIONER
ZOFRAN er kontraindiceret til patienter:
- kendt for at have overfølsomhed (f.eks. anafylaksi) over for ondansetron eller nogen af komponenterne i formuleringen [se BIVIRKNINGER ]
- samtidig med apomorphin på grund af risikoen for dyb hypotension og bevidsthedstab
KLINISK FARMAKOLOGI
Handlingsmekanisme
Ondansetron er en selektiv 5-HT3-receptorantagonist. Selvom dets virkningsmekanisme ikke er blevet fuldstændigt karakteriseret, er ondansetron ikke en dopamin-receptorantagonist. Serotoninreceptorer af 5-HT3-typen er til stede både perifert på vagale nerveterminaler og centralt i kemoreceptor-triggerzonen i area postrema. Det er ikke sikkert, om ondansetrons antiemetiske virkning medieres centralt, perifert eller på begge steder. Imidlertid ser cytotoksisk kemoterapi ud til at være forbundet med frigivelse af serotonin fra enterochromaffincellerne i tyndtarmen. Hos mennesker øges urinudskillelsen af 5-hydroxyindoleddikesyre (5-HIAA) efter administration af cisplatin parallelt med opkastningen. Det frigivne serotonin kan stimulere de vagale afferenter gennem 5-HT3-receptorerne og initiere opkastningsrefleksen.
Farmakodynamik
Hos raske forsøgspersoner havde enkelte intravenøse doser på 0,15 mg/kg ondansetron ingen effekt på esophageal motilitet, gastrisk motilitet, lavere esophageal sphincter tryk eller tyndtarms transittid. Flerdages administration af ondansetron har vist sig at bremse tyktarmstransit hos raske forsøgspersoner. Ondansetron har ingen effekt på plasmaprolaktinkoncentrationer.
Hjerteelektrofysiologi
QTc-intervalforlængelse blev undersøgt i et dobbeltblindt, enkelt-intravenøs dosis, placebo- og positivt kontrolleret, crossover-forsøg med 58 raske forsøgspersoner. Den maksimale gennemsnitlige (95 % øvre konfidensgrænse) forskel i QTcF fra placebo efter baseline-korrektion var 19,5 (21,8) millisekunder og 5,6 (7,4) millisekunder efter 15 minutters intravenøse infusioner af henholdsvis 32 mg og 8 mg ondansetron-injektion. Der blev identificeret et signifikant eksponering-respons-forhold mellem ondansetronkoncentration og ΔΔQTcF. Ved at bruge det etablerede eksponering-respons-forhold havde 24 mg infunderet intravenøst over 15 minutter en gennemsnitlig forudsagt (95 % øvre forudsigelsesinterval) ΔΔQTcF på 14,0 (16,3) millisekunder. I modsætning hertil havde 16 mg infunderet intravenøst over 15 minutter ved brug af den samme model en gennemsnitlig forudsagt (95 % øvre forudsigelsesinterval) ΔΔQTcF på 9,1 (11,2) millisekunder. I denne undersøgelse forlængede den 8 mg dosis, der blev infunderet over 15 minutter, ikke QT-intervallet i nogen klinisk relevant grad.
Farmakokinetik
Absorption
Ondansetron absorberes fra mave-tarmkanalen og gennemgår en vis first-pass metabolisme. Gennemsnitlig biotilgængelighed hos raske forsøgspersoner efter administration af en enkelt 8 mg tablet er ca. 56 %.
Ondansetrons systemiske eksponering stiger ikke proportionalt med dosis. Arealet under kurve (AUC) fra en 16 mg tablet var 24 % større end forudsagt fra en 8 mg tabletdosis. Dette kan afspejle en vis reduktion af first-pass metabolisme ved højere orale doser.
Mad effekter
Biotilgængeligheden øges også lidt af tilstedeværelsen af mad.
Fordeling
Plasmaproteinbinding af ondansetron som målt in vitro var 70 % til 76 % over koncentrationsområdet på 10 til 500 ng/ml. Cirkulerende lægemiddel distribueres også til erytrocytter.
Elimination
Metabolisme og udskillelse
Ondansetron metaboliseres i vid udstrækning hos mennesker, hvor ca. 5 % af en radioaktivt mærket dosis genfindes som moderstoffet fra urinen. Metabolitterne observeres i urinen. Den primære metaboliske vej er hydroxylering på indolringen efterfulgt af efterfølgende glucuronid- eller sulfatkonjugation.
In vitro-metabolismeundersøgelser har vist, at ondansetron er et substrat for humane hepatiske cytochrom P-450-enzymer, herunder CYP1A2, CYP2D6 og CYP3A4. Med hensyn til den samlede ondansetronomsætning spillede CYP3A4 den overvejende rolle. På grund af mangfoldigheden af metaboliske enzymer, der er i stand til at metabolisere ondansetron, er det sandsynligt, at hæmning eller tab af ét enzym (f.eks. CYP2D6 genetisk mangel) vil blive kompenseret af andre og kan resultere i en lille ændring i den samlede hastighed for eliminering af ondansetron.
Selvom nogle ikke-konjugerede metabolitter har farmakologisk aktivitet, findes disse ikke i plasma i koncentrationer, der sandsynligvis bidrager signifikant til ondansetrons biologiske aktivitet.
Specifikke populationer
Alder: Geriatrisk befolkning
En reduktion i clearance og stigning i eliminationshalveringstid ses hos patienter ældre end 75 år sammenlignet med yngre forsøgspersoner [se Brug i specifikke populationer ].
Køn
Kønsforskelle blev vist i disponeringen af ondansetron givet som en enkelt dosis. Omfanget og absorptionshastigheden er større hos kvinder end mænd. Langsommere clearance hos kvinder, et mindre tilsyneladende distributionsvolumen (justeret for vægt) og højere absolut biotilgængelighed resulterede i højere plasmakoncentrationer af ondansetron. Disse højere plasmakoncentrationer kan til dels forklares med forskelle i kropsvægt mellem mænd og kvinder. Det vides ikke, om disse kønsrelaterede forskelle var klinisk vigtige. Mere detaljeret farmakokinetisk information er indeholdt i tabel 5 og 6.
Nedsat nyrefunktion
Nedsat nyrefunktion forventes ikke at påvirke den totale clearance af ondansetron signifikant, da nyreclearance kun udgør 5 % af den samlede clearance. Imidlertid blev den gennemsnitlige plasmaclearance af ondansetron reduceret med ca. 50 % hos patienter med svært nedsat nyrefunktion (kreatininclearance mindre end 30 ml/min). Reduktionen i clearance var variabel og ikke i overensstemmelse med en stigning i halveringstid [se Brug i specifikke populationer ].
Nedsat leverfunktion
Hos patienter med let til moderat nedsat leverfunktion reduceres clearance 2 gange, og den gennemsnitlige halveringstid øges til 11,6 timer sammenlignet med 5,7 timer hos raske forsøgspersoner. Hos patienter med svært nedsat leverfunktion (Child-Pugh-score på 10 eller derover), reduceres clearance 2- til 3-fold, og det tilsyneladende distributionsvolumen øges med en resulterende øgning af halveringstiden til 20 timer [se DOSERING OG ADMINISTRATION , Brug i specifikke populationer ].
Lægemiddelinteraktionsstudier
CYP 3A4 inducere
Eliminering af ondansetron kan blive påvirket af cytochrom P-450-inducere. I et farmakokinetisk forsøg med 16 epileptiske patienter, der blev opretholdt kronisk på CYP3A4-inducere, carbamazepin eller phenytoin, blev der observeret en reduktion i AUC, Cmax og t½ af ondansetron. Dette resulterede i en signifikant stigning i clearance af ondansetron. Denne stigning menes dog ikke at være klinisk relevant [se DRUGSINTERAKTIONER ].
Kemoterapeutiske midler
Carmustin, etoposid og cisplatin påvirker ikke farmakokinetikken af ondansetron [se DRUGSINTERAKTIONER ].
Antacida
Samtidig administration af antacida ændrer ikke absorptionen af ondansetron.
Kliniske Studier
Forebyggelse af kemoterapi-induceret kvalme og opkastning
Meget emetogen kemoterapi
2 randomiserede, dobbeltblindede monoterapiforsøg var en enkelt 24 mg oral dosis af ZOFRAN bedre end en relevant historisk placebokontrol til forebyggelse af kvalme og opkastning forbundet med stærkt emetogen cancerkemoterapi, inklusive cisplatin større end eller lig med 50 mg/m². Steroidadministration blev udelukket fra disse kliniske forsøg. Mere end 90 % af patienterne, der fik en cisplatin-dosis på mere end eller lig med 50 mg/m² i den historiske placebo-komparator, oplevede opkastning i fravær af antiemetisk behandling.
Det første forsøg sammenlignede orale doser af ondansetron 24 mg som en enkelt dosis, 8 mg hver 8. time for 2 doser og 32 mg som en enkelt dosis hos 357 voksne cancerpatienter, der fik kemoterapi regimer indeholdende cisplatin større end eller lig med 50 mg/m² . Den første eller enkelt dosis blev administreret 30 minutter før kemoterapi. I alt 66 % af patienterne i ondansetron 24 mg én gang dagligt, 55 % i ondansetron 8 mg to gange dagligt og 55 % i ondansetron 32 mg én gang dagligt. den 24-timers forsøgsperiode med 0 emetiske episoder og ingen redningshæmmende medicin, det primære effektmål. Hver af de 3 behandlingsgrupper blev vist at være statistisk signifikant bedre end en historisk placebokontrol.
det samme forsøg oplevede 56 % af patienterne, der fik en enkelt 24 mg oral dosis ondansetron ingen kvalme i løbet af den 24-timers forsøgsperiode, sammenlignet med 36 % af patienterne i den orale ondansetron 8 mg to gange dagligt ( P = 0,001) og 50 % i den orale ondansetron 32 mg én gang dagligt. Doseringsregimer af ZOFRAN 8 mg to gange dagligt og 32 mg én gang dagligt anbefales ikke til forebyggelse af kvalme og opkastning forbundet med stærkt emetogen kemoterapi [se DOSERING OG ADMINISTRATION ].
I et andet forsøg blev effekten af en enkelt 24 mg oral dosis af ZOFRAN 4 mg til forebyggelse af kvalme og opkastning forbundet med stærkt emetogen cancerkemoterapi, inklusive cisplatin større end eller lig med 50 mg/m², bekræftet.
Moderat emetogen kemoterapi
Et randomiseret, placebo-kontrolleret, dobbelt-blindt forsøg blev udført i USA med 67 patienter, der fik et cyclophosphamid-baseret kemoterapiregime indeholdende doxorubicin. Den første 8 mg dosis af ZOFRAN 8 mg blev administreret 30 minutter før starten af kemoterapi med en efterfølgende dosis 8 timer efter den første dosis, efterfulgt af 8 mg ZOFRAN 8 mg to gange dagligt i 2 dage efter afslutningen af kemoterapien. ZOFRAN var signifikant mere effektiv end placebo til at forhindre opkastning. Behandlingsrespons var baseret på det samlede antal emetiske episoder over den 3-dages forsøgsperiode. Resultaterne af dette forsøg er opsummeret i tabel 7.
et dobbeltblindt, amerikansk forsøg med 336 patienter, der fik et cyclophosphamid-baseret kemoterapiregime, indeholdende enten methotrexat eller doxorubicin, var ZOFRAN 8 mg administreret to gange dagligt lige så effektivt som ZOFRAN 8 mg administreret 3 gange dagligt til at forebygge kvalme og opkastning. ZOFRAN 8 mg tre gange dagligt er ikke et anbefalet regime til behandling af moderat emetogen kemoterapi [se DOSERING OG ADMINISTRATION ].
Behandlingsrespons var baseret på det samlede antal emetiske episoder over den 3-dages forsøgsperiode. Se tabel 8 for detaljer om de undersøgte doseringsregimer og resultaterne af dette forsøg.
Genbehandling
I enkeltarmsforsøg blev 148 patienter, der fik cyclophosphamid-baseret kemoterapi, genbehandlet med ZOFRAN 8 mg tre gange dagligt under efterfølgende kemoterapi i i alt 396 genbehandlingsforløb. Der forekom ingen emetiske episoder i 314 (79 %) af genbehandlingsforløbene, og kun 1 til 2 emetiske episoder forekom i 43 (11 %) af genbehandlingsforløbene.
Pædiatriske forsøg
Tre åbne, enkeltarmede, ikke-amerikanske forsøg er blevet udført med 182 pædiatriske patienter i alderen 4 til 18 år med cancer, som fik en række forskellige cisplatin- eller noncisplatin-regimer. Startdosis af ZOFRAN 4 mg injektion varierede fra 0,04 til 0,87 mg pr. kg (samlet dosis på 2,16 mg til 12 mg) efterfulgt af administration af orale doser af ZOFRAN 4 mg varierende fra 4 til 24 mg dagligt i 3 dage. I disse forsøg havde 58 % af de 170 evaluerbare patienter et fuldstændigt respons (ingen emetiske episoder) på dag 1. I 2 forsøg svarede responsraterne til ZOFRAN 4 mg tre gange dagligt hos patienter yngre end 12 år til ZOFRAN 8 mg tre gange dagligt hos patienter 12 til 18 år. Forebyggelse af emesis hos disse pædiatriske patienter var stort set den samme som for voksne.
Strålingsinduceret kvalme og opkastning
Total kropsbestråling
et randomiseret, placebokontrolleret, dobbeltblindet forsøg med 20 patienter var 8 mg ZOFRAN administreret 1,5 timer før hver fraktion af strålebehandling i 4 dage signifikant mere effektivt end placebo til at forhindre opkastning forårsaget af bestråling af hele kroppen. Den samlede kropsbestråling bestod af 11 fraktioner (120 cGy pr. fraktion) over 4 dage for i alt 1.320 cGy. Patienterne modtog 3 fraktioner i 3 dage, derefter 2 fraktioner på dag 4.
Enkelt højdosisfraktion strålebehandling
et aktivt kontrolleret, dobbelt-blindt forsøg med 105 patienter, der modtog enkelt højdosis strålebehandling (800 til 1.000 cGy) over en anterior eller posterior feltstørrelse på større end eller lig med 80 cm² til abdomen, var ZOFRAN 4 mg signifikant mere effektiv end metoclopramid med hensyn til fuldstændig kontrol af emesis (0 emetiske episoder). Patienterne fik den første dosis ZOFRAN (8 mg) eller metoclopramid (10 mg) 1 til 2 timer før strålebehandling. Hvis strålebehandling blev givet om morgenen, blev 8 mg ZOFRAN 8 mg eller 10 mg metoclopramid administreret sidst på eftermiddagen og gentaget igen før sengetid. Hvis strålebehandling blev givet om eftermiddagen, tog patienterne 8 mg ZOFRAN 4 mg eller 10 mg metoclopramid kun én gang før sengetid. Patienterne fortsatte med doserne af oral medicin tre gange dagligt i 3 dage.
Daglig fraktioneret strålebehandling
et aktivt kontrolleret, dobbeltblindt forsøg med 135 patienter, der fik et 1- til 4-ugers forløb med fraktioneret strålebehandling (180 cGy-doser) over en feltstørrelse på mere end eller lig med 100 cm² til abdomen, var ZOFRAN 4 mg signifikant mere effektiv end prochlorperazin med hensyn til fuldstændig kontrol af emesis (0 emetiske episoder). Patienterne fik den første dosis ZOFRAN (8 mg) eller prochlorperazin (10 mg) 1 til 2 timer før den første daglige strålebehandlingsfraktion med efterfølgende 8 mg doser ca. hver 8. time på hver dag med strålebehandling.
Postoperativ kvalme og opkastning
2 placebo-kontrollerede, dobbeltblindede forsøg (det ene udført i USA og det andet uden for USA) med 865 kvinder, der gennemgår kirurgiske indgreb, blev ZOFRAN 16 mg som enkeltdosis eller placebo administreret en time før induktion af generel balanceret anæstesi (barbiturat, opioid, dinitrogenoxid, neuromuskulær blokade og supplerende isofluran eller enfluran), var ZOFRAN-tabletter signifikant mere effektive end placebo til at forhindre postoperativ kvalme og opkastning.
Der er ikke udført forsøg med mænd.
PATIENTOPLYSNINGER
QT forlængelse
Informer patienterne om, at ZOFRAN kan forårsage alvorlige hjertearytmier, såsom QT-forlængelse. Instruer patienterne i at fortælle deres læge med det samme, hvis de oplever en ændring i deres hjertefrekvens, hvis de føler sig svimmel, eller hvis de har en synkopal episode [se ADVARSLER OG FORHOLDSREGLER ].
Overfølsomhedsreaktioner
Informer patienterne om, at ZOFRAN 4 mg kan forårsage overfølsomhedsreaktioner, nogle så alvorlige som anafylaksi og bronkospasme. Instruer patienterne i straks at rapportere alle tegn og symptomer på overfølsomhedsreaktioner, herunder feber, kulderystelser, udslæt eller vejrtrækningsproblemer til deres læge [se ADVARSLER OG FORHOLDSREGLER ].
Maskering af progressiv ileus og gastrisk udspiling
Informer patienter efter abdominal kirurgi eller dem med kemoterapi-induceret kvalme og opkastning om, at ZOFRAN 4mg kan maskere tegn og symptomer på tarmobstruktion. Instruer patienterne i straks at rapportere alle tegn eller symptomer, der er forenelige med en potentiel tarmobstruktion, til deres læge [se ADVARSLER OG FORHOLDSREGLER ].
Lægemiddelinteraktioner
- Instruer patienten i at rapportere brugen af al medicin, især apomorphin, til deres læge. Samtidig brug af apomorphin og ZOFRAN kan forårsage et betydeligt blodtryksfald og bevidsthedstab.
- Informer patienter om muligheden for serotonergt syndrom ved samtidig brug af ZOFRAN 8mg og et andet serotonergt middel, såsom medicin til behandling af depression og migræne. Råd til patienter om at søge omgående lægehjælp, hvis følgende symptomer opstår: ændringer i mental status, autonom ustabilitet, neuromuskulære symptomer med eller uden gastrointestinale symptomer [se ADVARSLER OG FORHOLDSREGLER ].
Administration af ZOFRAN 4mg ODT oralt desintegrerende tabletter
Instruer patienterne i ikke at fjerne ZOFRAN 4mg ODT oralt desintegrerende tabletter fra blisterpakningen før lige før dosering.
- Forsøg ikke at skubbe ZOFRAN 8mg ODT oralt desintegrerende tabletter gennem foliebagsiden.
- Med tørre hænder trækker du foliebagsiden af 1 blister tilbage og fjerner forsigtigt tabletten.
- Anbring straks ZOFRAN ODT oralt desintegrerende tablet oven på tungen, hvor den vil opløses på få sekunder, og synk derefter med spyt.
- Administration med væske er ikke nødvendig.
- Aftagelige illustrerede klistermærker er klæbet på produktkartonen, som kan leveres med recepten for at sikre korrekt brug og håndtering af produktet.
