Casodex 50mg Bicalutamide Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Casodex, og hvordan bruges det?
Casodex er en receptpligtig medicin, der bruges til at behandle symptomerne på prostatakræft. Casodex 50mg kan bruges alene eller sammen med anden medicin.
Casodex 50mg tilhører en klasse af lægemidler kaldet Antineoplastics, Antiandrogen; CYP3A4-hæmmer, moderat.
Det vides ikke, om Casodex er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Casodex?
Casodex kan forårsage alvorlige bivirkninger, herunder:
- brystsmerter eller hævelse,
- blod i din urin,
- feber,
- kuldegysninger,
- pludselige brystsmerter eller ubehag,
- hvæsen,
- tør hoste,
- stakåndet,
- bleg hud,
- svimmelhed,
- hurtig puls,
- koncentrationsbesvær,
- kvalme,
- smerter i øvre mave,
- træthedsfornemmelse,
- mistet appetiten,
- mørk urin,
- lerfarvede afføring,
- gulfarvning af huden eller øjnene (gulsot),
- øget tørst,
- øget vandladning,
- sult,
- tør mund,
- frugtig ånde lugt,
- døsighed,
- tør hud,
- sløret syn, og
- vægttab
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Casodex 50mg omfatter:
- hedeture,
- smerter i ryggen,
- bækkensmerter,
- mavesmerter,
- hævelse i dine hænder, ankler eller fødder,
- øget natlig vandladning,
- svaghed,
- svimmelhed,
- kvalme,
- diarré, og
- forstoppelse
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Casodex. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
CASODEX® (bicalutamid) tabletter indeholder 50 mg bicalutamid, en ikke-steroid androgenreceptorhæmmer uden anden kendt endokrin aktivitet. Det kemiske navn er propanamid, N [4-cyano-3-(trifluormethyl)phenyl]-3-[(4-fluorphenyl)sulfonyl]-2-hydroxy-2-methyl-,(+-). De strukturelle og empiriske formler er:
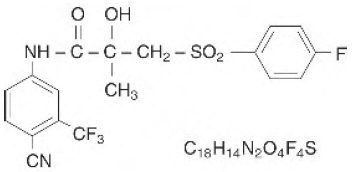
Bicalutamid har en molekylvægt på 430,37. pKa' er cirka 12. Bicalutamid er et fint hvidt til råhvidt pulver, som er praktisk talt uopløseligt i vand ved 37°C (5 mg pr. 1000 ml), let opløseligt i chloroform og absolut ethanol, tungtopløseligt i methanol og opløseligt i acetone og tetrahydrofuran.
CASODEX er et racemat, hvor dets antiandrogene aktivitet næsten udelukkende udvises af R-enantiomeren af bicalutamid; S-enantiomeren er i det væsentlige inaktiv.
De inaktive ingredienser i CASODEX 50 mg tabletter er lactose, magnesiumstearat, hypromellose, polyethylenglycol, polyvidon, natriumstivelsesglycolat og titaniumdioxid.
INDIKATIONER
CASODEX 50 mg dagligt er indiceret til brug i kombinationsterapi med en luteiniserende hormon-frigivende hormon (LHRH) analog til behandling af Stage D2 metastatisk carcinom i prostata.
CASODEX 150 mg dagligt er ikke godkendt til brug alene eller sammen med andre behandlinger [se Kliniske Studier ].
DOSERING OG ADMINISTRATION
Anbefalet dosis og tidsplan
Den anbefalede dosis til CASODEX 50 mg-behandling i kombination med en LHRH-analog er én 50 mg tablet én gang dagligt (morgen eller aften), med eller uden mad. Det anbefales, at CASODEX 50 mg tages på samme tidspunkt hver dag. Behandling med CASODEX bør startes samtidig med behandling med en LHRH-analog. Hvis en dosis af CASODEX 50 mg glemmes, skal du tage den næste dosis på det planlagte tidspunkt. Tag ikke den glemte dosis og fordoble ikke den næste dosis.
Dosisjustering ved nedsat nyrefunktion
Dosisjustering er ikke nødvendig for patienter med nedsat nyrefunktion [se Brug i specifikke populationer ].
Dosisjustering ved nedsat leverfunktion
Dosisjustering er ikke nødvendig for patienter med let til moderat nedsat leverfunktion. Hos patienter med alvorligt nedsat leverfunktion (n=4), selvom der var en stigning på 76 % i halveringstiden (henholdsvis 5,9 og 10,4 dage for normale og nedsatte patienter) af den aktive enantiomer af bicalutamid, er dosisjustering ikke nødvendig [ se Brug i specifikke populationer ].
HVORDAN LEVERET
Doseringsformer og styrke
CASODEX® (bicalutamid) 50 mg tabletter til oral administration.
Hvide, filmovertrukne tabletter (identificeret på den ene side med "CDX50" og på bagsiden med "CASODEX-logoet") leveres i enhedsdosisflasker med 30 tabletter (0310-0705-30).
Opbevaring og håndtering
Opbevares ved kontrolleret stuetemperatur, 20°-25°C (68°-77°F).
Fremstillet for: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Revideret: marts 2017.
BIVIRKNINGER
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Erfaring med kliniske forsøg
Hos patienter med fremskreden prostatacancer behandlet med CASODEX 50 mg i kombination med en LHRH-analog var den hyppigste bivirkning hedeture (53%).
I det multicenter, dobbeltblindede, kontrollerede kliniske forsøg, der sammenlignede CASODEX 50 mg én gang dagligt med flutamid 250 mg tre gange dagligt, hver i kombination med en LHRH-analog, de følgende bivirkninger med en forekomst på 5 % eller mere, uanset kausalitet, er blevet rapporteret.
Andre bivirkninger (større end eller lig med 2 %, men mindre end 5 %) rapporteret i CASODEX-LHRH-analogbehandlingsgruppen er anført nedenfor efter kropssystem og er i rækkefølge efter faldende frekvens inden for hvert kropssystem uanset årsagssammenhæng.
Kroppen som helhed: Neoplasma; Nakke smerter; Feber; Kuldegysninger; Sepsis; Brok; Cyste
Kardiovaskulær: Hjertekrampe; Kongestiv hjertesvigt; Myokardieinfarkt; Hjertestop; Koronararterielidelse; Synkope
Fordøjelse: Melena; rektal blødning; Tør mund; Dysfagi; Gastrointestinal lidelse; parodontal absces; Gastrointestinalt karcinom
Metabolisk og ernæringsmæssig: Ødem; BUN Øget; Kreatinin øget; Dehydrering; Gigt; Hyperkolesteræmi
Muskuloskeletale: Myalgi; Kramper i benene
Nervøs: hypertoni; Forvirring; Somnolens; Libido nedsat; neuropati; Nervøsitet
Åndedræt: Lungelidelse; Astma; Epistaxis; Bihulebetændelse
Hud og vedhæng: Tør hud; Alopeci; Kløe; Herpes zoster; Hudkarcinom; Hudlidelse
Særlige sanser: Grå stær specificeret
Urogenital: Dysuri; Urinary Urgency; Hydronefrose; Urinvejslidelse
Unormale laboratorietestværdier:
Laboratorieabnormiteter, herunder: forhøjet AST, ALT, bilirubin, BUN og kreatinin; og nedsat hæmoglobin og hvide blodlegemer er blevet rapporteret hos både CASODEX-LHRH-analogbehandlede og flutamid-LHRH-analogbehandlede patienter.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af CASODEX efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Åndedrætsforstyrrelser: Interstitiel lungesygdom (nogle dødelig) inklusive interstitiel pneumonitis og lungefibrose, oftest ved doser større end 50 mg.
Hud- og subkutane vævssygdomme: Lysfølsomhed
DRUGSINTERAKTIONER
Kliniske undersøgelser har ikke vist nogen lægemiddelinteraktioner mellem bicalutamid og LHRH-analoger (goserelin eller leuprolid). Der er ingen beviser for, at bicalutamid inducerer leverenzymer.
In vitro undersøgelser har vist, at R-bicalutamid er en hæmmer af CYP 3A4 med mindre hæmmende effekt på CYP 2C9, 2C19 og 2D6 aktivitet. Kliniske undersøgelser har vist, at ved samtidig administration af CASODEX kan gennemsnitlige midazolam-niveauer (et CYP 3A4-substrat) øges 1,5 gange (for Cmax) og 1,9 gange (for AUC). Der bør derfor udvises forsigtighed, når CASODEX 50 mg administreres sammen med CYP 3A4-substrater.
In vitro proteinbindingsundersøgelser har vist, at bicalutamid kan fortrænge coumarinantikoagulanter fra bindingssteder. Protrombintider bør overvåges nøje hos patienter, der allerede får coumarinantikoagulantia, og som er startet på CASODEX 50 mg, og justering af antikoagulantdosis kan være nødvendig.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Hepatitis
Tilfælde af dødsfald eller hospitalsindlæggelse på grund af alvorlig leverskade (leversvigt) er blevet rapporteret efter markedsføring i forbindelse med brugen af CASODEX. Hepatotoksicitet i disse rapporter forekom generelt inden for de første tre til fire måneder af behandlingen. Hepatitis eller markant stigning i leverenzymer, der førte til seponering af lægemidlet, forekom hos ca. 1 % af CASODEX-patienterne i kontrollerede kliniske forsøg.
Serumtransaminaseniveauer bør måles før påbegyndelse af behandling med CASODEX, med regelmæssige intervaller i de første fire måneder af behandlingen og periodisk derefter. Hvis der opstår kliniske symptomer eller tegn, der tyder på leverdysfunktion (f.eks. kvalme, opkastning, mavesmerter, træthed, anoreksi, "influenzalignende" symptomer, mørk urin, gulsot eller ømhed i den øverste højre kvadrant), transaminaser i serum, især serum ALT, bør måles med det samme. Hvis en patient på noget tidspunkt har gulsot, eller deres ALAT stiger til over to gange den øvre normalgrænse, skal CASODEX seponeres øjeblikkeligt med tæt opfølgning af leverfunktionen.
Gynækomasti og brystsmerter
I kliniske forsøg med CASODEX 150 mg som et enkelt middel mod prostatacancer er gynækomasti og brystsmerter blevet rapporteret hos henholdsvis op til 38 % og 39 % af patienterne.
Glucosetolerance
En reduktion i glucosetolerance er blevet observeret hos mænd, der fik LHRH-agonister. Dette kan vise sig som diabetes eller tab af glykæmisk kontrol hos dem med allerede eksisterende diabetes. Det bør derfor overvejes at måle blodsukkeret hos patienter, der får CASODEX 50 mg i kombination med LHRH-agonister.
Laboratorieprøver
Regelmæssige vurderinger af serum prostataspecifikt antigen (PSA) kan være nyttige til at overvåge patientens respons. Hvis PSA-niveauer stiger under CASODEX 50 mg-behandling, skal patienten evalueres for klinisk progression. For patienter, som har objektiv progression af sygdom sammen med en forhøjet PSA, kan en behandlingsfri periode med antiandrogen, mens LHRH-analogen fortsættes, overvejes.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER ).
Dosis og tidsplan
Informer patienterne om, at behandling med CASODEX 50 mg og LHRH-analogen bør startes samtidigt, og at de ikke bør afbryde eller stoppe med at tage disse lægemidler uden at konsultere deres læge [se DOSERING OG ADMINISTRATION ].
Hepatitis
Informer patienterne om, at CASODEX kan forårsage hepatitis, som kan resultere i leversvigt og død. Rådgiv patienterne om, at leverfunktionsprøver bør overvåges regelmæssigt under behandlingen og at rapportere tegn og symptomer på hepatitis [se ADVARSLER OG FORHOLDSREGLER ].
Glucosetolerance
Informer patienterne om, at diabetes eller tab af glykæmisk kontrol hos patienter med allerede eksisterende diabetes er blevet rapporteret under behandling med LHRH-agonister. Det bør derfor overvejes at monitorere blodsukker hos patienter, der får CASODEX i kombination med LHRH-agonister [se ADVARSLER OG FORHOLDSREGLER ].
Somnolens
Under behandling med CASODEX er der rapporteret om søvnighed. Råd til patienter, der oplever dette symptom, om at udvise forsigtighed, når de kører bil eller betjener maskiner [se BIVIRKNINGER ].
Lysfølsomhed
Informer patienterne om, at tilfælde af lysfølsomhed er blevet rapporteret under behandling med CASODEX, og at de bør undgå direkte eksponering for overdreven sollys eller UV-lys. Det bør overvejes at bruge solcreme [se BIVIRKNINGER ].
Prævention og fertilitet
Rådgiv mandlige patienter med kvindelige partnere med reproduktionspotentiale om at bruge effektiv prævention under behandlingen og i 130 dage efter den sidste dosis af CASODEX 50 mg behandling. Informer mandlige patienter om, at CASODEX kan svække fertiliteten [se Brug i specifikke populationer ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Toårige orale karcinogenicitetsundersøgelser blev udført i både han- og hunrotter og -mus i doser på 5, 15 eller 75 mg/kg/dag af bicalutamid. En række forskellige tumormålorganeffekter blev identificeret og blev tilskrevet antiandrogeniciteten af bicalutamid, nemlig testikelbenigne interstitielle (Leydig) celletumorer hos hanrotter ved alle dosisniveauer (steady-state plasmakoncentrationen med 5 mg/kg/dag dosis er ca. 0,7 gange den humane eksponering ved den anbefalede dosis) og uterint adenokarcinom hos hunrotter ved 75 mg/kg/dag (ca. 1,5 gange den humane eksponering ved den anbefalede dosis). Der er ingen tegn på Leydig-cellehyperplasi hos patienter; livmodertumorer er ikke relevante for den angivne patientpopulation.
En lille stigning i forekomsten af hepatocellulært carcinom hos hanmus, der fik 75 mg/kg/dag af bicalutamid (ca. 4 gange den humane eksponering ved den anbefalede dosis) og en øget forekomst af benigne skjoldbruskkirtelfollikulære celleadenomer hos rotter, der fik 5 mg/kg /dag (ca. 0,7 gange den humane eksponering ved den anbefalede dosis) og derover blev registreret. Disse neoplastiske ændringer var progressioner af ikke-neoplastiske forandringer relateret til leverenzyminduktion observeret i dyretoksicitetsundersøgelser. Enzyminduktion er ikke blevet observeret efter administration af bicalutamid til mennesker. Der var ingen tumorogene virkninger, der tydede på genotoksisk karcinogenese.
Et omfattende batteri af genotoksicitetstests både in vitro og in vivo (gærgenkonvertering, Ames, E. coli, CHO/HGPRT, cytogenetiske cytogenetiske lymfocytter, muse-mikronukleus- og rotteknoglemarvscytogenetiske tests) har vist, at bicalutamid ikke har genotoksisk aktivitet .
toksikologiske undersøgelser med gentagne doser er atrofi af sædrør i testiklerne observeret for alle undersøgte arter, hvilket er en forudsagt klasseeffekt med antiandrogener. I 6- og 12-måneders rottestudiet blev testikelatrofi set ved ca. 2 gange den humane eksponering ved den anbefalede dosis. I det 12-måneders hundestudie blev forekomsten af testikelatrofi set ved ca. 7 gange den humane eksponering ved den anbefalede dosis. Hos hanrotter, der fik 250 mg/kg/dag (ca. 2 gange human eksponering ved den anbefalede dosis), blev det præcoitale interval og tiden til vellykket parring øget i den første parring, men der blev ikke set nogen effekt på fertiliteten efter vellykket parring. Disse virkninger blev vendt 7 uger efter afslutningen af en 11-ugers periode med dosering.
Hunrotter doseret med 1, 10 og 250 mg/kg/dag (mindre end 2 gange den humane eksponering ved den anbefalede dosis) havde øget uregelmæssighed i brunstcyklussen, men der var ingen effekt på fertiliteten.
et peri- og postnatalt udviklingsstudie havde hunrotter, der fik doser på 10 mg/kg/dag (ca. 0,7 gange den humane eksponering ved den anbefalede kliniske dosis) og derover, reduceret graviditetsrater. Administration af bicalutamid til gravide kvinder resulterede i feminisering af det mandlige afkom, hvilket førte til hypospadi ved doser på 10 mg/kg/dag (ca. 0,7 gange den humane eksponering ved den anbefalede dosis) og derover. Berørte mandlige afkom var også impotente.
Brug i specifikke populationer
Graviditet
Risikooversigt
CASODEX er kontraindiceret til brug hos gravide kvinder, fordi det kan forårsage fosterskader. CASODEX 50mg er ikke indiceret til brug hos kvinder. Der er ingen humane data om brugen af CASODEX 50mg til gravide kvinder. I reproduktionsstudier på dyr forårsagede oral administration af bicalutamid til drægtige rotter under organogenese unormal udvikling af reproduktionsorganer hos hanfostre ved eksponeringer på ca. 0,7 til 2 gange den humane eksponering ved den anbefalede dosis (se Data ).
Data
Dyredata
et embryo-føtalt udviklingsstudie hos drægtige rotter doseret i løbet af organogeneseperioden fra drægtighedsdage 6-15 havde hanfostre reduceret anogenital afstand ved doser på 10 mg/kg/dag og derover (ca. 0,7 til 2 gange den humane eksponering kl. den anbefalede dosis).
I en præ- og postnatal udviklingsundersøgelse blev hunrotter doseret fra drægtighedsdag 7-16 og fik lov til at kuld og opdrage deres afkom til fravænning . Hanafkom af rotter, der fik doser på 10 mg/kg/dag (ca. 0,7 gange den humane eksponering ved den anbefalede dosis) og derover, blev observeret at have reduceret anogenital afstand.
et peri- og postnatalt udviklingsstudie blev hunrotter doseret fra drægtighedsdag 16 til laktationsdag 22 og fik lov til at kuld og opfostre deres afkom til fravænning. Overlevelse og vægt af afkom under diegivning blev reduceret for kuld fra maternelle rotter, der fik doser på 250 mg/kg/dag (ca. 2 gange den humane eksponering ved den anbefalede dosis). Hanafkom af rotter, der fik doser på 10 mg/kg/dag (ca. 0,7 gange den humane eksponering ved den anbefalede dosis) og derover, blev observeret at have reduceret anogenital afstand, mindre sekundære kønsorganer, kryptorkisme og hypospadier, hvilket resulterede i manglende evne til at parre sig. og imprægnere deres kvindelige partnere. Hunrotter, der modtog doser på 10 mg/kg/dag (ca. 0,7 gange den humane eksponering ved den anbefalede dosis) og derover havde reduceret graviditetsrater.
Amning
Risikooversigt
CASODEX 50mg er ikke indiceret til brug hos gravide kvinder. Der er ingen tilgængelig information om tilstedeværelsen af bicalutamid i modermælk eller om virkningen på det ammede spædbarn eller på mælkeproduktionen. Bicalutamid er blevet påvist i rottemælk.
Hunner og mænd med reproduktionspotentiale
Svangerskabsforebyggelse
Hanner
Antiandrogenbehandling kan forårsage morfologiske ændringer i spermatozoer [se Ikke-klinisk toksikologi ]. Baseret på resultater fra dyreforplantningsundersøgelser og dets virkningsmekanisme, rådgiv mandlige patienter med kvindelige partnere med reproduktionspotentiale om at bruge effektiv prævention under behandlingen og i 130 dage efter den sidste dosis af CASODEX [se Graviditet og KLINISK FARMAKOLOGI ].
Infertilitet
Hanner

Baseret på dyreforsøg kan CASODEX 50 mg føre til hæmning af spermatogenese og kan forringe fertiliteten hos mænd med reproduktionspotentiale. De langsigtede virkninger af CASODEX 50 mg på mandlig fertilitet er ikke blevet undersøgt [se Ikke-klinisk toksikologi ].
Pædiatrisk brug
Sikkerheden og effektiviteten af CASODEX 50 mg hos pædiatriske patienter er ikke blevet fastslået.
CASODEX (bicalutamid) smeltetablet blev undersøgt i kombination med ARIMIDEX (anastrozol) smeltetablet i et åbent, ikke-sammenlignende multicenter-studie, der vurderede effektiviteten og sikkerheden af denne kombinationsbehandling over 12 måneder i behandlingen af gonadotropin-uafhængig tidlig pubertet hos drenge med familiær mandlig begrænset tidlig pubertet, også kendt som testotoksikose. Patienter blev inkluderet i undersøgelsen, hvis de havde en baselinealder ≥2 år og en diagnose af testotoksikose baseret på kliniske træk ved progressiv tidlig pubertet, symmetrisk testikelforstørrelse, fremskreden knoglealder, pubertale niveauer af serum testosteron, præpubertet mønster af gonadotropinsekretion efter en GnRH-stimuleringstest og fravær af andre kliniske og biokemiske årsager til testosteronoverskud. Tretten ud af de 14 inkluderede patienter gennemførte 12 måneders kombinationsbehandling (en patient gik tabt til opfølgning). Hvis central tidlig pubertet (CPP) udviklede sig, skulle en LHRH-analog tilføjes. Fire patienter blev diagnosticeret med CPP i løbet af det 12-måneders studie og modtog LHRH analog behandling, og 2 yderligere patienter blev diagnosticeret ved udgangen af de 12 måneder og modtog efterfølgende behandling. Middel ± SD karakteristika ved baseline var som følger: kronologisk alder: 3,9±1,9 år; knoglealder 8,8±2,5; knoglealder/kronologisk aldersforhold: 2,06±0,51; væksthastighed (cm/år): 10,81±4,22; vækstrate standardafvigelsesscore (SDS): 0,41±1,36.
Startdosis CASODEX var 12,5 mg. CASODEX blev titreret i hver patient, indtil steady-state R-bicalutamid (den aktive isomer af bicalutamid) laveste plasmakoncentration nåede 5-15 mcg/ml, hvilket er intervallet af terapeutiske koncentrationer opnået hos voksne med prostatacancer efter administration af den pt. godkendt CASODEX dosis på 50 mg. Den daglige startdosis af anastrozol var 0,5 mg. Anastrozol blev titreret uafhængigt i hver patient, indtil det ved steady-state nåede en serum-estradiolkoncentration på
Studiets primære effektivitetsanalyse var at vurdere ændringen i væksthastighed efter 12 måneders behandling i forhold til væksthastigheden i løbet af ≥6 måneder før indtræden i undersøgelsen. Væksthastigheder før undersøgelse blev opnået retrospektivt. Der var ingen statistisk evidens for, at væksthastigheden blev reduceret under behandlingen. Under CASODEX/ARIMIDEX-behandling faldt den gennemsnitlige væksthastighed (cm/år) med 1,6 cm/år, 95 % CI (-4,7 til 1,5) p=0,28; den gennemsnitlige vækstrate SDS faldt med 0,1 SD, 95 % CI (–1,2 til 1,0) p=0,88. Tabel 2 viser beskrivende data for vækstrater for den overordnede population og for undergrupper defineret af historie med tidligere behandling for testotoksikose med ketoconazol, spironolacton, anastrozol eller andre aromatasehæmmere.
De samlede testosteronkoncentrationer steg med et gennemsnit på 5 mmol/L i løbet af de 12 måneders behandling fra en baseline-gennemsnit på 10 mmol/L. Østradiolkoncentrationer var på eller under niveauet for kvantificering (9,81 pmol/L) for 11 ud af 12 patienter efter 12 måneders behandling. Seks af de 12 patienter startede behandlingen med en østradiolkoncentration under kvantificeringsniveauet.
Der var ingen dødsfald, alvorlige bivirkninger eller seponeringer på grund af bivirkninger under undersøgelsen. Af de 14 patienter, der blev udsat for undersøgelsesbehandling, oplevede 13 (92,9 %) mindst én bivirkning. De hyppigst rapporterede (>3 patienter) bivirkninger var gynækomasti (7/14, 50 %), central tidlig pubertet (6/14, 43 %), opkastning (5/14, 36 %), hovedpine (3/14, 21 %), pyreksi (3/14, 21 %) og øvre luftvejsinfektion (3/14, 21 %). Bivirkninger, som efterforskerne anså for muligvis at være relateret til bicalutamid, omfattede gynækomasti (6/14, 43 %), central tidlig pubertet (2/14, 14 %), ømhed i brysterne (2/14, 14 %), brystsmerter (1/14, 7%), asteni (1/14, 7%), øget alaninaminotransferase [ALT] (1/14, 7%), øget aspartataminotransferase [AST] (1/14, 7%) og muskuloskeletale brystsmerter (1 /14, 7 %). Hovedpine var den eneste bivirkning, som efterforskerne anså for muligvis at være relateret til anastrozol. For patienten, der udviklede forhøjet ALAT og ASAT, var forhøjelsen
Geriatrisk brug
to undersøgelser med patienter, der fik 50 eller 150 mg dagligt, er der ikke påvist nogen signifikant sammenhæng mellem alder og steady-state niveauer af total bicalutamid eller den aktive R-enantiomer.
Nedsat leverfunktion
CASODEX bør anvendes med forsigtighed til patienter med moderat til svær leverinsufficiens. CASODEX metaboliseres i vid udstrækning i leveren. Begrænsede data fra forsøgspersoner med svær leverinsufficiens tyder på, at udskillelsen af CASODEX kan blive forsinket og kan føre til yderligere akkumulering. Periodiske leverfunktionstest bør overvejes for patienter med nedsat leverfunktion i langtidsbehandling [se ADVARSLER OG FORHOLDSREGLER ].
Der blev ikke observeret nogen klinisk signifikant forskel i farmakokinetikken af enantiomer af bicalutamid hos patienter med mild til moderat leversygdom sammenlignet med raske kontroller. Halveringstiden for R-enantiomeren blev dog øget med ca. 76 % (5,9 og 10,4 dage for henholdsvis normale og svækkede patienter) hos patienter med alvorlig leversygdom (n=4).
Nedsat nyrefunktion
Nedsat nyrefunktion (målt ved kreatininclearance) havde ingen signifikant effekt på elimineringen af total bicalutamid eller den aktive R-enantiomer.
OVERDOSIS
Langsigtede kliniske forsøg er blevet udført med doser op til 200 mg CASODEX 50 mg dagligt, og disse doser er blevet godt tolereret. En enkelt dosis CASODEX 50 mg, der resulterer i symptomer på en overdosis, der anses for at være livstruende, er ikke blevet fastlagt.
Der er ingen specifik modgift; behandling af en overdosis bør være symptomatisk.
Ved håndtering af en overdosis med CASODEX 50 mg kan opkastning fremkaldes, hvis patienten er opmærksom. Det skal huskes, at der i denne patientpopulation kan være taget flere lægemidler. Dialyse vil sandsynligvis ikke være nyttig, da CASODEX er stærkt proteinbundet og metaboliseres i vid udstrækning. Generel understøttende behandling, herunder hyppig overvågning af vitale tegn og tæt observation af patienten, er indiceret.
KONTRAINDIKATIONER
Casodex er kontraindiceret ved:
Overfølsomhed
CASODEX 50mg er kontraindiceret til enhver patient, der har vist en overfølsomhedsreaktion over for lægemidlet eller nogen af tablettens komponenter. Overfølsomhedsreaktioner inklusive angioneurotisk ødem og urticaria er blevet rapporteret.
Kvinder
CASODEX 50mg har ingen indikation for kvinder og bør ikke anvendes til denne population.
Graviditet
CASODEX 50mg kan forårsage fosterskader, når det administreres til en gravid kvinde [se Brug i specifikke populationer ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
CASODEX 50mg er en ikke-steroid androgenreceptorhæmmer. Det hæmmer kompetitivt virkningen af androgener ved at binde sig til cytosol androgen-receptorer i målvævet. Prostatakarcinom er kendt for at være androgenfølsomt og reagerer på behandling, der modvirker virkningen af androgen og/eller fjerner kilden til androgen.
Når CASODEX 50mg kombineres med LHRH-analogbehandling, påvirkes suppressionen af serumtestosteron induceret af LHRH-analogen ikke. I kliniske forsøg med CASODEX som et enkelt middel mod prostatacancer er der dog observeret stigninger i serumtestosteron og østradiol.
Hos en undergruppe af patienter, der er blevet behandlet med CASODEX og en LHRH-agonist, og som ophører med CASODEX 50 mg-behandling på grund af progressiv fremskreden prostatacancer, kan en reduktion i prostataspecifikt antigen (PSA) og/eller klinisk forbedring (fænomenet med antiandrogenabstinenser) være observeret.
Farmakokinetik
Absorption
Bicalutamid absorberes godt efter oral administration, selvom den absolutte biotilgængelighed er ukendt. Samtidig administration af bicalutamid med mad har ingen klinisk signifikant effekt på hastigheden eller omfanget af absorption.
Fordeling
Bicalutamid er stærkt proteinbundet (96%) [se DRUGSINTERAKTIONER ].
Metabolisme/Eliminering
Bicalutamid gennemgår stereospecifik metabolisme. Den S (inaktive) isomer metaboliseres primært ved glucuronidering. Den R (aktive) isomer gennemgår også glukuronidering, men oxideres overvejende til en inaktiv metabolit efterfulgt af glucuronidering. Både moder- og metabolitten glucuronider elimineres i urinen og afføringen. S-enantiomeren fjernes hurtigt i forhold til R-enantiomeren, hvor R-enantiomeren tegner sig for ca. 99% af de samlede steady-state plasmaniveauer.
Farmakokinetik af den aktive enantiomer af CASODEX 50 mg hos normale mænd og patienter med prostatacancer er vist i tabel 3.
Kliniske Studier
CASODEX 50 mg dagligt i kombination med en LHRH-A
et multicenter, dobbeltblindet, kontrolleret klinisk forsøg blev 813 patienter med tidligere ubehandlet fremskreden prostatacancer randomiseret til at modtage CASODEX 50 mg én gang dagligt (404 patienter) eller flutamid 250 mg (409 patienter) tre gange dagligt, hver i kombination med LHRH-analoger (enten goserelinacetatimplantat eller leuprolidacetatdepot).
I en analyse udført efter en median opfølgning på 160 uger var nået, var 213 (52,7 %) patienter behandlet med CASODEX-LHRH analog terapi og 235 (57,5 %) patienter behandlet med flutamid-LHRH analog terapi døde. Der var ingen signifikant forskel i overlevelse mellem behandlingsgrupperne (se figur 1). Hazard ratio for tid til død (overlevelse) var 0,87 (95 % konfidensinterval 0,72 til 1,05).
Figur 1 - Kaplan-Meier-sandsynligheden for død for begge antiandrogenbehandlingsgrupper. 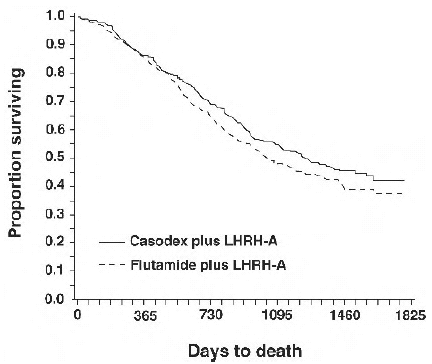
Der var ingen signifikant forskel i tid til objektiv tumorprogression mellem behandlingsgrupper (se figur 2). Objektiv tumorprogression blev defineret som forekomsten af eventuelle knoglemetastaser eller forværring af eksisterende knoglemetastaser på knoglescanning, der kan tilskrives metastatisk sygdom, eller en stigning på 25 % eller mere af eventuelle eksisterende målbare ekstraskeletale metastaser. Fareforholdet for tid til progression af CASODEX plus LHRH-analog til det for flutamid plus LHRH-analog var 0,93 (95 % konfidensinterval, 0,79 til 1,10).
Figur 2 - Kaplan-Meier-kurve for tid til progression for begge antiandrogenbehandlingsgrupper. 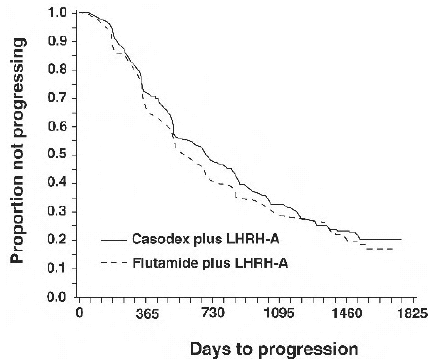
Livskvalitet blev vurderet med selvadministrerede patientspørgeskemaer om smerte, social funktion, følelsesmæssigt velvære, vitalitet, aktivitetsbegrænsning, sengehandicap, overordnet helbred, fysisk kapacitet, generelle symptomer og behandlingsrelaterede symptomer. Vurdering af livskvalitetsspørgeskemaerne viste ikke konsistente signifikante forskelle mellem de to behandlingsgrupper.
Sikkerhedsdata fra kliniske undersøgelser med CASODEX 150 mg
CASODEX 150 mg er ikke godkendt til brug hverken alene eller sammen med andre behandlinger.
To identiske multicenter, randomiserede, åbne forsøg, der sammenlignede CASODEX 150 mg daglig monoterapi med kastration, blev udført hos patienter, der havde lokalt fremskreden (T3-4, NX, M0) eller metastatisk (M1) prostatacancer.
Monoterapi – M1 Gruppe
CASODEX 150 mg dagligt er ikke godkendt til brug hos patienter med M1-kræft i prostata. Baseret på en foreløbig analyse af de to overlevelsesforsøg anbefalede Data Safety Monitoring Board, at CASODEX-behandlingen afbrydes hos M1-patienterne, fordi risikoen for død var 25 % (HR 1,25, 95 % CI 0,87 til 1,81) og 31 % ( HR 1,31, 95 % CI 0,97 til 1,77) højere i henholdsvis den CASODEX 50 mg-behandlede gruppe sammenlignet med den i den kastrerede gruppe.
Lokalt avanceret (T3-4, NX, M0) gruppe
CASODEX 150 mg dagligt er ikke godkendt til brug hos patienter med lokalt fremskreden (T3-4, NX, M0) cancer i prostata. Efter seponering af alle M1-patienter fortsatte forsøgene med T3-4-, NX-, M0-patienterne indtil undersøgelsens afslutning. I det større forsøg (N=352) var risikoen for død 25 % (HR 1,25, 95 % CI 0,92 til 1,71) højere i CASODEX-gruppen og i det mindre forsøg (N=140) var risikoen for død 36 % (HR 0,64, 95 % CI, 0,39 til 1,03) lavere i CASODEX 50 mg-gruppen.
Ud over de to ovennævnte undersøgelser er der tre andre igangværende kliniske undersøgelser, der giver yderligere sikkerhedsoplysninger for CASODEX 150 mg, en dosis, der ikke er godkendt til brug. Disse er tre multicenter, randomiserede, dobbeltblindede, parallelle gruppeforsøg, der sammenligner CASODEX 150 mg daglig monoterapi (adjuvans til tidligere behandling eller under vagtsom ventetid) med placebo, for død eller tid til sygdomsprogression, i en population på 8113 patienter med lokaliseret eller lokalt fremskreden prostatacancer.
CASODEX 150 mg dagligt er ikke godkendt til brug som terapi til patienter med lokaliseret prostatacancer, som er kandidater til at vente. Data fra en planlagt undergruppeanalyse af to af disse forsøg med 1627 patienter med lokaliseret prostatacancer, som var under vagtsom ventetid, afslørede en tendens til nedsat overlevelse i CASODEX-armen efter en medianopfølgning på 7,4 år. Der var 294 (37,7 %) dødsfald hos de CASODEX-behandlede patienter versus 279 (32,9 %) dødsfald hos de placebo-behandlede patienter (lokaliseret, vagtsom ventende gruppe) for en hazard ratio på 1,16 (95 % CI 0,99 til 1,37).
PATIENTOPLYSNINGER
CASODEX® [cas–o–dex] (bicalutamid) tablet
Læs denne patientinformation, før du begynder at tage CASODEX 50mg, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Denne folder træder ikke i stedet for at tale med din læge om din medicinske tilstand eller din behandling.
Hvad er CASODEX 50mg?
CASODEX er en receptpligtig medicin kaldet en androgenreceptorhæmmer, der bruges i kombination med luteiniserende hormon-frigivende hormon (LHRH) medicin til behandling af fase D2 metastatisk prostatacancer.
CASODEX må ikke bruges til kvinder.
Det vides ikke, om CASODEX er sikkert og effektivt til børn.
Hvem bør ikke tage CASODEX 50mg?
Tag ikke CASODEX 50 mg, hvis du:
- er en kvinde.
- er gravid eller kan blive gravid. CASODEX kan skade dit ufødte barn.
- er allergisk over for nogen af indholdsstofferne i CASODEX. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i CASODEX. Få lægehjælp med det samme, hvis du får nogle af følgende symptomer på en allergisk reaktion: kløe, nældefeber (hævede knopper), hævelse af ansigt, læber eller tunge, problemer med at trække vejret eller synke.
Hvad skal jeg fortælle min sundhedsplejerske, før jeg tager CASODEX?
Inden du tager CASODEX 50mg, skal du fortælle din læge om alle dine medicinske tilstande, inklusive hvis du:
- har leverproblemer.
- tage en medicin for at fortynde dit blod. Spørg din læge eller apotek, hvis du ikke er sikker på, om din medicin er blodfortyndende.
- har diabetes (dårlig blodsukkerkontrol er blevet rapporteret hos personer, der tager CASODEX i kombination med LHRH-medicin).
- har en partner, der er gravid eller kan blive gravid. Du bør bruge effektive præventionsmetoder, mens du tager CASODEX 50 mg og i 130 dage efter, at du er stoppet med CASODEX. Tal med din læge, hvis du har spørgsmål om prævention.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler. CASODEX 50mg og anden medicin kan påvirke hinanden og forårsage bivirkninger. CASODEX kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke, hvordan CASODEX 50mg virker.
Kend den medicin du tager. Hav en liste over din medicin med dig for at vise dine sundhedsudbydere, når du får en ny medicin.
Hvordan skal jeg tage CASODEX 50mg?
- Tag CASODEX nøjagtigt som din læge fortæller dig at tage det.
- Tag CASODEX på samme tidspunkt hver dag.
- Din behandling med CASODEX 50mg bør starte samtidig med din behandling med LHRH-medicinen.
- Hvis du glemmer en dosis, så tag ikke en ekstra dosis, tag den næste dosis på dit normale tidspunkt. Tag ikke 2 doser på samme tid.
- CASODEX 50 mg kan tages med eller uden mad.
- Hvis du tager for meget CASODEX, skal du ringe til din læge eller Giftinformationscentralen eller gå til den nærmeste skadestue på hospitalet med det samme.
- Stop ikke med at tage CASODEX, medmindre din læge fortæller dig det.
- Din læge kan tage blodprøver, mens du tager CASODEX.
- Din prostatacancer kan blive værre, mens du tager CASODEX i kombination med LHRH-medicin.
Regelmæssig overvågning af din prostatakræft med din læge er vigtig for at afgøre, om din sygdom er værre.
Hvad skal jeg undgå, mens jeg tager CASODEX 50mg?
Du må ikke køre bil, betjene maskiner eller udføre andre farlige aktiviteter, før du ved, hvordan CASODEX påvirker dig.
Nogle mennesker har haft hudfølsomhed over for sollys, mens de har taget CASODEX. Du bør undgå sollys eller sollamper og solarier og overveje at bruge solcreme, mens du bliver behandlet med CASODEX.
Hvad er de mulige bivirkninger af CASODEX 50mg?
CASODEX kan forårsage alvorlige bivirkninger, herunder:
- Leverproblemer, herunder leversvigt, der muligvis skal behandles på et hospital, eller som kan føre til døden. Din læge bør tage blodprøver for at kontrollere din leverfunktion før og under behandling med CASODEX. Fortæl din læge med det samme, hvis du får nogle af disse symptomer på et leverproblem under behandlingen:
- gulfarvning af hud og øjne (gulsot)
- mørk urin
- højre øvre mavesmerter
- kvalme
- opkastning
- træthed
- mistet appetiten
- kuldegysninger
- feber
- Åndedrætsbesvær med eller uden hoste eller feber. Nogle mennesker, der tager CASODEX 50mg, får en betændelse i lungerne kaldet interstitiel lungesygdom.
- En allergisk reaktion. Symptomer på en allergisk reaktion omfatter: kløe i huden, nældefeber (hævede knopper), hævelse af ansigt, læber, tunge, svælg eller synkebesvær.
- Forstørrelse af bryster (gynækomasti) og brystsmerter.
- Dårlig blodsukkerkontrol kan forekomme hos personer, der tager CASODEX 50mg i kombination med LHRH-medicin. Din læge kan kontrollere dit blodsukker under CASODEX 50 mg-behandling.
De mest almindelige bivirkninger af CASODEX 50mg omfatter:
- hedeture eller korte perioder med varmefølelse og svedtendens
- smerter i hele kroppen i din ryg, bækken, mave
- føler sig svag
- forstoppelse
- infektion
- kvalme
- hævelse i dine ankler, ben eller fødder
- diarré
- blod i din urin
- vågner fra søvn for at tisse om natten
- et fald i røde blodlegemer (anæmi)
- føler sig svimmel
Fortæl din læge, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af CASODEX. For mere information, spørg din læge eller apotek.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare CASODEX?
Opbevar CASODEX ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
Opbevar CASODEX 50mg og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af CASODEX.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en patientinformationsfolder. Brug ikke CASODEX til en tilstand, som det ikke er ordineret til. Giv ikke CASODEX 50 mg til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne patientinformationsfolder opsummerer de vigtigste oplysninger om CASODEX. Hvis du ønsker mere information om CASODEX, skal du tale med din læge. Du kan bede din sundhedsplejerske eller dit apotek om oplysninger om CASODEX, som er skrevet til sundhedspersonale. For mere information gå til www.CASODEX.com eller ring på 1-800-236-9933.
Hvad er ingredienserne i CASODEX 50mg?
Aktiv ingrediens: bicalutamid.
Inaktive ingredienser: lactose, magnesiumstearat, hypromellose, polyethylenglycol, polyvidon, natriumstivelsesglycolat, titaniumdioxid.
Denne patientinformation er blevet godkendt af US Food and Drug Administration.
