Leukeran 2mg, 5mg Chlorambucil Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Leukeran 5mg, og hvordan bruges det?
Leukeran 5mg er en receptpligtig medicin, der bruges til at behandle symptomerne på kronisk lymfatisk (lymfocytisk) leukæmi og Hodgkins lymfom. Leukeran 5mg kan bruges alene eller sammen med anden medicin.
Leukeran 5mg tilhører en klasse af lægemidler kaldet Antineoplastics, Alkylating.
Det vides ikke, om Leukeran er sikkert og effektivt hos børn.
Hvad er de mulige bivirkninger af Leukeran?
Leukeran kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- anfald,
- usædvanlig masse eller klump,
- svær opkastning eller diarré,
- ny eller forværret hoste,
- let blå mærker,
- usædvanlig blødning (næse, mund, vagina eller endetarm),
- lilla eller røde spidse pletter under huden,
- kvalme,
- smerter i øvre mave,
- kløe,
- træthed,
- mistet appetiten,
- mørk urin,
- lerfarvede afføring,
- gulfarvning af huden eller øjnene (gulsot),
- feber,
- hævede tandkød,
- smertefulde sår i munden,
- smerter ved synke,
- hudsår,
- symptomer på forkølelse eller influenza,
- hoste,
- vejrtrækningsbesvær,
- ondt i halsen,
- hudsmerter og
- et rødt eller lilla hududslæt, der breder sig (især i ansigtet eller overkroppen) og forårsager blærer og afskalning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Leukeran omfatter:
- feber,
- blødning, og
- influenza symptomer
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Leukeran. Spørg din læge eller apotek for mere information.
ADVARSEL
LEUKERAN (chlorambucil) kan undertrykke knoglemarvsfunktionen alvorligt. Chlorambucil er et kræftfremkaldende stof hos mennesker. Chlorambucil er sandsynligvis mutagen og teratogent hos mennesker. Chlorambucil producerer menneskelig infertilitet (se ADVARSLER OG FORHOLDSREGLER ).
BESKRIVELSE
LEUKERAN (chlorambucil) blev først syntetiseret af Everett et al. Det er et bifunktionelt alkyleringsmiddel af nitrogensennepstypen, som er fundet aktivt mod udvalgte humane neoplastiske sygdomme. Chlorambucil er kemisk kendt som 4-[bis(2-chlorethyl)amino]benzenbutansyre og har følgende strukturformel:
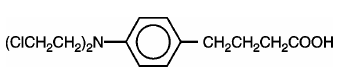
Chlorambucil hydrolyseres i vand og har en pKa på 5,8.
LEUKERAN (chlorambucil) fås i tabletform til oral administration. Hver filmovertrukket tablet indeholder 2 mg chlorambucil og de inaktive ingredienser kolloid siliciumdioxid, hypromellose, lactose (vandfri), makrogol/PEG 400, mikrokrystallinsk cellulose, rød jernoxid, stearinsyre, titaniumdioxid og gul jernoxid.
INDIKATIONER
LEUKERAN (chlorambucil) er indiceret til behandling af kronisk lymfatisk (lymfocytisk) leukæmi, maligne lymfomer inklusive lymfosarkom, kæmpe follikulært lymfom og Hodgkins sygdom. Det er ikke helbredende i nogen af disse lidelser, men kan producere klinisk nyttig palliation.
DOSERING OG ADMINISTRATION
Den sædvanlige orale dosis er 0,1 til 0,2 mg/kg legemsvægt dagligt i 3 til 6 uger efter behov. Dette beløber sig normalt til 4 til 10 mg pr. dag for den gennemsnitlige patient. Hele den daglige dosis kan gives på én gang. Disse doser er til initiering af terapi eller til korte behandlingsforløb. Dosis skal omhyggeligt justeres i henhold til patientens reaktion og skal reduceres, så snart der sker et brat fald i antallet af hvide blodlegemer. Patienter med Hodgkins sygdom kræver normalt 0,2 mg/kg dagligt, hvorimod patienter med andre lymfomer eller kronisk lymfatisk leukæmi normalt kun kræver 0,1 mg/kg dagligt. Når der er lymfocytisk infiltration af knoglemarven, eller når knoglemarven er hypoplastisk, bør den daglige dosis ikke overstige 0,1 mg/kg (ca. 6 mg for den gennemsnitlige patient).
Der er rapporteret om alternative skemaer for behandling af kronisk lymfatisk leukæmi, hvor der anvendes intermitterende, 2-ugentlige eller en gang månedlige pulsdoser af chlorambucil. Intermitterende skemaer for chlorambucil begynder med en indledende enkeltdosis på 0,4 mg/kg. Doserne øges generelt med 0,1 mg/kg, indtil kontrol af lymfocytose eller toksicitet observeres. Efterfølgende doser modificeres for at frembringe mild hæmatologisk toksicitet. Det menes, at responsraten for kronisk lymfatisk leukæmi på den anden uge eller én gang månedlige plan for administration af chlorambucil svarer til eller er bedre som den, der tidligere er rapporteret ved daglig administration, og at hæmatologisk toksicitet var mindre end eller lig med den, man stødte på i undersøgelser med daglig chlorambucil. .
Stråling og cytotoksiske lægemidler gør knoglemarven mere sårbar over for skader, og chlorambucil bør anvendes med særlig forsigtighed inden for 4 uger efter et fuldt strålebehandlings- eller kemoterapiforløb. Små doser af palliativ stråling over isolerede foci fjernt fra knoglemarven vil dog normalt ikke sænke neutrofil- og blodpladetallet. I disse tilfælde kan chlorambucil gives i den sædvanlige dosis.
Det menes i øjeblikket, at korte behandlingsforløb er sikrere end kontinuerlig vedligeholdelsesterapi, selvom begge metoder har været effektive. Det skal erkendes, at kontinuerlig terapi kan give et udseende af "vedligeholdelse" hos patienter, som faktisk er i remission og ikke har noget umiddelbart behov for yderligere lægemiddel. Hvis der anvendes vedligeholdelsesdosis, bør den ikke overstige 0,1 mg/kg dagligt og kan meget vel være så lav som 0,03 mg/kg dagligt. En typisk vedligeholdelsesdosis er 2 mg til 4 mg dagligt eller mindre, afhængigt af status for blodtallene. Det kan derfor være ønskeligt at seponere lægemidlet, efter at maksimal kontrol er opnået, da intermitterende terapi genoptaget på tidspunktet for tilbagefald kan være lige så effektiv som kontinuerlig behandling.
Procedurer for korrekt håndtering og bortskaffelse af lægemidler mod kræft bør anvendes. Der er udgivet flere retningslinjer om dette emne.1-4 Der er ingen generel enighed om, at alle de procedurer, der anbefales i retningslinjerne, er nødvendige eller passende.
Særlige Populationer
Nedsat leverfunktion
Patienter med nedsat leverfunktion bør overvåges nøje for toksicitet. Da chlorambucil primært metaboliseres i leveren, kan dosisreduktion overvejes hos patienter med nedsat leverfunktion, når de behandles med LEUKERAN. Der er dog utilstrækkelige data hos patienter med nedsat leverfunktion til at give en specifik doseringsanbefaling.
HVORDAN LEVERET
LEUKERAN leveres som brune, filmovertrukne, runde, bikonvekse tabletter indeholdende 2 mg chlorambucil i ravfarvede glasflasker med børnesikret lukning. Den ene side er indgraveret med "GX EG3", og den anden side er indgraveret med et "L."
Flaske med 25 ( NDC 76388-635-25)
Opbevares i køleskab, 2° til 8°C (36° til 46°F).
REFERENCER
1. NIOSH Alert: Forebyggelse af erhvervsmæssig eksponering for antineoplastiske og andre farlige lægemidler i sundhedsmiljøer. 2004. US Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH) publikation nr. 2004-165.
2. OSHA Technical Manual, TED 1-0.15A, Sektion VI: Kapitel 2. Kontrol af erhvervsmæssig eksponering for farlige stoffer. OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html
3. American Society of Health-System Pharmacists. ASHP retningslinjer for håndtering af farlige lægemidler. Am J Health-Syst Pharm. (2006) 63:1172-1193.
4. Polovich, M., White, JM, & Kelleher, LO (red.) 2005. Kemoterapi og bioterapi retningslinjer og anbefalinger til praksis (2. udg.) Pittsburgh, PA: Oncology Nursing Society.
Fremstillet af: Excella GmbH & Co. KG, Feucht, Tyskland. Revideret: Marts 2017
BIVIRKNINGER
Kontakt Aspen Global Inc. Gratis på 1-855-800-8165 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch for at rapportere FORSINKTE BIVIRKNINGER.
Hæmatologisk
Den mest almindelige bivirkning er knoglemarvssuppression, anæmi, leukopeni, neutropeni, trombocytopeni eller pancytopeni. Selvom knoglemarvssuppression ofte forekommer, er det normalt reversibelt, hvis chlorambucilen seponeres tidligt nok. Imidlertid er irreversibelt knoglemarvssvigt blevet rapporteret.
Gastrointestinale
Mave-tarmforstyrrelser såsom kvalme og opkastning, diarré og mundsår forekommer sjældent.
CNS
Rystelser, muskeltrækninger, myokloni, forvirring, agitation, ataksi, slappe pareser og hallucinationer er blevet rapporteret som sjældne bivirkninger for chlorambucil, som forsvinder ved seponering af lægemidlet. Sjældne, fokale og/eller generaliserede anfald er rapporteret at forekomme hos både børn og voksne ved både terapeutiske daglige doser og pulserende regimer og ved akut overdosis (se FORHOLDSREGLER : Generel ).
Dermatologisk
Allergiske reaktioner såsom urticaria og angioneurotisk ødem er blevet rapporteret efter indledende eller efterfølgende dosering. Hudoverfølsomhed (herunder sjældne rapporter om hududslæt, der udvikler sig til erythema multiforme, toksisk epidermal nekrolyse og Stevens-Johnsons syndrom) er blevet rapporteret (se ADVARSLER ).
Diverse
Andre rapporterede bivirkninger omfatter: lungefibrose, hepatotoksicitet og gulsot, lægemiddelfeber, perifer neuropati, interstitiel lungebetændelse, steril blærebetændelse, infertilitet, leukæmi og sekundære maligniteter (se ADVARSLER ).

DRUGSINTERAKTIONER
Der er ingen kendte lægemiddel-/lægemiddelinteraktioner med chlorambucil.
ADVARSLER
På grund af dets kræftfremkaldende egenskaber bør chlorambucil ikke gives til patienter med andre tilstande end kronisk lymfatisk leukæmi eller maligne lymfomer. Kramper, infertilitet, leukæmi og sekundære maligniteter er blevet observeret, når chlorambucil blev anvendt i behandlingen af maligne og ikke-maligne sygdomme.
Der er mange rapporter om akut leukæmi hos patienter med både ondartede og ikke-maligne sygdomme efter behandling med chlorambucil. I mange tilfælde fik disse patienter også andre kemoterapeutiske midler eller en eller anden form for strålebehandling. Kvantificering af risikoen for chlorambucil-induktion af leukæmi eller karcinom hos mennesker er ikke mulig. Evaluering af offentliggjorte rapporter om udvikling af leukæmi hos patienter, der har fået chlorambucil (og andre alkylerende midler), tyder på, at risikoen for leukogenese stiger med både kronisk behandling og store kumulative doser. Det har imidlertid vist sig umuligt at definere en kumulativ dosis, under hvilken der ikke er nogen risiko for induktion af sekundær malignitet. De potentielle fordele ved behandling med chlorambucil skal afvejes på individuel basis mod den mulige risiko for induktion af en sekundær malignitet.
Chlorambucil har vist sig at forårsage chromatid- eller kromosomskader hos mennesker. Både reversibel og permanent sterilitet er blevet observeret hos begge køn, der fik chlorambucil.
En høj forekomst af sterilitet er blevet dokumenteret, når chlorambucil administreres til præpubertale og pubertale mænd. Langvarig eller permanent azoospermi er også blevet observeret hos voksne mænd. Mens de fleste rapporter om gonadal dysfunktion sekundært til chlorambucil har relateret til mænd, er induktionen af amenoré hos kvinder med alkylerende midler veldokumenteret, og chlorambucil er i stand til at producere amenoré. Obduktionsundersøgelser af æggestokkene fra kvinder med malignt lymfom behandlet med kombinationskemoterapi inklusive chlorambucil har vist forskellige grader af fibrose, vaskulitis og udtømning af primordiale follikler.
Sjældne tilfælde af hududslæt, der udvikler sig til erythema multiforme, toksisk epidermal nekrolyse eller Stevens-Johnsons syndrom er blevet rapporteret. Chlorambucil bør seponeres omgående hos patienter, som udvikler hudreaktioner.
Graviditet
Graviditetskategori D
Chlorambucil kan forårsage fosterskader, når det administreres til en gravid kvinde. Unilateral nyreagenese er blevet observeret hos 2 afkom, hvis mødre fik chlorambucil i første trimester. Urogenitale misdannelser, herunder fravær af en nyre, blev fundet hos rottefostre, der fik chlorambucil. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Hvis dette lægemiddel bruges under graviditet, eller hvis patienten bliver gravid, mens han tager dette lægemiddel, skal patienten informeres om den potentielle fare for fosteret. Kvinder i den fødedygtige alder bør rådes til at undgå at blive gravide.
FORHOLDSREGLER
Generel
Mange patienter udvikler en langsomt fremadskridende lymfopeni under behandlingen. Lymfocyttallet vender normalt hurtigt tilbage til normale niveauer efter afslutning af lægemiddelbehandling. De fleste patienter har en vis neutropeni efter den tredje uges behandling, og dette kan fortsætte i op til 10 dage efter den sidste dosis. Efterfølgende vender neutrofiltallet normalt hurtigt tilbage til det normale. Alvorlig neutropeni ser ud til at være relateret til dosis og forekommer sædvanligvis kun hos patienter, som har fået en samlet dosis på 6,5 mg/kg eller mere i ét behandlingsforløb med kontinuerlig dosering. Omkring en fjerdedel af alle patienter, der får det kontinuerlige dosisskema, og en tredjedel af dem, der får denne dosis inden for 8 uger eller mindre, kan forventes at udvikle alvorlig neutropeni.
Selvom det ikke er nødvendigt at seponere chlorambucil ved det første tegn på et fald i neutrofiltallet, skal det huskes, at faldet kan fortsætte i 10 dage efter den sidste dosis, og at når den samlede dosis nærmer sig 6,5 mg/kg, er der en risiko for at forårsage irreversible knoglemarvsskader. Dosis af chlorambucil bør nedsættes, hvis leukocyt- eller trombocyttallet falder til under normale værdier, og bør seponeres ved mere alvorlig depression.
Chlorambucil bør ikke gives i fulde doser inden 4 uger efter et fuldt forløb med strålebehandling eller kemoterapi på grund af knoglemarvens sårbarhed over for beskadigelse under disse tilstande. Hvis antallet af leukocytter eller trombocytter før behandling er nedsat på grund af knoglemarvssygdomsprocessen før påbegyndelse af behandlingen, bør behandlingen påbegyndes med en reduceret dosis.
Vedvarende lavt neutrofil- og blodpladetal eller perifer lymfocytose tyder på knoglemarvsinfiltration. Hvis det bekræftes ved knoglemarvsundersøgelse, bør den daglige dosis af chlorambucil ikke overstige 0,1 mg/kg. Chlorambucil ser ud til at være relativt fri for gastrointestinale bivirkninger eller andre tegn på toksicitet bortset fra den knoglemarvsdempende virkning. Hos mennesker kan enkelte orale doser på 20 mg eller mere give kvalme og opkastning.
Børn med nefrotisk syndrom og patienter, der får høje pulsdoser af chlorambucil, kan have en øget risiko for anfald. Som med ethvert potentielt epileptogent lægemiddel skal der udvises forsigtighed ved administration af chlorambucil til patienter med en historie med anfaldssygdomme eller hovedtraume, eller som får andre potentielt epileptogene lægemidler.
Administration af levende vacciner til immunkompromitterede patienter bør undgås.
Laboratorieprøver
Patienter skal følges nøje for at undgå livstruende skader på knoglemarven under behandlingen. Ugentlig undersøgelse af blodet bør foretages for at bestemme hæmoglobinniveauer, totale og differentielle leukocyttal og kvantitative blodpladetal. I løbet af de første 3 til 6 uger af behandlingen anbefales det også, at tællinger af hvide blodlegemer foretages 3 eller 4 dage efter hver af de ugentlige fuldstændige blodtællinger. Galton et al har foreslået, at det ved at følge patienter er nyttigt at plotte blodtallene på et diagram, samtidig med at kropsvægt, temperatur, miltstørrelse osv. registreres. Det anses for farligt at lade en patient gå mere end 2 uger uden hæmatologisk og klinisk undersøgelse under behandlingen.
Karcinogenese, mutagenese, svækkelse af fertilitet
Se ADVARSLER afsnit for information om carcinogenese, mutagenese og svækkelse af fertilitet.
Graviditet
Teratogene virkninger
Graviditetskategori D
Se ADVARSLER afsnit.
Ammende mødre
Det vides ikke, om dette lægemiddel udskilles i modermælk. Fordi mange lægemidler udskilles i modermælk og på grund af potentialet for alvorlige bivirkninger hos ammende spædbørn fra chlorambucil, bør der tages en beslutning om, hvorvidt amningen skal afbrydes eller lægemidlet skal seponeres under hensyntagen til lægemidlets betydning for moderen.
Pædiatrisk brug
Sikkerheden og effektiviteten hos pædiatriske patienter er ikke fastlagt.
Geriatrisk brug
Kliniske undersøgelser af chlorambucil omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling.
Anvendelse hos patienter med nedsat nyrefunktion
Virkningen af nedsat nyrefunktion på chlorambucil-elimineringen er ikke formelt undersøgt. Renal elimination af uændret chlorambucil og dets vigtigste aktive metabolitter, phenyleddikesyresennep, udgør mindre end 1 % af den administrerede dosis. Derudover var dosisjustering ikke nødvendig hos 2 dialysepatienter på chlorambucil. Derfor forventes nedsat nyrefunktion ikke at påvirke eliminationen af chlorambucil signifikant.
Anvendelse hos patienter med nedsat leverfunktion
Der er ikke udført formelle undersøgelser af patienter med nedsat leverfunktion. Da chlorambucil primært metaboliseres i leveren, bør patienter med nedsat leverfunktion overvåges nøje for toksicitet, og dosisreduktion kan overvejes hos patienter med nedsat leverfunktion, når de behandles med LEUKERAN (se DOSERING OG ADMINISTRATION ).
OVERDOSIS
Reversibel pancytopeni var hovedfundet af utilsigtede overdoser af chlorambucil. Neurologisk toksicitet lige fra ophidset adfærd og ataksi til flere grand mal-anfald er også forekommet. Da der ikke er nogen kendt modgift, bør blodbilledet overvåges nøje, og der bør iværksættes generelle støtteforanstaltninger sammen med passende blodtransfusioner, hvis det er nødvendigt. Chlorambucil kan ikke dialyseres.
Orale LD50 enkeltdoser til mus er 123 mg/kg. Hos rotter frembringer en enkelt intraperitoneal dosis på 12,5 mg/kg chlorambucil typiske nitrogen-sennep-effekter; disse omfatter atrofi af tarmslimhinden og lymfoide væv, svær lymfopeni, der bliver maksimal på 4 dage, anæmi og trombocytopeni. Efter denne dosis begynder dyrene at komme sig inden for 3 dage og ser normale ud efter ca. en uge, selvom knoglemarven måske ikke bliver helt normal i ca. 3 uger. En intraperitoneal dosis på 18,5 mg/kg dræber omkring 50 % af rotterne med udvikling af kramper. Så meget som 50 mg/kg er blevet givet oralt til rotter som en enkelt dosis, med bedring. En sådan dosis forårsager bradykardi, overdreven spytsekretion, hæmaturi, kramper og respiratorisk dysfunktion.
KONTRAINDIKATIONER
Chlorambucil bør ikke anvendes til patienter, hvis sygdom har vist tidligere resistens over for midlet. Patienter, der har udvist overfølsomhed over for chlorambucil, bør ikke få lægemidlet. Der kan være krydsoverfølsomhed (hududslæt) mellem chlorambucil og andre alkyleringsmidler.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Chlorambucil, et aromatisk nitrogen-sennepsderivat, er et alkyleringsmiddel. Chlorambucil interfererer med DNA-replikation og inducerer cellulær apoptose via akkumulering af cytosolisk p53 og efterfølgende aktivering af Bax, en apoptosepromotor.
Farmakokinetik
en undersøgelse med 12 patienter, der fik en enkelt oral dosis på 0,2 mg/kg LEUKERAN 5 mg, var den gennemsnitlige dosisjusterede (±SD) plasma chlorambucil Cmax 492 ± 160 ng/mL, AUC var 883 ± 329 ng.t/mL , den gennemsnitlige eliminationshalveringstid (t½) var 1,3 ± 0,5 timer, og Tmax var 0,83 ± 0,53 timer. For hovedmetabolitten, phenyleddikesyresennep (PAAM), var den gennemsnitlige dosisjusterede (± SD) plasma Cmax 306 ± 73 ng/ml, AUC var 1204 ± 285 ng.h/mL, middel t½ var 1,8 ± 0,4 timer og Tmax var 1,9 ± 0,7 timer.
Efter enkelte orale doser på 0,6 til 1,2 mg/kg nås maksimale plasmakoncentrationer af chlorambucil (Cmax) inden for 1 time, og den terminale eliminationshalveringstid (t ) for moderlægemidlet estimeres til 1,5 timer.
Absorption
Chlorambucil absorberes hurtigt og fuldstændigt (>70%) fra mave-tarmkanalen. I overensstemmelse med den hurtige, forudsigelige absorption af chlorambucil har den inter-individuelle variabilitet i plasmafarmakokinetikken af chlorambucil vist sig at være relativt lille efter orale doser på mellem 15 og 70 mg (2 gange intrapatient variabilitet og en 2 til 4 gange interpatientvariabilitet i AUC). Absorptionen af chlorambucil reduceres, når det tages efter mad. I en undersøgelse med ti patienter øgede fødeindtagelse median-Tmax med 2 gange og reducerede de dosisjusterede Cmax- og AUC-værdier med henholdsvis 55 % og 20 %.
Fordeling
Det tilsyneladende distributionsvolumen var i gennemsnit 0,31 l/kg efter en enkelt 0,2 mg/kg oral dosis chlorambucil hos 11 cancerpatienter med kronisk lymfatisk leukæmi.
Chlorambucil og dets metabolitter er i vid udstrækning bundet til plasma- og vævsproteiner. In vitro er chlorambucil 99 % bundet til plasmaproteiner, specifikt albumin. Cerebrospinalvæskeniveauer af chlorambucil er ikke blevet bestemt.
Metabolisme
Chlorambucil metaboliseres i udstrakt grad i leveren primært til phenyleddikesyre sennep, som har antineoplastisk aktivitet. Chlorambucil og dets hovedmetabolit undergår oxidativ nedbrydning til monohydroxy- og dihydroxyderivater.
Udskillelse
Efter en enkelt dosis radioaktivt mærket chlorambucil (14C) vises ca. 20 % til 60 % af radioaktiviteten i urinen efter 24 timer. Igen er mindre end 1% af urinradioaktiviteten i form af chlorambucil eller phenyleddikesyresennep.
PATIENTOPLYSNINGER
Patienterne skal informeres om, at de vigtigste toksiciteter af chlorambucil er relateret til overfølsomhed, lægemiddelfeber, myelosuppression, levertoksicitet, infertilitet, kramper, gastrointestinal toksicitet og sekundære maligniteter. Patienter bør aldrig have lov til at tage lægemidlet uden lægeligt tilsyn og bør konsultere deres læge, hvis de oplever hududslæt, blødning, feber, gulsot, vedvarende hoste, anfald, kvalme, opkastning, amenoré eller usædvanlige klumper/masser. Kvinder i den fødedygtige alder bør rådes til at undgå at blive gravide.
