Hydrea 500mg Hydroxyurea Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Hydrea 500mg, og hvordan bruges det?
Hydrea (hydroxyurinstof) er et antineoplastisk (anti-cancer) middel, der bruges til at behandle melanom, resistent kronisk myelocytisk leukæmi og tilbagevendende, metastatisk eller inoperabelt karcinom i ovarie- og primære pladecellekarcinomer (epidermoid) i hoved og hals. Hydrea er tilgængelig i generisk form.
Hvad er bivirkninger af Hydrea?
Almindelige bivirkninger af Hydrea omfatter:
- kvalme,
- opkastning,
- dårlig mave,
- diarré,
- forstoppelse,
- hudforandringer såsom afskalning eller misfarvning,
- influenzalignende symptomer,
- hårtab,
- udslæt,
- hovedpine,
- svimmelhed,
- døsighed, eller
- vægtøgning.
Alvorlige bivirkninger af Hydrea omfatter:
- anæmi,
- myelosuppression og
- leukæmi.
BESKRIVELSE
HYDREA (hydroxyurinstofkapsler, USP) er en antimetabolit tilgængelig til oral brug som kapsler indeholdende 500 mg hydroxyurinstof. Inaktive ingredienser omfatter citronsyre, farvestoffer (D&C Yellow No. 10, FD&C Blue No. 1, FD&C Red No. 40 og D&C Red No. 28), gelatine, laktose, magnesiumstearat, natriumphosphat og titaniumdioxid.
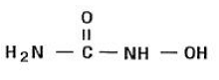
Hydroxyurea er et hvidt til råhvidt krystallinsk pulver. Det er hygroskopisk og frit opløseligt i vand, men praktisk talt uopløseligt i alkohol. Den empiriske formel er CH4N2O2 og den har en molekylvægt på 76,05. Dens strukturformel er:
INDIKATIONER
HYDREA 500mg er indiceret til behandling af:
- Resistent kronisk myeloid leukæmi.
- Lokalt fremskredne pladecellekarcinomer i hoved og hals (eksklusive læben) i kombination med kemoradiation.
DOSERING OG ADMINISTRATION
Doseringsoplysninger
HYDREA anvendes alene eller sammen med andre antitumormidler eller strålebehandling til behandling af neoplastiske sygdomme. Individualiser behandlingen baseret på tumortype, sygdomstilstand, respons på behandling, patientrisikofaktorer og aktuelle kliniske praksisstandarder.
Baser al dosering på patientens faktiske eller ideelle vægt, alt efter hvad der er mindst.
HYDREA er et cellegift. Følg gældende særlige håndterings- og bortskaffelsesprocedurer [se REFERENCER ].
Synk HYDREA kapsler hele. Du må IKKE åbne, knække eller tygge kapsler, da HYDREA er et cytotoksisk lægemiddel.
Profylaktisk administration af folinsyre anbefales [se ADVARSLER OG FORHOLDSREGLER ].
Overvåg blodtal mindst én gang om ugen under HYDREA 500 mg-behandling. Alvorlig anæmi skal korrigeres, før behandling med HYDREA påbegyndes.
Dosisændringer for toksicitet
Overvåg for følgende, og reducer dosis eller afbryd HYDREA 500mg i overensstemmelse hermed:
- Myelosuppression [se ADVARSLER OG FORHOLDSREGLER ]
- Kutan vaskulitis [se ADVARSLER OG FORHOLDSREGLER ]
Overvej dosisændringer for andre toksiciteter.
Dosisændringer ved nedsat nyrefunktion
Reducer dosis af HYDREA med 50 % hos patienter med målt kreatininclearance på mindre end 60 ml/min eller med nyresygdom i slutstadiet (ESRD) [se Brug i specifikke populationer og KLINISK FARMAKOLOGI ].
Tæt monitorering af hæmatologiske parametre tilrådes hos disse patienter.
HVORDAN LEVERET
Doseringsformer og styrker
Kapsler
500 mg uigennemsigtig grøn hætte og uigennemsigtig lyserød krop præget med "HYDREA" og "830".
Opbevaring og håndtering
HYDREA® (hydroxyurinstofkapsler, USP) leveres som 500 mg kapsler i HDPE-flasker med plastiksikkerhedsskruelåg. Hver flaske indeholder 100 kapsler.
Hætten er uigennemsigtig grøn og kroppen er uigennemsigtig pink. Kapslerne er præget på begge sektioner med "HYDREA" og "830" i sort blæk ( NDC 0003-0830-50).
Opbevaring
Opbevares ved 20-25°C (68-77°F); udflugter tilladt til 15°C-30°C (59°F-86°F) [se USP Controlled RoomTemperature]. Opbevares tæt lukket.
Håndtering og bortskaffelse
HYDREA 500mg er et cellegift. Følg gældende særlige håndterings- og bortskaffelsesprocedurer [se REFERENCER ].
For at mindske risikoen for kontakt, råd plejepersonalet til at bære engangshandsker, når de håndterer HYDREA eller flasker, der indeholder HYDREA. Vask hænder med sæbe og vand før og efter kontakt med flasken eller kapslerne, når du håndterer HYDREA. Åbn ikke HYDREA 500mg kapsler. Undgå udsættelse for knuste eller åbnede kapsler. Hvis der opstår kontakt med knuste eller åbnede kapsler på huden, vask det berørte område straks og grundigt med vand og sæbe. Hvis der opstår kontakt med knuste eller åbnede kapsler på øjet/øjnene, skal det berørte område skylles grundigt med vand eller isotonisk øjenskylning beregnet til dette formål i mindst 15 minutter. Hvis pulveret fra kapslen spildes, skal du straks tørre det af med et fugtigt engangshåndklæde og kassere det i en lukket beholder, såsom en plastikpose; ligesom de tomme kapsler. Spildområderne skal derefter rengøres tre gange med en rengøringsmiddelopløsning efterfulgt af rent vand. Hold medicinen væk fra børn og kæledyr. Kontakt din læge for at få instruktioner om, hvordan du skal bortskaffe forældede kapsler.
REFERENCER
OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Fremstillet for: Bristol-Myers Squibb Company Princeton, New Jersey 08543 USA. Revideret: december 2020
BIVIRKNINGER
Følgende klinisk signifikante bivirkninger er beskrevet detaljeret i andre mærkningsafsnit:
- Myelosuppression [se ADVARSLER OG FORHOLDSREGLER ]
- Maligniteter [se ADVARSLER OG FORHOLDSREGLER ]
- Vaskulitiske toksiciteter [se ADVARSLER OG FORHOLDSREGLER ]
- Risici ved samtidig brug af antiretrovirale lægemidler [se ADVARSLER OG FORHOLDSREGLER ]
- Genkaldelse af stråling [se ADVARSLER OG FORHOLDSREGLER ]
- Makrocytose [se ADVARSLER OG FORHOLDSREGLER ]
- Lungetoksicitet [se ADVARSLER OG FORHOLDSREGLER ]
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af HYDREA efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at estimere deres hyppighed pålideligt.
- Reproduktionssystem og brystsygdomme: azoospermi og oligospermi
- Gastrointestinale lidelser: stomatitis, kvalme, opkastning, diarré og forstoppelse
- Metabolisme og ernæringsforstyrrelser: anoreksi, tumor lysis syndrom
- Hud- og subkutane vævssygdomme: makulopapulært udslæt, sårdannelse i huden, kutan lupus erythematosus, dermatomyositis-lignende hudforandringer, perifert og ansigtserytem, hyperpigmentering, neglehyperpigmentering, atrofi af hud og negle, skældannelse, violette papler og alopeci
- Nyre- og urinvejslidelser: dysuri, stigninger i serumurinsyre, blodurinstofnitrogen (BUN) og kreatininniveauer
- Forstyrrelser i nervesystemet: hovedpine, svimmelhed, døsighed, desorientering, hallucinationer og kramper
- Generelle lidelser: feber, kulderystelser, utilpashed, ødem og asteni
- Lever og galdevejslidelser: forhøjelse af leverenzymer, kolestase og hepatitis
- Åndedrætsforstyrrelser: diffuse lungeinfiltrater, dyspnø og lungefibrose, interstitiel lungesygdom, pneumonitis, alveolitis, allergisk alveolitis og hoste
- Immunforstyrrelser: systemisk lupus erythematosus
- Overfølsomhed: Lægemiddelinduceret feber (pyreksi) (>39°C, >102°F), der kræver hospitalsindlæggelse, er blevet rapporteret samtidig med gastrointestinale, pulmonale, muskuloskeletale, hepatobiliære, dermatologiske eller kardiovaskulære manifestationer. Begyndelsen opstod typisk inden for 6 uger efter påbegyndelse og forsvandt ved seponering af hydroxyurinstof. Efter genadministrering opstod feber typisk inden for 24 timer.
Bivirkninger observeret ved kombineret hydroxyurinstof og strålebehandling svarer til dem, der er rapporteret ved brug af hydroxyurinstof eller strålebehandling alene. Disse virkninger omfatter primært knoglemarvsdepression (anæmi og leukopeni), maveirritation og mucositis. Næsten alle patienter, der får et passende forløb med kombineret hydroxyurinstof og strålebehandling, vil udvise samtidig leukopeni. Blodpladedepression (
DRUGSINTERAKTIONER
Øget toksicitet ved samtidig brug af antiretrovirale lægemidler
Pancreatitis
Hos patienter med HIV-infektion under behandling med hydroxyurinstof og didanosin, med eller uden stavudin, er der opstået fatal og ikke-fatal pancreatitis. Hydroxyurea er ikke indiceret til behandling af HIV-infektion; Hvis patienter med HIV-infektion behandles med hydroxyurinstof, og især i kombination med didanosin og/eller stavudin, anbefales det dog tæt monitorering for tegn og symptomer på pancreatitis. Afbryd permanent behandling med hydroxyurinstof hos patienter, som udvikler tegn og symptomer på pancreatitis.
Hepatotoksicitet
Hepatotoksicitet og leversvigt, der resulterer i dødsfald, er blevet rapporteret under postmarketingovervågning hos patienter med HIV-infektion behandlet med hydroxyurinstof og andre antiretrovirale lægemidler. Fatale leverhændelser blev oftest rapporteret hos patienter behandlet med kombinationen af hydroxyurinstof, didanosin og stavudin. Undgå denne kombination.
Perifer neuropati
Perifer neuropati, som i nogle tilfælde var alvorlig, er blevet rapporteret hos patienter med HIV-infektion, som fik hydroxyurinstof i kombination med antiretrovirale lægemidler, inklusive didanosin, med eller uden stavudin.
Laboratorietestinterferens
Interferens med urinsyre-, urinstof- eller mælkesyreanalyser
Undersøgelser har vist, at der er en analytisk interferens af hydroxyurinstof med enzymerne (urease, uricase og lactatdehydrogenase), der anvendes til bestemmelse af urinstof, urinsyre og mælkesyre, hvilket giver falsk forhøjede resultater af disse hos patienter behandlet med hydroxyurinstof.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Myelosuppression
Hydroxyurea forårsager alvorlig myelosuppression. Behandling med hydroxyurinstof bør ikke påbegyndes, hvis knoglemarvsfunktionen er markant nedsat. Knoglemarvssuppression kan forekomme, og leukopeni er generelt dens første og mest almindelige manifestation. Trombocytopeni og anæmi forekommer sjældnere og ses sjældent uden forudgående leukopeni. Knoglemarvsdepression er mere sandsynlig hos patienter, der tidligere har modtaget strålebehandling eller cytotoksiske cancerkemoterapeutika; brug hydroxyurinstof forsigtigt til sådanne patienter.
Evaluer hæmatologisk status før og under behandling med HYDREA. Giv støttende pleje og modificere dosis eller afbryd HYDREA efter behov. Genopretning efter myelosuppression er normalt hurtig, når behandlingen afbrydes.
Maligniteter
Hydroxyurea er et menneskeligt kræftfremkaldende stof. Hos patienter, der får langvarig hydroxyurinstof for myeloproliferative lidelser, er sekundær leukæmi blevet rapporteret. Hudkræft er også blevet rapporteret hos patienter, der får langtidsbehandling med hydroxyurinstof. Rådgiv beskyttelse mod soleksponering og overvåg udviklingen af sekundære maligniteter.
Embryo-føtal toksicitet
Baseret på virkningsmekanismen og fund hos dyr kan HYDREA 500 mg forårsage fosterskader, når det administreres til en gravid kvinde. Hydroxyurinstof var embryotoksisk og teratogent hos rotter og kaniner ved doser på henholdsvis 0,8 gange og 0,3 gange den maksimalt anbefalede daglige dosis til mennesker på mg/m2-basis. Informer gravide kvinder om den potentielle risiko for et foster [se Brug i specifikke populationer ].
Rådgiv kvinder med reproduktionspotentiale til at bruge effektiv prævention under og efter behandling med HYDREA 500 mg i mindst 6 måneder efter behandlingen. Rådgiv mænd med reproduktionspotentiale til at bruge effektiv prævention under og efter behandling med HYDREA 500 mg i mindst 1 år efter behandlingen [se Brug i specifikke populationer ].
Vaskulitiske toksiciteter
Kutan vaskulitisk toksicitet, herunder vaskulitiske ulcerationer og koldbrand, er forekommet hos patienter med myeloproliferative lidelser under behandling med hydroxyurinstof. Disse vaskulitiske toksiciteter blev oftest rapporteret hos patienter med en historie med eller i øjeblikket modtager interferonbehandling. Hvis der opstår kutane vaskulitiske sår, påbegynd behandling og seponér HYDREA.
Levende vaccinationer
Undgå brug af levende vaccine hos patienter, der tager HYDREA. Samtidig brug af HYDREA og en levende virusvaccine kan forstærke replikationen af viruset og/eller kan øge vaccinens bivirkninger, fordi normale forsvarsmekanismer kan undertrykkes af HYDREA. Vaccination med levende vacciner hos en patient, der får HYDREA 500 mg, kan resultere i alvorlig infektion. Patientens antistofrespons på vacciner kan være nedsat. Overvej konsultation med en specialist.
Risici ved samtidig brug af antiretrovirale lægemidler
Pancreatitis, hepatotoksicitet og perifer neuropati er opstået, når hydroxyurinstof blev administreret samtidig med antiretrovirale lægemidler, inklusive didanosin og stavudin [se DRUGSINTERAKTIONER ].
Genkaldelse af stråling
Patienter, der tidligere har modtaget strålebehandling, kan have en forværring af erytem efter bestråling. Overvåg for huderytem hos patienter, der tidligere har modtaget stråling, og behandle symptomatisk.
Makrocytose
HYDREA 500mg kan forårsage makrocytose, som er selvbegrænsende, og som ofte ses tidligt i behandlingsforløbet. Den morfologiske ændring ligner perniciøs anæmi, men er ikke relateret til vitamin B12 eller folinsyremangel. Dette kan maskere diagnosen perniciøs anæmi. Profylaktisk administration af folinsyre anbefales.
Lungetoksicitet
Interstitiel lungesygdom inklusive lungefibrose, lungeinfiltration, pneumonitis og alveolitis/allergisk alveolitis (inklusive fatale tilfælde) er blevet rapporteret hos patienter behandlet for myeloproliferativ neoplasma. Overvåg patienter, der udvikler pyreksi, hoste, dyspnø eller andre luftvejssymptomer ofte, undersøg og behandl omgående. Afbryd behandlingen med HYDREA 500mg og administrer med kortikosteroider [se BIVIRKNINGER ].
Laboratorietestinterferens
Interferens med urinsyre-, urinstof- eller mælkesyreanalyser er mulig, hvilket giver falsk forhøjede resultater af disse hos patienter behandlet med hydroxyurinstof [se DRUGSINTERAKTIONER ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Konventionelle langtidsundersøgelser til evaluering af det carcinogene potentiale af hydroxyurinstof er ikke blevet udført. Imidlertid øgede intraperitoneal administration af 125 til 250 mg/kg hydroxyurinstof (ca. 0,6-1,2 gange den maksimale anbefalede humane orale daglige dosis på mg/m2-basis) tre gange ugentligt i 6 måneder til hunrotter forekomsten af brysttumorer hos rotter, der overlevede til 18. måneder i forhold til kontrol. Hydroxyurea er mutagent in vitro for bakterier, svampe, protozoer og pattedyrceller. Hydroxyurea er klastogent in vitro (hamsterceller, humane lymfoblaster) og in vivo (SCE-assay i gnavere, muse-mikronkerneassay). Hydroxyurea forårsager transformation af gnaverembryonceller til en tumorigen fænotype.
Hydroxyurinstof indgivet til hanrotter med 60 mg/kg/dag (ca. 0,3 gange den maksimale anbefalede daglige dosis til mennesker på mg/m2-basis) producerede testikelatrofi, nedsatte spermatogenese og reducerede signifikant deres evne til at imprægnere hunner.
Brug i specifikke populationer
Graviditet
Risikooversigt
HYDREA kan forårsage fosterskade baseret på resultater fra dyreforsøg og lægemidlets virkningsmekanisme [se KLINISK FARMAKOLOGI ]. Der er ingen data om brug af HYDREA til gravide kvinder for at informere om en lægemiddelrelateret risiko. I reproduktionsstudier på dyr fremkaldte administration af hydroxyurinstof til drægtige rotter og kaniner under organogenese embryotoksiske og teratogene virkninger ved doser på henholdsvis 0,8 gange og 0,3 gange den maksimalt anbefalede daglige dosis til mennesker på mg/m2-basis (se Data ). Informer kvinder om den potentielle risiko for et foster og undgå at blive gravid, mens de behandles med HYDREA.
I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2%-4% og 15%-20%.
Data
Dyredata
Hydroxyurea har vist sig at være et potent teratogent i en lang række dyremodeller, herunder mus, hamstere, katte, miniaturesvin, hunde og aber i doser inden for 1 gange den humane dosis givet på mg/m2-basis. Hydroxyurinstof er embryotoksisk og forårsager føtale misdannelser (delvist forbenede kranieknogler, fravær af øjenhuler, hydrocefali, todelte brystben, manglende lændehvirvler) ved 180 mg/kg/dag (ca. 0,8 gange den maksimale anbefalede daglige dosis til mennesker på mg/m2-basis) hos rotter og ved 30 mg/kg/dag (ca. 0,3 gange den maksimale anbefalede daglige dosis til mennesker på mg/m2-basis) hos kaniner. Embryotoksicitet var karakteriseret ved nedsat føtal levedygtighed, reducerede levende kuldstørrelser og udviklingsforsinkelser. Hydroxyurea krydser placenta. Enkeltdoser på ≥375 mg/kg (ca. 1,7 gange den maksimale anbefalede humane daglige dosis på mg/m2-basis) til rotter forårsagede væksthæmning og nedsat indlæringsevne.
Amning
Risikooversigt
Hydroxyurea udskilles i modermælk. På grund af risikoen for alvorlige bivirkninger hos et ammet spædbarn fra hydroxyurinstof, herunder karcinogenicitet, skal du afbryde amningen under behandling med HYDREA.
Hunner og mænd med reproduktionspotentiale
Graviditetstest
Verificer graviditetsstatus for kvinder med reproduktionspotentiale før påbegyndelse af HYDREA-behandling.
Svangerskabsforebyggelse
Kvinder
HYDREA kan forårsage fosterskader, når det administreres til en gravid kvinde [se Graviditet ]. Rådgiv kvinder med reproduktionspotentiale til at bruge effektiv prævention under og efter behandling med HYDREA i mindst 6 måneder efter behandlingen. Rådgiv kvinder til straks at rapportere graviditet.
Hanner
HYDREA 500mg kan beskadige spermatozoer og testikelvæv, hvilket resulterer i mulige genetiske abnormiteter. Mænd med kvindelige seksuelle partnere af reproduktionspotentiale bør anvende effektiv prævention under og efter behandling med HYDREA 500 mg i mindst 1 år efter behandlingen [se Ikke-klinisk toksikologi ].
Infertilitet
Hanner
Baseret på fund hos dyr og mennesker kan mandlig fertilitet blive kompromitteret ved behandling med HYDREA. Azoospermi eller oligospermi, nogle gange reversibel, er blevet observeret hos mænd. Informelle mandlige patienter om muligheden for sædkonservering før starten af behandlingen [se BIVIRKNINGER og Ikke-klinisk toksikologi ].
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Ældre patienter kan være mere følsomme over for virkningerne af hydroxyurinstof og kan have behov for et lavere dosisregime. Hydroxyurea udskilles af nyrerne, og risikoen for bivirkninger af dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og det kan være nyttigt at overvåge nyrefunktionen [se DOSERING OG ADMINISTRATION ].
Nedsat nyrefunktion
Eksponeringen for hydroxyurinstof er højere hos patienter med kreatininclearance på mindre end 60 ml/min eller hos patienter med nyresygdom i slutstadiet (ESRD). Reducer dosis og overvåg nøje de hæmatologiske parametre, når HYDREA 500mg skal administreres til disse patienter [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Der er ingen data, der understøtter specifik vejledning for dosisjustering hos patienter med nedsat leverfunktion. Tæt monitorering af hæmatologiske parametre tilrådes hos disse patienter.
OVERDOSIS
Akut mukokutan toksicitet er blevet rapporteret hos patienter, der får hydroxyurinstof i doser flere gange den terapeutiske dosis. Ømhed, violet erytem, ødem på håndflader og såler efterfulgt af skæl af hænder og fødder, alvorlig generaliseret hyperpigmentering af huden og stomatitis er også blevet observeret.
KONTRAINDIKATIONER
HYDREA 500mg er kontraindiceret til patienter, der tidligere har påvist overfølsomhed over for hydroxyurinstof eller enhver anden komponent i formuleringen.
KLINISK FARMAKOLOGI
Virkningsmekanisme
Den præcise mekanisme, hvorved hydroxyurinstof frembringer sine antineoplastiske virkninger, kan ikke på nuværende tidspunkt beskrives. Rapporterne fra forskellige undersøgelser af vævskultur hos rotter og mennesker støtter imidlertid hypotesen om, at hydroxyurinstof forårsager en øjeblikkelig hæmning af DNA-syntese ved at fungere som en ribonukleotid-reduktaseinhibitor uden at forstyrre syntesen af ribonukleinsyre eller protein. Denne hypotese forklarer, hvorfor hydroxyurinstof under visse betingelser kan inducere teratogene virkninger.
Tre virkningsmekanismer er blevet postuleret for den øgede effektivitet af samtidig brug af hydroxyurinstofbehandling med bestråling på pladecellekarcinomer (epidermoide) i hoved og hals. In vitro-undersøgelser, der anvender kinesiske hamsterceller, tyder på, at hydroxyurinstof (1) er dødelig for normalt radioresistente S-stadiumceller og (2) holder andre celler i cellecyklussen i G1- eller præ-DNA-syntesestadiet, hvor de er mest modtagelige for effekter af bestråling. Den tredje virkningsmekanisme er blevet teoretiseret på basis af in vitro undersøgelser af HeLa-celler. Det ser ud til, at hydroxyurinstof ved inhibering af DNA-syntese hindrer den normale reparationsproces af celler, der er beskadiget, men ikke dræbt af bestråling, og derved nedsætter deres overlevelsesrate; RNA- og proteinsynteser har ikke vist nogen ændring.
Farmakokinetik
Absorption
Efter oral administration af HYDREA når hydroxyurinstof maksimale plasmakoncentrationer i løbet af 1 til 4 timer. Gennemsnitlige maksimale plasmakoncentrationer og AUC'er stiger mere end proportionalt med øget dosis.
Der er ingen data om virkningen af mad på absorptionen af hydroxyurinstof.
Fordeling
Hydroxyurea fordeler sig i hele kroppen med et distributionsvolumen, der tilnærmer sig det samlede kropsvand.
Hydroxyurea koncentreres i leukocytter og erytrocytter.
Metabolisme
Op til 60 % af en oral dosis undergår omdannelse gennem mættet levermetabolisme og en mindre nedbrydningsvej af urease fundet i tarmbakterier.
Udskillelse
Hos patienter med seglcelleanæmi var den gennemsnitlige kumulative uringenvinding af hydroxyurinstof ca. 40 % af den administrerede dosis.
Specifikke populationer
Nedsat nyrefunktion
Virkningen af nedsat nyrefunktion på farmakokinetikken af hydroxyurinstof blev vurderet hos voksne patienter med seglcellesygdom og nedsat nyrefunktion. Patienter med normal nyrefunktion (kreatininclearance [CrCl] >80 mL/min), mild (CrCl 50-80 mL/min), moderat (CrCl = 30-60 ml/min). Reducer dosis af HYDREA 500 mg, når det administreres til patienter med kreatininclearance på DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
PATIENTOPLYSNINGER
- Der er risiko for myelosuppression. Overvågning af blodtal ugentlig i hele behandlingens varighed bør fremhæves for patienter, der tager HYDREA [se ADVARSLER OG FORHOLDSREGLER ]. Rådgiv patienterne om straks at rapportere tegn og symptomer på infektion eller blødning.
- Rådgiv patienterne om, at der er risiko for kutan vaskulitisk toksicitet og sekundære maligniteter, herunder leukæmi og hudkræft [se ADVARSLER OG FORHOLDSREGLER ].
- Informer kvinder om reproduktionspotentiale om den potentielle risiko for et foster og informere deres læge om en kendt eller formodet graviditet. Rådgiv kvinder og mænd med reproduktionspotentiale til at bruge prævention under og efter behandling med HYDREA [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
- Råd patienterne til at informere deres læge, hvis de har modtaget eller planlægger at modtage vaccinationer, mens de tager HYDREA 500 mg, da dette kan resultere i en alvorlig infektion [se ADVARSLER OG FORHOLDSREGLER ].
- Råd til kvinder om at stoppe amningen under behandling med HYDREA [se Brug i specifikke populationer ].
- Patienter med HIV-infektion bør kontakte deres læge for tegn og symptomer på pancreatitis, leverhændelser og perifer neuropati [se ADVARSLER OG FORHOLDSREGLER ].
- Erytem efter bestråling kan forekomme hos patienter, som tidligere har modtaget strålebehandling [se ADVARSLER OG FORHOLDSREGLER ].
- Rådgiv patienterne om symptomerne på potentiel lungetoksicitet og instruer dem i at søge omgående lægehjælp i tilfælde af pyreksi, hoste, dyspnø eller andre luftvejssymptomer [se ADVARSLER OG FORHOLDSREGLER ].
