Suprax 100mg, 200mg Cefixime Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Suprax 200mg, og hvordan bruges det?
Suprax (cefixim) til oral suspension er et cephalosporin-antibiotikum, der bruges til at behandle mange forskellige typer infektioner forårsaget af bakterier.
Hvad er bivirkninger af Suprax?
Almindelige bivirkninger af Suprax 100mg omfatter:
- mavebesvær/smerter,
- diarré,
- kvalme,
- forstoppelse,
- mistet appetiten,
- gas,
- hovedpine,
- svimmelhed,
- angst,
- døsighed,
- øget natlig vandladning,
- løbende næse,
- ondt i halsen,
- hoste, eller
- vaginal kløe eller udflåd.
Fortæl det til din læge, hvis du oplever sjældne, men meget alvorlige bivirkninger af Suprax 200mg, herunder:
- stærke mave- eller mavesmerter,
- vedvarende kvalme eller opkastning,
- gulne øjne eller hud,
- mørk urin,
- usædvanlig træthed,
- nye tegn på infektion (f.eks. vedvarende ondt i halsen, feber),
- let blå mærker eller blødning,
- ændring i mængden af urin, eller
- mentale/humørændringer (såsom forvirring).
BESKRIVELSE
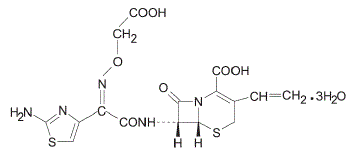
Cefixime er et semisyntetisk cephalosporin-antibakterielt middel til oral administration. Kemisk er det (6R,7R)-7-[2-(2-Amino-4-thiazolyl)glyoxylamido]-8-oxo-3-vinyl-5-thia-1-azabicyclo [4.2.0] oct-2 -en-2-carboxylsyre, 72-(Z)-[O-(carboxymethyl)oxim]trihydrat.
Molekylvægt = 507,50 som trihydrat. Kemisk formel er C16H15N5O7S2.3H2O
Strukturformlen for cefixim er:
- Inaktive ingredienser indeholdt i SUPRAX® (cefixim) 400 mg tabletter USP er: dibasisk calciumphosphat, hypromellose, lactosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, prægelatineret stivelse, titaniumdioxid og triacetin.
- Inaktive ingredienser indeholdt i SUPRAX® (cefixim) 400 mg kapsler er: kolloid siliciumdioxid, crospovidon, lavsubstitueret hydroxypropylcellulose, magnesiumstearat og mannitol. Kapselskallen indeholder følgende inaktive ingredienser: sort jernoxid, rød jernoxid, gelatine, kaliumhydroxid, propylenglycol, shellak, natriumlaurylsulfat og titaniumdioxid.
- Inaktive ingredienser indeholdt i SUPRAX® (cefixim) 100 mg eller 150 mg eller 200 mg tyggetabletter er: aspartam, kolloid siliciumdioxid, crospovidon, FD&C Red # 40 Aluminium Lake, lavsubstitueret hydroxypropylcellulose, magnesiumstearat, permaseal cellulose, mannitol og tutti frutti smag.
- Inaktive ingredienser indeholdt i SUPRAX® (cefixim) pulver til oral suspension USP er: kolloid siliciumdioxid, natriumbenzoat, jordbærsmag, sucralose (kun i 500 mg/5 ml styrke), saccharose og xanthangummi.
INDIKATIONER
Ukomplicerede urinvejsinfektioner
SUPRAX er indiceret til behandling af voksne og pædiatriske patienter i alderen seks måneder eller ældre med ukomplicerede urinvejsinfektioner forårsaget af modtagelige isolater af Escherichia coli og Proteus mirabilis.
Mellemørebetændelse
SUPRAX er indiceret til behandling af voksne og pædiatriske patienter i alderen seks måneder eller ældre med mellemørebetændelse forårsaget af modtagelige isolater af Haemophilus influenzae, Moraxella catarrhalis og Streptococcus pyogenes. (Effektiviteten for Streptococcus pyogenes i dette organsystem blev undersøgt i færre end 10 infektioner.)
Bemærk
For patienter med mellemørebetændelse forårsaget af Streptococcus pneumoniae var den samlede respons ca. 10 % lavere for cefixim end for sammenligningsmidlet [se Kliniske Studier ].
Pharyngitis og tonsillitis
SUPRAX er indiceret til behandling af voksne og pædiatriske patienter i alderen seks måneder eller ældremed pharyngitis og tonsillitis forårsaget af modtagelige isolater af Streptococcus pyogenes. (Bemærk: Penicillin er det sædvanlige lægemiddel til behandling af Streptococcus pyogenes-infektioner. SUPRAX er generelt effektivt til udryddelse af Streptococcus pyogenes fra nasopharynx, men data, der fastslår effektiviteten af SUPRAX 100mg i den efterfølgende forebyggelse af gigtfeber er ikke ledig.)
Akutte eksacerbationer af kronisk bronkitis
SUPRAX 200mg er indiceret til behandling af voksne og pædiatriske patienter i alderen seks måneder eller ældre med akutte forværringer af kronisk bronkitis forårsaget af modtagelige isolater af Streptococcus pneumoniae og Haemophilus influenzae.
Ukompliceret gonoré (cervikal/urethra)
SUPRAX 100mg er indiceret til behandling af voksne og pædiatriske patienter seks måneder eller ældre med ukompliceret gonoré (cervikal/urethral) forårsaget af modtagelige isolater af Neisseria gonorrhoeae (penicillinase- og ikke-penicillinase-producerende isolater).
Brug
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af SUPRAX 100mg og andre antibakterielle lægemidler, bør SUPRAX 100mg kun bruges til at behandle infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved valg eller ændring af antimikrobiel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
DOSERING OG ADMINISTRATION
Voksne
Den anbefalede dosis cefixim er 400 mg dagligt. Dette kan gives som en 400 mg tablet eller kapsel dagligt, eller 400 mg tabletten kan deles og gives som en halv tablet hver 12. time. Til behandling af ukomplicerede cervikale/urethrale gonokokinfektioner anbefales en enkelt oral dosis på 400 mg. Kapslen og tabletten kan administreres uden hensyntagen til mad.
Ved behandling af infektioner forårsaget af Streptococcus pyogenes bør en terapeutisk dosis af cefixim administreres i mindst 10 dage.
Pædiatriske patienter (6 måneder eller ældre)
Den anbefalede dosis er 8 mg/kg/dag af suspensionen. Dette kan indgives som en enkelt daglig dosis eller kan gives i to opdelte doser, som 4 mg/kg hver 12. time.
Bemærk
En foreslået dosis er blevet bestemt for hvert pædiatrisk vægtområde. Se tabel 1. Sørg for, at alle ordrer, der specificerer en dosis i milliliter, inkluderer en koncentration, fordi SUPRAX til oral suspension er tilgængelig i tre forskellige koncentrationer (100 mg/5 ml, 200 mg/5 ml og 500 mg/5 ml).
Børn, der vejer mere end 45 kg eller ældre end 12 år, bør behandles med den anbefalede voksendosis. SUPRAX (cefixim) tyggetabletter skal tygges eller knuses før indtagelse.
Mellemørebetændelse skal behandles med tyggetabletter eller suspension. Kliniske forsøg med mellemørebetændelse blev udført med tyggetabletterne eller suspensionen, og tyggetabletterne eller suspensionen resulterer i højere maksimale blodniveauer end tabletten, når de administreres i samme dosis.
Derfor bør tabletten eller kapslen ikke erstattes af tyggetabletter eller suspension ved behandling af mellemørebetændelse [se KLINISK FARMAKOLOGI ].
Ved behandling af infektioner forårsaget af Streptococcus pyogenes bør en terapeutisk dosis af cefixim administreres i mindst 10 dage.
Nedsat nyrefunktion
SUPRAX 200mg kan administreres i tilfælde af nedsat nyrefunktion. Normal dosis og skema kan anvendes til patienter med kreatininclearance på 60 ml/min eller mere. Se tabel 2 for dosisjusteringer til voksne med nedsat nyrefunktion. Hverken hæmodialyse eller peritonealdialyse fjerner væsentlige mængder lægemiddel fra kroppen.
Rekonstitutionsvejledning til oral suspension
Efter rekonstituering kan suspensionen opbevares i 14 dage enten ved stuetemperatur eller på køl uden væsentligt tab af styrke. Opbevares tæt lukket. Ryst godt før brug. Kassér ubrugt portion efter 14 dage.
HVORDAN LEVERET
Doseringsformer og styrker
SUPRAX er tilgængelig til oral administration i følgende doseringsformer og styrker:
- Filmovertrukne tabletter giver 400 mg cefixim som trihydrat. Disse er hvide til råhvide, filmovertrukne, kapselformede tabletter med skrå kanter og en delt delekærv på hver side. Tabletten er præget med "SUPRAX" på den ene side og "LUPIN" på den anden side.
- Kapsler giver 400 mg cefixim som trihydrat. Disse er størrelse "00EL" kapsler med pink uigennemsigtig hætte og pink uigennemsigtig krop med "LU" på hætten og "U43" på kroppen i sort blæk. Kapsler indeholder hvidt til gulligt hvidt granulært pulver.
- Tyggetabletter giver enten 100 mg eller 150 mg eller 200 mg cefixim som trihydrat. 100 mg tabletten er lyserød, rund tablet, præget med "SUPRAX 100" på den ene side og "LUPIN" på den anden side. 150 mg tabletten er lyserød, rund tablet, præget med "SUPRAX 150" på den ene side og "LUPIN" på den anden side. 200 mg tabletten er lyserød, rund tablet, præget med "SUPRAX 200" på den ene side og "LUPIN" på den anden side.
- Pulver til oral suspension giver, når det er rekonstitueret, enten 100 mg/5 ml eller 200 mg/5 ml eller 500 mg/5 ml cefixim som trihydrat. For 100 mg/5 mL og 200 mg/5 mL har pulveret en råhvid til svagt gul farve og er jordbærsmag. For 500 mg/5 ml har pulveret en råhvid til cremet farve og er jordbærsmag.
Opbevaring og håndtering
SUPRAX® fås til oral administration i følgende doseringsformer, styrker og pakninger anført i tabellen nedenfor:
Fremstillet af: Lupine Limited Mandideep 462 046 Indien. Revideret: marts 2018.
BIVIRKNINGER
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
De mest almindeligt sete bivirkninger i amerikanske forsøg med tabletformuleringen var gastrointestinale hændelser, som blev rapporteret hos 30 % af voksne patienter på enten regimen to gange dagligt eller én gang dagligt. Fem procent (5%) af patienterne i de amerikanske kliniske forsøg ophørte med behandlingen på grund af lægemiddelrelaterede bivirkninger. Individuelle bivirkninger inkluderede diarré 16 %, løs eller hyppig afføring 6 %, mavesmerter 3 %, kvalme 7 %, dyspepsi 3 % og flatulens 4 %. Forekomsten af gastrointestinale bivirkninger, inklusive diarré og løs afføring, hos pædiatriske patienter, der fik suspensionen, var sammenlignelig med forekomsten hos voksne patienter, der fik tabletter.
Post-marketing oplevelse
Følgende bivirkninger er blevet rapporteret efter brug af cefixim efter godkendelse. Incidensraterne var mindre end 1 ud af 50 (mindre end 2%).
Gastrointestinale
Adskillige tilfælde af dokumenteret pseudomembranøs colitis blev identificeret i kliniske forsøg. Begyndelsen af pseudomembranøs colitis-symptomer kan forekomme under eller efter behandlingen.
Overfølsomhedsreaktioner
Anafylaktiske/anafylaktoide reaktioner (inklusive shock og dødsfald), hududslæt, nældefeber, medicinfeber, kløe, angioødem og ansigtsødem. Erythema multiforme, Stevens-Johnsons syndrom og serumsygelignende reaktioner er blevet rapporteret.
Hepatisk
flygende stigninger i SGPT, SGOT, alkalisk fosfatase, hepatitis, gulsot.
Renal
Forbigående stigninger i BUN eller kreatinin, akut nyresvigt.
Centralnervesystemet
Hovedpine, svimmelhed, kramper.
Hemisk og lymfesystem
Forbigående trombocytopeni, leukopeni, neutropeni, forlængelse af protrombintid, forhøjet LDH, pancytopeni, agranulocytose og eosinofili.
Unormale laboratorieprøver
Hyperbilirubinæmi.
Andre bivirkninger
Genital pruritus, vaginitis, candidiasis, toksisk epidermal nekrolyse.
Bivirkninger rapporteret for lægemidler i cephalosporinklassen
Allergiske reaktioner, superinfektion, nyreinsufficiens, toksisk nefropati, hepatisk dysfunktion inklusive kolestase, aplastisk anæmi, hæmolytisk anæmi, blødning og colitis.
Adskillige cephalosporiner har været impliceret i at udløse anfald, især hos patienter med nedsat nyrefunktion, når dosis ikke blev reduceret [se DOSERING OG ADMINISTRATION se OVERDOSIS ]. Hvis der opstår anfald i forbindelse med lægemiddelbehandling, skal lægemidlet seponeres. Antikonvulsiv behandling kan gives, hvis det er klinisk indiceret.
DRUGSINTERAKTIONER
Carbamazepin
Forhøjede carbamazepinniveauer er blevet rapporteret efter markedsføring, når cefixim administreres samtidigt. Lægemiddelovervågning kan være en hjælp til at påvise ændringer i plasmakoncentrationer af carbamazepin.
Warfarin og antikoagulantia
Øget protrombintid, med eller uden klinisk blødning, er blevet rapporteret, når cefixim administreres samtidigt.
Interaktioner med lægemiddel/laboratorietest
En falsk-positiv reaktion for ketoner i urinen kan forekomme ved tests med nitroprussid, men ikke med dem, der bruger nitroferricyanid.
Administration af cefixim kan resultere i en falsk positiv reaktion for glukose i urinen ved brug af Clinitest®, Benedicts opløsning eller Fehlings opløsning. Det anbefales, at der anvendes glukosetest baseret på enzymatiske glucoseoxidase-reaktioner (såsom Clinistix® eller TesTape®). En falsk positiv direkte Coombs-test er blevet rapporteret under behandling med andre cephalosporiner; derfor bør det erkendes, at en positiv Coombs-test kan skyldes stoffet.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Overfølsomhedsreaktioner
Anafylaktiske/anafylaktoide reaktioner (inklusive shock og dødsfald) er blevet rapporteret ved brug af cefixim.
Før behandling med SUPRAX påbegyndes, bør der foretages omhyggelig undersøgelse for at afgøre, om patienten tidligere har haft overfølsomhedsreaktioner over for cephalosporiner, penicilliner eller andre lægemidler. Hvis dette produkt skal gives til penicillinfølsomme patienter, skal der udvises forsigtighed, fordi krydsoverfølsomhed blandt beta-lactam antibakterielle lægemidler er klart dokumenteret og kan forekomme hos op til 10 % af patienter med en historie med penicillinallergi. Hvis der opstår en allergisk reaktion på SUPRAX 100mg, skal du seponere lægemidlet.
Clostridium Difficile-associeret diarré
Clostridium difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive SUPRAX 200mg, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende isolater af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, som får diarré efter brug af antibakteriel medicin. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis der er mistanke om eller bekræftet CDAD, skal igangværende brug af antibakteriel medicin, der ikke er rettet mod C. difficile, muligvis afbrydes. Passende væske- og elektrolytbehandling, proteintilskud, antibakteriel lægemiddelbehandling af C. difficile og kirurgisk evaluering bør iværksættes som klinisk indiceret.
Dosisjustering ved nedsat nyrefunktion
Dosis af SUPRAX 100 mg bør justeres hos patienter med nedsat nyrefunktion samt patienter, der gennemgår kontinuerlig ambulatorisk peritonealdialyse (CAPD) og hæmodialyse (HD). Patienter i dialyse skal overvåges omhyggeligt [se DOSERING OG ADMINISTRATION ].
Koagulationseffekter
Cephalosporiner, inklusive SUPRAX 200 mg, kan være forbundet med et fald i protrombinaktivitet. De i risikogruppen omfatter patienter med nedsat nyre- eller leverfunktion eller dårlig ernæringstilstand, såvel som patienter, der får et langvarigt forløb med antimikrobiel behandling, og patienter, der tidligere har stabiliseret sig på antikoagulantbehandling. Protrombintiden bør overvåges hos patienter i risikogruppen, og eksogent K-vitamin skal administreres som indiceret.
Udvikling af lægemiddelresistente bakterier
Udskrivning af SUPRAX (cefixim) i fravær af en påvist eller stærkt mistænkt bakteriel infektion vil sandsynligvis ikke give gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier.
Risiko hos patienter med phenylketonuri
Phenylalanin kan være skadeligt for patienter med phenylketonuri (PKU). SUPRAX 200mg tyggetabletter indeholder aspartam, en kilde til phenylalanin. Hver 100 mg, 150 mg og 200 mg styrke indeholder henholdsvis 3,3 mg, 5 mg og 6,7 mg phenylalanin. Før du ordinerer SUPRAX tyggetabletter til en patient med PKU, skal du overveje den kombinerede daglige mængde phenylalanin fra alle kilder, inklusive SUPRAX 200 mg tyggetabletter.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Der er ikke udført livstidsundersøgelser på dyr for at vurdere kræftfremkaldende potentiale. Cefixim forårsagede ikke punktmutationer i bakterier eller pattedyrceller, DNA-skader eller kromosomskader in vitro og udviste ikke klastogent potentiale in vivo i mikronukleustesten hos mus. Hos rotter blev fertilitet og reproduktionsevne ikke påvirket af cefixim ved doser på op til 25 gange den terapeutiske dosis for voksne.
Brug i specifikke populationer
Graviditet
Graviditetskategori B
Reproduktionsundersøgelser er blevet udført på mus og rotter i doser op til 40 gange den humane dosis og har ikke afsløret tegn på skade på fosteret på grund af cefixim. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Arbejde og levering
Cefixime er ikke blevet undersøgt til brug under veer og fødsel. Behandling bør kun gives, hvis det er klart nødvendigt.
Ammende mødre
Det vides ikke, om cefixim udskilles i modermælk. Det bør overvejes at afbryde amningen midlertidigt under behandling med dette lægemiddel.
Pædiatrisk brug
Sikkerhed og effektivitet af cefixim hos børn under seks måneder er ikke blevet fastslået. Forekomsten af gastrointestinale bivirkninger, herunder diarré og løs afføring, hos de pædiatriske patienter, der fik suspensionen, var sammenlignelig med forekomsten hos voksne patienter, der fik tabletter.
Geriatrisk brug
Kliniske undersøgelser omfattede ikke tilstrækkeligt antal forsøgspersoner på 65 år og ældre til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. En farmakokinetisk undersøgelse hos ældre påviste forskelle i farmakokinetiske parametre [se KLINISK FARMAKOLOGI ]. Disse forskelle var små og indikerer ikke et behov for dosisjustering af lægemidlet hos ældre.
Nedsat nyrefunktion
Dosis af cefixim bør justeres hos patienter med nedsat nyrefunktion samt patienter, der gennemgår kontinuerlig ambulatorisk peritonealdialyse (CAPD) og hæmodialyse (HD). Patienter i dialyse skal overvåges omhyggeligt [se DOSERING OG ADMINISTRATION ].
OVERDOSIS
Maveskylning kan være indiceret; ellers findes der ingen specifik modgift. Cefixim fjernes ikke i væsentlige mængder fra kredsløbet ved hæmodialyse eller peritonealdialyse. Bivirkninger hos et lille antal raske voksne frivillige, der fik enkeltdoser på op til 2 g cefixim, afveg ikke fra profilen set hos patienter behandlet med de anbefalede doser.
KONTRAINDIKATIONER
Suprax (cefixim) er kontraindiceret hos patienter med kendt allergi over for cefixim eller andre cephalosporiner.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Cefixim er et semisyntetisk cephalosporin antibakterielt lægemiddel [se Mikrobiologi ].
Farmakokinetik
SUPRAX 200 mg tyggetabletter er bioækvivalente med oral suspension.
SUPRAX 200 mg tabletter og suspension, givet oralt, absorberes omkring 40 % til 50 %, uanset om de administreres med eller uden mad; dog øges tiden til maksimal absorption med ca. 0,8 timer, når det administreres sammen med mad. En enkelt 200 mg-tablet cefixim producerer en gennemsnitlig maksimal serumkoncentration på ca. 2 mcg/ml (interval 1 til 4 mcg/ml); en enkelt 400 mg tablet giver en gennemsnitlig topkoncentration på ca. 3,7 mcg/ml (interval 1,3 til 7,7 mcg/ml). Den orale suspension producerer gennemsnitlige maksimale koncentrationer, der er ca. 25 % til 50 % højere end tabletterne, når de testes hos normale voksne frivillige. To hundrede og 400 mg doser oral suspension producerer gennemsnitlige maksimale koncentrationer på henholdsvis 3 mcg/ml (interval 1 til 4,5 mcg/ml) og 4,6 mcg/ml (interval 1,9 til 7,7 mcg/ml), når de testes hos normale voksne frivillige. . Arealet under kurven for tid versus koncentration (AUC) er ca. 10 % til 25 % større med den orale suspension end med tabletten efter doser på 100 til 400 mg, når testet hos normale voksne frivillige. Denne øgede absorption skal tages i betragtning, hvis den orale suspension skal erstatte tabletten. På grund af den manglende bioækvivalens bør tabletter ikke erstatte oral suspension ved behandling af mellemørebetændelse [se DOSERING OG ADMINISTRATION ]. Cross-over undersøgelser af tablet versus suspension er ikke blevet udført hos børn.
400 mg kapslen er bioækvivalent med 400 mg tabletten under fastende forhold. Mad reducerer dog absorptionen efter administration af kapslen med ca. 15 % baseret på AUC og 25 % baseret på Cmax.
Maksimal serumkoncentration forekommer mellem 2 og 6 timer efter oral administration af en enkelt 200 mg tablet, en enkelt 400 mg tablet eller 400 mg cefiximsuspension. Maksimal serumkoncentration forekommer mellem 2 og 5 timer efter en enkelt administration af 200 mg suspension. Maksimal serumkoncentration forekommer mellem 3 og 8 timer efter oral administration af en enkelt 400 mg kapsel.
Fordeling
Serumproteinbinding er koncentrationsuafhængig med en bundet fraktion på ca. 65%. I en flerdosisundersøgelse udført med en forskningsformulering, som er mindre biotilgængelig end tabletten eller suspensionen, var der ringe ophobning af lægemiddel i serum eller urin efter dosering i 14 dage. Tilstrækkelige data om CSF-niveauer af cefixim er ikke tilgængelige.
Metabolisme og udskillelse
Der er ingen tegn på metabolisme af cefixim in vivo. Ca. 50 % af den absorberede dosis udskilles uændret i urinen i løbet af 24 timer. I dyreforsøg blev det bemærket, at cefixim også udskilles i galden ud over 10 % af den administrerede dosis. Serumhalveringstiden for cefixim hos raske forsøgspersoner er uafhængig af doseringsform og er i gennemsnit 3 til 4 timer, men kan variere op til 9 timer hos nogle normale frivillige.
Særlige Populationer
Geriatri
Gennemsnitlige AUC'er ved steady state hos ældre patienter er ca. 40 % højere end gennemsnitlige AUC'er hos andre raske voksne. Forskelle i de farmakokinetiske parametre mellem 12 unge og 12 ældre forsøgspersoner, der fik 400 mg cefixim én gang dagligt i 5 dage, er opsummeret som følger:
Disse stigninger var dog ikke klinisk signifikante [se DOSERING OG ADMINISTRATION ].
Nedsat nyrefunktion
Hos personer med moderat nedsat nyrefunktion (20 til 40 ml/min kreatininclearance) forlænges den gennemsnitlige serumhalveringstid for cefixim til 6,4 timer. Ved svær nyreinsufficiens (5 til 20 ml/min kreatininclearance) øgedes halveringstiden til et gennemsnit på 11,5 timer. Lægemidlet fjernes ikke signifikant fra blodet ved hæmodialyse eller peritonealdialyse. En undersøgelse viste imidlertid, at med doser på 400 mg har patienter, der gennemgår hæmodialyse, lignende blodprofiler som forsøgspersoner med kreatininclearance på 21 til 60 ml/min.
Mikrobiologi
Handlingsmekanisme
Som med andre cephalosporiner skyldes den bakteriedræbende virkning af cefixim fra hæmning af cellevægssyntese. Cefixim er stabilt i nærværelse af visse beta-lactamase-enzymer. Som følge heraf kan visse organismer, der er resistente over for penicilliner og nogle cephalosporiner på grund af tilstedeværelsen af betalaktamaser, være modtagelige for cefixim.
Modstand
Resistens over for cefixim i isolater af Haemophilus influenzae og Neisseria gonorrhoeae er oftest forbundet med ændringer i penicillin-bindende proteiner (PBP'er). Cefixim kan have begrænset aktivitet mod Enterobacteriaceae, der producerer udvidede spektrum beta-lactamaser (ESBL'er). Pseudomonas-arter, Enterococcus-arter, stammer af gruppe D-streptokokker, Listeria monocytogenes, de fleste stammer af stafylokokker (inklusive methicillin-resistente stammer), de fleste stammer af Enterobacter-arter, de fleste stammer af Bacteroides fragilis, og de fleste stammer af Clotostridium-arter er resistenser af Clotostridium.
Antimikrobiel aktivitet
Cefixim har vist sig at være aktivt mod de fleste isolater af følgende mikroorganismer, både in vitro og ved kliniske infektioner [se INDIKATIONER ].
Gram-positive bakterier
Streptococcus pneumoniae Streptococcus pyogenes
Gram-negative bakterier
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Neisseria gonorrhoeae Proteus mirabilis
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt. Mindst 90 procent af de følgende bakterier udviser en in vitro minimal hæmmende koncentration (MIC) mindre end eller lig med det modtagelige brudpunkt for cefixim mod isolater af lignende slægt eller organismegruppe. Effektiviteten af cefixim til behandling af kliniske infektioner forårsaget af disse bakterier er imidlertid ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
Gram-positive bakterier
Streptococcus agalactiae
Gram-negative bakterier
Citrobacter amalonaticus Citrobacter diversus Haemophilus parainfluenzae Klebsiella oxytoca Klebsiella pneumoniae Pasteurella multocida Proteus vulgaris Providencia arter Salmonella arter Serratia marcescens Shigella arter
Modtagelighedstest
For specifik information om fortolkningskriterier for følsomhedstest og tilhørende testmetoder og kvalitetskontrolstandarder anerkendt af FDA for dette lægemiddel, se venligst: https://www.fda.gov/STIC.
Kliniske Studier
Sammenlignende kliniske forsøg med mellemørebetændelse blev udført i næsten 400 børn i alderen 6 måneder til 10 år. Streptococcus pneumoniae blev isoleret fra 47 % af patienterne, Haemophilus influenzae fra 34 %, Moraxella catarrhalis fra 15 % og S. pyogenes fra 4 %.
Den samlede responsrate for Streptococcus pneumoniae på cefixim var ca. 10 % lavere og den for Haemophilus influenzae eller Moraxella catarrhalis ca. 7 % højere (12 %, når beta-lactamase positive isolater af H. influenzae er inkluderet) end responsraterne for disse organismer til de aktive kontrolmidler.
disse undersøgelser blev patienterne randomiseret og behandlet med enten cefixim i dosisregimer på 4 mg/kg to gange dagligt eller 8 mg/kg én gang dagligt eller med en komparator. 69 til 70 % af patienterne i hver gruppe havde opløsning af tegn og symptomer på mellemørebetændelse, når de blev evalueret 2 til 4 uger efter behandling, men vedvarende effusion blev fundet hos 15 % af patienterne. Når de blev evalueret ved afslutningen af behandlingen, blev 17 % af patienterne, der fik cefixim, og 14 % af patienterne, der fik effektive sammenlignende lægemidler (18 % inklusive de patienter, der havde Haemophilus influenzae, der var resistente over for kontrollægemidlet, og som fik det antibakterielle kontrolpræparat) behandlingssvigt. Ved 2 til 4 ugers opfølgning havde i alt 30%-31% af patienterne tegn på enten behandlingssvigt eller tilbagevendende sygdom.
Bakteriologisk resultat af otitis media to til fire uger efter terapi baseret på gentagen mellemøre
PATIENTOPLYSNINGER
Rådgiv patienterne om, at antibakterielle lægemidler, inklusive cefixim, kun bør bruges til at behandle bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. forkølelse). Når cefixim ordineres til behandling af en bakteriel infektion, skal patienterne fortælles, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan: (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med cefixim til oral suspension eller cefixim tyggetabletter eller andre antibakterielle lægemidler i fremtiden.
Rådgiv patienter med phenylketonuri, at SUPRAX 200 mg tyggetabletter indeholder aspartam, en kilde til phenylalanin som følger: Hver SUPRAX tyggetablet indeholder henholdsvis 3,3 mg, 5 mg og 6,7 mg phenylalanin pr. 100 mg og 200 mg styrke.
Rådgiv patienterne, at diarré er et almindeligt problem forårsaget af antibakterielle lægemidler, som normalt ophører, når det antibakterielle lægemiddel seponeres. Nogle gange kan patienter efter start af behandling med antibakterielle lægemidler udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af det antibakterielle lægemiddel. Hvis dette sker, skal patienter kontakte deres læge hurtigst muligt.
