Asacol 400mg Mesalamine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Asacol 400mg, og hvordan bruges det?
Asacol er en receptpligtig medicin, der bruges til at behandle symptomerne på colitis ulcerosa. Asacol 400mg kan bruges alene eller sammen med anden medicin.
Asacol tilhører en klasse af lægemidler kaldet 5-aminosalicylsyrederivater.
Det vides ikke, om Asacol 400mg er sikkert og effektivt til børn under 5 år.
Hvad er de mulige bivirkninger af Asacol 400mg?
Asacol kan forårsage alvorlige bivirkninger, herunder:
- stærke mavesmerter,
- mavekramper,
- blodig diarré,
- feber,
- hovedpine,
- udslæt,
- blodig eller tjæreagtig afføring,
- hoste blod op,
- opkast, der ligner kaffegrums,
- lidt eller ingen vandladning,
- smertefuld eller vanskelig vandladning,
- hævelse i dine fødder eller ankler,
- træthedsfornemmelse,
- stakåndet,
- mistet appetiten,
- smerter i øvre mave,
- let blå mærker eller blødning,
- mørk urin,
- lerfarvede afføring, og
- gulfarvning af huden eller øjnene (gulsot)
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Asacol omfatter:
- kvalme,
- opkastning,
- mavesmerter,
- diarré,
- dårlig fordøjelse,
- gas,
- hovedpine,
- udslæt, og
- unormale leverfunktionsprøver
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Asacol. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Hver Asacol (mesalamin) tablet med forsinket frigivelse til oral administration indeholder 400 mg mesalamin, et aminosalicylat. Asacol (mesalamin) tabletter med forsinket frigivelse indeholder akrylbaseret harpiks, Eudragit S (methacrylsyre copolymer type B, NF), som opløses ved pH 7 eller højere og frigiver mesalamin i den terminale ileum og videre til topisk anti-inflammatorisk virkning i tyktarmen . Mesalamin (også omtalt som 5-aminosalicylsyre eller 5-ASA) har det kemiske navn 5-amino-2-hydroxybenzoesyre. Dens strukturformel er:
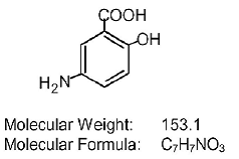
Inaktive ingredienser: Hver tablet indeholder kolloid siliciumdioxid, dibutylphthalat, spiseligt sort blæk, rødt jernoxid, gult jernoxid, lactosemonohydrat, magnesiumstearat, methacrylsyrecopolymer B (Eudragit S), polyethylenglycol, povidon, natriumstivelsesglycolat og talkum.
INDIKATIONER
Behandling af mild til moderat aktiv colitis ulcerosa
Asacol® (mesalamin) tabletter med forsinket frigivelse er indiceret til behandling af mild til moderat aktiv colitis ulcerosa hos patienter på 5 år og ældre.
Vedligeholdelse af remission af colitis ulcerosa hos voksne
Asacol (mesalamin) tabletter med forsinket frigivelse er indiceret til opretholdelse af remission af colitis ulcerosa hos voksne. Sikkerheden og effektiviteten af Asacol til opretholdelse af remission af colitis ulcerosa hos pædiatriske patienter er ikke blevet fastlagt.
DOSERING OG ADMINISTRATION
Dosering til behandling af mild til moderat aktiv colitis ulcerosa
Voksne
For voksne er den anbefalede dosis af Asacol 400 mg to 400 mg tabletter, der skal tages tre gange dagligt med eller uden mad (samlet daglig dosis på 2,4 gram), i en varighed på 6 uger [se Kliniske Studier ].
Pædiatri
For pædiatriske patienter er den anbefalede samlede daglige dosis af Asacol vægtbaseret (op til maksimalt 2,4 gram/dag) (se tabel 1). Asacol 400 mg tabletter skal tages to gange dagligt med eller uden mad i en varighed på 6 uger [se Kliniske Studier ].
Dosering til vedligeholdelse af remission af colitis ulcerosa hos voksne
For voksne er den anbefalede dosis af Asacol 1,6 gram dagligt, i opdelte doser, med eller uden mad [se Kliniske Studier ].
Vigtige administrationsinstruktioner
Synk Asacol-tabletter hele. Tabletterne må ikke skæres, knækkes eller tygges.
To Asacol 400 mg tabletter har ikke vist sig at være bioækvivalente med én Asacol® HD (mesalamin) 800 mg tablet med forsinket frigivelse og bør ikke anvendes i flæng.
Testning før Asacol 400mg administration
Evaluer nyrefunktionen før påbegyndelse af Asacol [se ADVARSLER OG FORHOLDSREGLER ].
HVORDAN LEVERET
Doseringsformer og styrker
Asacol (mesalamin) tabletter med forsinket frigivelse: 400 mg (rød-brun, kapselformet og præget med "0752 DR" i sort).
Opbevaring og håndtering
Asacol (mesalamin) tabletter med forsinket frigivelse fås som rødbrune, kapselformede tabletter indeholdende 400 mg mesalamin og præget med "0752 DR" i sort.
NDC 0430-0752-27 Flaske med 180 tabletter
Opbevares ved 20° til 25° C (68° til 77° F); udflugter tilladt 15° til 30° C (59° til 86° F) [Se USP kontrolleret rumtemperatur ].
Fremstillet af: Warner Chilcott Deutschland GmbH D-64331 Weiterstadt Tyskland. Markedsført af: Warner Chilcott (US), LLC Rockaway, NJ 07866. Revideret: Okt 2013
BIVIRKNINGER
De mest alvorlige bivirkninger set i Asacol kliniske forsøg eller med andre produkter, der indeholder mesalamin eller metaboliseres til mesalamin er:
- Nedsat nyrefunktion, herunder nyresvigt [se ADVARSLER OG FORHOLDSREGLER ]
- Akut intolerancesyndrom [se ADVARSLER OG FORHOLDSREGLER ]
- Overfølsomhedsreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Leversvigt [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
alt er Asacol 400 mg tabletter blevet evalueret hos 2.690 patienter med colitis ulcerosa i kontrollerede og åbne forsøg. Bivirkninger, der præsenteres i de følgende afsnit, kan forekomme uanset behandlingens længde, og lignende reaktioner er blevet rapporteret i kort- og langtidsstudier og efter markedsføring.
Kliniske undersøgelser, der understøtter brugen af Asacol 400 mg til behandling af mild til moderat aktiv colitis ulcerosa, omfattede to 6-ugers, placebokontrollerede, randomiserede, dobbeltblinde undersøgelser hos voksne med mild til moderat aktiv colitis ulcerosa (undersøgelse 1 og 2) og en 6-ugers, randomiseret, dobbeltblind undersøgelse af 2 dosisniveauer hos børn med mild til moderat aktiv colitis ulcerosa. Kliniske undersøgelser, der understøtter brugen af Asacol 400 mg tabletter til opretholdelse af remission af colitis ulcerosa, omfattede et 6-måneders, randomiseret, dobbeltblindt, placebokontrolleret, multicenter studie og fire aktivt kontrollerede vedligeholdelsesforsøg, der sammenlignede Asacol 400 mg tabletter med sulfasalazin. . Asacol 400mg er blevet evalueret hos 427 voksne og 82 børn med colitis ulcerosa i disse kontrollerede undersøgelser.
Behandling af let til moderat aktiv colitis ulcerosa hos voksne
to 6-ugers placebokontrollerede kliniske undersøgelser (studie 1 og 2) med 245 patienter, hvoraf 155 blev randomiseret til Asacol [se Kliniske Studier ], 3,2 procent af de Asacol-behandlede patienter afbrød behandlingen på grund af bivirkninger sammenlignet med 2,2 procent af de placebo-behandlede patienter. Gennemsnitsalderen for patienterne i undersøgelse 1 var 42 år, og 48 procent af patienterne var mænd. Gennemsnitsalderen for patienterne i undersøgelse 2 var 42 år, og 59 procent af patienterne var mænd. Bivirkninger, der førte til abstinenser fra Asacol inkluderet (hver hos én patient): diarré og colitis opblussen; svimmelhed, kvalme, ledsmerter og hovedpine; udslæt, sløvhed og forstoppelse; mundtørhed, utilpashed, ubehag i lænden, mild desorientering, mild fordøjelsesbesvær og kramper; hovedpine, kvalme, ømhed, opkastning, muskelkramper, tilstoppet hoved, tilstoppede ører og feber.
Bivirkninger hos patienter behandlet med Asacol, der forekommer med en hyppighed på mindst 2 procent og med en frekvens, der er større end placebo i 6-ugers, dobbeltblindede, placebokontrollerede forsøg (undersøgelse 1 og 2) er anført i tabel 2 nedenfor.
Behandling af let til moderat aktiv colitis ulcerosa hos pædiatriske patienter 5 til 17 år gamle
En randomiseret, dobbeltblind, 6-ugers undersøgelse af 2 dosisniveauer af Asacol (undersøgelse 3) blev udført hos 82 pædiatriske patienter i alderen 5 til 17 år med mild til moderat aktiv colitis ulcerosa. Alle patienter blev opdelt efter kropsvægtkategori (17 til mindre end 33 kg, 33 til under 54 kg og 54 til 90 kg) og tilfældigt tildelt til at modtage en lav dosis (1,2, 2,0 og 2,4 g/dag for de respektive kropsvægtskategori) eller en høj dosis (2,0, 3,6 og 4,8 g/dag).
Den høje dosis er ikke en godkendt dosis, fordi den ikke viste sig at være mere effektiv end den godkendte dosis [se DOSERING OG ADMINISTRATION og Kliniske Studier ].
Varigheden af eksponering for mesalamin blandt de 82 patienter i undersøgelsen varierede fra 12 til 50 dage (gennemsnit på 40 dage i hver dosisgruppe). Størstedelen (88 procent) af patienterne i hver gruppe blev behandlet i mere end 5 uger. Tabel 3 giver en oversigt over de specifikke rapporterede bivirkninger (AR'er).
Tolv procent af patienterne i lavdosisgruppen og 5 procent af patienterne i højdosisgruppen havde alvorlige bivirkninger (AR). Colitis ulcerosa blev rapporteret som en alvorlig AR hos et individ i hver gruppe. Andre alvorlige AR'er bestod af bihulebetændelse, mavesmerter, nedsat kropsmasseindeks, adenovirusinfektion, blodig diarré, skleroserende kolangitis og pancreatitis hos et individ hver i lavdosisgruppen og anæmi og synkope hos et individ i hver i højdosisgruppen.
Syv patienter blev trukket tilbage fra undersøgelsen på grund af ARs: 5 (12 procent) i lavdosisgruppen (colitis ulcerosa, adenovirusinfektion, skleroserende cholangitis, pancreatitis) og 2 (5 procent) i højdosisgruppen (øget amylase og øget lipase). smerter i øvre mave).
Generelt svarede arten og sværhedsgraden af reaktioner i den pædiatriske population til dem, der blev rapporteret i voksne populationer af patienter med colitis ulcerosa.
Vedligeholdelse af remission af colitis ulcerosa hos voksne
I et 6-måneders placebo-kontrolleret vedligeholdelsesforsøg, der involverede 264 patienter (studie 4), hvoraf 177 blev randomiseret til Asacol, afbrød seks (3,4 procent) af patienterne, der brugte Asacol, behandlingen på grund af bivirkninger, sammenlignet med fire (4,6 procent) af patienter, der bruger placebo [se Kliniske Studier ]. Gennemsnitsalderen for patienterne i undersøgelse 4 var 42 år, og 55 procent af patienterne var mænd. Bivirkninger, der førte til undersøgelsesabstinenser hos patienter, der brugte Asacol inkluderet (hver hos én patient): angst; hovedpine; kløe; nedsat libido; rheumatoid arthritis; og stomatitis og asteni.
Ud over de reaktioner, der er anført i tabel 2, forekom følgende bivirkninger hos patienter, der brugte Asacol med en frekvens på 2 procent eller mere i undersøgelse 4: abdominal forstørrelse, gastroenteritis, gastrointestinal blødning, infektion, ledlidelse, migræne, nervøsitet, paræstesi, rektal lidelse, rektal blødning, abnormiteter i afføringen, tenesmus, vandladningsfrekvens, vasodilatation og synsabnormiteter.
Hos 3342 patienter i ukontrollerede kliniske undersøgelser forekom følgende bivirkninger med en frekvens på 5 procent eller mere og så ud til at stige i frekvens med stigende dosis: asteni, feber, influenzasyndrom, smerter, mavesmerter, rygsmerter, flatulens, gastrointestinal blødning artralgi og rhinitis.
Postmarketing oplevelse
Ud over de bivirkninger, der er rapporteret ovenfor i kliniske forsøg med Asacol, er de bivirkninger, der er anført nedenfor, blevet identificeret under post-godkendelse brug af Asacol 400mg og andre mesalaminholdige produkter. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Kroppen som helhed: Nakkesmerter, ansigtsødem, ødem, lupuslignende syndrom, stoffeber.
Kardiovaskulær: Pericarditis, myocarditis [se ADVARSLER OG FORHOLDSREGLER ].
Gastrointestinale: Anoreksi, pancreatitis, gastritis, øget appetit, kolecystitis, mundtørhed, mundsår, perforeret mavesår blodig diarré.
Hæmatologisk: Agranulocytose aplastisk anæmi, trombocytopeni, eosinofili, leukopeni, anæmi, lymfadenopati.
Muskuloskeletale: Gigt.
Nervøs: Depression, somnolens, følelsesmæssig labilitet, hyperæstesi, vertigo, forvirring, tremor, perifer neuropati, tværgående myelitis, Guillain-Barré syndrom.
Nyre: Nyresvigt, interstitiel nefritis, minimal change nefropati [se ADVARSLER OG FORHOLDSREGLER ].
Åndedræt/lunge: Eosinofil lungebetændelse, interstitiel pneumonitis, astmaforværring, pleuritis.
Hud: Alopeci, psoriasis, pyoderma gangrenosus, tør hud, erythema nodosum, nældefeber.
Særlige sanser: Øjensmerter, smagsforstyrrelser, sløret syn, tinnitus.
Urogenital: Dysuri, urintrang, hæmaturi, epididymitis, menorragi, reversibel oligospermi.
Laboratorieabnormiteter: Forhøjet AST (SGOT) eller ALT (SGPT), forhøjet alkalisk fosfatase, forhøjet GGT, forhøjet LDH, forhøjet bilirubin, forhøjet serumkreatinin og BUN.

DRUGSINTERAKTIONER
Der er ikke udført formelle lægemiddelinteraktionsstudier med Asacol 400mg sammen med andre lægemidler. Imidlertid er følgende interaktioner mellem mesalaminholdige produkter og andre lægemidler blevet rapporteret.
Nefrotoksiske midler, herunder ikke-steroide antiinflammatoriske lægemidler
Samtidig brug af mesalamin og kendte nefrotoksiske midler, herunder ikke-steroide antiinflammatoriske lægemidler (NSAID'er), kan øge risikoen for nyrereaktioner [se ADVARSLER OG FORHOLDSREGLER ].
Azathioprin eller 6-mercaptopurin
Samtidig brug af mesalamin og azathioprin eller 6-mercaptopurin kan øge risikoen for blodsygdomme.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Nedsat nyrefunktion
Nedsat nyrefunktion, herunder minimal forandringsnefropati, akut og kronisk interstitiel nefritis og nyresvigt, er blevet rapporteret hos patienter, der tager produkter såsom Asacol 400 mg, der indeholder mesalamin eller omdannes til mesalamin.
Det anbefales, at patienter får en evaluering af nyrefunktionen før påbegyndelse af Asacol 400 mg og periodisk under behandling.
Udskrivende læger bør omhyggeligt vurdere risici og fordele ved brug af Asacol til patienter med kendt nyreinsufficiens eller anamnese med nyresygdom [se DRUGSINTERAKTIONER og Ikke-klinisk toksikologi ].
Mesalamin-induceret akut intolerancesyndrom
Mesalamin er blevet forbundet med et akut intolerancesyndrom, der kan være vanskeligt at skelne fra en forværring af colitis ulcerosa. Selvom den nøjagtige hyppighed af forekomsten ikke er blevet bestemt, er den forekommet i 3 procent af kontrollerede kliniske forsøg med mesalamin eller sulfasalazin. Symptomerne omfatter kramper, mavesmerter, blodig diarré og nogle gange feber, hovedpine og udslæt. Observer patienterne nøje for forværring af disse symptomer under behandling. Hvis der er mistanke om akut intolerancesyndrom, skal behandlingen med Asacol straks afbrydes.
Overfølsomhedsreaktioner
Nogle patienter, som har oplevet en overfølsomhedsreaktion over for sulfasalazin, kan have en lignende reaktion som Asacol 400 mg eller andre forbindelser, der indeholder eller omdannes til mesalamin.
Mesalamin-inducerede hjerteoverfølsomhedsreaktioner (myocarditis og pericarditis) er blevet rapporteret med Asacol og andre mesalaminmedicin. Der bør udvises forsigtighed ved ordinering af denne medicin til patienter med tilstande, der disponerer dem for udvikling af myocarditis eller pericarditis.
Leversvigt
Der har været rapporter om leversvigt hos patienter med allerede eksisterende leversygdom, som har fået mesalamin. Der bør udvises forsigtighed ved administration af Asacol til patienter med leversygdom.
Langvarig gastrisk retention hos patienter med øvre gastrointestinal obstruktion
Organisk eller funktionel obstruktion i den øvre mave-tarmkanal kan forårsage forlænget gastrisk retention af Asacol 400mg, hvilket ville forsinke frigivelsen af mesalamin i tyktarmen.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Mesalamin var ikke kræftfremkaldende ved diætdoser på op til 480 mg/kg/dag hos rotter og 2000 mg/kg/dag hos mus, hvilket er omkring 2,9 og 6,1 gange den maksimalt anbefalede vedligeholdelsesdosis af Asacol 400 mg på 1,6 g/dag eller 26,7 mg/kg/dag, baseret på henholdsvis 60 kg kropsvægt, baseret på kropsoverfladeareal.
Mutagenese
Mesalamin var negativ i Ames-analysen for mutagenese, negativ for induktion af søsterkromatidudvekslinger (SCE) og kromosomafvigelser i ovarieceller fra kinesisk hamster in vitro og negativ for induktion af mikrokerner (MN) i polykromatiske erytrocytter af museknoglemarv.
Forringelse af fertilitet
Mesalamin, ved orale doser op til 480 mg/kg/dag (ca. 1,9 gange den anbefalede humane behandlingsdosis på basis af kropsoverfladeareal), viste sig ikke at have nogen effekt på fertilitet eller reproduktionsevne hos han- og hunrotter.
Brug i specifikke populationer
Graviditet
Graviditetskategori C
Risikooversigt
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af Asacol 400mg brug hos gravide kvinder. Begrænsede publicerede humane data om mesalamin viser ingen stigning i den samlede frekvens af medfødte misdannelser. Nogle data viser en øget frekvens af for tidlig fødsel, dødfødsel og lav fødselsvægt; dog er disse ugunstige graviditetsresultater også forbundet med aktiv inflammatorisk tarmsygdom. Desuden har alle graviditeter, uanset lægemiddeleksponering, en baggrundsrate på 2 til 4 procent for større misdannelser og 15 til 20 procent for tab af graviditet. Der blev ikke observeret tegn på fosterskade i reproduktionsundersøgelser hos dyr med mesalamin hos rotter og kaniner ved orale doser ca. 1,9 gange (rotte) og 3,9 gange (kanin) den anbefalede humane dosis. Dibutylphthalat (DBP) er imidlertid en inaktiv ingrediens i Asacols enteriske belægning, og i dyreforsøg med rotter i doser, der er større end 190 gange den humane dosis baseret på kropsoverfladeareal, var moderens DBP forbundet med eksterne misdannelser og skeletmisdannelser og negative effekter på det mandlige reproduktive system. Asacol 400 mg bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Menneskelige data
Mesalamin krydser moderkagen. I prospektive og retrospektive undersøgelser af over 600 kvinder, der blev eksponeret for mesalamin under graviditet, var den observerede frekvens af medfødte misdannelser ikke øget over baggrundshyppigheden i den generelle befolkning. Nogle data viser en øget frekvens af for tidlig fødsel, dødfødsel og lav fødselsvægt, men det er uklart, om dette skyldtes underliggende modersygdom, lægemiddeleksponering eller begge dele, da aktiv inflammatorisk tarmsygdom også er forbundet med uønskede graviditetsresultater.
Dyredata
Reproduktionsundersøgelser med mesalamin blev udført under organogenese hos rotter og kaniner ved orale doser op til 480 mg/kg/dag. Der var ingen tegn på nedsat fertilitet eller skade på fosteret. Disse mesalamindoser var ca. 1,9 gange (rotte) og 3,9 gange (kanin) den anbefalede humane dosis baseret på kropsoverfladeareal.
Dibutylphthalat (DBP) er en inaktiv ingrediens i Asacols enteriske coating. Menneskets daglige indtag af DBP fra den maksimalt anbefalede dosis af Asacol-tabletter er omkring 21 mg. Publicerede rapporter om rotter viser, at hanrotteafkom udsat in utero for DBP (større end eller lig med 100 mg/kg/dag, ca. 39 gange den humane dosis baseret på kropsoverfladeareal), udviser reproduktionssystemafvigelser, der er kompatible med forstyrrelse af androgen afhængighed udvikling. Den kliniske betydning af dette fund hos rotter er ukendt. Ved højere doser (større end eller lig med 500 mg/kg/dag, ca. 194 gange den humane dosis baseret på kropsoverfladen), yderligere effekter, herunder kryptorkisme, hypospadi, atrofi eller agenesis af kønsorganer, testikelskade, reduceret dagligt sædproduktion, permanent tilbageholdelse af brystvorter og nedsat anogenital afstand er noteret. Kvindelige afkom er upåvirkede. Høje doser af DBP administreret til gravide rotter var forbundet med øget forekomst af udviklingsmæssige abnormiteter, såsom ganespalte (større end eller lig med 630 mg/kg/dag, ca. 244 gange den humane dosis baseret på kropsoverfladeareal) og skelet abnormiteter (større end eller lig med 750 mg/kg/dag, ca. 290 gange den humane dosis baseret på kropsoverfladeareal) hos afkommet.
Ammende mødre
Mesalamin og dets N-acetylmetabolit er til stede i modermælk. I offentliggjorte laktationsundersøgelser varierede maternelle mesalamindoser fra forskellige orale og rektale formuleringer og produkter fra 500 mg til 3 g dagligt. Koncentrationen af mesalamin i mælk varierede fra ikke-påviselig til 0,11 mg/L. Koncentrationen af N-acetyl-5-aminosalicylsyremetabolitten varierede fra 5 til 18,1 mg/L. Baseret på disse koncentrationer er de estimerede daglige doser af spædbørn for et spædbarn, der udelukkende ammes, 0 til 0,017 mg/kg/dag mesalamin og 0,75 til 2,72 mg/kg/dag af N-acetyl-5-aminosalicylsyre.
Dibutylphthalat (DBP), en inaktiv ingrediens i den enteriske coating af Asacol 400 mg tabletter, og dets primære metabolit mono-butylphthalat (MBP) udskilles i modermælk. Den kliniske betydning af dette er ikke fastlagt.
De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for Asacol 400mg og eventuelle negative virkninger på det ammede barn fra lægemidlet eller fra den underliggende moderens tilstand. Udvis forsigtighed, når Asacol 400mg administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerheden og effektiviteten af Asacol 400 mg hos pædiatriske patienter i alderen 5 til 17 år til behandling af mild til moderat aktiv colitis ulcerosa er blevet fastslået over en 6-ugers periode. Brug af Asacol i disse aldersgrupper understøttes af evidens fra tilstrækkelige og velkontrollerede undersøgelser af Asacol 400mg hos voksne og en enkelt undersøgelse hos pædiatriske patienter [se BIVIRKNINGER , KLINISK FARMAKOLOGI og Kliniske Studier ].
Asacol 400mg blev undersøgt i et randomiseret, dobbeltblindt, parallelgruppe, 6-ugers behandlingsstudie af to dosisniveauer af Asacol 400mg hos 82 pædiatriske patienter i alderen 5 til 17 år med mild til moderat aktiv colitis ulcerosa. Alle patienter blev inddelt efter vægtkategori (17 til mindre end 33 kg, 33 til mindre end 54 kg og 54 til 90 kg) og tilfældigt tildelt til at modtage en lav dosis (1,2, 2,0 og 2,4 g/dag for den respektive vægt kategori) eller en høj dosis (2,0, 3,6 og 4,8 g/dag). Baseline- og screeningsbesøg blev efterfulgt af en behandlingsperiode på 6 uger [se DOSERING OG ADMINISTRATION ]. Den høje dosis var ikke mere effektiv end den lave dosis og er ikke en godkendt dosis [se Kliniske Studier ].
Sikkerheden og effektiviteten af Asacol hos pædiatriske patienter under 5 år er ikke blevet fastlagt. Sikkerheden og effektiviteten af Asacol til opretholdelse af remission af colitis ulcerosa hos pædiatriske patienter er ikke blevet fastlagt.
Geriatrisk brug
Kliniske undersøgelser af Asacol omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Generelt bør den højere hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling hos ældre patienter overvejes, når Asacol ordineres. Rapporter fra ukontrollerede kliniske undersøgelser og postmarketing rapporteringssystemer tyder på en højere forekomst af bloddyskrasier, dvs. agranulocytose, neutropeni, pancytopeni, hos personer, der får Asacol, og som er 65 år eller ældre. Der bør udvises forsigtighed med nøje at overvåge blodcelletal under behandling med Asacol.
Nedsat nyrefunktion
Mesalamin er kendt for at blive udskilt væsentligt af nyrerne, og risikoen for toksiske reaktioner på dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, skal der udvises forsigtighed, når denne lægemiddelbehandling ordineres. Det anbefales, at alle patienter får en evaluering af nyrefunktionen før påbegyndelse af Asacol-behandling og periodisk under Asacol-behandling [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER ].
OVERDOSIS
Der er ingen specifik modgift mod overdosering af mesalamin, og behandling af formodet akut alvorlig toksicitet med Asacol bør være symptomatisk og understøttende. Dette kan omfatte forebyggelse af yderligere absorption af mave-tarmkanalen, korrektion af væskeelektrolyt-ubalance og vedligeholdelse af tilstrækkelig nyrefunktion. Asacol 400mg er et pH-afhængigt produkt med forsinket frigivelse, og denne faktor bør tages i betragtning ved behandling af en formodet overdosis.
KONTRAINDIKATIONER
Asacol er kontraindiceret hos patienter med kendt overfølsomhed over for salicylater eller aminosalicylater eller over for et eller flere af indholdsstofferne i Asacol [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER , og BESKRIVELSE ].
ASACOL (mesalamin) tabletter med forsinket frigivelse, til oral brug
KLINISK FARMAKOLOGI
Handlingsmekanisme
Mesalamins virkningsmekanisme er ukendt, men ser ud til at være topisk snarere end systemisk. Slimhindeproduktionen af arachidonsyremetabolitter, både gennem cyclooxygenase-vejene, det vil sige prostanoider, og gennem lipoxygenase-vejene, det vil sige leukotriener og hydroxyeicosatetraensyrer, øges hos patienter med kronisk colitis ulcerosa, og det er muligt, at mesalamin ved at mindske inflammation blokerer cyclooxygenase og hæmmer prostaglandinproduktionen i tyktarmen.
Farmakokinetik
Absorption
Cirka 28 procent af mesalamin i Asacol 400mg tabletter absorberes efter oral indtagelse. Absorption af mesalamin er ens hos fastende og fodrede personer. T max for mesalamin og dets metabolit er normalt forsinket, hvilket afspejler den forsinkede frigivelse, og varierer fra 4 til 16 timer.
Metabolisme
Den absorberede mesalamin acetyleres hurtigt i tarmslimhinden og af leveren til N-acetyl-5aminosalicylsyre.
Udskillelse
Absorberet mesalamin udskilles hovedsageligt af nyrerne som N-acetyl-5-aminosalicylsyre. Uabsorberet mesalamin udskilles i fæces.
Efter intravenøs administration rapporteres eliminationshalveringstiden for mesalamin at være ca. 40 minutter. Efter oral dosering er de terminale t½-værdier for mesalamin og N-acetyl-5-aminosalicylsyre normalt omkring 12 timer, men varierer fra 2 til 15 timer. Der er en stor inter-individ og intra-individ variabilitet i plasmakoncentrationerne af mesalamin og N-acetyl-5aminosalicylsyre og i deres eliminationshalveringstider efter administration af Asacol.
Specifikke populationer
Pædiatriske patienter
I et PK-studie med dosisintervaller, der evaluerede 30, 60 og 90 mg/kg/dag doser af Asacol 400 mg administreret to gange dagligt i fire uger, varierede de gennemsnitlige Cavg-værdier for mesalamin hos pædiatriske colitis ulcerosapatienter fra ca. 400 ng/ml til 2100 ng /ml baseret på data fra alle dosisniveauer.
et studie med pædiatriske ulcerøs colitis-patienter (undersøgelse 3) var de gennemsnitlige plasmakoncentrationer af mesalamin (baseret på sparsom prøveudtagning) 820 til 988 ng/ml ved det lave dosisniveau (det vil sige 1,2, 2,0 eller 2,4 g/dag baseret på kropsvægtlag på henholdsvis 17 til mere end 33 kg, 33 til mindre end 54 kg og 54 til mindre end 90 kg).
Dyretoksikologi og/eller farmakologi
I dyreforsøg (rotter, mus, hunde) var nyren det vigtigste organ for toksicitet. (I det følgende er sammenligninger af dyredosering med anbefalet human dosering baseret på kropsoverfladeareal og en dosis på 2,4 g/dag for en person på 60 kg.)
Mesalamin forårsager nyrepapillær nekrose hos rotter ved enkeltdoser på ca. 750 mg/kg til 1000 mg/kg (ca. 3 til 4 gange den anbefalede humane dosis baseret på kropsoverfladeareal). Doser på 170 og 360 mg/kg/dag (ca. 0,7 og 1,5 gange den anbefalede humane dosis baseret på kropsoverfladeareal) givet til rotter i seks måneder gav papillær nekrose, papillært ødem, tubulær degeneration, tubulær mineralisering og urotelial hyperplasi.
Hos mus frembragte orale doser på 4000 mg/kg/dag mesalamin (ca. 8 gange den anbefalede humane dosis baseret på kropsoverfladeareal) i tre måneder tubulær nefrose, multifokal/diffus tubulo-interstitiel inflammation og multifokal/diffus papillær nekrose.
Hos hunde resulterede enkeltdoser på 6000 mg (ca. 8 gange den anbefalede humane dosis baseret på kropsoverfladeareal) af mesalamintabletter med forsinket frigivelse i nyrepapillær nekrose, men var ikke dødelig. Nyreforandringer er forekommet hos hunde, som har fået kronisk administration af mesalamin i doser på 80 mg/kg/dag (1,1 gange den anbefalede humane dosis baseret på kropsoverfladeareal).
Kliniske Studier
Behandling af mild til moderat aktiv colitis ulcerosa
Voksne
To placebokontrollerede undersøgelser (undersøgelse 1 og 2) har vist effektiviteten af Asacol-tabletter hos patienter med let til moderat aktiv colitis ulcerosa.
et randomiseret, dobbeltblindt multicenterforsøg med 158 patienter (undersøgelse 1) blev Asacol-doser på 1,6 g/dag og 2,4 g/dag i 6 uger sammenlignet med placebo. Scoringssystemet til bestemmelse af behandlingseffektivitet omfattede vurdering af afføringsfrekvens, rektal blødning, sigmoidoskopiske fund, patientens funktionelle vurdering og lægens globale vurdering. Ved en dosis på 2,4 g/dag viste 21 ud af 43 (49 procent) patienter, der brugte Asacol-tabletter, en forbedring i sigmoidoskopisk udseende af tarmen sammenlignet med 12 ud af 44 (27 procent) patienter, der brugte placebo (p = 0,048). Derudover viste signifikant flere patienter i gruppen Asacol tabletter 2,4 g/dag forbedring i rektal blødning og afføringsfrekvens. Dosis på 1,6 g/dag gav ikke konsistent bevis for effektivitet.
et andet randomiseret, dobbeltblindt, placebokontrolleret klinisk forsøg af 6 ugers varighed med 87 patienter (undersøgelse 2), resulterede Asacol-tabletter i en dosis på 4,8 g/dag i 6 uger i sigmoidoskopisk forbedring hos 28 af 38 (74 procent) patienter sammenlignet med 10 ud af 38 (26 procent) placebopatienter (p mindre end 0,001). Også flere patienter i gruppen med Asacol 400 mg tabletter 4,8 g/dag end placebogruppen viste forbedring i generelle symptomer.
Dosis på 4,8 g/dag er ikke en godkendt dosis til behandling af mild til moderat aktiv colitis ulcerosa.
Pædiatri
Sikkerheden og effektiviteten af Asacol 400 mg hos pædiatriske patienter i alderen 5 til 17 år til behandling af mild til moderat aktiv colitis ulcerosa understøttes af beviser fra tilstrækkelige og velkontrollerede undersøgelser af Asacol 400 mg hos voksne og en enkelt undersøgelse hos pædiatriske patienter.
En randomiseret, dobbeltblind, 6-ugers undersøgelse af 2 dosisniveauer af Asacol (undersøgelse 3) blev udført hos 82 pædiatriske patienter i alderen 5 til 17 år med mild eller moderat aktiv colitis ulcerosa. Alle patienter blev inddelt efter vægtkategori (17 til mindre end 33 kg, 33 til mindre end 54 kg og 54 til 90 kg) og tilfældigt tildelt til at modtage en lav dosis (1,2, 2,0 og 2,4 g/dag for den respektive vægt kategori) eller en høj dosis (2,0, 3,6 og 4,8 g/dag). Doser blev administreret hver 12. time.
Andelen af patienter, der opnåede succes baseret på Truncated Mayo Score (TM-Mayo) (baseret på afføringsfrekvensen og rektal blødningsunderscore af Mayo Score) og baseret på Pediatric Ulcerative Colitis Activity Index (PUCAI) (som inkluderede vurdering af mavesmerter, rektal blødning, afføringens konsistens og hyppighed, tilstedeværelse af natlig afføring og aktivitetsniveau) blev målt efter 6 ugers behandling. Succes baseret på TM-Mayo blev defineret som enten delvis respons (forbedring fra baseline i afføringsfrekvens eller rektal blødningssubscore uden forværring i den anden) eller komplet respons (både afføringsfrekvens og rektal blødningssubscore er lig med 0). Succes baseret på PUCAI blev defineret som enten delvis respons (PUCAI-reduktion på større end eller lig med 20 point fra baseline til uge 6 med uge 6-score større end eller lig med 10) eller komplet respons (PUCAI mindre end 10 i uge 6).
Der var 41 patienter i lavdosisgruppen og 41 patienter i højdosisgruppen, som fik mindst én dosis Asacol; 36 patienter i hver dosisgruppe gennemførte undersøgelsen. Patienter blev betragtet som behandlingsfejl, hvis de ikke opnåede succes eller droppede ud på grund af bivirkning eller manglende effekt.
I uge 6 opnåede 73,2 procent af patienterne i lavdosisgruppen og 70,0 procent af patienterne i højdosisgruppen succes baseret på TM-Mayo; 34,1 procent af patienterne i lavdosisgruppen og 42,5 procent af patienterne i højdosisgruppen opnåede fuldstændig respons. I uge 6 opnåede 56,1 procent af patienterne i lavdosisgruppen og 55,0 procent af patienterne i højdosisgruppen succes baseret på PUCAI; 46,3 procent af patienterne i lavdosisgruppen og 42,5 procent af patienterne i højdosisgruppen opnåede fuldstændig respons.
Den høje dosis var ikke mere effektiv end den lave dosis og er ikke en godkendt dosis [se DOSERING OG ADMINISTRATION ].
Vedligeholdelse af remission af colitis ulcerosa hos voksne
Et 6-måneders, randomiseret, dobbeltblindt, placebokontrolleret, multicenterstudie (Studie 4) involverede 264 patienter behandlet med Asacol 400 mg tabletter 0,8 g/dag (n = 90), 1,6 g/dag (n = 87) eller placebo (n = 87). I 0,8 g/dag-armen blev patienterne doseret to gange dagligt; i 1,6 g/dag-armen blev patienterne doseret fire gange dagligt. Andelen af patienter behandlet med 0,8 g/dag, som opretholdt endoskopisk remission, var ikke statistisk signifikant sammenlignet med placebo. Andelen af patienter, der brugte Asacol-tabletter 1,6 g/dag, som opretholdt endoskopisk remission af colitis ulcerosa, var hos 61 ud af 87 (70,1 procent) sammenlignet med 42 ud af 87 (48,3 procent) af placebopatienterne (p = 0,005).
En samlet effektivitetsanalyse af 4 vedligeholdelsesforsøg sammenlignede Asacol 400 mg tabletter i doser på 0,8 g/dag til 2,8 g/dag i opdelte doser fra to gange dagligt til fire gange dagligt med sulfasalazin i doser på 2 g/dag til 4 g/dag. Behandlingssucces blev set hos 59 ud af 98 (59 procent) patienter, der brugte Asacol-tabletter og 70 ud af 102 (69 procent) af patienterne, der brugte sulfasalazin, en ikke-signifikant forskel.
PATIENTOPLYSNINGER
- Instruer patienterne i at sluge Asacol-tabletterne hele, og pas på ikke at knække, skære eller tygge tabletterne, da coatingen er en vigtig del af formuleringen med forsinket frigivelse.
- Informer patienterne om, at hvis de skifter fra en tidligere oral mesalaminbehandling til Asacol, skal de afbryde deres tidligere orale mesalaminbehandling og følge doseringsinstruktionerne for Asacol. Informer patienterne om, at de ikke bør erstatte to Asacol 400 mg tabletter med en Asacol 400mg HD 800 mg tablet [se DOSERING OG ADMINISTRATION ].
- Informer patienterne om, at der er rapporteret intakte, delvist intakte og/eller tabletskaller i afføringen. Instruer patienterne i at kontakte deres læge, hvis dette sker gentagne gange.
- Instruer patienterne i at beskytte Asacol 400 mg tabletter mod fugt. Instruer patienterne i at lukke beholderen tæt og efterlade eventuelle tørremiddelposer i flasken sammen med tabletterne.
- Rådgiv kvinder, der er gravide, ammer eller er i den fødedygtige alder, at Asacol 400mg indeholder dibutylphthalat, som var forbundet med misdannelser og negative virkninger på det mandlige reproduktionssystem i dyreforsøg. Dibutylphthalat udskilles i modermælk.
