Furadantin 100mg Nitrofurantoin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Furadantin 100mg, og hvordan bruges det?
Furadantin (nitrofurantoin oral suspension) er et antibiotikum, der bruges til at behandle urinvejsinfektioner. Furadantin er tilgængelig i generisk form.
Hvad er bivirkninger af Furadantin?
Almindelige bivirkninger af Furadantin omfatter:
- kvalme,
- opkastning,
- mistet appetiten,
- dårlig mave,
- diarré,
- hovedpine,
- svimmelhed,
- døsighed,
- rustfarvet eller brunlig urin, el
- vaginal kløe eller udflåd.
Fortæl det til din læge, hvis du har sjældne, men meget alvorlige bivirkninger af Furadantin, herunder:
- øjensmerter,
- synsforandringer,
- mentale/stemningsændringer,
- vedvarende eller svær hovedpine,
- nye tegn på infektion (f.eks. feber, vedvarende ondt i halsen), eller
- let blå mærker eller blødning.
BESKRIVELSE
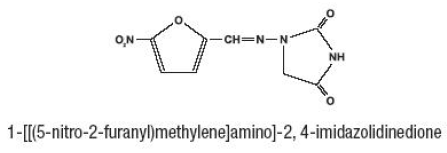
Furadantin (nitrofurantoin), et syntetisk kemikalie, er en stabil, gul, krystallinsk forbindelse. Furadantin er et antibakterielt middel mod specifikke urinvejsinfektioner. Furadantin fås i 25 mg/5 ml flydende suspension til oral administration.
inaktive ingredienser
Furadantin Oral Suspension indeholder carboxymethylcellulosenatrium, citronsyre, smagsstoffer, glycerin, magnesiumaluminiumsilicat, methylparaben, propylparaben, renset vand, natriumcitrat og sorbitol.
INDIKATIONER
Furadantin er specifikt indiceret til behandling af urinvejsinfektioner på grund af modtagelige stammer af Escherichia coli, enterokokker, Staphylococcus aureus og visse modtagelige stammer af Klebsiella- og Enterobacter-arter.
Nitrofurantoin er ikke indiceret til behandling af pyelonefritis eller perinefrie bylder.
Nitrofurantoiner mangler den bredere vævsfordeling af andre terapeutiske midler, der er godkendt til urinvejsinfektioner. Derfor er mange patienter, der behandles med Furadantin er disponerede for persistens eller genkomst af bakteriuri. Urinprøver til dyrkning og følsomhedstest bør tages før og efter afslutning af behandlingen. Hvis persistens eller gensyn af bakteriuri opstår efter behandling med Furadantin , bør andre terapeutiske midler med bredere vævsfordeling vælges. Ved overvejelse af brugen af Furadantin , bør lavere udryddelsesrater afvejes mod det øgede potentiale for systemisk toksicitet og for udvikling af antimikrobiel resistens, når midler med bredere vævsfordeling anvendes.
DOSERING OG ADMINISTRATION
Furadantin bør gives sammen med mad for at forbedre lægemiddelabsorptionen og hos nogle patienter tolerancen.
Voksne
50-100 mg fire gange dagligt - det lavere dosisniveau anbefales til ukomplicerede urinvejsinfektioner.
Pædiatriske patienter
5-7 mg/kg legemsvægt pr. 24 timer, givet i fire opdelte doser (kontraindiceret under en måneds alder).
Følgende tabel er baseret på en gennemsnitsvægt i hvert område, der modtager 5 til 6 mg/kg legemsvægt pr. 24 timer, givet i fire opdelte doser. Det kan bruges til at beregne en gennemsnitlig dosis af Furadantin Oral suspension (25 mg/5 ml) til pædiatriske patienter.
Behandlingen bør fortsættes i en uge eller i mindst 3 dage efter, at urinen er steril. Fortsat infektion indikerer behovet for revurdering.
Til langvarig suppressiv behandling hos voksne kan en reduktion af dosis til 50-100 mg ved sengetid være tilstrækkelig. Til langvarig suppressiv behandling hos pædiatriske patienter kan doser så lave som 1 mg/kg pr. 24 timer, givet i en enkelt dosis eller i to opdelte doser, være passende. SE ADVARSLER AFSNIT VEDRØRENDE RISICI FORBUNDET MED LANGSIGT BEHANDLING .
HVORDAN LEVERET
Furadantin Oral suspension er tilgængelig i:
NDC 70199-006-32 PET-ravfarvet flaske på 230 ml
Undgå udsættelse for stærkt lys, som kan gøre lægemidlet mørkere. Det er stabilt, når det opbevares mellem 20°-25°C (68°-77°F); udflugter tilladt til 15°-30°C (59°-86°F) [Se USP kontrolleret rumtemperatur ]. Beskyt mod frysning. Ryst kraftigt. Dispenser i tæt, lysbestandig, plastik (PET) eller glasbeholder.
Brug inden for 30 dage.
Holde utilgængeligt for børn.
Fremstillet for: Casper Pharma LLC, East Brunswick NJ 08816. Revideret: Dec 2020
BIVIRKNINGER
Åndedræt
KRONISKE, SUBAKUTE ELLER AKUTTE LULMONÆRE HYPERSENSITIVITETSREAKTIONER KAN FOREKOMME.
KRONISKE LUNNEREAKTIONER KAN GENERELT OPKOMME HOS PATIENTER, DER HAR MODTAGET KONTINUERLIG BEHANDLING I 6 MÅNEDER ELLER LÆNGER. ULAGSMÆSSIGHED, DYSPNØ VED ANSØGELSE, HOSTE OG ÆNDRET LUNGEFUNKTION ER ALMINDELIGE MANIFESTATIONER, SOM KAN OPSTÅ SMIDIG. RADIOLOGISKE OG HISTOLOGISKE FUND AF DIFFUSE INTERSTITIEL PNEUMONITIS ELLER FIBROSIS, ELLER BEGGE, ER OGSÅ ALMINDELIGE MANIFESTATIONER AF DEN KRONISKE LUNNEREAKTION. FEBER ER SJÆLDEN PROMINENT.
SVARIGHEDEN AF KRONISKE LUNNEREAKTIONER OG DERES OPSLØSNINGSGRADER SYNES AT VÆRE RELATERET TIL VARIGHED AF TERAPIEN, EFTER DE FØRSTE KLINISKE TEGN VISES. LUNGEFUNKTIONEN KAN VÆRE PERMANENT SÆNGET, SELV EFTER OPHØR AF TERAPIEN. RISIKOEN ER STØRRE, NÅR KRONISKE LUNNEREAKTIONER IKKE ERKENDENS TIDLIGT.
Ved subakutte lungereaktioner forekommer feber og eosinofili sjældnere end i den akutte form. Efter ophør af terapien kan genopretning tage flere måneder. Hvis symptomerne ikke anerkendes som værende lægemiddelrelaterede, og nitrofurantoinbehandlingen ikke stoppes, kan symptomerne blive mere alvorlige.
Akutte lungereaktioner er almindeligvis manifesteret ved feber, kulderystelser, hoste, brystsmerter, dyspnø, pulmonal infiltration med konsolidering af pleural effusion på røntgen og eosinofili.
Akutte reaktioner opstår normalt inden for den første uge af behandlingen og er reversible ved ophør af behandlingen. Opløsning er ofte dramatisk. (se ADVARSLER )
Ændringer i EKG (f.eks. uspecifikke ST/T-bølgeændringer, bundtgrenblok) er blevet rapporteret i forbindelse med pulmonale reaktioner.
Cyanose er blevet rapporteret sjældent.
Hepatisk
Leverreaktioner, herunder hepatitis, kolestatisk gulsot, kronisk aktiv hepatitis og hepatisk neurose, forekommer sjældent. (se ADVARSLER )
Neurologisk
Perifer neuropati, som kan blive alvorlig eller irreversibel, er opstået. Der er rapporteret om dødsfald. Tilstande såsom nedsat nyrefunktion (kreatininclearance under 60 ml pr. minut eller klinisk signifikant forhøjet serumkreatinin), anæmi, diabetes mellitus, elektrolytforstyrrelser, vitamin B-mangel og invaliderende sygdomme kan øge muligheden for perifer neuropati (se ADVARSLER )
Asteni, vertigo, nystagmus, svimmelhed, hovedpine og døsighed er også blevet rapporteret ved brug af nitrofurantoin.
Benign intrakraniel hypertension (pseudotumor cerebri), forvirring, depression, optisk neuritis og psykotiske reaktioner er sjældent blevet rapporteret. Udbulende fontaneller, som tegn på benign intrakraniel hypertension hos spædbørn, er sjældent blevet rapporteret.
Dermatologisk
Eksfoliativ dermatitis og erythema multiforme (inklusive Stevens-Johnsons syndrom) er sjældent blevet rapporteret. Forbigående alopeci er også blevet rapporteret.
Allergisk
Et lupuslignende syndrom forbundet med pulmonale reaktioner på nitrofurantoin er blevet rapporteret. Også angioødem; makulopapulære, erytematøse eller eksematiske udbrud; kløe; nældefeber; anafylaksi; artralgi; myalgi; stof feber; og vaskulitis (nogle gange forbundet med pulmonale reaktioner) er blevet rapporteret. Overfølsomhedsreaktioner er de hyppigste spontant rapporterede bivirkninger i verdensomspændende erfaring efter markedsføring med nitrofurantoinformuleringer.
Gastrointestinale
Kvalme, opkastning og anoreksi forekommer oftest. Mavesmerter og diarré er mindre almindelige gastrointestinale reaktioner. Disse dosisrelaterede reaktioner kan minimeres ved at reducere dosis. Sialadenitis og pancreatitis er blevet rapporteret. Der har været sporadiske rapporter om pseudomembranøs colitis ved brug af nitrofurantoin. Begyndelsen af pseudomembranøs colitis-symptomer kan forekomme under eller efter antimikrobiel behandling. (se ADVARSLER )
Hæmatologisk
Cyanose sekundært til methæmoglobinæmi er sjældent blevet rapporteret.
Diverse
Som med andre antimikrobielle midler kan superinfektioner forårsaget af resistente organismer, f.eks. Pseudomonas-arter eller Candida-arter, forekomme. Der er sporadiske rapporter om Clostridium difficile-superinfektioner eller pseudomembranøs colitis ved brug af nitrofurantoin.
Uønskede hændelser i laboratoriet
Følgende laboratoriebivirkninger er blevet rapporteret ved brug af nitrofurantoin; øget AST (SGOT), øget ALAT (SGPT), nedsat hæmoglobin, øget serumfosfor, eosinofili, glucose-6-phosphat-dehydrogenase-mangelanæmi (se ADVARSLER ), agranulocytose, leukopeni, granulocytopeni, hæmolytisk anæmi, trombocytopeni, megaloblastisk anæmi. I de fleste tilfælde forsvandt disse hæmatologiske abnormiteter efter ophør af behandlingen. Aplastisk anæmi er sjældent blevet rapporteret.
Kontakt Casper Pharma LLC for at rapportere FORSINKTE BIVIRKNINGER. på 1-844-5-CASPER (1-844-522-7737) eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
DRUGSINTERAKTIONER
Antacida indeholdende magnesiumtrisilicat, når det administreres samtidig med nitrofurantoin, reducerer både hastigheden og omfanget af absorption. Mekanismen for denne interaktion er sandsynligvis adsorption af nitrofurantoin på overfladen af magnesiumtrisilicat.
Uricosuriske lægemidler, såsom probenecid og sulfinpyrazon, kan hæmme renal tubulær sekretion af nitrofurantoin. Den resulterende stigning i nitrofurantoinserumniveauer kan øge toksiciteten, og de nedsatte urinniveauer kan mindske dets effektivitet som antibakterielt middel i urinvejene.
Interaktioner med lægemiddel/laboratorietest
Som følge af tilstedeværelsen af nitrofurantoin kan der forekomme en falsk positiv reaktion for glukose i urinen. Dette er blevet observeret med Benedict's og Fehlings opløsninger, men ikke med den enzymatiske glukosetest.
ADVARSLER
Lungereaktioner
AKUTTE, SUBAKUTE ELLER KRONISKE LUNNEREAKTIONER ER BLEVET OBSERVERET HOS PATIENTER BEHANDLET MED NITROFURANTOIN. HVIS DISSE REAKTIONER OPSTÅR, BØR FURADANTIN 100mg AFBINDES OG DER TREFFES passende forholdsregler. RAPPORTER HAR citeret LUNGEREAKTIONER SOM EN MEDIDRAGENDE DØDSÅRSAG.
KRONISKE LUNNEREAKTIONER (DIFFUS INTERSTITIEL PNEUMONIT ELLER LUNGEFIBROSIS ELLER BEGGE) KAN UDVIKLE SMIDIG. DISSE REAKTIONER OPtræder sjældent og generelt hos patienter, der modtager terapi i seks måneder eller længere. TÆT OVERVÅGNING AF LUNGE TILSTANDEN HOS PATIENTER, DER MODTAGES LANGTIDSBEHANDLING, ER GARANTERET, OG KRÆVER, AT FORDELENE VED BEHANDLING AFVEJES MOD POTENTIELLE RISICI. (se RESPIRATORISKE REAKTIONER.)
Hepatotoksicitet
Leverreaktioner, herunder hepatitis, kolestatisk gulsot, kronisk aktiv hepatitis og hepatisk nekrose, forekommer sjældent. Der er rapporteret om dødsfald. Begyndelsen af kronisk aktiv hepatitis kan være snigende, og patienter bør overvåges med jævne mellemrum for ændringer i biokemiske tests, der tyder på leverskade. Hvis der opstår hepatitis, skal lægemidlet seponeres med det samme, og passende foranstaltninger skal træffes.
Neuropati
Perifer neuropati, som kan blive alvorlig eller irreversibel, er opstået. Der er rapporteret om dødsfald. Tilstande såsom nedsat nyrefunktion (kreatininclearance under 60 ml pr. minut eller klinisk signifikant forhøjet serumkreatinin), anæmi, diabetes mellitus, elektrolyt-ubalance, vitamin B-mangel og invaliderende sygdom kan øge forekomsten af perifer neuropati. Patienter, der får langtidsbehandling, bør overvåges periodisk for ændringer i nyrefunktionen.
Optisk neuritis er sjældent rapporteret efter markedsføring af nitrofurantoinformuleringer.
Hæmolytisk anæmi
Tilfælde af hæmolytisk anæmi af typen primaquin-følsomhed er blevet induceret af nitrofurantoin. Hæmolyse ser ud til at være forbundet med en glucose-6-phosphat dehydrogenase mangel i de røde blodlegemer hos de berørte patienter. Denne mangel findes hos 10 procent af sorte og en lille procentdel af etniske grupper af middelhavs- og nærøstlig oprindelse. Hæmolyse er en indikation for seponering Furadantin hæmolysen ophører, når lægemidlet trækkes tilbage.
Clostridium Difficile-associeret diarré
Clostridium difficile associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inkl. Furadantin Oral suspension, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, der får diarré efter brug af antibiotika. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibiotikabrug, der ikke er rettet mod C. difficile. Passende væske- og elektrolytbehandling, proteintilskud, antibiotikabehandling af C. difficile og kirurgisk evaluering bør iværksættes som klinisk indiceret.
FORHOLDSREGLER
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Nitrofurantoin var ikke kræftfremkaldende, når det blev fodret til Holtzman-hunrotter i 44,5 uger eller til Sprague-Dawley-hunrotter i 75 uger. To kroniske gnaverbioassays med anvendelse af Sprague-Dawley-han- og hunrotter og to kroniske bioassays i schweiziske mus og BDF1-mus viste ingen tegn på carcinogenicitet.
Nitrofurantoin fremlagde bevis for kræftfremkaldende aktivitet hos hun B6C3F1 mus som vist ved øget forekomst af tubulære adenomer, godartede blandede tumorer og granulosacelletumorer i ovariet. Hos F344/N-hanrotter var der øget forekomst af ualmindelige nyretubulære celle-neoplasmer, osteosarkomer i knoglerne og neoplasmer i det subkutane væv. I en undersøgelse, der involverede subkutan administration af 75 mg/kg nitrofurantoin til gravide hunmus, blev der observeret lungepapillære adenomer af ukendt betydning i F1-generationen.
Nitrofurantoin har vist sig at inducere punktmutationer i visse stammer af Salmonella typhimurium og fremadrettede mutationer på L5178Y muselymfomceller. Nitrofurantoin inducerede øget antal søsterkromatidudvekslinger og kromosomafvigelser i ovarieceller fra kinesisk hamster, men ikke i humane celler i kultur. Resultaterne af det kønsbundne recessive letale assay i Drosophila var negative efter administration af nitrofurantoin ved fodring eller ved injektion. Nitrofurantoin inducerede ikke arvelig mutation i de undersøgte gnavermodeller.
Betydningen af karcinogenicitet og mutagenicitetsfund i forhold til den terapeutiske anvendelse af nitrofurantoin hos mennesker er ukendt.
Administration af høje doser nitrofurantoin til rotter forårsager midlertidig spermatogen standsning; dette er reversibelt ved seponering af lægemidlet. Doser på 10 mg/kg/dag eller mere hos raske menneskelige mænd kan i visse uforudsigelige tilfælde give en let til moderat spermatogen standsning med et fald i sædtal.
Graviditet
Teratogene virkninger
Adskillige reproduktionsundersøgelser er blevet udført på kaniner og rotter i doser op til seks gange den humane dosis og har ikke afsløret tegn på nedsat fertilitet eller skade på fosteret på grund af nitrofurantoin. I en enkelt publiceret undersøgelse udført i mus med 68 gange den humane dosis (baseret på mg/kg administreret til moderen), blev væksthæmning og en lav forekomst af mindre og almindelige misdannelser observeret. Ved 25 gange den humane dosis blev der imidlertid ikke observeret føtale misdannelser; relevansen af disse fund for mennesker er usikker. Der er dog ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Ikke-teratogene virkninger
Nitrofurantoin er blevet vist i en publiceret transplacental carcinogenicitetsundersøgelse at inducere lungepapillære adenomer i F1-generationsmusene ved doser på 19 gange den humane dosis på mg/kg-basis. Forholdet mellem dette fund og potentiel human carcinogenese er i øjeblikket ukendt. På grund af usikkerheden med hensyn til de menneskelige implikationer af disse dyredata, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Arbejde og levering
Se KONTRAINDIKATIONER .
Ammende mødre
Nitrofurantoin er blevet påvist i human modermælk i spormængder. På grund af risikoen for alvorlige bivirkninger fra nitrofurantoin hos ammende spædbørn under en måneds alder, bør der tages en beslutning om, hvorvidt amningen skal afbrydes eller lægemidlet skal seponeres, under hensyntagen til lægemidlets betydning for moderen. (se KONTRAINDIKATIONER )
Pædiatrisk brug
Sikkerhed og effektivitet af Furadantin hos nyfødte under en måned er ikke blevet fastslået. (se KONTRAINDIKATIONER )
OVERDOSIS
Lejlighedsvise tilfælde af akut overdosering af Furadantin ikke har resulteret i andre specifikke symptomer end opkastning. Induktion af emesis anbefales. Der er ingen specifik modgift, men et højt væskeindtag bør opretholdes for at fremme urinudskillelsen af lægemidlet. Det er dialyserbart.
KONTRAINDIKATIONER
Anuri, oliguri eller signifikant svækkelse af nyrefunktionen (kreatininclearance under 60 ml pr. minut eller klinisk signifikant forhøjet serumkreatinin) er kontraindikationer. Behandling af denne type patienter medfører en øget risiko for toksicitet på grund af nedsat udskillelse af lægemidlet.
På grund af muligheden for hæmolytisk anæmi på grund af umodne erytrocytenzymsystemer (glutathion-ustabilitet), er lægemidlet kontraindiceret til gravide patienter ved termin (38-42 ugers svangerskab), under fødsel og fødsel, eller når fødslen er nært forestående. Af samme grund er lægemidlet kontraindiceret til nyfødte under en måneds alderen.
Furadantin er kontraindiceret hos patienter med tidligere kolestatisk gulsot/leverdysfunktion i forbindelse med nitrofurantoin. Furadantin er også kontraindiceret hos patienter med kendt overfølsomhed over for nitrofurantoin.
KLINISK FARMAKOLOGI
Oralt administreret Furadantin absorberes let og udskilles hurtigt i urinen. Blodkoncentrationer ved terapeutisk dosering er sædvanligvis lave. Det er meget opløseligt i urin, som det kan give en brun farve.
Efter et dosisregime på 100 mg qid i 7 dage, var den gennemsnitlige lægemiddelgenvinding i urinen (0-24 timer) på dag 1 og dag 7 42,7 % og 43,6 %.
I modsætning til mange lægemidler kan tilstedeværelsen af mad eller midler, der forsinker mavetømningen, øge biotilgængeligheden af Furadantin , formentlig ved at tillade bedre opløsning i mavesaft.
Mikrobiologi
Virkemåde
Nitrofurantoin reduceres af en lang række enzymer, herunder bakterielle flavoproteiner, til reaktive mellemprodukter, som er skadelige for makromolekyler såsom DNA og proteiner.
Krydsmodstand
Selvom krydsresistens med andre antimikrobielle stoffer kan forekomme, er krydsresistens med sulfonamider ikke blevet observeret.
Interaktion med andre antimikrobielle stoffer
Antagonisme er blevet påvist in vitro mellem nitrofurantoin og quinolonantimikrobielle midler. Nitrofurantoin, i form af nitrofurantoin oral suspension, har vist sig at være aktiv mod de fleste af følgende bakterier både in vitro og ved kliniske infektioner: (Se INDIKATIONER OG BRUG ).
Gram-positive aerober
Staphylococcus aureus Enterococcus arter
Gram-negative aerober
Escherichia coli
BEMÆRK: Nogle stammer af Enterobacter-arter og Klebsiella-arter er resistente over for nitrofurantoin.
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt. Nitrofurantoin udviser in vitro aktivitet mod følgende bakterier; dog er sikkerheden og effektiviteten af nitrofurantoin til behandling af kliniske infektioner på grund af disse bakterier ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
Gram-positive aerober
Koagulase-negative stafylokokker (herunder Staphylococcus epidermidis og Staphylococcus saprophyticus) Streptococcus agalactiaeViridans gruppe streptokokker
Gram-negative aerober
Citrobacter koseriCitrobacter freundiiKlebsiella oxytoca
Nitrofurantoin er ikke aktiv mod de fleste stammer af Proteus-arter eller Serratia-arter. Det har ingen aktivitet mod Pseudomonas-arter.
Modtagelighedstest
For specifik information om fortolkningskriterier for følsomhedstest og tilhørende testmetoder og kvalitetskontrolstandarder, der er anerkendt af FDA for dette lægemiddel, se venligst: http://www.fda.gov/STIC.
PATIENTOPLYSNINGER
Patienter bør rådes til at tage Furadantin med mad for yderligere at øge tolerancen og forbedre lægemiddelabsorptionen. Patienterne skal instrueres i at fuldføre hele behandlingsforløbet; dog bør de rådes til at kontakte deres læge, hvis der skulle opstå usædvanlige symptomer under behandlingen.
Diarré er et almindeligt problem forårsaget af antibiotika, som normalt ophører, når antibiotikaen seponeres. Nogle gange kan patienter efter start af behandling med antibiotika udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af antibiotika. Hvis dette sker, skal patienter kontakte deres læge hurtigst muligt.
Patienter bør rådes til ikke at bruge antacida præparater indeholdende magnesiumtrisilicat, mens de tager Furadantin .
