Ceftin 250mg, 500mg, 125mg Cefuroxime Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Ceftin 500mg, og hvordan bruges det?
Ceftin 500mg er en receptpligtig medicin, der bruges til at behandle symptomer på bakterielle infektioner. Ceftin kan bruges alene eller sammen med anden medicin.
Ceftin 250mg er et cephalosporin antibiotikum.
Det vides ikke, om Ceftin er sikkert og effektivt til børn under 3 måneder.
Hvad er de mulige bivirkninger af Ceftin?
Ceftin 250mg kan forårsage alvorlige bivirkninger, herunder:
- stærke mavesmerter,
- diarré (med eller uden blod),
- gulfarvning af hud eller øjne,
- udslæt,
- blå mærker,
- alvorlig prikken eller følelsesløshed,
- krampeanfald (kramper),
- vanskelig eller smertefuld vandladning,
- hævelse i dine fødder, ankler, ansigt eller tunge,
- træthed,
- stakåndet,
- feber,
- ondt i halsen,
- brændende i dine øjne,
- hudsmerter med rødt eller lilla udslæt,
- hudblærer og afskalning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Ceftin omfatter:
- diarré,
- kvalme,
- opkastning,
- usædvanlig eller ubehagelig smag i munden,
- bleudslæt hos et spædbarn,
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Ceftin. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
CEFTIN 500 mg tabletter og CEFTIN til oral suspension indeholder cefuroxim som cefuroximaxetil. CEFTIN er et semisyntetisk, cephalosporin antibakterielt lægemiddel til oral administration.
Det kemiske navn for cefuroximaxetil (1-(acetyloxy)ethylester af cefuroxim) er (RS)-1-hydroxyethyl (6R,7R)-7-[2-(2-furyl)glyoxyl-amido]-3-(hydroxymethyl) )-8-oxo-5-thia-1-azabicyclo[4.2.0]-oct-2-en-2-carboxylat, 72-(Z)-(O-methyloxim), 1-acetat-3-carbamat. Dens molekylære formel er C20H22N4O10S, og den har en molekylvægt på 510,48.
Cefuroximaxetil er i amorf form og har følgende strukturformel:
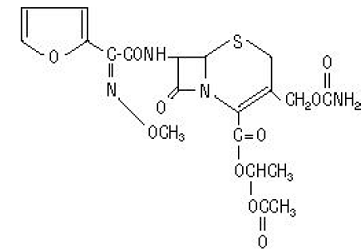
Tabletterne er filmovertrukne og indeholder, hvad der svarer til 250 eller 500 mg cefuroxim som cefuroximaxetil. Tabletter indeholder de inaktive ingredienser kolloid siliciumdioxid, croscarmellosenatrium, hydrogeneret vegetabilsk olie, hypromellose, methylparaben, mikrokrystallinsk cellulose, propylenglycol, propylparaben, natriumbenzoat, natriumlaurylsulfat og titaniumdioxid.
Oral suspension giver, når den er rekonstitueret med vand, hvad der svarer til 125 mg eller 250 mg cefuroxim (som cefuroximaxetil) pr. 5 ml. Oral suspension indeholder de inaktive ingredienser acesulfamkalium, aspartam, povidon K30, stearinsyre, saccharose, tutti-frutti-aromastoffer og xanthangummi.
INDIKATIONER
Pharyngitis/Tonsillitis
CEFTIN 125 mg tabletter er indiceret til behandling af voksne patienter og pædiatriske patienter (13 år og ældre) med mild til moderat faryngitis/tonsillitis forårsaget af modtagelige stammer af Streptococcus pyogenes.
CEFTIN 500 mg til oral suspension er indiceret til behandling af pædiatriske patienter i alderen 3 måneder til 12 år med mild til moderat faryngitis/tonsillitis forårsaget af modtagelige stammer af Streptococcus pyogenes.
Brugsbegrænsninger
- Effekten af CEFTIN til forebyggelse af gigtfeber blev ikke fastslået i kliniske forsøg.
- Effekten af CEFTIN 125 mg til behandling af penicillin-resistente stammer af Streptococcus pyogenes er ikke blevet påvist i kliniske forsøg.
Akut bakteriel mellemørebetændelse
CEFTIN 125 mg tabletter er indiceret til behandling af pædiatriske patienter (som kan sluge tabletter hele) med akut bakteriel mellemørebetændelse forårsaget af følsomme stammer af Streptococcus pneumoniae, Haemophilus influenzae (inklusive β-lactamase-producerende stammer af catamase, β-lactamase-producerende stammer). -producerende stammer) eller Streptococcus pyogenes.
CEFTIN til oral suspension er indiceret til behandling af pædiatriske patienter i alderen 3 måneder til 12 år med akut bakteriel mellemørebetændelse forårsaget af modtagelige stammer af Streptococcus pneumoniae, Haemophilus influenzae (inklusive β-lactamase-producerende stammer), Moraxella catarrmasehal -producerende stammer) eller Streptococcus pyogenes.
Akut bakteriel maxillær bihulebetændelse
CEFTIN-tabletter er indiceret til behandling af voksne og pædiatriske patienter (13 år og ældre) med mild til moderat akut bakteriel maksillær bihulebetændelse forårsaget af modtagelige stammer af Streptococcus pneumoniae eller Haemophilus influenzae (kun ikke-β-lactamase-producerende stammer).
CEFTIN 250 mg til oral suspension er indiceret til behandling af pædiatriske patienter i alderen 3 måneder til 12 år med mild til moderat akut bakteriel maksillær bihulebetændelse forårsaget af modtagelige stammer af Streptococcus pneumoniae eller Haemophilus influenzae (kun ikke-β-producerende laktamasestammer) .
Brugsbegrænsninger
Effektiviteten af CEFTIN til bihuleinfektioner forårsaget af β-lactamase-producerende Haemophilus influenzae eller Moraxella catarrhalis hos patienter med akut bakteriel maksillær bihulebetændelse blev ikke fastslået på grund af utilstrækkeligt antal af disse isolater i de kliniske forsøg [se Kliniske Studier ].
Akutte bakterielle eksacerbationer af kronisk bronkitis
CEFTIN-tabletter er indiceret til behandling af voksne patienter og pædiatriske patienter (i alderen 13 og ældre) med mild til moderat akut bakteriel eksacerbation af kronisk bronkitis forårsaget af modtagelige stammer af Streptococcus pneumoniae, Haemophilus influenzae (β-negative stammer), eller Haemophilus para influenzae (β-lactamase-negative stammer).
Ukomplicerede hud- og hudstrukturinfektioner
CEFTIN 250 mg tabletter er indiceret til behandling af voksne patienter og pædiatriske patienter (i alderen 13 og ældre) med ukomplicerede hud- og hudstrukturinfektioner forårsaget af modtagelige stammer af Staphylococcus aureus (inklusive β-lactamase-producerende stammer) eller Streptococcus pyogenes.
Ukomplicerede urinvejsinfektioner
CEFTIN 500 mg tabletter er indiceret til behandling af voksne patienter og pædiatriske patienter (i alderen 13 år og ældre) med ukomplicerede urinvejsinfektioner forårsaget af modtagelige stammer af Escherichia coli eller Klebsiella pneumoniae.
Ukompliceret gonoré
CEFTIN tabletter er indiceret til behandling af voksne patienter og pædiatriske patienter (i alderen 13 og ældre) med ukompliceret gonoré, urethral og endocervikal, forårsaget af penicillinase-producerende og ikke-penicillinase-producerende modtagelige stammer af Neisseria gonorrhoeae i recirkuleret og ukompliceret kvindelig gonorrhoeae og ukompliceret kvindelig gonorrhoeae, , forårsaget af ikke-penicillinase-producerende modtagelige stammer af Neisseria gonorrhoeae.
Tidlig Lyme-sygdom (erythema migrans)
CEFTIN-tabletter er indiceret til behandling af voksne patienter og pædiatriske patienter (13 år og ældre) med tidlig borreliose (erythema migrans) forårsaget af modtagelige stammer af Borrelia burgdorferi.
Impetigo
CEFTIN 250 mg til oral suspension er indiceret til behandling af pædiatriske patienter i alderen 3 måneder til 12 år med impetigo forårsaget af følsomme stammer af Staphylococcus aureus (inklusive Plactamase-producerende stammer) eller Streptococcus pyogenes.
Brug
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af CEFTIN og andre antibakterielle lægemidler, bør CEFTIN 500mg kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til den empiriske udvælgelse af terapi.
DOSERING OG ADMINISTRATION
Vigtige administrationsinstruktioner
- CEFTIN tabletter og CEFTIN til oral suspension er ikke bioækvivalente og er derfor ikke substituerbare på milligram-per-milligram-basis [se KLINISK FARMAKOLOGI ].
- Administrer CEFTIN-tabletter eller oral suspension som beskrevet i de relevante doseringsvejledninger [se Dosering for CEFTIN 500mg tabletter, Dosering for CEFTIN 250mg til oral suspension og Klargøring og administration af CEFTIN 125mg til oral suspension ].
- Administrer CEFTIN 500 mg tabletter med eller uden mad.
- Administrer CEFTIN 500 mg til oral suspension med mad.
- Pædiatriske patienter (i alderen 13 år og ældre), som ikke kan sluge CEFTIN 125 mg tabletterne hele, bør modtage CEFTIN som oral suspension, fordi tabletten har en stærk, vedvarende bitter smag, når den knuses [se Dosering til CEFTIN-tabletter ].
Dosering til CEFTIN 500mg tabletter
Administrer CEFTIN 250 mg tabletter som beskrevet i doseringsvejledningstabellen nedenfor med eller uden mad.
Dosering til CEFTIN til oral suspension
Administrer CEFTIN til oral suspension som beskrevet i nedenstående tabel med doseringsvejledninger sammen med mad.
Klargøring og administration af CEFTIN til oral suspension
Forbered en suspension på udleveringstidspunktet som følger:
- Ryst den orale suspension godt før hver brug.
- Sæt hætten på igen efter hver åbning.
- Opbevar den rekonstituerede suspension i køleskab mellem 2° og 8°C (36° og 46°F).
- Kassér den rekonstituerede suspension efter 10 dage.
Dosering hos patienter med nedsat nyrefunktion
En dosisintervaljustering er påkrævet for patienter, hvis kreatininclearance er mindre end 30 ml/min, som anført i tabel 4 nedenfor, fordi cefuroxim primært elimineres af nyrerne [se KLINISK FARMAKOLOGI ].
HVORDAN LEVERET
Doseringsformer og styrker
CEFTIN tabletter er hvide, kapselformede, filmovertrukne tabletter, der fås i følgende styrker:
- 250 mg cefuroxim (som cefuroximaxetil) med "GX ES7" indgraveret på den ene side og blank på den anden side.
- 500 mg cefuroxim (som cefuroximaxetil) med "GX EG2" indgraveret på den ene side og blank på den anden side.
CEFTIN til oral suspension leveres som tørt, hvidt til råhvidt pulver med tutti-frutti-smag. Når den er rekonstitueret som anvist, giver suspensionen det, der svarer til 125 mg eller 250 mg cefuroxim (som cefuroximaxetil) pr. 5 ml.
Opbevaring og håndtering
CEFTIN tabletter, 250 mg cefuroxim (som cefuroximaxetil), er hvide, kapselformede, filmovertrukne tabletter præget med "GX ES7" på den ene side og blanke på den anden side som følger: 20 tabletter/flaske NDC 0173-0387-00
CEFTIN tabletter, 500 mg cefuroxim (som cefuroximaxetil), er hvide, kapselformede, filmovertrukne tabletter præget med "GX EG2" på den ene side og blanke på den anden side som følger: 20 tabletter/flaske NDC 0173-0394-00
Opbevar tabletterne mellem 15° og 30°C (59° og 86°F). Sæt hætten på igen efter hver åbning.
CEFTIN 500mg til oral suspension leveres som tørt, hvidt til råhvidt pulver med tutti-frutti-smag. Når den er rekonstitueret som anvist, giver suspensionen det, der svarer til 125 mg eller 250 mg cefuroxim (som cefuroximaxetil) pr. 5 ml. Den leveres i ravfarvede glasflasker som følger:
125 mg/5 ml
100 ml suspension NDC 0173-0740-00
250 mg/5 ml
50 ml suspension NDC 0173-0741-10 100-mL Suspension NDC 0173-0741-00
Før rekonstitution opbevares tørt pulver mellem 2° og 30°C (36° og 86°F).
Efter rekonstitution opbevares suspensionen straks i køleskab mellem 2° og 8°C (36° og 46°F). BORTSKAFFES EFTER 10 DAGE.
GlaxoSmithKline, Research Triangle Park, NC 27709. Revideret: okt 2017
BIVIRKNINGER
Følgende alvorlige og ellers vigtige bivirkning er beskrevet mere detaljeret i afsnittet Advarsler og forholdsregler på etiketten:
Anafylaktiske reaktioner [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan de bivirkninger, der er observeret i de kliniske forsøg med et lægemiddel, ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Tabletter
Multiple-dosis doseringsregimer med 7 til 10 dages varighed
kliniske forsøg med flere doser blev 912 forsøgspersoner behandlet med CEFTIN (125 til 500 mg to gange dagligt). Det bemærkes, at 125 mg to gange dagligt ikke er en godkendt dosis. Tyve (2,2%) forsøgspersoner ophørte med medicin på grund af bivirkninger. Sytten (85 %) af de 20 forsøgspersoner, der afbrød behandlingen, gjorde det på grund af mave-tarmforstyrrelser, herunder diarré, kvalme, opkastning og mavesmerter. Procentdelen af forsøgspersoner, der blev behandlet med CEFTIN, og som ophørte med studielægemidlet på grund af bivirkninger, var ens ved daglige doser på 1.000, 500 og 250 mg (henholdsvis 2,3 %, 2,1 % og 2,2 %). Imidlertid steg forekomsten af gastrointestinale bivirkninger med de højere anbefalede doser.
Bivirkningerne i tabel 5 er for forsøgspersoner (n = 912) behandlet med CEFTIN 250 mg i kliniske forsøg med flere doser.
Følgende bivirkninger forekom hos mindre end 1 %, men mere end 0,1 % af forsøgspersonerne (n = 912) behandlet med CEFTIN i kliniske forsøg med flere doser.
Forstyrrelser i immunsystemet Nældefeber, hævet tunge.
Metabolisme og ernæringsforstyrrelser : Anoreksi.
Forstyrrelser i nervesystemet : Hovedpine.
Hjertelidelser : Brystsmerter.
Åndedrætsforstyrrelser : Stakåndet.
Gastrointestinale lidelser : Mavesmerter, mavekramper, flatulens, fordøjelsesbesvær, mundsår.
Hud- og subkutane vævsforstyrrelser : Udslæt, kløe.
Nyre- og urinvejslidelser : Dysuri.
Reproduktionssystem og brystlidelser : Vaginitis, vulva kløe.
Generelle lidelser og betingelser for administrationsstedet : Kuldegysninger, søvnighed, tørst.
Undersøgelser : Positiv Coombs' test.
Tidlig Lyme-sygdom med 20-dages regime
To multicenterforsøg vurderede CEFTIN 500 mg to gange dagligt i 20 dage. De mest almindelige lægemiddelrelaterede bivirkninger var diarré (10,6 %), Jarisch-Herxheimer-reaktion (5,6 %) og vaginitis (5,4 %). Andre uønskede oplevelser forekom med frekvenser sammenlignelige med dem, der blev rapporteret ved 7 til 10 dages dosering.
Enkeltdosis regime til ukompliceret gonoré
I kliniske forsøg med en enkelt dosis på 1.000 mg CEFTIN 250 mg blev 1.061 forsøgspersoner behandlet for ukompliceret gonoré. Bivirkningerne i tabel 6 var for forsøgspersoner behandlet med en enkelt dosis på 1.000 mg CEFTIN i amerikanske kliniske forsøg.
Følgende bivirkninger forekom hos mindre end 1 %, men mere end 0,1 % af forsøgspersonerne (n = 1.061) behandlet med en enkelt dosis CEFTIN 1.000 mg mod ukompliceret gonoré i kliniske forsøg i USA.
Infektioner og angreb : Vaginal candidiasis.
Forstyrrelser i nervesystemet : Hovedpine, svimmelhed, somnolens.
Hjertelidelser : Tæthed/smerter i brystet, takykardi.
Gastrointestinale lidelser : Mavesmerter, dyspepsi.
Hud- og subkutane vævsforstyrrelser : Erytem, udslæt, kløe.
Muskuloskeletale og bindevævslidelser : Muskelkramper, muskelstivhed, muskelspasmer i nakken, reaktion af lockjaw-typen.
Nyre- og urinvejslidelser : Blødning/smerter i urinrøret, nyresmerter.
Reproduktionssystem og brystlidelser : Vaginal kløe, vaginalt udflåd.
Oral suspension
I kliniske forsøg med multiple doser af CEFTIN 250 mg blev pædiatriske forsøgspersoner (96,7 % var yngre end 12 år) behandlet med CEFTIN (20 til 30 mg/kg/dag fordelt to gange dagligt op til en maksimal dosis på 500 eller 1.000 mg/dag, henholdsvis). Elleve (1,2%) amerikanske forsøgspersoner ophørte med medicin på grund af bivirkninger. Seponeringerne skyldtes primært mave-tarmforstyrrelser, sædvanligvis diarré eller opkastning. Tretten (1,4 %) amerikanske pædiatriske forsøgspersoner afbrød behandlingen på grund af smag og/eller problemer med lægemiddeladministration.
Bivirkningerne i tabel 7 er for amerikanske forsøgspersoner (n = 931) behandlet med CEFTIN i kliniske forsøg med flere doser.
Følgende bivirkninger forekom hos mindre end 1 %, men mere end 0,1 % af de amerikanske forsøgspersoner (n = 931) behandlet med CEFTIN til oral suspension i kliniske forsøg med flere doser.
Infektioner og angreb : Gastrointestinal infektion, candidiasis, virussygdom, øvre luftvejsinfektion, bihulebetændelse, urinvejsinfektion.
Blod og lymfesystem lidelser : Eosinofili.
Psykiatriske lidelser : Hyperaktivitet, irritabel adfærd.
Gastrointestinale lidelser : Mavesmerter, flatulens, ptyalisme.
Hud- og subkutane vævsforstyrrelser : Udslæt.
Muskuloskeletale og bindevævslidelser : Ledhævelse, artralgi.
Reproduktionssystem og brystlidelser : Vaginal irritation.
Generelle lidelser og betingelser for administrationsstedet : Hoste, feber.
Undersøgelser : Forhøjede leverenzymer, positiv Coombs' test.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af CEFTIN efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Blod og lymfesystem lidelser
Hæmolytisk anæmi, leukopeni, pancytopeni, trombocytopeni.
Gastrointestinale lidelser
Pseudomembranøs colitis [se ADVARSLER OG FORHOLDSREGLER ].
Lever og galdelidelser
Nedsat leverfunktion inklusive hepatitis og kolestase, gulsot.
Forstyrrelser i immunsystemet
Anafylaksi, serumsygelignende reaktion.
Undersøgelser
Øget protrombintid.
Forstyrrelser i nervesystemet
Anfald, encefalopati.
Nyre- og urinvejslidelser
Renal dysfunktion.
Hud- og subkutane vævsforstyrrelser
Angioødem, erythema multiforme, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, nældefeber.
DRUGSINTERAKTIONER
Orale præventionsmidler
Cefuroximaxetil kan påvirke tarmfloraen, hvilket fører til lavere østrogenreabsorption og reduceret effektivitet af kombinerede orale østrogen/progesteron-præventionsmidler. Rådgiv patienterne til at overveje alternative supplerende (ikke-hormonelle) præventionsforanstaltninger under behandlingen.
Lægemidler, der reducerer mavesyre
Lægemidler, der reducerer surhedsgraden i maven, kan resultere i en lavere biotilgængelighed af CEFTIN sammenlignet med administration i fastende tilstand. Administration af lægemidler, der reducerer surhedsgraden i maven, kan ophæve fødevareeffekten af øget absorption af CEFTIN 250 mg, når det administreres i postprandial tilstand. Administrer CEFTIN mindst 1 time før eller 2 timer efter administration af korttidsvirkende antacida. Histamin-2 (H2) antagonister og protonpumpehæmmere bør undgås.
Probenecid
Samtidig administration af probenecid og cefuroximaxetil-tabletter øger serumkoncentrationen af cefuroxim [se KLINISK FARMAKOLOGI ]. Samtidig administration af probenecid og cefuroximaxetil anbefales ikke.
Interaktioner med lægemiddel/laboratorietest
En falsk positiv reaktion for glukose i urinen kan forekomme med kobberreduktionstest (f.eks. Benedicts eller Fehlings opløsning), men ikke med enzymbaserede tests for glykosuri. Da et falsk-negativt resultat kan forekomme i ferricyanid-testen, anbefales det, at enten glucoseoxidase- eller hexokinasemetoden anvendes til at bestemme blod-/plasmaglukoseniveauer hos patienter, der får cefuroximaxetil. Tilstedeværelsen af cefuroxim interfererer ikke med analysen af serum- og urinkreatinin ved den alkaliske piratmetode.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Anafylaktiske reaktioner
Alvorlige og lejlighedsvis fatale overfølsomhedsreaktioner (anafylaktiske) er blevet rapporteret hos patienter på β-lactam antibakterielle midler. Disse reaktioner er mere tilbøjelige til at forekomme hos personer med en historie med β-lactam-overfølsomhed og/eller en historie med følsomhed over for flere allergener. Der har været rapporter om personer med en historie med overfølsomhed over for penicillin, som har oplevet alvorlige reaktioner ved behandling med cephalosporiner. CEFTIN 500mg er kontraindiceret til patienter med kendt overfølsomhed over for CEFTIN eller andre β-lactam antibakterielle lægemidler [se KONTRAINDIKATIONER ]. Inden behandling med CEFTIN påbegyndes, forhør dig om tidligere overfølsomhedsreaktioner over for penicilliner, cephalosporiner eller andre allergener. Hvis der opstår en allergisk reaktion, skal du seponere CEFTIN og igangsætte passende behandling.
Clostridium Difficile-associeret diarré
Clostridium difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive CEFTIN, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, der får diarré efter brug af antibiotika. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over 2 måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibiotikabrug, der ikke er rettet mod C. difficile. Passende væske- og elektrolytbehandling, proteintilskud, antibiotikabehandling af C. difficile og kirurgisk evaluering bør iværksættes som klinisk indiceret.
Potentiale for mikrobiel overvækst
Muligheden for superinfektioner med svampe- eller bakteriepatogener bør overvejes under behandlingen.
Udvikling af lægemiddelresistente bakterier
Det er usandsynligt, at ordination af CEFTIN, enten i fravær af en påvist eller stærkt mistænkt bakteriel infektion eller en profylaktisk indikation, vil give gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier.
Fenylketonuri
CEFTIN 125 mg til oral suspension 125 mg/5 ml indeholder phenylalanin 11,8 mg pr. 5 ml (1 teskefuld) rekonstitueret suspension. CEFTIN 250 mg til oral suspension 250 mg/5 ml indeholder phenylalanin 25,2 mg pr. 5 ml (1 teskefuld) rekonstitueret suspension.
Interferens med glukosetests
Et falsk-positivt resultat for glukose i urinen kan forekomme med kobberreduktionstest, og et falsk-negativt resultat for blod-/plasmaglukose kan forekomme med ferricyanid-tests hos forsøgspersoner, der får CEFTIN [se DRUGSINTERAKTIONER ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Selvom livstidsundersøgelser på dyr ikke er blevet udført for at vurdere karcinogent potentiale, blev der ikke fundet mutagen aktivitet for cefuroximaxetil i en række bakterielle mutationstests. Positive resultater blev opnået i et in vitro kromosomafvigelsesassay; negative resultater blev dog fundet i en in vivo mikronukleustest ved doser op til 1,5 g/kg. Reproduktionsundersøgelser med rotter ved doser op til 1.000 mg/kg/dag (9 gange den anbefalede maksimale humane dosis baseret på kropsoverfladeareal) har ikke vist nogen svækkelse af fertiliteten.
Brug i specifikke populationer
Graviditet
Graviditetskategori B. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Da reproduktionsundersøgelser hos dyr ikke altid forudsiger human respons, bør CEFTIN kun anvendes under graviditet, hvis det er klart nødvendigt.
Reproduktionsundersøgelser er blevet udført på mus i doser op til 3.200 mg/kg/dag (14 gange den anbefalede maksimale humane dosis baseret på kropsoverfladeareal) og i rotter i doser op til 1.000 mg/kg/dag (9 gange den anbefalede maksimale dosis) human dosis baseret på kropsoverfladeareal) og har ikke afsløret tegn på nedsat fertilitet eller skade på fosteret på grund af cefuroximaxetil.
Ammende mødre
Da cefuroxim udskilles i modermælk, bør der udvises forsigtighed, når CEFTIN 500 mg administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerheden og effektiviteten af CEFTIN 250 mg er blevet fastslået til pædiatriske patienter i alderen 3 måneder til 12 år for akut bakteriel maksillær bihulebetændelse baseret på dets godkendelse hos voksne. Brug af CEFTIN til pædiatriske patienter understøttes af farmakokinetiske og sikkerhedsdata hos voksne og pædiatriske patienter og af kliniske og mikrobiologiske data fra tilstrækkelige og velkontrollerede undersøgelser af behandling af akut bakteriel maxillar bihulebetændelse hos voksne og af akut mellemørebetændelse med effusion i pædiatriske patienter. Det understøttes også af overvågning af bivirkninger efter markedsføring. [Se INDIKATIONER OG BRUG , DOSERING OG ADMINISTRATION , BIVIRKNINGER , KLINISK FARMAKOLOGI ]
Geriatrisk brug
Af det samlede antal forsøgspersoner, der modtog CEFTIN 250 mg i 20 kliniske forsøg, var 375 i alderen 65 år og ældre, mens 151 var 75 år og ældre. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre voksne forsøgspersoner. Rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre voksne patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes.
Cefuroxim udskilles væsentligt via nyrerne, og risikoen for bivirkninger kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og det kan være nyttigt at overvåge nyrefunktionen.
Nedsat nyrefunktion
Reduktion af dosis af CEFTIN 125 mg anbefales til voksne patienter med svært nedsat nyrefunktion (kreatininclearance DOSERING OG ADMINISTRATION , KLINISK FARMAKOLOGI ].
OVERDOSIS
Overdosering af cephalosporiner kan forårsage cerebral irritation, der kan føre til kramper eller encefalopati. Serumniveauer af cefuroxim kan reduceres ved hæmodialyse og peritonealdialyse.
KONTRAINDIKATIONER
CEFTIN er kontraindiceret hos patienter med kendt overfølsomhed (f.eks. anafylaksi) over for CEFTIN eller andre β-lactam antibakterielle lægemidler (f.eks. penicilliner og cephalosporiner).
KLINISK FARMAKOLOGI
Handlingsmekanisme
CEFTIN 250mg er et antibakterielt lægemiddel [se Mikrobiologi ].
Farmakokinetik
Absorption
Efter oral administration absorberes cefuroximaxetil fra mave-tarmkanalen og hydrolyseres hurtigt af uspecifikke esteraser i tarmslimhinden og blodet til cefuroxim. Serumfarmakokinetiske parametre for cefuroxim efter administration af CEFTIN 250 mg tabletter til voksne er vist i tabel 8.
Mad effekt
Absorptionen af tabletten er større, når den tages efter mad (absolut biotilgængelighed øges fra 37 % til 52 %). På trods af denne forskel i absorption var forsøgspersonernes kliniske og bakteriologiske respons uafhængig af fødeindtagelse på tidspunktet for tabletindgivelse i 2 forsøg, hvor dette blev vurderet.
Alle farmakokinetiske og kliniske effektivitets- og sikkerhedsforsøg hos pædiatriske forsøgspersoner, der anvender suspensionsformuleringen, blev udført i fødetilstand. Der er ingen tilgængelige data om absorptionskinetikken af suspensionsformuleringen, når den administreres til fastende pædiatriske personer.
Mangel på bioækvivalens
Oral suspension var ikke bioækvivalent med tabletter, når de blev testet hos raske voksne. Tablet- og oral suspensionsformuleringerne er IKKE substituerbare på milligram-permilligram-basis. Arealet under kurven for suspensionen var i gennemsnit 91 % af det for tabletten, og topplasmakoncentrationen for suspensionen var i gennemsnit 71 % af tabletternes maksimale plasmakoncentration. Derfor blev sikkerheden og effektiviteten af både tablet- og oral suspensionsformulering fastlagt i separate kliniske forsøg.
Fordeling
Cefuroxim fordeles i de ekstracellulære væsker. Cirka 50 % af serumcefuroxim er bundet til protein.
Metabolisme
Aksetildelen metaboliseres til acetaldehyd og eddikesyre.
Udskillelse
Cefuroxim udskilles uændret i urinen; hos voksne genfindes ca. 50 % af den administrerede dosis i urinen inden for 12 timer. Farmakokinetikken af cefuroxim hos pædiatriske forsøgspersoner er ikke blevet undersøgt. Indtil yderligere data er tilgængelige, bør den renale elimination af cefuroximaxetil etableret hos voksne ikke ekstrapoleres til pædiatriske forsøgspersoner.
Specifikke populationer
Nedsat nyrefunktion
I et forsøg med 28 voksne med normal nyrefunktion eller svært nedsat nyrefunktion (kreatininclearance DOSERING OG ADMINISTRATION ].
Pædiatriske patienter
Serumfarmakokinetiske parametre for cefuroxim hos pædiatriske forsøgspersoner, der får CEFTIN til oral suspension, er vist i tabel 9.
Geriatriske patienter
et forsøg med 20 ældre forsøgspersoner (gennemsnitsalder = 83,9 år) med en gennemsnitlig kreatininclearance på 34,9 ml/min blev den gennemsnitlige serumelimineringshalveringstid forlænget til 3,5 timer; på trods af den lavere elimination af cefuroxim hos geriatriske patienter, er dosisjustering baseret på alder imidlertid ikke nødvendig [se Brug i specifikke populationer ].
Lægemiddelinteraktioner
Samtidig administration af probenecid og cefuroximaxetil-tabletter øger cefuroxim-arealet under serumkoncentrationen versus tidskurven og den maksimale serumkoncentration med henholdsvis 50 % og 21 %.
Mikrobiologi
Handlingsmekanisme
Cefuroximaxetil er et bakteriedræbende middel, der virker ved at hæmme bakteriel cellevægsyntese. Cefuroximaxetil har aktivitet i nærvær af nogle β-lactamaser, både penicillinaser og cephalosporinaser, af gram-negative og gram-positive bakterier.
Modstandsmekanisme
Resistens over for cefuroximaxetil er primært gennem hydrolyse af β-lactamase, ændring af penicillin-bindende proteiner (PBP'er), nedsat permeabilitet og tilstedeværelsen af bakterielle effluxpumper.
Modtagelighed for cefuroximaxetil vil variere med geografi og tid; lokale modtagelighedsdata bør konsulteres, hvis de er tilgængelige. Beta-lactamase-negative, ampicillin-resistente (BLNAR) isolater af H. influenzae bør betragtes som resistente over for cefuroximaxetil.
Cefuroximaxetil har vist sig at være aktiv mod de fleste isolater af følgende bakterier, både in vitro og ved kliniske infektioner [se INDIKATIONER OG BRUG ]:
Gram-positive bakterier
Staphylococcus aureus (kun meticillin-modtagelige isolater) Streptococcus pneumoniae Streptococcus pyogenes
Gram-negative bakterier
Escherichia colia Klebsiella pneumoniaea Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis Neisseria gonorrhoeae a Mest udvidet spektrum β-lactamase (ESBL)-producerende og carbapenemase-producerende isolater er resistente over for cefuroxime. Spirochetes Borrelia Burgdorferi
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt. Mindst 90 procent af følgende mikroorganismer udviser en in vitro minimal hæmmende koncentration (MIC) mindre end eller lig med det modtagelige brudpunkt for cefuroximaxetil på 1 mcg/ml. Effekten af cefuroximaxetil til behandling af kliniske infektioner forårsaget af disse mikroorganismer er imidlertid ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
Gram-positive bakterier
Staphylococcus epidermidis (kun meticillin-følsomme isolater) Staphylococcus saprophyticus (kun meticillin-modtagelige isolater) Streptococcus agalactiae
Gram-negative bakterier
Morganella morganii Proteus inconstans Proteus mirabilis Providencia rettgeri Anaerobe bakterier Peptococcus niger
Modtagelighedstestmetoder
Når det er tilgængeligt, bør det kliniske mikrobiologiske laboratorium levere resultaterne af in vitro-følsomhedstests for antimikrobielle lægemidler, der anvendes på lokale hospitaler og praksisområder, til lægen som periodiske rapporter, der beskriver følsomhedsprofilen for nosokomiale og samfundserhvervede patogener. Disse rapporter skal hjælpe lægen med at vælge et antibakterielt lægemiddel til behandling.
Fortyndingsteknikker
Kvantitative metoder bruges til at bestemme antimikrobielle MIC'er. Disse MIC'er giver reproducerbare estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. MIC'erne bør bestemmes ved hjælp af en standardiseret testmetode (bouillon eller agar).1, 2 MIC-værdierne skal fortolkes i henhold til kriterierne i tabel 10.2,3
Diffusionsteknikker
Kvantitative metoder, der kræver måling af zonediametre, giver også reproducerbare estimater af bakteriers modtagelighed over for antimikrobielle forbindelser. Zonestørrelsen giver et skøn over bakteriers modtagelighed over for antimikrobielle forbindelser. Zonestørrelsen bør bestemmes ved hjælp af en standardiseret testmetode.4 Denne procedure bruger papirskiver imprægneret med 30 mcg cefuroximaxetil til at teste mikroorganismers modtagelighed for cefuroximaxetil. Diskdiffusionsfortolkningskriterierne er angivet i tabel 10.3
Stafylokokkers modtagelighed for cefuroxim kan udledes af kun at teste penicillin og enten cefoxitin eller oxacillin.
Følsomhed af Streptococcus pyogenes kan udledes af testning af penicillin.3
En rapport om "følsom" indikerer, at det antimikrobielle lægemiddel sandsynligvis vil hæmme væksten af patogenet, hvis det antimikrobielle lægemiddel når den koncentration, der normalt kan opnås på infektionsstedet. En rapport med "Mellem" indikerer, at resultatet skal betragtes som tvetydigt, og hvis mikroorganismen ikke er fuldt ud modtagelig for alternative, klinisk mulige lægemidler, skal testen gentages. Denne kategori indebærer mulig klinisk anvendelighed på kropssteder, hvor lægemidlet er fysiologisk koncentreret, eller i situationer, hvor en høj dosis af lægemidlet kan anvendes. Denne kategori giver også en bufferzone, der forhindrer små ukontrollerede tekniske faktorer i at forårsage store uoverensstemmelser i fortolkningen. En rapport om "Resistent" indikerer, at det antimikrobielle lægemiddel sandsynligvis ikke vil hæmme væksten af patogenet, hvis det antimikrobielle lægemiddel når de koncentrationer, der normalt kan opnås på infektionsstedet; anden terapi bør vælges.
Kvalitetskontrol
Standardiserede følsomhedstestprocedurer kræver brug af laboratoriekontroller til at overvåge og sikre nøjagtigheden og præcisionen af forsyninger og reagenser, der anvendes i analysen, og teknikkerne for den person, der udfører testen.1,2,4 QC-intervallerne for MIC og diskdiffusion test ved hjælp af 30-mcg-disken findes i tabel 11.3
Kliniske Studier
Akut bakteriel maxillær bihulebetændelse
Et tilstrækkeligt og velkontrolleret forsøg blev udført i forsøgspersoner med akut bakteriel maksillær bihulebetændelse. I dette forsøg fik hvert forsøgsperson et maxillært sinusaspirat opsamlet ved sinuspunktur, før behandlingen blev påbegyndt for formodet akut bakteriel bihulebetændelse. Alle forsøgspersoner havde radiografisk og klinisk tegn på akut maksillær bihulebetændelse. I forsøget var den kliniske effektivitet af CEFTIN til behandling af akut maksillær bihulebetændelse sammenlignelig med et oralt antimikrobielt middel indeholdende en specifik β-lactamasehæmmer. Mikrobiologiske data viste imidlertid, at CEFTIN er effektivt til behandling af akut bakteriel maksillær bihulebetændelse, som kun skyldes Streptococcus pneumoniae eller ikke-β-lactamase-producerende Haemophilus influenzae. Der blev opnået et utilstrækkeligt antal β-lactamase-producerende Haemophilus influenzae og Moraxella catarrhalis isolater i dette forsøg til tilstrækkeligt at evaluere effektiviteten af CEFTIN til behandling af akut bakteriel maxillær bihulebetændelse på grund af disse 2 organismer.
Dette forsøg randomiserede 317 voksne forsøgspersoner, 132 forsøgspersoner i USA og 185 forsøgspersoner i Sydamerika. Tabel 12 viser resultaterne af intention-to-treat-analysen.
I dette forsøg og i et understøttende maksillær punkturforsøg havde 15 evaluerbare forsøgspersoner ikke-β-lactamase-producerende Haemophilus influenzae som det identificerede patogen. Af disse fik 67 % (10/15) dette patogen udryddet. Atten (18) evaluerbare forsøgspersoner havde Streptococcus pneumoniae som det identificerede patogen. Af disse fik 83 % (15/18) dette patogen udryddet.
Tidlig Lyme-sygdom
To tilstrækkelige og velkontrollerede forsøg blev udført i forsøgspersoner med tidlig borreliose. Alle forsøgspersoner præsenteret med lægedokumenteret erythema migrans, med eller uden systemiske manifestationer af infektion. Forsøgspersoner blev vurderet 1 måned efter behandling for succes med behandling af tidlig borreliose (del I) og 1 år efter behandling for succes med at forhindre progression til følgesygdomme af sen borreliose (del II).
alt 355 voksne forsøgspersoner (181 behandlet med cefuroximaxetil og 174 behandlet med doxycyclin) blev randomiseret i de 2 forsøg, med diagnosen tidlig borreliose bekræftet hos 79 % (281/355). Den kliniske diagnose af tidlig borreliose hos disse forsøgspersoner blev valideret ved 1) blindet ekspertlæsning af fotografier, når de er tilgængelige, af forbehandlingen erythema migrans hudlæsion og 2) serologisk bekræftelse (ved hjælp af enzym-linked immunosorbent assay [ELISA] og immunoblot assay ["Western" blot]) af tilstedeværelsen af antistoffer, der er specifikke for Borrelia burgdorferi, det ætiologiske agens af Lyme-sygdom. Effektdataene i tabel 13 er specifikke for denne "validerede" patientundergruppe, mens sikkerhedsdataene nedenfor afspejler hele patientpopulationen for de 2 forsøg. Kliniske data for evaluerbare forsøgspersoner i den "validerede" patientundergruppe er vist i tabel 13.
CEFTIN og doxycyclin var effektive til at forebygge udviklingen af følgesygdomme efter sen Lyme-sygdom.
Mens forekomsten af lægemiddelrelaterede gastrointestinale bivirkninger var ens i de 2 behandlingsgrupper (cefuroximaxetil - 13 %; doxycyclin - 11 %), var forekomsten af lægemiddelrelateret diarré højere i cefuroximaxetil-armen sammenlignet med doxycyclin-armen (11). % mod henholdsvis 3 %).
REFERENCER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder til fortynding Antimikrobielle følsomhedstests for bakterier, der vokser aerobt; Godkendt standard - tiende udgave. 2015. CLSI-dokument M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
2. Clinical and Laboratory Standards Institute (CLSI). Metoder til antimikrobiel fortynding og testning af diskfølsomhed for sjældent isolerede eller kræsne bakterier: Godkendte retningslinjer - anden udgave. 2010. CLSI-dokument M45-A2, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
3. Clinical and Laboratory Standards Institute (CLSI). Ydeevnestandarder for antimikrobiel følsomhedstestning; Femogtyvende informationstillæg. 2015. CLSI-dokument M100- S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
4. Clinical and Laboratory Standards Institute (CLSI). Ydeevnestandarder for antimikrobielle diskdiffusionsfølsomhedstests; Godkendt standard - tolvte udgave. 2015. CLSI-dokument M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
PATIENTOPLYSNINGER
Allergiske reaktioner
Informer patienterne om, at CEFTIN er et cephalosporin, der kan forårsage allergiske reaktioner hos nogle individer [se ADVARSLER OG FORHOLDSREGLER ].
Clostridium Difficile-associeret diarré
Informer patienterne om, at diarré er et almindeligt problem forårsaget af antibakterielle midler, og det slutter normalt, når det antibakterielle middel seponeres. Nogle gange kan patienter efter påbegyndelse af behandling med antibakterielle midler udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som 2 eller flere måneder efter at have taget deres sidste dosis af det antibakterielle middel. Hvis dette sker, skal du rådgive patienterne om at kontakte deres læge så hurtigt som muligt.
Fenylketonuri
Informer patienter og pårørende om, at CEFTIN 125mg til oral suspension indeholder phenylalanin (en komponent af aspartam) [se ADVARSLER OG FORHOLDSREGLER ].
Knusende tabletter
Instruer patienterne i at sluge tabletten hel uden at knuse tabletten. Patienter, der ikke kan sluge tabletten hel, bør modtage den orale suspension.
Oral suspension
Instruer patienterne i at ryste den orale suspension godt før hver brug, opbevares i køleskabet og kasseres efter 10 dage. Den orale suspension skal tages sammen med mad.
Lægemiddelresistens
Informer patienterne om, at antibakterielle lægemidler, inklusive CEFTIN, kun bør bruges til at behandle bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. forkølelse). Når CEFTIN 250 mg er ordineret til behandling af en bakteriel infektion, skal du informere patienterne om, at selvom det er almindeligt at føle sig bedre tidligt i behandlingsforløbet, skal medicinen tages nøjagtigt som anvist. At springe doser over eller ikke fuldføre hele behandlingsforløbet kan: (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke vil kunne behandles med CEFTIN 500mg eller andre antibakterielle lægemidler i fremtiden .
