Medicin mod kræft: Nolvadex 10mg, 20mg Tamoxifen Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Nolvadex, og hvordan bruges det?
Nolvadex 10mg er en receptpligtig medicin, der bruges til at behandle symptomerne på brystkræft. Nolvadex kan bruges alene eller sammen med anden medicin.
Nolvadex 20mg tilhører en klasse af lægemidler kaldet antineoplastik, østrogenreceptorantagonister.
Det vides ikke, om Nolvadex 20mg er sikkert og effektivt hos børn.
Hvad er de mulige bivirkninger af Nolvadex 20mg?
Nolvadex kan forårsage alvorlige bivirkninger, herunder:
- synsforandringer,
- øjensmerter,
- let blå mærker eller blødning,
- humørsvingninger,
- hævelse af ankler eller fødder, og
- usædvanlig træthed
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Nolvadex omfatter:
- hedeture,
- rødmen,
- ændringer i menstruation,
- kvalme,
- kramper i benene,
- mavekramper,
- knoglesmerter,
- muskelsmerter,
- hoste,
- hævelse,
- træthed,
- hår udtynding,
- hovedpine,
- depression, og
- tab af seksuel formåen/interesse (hos mænd)
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Nolvadex. Spørg din læge eller apotek for mere information.
ADVARSEL
For kvinder med ductal carcinoma in situ (DCIS) og kvinder med høj risiko for brystkræft: Alvorlige og livstruende hændelser forbundet med NOLVADEX (tamoxifencitrat) i risikoreduktionsmiljøet (kvinder med høj risiko for kræft og kvinder med DCIS) omfatter uterusmaligniteter, slagtilfælde og lungeemboli. Incidensrater for disse hændelser blev estimeret ud fra NSABP P-1-studiet (se KLINISK FARMAKOLOGI-Kliniske undersøgelser - Reduktion i forekomst af brystkræft hos højrisikokvinder ). Uterin malignitet består af både endometrielt adenokarcinom (incidensrate pr. 1.000 kvindeår på 2,20 for NOLVADEX (tamoxifencitrat) vs 0,71 for placebo) og uterin sarkom (hyppighedsrate pr. placebo)*. For slagtilfælde var incidensraten pr. 1.000 kvindeår 1,43 for NOLVADEX (tamoxifencitrat) vs. 1,00 for placebo**. For lungeemboli var incidensraten pr. 1.000 kvindeår 0,75 for NOLVADEX (tamoxifencitrat) versus 0,25 for placebo**.
Nogle af slagtilfældene, lungeembolierne og uterine maligniteter var dødelige.
Sundhedsudbydere bør diskutere de potentielle fordele versus de potentielle risici ved disse alvorlige hændelser med kvinder med høj risiko for brystkræft og kvinder med DCIS, der overvejer NOLVADEX (tamoxifencitrat) for at reducere deres risiko for at udvikle brystkræft.
Fordelene ved NOLVADEX (tamoxifencitrat) opvejer dets risici hos kvinder, der allerede er diagnosticeret med brystkræft.
REFERENCER
*Opdaterede langtidsopfølgningsdata (median opfølgningslængde er 6,9 år) fra NSABP P-1 undersøgelse. Se ADVARSLER: Virkninger på uterus-endometriecancer og livmodersarkom .
**Se tabel 3 under KLINISK FARMAKOLOGI-Kliniske undersøgelser .
BESKRIVELSE
NOLVADEX® (tamoxifencitrat) tabletter, et ikke-steroidt antiøstrogen, er til oral administration. NOLVADEX (tamoxifencitrat) tabletter fås som:
10 mg tabletter
Hver tablet indeholder 15,2 mg tamoxifencitrat, hvilket svarer til 10 mg tamoxifen.
20 mg tabletter
Hver tablet indeholder 30,4 mg tamoxifencitrat, hvilket svarer til 20 mg tamoxifen.
Inaktive ingredienser: carboxymethylcellulose calcium, magnesiumstearat, mannitol og stivelse.
Kemisk er NOLVADEX (tamoxifencitrat) trans-isomeren af et triphenylethylenderivat. Det kemiske navn er (Z)2-[4-(1,2-diphenyl-1-butenyl)phenoxy]-N,N-dimethylethanamin 2-hydroxy-1,2,3-propanetricarboxylat (1:1). De strukturelle og empiriske formler er:
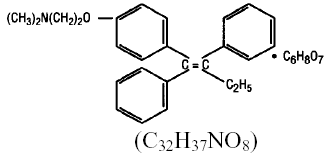
Tamoxifencitrat har en molekylvægt på 563,62, pKa' er 8,85, ligevægtsopløseligheden i vand ved 37°C er 0,5 mg/ml og i 0,02 N HCl ved 37°C er den 0,2 mg/ml.
INDIKATIONER
Metastatisk brystkræft
NOLVADEX (tamoxifencitrat) er effektiv til behandling af metastatisk brystkræft hos kvinder og mænd. Hos præmenopausale kvinder med metastatisk brystkræft er NOLVADEX (tamoxifencitrat) et alternativ til ooforektomi eller ovariebestråling. Tilgængelig dokumentation indikerer, at patienter, hvis tumorer er østrogenreceptorpositive, er mere tilbøjelige til at få gavn af NOLVADEX (tamoxifencitrat)-behandling.
Adjuverende behandling af brystkræft
NOLVADEX (tamoxifencitrat) er indiceret til behandling af nodepositiv brystkræft hos kvinder efter total mastektomi eller segmental mastektomi, aksillær dissektion og brystbestråling. I nogle NOLVADEX (tamoxifencitrat) adjuvansundersøgelser har størstedelen af fordelene til dato været i undergruppen med fire eller flere positive aksillære knuder.
NOLVADEX (tamoxifencitrat) er indiceret til behandling af aksillær node-negativ brystkræft hos kvinder efter total mastektomi eller segmental mastektomi, aksillær dissektion og brystbestråling.
Østrogen- og progesteronreceptorværdierne kan hjælpe med at forudsige, om adjuverende NOLVADEX-behandling (tamoxifencitrat) sandsynligvis vil være gavnlig.
NOLVADEX (tamoxifencitrat) reducerer forekomsten af kontralateral brystkræft hos patienter, der får adjuverende NOLVADEX (tamoxifencitrat)-behandling til brystkræft.
Ductal Carcinoma in Situ (DCIS)
Hos kvinder med DCIS er NOLVADEX (tamoxifencitrat) efter brystkirurgi og stråling indiceret til at reducere risikoen for invasiv brystkræft (se KASSET ADVARSEL i begyndelsen af etiketten). Beslutningen om behandling med NOLVADEX (tamoxifencitrat) for at reducere forekomsten af brystkræft bør baseres på en individuel vurdering af fordele og risici ved NOLVADEX (tamoxifencitrat)-behandling.
Aktuelle data fra kliniske forsøg understøtter fem års adjuverende NOLVADEX-behandling (tamoxifencitrat) til patienter med brystkræft.
Reduktion i forekomsten af brystkræft hos højrisikokvinder
NOLVADEX (tamoxifencitrat) er indiceret til at reducere forekomsten af brystkræft hos kvinder med høj risiko for brystkræft. Denne effekt blev vist i et studie af 5 års planlagt varighed med en median opfølgning på 4,2 år. Femogtyve procent af deltagerne fik medicin i 5 år. De langsigtede virkninger kendes ikke. I denne undersøgelse var der ingen indvirkning af tamoxifen på den samlede eller brystkræftrelateret dødelighed (se KASSET ADVARSEL i begyndelsen af etiketten).
NOLVADEX (tamoxifencitrat) er kun indiceret til højrisikokvinder. "Høj risiko" er defineret som kvinder på mindst 35 år med en 5-års forudsagt risiko for brystkræft ≥ 1,67 %, som beregnet af Gail-modellen.
Eksempler på kombinationer af faktorer, der forudsiger en 5-års risiko ≥ 1,67 % er:
Alder 35 eller ældre og en af følgende kombinationer af faktorer:
- En første grads slægtning med en historie med brystkræft, 2 eller flere godartede biopsier og en anamnese med en brystbiopsi, der viser atypisk hyperplasi; eller
- Mindst 2 førstegradsslægtninge med en historie med brystkræft og en personlig historie med mindst én brystbiopsi; eller
- LCIS
Alder 40 eller ældre og en af følgende kombinationer af faktorer:
- En første grads slægtning med en historie med brystkræft, 2 eller flere benigne biopsier, alder ved første levende fødsel 25 eller ældre, og alder ved menarche 11 eller yngre; eller
- Mindst 2 første grads slægtninge med en historie med brystkræft og alder ved første levende fødsel 19 eller yngre; eller
- En første grads slægtning med en historie med brystkræft og en personlig historie med en brystbiopsi, der viser atypisk hyperplasi.
Alder 45 eller ældre og en af følgende kombinationer af faktorer:
- Mindst 2 førstegradsslægtninge med en historie med brystkræft og alder ved første levende fødsel 24 år eller yngre; eller
- En første grads slægtning med en historie med brystkræft med en personlig historie med en godartet brystbiopsi, alder ved menarche 11 eller derunder og alder ved første levende fødsel 20 eller mere.
Alder 50 eller ældre og en af følgende kombinationer af faktorer:
- Mindst 2 førstegradsslægtninge med en historie med brystkræft; eller
- Anamnese med en brystbiopsi, der viser atypisk hyperplasi, og alder ved første levende fødsel 30 eller ældre og alder ved menarche 11 eller derunder; eller
- Anamnese med mindst to brystbiopsier med en historie med atypisk hyperplasi og alder ved første levende fødsel 30 eller mere.
Alder 55 eller ældre og en af følgende kombinationer af faktorer:
- En førstegradsslægtning med en historie med brystkræft med en personlig historie med en godartet brystbiopsi og alder ved menarche 11 eller derunder; eller
- Anamnese med mindst 2 brystbiopsier med en historie med atypisk hyperplasi og alder ved første levende fødsel 20 eller ældre.
Alder 60 eller ældre og:
- 5-års forudsagt risiko for brystkræft ≥ 1,67 %, som beregnet af Gail-modellen.
For kvinder, hvis risikofaktorer ikke er beskrevet i ovenstående eksempler, er Gail-modellen nødvendig for at estimere den absolutte risiko for brystkræft. Sundhedspersonale kan få et Gail Model Risk Assessment Tool ved at ringe til 1-800-544-2007.
Der er utilstrækkelige data tilgængelige vedrørende effekten af NOLVADEX (tamoxifencitrat) på brystkræftforekomsten hos kvinder med arvelige mutationer (BRCA1, BRCA2) til at kunne give specifikke anbefalinger om effektiviteten af NOLVADEX (tamoxifencitrat) hos disse patienter.
Efter en vurdering af risikoen for at udvikle brystkræft bør beslutningen om behandling med NOLVADEX (tamoxifencitrat) til reduktion af brystcancerforekomsten baseres på en individuel vurdering af fordele og risici ved NOLVADEX (tamoxifencitrat)-behandling. I NSABP P-1-studiet sænkede behandling med NOLVADEX (tamoxifencitrat) risikoen for at udvikle brystkræft under forsøgets opfølgningsperiode, men eliminerede ikke risikoen for brystkræft (se tabel 3 i KLINISK FARMAKOLOGI ).
DOSERING OG ADMINISTRATION
For patienter med brystkræft er den anbefalede daglige dosis 20-40 mg. Doser større end 20 mg dagligt bør gives i opdelte doser (morgen og aften).
tre enkeltstof-adjuverende undersøgelser af kvinder blev en 10 mg NOLVADEX (tamoxifencitrat)-tablet administreret to (ECOG og NATO) eller tre (Toronto) gange dagligt i to år. I NSABP B-14 adjuverende undersøgelse med kvinder med node-negativ brystkræft blev der givet én 10 mg NOLVADEX (tamoxifencitrat) tablet to gange dagligt i mindst 5 år. Resultaterne af B-14-undersøgelsen tyder på, at fortsættelse af behandlingen ud over fem år ikke giver yderligere fordele (se KLINISK FARMAKOLOGI ). I EBCTCG 1995-oversigten var reduktionen i recidiv og dødelighed større i de undersøgelser, der brugte tamoxifen i omkring 5 år, end i dem, der brugte tamoxifen i en kortere behandlingsperiode. Der var ingen indikation af, at doser større end 20 mg pr. dag var mere effektive. Aktuelle data fra kliniske forsøg understøtter 5 års adjuverende NOLVADEX (tamoxifencitrat) behandling til patienter med brystkræft.
Ductal Carcinoma in Situ (DCIS)
Den anbefalede dosis er NOLVADEX (tamoxifencitrat) 20 mg dagligt i 5 år.
Reduktion i forekomsten af brystkræft hos højrisikokvinder
Den anbefalede dosis er NOLVADEX (tamoxifencitrat) 20 mg dagligt i 5 år. Der er ingen data til støtte for brugen af NOLVADEX (tamoxifencitrat) ud over 5 år (se KLINISK FARMAKOLOGI-Kliniske undersøgelser - Reduktion i forekomst af brystkræft hos højrisikokvinder ).
HVORDAN LEVERET
10 mg tabletter indeholdende tamoxifen som citrat i en mængde svarende til 10 mg tamoxifen (rund, bikonveks, uovertrukket, hvid tablet identificeret med NOLVADEX (tamoxifencitrat) 600 præget på den ene side og en cameo præget på den anden side) leveres i flasker med 60 stk. tabletter. NDC 0310-0600-60.
20 mg tabletter indeholdende tamoxifen som citrat i en mængde svarende til 20 mg tamoxifen (rund, bikonveks, uovertrukket, hvid tablet identificeret med NOLVADEX (tamoxifencitrat) 604 præget på den ene side og en cameo præget på den anden side) leveres i flasker med 30 stk. tabletter. NDC 0310-0604-30.
Opbevares ved kontrolleret stuetemperatur, 20-25°C (68-77°F) [se USP]. Dispenser i en godt lukket, lysbestandig beholder.
*Coumadin® er et registreret varemærke tilhørende Bristol-Myers Squibb Pharmaceuticals. Alle andre varemærker tilhører AstraZeneca-gruppen, AstraZeneca Pharmaceuticals LP Wilmington, Delaware 19850-5437. Rev 27-09-05. FDA revisionsdato: 3/9/2006
BIVIRKNINGER
Bivirkninger af NOLVADEX (tamoxifencitrat) er relativt milde og sjældent alvorlige nok til at kræve afbrydelse af behandlingen hos brystkræftpatienter.
Fortsatte kliniske undersøgelser har resulteret i yderligere information, som bedre indikerer forekomsten af bivirkninger med NOLVADEX (tamoxifencitrat) sammenlignet med placebo.
Metastatisk brystkræft
Øget knogle- og tumorsmerter og også lokal sygdomsopblussen er forekommet, som nogle gange er forbundet med en god tumorrespons. Patienter med øget knoglesmerter kan have behov for yderligere analgetika. Patienter med bløddelssygdomme kan have pludselige stigninger i størrelsen af allerede eksisterende læsioner, nogle gange forbundet med markant erytem i og omkring læsionerne og/eller udvikling af nye læsioner. Når de opstår, ses knoglesmerten eller sygdomsopblussen kort efter start af NOLVADEX (tamoxifencitrat) og aftager generelt hurtigt.
Hos patienter, der behandles med NOLVADEX (tamoxifencitrat) for metastatisk brystkræft, er den hyppigste bivirkning af NOLVADEX (tamoxifencitrat) hedeture.
Andre bivirkninger, som ses sjældent, er hypercalcæmi, perifert ødem, afsky for mad, pruritus vulvae, depression, svimmelhed, svimmelhed, hovedpine, hårudtynding og/eller delvist hårtab og vaginal tørhed.
Præmenopausale kvinder
Følgende tabel opsummerer forekomsten af bivirkninger rapporteret med en frekvens på 2 % eller mere fra kliniske forsøg (Ingle, Pritchard, Buchanan), som sammenlignede NOLVADEX (tamoxifencitrat)-behandling med ovarieablation hos præmenopausale patienter med metastatisk brystkræft.
Mandlig brystkræft
NOLVADEX (tamoxifencitrat) tolereres godt hos mænd med brystkræft. Rapporter fra litteraturen og case-rapporter tyder på, at sikkerhedsprofilen for NOLVADEX (tamoxifencitrat) hos mænd svarer til den, der ses hos kvinder. Tab af libido og impotens har resulteret i seponering af tamoxifenbehandling hos mandlige patienter. Også hos oligospermiske mænd behandlet med tamoxifen var LH, FSH, testosteron og østrogen niveauer forhøjede. Ingen signifikante kliniske ændringer blev rapporteret.
Adjuverende brystkræft
NSABP B-14-studiet blev kvinder med aksillær node-negativ brystkræft randomiseret til 5 års NOLVADEX (tamoxifencitrat) 20 mg/dag eller placebo efter primær operation. De rapporterede bivirkninger er opstillet nedenfor (gennemsnitlig opfølgning på ca. 6,8 år), som viser bivirkninger mere almindelige på NOLVADEX (tamoxifencitrat) end på placebo. Forekomsten af hedeture (64 % vs. 48 %), vaginalt udflåd (30 % vs. 15 %) og uregelmæssig menstruation (25 % vs. 19 %) var højere med NOLVADEX (tamoxifencitrat) sammenlignet med placebo. Alle andre bivirkninger forekom med lignende hyppighed i de 2 behandlingsgrupper, med undtagelse af trombotiske hændelser; en højere forekomst blev set hos NOLVADEX (tamoxifencitrat)-behandlede patienter (gennem 5 år, 1,7 % vs. 0,4 %). To af patienterne behandlet med NOLVADEX (tamoxifencitrat), som havde trombotiske hændelser, døde.
Eastern Cooperative Oncology Group (ECOG) adjuverende brystkræftforsøg blev NOLVADEX (tamoxifencitrat) eller placebo administreret i 2 år til kvinder efter mastektomi. Sammenlignet med placebo viste NOLVADEX (tamoxifencitrat) en signifikant højere forekomst af hedeture (19 % vs. 8 % for placebo). Incidensen af alle andre bivirkninger var ens i de 2 behandlingsgrupper med undtagelse af trombocytopeni, hvor incidensen for NOLVADEX (tamoxifencitrat) var 10 % vs. 3 % for placebo, en observation af statistisk signifikans på grænsen.
andre adjuverende undersøgelser, Toronto og NOLVADEX (tamoxifencitrat) Adjuverende forsøgsorganisation (NATO), modtog kvinder enten NOLVADEX (tamoxifencitrat) eller ingen behandling. I Toronto-undersøgelsen blev der observeret hedeture hos 29 % af patienterne for NOLVADEX (tamoxifencitrat) vs. 1 % i den ubehandlede gruppe. I NATO-forsøget blev hedeture og vaginal blødning rapporteret hos henholdsvis 2,8 % og 2,0 % af kvinderne for NOLVADEX (tamoxifencitrat) mod 0,2 % for hver i den ubehandlede gruppe.
Anastrozol-adjuverende forsøg - Undersøgelse af anastrozol sammenlignet med NOLVADEX (tamoxifencitrat) til adjuverende behandling af tidlig brystkræft (se KLINISK FARMAKOLOGI - kliniske undersøgelser).
Ved en median opfølgning på 33 måneder viste kombinationen af anastrozol og NOLVADEX (tamoxifencitrat) ingen effektfordel sammenlignet med NOLVADEX (tamoxifencitrat)-behandling givet alene hos alle patienter såvel som i den hormonreceptorpositive subpopulation. Denne behandlingsarm blev afbrudt fra forsøget. Medianvarigheden af adjuverende behandling til sikkerhedsevaluering var 59,8 måneder og 59,6 måneder for patienter, der fik henholdsvis anastrozol 1 mg og NOLVADEX (tamoxifencitrat) 20 mg.
Bivirkninger, der forekommer med en forekomst på mindst 5 % i begge behandlingsgrupper under behandlingen eller inden for 14 dage efter behandlingens afslutning, er vist i følgende tabel.
Bivirkninger, der forekommer med en forekomst på mindst 5 % i begge behandlingsgrupper under behandlingen eller inden for 14 dage efter behandlingens afslutning
Visse bivirkninger og kombinationer af bivirkninger blev prospektivt specificeret til analyse baseret på de kendte farmakologiske egenskaber og bivirkningsprofiler for de to lægemidler (se følgende tabel).
Antal (%) af patienter med forudspecificeret bivirkning i anastrozol-adjuverende forsøg1
Patienter, der fik anastrozol, havde en stigning i ledlidelser (herunder arthritis, artrose og artralgi) sammenlignet med patienter, der fik NOLVADEX (tamoxifencitrat). Patienter, der fik anastrozol, havde en stigning i forekomsten af alle frakturer (specifikt brud på rygsøjlen, hoften og håndleddet) [315 (10%)] sammenlignet med patienter, der fik NOLVADEX (tamoxifencitrat) [209 (7%)]. Patienter, der fik anastrozol, havde et fald i hedeture, vaginal blødning, vaginalt udflåd, endometriecancer, venøse tromboemboliske hændelser og iskæmiske cerebrovaskulære hændelser sammenlignet med patienter, der fik NOLVADEX (tamoxifencitrat).
Patienter, der fik NOLVADEX (tamoxifencitrat), havde et fald i hyperkolesterolæmi (108 [3,5 %) sammenlignet med patienter, der fik anastrozol (278 [9 %)). Angina pectoris blev rapporteret hos 71 [2,3 %] patienter i anastrozol-armen og 51 [1,6 %] patienter i NOLVADEX-armen (tamoxifencitrat); myokardieinfarkt blev rapporteret hos 37 [1,2 %] patienter i anastrozol-armen og hos 34 [1,1 %] patienter i NOLVADEX-armen (tamoxifencitrat).
Resultater fra adjuverende knoglesubstudiet efter 12 og 24 måneder viste, at patienter, der fik anastrozol, havde et gennemsnitligt fald i både lændehvirvelsøjlen og total hofteknoglemineraltæthed (BMD) sammenlignet med baseline. Patienter, der fik NOLVADEX (tamoxifencitrat), havde en gennemsnitlig stigning i både lændehvirvelsøjlen og total hofte-BMD sammenlignet med baseline.
Ductal Carcinoma in Situ (DCIS)
Typen og hyppigheden af uønskede hændelser i NSABP B-24-studiet var i overensstemmelse med dem, der blev observeret i de andre adjuvans-forsøg udført med NOLVADEX (tamoxifencitrat).
Reduktion i forekomsten af brystkræft hos højrisikokvinder
NSABP P-1-studiet var der en stigning i fem alvorlige bivirkninger i NOLVADEX-gruppen (tamoxifencitrat): endometriecancer (33 tilfælde i NOLVADEX-gruppen (tamoxifencitrat) mod 14 i placebogruppen); lungeemboli (18 tilfælde i NOLVADEX-gruppen (tamoxifencitrat) mod 6 i placebogruppen); dyb venetrombose (30 tilfælde i NOLVADEX-gruppen (tamoxifencitrat) mod 19 i placebogruppen); slagtilfælde (34 tilfælde i NOLVADEX-gruppen (tamoxifencitrat) mod 24 i placebogruppen); kataraktdannelse (540 tilfælde i NOLVADEX (tamoxifencitrat)-gruppen mod 483 i placebogruppen) og grå stærkirurgi (101 tilfælde i NOLVADEX (tamoxifencitrat)-gruppen mod 63 i placebogruppen) (Se ADVARSLER og tabel 3 in KLINISK FARMAKOLOGI ).
Følgende tabel viser de bivirkninger, der er observeret i NSABP P-1 efter behandlingsarm. Kun bivirkninger, der er mere almindelige på NOLVADEX (tamoxifencitrat) end placebo, er vist.
NSABP P-1-studiet trak 15,0 % og 9,7 % af deltagerne, der fik henholdsvis NOLVADEX (tamoxifencitrat) og placebobehandling, sig fra forsøget af medicinske årsager. Følgende er de medicinske årsager til at trække sig fra henholdsvis NOLVADEX (tamoxifencitrat) og placebobehandling: Hedeture (3,1 % mod 1,5 %) og vaginalt udflåd (0,5 % vs. 0,1 %).
I NSABP P-1-studiet trak 8,7 % og 9,6 % af deltagerne, der fik henholdsvis NOLVADEX (tamoxifencitrat) og placebo-behandling, af ikke-medicinske årsager.
NSABP P-1 forsøget forekom hedeture af enhver sværhedsgrad hos 68 % af kvinderne på placebo og hos 80 % af kvinderne på NOLVADEX (tamoxifencitrat). Alvorlige hedeture forekom hos 28 % af kvinderne på placebo og 45 % af kvinderne på NOLVADEX (tamoxifencitrat). Vaginalt udflåd forekom hos 35 % og 55 % af kvinderne på henholdsvis placebo og NOLVADEX (tamoxifencitrat); og var alvorlig hos henholdsvis 4,5 % og 12,3 %. Der var ingen forskel i forekomsten af vaginal blødning mellem behandlingsarme.
Pædiatriske patienter - McCune-Albright syndrom
Det gennemsnitlige uterusvolumen steg efter 6 måneders behandling og fordobledes ved afslutningen af det etårige studie. En årsagssammenhæng er ikke fastslået; dog er der observeret en stigning i forekomsten af endometrieadenokarcinom og uterin sarkom hos voksne behandlet med NOLVADEX (se KASSET ADVARSEL ), anbefales fortsat overvågning af McCune-Albright-patienter behandlet med NOLVADEX (tamoxifencitrat) for langtidsvirkninger. Sikkerheden og effekten af NOLVADEX (tamoxifencitrat) til piger i alderen to til 10 år med McCune-Albright syndrom og tidlig pubertet er ikke blevet undersøgt efter et års behandling. Langtidsvirkningerne af NOLVADEX (tamoxifencitrat) behandling hos piger er ikke blevet fastlagt.
Postmarketing oplevelse
Mindre hyppigt rapporterede bivirkninger er vaginal blødning, vaginalt udflåd, menstruationsuregelmæssigheder, hududslæt og hovedpine. Disse har normalt ikke været af tilstrækkelig sværhedsgrad til at kræve dosisreduktion eller seponering af behandlingen. Meget sjældne rapporter om erythema multiforme, Stevens-Johnsons syndrom, bulløs pemfigoid, interstitiel pneumonitis og sjældne rapporter om overfølsomhedsreaktioner inklusive angioødem er blevet rapporteret ved behandling med NOLVADEX (tamoxifencitrat). I nogle af disse tilfælde var det mere end et år, før det begyndte. Sjældent kan forhøjede serumtriglyceridniveauer, i nogle tilfælde med pancreatitis, være forbundet med brugen af NOLVADEX (tamoxifencitrat) (se FORHOLDSREGLER- Interaktioner med lægemiddel/laboratorietest afsnit).
DRUGSINTERAKTIONER
Når NOLVADEX (tamoxifencitrat) anvendes i kombination med antikoagulantia af coumarin-typen, kan der forekomme en signifikant forøgelse af den antikoagulerende virkning. Hvor en sådan samtidig administration findes, anbefales omhyggelig monitorering af patientens protrombintid.
I NSABP P-1-studiet var kvinder, der af en eller anden grund havde brug for antikoagulantia af coumarin-typen, ikke kvalificerede til at deltage i forsøget (se KONTRAINDIKATIONER ).
Der er en øget risiko for tromboemboliske hændelser, når cytotoksiske midler anvendes i kombination med NOLVADEX (tamoxifencitrat).
Tamoxifen reducerede letrozol plasmakoncentrationer med 37%. Effekten af tamoxifen på metabolisme og udskillelse af andre antineoplastiske lægemidler, såsom cyclophosphamid og andre lægemidler, der kræver blandede oxidaser for aktivering, er ikke kendt. Tamoxifen og N-desmethyl tamoxifen plasmakoncentrationer har vist sig at blive reduceret, når de administreres sammen med rifampin eller aminoglutethimid. Induktion af CYP3A4-medieret metabolisme anses for at være den mekanisme, hvorved disse reduktioner forekommer; andre CYP3A4-inducerende midler er ikke blevet undersøgt for at bekræfte denne effekt.
En patient, der fik NOLVADEX (tamoxifencitrat) sammen med phenobarbital, udviste et steady state serumniveau af tamoxifen, der var lavere end det, der blev observeret for andre patienter (dvs. 26 ng/ml vs. middelværdi på 122 ng/ml). Den kliniske betydning af dette fund kendes dog ikke. Rifampin inducerede metabolismen af tamoxifen og reducerede signifikant plasmakoncentrationerne af tamoxifen hos 10 patienter. Aminoglutethimid reducerer plasmakoncentrationerne af tamoxifen og N-desmethyltamoxifen. Medroxyprogesteron reducerer plasmakoncentrationer af N-desmethyl, men ikke tamoxifen.
Samtidig bromocriptinbehandling har vist sig at hæve serumtamoxifen og N-desmethyltamoxifen.
Baseret på kliniske og farmakokinetiske resultater fra anastrozol-adjuverende forsøg, bør NOLVADEX (tamoxifencitrat) ikke administreres sammen med anastrozol (se KLINISK FARMAKOLOGI - Lægemiddel-lægemiddelinteraktioner afsnit).
Interaktioner med lægemiddel/laboratorietest
Under postmarketing-overvågning blev T4-stigninger rapporteret for nogle få postmenopausale patienter, hvilket kan forklares med stigninger i thyreoidea-bindende globulin. Disse stigninger var ikke ledsaget af klinisk hyperthyroidisme.
Variationer i det karyopyknotiske indeks på vaginale smears og forskellige grader af østrogeneffekt på Pap smears er sjældent set hos postmenopausale patienter, der har fået NOLVADEX (tamoxifencitrat).
Efter markedsføringen af NOLVADEX (tamoxifencitrat) er der rapporteret sjældne tilfælde af hyperlipidæmi. Periodisk monitorering af plasmatriglycerider og kolesterol kan være indiceret hos patienter med allerede eksisterende hyperlipidæmi (se BIVIRKNINGER - Postmarketing-oplevelse afsnit).
ADVARSLER
Virkninger hos patienter med metastaserende brystkræft
Som med anden additiv hormonbehandling (østrogener og androgener) er hypercalcæmi blevet rapporteret hos nogle brystkræftpatienter med knoglemetastaser inden for et par uger efter start af behandling med NOLVADEX (tamoxifencitrat). Hvis der opstår hypercalcæmi, skal passende foranstaltninger træffes, og hvis det er alvorligt, bør NOLVADEX (tamoxifencitrat) seponeres.
Virkninger på uterus-endometriecancer og livmodersarkom
En øget forekomst af uterine maligniteter er blevet rapporteret i forbindelse med NOLVADEX (tamoxifencitrat) behandling. Den underliggende mekanisme er ukendt, men kan være relateret til den østrogenlignende virkning af NOLVADEX (tamoxifencitrat). De fleste uterine maligniteter set i forbindelse med NOLVADEX (tamoxifencitrat) er klassificeret som adenokarcinom i endometriet. Sjældne livmodersarkomer, herunder maligne blandede mullerian tumorer (MMMT), er dog også blevet rapporteret. Uterin sarkom er generelt forbundet med et højere FIGO-stadium (III/IV) ved diagnose, dårligere prognose og kortere overlevelse. Uterin sarkom er blevet rapporteret at forekomme hyppigere blandt langtidsbrugere (≥ 2 år) af NOLVADEX (tamoxifencitrat) end ikke-brugere. Nogle af de uterine maligniteter (endometriekarcinom eller livmodersarkom) har været dødelige.
NSABP P-1 forsøget var der blandt deltagere randomiseret til NOLVADEX (tamoxifencitrat) en statistisk signifikant stigning i forekomsten af endometriecancer (33 tilfælde af invasiv endometriecancer sammenlignet med 14 tilfælde blandt deltagere randomiseret til placebo (RR=2,48) , 95 % CI: 1,27-4,92). De 33 tilfælde hos deltagere, der modtog NOLVADEX (tamoxifencitrat), var FIGO-stadie I, inklusive 20 IA, 12 IB og 1 IC endometriale adenokarcinomer. Hos deltagere randomiseret til placebo var Stage I FIGO (8 IA og 5 IB) og 1 var FIGO Stage IV. Fem kvinder på NOLVADEX (tamoxifencitrat) og 1 på placebo modtog postoperativ strålebehandling ud over operation. Denne stigning blev primært observeret blandt kvinder på mindst 50 år ved tidspunkt for randomisering (26 tilfælde af invasiv endometriecancer sammenlignet med 6 tilfælde blandt deltagere randomiseret til placebo (RR=4,50, 95 % CI: 1,78-13,16). Blandt kvinder ≤ 49 år på randomiseringstidspunktet var der 7 tilfælde af i nvasiv endometriecancer sammenlignet med 8 tilfælde blandt deltagere randomiseret til placebo (RR=0,94, 95 % CI: 0,28-2,89). Hvis alderen på diagnosetidspunktet tages i betragtning, var der 4 tilfælde af endometriecancer blandt deltagere ≤ 49 randomiseret til NOLVADEX (tamoxifencitrat) sammenlignet med 2 blandt deltagere randomiseret til placebo (RR=2,21, 95 % CI: 0,4-12,0). For kvinder ≥ 50 på diagnosetidspunktet var der 29 tilfælde blandt deltagere randomiseret til NOLVADEX (tamoxifencitrat) sammenlignet med 12 blandt kvinder på placebo (RR=2,5, 95 % CI: 1,3-4,9). Risikoforholdet var ens i de to grupper, selvom der forekom færre hændelser hos yngre kvinder. De fleste (29 ud af 33 tilfælde i NOLVADEX (tamoxifen citrat) gruppen) endometriecancer blev diagnosticeret hos symptomatiske kvinder, selvom 5 ud af 33 tilfælde i NOLVADEX (tamoxifen citrat) gruppen forekom hos asymptomatiske kvinder. Blandt kvinder, der fik NOLVADEX (tamoxifencitrat), forekom hændelserne mellem 1 og 61 måneder (gennemsnit=32 måneder) fra behandlingens start.
en opdateret gennemgang af langtidsdata (median længde af total opfølgning er 6,9 år, inklusive blindet opfølgning) på 8.306 kvinder med en intakt livmoder ved randomisering i NSABP P-1 risikoreduktionsforsøg, viser forekomsten af begge adenokarcinomer og sjældne livmodersarkomer var øget hos kvinder, der tog NOLVADEX (tamoxifencitrat). Under blindet opfølgning var der 36 tilfælde af FIGO Stage I endometrielt adenokarcinom (22 var FIGO Stage IA, 13 IB og 1 IC) hos kvinder, der fik NOLVADEX (tamoxifencitrat) og 15 tilfælde hos kvinder, der fik placebo [14 var FIGO Stage I (9 IA og 5 IB), og 1 tilfælde var FIGO Stage IV]. Af de patienter, der fik NOLVADEX (tamoxifencitrat), og som udviklede endometriecancer, modtog en med trin IA og 4 med kræft i stadium IB strålebehandling. I placebogruppen modtog en patient med FIGO Stage 1B cancer strålebehandling og patienten med FIGO Stage IVB cancer modtog kemoterapi og hormonbehandling. Under total opfølgning blev endometrielt adenokarcinom rapporteret hos 53 kvinder randomiseret til NOLVADEX (tamoxifencitrat) (30 tilfælde af FIGO trin IA, 20 var trin IB, 1 var trin IC, og 2 var trin IIIC), og 17 kvinder randomiseret til placebo (9 tilfælde var FIGO trin IA, 6 var trin IB, 1 var trin IIIC, og 1 var trin IVB) (hyppighed pr. 1.000 kvindeår på henholdsvis 2,20 og 0,71). Nogle patienter fik postoperativ strålebehandling udover operation. Uterus sarkomer blev rapporteret hos 4 kvinder randomiseret til NOLVADEX (tamoxifencitrat) (1 var FIGO IA, 1 var FIGO IB, 1 var FIGO IIA og 1 var FIGO IIIC) og en patient randomiseret til placebo (FIGO 1A); incidens pr. 1.000 kvindeår på henholdsvis 0,17 og 0,04. Af patienterne randomiseret til NOLVADEX (tamoxifencitrat) var FIGO IA- og IB-tilfældene henholdsvis MMMT og sarkom; FIGO II var en MMMT; og FIGO III var et sarkom; og den ene patient randomiseret til placebo havde en MMMT. En tilsvarende øget forekomst af endometrie-adenokarcinom og uterin-sarkom blev observeret blandt kvinder, der fik NOLVADEX (tamoxifencitrat) i fem andre kliniske NSABP-undersøgelser.
Enhver patient, der modtager eller tidligere har modtaget NOLVADEX (tamoxifencitrat), og som rapporterer unormal vaginal blødning, bør omgående evalueres. Patienter, der modtager eller tidligere har modtaget NOLVADEX (tamoxifencitrat), skal have årlige gynækologiske undersøgelser, og de skal straks informere deres læger, hvis de oplever unormale gynækologiske symptomer, f.eks. tryk.
I P-1-studiet ændrede endometrieprøvetagning ikke påvisningshastigheden for endometriecancer sammenlignet med kvinder, der ikke gennemgik endometrieprøvetagning (0,6 % med prøvetagning, 0,5 % uden prøvetagning) for kvinder med en intakt livmoder. Der er ingen data, der tyder på, at rutinemæssig endometrieprøvetagning hos asymptomatiske kvinder, der tager NOLVADEX (tamoxifencitrat) for at reducere forekomsten af brystkræft, ville være gavnlig.
Ikke-maligne virkninger på livmoderen
En øget forekomst af endometrieforandringer inklusive hyperplasi og polypper er blevet rapporteret i forbindelse med behandling med NOLVADEX (tamoxifencitrat). Forekomsten og mønsteret af denne stigning tyder på, at den underliggende mekanisme er relateret til de østrogene egenskaber af NOLVADEX (tamoxifencitrat).
Der har været enkelte rapporter om endometriose og uterusfibromer hos kvinder, der fik NOLVADEX (tamoxifencitrat). Den underliggende mekanisme kan skyldes den delvise østrogene virkning af NOLVADEX (tamoxifencitrat). Ovariecyster er også blevet observeret hos et lille antal præmenopausale patienter med fremskreden brystkræft, som er blevet behandlet med NOLVADEX (tamoxifencitrat).
NOLVADEX (tamoxifencitrat) er blevet rapporteret at forårsage uregelmæssig menstruation eller amenoré.
Tromboemboliske virkninger af NOLVADEX (tamoxifencitrat)
Der er tegn på en øget forekomst af tromboemboliske hændelser, herunder dyb venetrombose og lungeemboli, under NOLVADEX (tamoxifencitrat) behandling. Når NOLVADEX (tamoxifencitrat) administreres sammen med kemoterapi, kan der være en yderligere stigning i forekomsten af tromboemboliske virkninger. Til behandling af brystkræft bør risici og fordele ved NOLVADEX (tamoxifencitrat) nøje overvejes hos kvinder med en historie med tromboemboliske hændelser. I en lille delundersøgelse (N=81) af NSABP P-1-studiet, så det ud til, at der ikke var nogen fordel ved at screene kvinder for faktor V Leiden og protrombinmutationer G20210A som et middel til at identificere dem, der måske ikke er passende kandidater til NOLVADEX (tamoxifen) citrat) behandling.
Data fra NSABP P-1-studiet viser, at deltagere, der fik NOLVADEX (tamoxifencitrat) uden en historie med lungeemboli (PE), havde en statistisk signifikant stigning i lungeemboli (18-NOLVADEX (tamoxifencitrat), 6-placebo, RR=3,01 95% CI: 1,15-9,27). Tre af lungeembolierne, alle i NOLVADEX (tamoxifencitrat)-armen, var dødelige. 87 procent af tilfældene af lungeemboli forekom hos kvinder på mindst 50 år ved randomisering. Blandt kvinder, der fik NOLVADEX (tamoxifencitrat), forekom hændelserne mellem 2 og 60 måneder (gennemsnit = 27 måneder) fra behandlingens start.
denne samme population blev der set en ikke-statistisk signifikant stigning i dyb venetrombose (DVT) i NOLVADEX (tamoxifencitrat)-gruppen (30-NOLVADEX (tamoxifencitrat), 19-placebo; RR=1,59, 95% CI: 0,86 -2,98). Den samme stigning i relativ risiko blev set hos kvinder ≤ 49 og hos kvinder ≥ 50, selvom der forekom færre hændelser hos yngre kvinder. Kvinder med tromboemboliske hændelser var i risiko for en anden relateret hændelse (7 ud af 25 kvinder på placebo, 5 ud af 48 kvinder på NOLVADEX (tamoxifencitrat)) og var i risiko for komplikationer af hændelsen og dens behandling (0/25 på placebo, 4/48 på NOLVADEX (tamoxifencitrat) ). Blandt kvinder, der fik NOLVADEX (tamoxifencitrat), forekom dyb venetrombosehændelser mellem 2 og 57 måneder (gennemsnit=19 måneder) fra behandlingens start.
Der var en ikke-statistisk signifikant stigning i slagtilfælde blandt patienter randomiseret til NOLVADEX (tamoxifencitrat) (24-Placebo; 34-NOLVADEX (tamoxifencitrat); RR=1,42; 95 % CI 0,82-2,51). Seks af de 24 slagtilfælde i placebogruppen blev betragtet som hæmoragiske, og 10 af de 34 slagtilfælde i NOLVADEX-gruppen (tamoxifencitrat) blev kategoriseret som hæmoragiske. Sytten af de 34 slagtilfælde i NOLVADEX-gruppen (tamoxifencitrat) blev betragtet som okklusive, og 7 blev anset for at være af ukendt ætiologi. Fjorten af de 24 slagtilfælde på placeboarmen blev rapporteret at være okklusive og 4 af ukendt ætiologi. Blandt disse slagtilfælde var 3 slagtilfælde i placebogruppen og 4 slagtilfælde i NOLVADEX-gruppen (tamoxifencitrat) dødelige. 88 procent af slagtilfældene forekom hos kvinder, der var mindst 50 år gamle på randomiseringstidspunktet. Blandt kvinder, der fik NOLVADEX (tamoxifencitrat), forekom hændelserne mellem 1 og 63 måneder (gennemsnit=30 måneder) fra behandlingens start.
Virkninger på leveren: Leverkræft
I det svenske forsøg med adjuvans NOLVADEX (tamoxifencitrat) 40 mg/dag i 2-5 år er der rapporteret 3 tilfælde af levercancer i den NOLVADEX (tamoxifencitrat)-behandlede gruppe versus 1 tilfælde i observationsgruppen (se FORHOLDSREGLER- Kræftfremkaldende ). I andre kliniske undersøgelser, der evaluerer NOLVADEX (tamoxifencitrat), er der hidtil ikke rapporteret tilfælde af leverkræft.
Et tilfælde af leverkræft blev rapporteret i NSABP P-1 hos en deltager randomiseret til NOLVADEX (tamoxifencitrat).
Virkninger på leveren: Ikke-maligne virkninger
NOLVADEX (tamoxifencitrat) er blevet forbundet med ændringer i leverenzymniveauer og i sjældne tilfælde et spektrum af mere alvorlige leverabnormiteter, herunder fedtlever, kolestase, hepatitis og levernekrose. Nogle få af disse alvorlige tilfælde omfattede dødsfald. I de fleste rapporterede tilfælde er forholdet til NOLVADEX (tamoxifencitrat) usikkert. Der er dog rapporteret om nogle positive gen- og dechallenges.
I NSABP P-1 forsøget blev der observeret få grad 3-4 ændringer i leverfunktionen (SGOT, SGPT, bilirubin, alkalisk fosfatase) (10 på placebo og 6 på NOLVADEX (tamoxifencitrat)). Serumlipider blev ikke systematisk opsamlet.
Andre kræftformer
En række sekundære primære tumorer, der forekommer på andre steder end endometriet, er blevet rapporteret efter behandling af brystkræft med NOLVADEX (tamoxifencitrat) i kliniske forsøg. Data fra NSABP B-14 og P-1 undersøgelserne viser ingen stigning i andre (ikke-uterin) cancerformer blandt patienter, der får NOLVADEX (tamoxifencitrat). Hvorvidt en øget risiko for andre (ikke-uterine) kræftformer er forbundet med NOLVADEX (tamoxifencitrat) er stadig usikkert og vurderes fortsat.
Effekter på øjet
Øjenforstyrrelser, herunder hornhindeforandringer, fald i farvesynsopfattelsen, retinal venetrombose og retinopati er blevet rapporteret hos patienter, der fik NOLVADEX (tamoxifencitrat). En øget forekomst af grå stær og behov for operation af grå stær er blevet rapporteret hos patienter, der får NOLVADEX (tamoxifencitrat).
NSABP P-1 forsøget var en øget risiko for grænseoverskridende betydning for udvikling af grå stær blandt de kvinder uden grå stær ved baseline (540-NOLVADEX (tamoxifencitrat); 483-placebo; RR=1,13, 95 % CI: 1,00-1,28) observeret. Blandt disse samme kvinder var NOLVADEX (tamoxifencitrat) forbundet med en øget risiko for at få operation for grå stær (101-NOLVADEX (tamoxifencitrat); 63-placebo; RR=1,62, 95 % CI 1,18-2,22) (se tabel 3 i KLINISK FARMAKOLOGI ). Blandt alle kvinder i forsøget (med eller uden grå stær ved baseline) var NOLVADEX (tamoxifencitrat) forbundet med en øget risiko for at få operation for grå stær (201-NOLVADEX (tamoxifencitrat); 129-placebo; RR=1,58, 95 % CI 1,26-1,97). Øjenundersøgelser var ikke påkrævet under undersøgelsen. Der kan ikke drages andre konklusioner vedrørende oftalmiske hændelser uden katarakt.
Graviditetskategori D
NOLVADEX (tamoxifencitrat) kan forårsage fosterskader, når det administreres til en gravid kvinde. Kvinder bør rådes til ikke at blive gravide, mens de tager NOLVADEX (tamoxifencitrat) eller inden for 2 måneder efter seponering af NOLVADEX (tamoxifencitrat) og bør anvende barriere- eller ikke-hormonelle præventionsforanstaltninger, hvis de er seksuelt aktive. Tamoxifen forårsager ikke infertilitet, selv i nærværelse af menstruationsuregelmæssigheder. Effekter på reproduktive funktioner forventes ud fra lægemidlets antiøstrogene egenskaber. I reproduktionsstudier med rotter ved dosisniveauer svarende til eller under den humane dosis blev der set ikke-teratogene udviklingsmæssige skeletændringer, som blev fundet reversible. Derudover blev der i fertilitetsundersøgelser hos rotter og i teratologiske undersøgelser hos kaniner, hvor der blev anvendt doser på eller under dem, der blev brugt hos mennesker, observeret en lavere forekomst af embryoimplantation og en højere forekomst af fosterdød eller forsinket vækst i utero, med langsommere indlæringsadfærd hos nogle rotteunger sammenlignet med historiske kontroller. Adskillige drægtige silkeaber blev doseret med 10 mg/kg/dag (ca. 2 gange den daglige maksimale anbefalede humane dosis på mg/m²-basis) under organogenese eller i sidste halvdel af graviditeten. Der blev ikke set nogen deformationer, og selvom dosis var høj nok til at afbryde drægtighed hos nogle dyr, viste de, der fastholdt drægtighed, ingen tegn på teratogene misdannelser.
gnavermodeller for udvikling af fosterets reproduktionskanal forårsagede tamoxifen (ved doser på 0,002 til 2,4 gange den daglige maksimale anbefalede humane dosis på mg/m²-basis) ændringer hos begge køn, der ligner dem forårsaget af østradiol, ethynyestradiol og diethylstilbestrol. Selvom den kliniske relevans af disse ændringer er ukendt, ligner nogle af disse ændringer, især vaginal adenose, dem, der ses hos unge kvinder, der blev eksponeret for diethylstilbestrol in utero, og som har en risiko på 1 ud af 1000 for at udvikle klarcellet adenokarcinom af skeden eller livmoderhalsen. Hidtil har det ikke vist sig, at in utero eksponering for tamoxifen forårsager vaginal adenose eller klarcellet adenokarcinom i skeden eller livmoderhalsen hos unge kvinder. Imidlertid er kun et lille antal unge kvinder blevet udsat for tamoxifen in utero, og et mindre antal er blevet fulgt længe nok (til alderen 15-20) til at afgøre, om vaginal eller cervikal neoplasi kan opstå som følge af denne eksponering.
Der er ingen tilstrækkelige og velkontrollerede forsøg med tamoxifen hos gravide kvinder. Der har været et lille antal rapporter om vaginal blødning, spontane aborter, fosterskader og fosterdød hos gravide kvinder. Hvis dette lægemiddel bruges under graviditet, eller patienten bliver gravid, mens du tager dette lægemiddel, eller inden for cirka to måneder efter seponering af behandlingen, skal patienten informeres om de potentielle risici for fosteret, herunder den potentielle langsigtede risiko for en DES- som syndrom.
Reduktion i forekomsten af brystkræft hos højrisikokvinder - Graviditetskategori D
For seksuelt aktive kvinder i den fødedygtige alder bør NOLVADEX (tamoxifencitrat) behandling påbegyndes under menstruation. Hos kvinder med uregelmæssig menstruation er et negativt B-HCG umiddelbart før påbegyndelse af behandlingen tilstrækkelig (se FORHOLDSREGLER-INFORMATION TIL PATIENTER - Reduktion i forekomsten af brystkræft hos højrisikokvinder ).
FORHOLDSREGLER
Generel
Fald i blodpladetal, sædvanligvis til 50.000-100.000/mm³, sjældent lavere, er lejlighedsvis blevet rapporteret hos patienter, der tager NOLVADEX (tamoxifencitrat) mod brystkræft. Hos patienter med signifikant trombocytopeni er sjældne hæmoragiske episoder forekommet, men det er usikkert, om disse episoder skyldes NOLVADEX (tamoxifencitrat) behandling. Leukopeni er blevet observeret, nogle gange i forbindelse med anæmi og/eller trombocytopeni. Der har været sjældne rapporter om neutropeni og pancytopeni hos patienter, der fik NOLVADEX (tamoxifencitrat); dette kan nogle gange være alvorligt.
I NSABP P-1 forsøget oplevede 6 kvinder på NOLVADEX (tamoxifencitrat) og 2 på placebo grad 3-4 fald i blodpladetal (≤ 50.000/mm³).
Information til patienter
Patienterne skal instrueres i at læse Medicinvejledning leveres som krævet ved lov, når NOLVADEX 10mg udleveres. Den fulde tekst af Medicinvejledning er genoptrykt i slutningen af dette dokument.
Reduktion af invasiv brystkræft og DCIS hos kvinder med DCIS
Kvinder med DCIS behandlet med lumpektomi og strålebehandling, som overvejer NOLVADEX (tamoxifencitrat) for at reducere forekomsten af en anden brystkræfthændelse, bør vurdere risici og fordele ved behandlingen, da behandling med NOLVADEX (tamoxifencitrat) reducerede forekomsten af invasiv brystkræft. kræft, men har ikke vist sig at påvirke overlevelsen (se tabel 1 i KLINISK FARMAKOLOGI ).
Reduktion i forekomsten af brystkræft hos højrisikokvinder
Kvinder med høj risiko for brystkræft kan overveje at tage NOLVADEX (tamoxifencitrat)-behandling for at reducere forekomsten af brystkræft. Hvorvidt fordelene ved behandling anses for at opveje risiciene afhænger af en kvindes personlige helbredshistorie og af, hvordan hun vejer fordele og risici. NOLVADEX (tamoxifencitrat)-behandling til at reducere forekomsten af brystkræft er derfor muligvis ikke passende for alle kvinder med høj risiko for brystkræft. Kvinder, der overvejer behandling med NOLVADEX (tamoxifencitrat) bør konsultere deres sundhedspersonale for en vurdering af de potentielle fordele og risici, før de påbegynder behandling for at reducere forekomsten af brystkræft (se tabel 3 i KLINISK FARMAKOLOGI ). Kvinder bør forstå, at NOLVADEX (tamoxifencitrat) reducerer forekomsten af brystkræft, men muligvis ikke eliminerer risikoen. NOLVADEX (tamoxifencitrat) reducerede forekomsten af små østrogenreceptorpositive tumorer, men ændrede ikke forekomsten af østrogenreceptornegative tumorer eller større tumorer. Hos kvinder med brystkræft, som har høj risiko for at udvikle endnu en brystkræft, reducerede behandling med ca. 5 års NOLVADEX (tamoxifencitrat) den årlige forekomst af en anden brystkræft med ca. 50 %.
Kvinder, der er gravide eller planlægger at blive gravide, bør ikke tage NOLVADEX (tamoxifencitrat) for at reducere risikoen for brystkræft. Effektiv ikke-hormonel prævention skal anvendes af alle præmenopausale kvinder, der tager NOLVADEX (tamoxifencitrat), og i ca. to måneder efter seponering af behandlingen, hvis de er seksuelt aktive. Tamoxifen forårsager ikke infertilitet, selv i nærværelse af menstruationsuregelmæssigheder. For seksuelt aktive kvinder i den fødedygtige alder bør NOLVADEX (tamoxifencitrat) behandling påbegyndes under menstruation. Hos kvinder med uregelmæssig menstruation er et negativt B-HCG umiddelbart før påbegyndelse af behandlingen tilstrækkelig (se ADVARSLER - Graviditetskategori D ).
To europæiske forsøg med tamoxifen for at reducere risikoen for brystkræft blev udført og viste ingen forskel i antallet af brystkræfttilfælde mellem tamoxifen- og placeboarmen. Disse undersøgelser havde forsøgsdesign, der adskilte sig fra NSABP P-1, var mindre end NSABP P-1 og indrullerede kvinder med en lavere risiko for brystkræft end dem i P-1.
Overvågning under NOLVADEX (tamoxifencitrat) terapi
Kvinder, der tager eller tidligere har taget NOLVADEX (tamoxifencitrat), bør instrueres i at søge omgående lægehjælp for nye brystklumper, vaginale blødninger, gynækologiske symptomer (menstruationsuregelmæssigheder, ændringer i vaginalt udflåd eller bækkensmerter eller -tryk), symptomer på hævede ben eller ømhed, uforklarlig åndenød eller ændringer i synet. Kvinder bør informere alle behandlere, uanset årsagen til evalueringen, om, at de tager NOLVADEX (tamoxifencitrat).
Kvinder, der tager NOLVADEX (tamoxifencitrat) for at reducere forekomsten af brystkræft, bør have en brystundersøgelse, en mammografi og en gynækologisk undersøgelse før påbegyndelse af behandlingen. Disse undersøgelser bør gentages med jævne mellemrum under behandlingen i overensstemmelse med god medicinsk praksis. Kvinder, der tager NOLVADEX (tamoxifencitrat) som adjuverende brystkræftbehandling, bør følge de samme overvågningsprocedurer som for kvinder, der tager NOLVADEX (tamoxifencitrat) for at reducere forekomsten af brystkræft. Kvinder, der tager NOLVADEX (tamoxifencitrat) som behandling for metastatisk brystkræft, bør gennemgå denne monitoreringsplan med deres plejepersonale og vælge de passende modaliteter og tidsplan for evaluering.
Laboratorieprøver
Der bør foretages periodiske fuldstændige blodtællinger, inklusive blodpladetal, og periodiske leverfunktionstests.
Under ATAC-studiet blev flere patienter, der fik anastrozol, rapporteret at have et forhøjet serumkolesterol sammenlignet med patienter, der fik NOLVADEX (tamoxifencitrat) (henholdsvis 9 % versus 3,5 %).
Karcinogenese
En konventionel karcinogeneseundersøgelse i rotter i doser på 5, 20 og 35 mg/kg/dag (ca. en, tre og syv gange den daglige maksimale anbefalede humane dosis på mg/m²-basis) indgivet ved oral sonde i op til 2 år ) afslørede en signifikant stigning i hepatocellulært carcinom ved alle doser. Forekomsten af disse tumorer var signifikant større blandt rotter, der fik 20 eller 35 mg/kg/dag (69 %) sammenlignet med dem, der fik 5 mg/kg/dag (14 %). I en separat undersøgelse fik rotter tamoxifen i en dosis på 45 mg/kg/dag (ca. ni gange den daglige maksimale anbefalede humane dosis på mg/m²-basis); hepatocellulær neoplasi blev udvist efter 3 til 6 måneder.
Granulosacelle-ovarietumorer og interstitielle testikeltumorer blev observeret i to separate museundersøgelser. Musene fik de trans- og racemiske former for tamoxifen i 13 til 15 måneder i doser på 5, 20 og 50 mg/kg/dag (ca. en halv, to og fem gange den daglige anbefalede humane dosis på en mg/m² basis).
Mutagenese
Der blev ikke fundet noget genotoksisk potentiale i et konventionelt batteri af in vivo og in vitro tests med pro- og eukaryote testsystemer med lægemiddelmetaboliserende systemer. Forhøjede niveauer af DNA-addukter blev imidlertid observeret ved 32P efter-mærkning i DNA fra rottelever og dyrkede humane lymfocytter. Tamoxifen har også vist sig at øge niveauet af mikronukleusdannelse in vitro i human lymfoblastoid cellelinje (MCL-5). Baseret på disse fund er tamoxifen genotoksisk i gnavere og humane MCL-5-celler.
Forringelse af fertilitet
Tamoxifen forårsagede svækkelse af fertilitet og undfangelse hos hunrotter ved doser på 0,04 mg/kg/dag (ca. 0,01 gange den daglige maksimale anbefalede humane dosis på mg/m²-basis) ved dosering i to uger før parring til og med dag 7 af graviditeten . Ved denne dosis var fertilitets- og reproduktionsindeks markant reduceret med total føtal dødelighed. Føtal mortalitet var også øget ved doser på 0,16 mg/kg/dag (ca. 0,03 gange den daglige maksimale anbefalede humane dosis på mg/m²-basis), når hunrotter blev doseret fra dag 7-17 af drægtighedsperioden. Tamoxifen forårsagede abort, for tidlig fødsel og føtal død hos kaniner, der fik doser lig med eller større end 0,125 mg/kg/dag (ca. 0,05 gange den daglige maksimale anbefalede humane dosis på mg/m²-basis). Der var ingen teratogene ændringer hos hverken rotter eller kaniner.
Graviditetskategori D
Se ADVARSLER .
Ammende mødre
Tamoxifen er blevet rapporteret at hæmme amning. To placebokontrollerede undersøgelser med over 150 kvinder har vist, at tamoxifen signifikant hæmmer tidlig mælkeproduktion efter fødslen. I begge undersøgelser blev tamoxifen administreret inden for 24 timer efter fødslen i mellem 5 og 18 dage. Effekten af tamoxifen på etableret mælkeproduktion er ikke kendt.
Der er ingen data, der viser, om tamoxifen udskilles i modermælk. Hvis det udskilles, er der ingen data vedrørende virkningen af tamoxifen i modermælk på det ammede spædbarn eller ammede dyr. Direkte neonatal eksponering af tamoxifen til mus og rotter (ikke via modermælk) forårsagede imidlertid 1) reproduktionskanallæsioner hos hungnavere (svarende til dem, der ses hos mennesker efter intrauterin eksponering for diethylstilbestrol) og 2) funktionelle defekter i forplantningskanalen hos mænd gnavere såsom testikelatrofi og standsning af spermatogenese.
Det vides ikke, om NOLVADEX (tamoxifencitrat) udskilles i modermælk. På grund af risikoen for alvorlige bivirkninger hos ammende spædbørn fra NOLVADEX (tamoxifencitrat), bør kvinder, der tager NOLVADEX (tamoxifencitrat), ikke amme.
Reduktion i forekomst af brystkræft hos højrisikokvinder med DCIS
Det vides ikke, om NOLVADEX (tamoxifencitrat) udskilles i modermælk. På grund af risikoen for alvorlige bivirkninger hos ammende spædbørn fra NOLVADEX (tamoxifencitrat), bør kvinder, der tager NOLVADEX (tamoxifencitrat), ikke amme.
Pædiatrisk brug
Sikkerheden og effekten af NOLVADEX (tamoxifencitrat) til piger i alderen to til 10 år med McCune-Albright syndrom og tidlig pubertet er ikke blevet undersøgt efter et års behandling. Langtidsvirkningerne af NOLVADEX (tamoxifencitrat) behandling for piger er ikke blevet fastlagt. Hos voksne behandlet med NOLVADEX (tamoxifencitrat) er der set en stigning i forekomsten af uterine maligniteter, slagtilfælde og lungeemboli (se KASSET ADVARSEL , og KLINISK FARMAKOLOGI-Kliniske undersøgelser-McCune-Albright syndrom underafsnit).
Geriatrisk brug
NSABP P-1 forsøget var procentdelen af kvinder på mindst 65 år 16 %. Kvinder på mindst 70 år udgjorde 6 % af deltagerne. En reduktion i forekomsten af brystkræft blev set blandt deltagere i hver af undergrupperne: I alt 28 og 10 invasive brystkræfttilfælde blev set blandt deltagere 65 og ældre i henholdsvis placebo- og NOLVADEX-gruppen (tamoxifencitrat). På tværs af alle andre resultater afspejler resultaterne i denne undergruppe resultaterne observeret i undergruppen af kvinder på mindst 50 år. Der blev ikke observeret nogen overordnede forskelle i tolerabilitet mellem ældre og yngre patienter (se KLINISK FARMAKOLOGI - Kliniske undersøgelser - Reduktion af forekomsten af brystkræft hos højrisikokvinder afsnit).
NSABP B-24 forsøget var procentdelen af kvinder på mindst 65 år 23 %. Kvinder på mindst 70 år udgjorde 10 % af deltagerne. I alt 14 og 12 invasive brystkræftformer blev set blandt deltagere 65 og ældre i henholdsvis placebo- og NOLVADEX-gruppen (tamoxifencitrat). Denne delmængde er for lille til at nå frem til nogen konklusioner om effektivitet. På tværs af alle andre endepunkter var resultaterne i denne undergruppe sammenlignelige med resultaterne for yngre kvinder, der var tilmeldt dette forsøg. Der blev ikke observeret nogen overordnede forskelle i tolerabilitet mellem ældre og yngre patienter.
OVERDOSIS
Tegn observeret ved de højeste doser efter undersøgelser til bestemmelse af LD50 hos dyr var åndedrætsbesvær og kramper.
Akut overdosering hos mennesker er ikke blevet rapporteret. I en undersøgelse af fremskredne metastaserende cancerpatienter, som specifikt bestemte den maksimalt tolererede dosis af NOLVADEX (tamoxifencitrat) ved evaluering af brugen af meget høje doser til at vende multilægemiddelresistens, blev akut neurotoksicitet manifesteret ved tremor, hyperrefleksi, ustabil gang og svimmelhed noteret. Disse symptomer opstod inden for 3-5 dage efter påbegyndelse af NOLVADEX (tamoxifencitrat) og forsvandt inden for 2-5 dage efter behandlingens ophør. Ingen permanent neurologisk toksicitet blev noteret. En patient oplevede et anfald flere dage efter, at NOLVADEX (tamoxifencitrat) blev seponeret, og neurotoksiske symptomer var forsvundet. Årsagssammenhængen mellem anfaldet og NOLVADEX (tamoxifencitrat) behandling er ukendt. Doser givet til disse patienter var alle større end 400 mg/m² startdosis, efterfulgt af vedligeholdelsesdoser på 150 mg/m² NOLVADEX (tamoxifencitrat) givet to gange dagligt.
samme undersøgelse blev forlængelse af QT-intervallet på elektrokardiogrammet bemærket, når patienter fik doser højere end 250 mg/m² startdosis efterfulgt af vedligeholdelsesdoser på 80 mg/m² NOLVADEX (tamoxifencitrat) givet to gange dagligt. For en kvinde med en kropsoverflade på 1,5 m² var den minimale startdosis og vedligeholdelsesdoser givet, ved hvilke neurologiske symptomer og QT-ændringer forekom, mindst 6 gange højere i forhold til den maksimalt anbefalede dosis.
Der kendes ingen specifik behandling for overdosering; Behandlingen skal være symptomatisk.
KONTRAINDIKATIONER
NOLVADEX (tamoxifencitrat) er kontraindiceret til patienter med kendt overfølsomhed over for lægemidlet eller et eller flere af dets ingredienser.
Reduktion i forekomsten af brystkræft hos højrisikokvinder og kvinder med DCIS
NOLVADEX (tamoxifencitrat) er kontraindiceret hos kvinder, som har behov for samtidig antikoagulantbehandling af coumarin-typen, eller hos kvinder med en historie med dyb venetrombose eller lungeemboli.
KLINISK FARMAKOLOGI
NOLVADEX (tamoxifencitrat) er et ikke-steroidt middel, der har vist kraftige antiøstrogene egenskaber i dyreforsøgssystemer. De antiøstrogene virkninger kan være relateret til dets evne til at konkurrere med østrogen om bindingssteder i målvæv, såsom bryst. Tamoxifen hæmmer induktionen af rottebrystcarcinom induceret af dimethylbenzanthracen (DMBA) og forårsager regression af allerede etablerede DMBA-inducerede tumorer. I denne rottemodel ser tamoxifen ud til at udøve sin antitumorvirkning ved at binde østrogenreceptorerne.
I cytosoler afledt af humane brystadenokarcinomer konkurrerer tamoxifen med østradiol om østrogenreceptorprotein.
Absorption og distribution
Efter en enkelt oral dosis på 20 mg tamoxifen forekom en gennemsnitlig maksimal plasmakoncentration på 40 ng/ml (interval 35 til 45 ng/ml) ca. 5 timer efter dosering. Faldet i plasmakoncentrationer af tamoxifen er bifasisk med en terminal eliminationshalveringstid på ca. 5 til 7 dage. Den gennemsnitlige maksimale plasmakoncentration af N-desmethyltamoxifen er 15 ng/ml (interval 10 til 20 ng/ml). Kronisk administration af 10 mg tamoxifen givet to gange dagligt i 3 måneder til patienter resulterer i gennemsnitlige steady-state plasmakoncentrationer på 120 ng/ml (interval 67-183 ng/ml) for tamoxifen og 336 ng/ml (interval 148-654 ng/ mL) for N-desmethyltamoxifen. De gennemsnitlige steady-state plasmakoncentrationer af tamoxifen og N-desmethyltamoxifen efter administration af 20 mg tamoxifen én gang dagligt i 3 måneder er 122 ng/mL (interval 71-183 ng/mL) og 353 ng/mL (interval 152-706 ng /ml). Efter påbegyndelse af behandlingen opnås steady state-koncentrationer for tamoxifen efter ca. 4 uger, og steady-state-koncentrationer for N-desmethyltamoxifen opnås på ca. 8 uger, hvilket tyder på en halveringstid på ca. 14 dage for denne metabolit. I et steady-state, crossover-studie af 10 mg NOLVADEX (tamoxifencitrat)-tabletter givet to gange dagligt i forhold til en 20 mg NOLVADEX (tamoxifencitrat)-tablet givet én gang dagligt, var 20 mg NOLVADEX (tamoxifencitrat)-tabletten bioækvivalent med de 10 mg NOLVADEX (tamoxifencitrat) tabletter.
Metabolisme
Tamoxifen metaboliseres i vid udstrækning efter oral administration. N-desmethyltamoxifen er den vigtigste metabolit, der findes i patienters plasma. Den biologiske aktivitet af N-desmethyltamoxifen ser ud til at svare til tamoxifens. 4-Hydroxytamoxifen og et sidekædet primært alkoholderivat af tamoxifen er blevet identificeret som mindre metabolitter i plasma. Tamoxifen er et substrat for cytochrom P-450 3A, 2C9 og 2D6 og en inhibitor af P-glycoprotein.
Udskillelse
Undersøgelser med kvinder, der fik 20 mg 14C-tamoxifen, har vist, at ca. 65 % af den administrerede dosis blev udskilt fra kroppen over en periode på 2 uger med fækal udskillelse som den primære eliminationsvej. Lægemidlet udskilles hovedsageligt som polære konjugater, hvor uændret lægemiddel og ukonjugerede metabolitter tegner sig for mindre end 30 % af den samlede fækale radioaktivitet.
Særlige Populationer
Effekten af alder, køn og race på tamoxifens farmakokinetik er ikke blevet bestemt. Virkningerne af nedsat leverfunktion på tamoxifens metabolisme og farmakokinetik er ikke blevet fastlagt.
Pædiatriske patienter
Farmakokinetikken af tamoxifen og N-desmethyltamoxifen blev karakteriseret ved hjælp af en populationsfarmakokinetisk analyse med sparsomme prøver pr. patient opnået fra 27 kvindelige pædiatriske patienter i alderen 2 til 10 år inkluderet i en undersøgelse designet til at evaluere sikkerheden, effektiviteten og farmakokinetikken af NOLVADEX (tamoxifen) citrat) til behandling af McCune-Albright syndrom. Rige data fra to farmakokinetiske forsøg med tamoxifencitrat, hvor 59 postmenopausale kvinder med brystkræft fuldførte undersøgelserne, blev inkluderet i analysen for at bestemme den strukturelle farmakokinetiske model for tamoxifen. En model med ét rum gav den bedste tilpasning til dataene.
Hos pædiatriske patienter var en gennemsnitlig steady state peak plasmakoncentration (Css, max) og AUC på henholdsvis 187 ng/ml og 4110 ng time/mL, og Css, max forekom ca. 8 timer efter dosering. Clearance (CL/F) som kropsvægt justeret hos kvindelige pædiatriske patienter var ca. 2,3 gange højere end hos kvindelige brystkræftpatienter. I den yngste kohorte af kvindelige pædiatriske patienter (2-6-årige) var CL/F 2,6 gange højere; i den ældste kohorte (7-10,9 årige) var CL/F ca. 1,9 gange højere. Eksponering for N-desmethyltamoxifen var sammenlignelig mellem pædiatriske og voksne patienter. Sikkerheden og effekten af NOLVADEX (tamoxifencitrat) til piger i alderen to til 10 år med McCune-Albright syndrom og tidlig pubertet er ikke blevet undersøgt efter et års behandling. Langtidsvirkningerne af NOLVADEX (tamoxifencitrat) behandling hos piger er ikke blevet fastlagt. Hos voksne behandlet med NOLVADEX (tamoxifencitrat) er der set en stigning i forekomsten af uterine maligniteter, slagtilfælde og lungeemboli (se KASSET ADVARSEL ).
Lægemiddel-lægemiddelinteraktioner
In vitro undersøgelser viste, at erythromycin, cyclosporin, nifedipin og diltiazem kompetitivt hæmmede dannelsen af N-desmethyltamoxifen med tilsyneladende K1 på henholdsvis 20, 1, 45 og 30 µM. Den kliniske betydning af disse in vitro undersøgelser er ukendt.
Tamoxifen reducerede plasmakoncentrationen af letrozol med 37 %, når disse lægemidler blev administreret samtidigt. Rifampin, en cytochrom P-450 3A4-inducer, reducerede tamoxifens AUC og Cmax med henholdsvis 86 % og 55 %. Aminoglutethimid reducerer plasmakoncentrationerne af tamoxifen og N-desmethyltamoxifen. Medroxyprogesteron reducerer plasmakoncentrationer af N-desmethyl, men ikke tamoxifen.
anastrozol-adjuverende forsøg reducerede samtidig administration af anastrozol og NOLVADEX (tamoxifencitrat) hos brystkræftpatienter anastrozol-plasmakoncentrationen med 27 % sammenlignet med dem, der blev opnået med anastrozol alene; dog påvirkede samtidig administration ikke farmakokinetikken af tamoxifen eller N-desmethyltamoxifen (se SIKKERHEDSFORANSTALTNINGER - DRUGSINTERAKTIONER ). NOLVADEX (tamoxifencitrat) bør ikke administreres sammen med anastrozol.
Kliniske Studier
Metastatisk brystkræft
Præmenopausale kvinder (NOLVADEX (tamoxifencitrat) vs. ablation)
Tre prospektive, randomiserede undersøgelser (Ingle, Pritchard, Buchanan) sammenlignede NOLVADEX (tamoxifencitrat) med ovarieablation (ooforektomi eller ovariebestråling) hos præmenopausale kvinder med fremskreden brystkræft. Selvom den objektive responsrate, tid til behandlingssvigt og overlevelse var ens med begge behandlinger, forhindrede den begrænsede patienttilvækst en demonstration af ækvivalens. I en oversigtsanalyse af overlevelsesdata fra de 3 undersøgelser var hazard ratio for død (NOLVADEX (tamoxifencitrat)/ovarieablation) 1,00 med tosidede 95 % konfidensintervaller på 0,73 til 1,37. Forhøjede serum- og plasmaøstrogener er blevet observeret hos præmenopausale kvinder, der fik NOLVADEX (tamoxifencitrat), men dataene fra de randomiserede undersøgelser tyder ikke på en negativ effekt af denne stigning. Et begrænset antal præmenopausale patienter med sygdomsprogression under NOLVADEX (tamoxifencitrat)-behandling reagerede på efterfølgende ovarieablation.
Mandlig brystkræft
Publicerede resultater fra 122 patienter (119 evaluerbare) og case-rapporter fra 16 patienter (13 evaluerbare) behandlet med NOLVADEX (tamoxifencitrat) har vist, at NOLVADEX (tamoxifencitrat) er effektiv til palliativ behandling af mandlig brystkræft. 66 af disse 132 evaluerbare patienter reagerede på NOLVADEX (tamoxifencitrat), som udgør en objektiv responsrate på 50 %.
Adjuverende brystkræft
Oversigt
Early Breast Cancer Trialists' Collaborative Group (EBCTCG) gennemførte verdensomspændende oversigter over systemisk adjuverende terapi for tidlig brystkræft i 1985, 1990 og igen i 1995. I 1998 blev 10-årige udfaldsdata rapporteret for 36.689 kvinder i 5 tilfældige forsøg adjuvans NOLVADEX (tamoxifencitrat) med doser på 20-40 mg/dag i 1-5+ år. Femogtyve procent af patienterne modtog 1 års eller mindre forsøgsbehandling, 52 % modtog 2 år, og 23 % modtog omkring 5 år. 48 procent af tumorerne var østrogenreceptor (ER) positive (> 10 fmol/mg), 21 % var ER dårlige (
Blandt kvinder med ER-positiv eller ukendt brystkræft og positive knuder, som modtog omkring 5 års behandling, var den samlede overlevelse efter 10 år 61,4 % for NOLVADEX (tamoxifencitrat) vs. 50,5 % for kontrol (logrank 2p
Effekten af den planlagte varighed af tamoxifen kan beskrives som følger. Hos kvinder med ER-positiv eller ukendt brystkræft, der fik NOLVADEX (tamoxifencitrat) i 1 år eller mindre, 2 år eller omkring 5 år, var de proportionale reduktioner i dødeligheden henholdsvis 12 %, 17 % og 26 % (tendens signifikant ved 2p
Fordelen er mindre klar for kvinder med ER-fattig brystkræft, hvor den proportionale reduktion i recidiv var 10 % (2p = 0,007) for alle varigheder tilsammen, eller 9 % (2p = 0,02), hvis kontralaterale brystkræftformer er udelukket. Den tilsvarende reduktion i dødelighed var 6 % (NS). Virkningerne af omkring 5 års NOLVADEX (tamoxifencitrat) på recidiv og dødelighed var ens uanset alder og samtidig kemoterapi. Der var ingen indikation af, at doser større end 20 mg pr. dag var mere effektive.
Anastrozol Adjuverende ATAC-forsøg - Undersøgelse af Anastrozol sammenlignet med NOLVADEX (tamoxifencitrat) til adjuverende behandling af tidlig brystkræft - Et anastrozol-adjuverende forsøg blev udført med 9366 postmenopausale kvinder med operabel brystkræft, som blev randomiseret til at modtage adjuverende behandling med enten anastrozol 1 mg dagligt, NOLVADEX (tamoxifencitrat) 20 mg dagligt eller en kombination af disse to behandlinger i fem år eller indtil tilbagevenden af sygdommen. Ved en median opfølgning på 33 måneder viste kombinationen af anastrozol og NOLVADEX (tamoxifencitrat) ingen effektfordel sammenlignet med NOLVADEX (tamoxifencitrat) behandling alene hos alle patienter såvel som i den hormonreceptorpositive subpopulation. Denne behandlingsarm blev afbrudt fra forsøget. Vær sød at henvise til KLINISK FARMAKOLOGI-Specialpopulationer-Drug-Drug interaktioner , FORHOLDSREGLER-Laboratorieundersøgelser , FORHOLDSREGLER - Lægemiddelinteraktioner og BIVIRKNINGER afsnit for sikkerhedsoplysninger fra dette forsøg. Se venligst den fulde ordinationsinformation for ARIMIDEX® (anastrozol) 1 mg tabletter for yderligere information om dette forsøg.
Patienter i de to monoterapiarme i ATAC-studiet blev behandlet i en median på 60 måneder (5 år) og fulgt i en median på 68 måneder. Sygdomsfri overlevelse i intention-to-treat-populationen var statistisk signifikant forbedret [Hazard Ratio (HR) = 0,87, 95 % CI: 0,78, 0,97, p=0,0127] i anastrazol-armen sammenlignet med NOLVADEX-armen (tamoxifencitrat) .
Node Positiv - Individuelle undersøgelser
To undersøgelser (Hubay og NSABP B-09) viste en forbedret sygdomsfri overlevelse efter radikal eller modificeret radikal mastektomi hos postmenopausale kvinder eller kvinder på 50 år eller ældre med kirurgisk helbredelig brystkræft med positive aksillære noder, når NOLVADEX (tamoxifencitrat) blev tilføjet til adjuverende cytotoksisk kemoterapi. I Hubay-undersøgelsen blev NOLVADEX (tamoxifencitrat) tilsat til "lavdosis" CMF (cyclophosphamid, methotrexat og fluorouracil). I NSABP B-09-undersøgelsen blev NOLVADEX (tamoxifencitrat) tilsat melphalan [L-phenylalaninsennep (P)] og fluorouracil (F).
Hubay-undersøgelsen var patienter med en positiv (mere end 3 fmol) østrogenreceptor mere tilbøjelige til at få gavn af det. I NSABP B-09-studiet med kvinder i alderen 50-59 år var det kun kvinder med både østrogen- og progesteronreceptorniveauer på 10 fmol eller derover, der havde klart gavn af det, mens der var en ikke-statistisk signifikant tendens til negativ effekt hos kvinder med både østrogen- og progesteronreceptorniveauer mindre end 10 fmol. Hos kvinder i alderen 60-70 år var der en tendens til en gavnlig effekt af NOLVADEX (tamoxifencitrat) uden nogen klar sammenhæng med østrogen- eller progesteronreceptorstatus.
Tre prospektive undersøgelser (ECOG-1178, Toronto, NATO) med NOLVADEX (tamoxifencitrat) adjuverende som et enkelt middel viste en forbedret sygdomsfri overlevelse efter total mastektomi og aksillær dissektion for postmenopausale kvinder med positive aksillære knuder sammenlignet med placebo/ingen behandlingskontrol . NATO-undersøgelsen viste også en samlet overlevelsesfordel.
Node Negativ - Individuelle undersøgelser
NSABP B-14, en prospektiv, dobbeltblind, randomiseret undersøgelse, sammenlignede NOLVADEX (tamoxifencitrat) med placebo hos kvinder med aksillær node-negativ, østrogenreceptorpositiv (≥ 10 fmol/mg cytosolprotein) brystkræft (som adjuverende behandling) , efter total mastektomi og aksillær dissektion eller segmental resektion
PATIENTOPLYSNINGER
MEDICIN GUIDE
NOLVADEX (tamoxifencitrat) ® (NOLE-vah-dex) Tabletter Generisk navn: tamoxifen (ta-MOX-I-fen)
Skrevet til kvinder, der bruger NOLVADEX (tamoxifencitrat) for at reducere deres høje chance for at få brystkræft, eller som har duktalt carcinom in situ (DCIS)
Denne medicinvejledning diskuterer kun brugen af NOLVADEX (tamoxifencitrat) for at sænke chancen for at få brystkræft hos højrisikokvinder og hos kvinder behandlet for DCIS.
Personer, der tager NOLVADEX (tamoxifencitrat) at behandle brystkræft har andre fordele og andre beslutninger at træffe end højrisikokvinder eller kvinder med duktalt carcinoma in situ (DCIS), der tager NOLVADEX (tamoxifencitrat) for at reducere risikoen for at få brystkræft. Hvis du allerede har brystkræft, så tal med din læge om, hvordan fordelene ved at behandle brystkræft med NOLVADEX (tamoxifencitrat) sammenlignes med de risici, der er beskrevet i dette dokument.
Hvorfor skal jeg læse denne medicinvejledning?
Denne vejledning har information, der hjælper dig med at beslutte, om du skal bruge NOLVADEX (tamoxifencitrat) for at mindske din chance for at få brystkræft.
Du og din læge bør tale om, hvorvidt den mulige fordel ved NOLVADEX (tamoxifencitrat) til at nedsætte din høje chance for at få brystkræft er større end dens mulige risici. Din læge har et særligt computerprogram eller håndholdt lommeregner til at fortælle, om du er i højrisikogruppen. Hvis du har DCIS og er blevet behandlet med kirurgi og strålebehandling, kan din læge ordinere NOLVADEX (tamoxifencitrat) for at mindske din chance for at få invasiv (spredning) brystkræft.
Læs denne vejledning omhyggeligt, før du starter NOLVADEX (tamoxifencitrat). Det er vigtigt at læse den information, du får, hver gang du får mere medicin. Der kan være noget nyt. Denne guide fortæller dig ikke alt om NOLVADEX (tamoxifencitrat) og gør ikke træde i stedet for at tale med din læge.
Kun du og din læge kan afgøre, om NOLVADEX (tamoxifencitrat) er det rigtige for dig.
Hvad er den vigtigste information, jeg bør vide om brug af NOLVADEX (tamoxifencitrat) for at reducere risikoen for at få brystkræft?
NOLVADEX (tamoxifencitrat) er en receptpligtig medicin, der er ligesom østrogen (kvindelig hormon) på nogle måder og anderledes på andre måder. I brystet kan NOLVADEX (tamoxifencitrat) blokere østrogens virkninger. Fordi det gør dette, kan NOLVADEX (tamoxifencitrat) blokere væksten af brystkræft, der har brug for østrogen for at vokse (kræft, der er østrogen- eller progesteron-receptor-positive).
NOLVADEX (tamoxifencitrat) kan sænke chancen for at få brystkræft hos kvinder med en større chance end normalt for at få brystkræft inden for de næste fem år (højrisikokvinder) og kvinder med DCIS.
Fordi højrisikokvinder endnu ikke har kræft, er det vigtigt at tænke grundigt over, om den mulige fordel ved NOLVADEX (tamoxifencitrat) til at nedsætte chancen for at få brystkræft er større end dens mulige risici.
Denne medicinvejledning gennemgår risici og fordele ved at bruge NOLVADEX (tamoxifencitrat) for at reducere risikoen for at få brystkræft hos højrisikokvinder og kvinder med DCIS. Det gør denne guide ikke diskutere de særlige fordele og beslutninger for mennesker, der allerede har brystkræft.
Hvorfor bruger kvinder og mænd NOLVADEX (tamoxifencitrat)?
NOLVADEX (tamoxifencitrat) har mere end én anvendelse. NOLVADEX (tamoxifencitrat) anvendes:
for at mindske chancen for at få brystkræft hos kvinder med en højere end normalt chance for at få brystkræft inden for de næste 5 år (højrisikokvinder)
for at mindske chancen at få invasiv (spredning) brystkræft hos kvinder, der blev opereret og bestrålet for ductal carcinoma in situ (DCIS). DCIS betyder, at kræften kun er inde i mælkekanalerne.
at behandle brystkræft hos kvinder, efter at de har afsluttet tidlig behandling. Tidlig behandling kan omfatte operation, stråling og kemoterapi. NOLVADEX (tamoxifencitrat) kan forhindre kræften i at sprede sig til andre dele af kroppen. Det kan også reducere kvindens chance for at få en ny brystkræft. hos kvinder og mænd,
at behandle brystkræft, der har spredt sig til andre dele af kroppen (metastatisk brystkræft).
Denne vejledning taler kun om brug af NOLVADEX (tamoxifencitrat) for at sænke chancen for at få brystkræft (#1 og #2 ovenfor).
Hvad er fordelene ved NOLVADEX (tamoxifencitrat) for at sænke chancen for at få brystkræft hos højrisikokvinder og hos kvinder behandlet for DCIS?
En stor amerikansk undersøgelse kiggede på højrisiko kvinder og sammenlignede dem, der tog NOLVADEX (tamoxifencitrat) i 5 år med andre, der tog en pille uden NOLVADEX (tamoxifencitrat) (placebo). Højrisikokvinder blev defineret som kvinder, der har 1,7 % eller større chance for at få brystkræft inden for de næste 5 år, baseret på et særligt computerprogram. I dette studie:
- Ud af hver 1.000 højrisiko kvinder der tog placebo , hvert år fik omkring 7 brystkræft.
- Ud af hver 1.000 højrisiko kvinder der tog NOLVADEX (tamoxifencitrat) 4 fik hvert år brystkræft.
Undersøgelsen viste, at højrisikokvinder, der tog NOLVADEX (tamoxifencitrat), i gennemsnit sænkede deres chancer for at få brystkræft med 44 %, fra 7 ud af 1.000 til 4 ud af 1.000.
En anden amerikansk undersøgelse kiggede på kvinder med DCIS og sammenlignede dem, der tog NOLVADEX (tamoxifencitrat) i 5 år med andre, der tog placebo. I dette studie:
- Ud af hver 1.000 kvinder med DCIS der fik placebo 17 fik hvert år brystkræft.
- Ud af hver 1.000 kvinder med DCIS der tog NOLVADEX (tamoxifencitrat) , hvert år fik omkring 10 brystkræft.
Undersøgelsen viste, at kvinder med DCIS, der tog NOLVADEX (tamoxifencitrat), i gennemsnit sænkede deres chancer for at få invasiv (spredning) brystkræft med 43 %, fra 17 ud af 1.000 til 10 ud af 1.000.
Disse undersøgelser betyder ikke, at indtagelse af NOLVADEX (tamoxifencitrat) vil mindske din personlige chance for at få brystkræft. Vi ved ikke, hvad fordelene vil være for en kvinde, der tager NOLVADEX (tamoxifencitrat) for at reducere sin chance for at få brystkræft.
Hvad er risiciene ved NOLVADEX (tamoxifencitrat)?
I undersøgelserne beskrevet under "Hvad er fordelene ved NOLVADEX (tamoxifencitrat)?", fik de højrisikokvinder, der tog NOLVADEX (tamoxifencitrat), visse bivirkninger i højere grad end dem, der fik placebo.
Nogle af disse bivirkninger kan forårsage død.
I en undersøgelse hos kvinder, der stadig havde deres livmoder
- Ud af hver 1.000 kvinder, der fik placebo, fik 1 hvert år endometriecancer (kræft i livmoderslimhinden), og ingen fik uterin sarkom (kræft i livmoderkroppen).
- Ud af hver 1.000 kvinder, der tog NOLVADEX (tamoxifencitrat), fik 2 hvert år endometriecancer og færre end 1 fik livmodersarkom.
Disse resultater viser, at i gennemsnit hos kvinder med høj risiko som stadig havde deres livmoder NOLVADEX (tamoxifencitrat) fordoblede chancen for at få endometriecancer fra 1 ud af 1.000 til 2 ud af 1.000, og det øgede chancen for at få livmodersarkom. Dette betyder ikke, at indtagelse af NOLVADEX (tamoxifencitrat) vil fordoble din personlige chance for at få endometriecancer eller øge din chance for at få livmodersarkom. Vi ved ikke, hvad denne risiko vil være for en kvinde. Risikoen er anderledes for kvinder, der ikke længere har deres livmoder.
For alle kvinder i denne undersøgelse øgede indtagelse af NOLVADEX (tamoxifencitrat) risikoen for at få en blodprop i deres lunger eller vener eller for at få et slagtilfælde. I nogle tilfælde døde kvinder af disse virkninger.
NOLVADEX (tamoxifencitrat) øgede risikoen for at få grå stær (uklarhed af øjets linse) eller behov for operation af grå stær. (Se "Hvad er de mulige bivirkninger af NOLVADEX (tamoxifencitrat)?" for flere detaljer om bivirkninger.)
Hvad ved vi ikke om at tage NOLVADEX (tamoxifencitrat) for at reducere risikoen for at få brystkræft?
Vi ved det ikke
- hvis NOLVADEX (tamoxifencitrat) sænker chancen for at få brystkræft hos kvinder, der har unormale brystkræftgener (BRCA1 og BRCA2)
- hvis du tager NOLVADEX (tamoxifencitrat) i 5 år reducerer antallet af brystkræfttilfælde, som en kvinde vil få i løbet af sin levetid, eller hvis det kun forsinker nogle brystkræftformer
- hvis NOLVADEX (tamoxifencitrat) hjælper en kvinde med at leve længere
- virkningerne af at tage NOLVADEX (tamoxifencitrat) sammen med hormonsubstitutionsterapi (HRT), p-piller eller androgener (mandlige hormoner)
- fordelene ved at tage NOLVADEX (tamoxifencitrat), hvis du er under 35 år
Der udføres undersøgelser for at lære mere om de langsigtede fordele og risici ved at bruge NOLVADEX (tamoxifencitrat) for at reducere chancen for at få brystkræft.
Hvad er de mulige bivirkninger af NOLVADEX (tamoxifencitrat)?
Den mest almindelige bivirkning af NOLVADEX (tamoxifencitrat) er hedeture. Dette er ikke et tegn på et alvorligt problem.
Den næstmest almindelige bivirkning er udflåd fra skeden. Hvis udflådet er blodigt, kan det være et tegn på et alvorligt problem. [Se "Ændringer i slimhinden (endometriet) eller kroppen af din livmoder" nedenfor.]
Mindre almindelige, men alvorlige bivirkninger af NOLVADEX (tamoxifencitrat) er anført nedenfor. Disse kan forekomme når som helst. Kontakt din læge med det samme, hvis du har nogen tegn på bivirkninger, der er anført nedenfor:
- Ændringer i slimhinden (endometrium) eller kroppen af din livmoder. Disse ændringer kan betyde, at alvorlige problemer begynder, herunder kræft i livmoderen. Tegnene på ændringer i livmoderen er:
- Vaginal blødning eller blodigt udflåd, der kan have en rusten eller brun farve. Du bør ringe til din læge, selvom der kun forekommer en lille mængde blødning.
- Ændringer i din månedlige blødning, såsom mængden eller tidspunktet for blødning eller øget koagulation.
- Smerter eller tryk i dit bækken (under din navle).
- Blodpropper i dine vener eller lunger. Disse kan forårsage alvorlige problemer, herunder død. Du kan få blodpropper op til 2-3 måneder efter du holder op med at tage NOLVADEX (tamoxifencitrat). Symptomerne på blodpropper er:
- pludselige brystsmerter, åndenød, hoste blod op
- smerte, ømhed eller hævelse i et eller begge dine ben
- Slag. Slagtilfælde kan forårsage alvorlige medicinske problemer, herunder død. Tegnene på slagtilfælde er:
- pludselig svaghed, prikken eller følelsesløshed i dit ansigt, arm eller ben, især på den ene side af din krop
- pludselig forvirring, problemer med at tale eller forstå
- pludselige problemer med at se på det ene eller begge øjne
- pludselige gangbesvær, svimmelhed, tab af balance eller koordination
- pludselig alvorlig hovedpine uden kendt årsag
- Grå stær eller øget chance for at have behov for operation for grå stær. Tegnet på disse problemer er langsom sløring af dit syn.
- Leverproblemer, herunder gulsot. Tegnene på leverproblemer omfatter manglende appetit og gulfarvning af din hud eller det hvide i dine øjne.
Disse er ikke alle de mulige bivirkninger af NOLVADEX (tamoxifencitrat). For en komplet liste, spørg din læge eller apotek.
Hvem bør ikke tage NOLVADEX (tamoxifencitrat)?
Tag ikke NOLVADEX (tamoxifencitrat) af nogen grund, hvis du
- Er gravid eller planlægger at blive gravid, mens du tager NOLVADEX (tamoxifencitrat) eller i løbet af de 2 måneder efter du holder op med at tage NOLVADEX (tamoxifencitrat). NOLVADEX (tamoxifencitrat) kan skade dit ufødte barn. Det tager omkring 2 måneder at fjerne NOLVADEX (tamoxifencitrat) fra din krop. For at være sikker på, at du ikke er gravid, kan du begynde at tage NOLVADEX (tamoxifencitrat), mens du har din menstruation. Eller du kan tage en graviditetstest for at være sikker på, at du ikke er gravid, før du begynder.
- Ammer. Vi ved ikke, om NOLVADEX (tamoxifencitrat) kan passere gennem din mælk og skade din baby.
- Har haft en allergisk reaktion på NOLVADEX (tamoxifencitrat) eller tamoxifen (det andet navn for NOLVADEX (tamoxifencitrat) ), eller til nogen af dets inaktive ingredienser.
Hvis du bliver gravid, mens du tager NOLVADEX (tamoxifencitrat), skal du stoppe med at tage det med det samme og kontakte din læge. NOLVADEX (tamoxifencitrat) kan skade dit ufødte barn. Tag ikke NOLVADEX (tamoxifencitrat) for at mindske din chance for at få brystkræft
- Du har nogensinde haft en blodprop, der havde brug for medicinsk behandling.
- Du tager medicin for at fortynde dit blod, f.eks. warfarin (også kaldet Coumadin®*).
- Din evne til at bevæge sig rundt er begrænset i det meste af dine vågne timer.
- Du er i fare for blodpropper. Din læge kan fortælle dig, om du har høj risiko for blodpropper.
- Du har ikke en større chance end normalt for at få brystkræft. Din læge kan fortælle dig, om du er en højrisikokvinde.
Hvordan skal jeg tage NOLVADEX (tamoxifencitrat)?
- Synk tabletten/tabletterne hele med vand eller en anden ikke-alkoholholdig væske. Du kan tage NOLVADEX (tamoxifencitrat) med eller uden mad. Tag din medicin hver dag. Det kan være lettere at huske, hvis du tager det på samme tidspunkt hver dag.
- Hvis du glemmer en dosis, så tag den, når du husker det, og tag derefter den næste dosis som normalt. Hvis det næsten er tid til din næste dosis, eller du husker det ved din næste dosis, må du ikke tage ekstra tabletter som erstatning for den glemte dosis.
- Tag NOLVADEX (tamoxifencitrat) i 5 år, medmindre din læge fortæller dig noget andet.
Hvad skal jeg undgå, mens jeg tager NOLVADEX (tamoxifencitrat)?
- Bliv ikke gravid, mens du tager NOLVADEX (tamoxifencitrat) eller i 2 måneder efter du er stoppet. NOLVADEX (tamoxifencitrat) kan forhindre hormonelle præventionsmetoder i at virke. Hormonelle metoder omfatter p-piller, plastre, injektioner, ringe og implantater. Derfor, mens du tager NOLVADEX (tamoxifencitrat), bruge præventionsmetoder, der ikke bruger hormoner, såsom kondomer, membraner med sæddræbende middel eller almindelige spiraler. Hvis du bliver gravid, skal du stoppe med at tage NOLVADEX (tamoxifencitrat) med det samme og ringe til din læge.
- Må ikke amme. Vi ved ikke, om NOLVADEX (tamoxifencitrat) kan passere gennem din mælk, og om det kan skade barnet.
Hvad skal jeg gøre, mens jeg tager NOLVADEX (tamoxifencitrat)?
- Få regelmæssige gynækologiske undersøgelser ("kvindelige undersøgelser"), brystundersøgelser og mammografi. Din læge vil fortælle dig, hvor ofte. Disse vil kontrollere for tegn på brystkræft og kræft i endometrium (slimhinden i livmoderen). Fordi NOLVADEX (tamoxifencitrat) ikke forhindrer alle brystkræftformer, og du kan få andre former for kræft, har du brug for disse undersøgelser for at finde eventuelle kræftformer så tidligt som muligt.
- Fordi NOLVADEX (tamoxifencitrat) kan forårsage alvorlige bivirkninger, skal du være meget opmærksom på din krop. Tegn, du bør kigge efter, er anført i "Hvad er de mulige bivirkninger af NOLVADEX (tamoxifencitrat)?"
- Fortæl alle lægerne, at du ser, at du tager NOLVADEX (tamoxifencitrat).
- Fortæl din læge med det samme, hvis du har nye brystklumper.
Generel information om sikker og effektiv brug af NOLVADEX (tamoxifencitrat)
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Din læge har kun ordineret NOLVADEX (tamoxifencitrat) til dig. Giv det ikke til andre mennesker, selvom de har en lignende tilstand, fordi det kan skade dem. Brug det ikke til en tilstand, som det ikke er ordineret til.
Denne medicinvejledning er et resumé af information om NOLVADEX (tamoxifencitrat) til kvinder, der bruger NOLVADEX (tamoxifencitrat) for at mindske deres høje chance for at få brystkræft, eller som har DCIS. Spørg din læge eller apotek, hvis du ønsker mere information om NOLVADEX (tamoxifencitrat). De kan give dig information om NOLVADEX (tamoxifencitrat), der er skrevet til sundhedspersonale. For mere information om NOLVADEX (tamoxifencitrat) eller brystkræft, besøg venligst www.NOLVADEX (tamoxifencitrat) .com eller ring på 1-800-236-9933.
Ingredienser: tamoxifencitrat, carboxymethylcellulose calcium, magnesiumstearat, mannitol og stivelse.
Denne medicinvejledning er godkendt af US Food and Drug Administration
