Neoral 25mg, 100mg Cyclosporine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Neoral 25mg, og hvordan bruges det?
Neoral 25mg er en receptpligtig medicin, der bruges til at forebygge organafstødning efter transplantation og til at behandle symptomerne på leddegigt og psoriasis. Neoral kan bruges alene eller sammen med anden medicin.
Neoral tilhører en klasse af lægemidler kaldet DMARDs, immunmodulatorer; Immunsuppressiva; Calcineurin-hæmmere.
Det vides ikke, om Neoral 25mg er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Neoral?
Neoral kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- problemer med tale, tanke, syn eller muskelbevægelser,
- anfald,
- svær hovedpine,
- sløret syn,
- dunkende i nakken eller ørerne,
- bleg hud,
- let blå mærker,
- usædvanlig blødning,
- kvalme,
- svaghed,
- prikkende følelse,
- brystsmerter,
- uregelmæssige hjerteslag,
- tab af bevægelse,
- lidt eller ingen vandladning,
- hævelse i dine fødder eller ankler,
- træthedsfornemmelse,
- stakåndet,
- mistet appetiten,
- mavesmerter (øverst til højre),
- gulfarvning af hud eller øjne,
- feber,
- kuldegysninger,
- influenza symptomer,
- sår i munden,
- hudsår,
- ondt i halsen, og
- hoste
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Neoral omfatter:
- rysten eller rysten,
- acne,
- øget vækst af ansigts- eller kropsbehåring,
- forhøjet blodtryk,
- kvalme,
- diarré, og
- hævede eller smertefulde tandkød
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Neoral. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
Kun læger med erfaring i behandling af systemisk immunsuppressiv terapi for den indikerede sygdom bør ordinere Neoral®. Ved doser, der anvendes til solid organtransplantation, bør kun læger med erfaring i immunsuppressiv behandling og behandling af organtransplanterede modtagere ordinere Neoral®. Patienter, der modtager lægemidlet, bør behandles i faciliteter udstyret og bemandet med passende laboratorie- og understøttende medicinske ressourcer. Den læge, der er ansvarlig for vedligeholdelsesbehandlingen, bør have fuldstændig information, der er nødvendig for opfølgning af patienten. Neoral®, et systemisk immunsuppressivt middel, kan øge modtageligheden for infektion og udvikling af neoplasi. Hos nyre-, lever- og hjertetransplanterede patienter kan Neoral® administreres sammen med andre immunsuppressive midler. Øget modtagelighed for infektion og mulig udvikling af lymfom og andre neoplasmer kan skyldes stigningen i graden af immunsuppression hos transplanterede patienter.
Neoral® Soft Gelatine Capsules (cyclosporinkapsler, USP) MODIFIED og Neoral® Oral Solution (cyclosporin oral opløsning, USP) MODIFIED har øget biotilgængelighed sammenlignet med Sandimmune® Soft Gelatine Capsules (cyclosporinkapsler, USP) og Sandimmune® Oral Solution (cyclosporin oral opløsning) løsning, USP). Neoral® og Sandimmune® er ikke bioækvivalente og kan ikke anvendes i flæng uden en læges tilsyn. For en given bundkoncentration vil eksponeringen for cyclosporin være større med Neoral® end med Sandimmune®. Hvis en patient, som får usædvanlig høje doser af Sandimmune®, konverteres til Neoral®, skal der udvises særlig forsigtighed. Cyclosporin-blodkoncentrationer bør overvåges hos transplanterede og reumatoid arthritispatienter, der tager Neoral® for at undgå toksicitet på grund af høje koncentrationer. Dosisjusteringer bør foretages hos transplanterede patienter for at minimere mulig organafstødning på grund af lave koncentrationer. Sammenligning af blodkoncentrationer i den publicerede litteratur med blodkoncentrationer opnået ved brug af nuværende analyser skal foretages med detaljeret viden om de anvendte analysemetoder.
For psoriasispatienter (se også ADVARSLER I INDKAMMET ovenfor)
Psoriasispatienter, der tidligere er behandlet med PUVA og i mindre grad methotrexat eller andre immunsuppressive midler, UVB, stenkulstjære eller strålebehandling, har en øget risiko for at udvikle ondartede hudsygdomme, når de tager Neoral®.
Cyclosporin, den aktive ingrediens i Neoral®, kan i anbefalede doser forårsage systemisk hypertension og nefrotoksicitet. Risikoen stiger med stigende dosis og varighed af ciclosporinbehandling. Renal dysfunktion, herunder strukturel nyreskade, er en potentiel konsekvens af ciclosporin, og derfor skal nyrefunktionen overvåges under behandlingen.
BESKRIVELSE
Neoral® er en oral formulering af cyclosporin, der straks danner en mikroemulsion i et vandigt miljø.
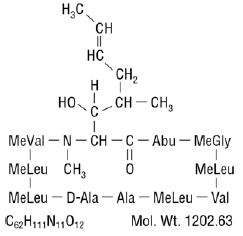
Cyclosporin, det aktive stof i Neoral®, er et cyklisk polypeptid immunsuppressivt middel bestående af 11 aminosyrer. Det produceres som en metabolit af svampearten Beauveria nivea.
Kemisk betegnes cyclosporin som [R-[R*,R*-(E)]]-cyklisk-(L-alanyl-D-alanyl-N-methyl-L-leucyl-N-methyl-L-leucyl-N-methyl -L-valyl-3-hydroxy-N,4-dimethyl-L-2-amino-6-octenoyl-L-a-aminobutyryl-N-methylglycyl-N-methyl-L-leucyl-L-valyl-N-methyl -L-leucyl).
Neoral® Soft Gelatine Capsules (cyclosporinkapsler, USP) MODIFIED fås i styrkerne 25 mg og 100 mg.
Hver 25 mg kapsel indeholder:
cyclosporin………………………………25 mg alkohol, USP dehydreret.................................11,9 % v/v (9,5 % vægt/volumen)
Hver 100 mg kapsel indeholder:
cyclosporin…………………………………...100 mg alkohol, USP dehydreret.............................11.9 % v/v (9,5 % vægt/volumen)
Inaktive ingredienser: Majsolie-mono-di-triglycerider, polyoxyl 40 hydrogeneret ricinusolie NF, DL-αtocopherol USP, gelatine NF, glycerol, sort jernoxid, propylenglycol USP, titaniumdioxid USP, karmin og andre ingredienser.
Neoral® oral opløsning (cyclosporin oral opløsning, USP) MODIFIED fås i 50 ml flasker.
Hver ml indeholder:
cyclosporin………………………………..................100 mg/ml alkohol, USP dehydreret................ ...........11,9 % v/v (9,5 % vægt/vol.)
Inaktive ingredienser: Majsolie-mono-di-triglycerider, polyoxyl 40 hydrogeneret ricinusolie NF, DL-α tocopherol USP, propylenglycol USP.
Den kemiske struktur af cyclosporin (også kendt som cyclosporin A) er:
INDIKATIONER
Nyre-, lever- og hjertetransplantation
Neoral 25 mg er indiceret til profylakse af organafstødning ved allogene nyre-, lever- og hjertetransplantationer. Neoral 100 mg er blevet brugt i kombination med azathioprin og kortikosteroider.
Rheumatoid arthritis
Neoral er indiceret til behandling af patienter med svær aktiv reumatoid arthritis, hvor sygdommen ikke har reageret tilstrækkeligt på methotrexat. Neoral kan anvendes i kombination med methotrexat til patienter med reumatoid arthritis, som ikke reagerer tilstrækkeligt på methotrexat alene.
Psoriasis
Neoral er indiceret til behandling af voksne, ikke-immunkompromitterede patienter med svær (dvs. omfattende og/eller invaliderende), genstridig plakpsoriasis, som ikke har reageret på mindst én systemisk behandling (f.eks. PUVA, retinoider eller methotrexat) eller i patienter, for hvem andre systemiske behandlinger er kontraindiceret eller ikke kan tolereres.
Mens rebound sjældent forekommer, vil de fleste patienter opleve tilbagefald med Neoral 100 mg som med andre behandlinger ved ophør af behandlingen.
DOSERING OG ADMINISTRATION
Neoral 25 mg bløde gelatinekapsler (cyclosporinkapsler, USP) MODIFICERET og Neoral oral opløsning (cyclosporin oral opløsning, USP) MODIFICER D
Neoral har øget biotilgængelighed sammenlignet med Sandimmune. Neoral 25mg og Sandimmune er ikke bioækvivalente og kan ikke anvendes i flæng uden lægens opsyn.
Den daglige dosis af Neoral 100 mg bør altid gives i to opdelte doser (BID). Det anbefales, at Neoral administreres efter en ensartet tidsplan med hensyn til tidspunkt på dagen og forhold til måltider. Grapefrugt og grapefrugtjuice påvirker stofskiftet, hvilket øger blodkoncentrationen af cyclosporin, bør derfor undgås.
Specifikke populationer
Nedsat nyrefunktion ved nyre-, lever- og hjertetransplantation
Cyclosporin gennemgår minimal renal elimination, og dets farmakokinetik ser ikke ud til at være væsentligt ændret hos patienter med nyresygdom i slutstadiet, som får rutinemæssige hæmodialysebehandlinger (se KLINISK FARMAKOLOGI ). Men på grund af dets nefrotoksiske potentiale (se ADVARSLER ), anbefales omhyggelig overvågning af nyrefunktionen; cyclosporindosis bør reduceres, hvis det er indiceret (se ADVARSLER og FORHOLDSREGLER ).
Nedsat nyrefunktion ved reumatoid arthritis og psoriasis
Patienter med nedsat nyrefunktion bør ikke få ciclosporin (se KONTRAINDIKATIONER , ADVARSLER og FORHOLDSREGLER ).
Nedsat leverfunktion
Clearance af ciclosporin kan være betydeligt reduceret hos patienter med svær leversygdom (se KLINISK FARMAKOLOGI ). Dosisreduktion kan være nødvendig hos patienter med alvorligt nedsat leverfunktion for at opretholde blodkoncentrationerne inden for det anbefalede målområde (se ADVARSLER og FORHOLDSREGLER ).
Nytransplanterede patienter
Den indledende orale dosis af Neoral 25 mg kan gives 4 til 12 timer før transplantation eller gives postoperativt. Den initiale dosis af Neoral 25 mg varierer afhængigt af det transplanterede organ og de andre immunsuppressive midler, der er inkluderet i den immunsuppressive protokol. Hos nytransplanterede patienter er den indledende orale dosis af Neoral den samme som den indledende orale dosis af Sandimmune. Foreslåede startdoser er tilgængelige fra resultaterne af en undersøgelse fra 1994 af brugen af Sandimmune i amerikanske transplantationscentre. De gennemsnitlige ± SD startdoser var 9 ± 3 mg/kg/dag for nyretransplanterede patienter (75 centre), 8 ± 4 mg/kg/dag for levertransplanterede patienter (30 centre) og 7 ± 3 mg/kg/dag til hjertetransplanterede patienter (24 centre). Samlede daglige doser blev opdelt i to lige store daglige doser. Neoral-dosis justeres efterfølgende for at opnå en foruddefineret koncentration af ciclosporin i blodet (se Blodkoncentrationsovervågning hos transplanterede patienter nedenfor). Hvis der anvendes ciclosporin dalkoncentrationer i blodet, er målområdet det samme for Neoral 100 mg som for Sandimmune. Anvendelse af det samme dalkoncentrationsmålområde for Neoral 100 mg som for Sandimmune resulterer i større eksponering for cyclosporin, når Neoral administreres (se Farmakokinetik, Absorption ). Dosering bør titreres baseret på kliniske vurderinger af afstødning og tolerabilitet. Lavere Neoral 100 mg doser kan være tilstrækkelige som vedligeholdelsesbehandling.
Tillægsbehandling med binyrekortikosteroider anbefales indledningsvis. Forskellige nedtrappende doseringsskemaer af prednison ser ud til at opnå lignende resultater. Et repræsentativt doseringsskema baseret på patientens vægt startede med 2,0 mg/kg/dag i de første 4 dage nedtrappet til 1,0 mg/kg/dag i 1 uge, 0,6 mg/kg/dag i 2 uger, 0,3 mg/kg/dag 1 måned og 0,15 mg/kg/dag i 2 måneder og derefter som vedligeholdelsesdosis. Steroiddoser kan nedtrappes yderligere på individuel basis afhængigt af patientens status og transplantatets funktion. Justering af dosis af prednison skal foretages i henhold til den kliniske situation.
Konvertering fra Sandimmune til Neoral 25 mg hos transplanterede patienter
Hos transplanterede patienter, som overvejes at konvertere til Neoral fra Sandimmune, bør Neoral startes med den samme daglige dosis, som tidligere blev brugt med Sandimmune (1:1 dosiskonvertering). Neoral-dosis bør efterfølgende justeres for at opnå den laveste koncentration af cyclosporin i blodet før konvertering. Anvendelse af det samme dalkoncentrationsmålområde for Neoral 100 mg som for Sandimmune resulterer i større eksponering for cyclosporin, når Neoral administreres (se Farmakokinetik, Absorption ). Patienter med mistanke om dårlig absorption af Sandimmune kræver forskellige doseringsstrategier (se Transplantationspatienter med dårlig absorption af sandimmun, under). Hos nogle patienter er stigningen i dalkoncentrationen i blodet mere udtalt og kan være af klinisk betydning.
Indtil dalkoncentrationen i blodet når præ-konverteringsværdien, anbefales det kraftigt, at ciclosporin-koncentrationen i blodet overvåges hver 4. til 7. dag efter konvertering til Neoral Derudover bør kliniske sikkerhedsparametre, såsom serumkreatinin og blodtryk, monitoreres hver anden uge i de første to måneder efter konvertering. Hvis dalkoncentrationerne i blodet er uden for det ønskede interval, og/eller hvis de kliniske sikkerhedsparametre forværres, skal dosis af Neoral 100 mg justeres i overensstemmelse hermed.
Transplantationspatienter med dårlig absorption af sandimmun
Patienter med lavere end forventet ciklosporin-blodkoncentrationer i forhold til den orale dosis af Sandimmune kan have dårlig eller inkonsekvent absorption af cyclosporin fra Sandimmune. Efter konvertering til Neoral har patienter en tendens til at have højere ciclosporinkoncentrationer. På grund af stigningen i biotilgængeligheden af cyclosporin efter konvertering til Neoral, kan dalkoncentrationen af cyclosporin i blodet overstige målområdet. Der bør udvises særlig forsigtighed, når patienter konverteres til Neoral 100 mg ved doser større end 10 mg/kg/dag. Dosis af Neoral bør titreres individuelt baseret på ciclosporin-dalkoncentrationer, tolerabilitet og klinisk respons. I denne population bør dalkoncentrationen af cyclosporin i blodet måles hyppigere, mindst to gange om ugen (dagligt, hvis startdosis overstiger 10 mg/kg/dag), indtil koncentrationen stabiliserer sig inden for det ønskede område.
Rheumatoid arthritis
Den initiale dosis af Neoral er 2,5 mg/kg/dag, taget to gange dagligt som en delt (BID) oral dosis. Salicylater, NSAID'er og orale kortikosteroider kan fortsættes (se ADVARSLER og FORHOLDSREGLER , DRUGSINTERAKTIONER ). Virkningen indtræder normalt mellem 4 og 8 uger. Hvis der ses utilstrækkelig klinisk fordel, og tolerabiliteten er god (inklusive serumkreatinin mindre end 30 % over baseline), kan dosis øges med 0,5 til 0,75 mg/kg/dag efter 8 uger og igen efter 12 uger til maksimalt 4 mg /kg/dag. Hvis der ikke ses nogen fordel efter 16 ugers behandling, bør Neoral 25 mg-behandling seponeres.
Dosisreduktioner med 25 % til 50 % bør foretages til enhver tid for at kontrollere bivirkninger, f.eks. forhøjet blodtryk i serumkreatinin (30 % over patientens niveau før behandling) eller klinisk signifikante laboratorieabnormiteter (se ADVARSLER og FORHOLDSREGLER ).
Hvis dosisreduktion ikke er effektiv til at kontrollere abnormiteter, eller hvis bivirkningen eller abnormiteten er alvorlig, skal Neoral 25 mg seponeres. Den samme startdosis og dosisinterval bør anvendes, hvis Neoral 25 mg kombineres med den anbefalede dosis methotrexat. De fleste patienter kan behandles med Neoral 25 mg doser på 3 mg/kg/dag eller derunder, når de kombineres med methotrexat doser på op til 15 mg/uge (se KLINISK FARMAKOLOGI , Kliniske forsøg ).
Der er begrænsede langtidsbehandlingsdata. Gentagelse af reumatoid arthritis sygdomsaktivitet er generelt synlig inden for 4 uger efter ophør med ciclosporin.
Psoriasis
Startdosis af Neoral 100 mg bør være 2,5 mg/kg/dag. Neoral bør tages to gange dagligt som en delt (1,25 mg/kg BID) oral dosis. Patienter bør holdes ved denne dosis i mindst 4 uger, undtagen bivirkninger. Hvis der ikke er indtruffet signifikant klinisk bedring hos patienter på det tidspunkt, bør patientens dosis øges med 2-ugers intervaller. Baseret på patientens respons bør dosisforøgelser på ca. 0,5 mg/kg/dag foretages til maksimalt 4,0 mg/kg/dag.
Dosisreduktioner med 25 % til 50 % bør foretages til enhver tid for at kontrollere bivirkninger, f.eks. hypertension, forhøjelser i serumkreatinin (≥ 25 % over patientens niveau før behandling) eller klinisk signifikante laboratorieabnormiteter. Hvis dosisreduktion ikke er effektiv til at kontrollere abnormiteter, eller hvis bivirkningen eller abnormiteten er alvorlig, skal Neoral 25 mg seponeres (se Særlig overvågning af psoriasispatienter ).
Patienter viser generelt en vis forbedring i de kliniske manifestationer af psoriasis i løbet af 2 uger. Tilfredsstillende kontrol og stabilisering af sygdommen kan tage 12 til 16 uger at opnå. Resultater af et klinisk forsøg med dosistitrering med Neoral 25 mg indikerer, at en forbedring af psoriasis med 75 % eller mere (baseret på PASI) blev opnået hos 51 % af patienterne efter 8 uger og hos 79 % af patienterne efter 16 uger. Behandlingen bør seponeres, hvis tilfredsstillende respons ikke kan opnås efter 6 uger ved 4 mg/kg/dag eller patientens maksimalt tolererede dosis. Når en patient er tilstrækkeligt kontrolleret og ser stabil ud, bør dosis af Neoral 25 mg sænkes, og patienten behandles med den laveste dosis, der opretholder et tilstrækkeligt respons (dette bør ikke nødvendigvis være total clearing af patienten). I kliniske forsøg var ciclosporindoser i den nedre ende af det anbefalede dosisinterval effektive til at opretholde et tilfredsstillende respons hos 60 % af patienterne. Doser under 2,5 mg/kg/dag kan også være lige så effektive.
Ved ophør af behandling med ciclosporin vil der opstå tilbagefald efter ca. 6 uger (50 % af patienterne) til 16 uger (75 % af patienterne). Hos størstedelen af patienterne forekommer rebound ikke efter ophør af behandling med ciclosporin. Tretten tilfælde af transformation af kronisk plakpsoriasis til mere alvorlige former for psoriasis er blevet rapporteret. Der var 9 tilfælde af pustulær og 4 tilfælde af erytrodermisk psoriasis. Langtidserfaring med Neoral hos psoriasispatienter er begrænset, og kontinuerlig behandling i længere perioder på mere end et år anbefales ikke. Skift med andre former for behandling bør overvejes i den langsigtede behandling af patienter med denne livslange sygdom.
Neoral 25 mg oral opløsning (cyclosporin oral opløsning, USP) MODIFICERET - anbefalinger til administration
For at gøre Neoral 25 mg oral opløsning (cyclosporin oral opløsning, USP) MODIFIED mere velsmagende, bør den fortyndes med appelsin- eller æblejuice, der er ved stuetemperatur. Patienter bør undgå at skifte fortynder ofte. Grapefrugtjuice påvirker metabolismen af cyclosporin og bør undgås. Kombinationen af Neoral opløsning med mælk kan være ubehagelig. Effekten af mælk på biotilgængeligheden af cyclosporin, når det administreres som Neoral 100 mg oral opløsning, er ikke blevet evalueret.
Tag den foreskrevne mængde Neoral 25 mg oral opløsning (cyclosporin oral opløsning, USP) MODIFICERET fra beholderen ved hjælp af den medfølgende doseringssprøjte, efter fjernelse af beskyttelseslåget, og overfør opløsningen til et glas appelsin- eller æblejuice. Rør godt rundt og drik med det samme. Lad ikke fortyndet oral opløsning stå, før du drikker. Brug en glasbeholder (ikke plastik). Skyl glasset med mere fortyndingsmiddel for at sikre, at den samlede dosis er forbrugt. Efter brug skal du tørre ydersiden af doseringssprøjten med et rent håndklæde og sætte beskyttelsesdækslet på igen. Skyl ikke doseringssprøjten med vand eller andre rengøringsmidler. Hvis sprøjten skal renses, skal den være helt tør, før den genoptages.
Blodkoncentrationsovervågning hos transplanterede patienter
Transplantationscentre har fundet ud af, at blodkoncentrationsovervågning af cyclosporin er en væsentlig komponent i patientbehandlingen. Af betydning for blodkoncentrationsanalyse er den anvendte type assay, det transplanterede organ og andre immunsuppressive midler, der administreres. Selvom der ikke er etableret nogen fast sammenhæng, kan overvågning af blodkoncentrationer hjælpe med den kliniske evaluering af afstødning og toksicitet, dosisjusteringer og vurdering af compliance.
Forskellige analyser er blevet brugt til at måle blodkoncentrationer af cyclosporin. Ældre undersøgelser, der anvender et uspecifikt assay, citerede ofte koncentrationer, der var omtrent det dobbelte af de specifikke assays. Derfor skal sammenligning mellem koncentrationer i den publicerede litteratur og en individuel patientkoncentration ved hjælp af nuværende assays foretages med detaljeret viden om de anvendte assaymetoder. Aktuelle analyseresultater er heller ikke udskiftelige, og deres anvendelse bør være styret af deres godkendte mærkning. En diskussion af de forskellige assaymetoder er indeholdt i Annals of Clinical Biochemistry 1994; 31: 420-446. Mens flere assays og assaymatricer er tilgængelige, er der konsensus om, at forældre-forbindelsesspecifikke assays korrelerer bedst med kliniske hændelser. Af disse er HPLC standardreferencen, men det monoklonale antistof RIA'er og det monoklonale antistof FPIA tilbyder følsomhed, reproducerbarhed og bekvemmelighed. De fleste klinikere baserer deres monitorering på laveste koncentrationer af cyclosporin. Applied Pharmacokinetics, Principles of Therapeutic Drug Monitoring (1992) indeholder en bred diskussion af cyclosporins farmakokinetik og lægemiddelovervågningsteknikker. Blodkoncentrationsmonitorering er ikke en erstatning for nyrefunktionsmonitorering eller vævsbiopsier.
HVORDAN LEVERET
Neoral® bløde gelatinekapsler (cyclosporinkapsler, USP) MODIFICERET
25 mg
Oval, blågrå præget i rødt, "Neoral" over "25 mg."
Pakninger med 30 enhedsdosisblister ( NDC 0078-0246-15).
100 mg
Aflang, blågrå præget i rødt, "NEORAL" over "100 mg."
Pakninger med 30 enhedsdosisblister ( NDC 0078-0248-15).
Opbevar og dispenser
I den originale enhedsdosisbeholder ved kontrolleret stuetemperatur 68°F til 77°F (20°C til 25°C).
Neoral® oral opløsning (cyclosporin oral opløsning, USP) MODIFICERET
En klar, gul væske leveret i 50 ml flasker indeholdende 100 mg/ml ( NDC 0078-0274-22).
Opbevar og dispenser
den originale beholder ved kontrolleret stuetemperatur 68°F til 77°F (20° til 25°C). Må ikke opbevares i køleskabet. Efter åbning skal indholdet bruges inden for to måneder. Ved temperaturer under 68°F (20°C) kan opløsningen gelere; let flokkulering eller dannelse af et let sediment kan også forekomme. Der er ingen indflydelse på produktets ydeevne eller dosering ved brug af den medfølgende sprøjte. Lad det varme op til stuetemperatur 77°F (25°C) for at vende disse ændringer.
Neoral® bløde gelatinekapsler (cyclosporinkapsler, USP) MODIFICERET
Neoral® oral opløsning (cyclosporin oral opløsning, USP) MODIFICERET
Distribueret af: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Revideret juni 2021.
BIVIRKNINGER
Nyre-, lever- og hjertetransplantation
De vigtigste bivirkninger ved cyclosporinbehandling er nyreinsufficiens, tremor, hirsutisme, hypertension og tandkødshyperplasi.
Forhøjet blodtryk
Hypertension, som sædvanligvis er mild til moderat, kan forekomme hos ca. 50 % af patienterne efter nyretransplantation og hos de fleste hjertetransplanterede patienter.
Glomerulær kapillær trombose
Glomerulær kapillær trombose er blevet fundet hos patienter behandlet med ciclosporin og kan udvikle sig til graftsvigt. De patologiske forandringer lignede dem, der ses ved hæmolytisk-uremisk syndrom og omfattede trombose af den renale mikrovaskulatur, med blodplade-fibrintrombi, der okkluderer glomerulære kapillærer og afferente arterioler, mikroangiopatisk hæmolytisk anæmi, trombocytopeni og nedsat nyrefunktion. Lignende resultater er blevet observeret, når andre immunsuppressive midler er blevet anvendt efter transplantation.
Hypomagnesæmi
Hypomagnesæmi er blevet rapporteret hos nogle, men ikke alle, patienter, der udviser kramper under behandling med ciclosporin. Selvom undersøgelser af magnesiumdepletering hos normale forsøgspersoner tyder på, at hypomagnesæmi er forbundet med neurologiske lidelser, synes flere faktorer, herunder hypertension, højdosis methylprednisolon, hypokolesterolæmi og nefrotoksicitet forbundet med høje plasmakoncentrationer af cyclosporin, at være relateret til de neurologiske manifestationer af cyclosporintoksicitet.
DRUGSINTERAKTIONER
Virkning af lægemidler og andre midler på cyclosporins farmakokinetik og/eller sikkerhed
Alle de individuelle lægemidler citeret nedenfor er veldokumenterede til at interagere med cyclosporin. Derudover kan samtidig brug af NSAID'er og cyclosporin, især i forbindelse med dehydrering, forstærke nyreinsufficiens. Der skal udvises forsigtighed ved brug af andre lægemidler, som vides at svække nyrefunktionen (se ADVARSLER , Nefrotoksicitet ).
Lægemidler, der kan forstærke nyreinsufficiens
Ved samtidig brug af et lægemiddel, der kan udvise additiv eller synergistisk nyreinsufficiens med ciclosporin, bør der udføres tæt monitorering af nyrefunktionen (især serumkreatinin). Hvis der opstår en betydelig svækkelse af nyrefunktionen, bør dosis af det samtidig administrerede lægemiddel reduceres, eller en alternativ behandling bør overvejes.
Cyclosporin metaboliseres i vid udstrækning af CYP 3A isoenzymer, især CYP3A4, og er et substrat for multidrug efflux transporteren P-glycoprotein. Forskellige midler vides enten at øge eller reducere plasma- eller fuldblodskoncentrationer af cyclosporin, sædvanligvis ved hæmning eller induktion af CYP3A4 eller P-glykoproteintransporter eller begge dele. Forbindelser, der nedsætter cyclosporinabsorptionen, såsom orlistat, bør undgås. Passende Neoral 100 mg dosisjustering for at opnå de ønskede ciclosporinkoncentrationer er afgørende, når lægemidler, der væsentligt ændrer ciclosporinkoncentrationerne anvendes samtidigt (se B overvågning af blodkoncentration ).
1. Lægemidler, der øger koncentrationen af cyklosporin
HIV-proteasehæmmere
HIV-proteasehæmmere (f.eks. indinavir, nelfinavir, ritonavir og saquinavir) er kendt for at hæmme cytochrom P-450 3A og kan derfor potentielt øge koncentrationerne af cyclosporin, men der er ingen formelle undersøgelser af interaktionen tilgængelige. Der skal udvises forsigtighed, når disse lægemidler administreres samtidigt.
Grapefrugtjuice
Grapefrugt og grapefrugtjuice påvirker stofskiftet, hvilket øger blodkoncentrationen af cyclosporin, bør derfor undgås.
2. Lægemidler/kosttilskud, der nedsætter koncentrationen af cyklosporin
Bosentan
Samtidig administration af bosentan (250 til 1000 mg hver 12. time baseret på tolerabilitet) og cyclosporin (300 mg hver 12. time i 2 dage, derefter dosering for at opnå en Cmax på 200 til 250 ng/ml) i 7 dage hos raske forsøgspersoner resulterede i fald i den gennemsnitlige dosisnormaliserede cyclosporin AUC, Cmax og dalkoncentration på henholdsvis ca. 50 %, 30 % og 60 % sammenlignet med, når cyclosporin blev givet alene (se Virkning af cyclosporin på farmakokinetikken og/eller sikkerheden af andre lægemidler eller midler ). Samtidig administration af cyclosporin og bosentan bør undgås.
Boceprevir
Samtidig administration af boceprevir (800 mg tre gange dagligt i 7 dage) og ciclosporin (100 mg enkeltdosis) hos raske forsøgspersoner resulterede i stigninger i den gennemsnitlige AUC og Cmax for cyclosporin henholdsvis ca. 2,7 gange og 2 gange sammenlignet med ciclosporin. blev givet alene.
Telaprevir
Samtidig administration af telaprevir (750 mg hver 8. time i 11 dage) og cyclosporin (10 mg på dag 8) hos raske forsøgspersoner resulterede i stigninger i den gennemsnitlige dosisnormaliserede AUC og Cmax for cyclosporin henholdsvis ca. 4,5 gange og 1,3 gange, sammenlignet med når cyclosporin (100 mg enkeltdosis) blev givet alene.
St. John's Wort
Der har været rapporter om en alvorlig lægemiddelinteraktion mellem cyclosporin og urtekosttilskuddet perikon. Denne interaktion er blevet rapporteret at producere en markant reduktion i blodkoncentrationerne af cyclosporin, hvilket resulterer i subterapeutiske niveauer, afstødning af transplanterede organer og tab af transplantat.
Rifabutin
Rifabutin er kendt for at øge metabolismen af andre lægemidler, der metaboliseres af cytochrom P-450-systemet. Interaktionen mellem rifabutin og cyclosporin er ikke blevet undersøgt. Der skal udvises forsigtighed, når disse to lægemidler administreres samtidigt.
Virkning af cyclosporin på farmakokinetikken og/eller sikkerheden af andre lægemidler eller midler
Cyclosporin er en hæmmer af CYP3A4 og af flere lægemiddeludstrømningstransportører (f.eks. P-glycoprotein) og kan øge plasmakoncentrationer af medicin, der er substrater for CYP3A4, P-glycoprotein eller organiske aniontransporterproteiner.
Cyclosporin kan reducere clearance af digoxin, colchicin, prednisolon, HMG-CoA-reduktasehæmmere (statiner) og aliskiren, bosentan, dabigatran, repaglinid, NSAID'er, sirolimus, etoposid og andre lægemidler.
Se den fulde ordinationsinformation for det andet lægemiddel for yderligere information og specifikke anbefalinger. Beslutningen om samtidig administration af cyclosporin med andre lægemidler eller midler bør træffes af sundhedspersonalet efter en omhyggelig vurdering af fordele og risici.
Digoxin
Alvorlig digitalis-toksicitet er set inden for få dage efter start af ciclosporin hos adskillige patienter, der tager digoxin. Hvis digoxin anvendes samtidig med cyclosporin, bør digoxinkoncentrationen i serum overvåges.
Colchicin
Der er rapporter om potentialet af cyclosporin til at forstærke de toksiske virkninger af colchicin såsom myopati og neuropati, især hos patienter med nyreinsufficiens. Samtidig administration af cyclosporin og colchicin resulterer i signifikante stigninger i colchicin plasmakoncentrationer. Hvis colchicin anvendes samtidig med ciclosporin, anbefales en reduktion i dosis af colchicin.
HMG-CoA-reduktasehæmmere (statiner)
Litteratur og postmarketing tilfælde af myotoksicitet, herunder muskelsmerter og -svaghed, myositis og rabdomyolyse, er blevet rapporteret ved samtidig administration af ciclosporin med lovastatin, simvastatin, atorvastatin, pravastatin og i sjældne tilfælde fluvastatin. Når de administreres samtidig med ciclosporin, bør dosis af disse statiner reduceres i henhold til anbefalingerne på etiketten. Statinbehandling skal midlertidigt seponeres eller afbrydes hos patienter med tegn og symptomer på myopati eller patienter med risikofaktorer, der disponerer for alvorlig nyreskade, herunder nyresvigt, sekundært til rhabdomyolyse.
Repaglinid
Cyclosporin kan øge plasmakoncentrationen af repaglinid og dermed øge risikoen for hypoglykæmi. Hos 12 raske mandlige forsøgspersoner, som fik to doser på 100 mg ciclosporin kapsel oralt med 12 timers mellemrum med en enkelt dosis på 0,25 mg repaglinidtablet (den halve af en 0,5 mg tablet) oralt 13 timer efter ciclosporin-startdosis, var repaglinidets gennemsnitlige Cmax. og AUC blev henholdsvis øget 1,8 gange (interval: 0,6 til 3,7 gange) og 2,4 gange (interval 1,2 til 5,3 gange). Tæt monitorering af blodsukkerniveauet er tilrådeligt for en patient, der tager ciclosporin og repaglinid samtidigt.
Ambrisentan
Samtidig administration af ambrisentan (5 mg dagligt) og cyclosporin (100 til 150 mg to gange dagligt initialt, derefter dosering for at opnå Cmax 150 til 200 ng/ml) i 8 dage hos raske forsøgspersoner resulterede i gennemsnitlige stigninger i ambrisentan AUC og Cmax på ca. henholdsvis fold og 1,5 gange sammenlignet med ambrisentan alene. Ved samtidig administration af ambrisentan og cyclosporin bør ambrisentan-dosis ikke titreres til den anbefalede maksimale daglige dosis
Antracyklin antibiotika
Høje doser af cyclosporin (f.eks. ved en startdosis på 16 mg/kg/dag) kan øge eksponeringen for antracyklin-antibiotika (f.eks. doxorubicin, mitoxantron, daunorubicin) hos cancerpatienter.
Aliskiren
Cyclosporin ændrer farmakokinetikken af aliskiren, et substrat af P-glycoprotein og CYP3A4. Hos 14 raske forsøgspersoner, som samtidig fik enkeltdoser af cyclosporin (200 mg) og reduceret dosis aliskiren (75 mg), blev den gennemsnitlige Cmax for aliskiren øget med ca. 2,5 gange (90 % CI: 1,96 til 3,17) og den gennemsnitlige AUC med ca. 4,3 gange (90 % CI: 3,52 til 5,21), sammenlignet med når disse forsøgspersoner fik aliskiren alene. Samtidig administration af aliskiren og cyclosporin forlængede den mediane eliminationshalveringstid for aliskiren (26 timer versus 43 til 45 timer) og T (0,5 timer versus 1,5 til 2,0 timer). Den gennemsnitlige AUC og Cmax for cyclosporin var sammenlignelige med rapporterede litteraturværdier. Samtidig administration af cyclosporin og aliskiren hos disse personer resulterede også i en stigning i antallet og/eller intensiteten af bivirkninger, hovedsageligt hovedpine, hedeture, kvalme, opkastning og somnolens. Samtidig administration af cyclosporin og aliskiren anbefales ikke.
Bosentan
Hos raske forsøgspersoner resulterede samtidig administration af bosentan og cyclosporin i tidsafhængige gennemsnitlige stigninger i dosisnormaliseret
dalkoncentrationer af bosentan (dvs. ca. 21 gange på dag 1 og 2 gange på dag 8 (steady state)) sammenlignet med når bosentan blev givet alene som en enkelt dosis på dag 1 (se Virkning af lægemidler og andre midler på cyclosporins farmakokinetik og/eller sikkerhed ). Samtidig administration af cyclosporin og bosentan bør undgås.
Dabigatran
Virkningen af cyclosporin på dabigatran-koncentrationer var ikke formelt undersøgt. Samtidig administration af dabigatran og cyclosporin kan resultere i øgede plasmakoncentrationer af dabigatran på grund af den P-gp-hæmmende aktivitet af cyclosporin. Samtidig administration af cyclosporin og dabigatran bør undgås.
Kaliumbesparende diuretika
Cyclosporin bør ikke anvendes sammen med kaliumbesparende diuretika, da hyperkaliæmi kan forekomme. Forsigtighed er også påkrævet, når cyclosporin administreres sammen med kaliumbesparende lægemidler (f.eks. angiotensinkonverterende enzymhæmmere, angiotensin II-receptorantagonister), kaliumholdige lægemidler samt til patienter på en kaliumrig diæt. Kontrol af kaliumniveauer i disse situationer er tilrådeligt.
Ikke-steroide antiinflammatoriske lægemidler (NSAID) interaktioner
Klinisk status og serumkreatinin bør overvåges nøje, når ciclosporin anvendes sammen med NSAID til patienter med reumatoid arthritis (se ADVARSLER ).
Farmakodynamiske interaktioner er blevet rapporteret at forekomme mellem cyclosporin og både naproxen og sulindac, idet samtidig brug er forbundet med additive fald i nyrefunktionen, bestemt af 99mTc-diethylentriaminpentaeddikesyre (DTPA) og (p-aminohippursyre) PAH-clearance. Selvom samtidig administration af diclofenac ikke påvirker blodkoncentrationerne af cyclosporin, er det blevet forbundet med en omtrentlig fordobling af diclofenac-blodkoncentrationen og lejlighedsvise rapporter om reversible fald i nyrefunktionen. Derfor bør dosis af diclofenac være i den nedre ende af det terapeutiske område.
Methotrexat-interaktion
Foreløbige data indikerer, at når methotrexat og cyclosporin blev administreret samtidigt til patienter med reumatoid arthritis (N = 20), blev methotrexatkoncentrationerne (AUC'er) øget med ca. 30%, og koncentrationerne (AUC'er) af dets metabolit, 7-hydroxymethotrexat, blev reduceret med ca. 80 %. Den kliniske betydning af denne interaktion er ikke kendt. Cyclosporinkoncentrationer synes ikke at være blevet ændret (N = 6).
Sirolimus
Forhøjelser i serumkreatinin blev observeret i undersøgelser med sirolimus i kombination med fulddosis cyclosporin. Denne effekt er ofte reversibel med ciclosporindosisreduktion. Samtidig administration af cyclosporin øger signifikant blodniveauet af sirolimus. For at minimere stigninger i sirolimuskoncentrationer anbefales det, at sirolimus gives 4 timer efter administration af ciclosporin.
Nifedipin
Hyppig gingival hyperplasi, når nifedipin gives samtidig med cyclosporin, er blevet rapporteret. Samtidig brug af nifedipin bør undgås hos patienter, hvor gingival hyperplasi udvikles som en bivirkning af ciclosporin.
Methylprednisolon
Kramper, når høje doser methylprednisolon gives samtidig med cyclosporin, er blevet rapporteret.
Andre immunsuppressive lægemidler og midler
Psoriasispatienter, der får andre immunsuppressive midler eller strålebehandling (inklusive PUVA og UVB), bør ikke samtidig modtage ciclosporin på grund af muligheden for overdreven immunsuppression.
Virkning af cyclosporin på virkningen af levende vacciner
Under behandling med ciclosporin kan vaccination være mindre effektiv. Brug af levende vacciner bør undgås.
For yderligere oplysninger om lægemiddelinteraktioner med cyklosporin kontakt venligst Novartis Medical Affairs Department på 1-888- NOW-NOVA [1-888-669-6682].
ADVARSLER
(Se også KASSET ADVARSEL )
Alle patienter
Cyclosporin, den aktive ingrediens i Neoral 25mg, kan forårsage nefrotoksicitet og hepatotoksicitet. Risikoen stiger med stigende doser af ciclosporin. Renal dysfunktion inklusive strukturel nyreskade er en potentiel konsekvens af Neoral 100 mg, og derfor skal nyrefunktionen monitoreres under behandlingen. Der skal udvises forsigtighed ved at bruge cyclosporin sammen med nefrotoksiske lægemidler (se FORHOLDSREGLER ).
Patienter, der får Neoral, kræver hyppig monitorering af serumkreatinin (se Særlig overvågning under DOSERING OG ADMINISTRATION ). Ældre patienter bør overvåges med særlig omhu, da nedsat nyrefunktion også forekommer med alderen. Hvis patienterne ikke overvåges ordentligt, og doserne ikke er korrekt justeret, kan ciclosporinbehandling være forbundet med forekomsten af strukturel nyreskade og vedvarende nyreinsufficiens.
En stigning i serumkreatinin og BUN kan forekomme under Neoral-behandling og afspejler en reduktion i den glomerulære filtrationshastighed. Nedsat nyrefunktion kræver til enhver tid nøje overvågning, og hyppig dosisjustering kan være indiceret. Hyppigheden og sværhedsgraden af forhøjede serumkreatinin stiger med dosis og varighed af ciclosporinbehandling. Disse stigninger vil sandsynligvis blive mere udtalte uden dosisreduktion eller seponering.
Fordi Neoral 100 mg ikke er bioækvivalent med Sandimmune, kan konvertering fra Neoral til Sandimmune ved brug af et 1:1-forhold (mg/kg/dag) resultere i lavere blodkoncentrationer af ciclosporin. Konvertering fra Neoral til Sandimmune bør foretages med øget overvågning for at undgå risikoen for underdosering.
Nyre-, lever- og hjertetransplantation
Nefrotoksicitet
Cyclosporin, den aktive ingrediens i Neoral, kan forårsage nefrotoksicitet og hepatotoksicitet, når det bruges i høje doser. Det er ikke usædvanligt, at serumkreatinin- og BUN-niveauer er forhøjede under ciclosporinbehandling. Disse stigninger hos nyretransplanterede patienter indikerer ikke nødvendigvis afstødning, og hver patient skal evalueres fuldt ud, før dosisjustering påbegyndes.
Baseret på Sandimmunes historiske erfaring med oral opløsning, var nefrotoksicitet forbundet med cyclosporin blevet observeret i 25 % af tilfældene af nyretransplantation, 38 % af tilfældene med hjertetransplantation og 37 % af tilfældene med levertransplantationer. Mild nefrotoksicitet blev generelt observeret 2 til 3 måneder efter nyretransplantation og bestod i en standsning i efteråret af de præoperative forhøjelser af BUN og kreatinin i et område på henholdsvis 35 til 45 mg/dL og 2,0 til 2,5 mg/dL. Disse stigninger reagerede ofte på reduktion af cyclosporindosis.
Mere åbenlys nefrotoksicitet blev set tidligt efter transplantation og var karakteriseret ved en hurtigt stigende BUN og kreatinin. Da disse hændelser ligner episoder med nyreafstødning, skal man være opmærksom på at skelne mellem dem. Denne form for nefrotoksicitet reagerer sædvanligvis på reduktion af cyclosporindosis.
Selvom der ikke er fundet specifikke diagnostiske kriterier, som pålideligt adskiller nyretransplantatafstødning fra lægemiddeltoksicitet, er en række parametre blevet signifikant forbundet med det ene eller det andet. Det skal dog bemærkes, at op til 20% af patienterne kan have samtidig nefrotoksicitet og afstødning.
En form for en cyclosporin-associeret nefropati er karakteriseret ved seriel forringelse af nyrefunktionen og morfologiske ændringer i nyrerne. Fra 5 % til 15 % af transplantationsmodtagere, som har fået ciclosporin, vil ikke vise en reduktion i stigende serumkreatinin på trods af et fald eller seponering af ciclosporinbehandling. Nyrebiopsier fra disse patienter vil vise en eller flere af følgende ændringer: tubulær vakuolisering, tubulære mikrokalcifikationer, peritubulær kapillær kongestion, arteriolopati og en stribet form for interstitiel fibrose med tubulær atrofi. Selvom ingen af disse morfologiske ændringer er helt specifikke, kræver en diagnose af cyclosporin-associeret strukturel nefrotoksicitet bevis for disse fund.
Når man overvejer udviklingen af cyclosporin-associeret nefropati, er det bemærkelsesværdigt, at flere forfattere har rapporteret en sammenhæng mellem forekomsten af interstitiel fibrose og højere kumulative doser eller vedvarende høje cirkulerende bundkoncentrationer af cyclosporin. Dette gælder især i de første 6 måneder efter transplantation, hvor doseringen har tendens til at være højest, og hvor organet hos nyremodtagere ser ud til at være mest sårbart over for de toksiske virkninger af cyclosporin. Blandt andre medvirkende faktorer til udviklingen af interstitiel fibrose hos disse patienter er forlænget perfusionstid, varm iskæmi-tid samt episoder med akut toksicitet og akut og kronisk afstødning. Reversibiliteten af interstitiel fibrose og dens korrelation til nyrefunktionen er endnu ikke blevet bestemt. Reversibilitet af arteriolopati er blevet rapporteret efter seponering af ciclosporin eller sænkning af dosis.
Nedsat nyrefunktion kræver til enhver tid nøje overvågning, og hyppig dosisjustering kan være indiceret.
I tilfælde af alvorlig og uafbrudt afstødning, når redningsterapi med pulssteroider og monoklonale antistoffer ikke kan vende afstødningsepisoden, kan det være at foretrække at skifte til alternativ immunsuppressiv behandling frem for at øge Neoral-dosis til for høje blodkoncentrationer.
På grund af potentialet for additiv eller synergistisk svækkelse af nyrefunktionen, bør der udvises forsigtighed ved samtidig administration af Neoral med andre lægemidler, der kan svække nyrefunktionen (se FORHOLDSREGLER , DRUGSINTERAKTIONER ).
Trombotisk mikroangiopati
Nogle gange har patienter udviklet et syndrom af trombocytopeni og mikroangiopatisk hæmolytisk anæmi, som kan resultere i transplantatsvigt. Vaskulopatien kan forekomme i fravær af afstødning og er ledsaget af ivrig blodpladeforbrug i transplantatet, som vist ved Indium 111-mærkede blodpladeundersøgelser. Hverken patogenesen eller håndteringen af dette syndrom er klar. Selvom opløsning er sket efter reduktion eller seponering af cyclosporin og 1) administration af streptokinase og heparin eller 2) plasmaferese, ser dette ud til at afhænge af tidlig påvisning med Indium 111-mærkede blodpladescanninger (se BIVIRKNINGER ).
Hyperkaliæmi
Signifikant hyperkaliæmi (nogle gange forbundet med hyperchloræmisk metabolisk acidose) og hyperurikæmi er lejlighedsvis set hos individuelle patienter.
Hepatotoksicitet
Tilfælde af hepatotoksicitet og leverskade, herunder kolestase, gulsot, hepatitis og leversvigt, er blevet rapporteret hos patienter behandlet med ciclosporin. De fleste rapporter omfattede patienter med signifikante komorbiditeter, underliggende tilstande og andre forvirrende faktorer, herunder infektiøse komplikationer og komikationer med hepatotoksisk potentiale. I nogle tilfælde, hovedsageligt hos transplanterede patienter, er dødelige udfald blevet rapporteret (se BIVIRKNINGER , Postmarketing-erfaring, nyre-, lever- og hjertetransplantation ).
Levertoksicitet, sædvanligvis manifesteret ved forhøjede leverenzymer og bilirubin, blev rapporteret hos patienter behandlet med cyclosporin i kliniske forsøg: 4 % ved nyretransplantation, 7 % ved hjertetransplantation og 4 % ved levertransplantation. Dette blev normalt bemærket i løbet af den første behandlingsmåned, når der blev brugt høje doser ciclosporin. Kemistigningerne faldt normalt med en reduktion i dosis.
Maligniteter
Som hos patienter, der får andre immunsuppressiva, har de patienter, der får ciclosporin, øget risiko for udvikling af lymfomer og andre maligne sygdomme, især i huden. Patienter, der tager ciclosporin, bør advares om at undgå overdreven eksponering for ultraviolet lys. Den øgede risiko ser ud til at være relateret til intensiteten og varigheden af immunsuppression snarere end til brugen af specifikke midler. På grund af faren for oversuppression af immunsystemet, hvilket resulterer i øget risiko for infektion eller malignitet, bør et behandlingsregime indeholdende flere immunsuppressiva anvendes med forsigtighed. Nogle maligne sygdomme kan være dødelige. Transplanterede patienter, der får ciclosporin, har øget risiko for alvorlig infektion med dødelig udgang.
Alvorlige infektioner
Patienter, der får immunsuppressiva, inklusive Neoral 100 mg, har øget risiko for at udvikle bakterielle, virale, svampe- og protozoinfektioner, herunder opportunistiske infektioner. Disse infektioner kan føre til alvorlige, herunder dødelige udfald (se KASSET ADVARSEL , og BIVIRKNINGER ).
Polyoma virus infektioner
Patienter, der får immunsuppressiva, inklusive Neoral 100 mg, har øget risiko for opportunistiske infektioner, herunder polyomavirusinfektioner. Polyomavirusinfektioner hos transplanterede patienter kan have alvorlige og nogle gange dødelige udfald. Disse omfatter tilfælde af JC-virus-associeret progressiv multifokal leukoencefalopati (PML) og polyoma-virus-associeret nefropati (PVAN), især på grund af BK-virusinfektion, som er blevet observeret hos patienter, der får cyclosporin. PVAN er forbundet med alvorlige udfald, herunder forringet nyrefunktion og tab af nyretransplantat (se BIVIRKNINGER , Postmarketing-erfaring, nyre-, lever- og hjertetransplantation ). Patientovervågning kan hjælpe med at opdage patienter med risiko for PVAN.
Tilfælde af PML er blevet rapporteret hos patienter behandlet med Neoral. PML, som nogle gange er dødelig, viser sig almindeligvis med hemiparese, apati, forvirring, kognitive mangler og ataksi. Risikofaktorer for PML omfatter behandling med immunsuppressive terapier og svækkelse af immunfunktionen. Hos immunsupprimerede patienter bør læger overveje PML i differentialdiagnosen hos patienter, der rapporterer neurologiske symptomer, og konsultation med en neurolog bør betragtes som klinisk indiceret.
Det bør overvejes at reducere den totale immunsuppression hos transplanterede patienter, som udvikler PML eller PVAN. Men nedsat immunsuppression kan bringe transplantatet i fare.
Neurotoksicitet
Der har været rapporter om kramper hos voksne og pædiatriske patienter, der får ciclosporin, især i kombination med højdosis methylprednisolon.
Encefalopati, herunder posterior reversibelt encefalopatisyndrom (PRES), er blevet beskrevet både i post-marketing rapporter og i litteraturen. Manifestationer omfatter nedsat bevidsthed, kramper, synsforstyrrelser (herunder blindhed), tab af motorisk funktion, bevægelsesforstyrrelser og psykiatriske forstyrrelser. I mange tilfælde er ændringer i den hvide substans blevet opdaget ved hjælp af billeddannelsesteknikker og patologiske prøver. Prædisponerende faktorer, såsom hypertension, hypomagnesiæmi, hypokolesterolæmi, højdosis kortikosteroider, høje blodkoncentrationer af cyclosporin og graft-versus-host-sygdom, er blevet bemærket i mange, men ikke alle af de rapporterede tilfælde. Ændringerne har i de fleste tilfælde været reversible ved seponering af ciclosporin, og i nogle tilfælde blev der observeret forbedring efter reduktion af dosis. Det ser ud til, at patienter, der modtager levertransplantation, er mere modtagelige for encefalopati end dem, der modtager nyretransplantation. En anden sjælden manifestation af cyclosporin-induceret neurotoksicitet, som forekommer hyppigere hos transplanterede patienter end ved andre indikationer, er optisk diskusødem, herunder papilødem, med mulig synsnedsættelse, sekundært til benign intrakraniel hypertension.
Der skal udvises forsigtighed ved at bruge cyclosporin sammen med nefrotoksiske lægemidler (se FORHOLDSREGLER ).
Rheumatoid arthritis
Cyclosporin nefropati blev påvist i nyrebiopsier hos 6 ud af 60 (10 %) patienter med reumatoid arthritis efter den gennemsnitlige behandlingsvarighed på 19 måneder. Kun én patient ud af disse 6 patienter blev behandlet med en dosis ≤ 4 mg/kg/dag. Serumkreatinin forbedredes hos alle på nær én patient efter seponering af ciclosporin. Den "maksimale kreatininstigning" ser ud til at være en faktor til at forudsige cyclosporin nefropati.
Som med andre immunsuppressive midler er der et potentiale for en stigning i forekomsten af maligne lymfomer med cyclosporin. Det er ikke klart, om risikoen med ciclosporin er større end hos patienter med leddegigt eller hos patienter med leddegigt i cytotoksisk behandling for denne indikation. Fem tilfælde af lymfom blev påvist: fire i en undersøgelse af cirka 2.300 patienter behandlet med cyclosporin for leddegigt, og et andet tilfælde af lymfom blev rapporteret i et klinisk forsøg. Selvom andre tumorer (12 hudkræftformer, 24 solide tumorer af forskellige typer og 1 myelomatose) også blev rapporteret i denne undersøgelse, understøttede epidemiologiske analyser ikke et forhold til cyclosporin andet end for maligne lymfomer.
Patienter bør evalueres grundigt før og under Neoral 25 mg behandling for udvikling af maligniteter. Desuden kan brug af Neoral 25 mg-behandling sammen med andre immunsuppressive midler inducere en overdreven immunsuppression, som vides at øge risikoen for malignitet.
Psoriasis
(Se også KASSET ADVARSEL for Psoriasis )
Da ciclosporin er et potent immunsuppressivt middel med en række potentielt alvorlige bivirkninger, bør risici og fordele ved at bruge Neoral 100 mg overvejes før behandling af patienter med psoriasis. Cyclosporin, den aktive ingrediens i Neoral, kan forårsage nefrotoksicitet og hypertension (se FORHOLDSREGLER ) og risikoen stiger med stigende dosis og varighed af behandlingen. Patienter, der kan have øget risiko, såsom dem med unormal nyrefunktion, ukontrolleret hypertension eller maligniteter, bør ikke få Neoral.
Renal dysfunktion er en potentiel konsekvens af Neoral, derfor skal nyrefunktionen monitoreres under behandlingen.
Patienter, der får Neoral 100 mg, kræver hyppig monitorering af serumkreatinin (se Særlig overvågning under DOSERING OG ADMINISTRATION ). Ældre patienter bør overvåges med særlig omhu, da nedsat nyrefunktion også forekommer med alderen. Hvis patienterne ikke overvåges ordentligt, og dosis ikke justeres korrekt, kan ciclosporinbehandling forårsage strukturel nyreskade og vedvarende nyreinsufficiens.
En stigning i serumkreatinin og BUN kan forekomme under Neoral 25 mg-behandling og afspejler en reduktion i den glomerulære filtrationshastighed.
Nyrebiopsier fra 86 psoriasispatienter behandlet i en gennemsnitlig varighed på 23 måneder med 1,2 til 7,6 mg/kg/dag cyclosporin viste tegn på cyclosporin nefropati hos 18/86 (21 %) af patienterne. Patologien bestod af renal tubulær atrofi og interstitiel fibrose. Ved gentagen biopsi af 13 af disse patienter, der blev holdt på forskellige doser af cyclosporin i gennemsnitligt 2 yderligere år, steg antallet med cyclosporin-induceret nefropati til 26/86 (30%). Størstedelen af patienterne (19/26) fik en dosis på ≥ 5,0 mg/kg/dag (den højeste anbefalede dosis er 4 mg/kg/dag). Patienterne var også på cyclosporin i mere end 15 måneder (18/26) og/eller havde en klinisk signifikant stigning i serumkreatinin i mere end 1 måned (21/26). Kreatininniveauet vendte tilbage til normalområdet hos 7 ud af 11 patienter, hvor ciclosporinbehandlingen blev afbrudt.
Der er en øget risiko for udvikling af hud- og lymfoproliferative maligniteter hos ciclosporin-behandlede psoriasispatienter. Den relative risiko for maligniteter er sammenlignelig med den, der er observeret hos psoriasispatienter behandlet med andre immunsuppressive midler.
Tumorer blev rapporteret hos 32 (2,2%) af 1439 psoriasispatienter behandlet med cyclosporin på verdensplan fra kliniske forsøg. Yderligere tumorer er blevet rapporteret hos 7 patienter efter markedsføring af ciclosporin. Maligne hudsygdomme blev rapporteret hos 16 (1,1 %) af disse patienter; alle undtagen 2 af dem havde tidligere modtaget PUVA-terapi. Methotrexat blev modtaget af 7 patienter.
UVB og stenkulstjære var blevet brugt af henholdsvis 2 og 3 patienter. Syv patienter havde enten en historie med tidligere hudkræft, eller en potentielt disponerende læsion var til stede før eksponering for ciclosporin. Af de 16 patienter med hudkræft havde 11 patienter 18 pladecellekarcinomer og 7 patienter havde 10 basalcellekarcinomer.
Der var to lymfoproliferative maligniteter; et tilfælde af non-Hodgkins lymfom, som krævede kemoterapi, og et tilfælde af mycosis fungoides, som faldt spontant efter seponering af ciclosporin. Der var fire tilfælde af godartet lymfocytisk infiltration: 3 faldt spontant tilbage efter seponering af cyclosporin, mens det fjerde faldt tilbage trods fortsættelse af lægemidlet. Resten af maligniteterne, 13 tilfælde (0,9%), involverede forskellige organer.
Patienter bør ikke behandles samtidig med cyclosporin og PUVA eller UVB, anden strålebehandling eller andre immunsuppressive midler på grund af muligheden for overdreven immunsuppression og den efterfølgende risiko for maligniteter (se KONTRAINDIKATIONER ). Patienter bør også advares om at beskytte sig selv passende, når de er i solen, og at undgå overdreven soleksponering. Patienter bør evalueres grundigt før og under behandlingen for tilstedeværelsen af maligniteter, idet man husker, at ondartede læsioner kan være skjult af psoriatiske plaques. Hudlæsioner, der ikke er typiske for psoriasis, bør biopsieres, før behandlingen påbegyndes. Patienter bør kun behandles med Neoral efter fuldstændig opløsning af mistænkelige læsioner, og kun hvis der ikke er andre behandlingsmuligheder (se Særlig overvågning til psoriasispatienter ).
Særlige hjælpestoffer
Alkohol (ethanol)
Alkoholindholdet (se BESKRIVELSE af Neoral 100 mg bør tages i betragtning, når det gives til patienter, hvor alkoholindtagelse bør undgås eller minimeres, f.eks. gravide eller ammende kvinder, til patienter med leversygdom eller epilepsi, til alkoholiske patienter eller pædiatriske patienter. For en voksen, der vejer 70 kg, vil den maksimale daglige orale dosis give omkring 1 gram alkohol, hvilket er cirka 6 % af mængden af alkohol indeholdt i en standarddrik.
FORHOLDSREGLER
Generel
Forhøjet blodtryk
Cyclosporin er den aktive ingrediens i Neoral. Hypertension er en almindelig bivirkning ved ciclosporinbehandling, som kan vare ved (se BIVIRKNINGER og DOSERING OG ADMINISTRATION for overvågningsanbefalinger). Mild eller moderat hypertension ses hyppigere end svær hypertension, og forekomsten falder over tid. Hos modtagere af nyre-, lever- og hjerteallotransplantater behandlet med ciclosporin kan antihypertensiv behandling være nødvendig (se Særlig overvågning af reumatoid arthritis og Psoriasispatienter ). Men da ciclosporin kan forårsage hyperkaliæmi, bør kaliumbesparende diuretika ikke anvendes. Selvom calciumantagonister kan være effektive midler til behandling af cyclosporin-associeret hypertension, kan de interferere med cyclosporinmetabolismen (se DRUGSINTERAKTIONER ).
Vaccination
Under behandling med ciclosporin kan vaccination være mindre effektiv; og brug af levende svækkede vacciner bør undgås.
Særlig overvågning af reumatoid arthritispatienter
Før behandlingen påbegyndes, bør der udføres en omhyggelig fysisk undersøgelse, inklusive blodtryksmålinger (ved mindst to lejligheder) og to kreatininniveauer for at estimere baseline. Blodtryk og serumkreatinin bør evalueres hver anden uge i løbet af de første 3 måneder og derefter månedligt, hvis patienten er stabil. Det tilrådes altid at monitorere serumkreatinin og blodtryk efter en stigning i dosis af non-steroide antiinflammatoriske lægemidler (NSAID'er) og efter påbegyndelse af ny NSAID-behandling under Neoral 25 mg-behandling. Hvis det administreres sammen med methotrexat, anbefales det, at CBC og leverfunktionsprøver monitoreres månedligt (se FORHOLDSREGLER , Generelt, hypertension ).
Hos patienter, som får ciclosporin, bør dosis af Neoral reduceres med 25 % til 50 %, hvis der opstår hypertension. Hvis hypertension fortsætter, bør dosis af Neoral 100 mg reduceres yderligere, eller blodtrykket bør kontrolleres med antihypertensiva. I de fleste tilfælde er blodtrykket vendt tilbage til baseline, når ciclosporin blev afbrudt.
I placebokontrollerede forsøg med patienter med reumatoid arthritis forekom systolisk hypertension (defineret som en forekomst af to systoliske blodtryksmålinger > 140 mmHg) og diastolisk hypertension (defineret som to diastoliske blodtryksmålinger > 90 mmHg) hos 33 % og 19 % af patienter behandlet med henholdsvis cyclosporin. De tilsvarende placebo-rater var 22 % og 8 %.
Særlig overvågning til psoriasispatienter
Før behandlingen påbegyndes, bør der udføres en omhyggelig dermatologisk og fysisk undersøgelse, herunder blodtryksmålinger (ved mindst to lejligheder). Da Neoral er et immunsuppressivt middel, bør patienter vurderes for tilstedeværelsen af okkult infektion ved deres første fysiske undersøgelse og for tilstedeværelsen af tumorer initialt og under hele behandlingen med Neoral. Hudlæsioner, der ikke er typiske for psoriasis, bør biopsieres, før du starter Neoral. Patienter med maligne eller præmaligne hudforandringer bør kun behandles med Neoral 100 mg efter passende behandling af sådanne læsioner, og hvis der ikke findes andre behandlingsmuligheder.
Baseline-laboratorier bør omfatte serumkreatinin (ved to lejligheder), BUN, CBC, serummagnesium, kalium, urinsyre og lipider.
Risikoen for cyclosporin nefropati reduceres, når startdosis er lav (2,5 mg/kg/dag), den maksimale dosis ikke overstiger 4,0 mg/kg/dag, serumkreatinin overvåges regelmæssigt, mens ciclosporin administreres, og dosis af Neoral 25 mg reduceres, når stigningen i kreatinin er større end eller lig med 25 % over patientens niveau før behandling. Stigningen i kreatinin er generelt reversibel ved rettidig reduktion af Neoral-dosis eller seponering.
Serumkreatinin og BUN bør evalueres hver anden uge i løbet af de første 3 måneder af behandlingen og derefter månedligt, hvis patienten er stabil. Hvis serumkreatinin er større end eller lig med 25 % over patientens forbehandlingsniveau, bør serumkreatinin gentages inden for to uger. Hvis ændringen i serumkreatinin forbliver større end eller lig med 25 % over baseline, skal Neoral 25 mg reduceres med 25 % til 50 %. Hvis kl når som helst serumkreatinin stiger med mere end eller lig med 50 % over niveauet før behandling, Neoral 25 mg bør reduceres med 25 % til 50 %. Neoral bør seponeres, hvis reversibilitet (inden for 25 % af baseline) af serumkreatinin ikke er opnåelig efter to dosisændringer. Det er tilrådeligt at overvåge serumkreatinin efter en stigning i dosis af non-steroidt antiinflammatorisk lægemiddel og efter påbegyndelse af ny non-steroid antiinflammatorisk behandling under Neoral 25 mg behandling.
Blodtrykket bør evalueres hver 2. uge i løbet af de første 3 måneder af behandlingen og derefter månedligt, hvis patienten er stabil, eller hyppigere, når der foretages dosisjusteringer. Patienter uden tidligere hypertension i anamnesen før påbegyndelse af behandling med Neoral bør have nedsat lægemidlet med 25 % til 50 %, hvis det konstateres, at de har vedvarende hypertension. Hvis patienten fortsætter med at være hypertensiv på trods af flere reduktioner af Neoral 25 mg, skal Neoral seponeres. For patienter med behandlet hypertension, før påbegyndelse af Neoral 100 mg-behandling, bør deres medicin justeres for at kontrollere hypertension, mens de er på Neoral. Neoral 100 mg bør seponeres, hvis en ændring i hypertensionsbehandlingen ikke er effektiv eller tolerabel.
CBC, urinsyre, kalium, lipider og magnesium bør også overvåges hver anden uge i de første 3 måneder af behandlingen og derefter månedligt, hvis patienten er stabil, eller hyppigere, når der foretages dosisjusteringer. Neoral 25 mg dosis bør reduceres med 25 % til 50 % for enhver unormal klinisk bekymring.
I kontrollerede forsøg med cyclosporin hos psoriasispatienter korrelerede ciclosporin-blodkoncentrationerne ikke godt med hverken forbedring eller med bivirkninger såsom nyreinsufficiens.
Laboratorieprøver
Hos alle patienter, der behandles med cyclosporin, bør nyre- og leverfunktioner vurderes gentagne gange ved måling af serumkreatinin, BUN, serumbilirubin og leverenzymer. Serumlipider, magnesium og kalium bør også overvåges.
Cyclosporin-blodkoncentrationer bør overvåges rutinemæssigt hos transplanterede patienter (se DOSERING OG ADMINISTRATION , Blodkoncentrationsovervågning hos transplanterede patienter ), og overvåges periodisk hos patienter med reumatoid arthritis.
Karcinogenese, mutagenese og svækkelse af fertilitet
Carcinogenicitetsundersøgelser blev udført på han- og hunrotter og mus. I det 78-ugers musestudie blev der fundet tegn på en statistisk signifikant tendens for lymfocytiske lymfomer hos kvinder, og forekomsten af hepatocellulære carcinomer hos mænd med mellemdosis oversteg signifikant kontrolværdien. I det 24-måneders rottestudie oversteg pancreas-øcelle-adenomer signifikant kontrolfrekvensen i det lave dosisniveau. De anvendte doser i muse- og rotteundersøgelserne var 0,01 til 0,16 gange den kliniske vedligeholdelsesdosis (6 mg/kg). De hepatocellulære carcinomer og pancreas-øcelleadenomer var ikke dosisrelaterede. Publicerede rapporter indikerer, at samtidig behandling af hårløse mus med UV-bestråling og cyclosporin eller andre immunsuppressive midler forkorter tiden til hudtumordannelse sammenlignet med UV-bestråling alene.
Cyclosporin var ikke mutagent i passende testsystemer. Cyclosporin har ikke vist sig at være mutagent/gentoksisk i Ames-testen, V79-HGPRT-testen, mikronukleustesten i mus og kinesiske hamstere, kromosomafvigelsestestene i kinesisk hamster-knoglemarv, musedominant letal assay og DNA-reparationstest i sædceller fra behandlede mus. En nylig undersøgelse, der analyserede induktion af søsterkromatidudveksling (SCE) med cyclosporin under anvendelse af humane lymfocytter in vitro, gav indikation af en positiv effekt (dvs. induktion af SCE) ved høje koncentrationer i dette system. I to publicerede forskningsstudier påviste kaniner udsat for cyclosporin in utero (10 mg/kg/dag subkutant) reduceret antal nefroner, nyrehypertrofi, systemisk hypertension og progressiv nyreinsufficiens op til 35 ugers alderen. Drægtige rotter, som fik 12 mg/kg/dag cyclosporin intravenøst (to gange den anbefalede humane intravenøse dosis), havde fostre med en øget forekomst af ventrikulær septumdefekt. Disse fund er ikke blevet påvist hos andre arter, og deres relevans for mennesker er ukendt.
Der blev ikke påvist nedsat fertilitet i studier med han- og hunrotter.
Udbredt papillomatose af huden blev observeret efter kronisk behandling af hunde med cyclosporin ved 9 gange den humane initiale psoriasisbehandlingsdosis på 2,5 mg/kg, hvor doser er udtrykt på basis af kropsoverfladeareal. Denne papillomatose viste en spontan regression ved seponering af cyclosporin.
En øget forekomst af malignitet er en anerkendt komplikation til immunsuppression hos modtagere af organtransplantationer og patienter med reumatoid arthritis og psoriasis. De mest almindelige former for neoplasmer er non-Hodgkins lymfom og karcinomer i huden. Risikoen for maligniteter hos cyclosporin-recipienter er højere end i den normale, raske befolkning, men svarer til den hos patienter, der får andre immunsuppressive behandlinger. Reduktion eller ophør af immunsuppression kan få læsionerne til at regressere.
Hos psoriasispatienter på cyclosporin er der rapporteret udvikling af maligniteter, især i huden (se ADVARSLER ). Hudlæsioner, der ikke er typiske for psoriasis, bør biopsieres, før behandlingen med ciclosporin påbegyndes. Patienter med maligne eller præmaligne hudforandringer bør kun behandles med ciclosporin efter passende behandling af sådanne læsioner, og hvis der ikke findes andre behandlingsmuligheder.
Graviditet
Dyreforsøg har vist reproduktionstoksicitet hos rotter og kaniner. Cyclosporin gav ingen tegn på mutagene eller teratogene virkninger i standardtestsystemerne med oral applikation (rotter op til 17 mg/kg og kaniner op til 30 mg/kg per dag oralt). Kun ved dosisniveauer, der var giftige for moderdyr, blev der set bivirkninger. i reproduktionsundersøgelser hos rotter. Cyclosporin har vist sig at være embryo- og føtotoksisk hos rotter og kaniner efter oral administration i maternelle toksiske doser. Føtal toksicitet blev noteret hos rotter ved 0,8 og kaniner ved 5,4 gange transplantationsdoserne hos mennesker på 6,0 mg/kg, hvor dosiskorrektioner er baseret på kropsoverfladeareal. Cyclosporin var embryo- og føtotoksisk som indikeret ved øget præ- og postnatal mortalitet og reduceret føtal vægt sammen med relateret skeletretardering.
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder, og Neoral bør derfor ikke anvendes under graviditet, medmindre den potentielle fordel for moderen retfærdiggør den potentielle risiko for fosteret.
Hos gravide transplanterede modtagere, som er i behandling med immunsuppressiva, er risikoen for for tidlig fødsel øget. Følgende data repræsenterer de rapporterede resultater af 116 graviditeter hos kvinder, der fik ciclosporin under graviditeten, hvoraf 90 % var transplanterede patienter, og hvoraf de fleste fik ciclosporin gennem hele svangerskabsperioden. De eneste konsistente mønstre for abnormitet var for tidlig fødsel (svangerskabsperiode på 28 til 36 uger) og lav fødselsvægt for svangerskabsalderen. Seksten føtale tab fandt sted. De fleste af graviditeterne (85 ud af 100) var komplicerede af lidelser; herunder præeklampsi, eclampsia, for tidlig fødsel, abruptio placentae, oligohydramnios, Rh-inkompatibilitet og føtoplacental dysfunktion. For tidlig fødsel forekom hos 47 %. Syv misdannelser blev rapporteret hos 5 levedygtige spædbørn og i 2 tilfælde af fostertab. Otteogtyve procent af spædbørnene var små i forhold til svangerskabsalderen. Neonatale komplikationer forekom hos 27 %. Derfor bør risici og fordele ved at bruge Neoral under graviditet afvejes nøje.
Et begrænset antal observationer hos børn udsat for ciclosporin in utero er tilgængelige, op til en alder på ca. 7 år. Nyrefunktionen og blodtrykket hos disse børn var normalt.
På grund af den mulige afbrydelse af interaktion mellem moder og foster, bør risiko/benefit-forholdet ved brug af Neoral til psoriasispatienter under graviditet nøje afvejes med seriøs overvejelse for seponering af Neoral.
Alkoholindholdet i Neoral 100 mg formuleringerne bør også tages i betragtning hos gravide kvinder (se ADVARSLER , Særlige hjælpestoffer ).
Ammende mødre
Cyclosporin er til stede i modermælk. På grund af risikoen for alvorlige bivirkninger hos ammende spædbørn fra Neoral 100 mg, bør der tages en beslutning om at afbryde amningen eller at seponere lægemidlet under hensyntagen til lægemidlets betydning for moderen. Neoral indeholder ethanol. Ethanol vil være til stede i modermælk i niveauer svarende til det, der findes i moderens serum, og hvis det er til stede i modermælk vil det blive oralt absorberet af et ammende spædbarn (se ADVARSLER ).
Pædiatrisk brug
Selvom der ikke er gennemført tilstrækkelige og velkontrollerede undersøgelser af børn, har transplanterede modtagere helt ned til et års alderen fået Neoral uden usædvanlige bivirkninger. Sikkerheden og effekten af Neoral-behandling hos børn med juvenil reumatoid arthritis eller psoriasis under 18 år er ikke blevet fastlagt.
Geriatrisk brug
kliniske forsøg med rheumatoid arthritis med cyclosporin var 17,5 % af patienterne 65 år eller ældre. Disse patienter var mere tilbøjelige til at udvikle systolisk hypertension under behandlingen og mere tilbøjelige til at vise serumkreatininstigninger ≥ 50 % over baseline efter 3 til 4 måneders behandling.
Kliniske undersøgelser af Neoral 100 mg hos transplanterede og psoriasispatienter omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Generelt bør dosisvalg for en ældre patient være forsigtigt, sædvanligvis begyndende i den lave ende af doseringsområdet, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling.
OVERDOSIS
Der er minimal erfaring med overdosering af ciclosporin. Tvungen opkastning og maveskylning kan være af værdi op til 2 timer efter administration af Neoral. Forbigående hepatotoksicitet og nefrotoksicitet kan forekomme, som bør forsvinde efter seponering af lægemidlet. Orale doser af cyclosporin op til 10 g (ca. 150 mg/kg) er blevet tolereret med relativt små kliniske konsekvenser, såsom opkastning, døsighed, hovedpine, takykardi og hos nogle få patienter moderat alvorlig, reversibel nyrefunktionsnedsættelse. Alvorlige symptomer på forgiftning er imidlertid blevet rapporteret efter utilsigtet parenteral overdosering med ciclosporin hos præmature nyfødte. Generelle støtteforanstaltninger og symptomatisk behandling bør følges i alle tilfælde af overdosering. Cyclosporin er ikke dialyserbart i nogen større udstrækning, og det fjernes heller ikke godt ved trækulshæmoperfusion. Den orale dosis, hvor halvdelen af forsøgsdyrene estimeres til at dø, er 31 gange, 39 gange og > 54 gange den humane vedligeholdelsesdosis for transplanterede patienter (6 mg/kg; korrektioner baseret på kropsoverfladeareal) hos mus, rotter og kaniner .
KONTRAINDIKATIONER
Generel
Neoral 100mg er kontraindiceret til patienter med overfølsomhed over for cyclosporin eller over for et eller flere af indholdsstofferne i formuleringen.
Rheumatoid arthritis
Reumatoid arthritispatienter med unormal nyrefunktion, ukontrolleret hypertension eller maligniteter bør ikke få Neoral.
Psoriasis
Psoriasispatienter, der behandles med Neoral 100 mg, bør ikke modtage samtidig PUVA- eller UVB-behandling, methotrexat eller andre immunsuppressive midler, stenkulstjære eller strålebehandling. Psoriasispatienter med unormal nyrefunktion, ukontrolleret hypertension eller maligniteter bør ikke få Neoral.
KLINISK FARMAKOLOGI
Cyclosporin er et potent immunsuppressivt middel, som hos dyr forlænger overlevelsen af allogene transplantationer, der involverer hud, nyre, lever, hjerte, bugspytkirtel, knoglemarv, tyndtarm og lunger. Cyclosporin har vist sig at undertrykke en vis humoral immunitet og i højere grad cellemedierede immunreaktioner såsom allograftafstødning, forsinket overfølsomhed, eksperimentel allergisk encephalomyelitis, Freunds adjuverende arthritis og graft versus host sygdom hos mange dyrearter for en række organer. .
Effektiviteten af cyclosporin skyldes specifik og reversibel hæmning af immunkompetente lymfocytter i G0- og G1-fasen af cellecyklussen. T-lymfocytter hæmmes fortrinsvis. T-hjælpercellen er hovedmålet, selvom Tsuppressor-cellen også kan være undertrykt. Cyclosporin hæmmer også lymfokinproduktion og -frigivelse, herunder interleukin-2.
Der er ikke påvist nogen virkninger på fagocytisk funktion (ændringer i enzymsekretioner, kemotaktisk migration af granulocytter, makrofagmigration, carbon-clearance in vivo) hos dyr. Cyclosporin forårsager ikke knoglemarvssuppression i dyremodeller eller mennesker.
Farmakokinetik
Den immunsuppressive aktivitet af cyclosporin skyldes primært moderlægemidlet. Efter oral administration er absorptionen af cyclosporin ufuldstændig. Omfanget af absorption af cyclosporin afhænger af den enkelte patient, patientpopulationen og formuleringen. Elimination af cyclosporin er primært galde, idet kun 6 % af dosis (moderstof og metabolitter) udskilles i urinen. Disponeringen af cyclosporin fra blod er generelt bifasisk med en terminal halveringstid på ca. 8,4 timer (interval 5 til 18 timer). Efter intravenøs administration er blodclearancen af cyclosporin (assay: HPLC) ca. 5 til 7 ml/min/kg hos voksne modtagere af nyre- eller leverallotransplantater. Blodets cyclosporinclearance synes at være lidt langsommere hos hjertetransplanterede patienter.
Neoral Soft Gelatine Capsules (cyclosporinkapsler, USP) MODIFIED og Neoral Oral Solution (cyclosporin oral opløsning, USP) MODIFIED er bioækvivalente. Neoral 25 mg oral opløsning fortyndet med appelsinjuice eller æblejuice er bioækvivalent med Neoral oral opløsning fortyndet med vand. Effekten af mælk på biotilgængeligheden af cyclosporin, når det administreres som Neoral oral opløsning, er ikke blevet evalueret.
Forholdet mellem administreret dosis og eksponering (areal under kurven for koncentration versus tid, AUC) er lineær inden for det terapeutiske dosisområde. Variabiliteten mellem individer (total, %CV) af cyclosporineksponering (AUC), når Neoral eller Sandimmune administreres, varierer fra ca. 20 % til 50 % hos nyretransplanterede patienter. Denne intersubjektvariabilitet bidrager til behovet for individualisering af doseringsregimet for optimal terapi (se DOSERING OG ADMINISTRATION ).
Variabiliteten af AUC intraindividuelt hos nyretransplanterede modtagere (%CV) var 9% til 21% for Neoral og 19% til 26% for Sandimmune. I de samme undersøgelser var den intraindividuelle variabilitet af bundkoncentrationer (%CV) 17 % til 30 % for Neoral og 16 % til 38 % for Sandimmune.
Absorption
Neoral har øget biotilgængelighed sammenlignet med Sandimmune. Den absolutte biotilgængelighed af cyclosporin administreret som Sandimmune er afhængig af patientpopulationen, estimeret til at være mindre end 10 % hos levertransplanterede patienter og så stor som 89 % hos nogle nyretransplanterede patienter. Den absolutte biotilgængelighed af cyclosporin administreret som Neoral er ikke blevet bestemt hos voksne. I undersøgelser af nyretransplanterede, reumatoid arthritis- og psoriasispatienter var den gennemsnitlige cyclosporin-AUC ca. 20% til 50% større, og den maksimale ciclosporinkoncentration i blodet var ca. 40% til 106% højere efter administration af Neoral 100 mg sammenlignet med efter administration af Sandimmune . Den dosisnormaliserede AUC hos de novo levertransplantationspatienter, der fik Neoral 28 dage efter transplantationen, var 50 % højere og Cmax var 90 % større end hos de patienter, der fik Sandimmune. AUC og Cmax er også øget (neoralt i forhold til Sandimmune) hos hjertetransplanterede patienter, men data er meget begrænsede. Selvom AUC- og Cmax-værdierne er højere på Neoral 100 mg i forhold til Sandimmune, er de laveste koncentrationer før dosis (dosis-normaliseret) ens for de to formuleringer.
Efter oral administration af Neoral varierede tiden til maksimale ciklosporinkoncentrationer i blodet (Tmax) fra 1,5 til 2,0 timer. Administration af mad med Neoral 25 mg nedsætter cyclosporins AUC og Cmax. Et fedtrigt måltid (669 kcal, 45 gram fedt) indtaget inden for en halv time før Neoral 25 mg administration reducerede AUC med 13 % og Cmax med 33 %. Effekterne af et fedtfattigt måltid (667 kcal, 15 gram fedt) var ens.
Effekten af T-rørsdirigering af galde på absorptionen af cyclosporin fra Neoral 25 mg blev undersøgt hos elleve de novo levertransplanterede patienter. Når patienterne fik Neoral med og uden T-rørafledning af galde, blev der observeret meget lille forskel i absorption, målt ved ændringen i maksimale ciclosporin-blodkoncentrationer fra før-dosisværdier med T-røret lukket i forhold til hvornår det var åben: 6,9 ± 41 % (interval 55 % til 68 %).
PatientpopulationFordeling
Cyclosporin fordeles stort set uden for blodvolumenet. Steady-state distributionsvolumen under intravenøs dosering er blevet rapporteret som 3 til 5 l/kg hos faste organtransplanterede modtagere. I blod er fordelingen koncentrationsafhængig. Ca. 33 % til 47 % er i plasma, 4 % til 9 % i lymfocytter, 5 % til 12 % i granulocytter og 41 % til 58 % i erytrocytter. Ved høje koncentrationer bliver bindingskapaciteten af leukocytter og erytrocytter mættet. I plasma er ca. 90 % bundet til proteiner, primært lipoproteiner. Cyclosporin udskilles i modermælk (se FORHOLDSREGLER , Ammende mødre ).
Metabolisme
Cyclosporin metaboliseres i vid udstrækning af cytochrom P-450 3A enzymsystemet i leveren og i mindre grad i mave-tarmkanalen og nyrerne. Metabolismen af cyclosporin kan ændres ved samtidig administration af en række midler (se FORHOLDSREGLER , DRUGSINTERAKTIONER ). Mindst 25 metabolitter er blevet identificeret fra menneskelig galde, afføring, blod og urin. Den biologiske aktivitet af metabolitterne og deres bidrag til toksicitet er betydeligt mindre end moderforbindelsens. De vigtigste metabolitter (M1, M9 og M4N) skyldes oxidation i henholdsvis 1-beta-, 9-gamma- og 4-N-demethylerede positioner. Ved steady state efter oral administration af Sandimmune er de gennemsnitlige AUC'er for blodkoncentrationer af M1, M9 og M4N henholdsvis ca. 70 %, 21 % og 7,5 % af AUC for blodciklosporinkoncentrationer. Baseret på blodkoncentrationsdata fra stabile nyretransplanterede patienter (13 patienter fik Neoral og Sandimmune i en crossover-undersøgelse) og galdekoncentrationsdata fra de novo levertransplanterede patienter (4 administrerede Neoral 100 mg, 3 administrerede Sandimmune), er procentdelen af dosis til stede som M1-, M9- og M4N-metabolitter er ens, når enten Neoral 25 mg eller Sandimmune administreres.
Udskillelse
Kun 0,1 % af en ciclosporindosis udskilles uændret i urinen. Elimination er primært biliær med kun 6 % af dosis (moderlægemiddel og metabolitter) udskilles i urinen. Hverken dialyse eller nyresvigt ændrer cyclosporinclearance væsentligt.
Lægemiddelinteraktioner
(Se FORHOLDSREGLER , DRUGSINTERAKTIONER ) Når diclofenac eller methotrexat blev administreret sammen med cyclosporin til patienter med reumatoid arthritis, var AUC for diclofenac og methotrexat hver signifikant forøget (se FORHOLDSREGLER , DRUGSINTERAKTIONER ). Der forekom ingen klinisk signifikante farmakokinetiske interaktioner mellem cyclosporin og aspirin, ketoprofen, piroxicam eller indomethacin.
Specifikke populationer
Nedsat nyrefunktion
en undersøgelse udført med 4 forsøgspersoner med nyresygdom i slutstadiet (kreatininclearance
Nedsat leverfunktion
Cyclosporin metaboliseres i vid udstrækning af leveren. Da alvorlig leverinsufficiens kan resultere i signifikant øget eksponering for ciclosporin, kan det være nødvendigt at reducere dosis af ciclosporin hos disse patienter.
Pædiatrisk population
Farmakokinetiske data fra pædiatriske patienter, der får Neoral eller Sandimmune, er meget begrænsede. Hos 15 nyretransplanterede patienter i alderen 3-16 år var cyclosporin fuldblodsclearance efter IV administration af Sandimmune 10,6 ± 3,7 ml/min/kg (assay: Cyclo-trac specifik RIA). I et studie med 7 nyretransplanterede patienter i alderen 2 til 16 år varierede cyclosporinclearance fra 9,8 til 15,5 ml/min/kg. Hos 9 levertransplanterede patienter i alderen 0,6 til 5,6 år var clearance 9,3 ± 5,4 ml/min/kg (assay: HPLC).
I den pædiatriske population udviser Neoral også en øget biotilgængelighed sammenlignet med Sandimmune. Hos 7 lever de novo transplanterede patienter i alderen 1,4 til 10 år var den absolutte biotilgængelighed af Neoral 43 % (interval 30 % til 68 %) og for Sandimmune hos de samme individer var den absolutte biotilgængelighed 28 % (interval 17 % til 42 %).
Geriatrisk befolkning
Sammenligning af enkeltdosisdata fra både normale ældre frivillige (N = 18, gennemsnitsalder 69 år) og ældre reumatoid arthritispatienter (N = 16, gennemsnitsalder 68 år) med enkeltdosisdata hos unge voksne frivillige (N = 16, gennemsnitsalder) 26 år) viste ingen signifikant forskel i de farmakokinetiske parametre.
Kliniske forsøg
Rheumatoid arthritis
Effektiviteten af Sandimmune og Neoral 100 mg til behandling af svær reumatoid arthritis blev evalueret i 5 kliniske undersøgelser med i alt 728 cyclosporinbehandlede patienter og 273 placebobehandlede patienter.
Et resumé af resultaterne præsenteres for "responder"-raterne pr. behandlingsgruppe, hvor en responder defineres som en patient, der har gennemført forsøget med en 20 % forbedring i ømheden og antallet af hævede led og en 20 % forbedring i 2 af 4 af investigator globale, patient globale, handicap og erytrocytsedimentationsrater (ESR) for undersøgelserne 651 og 652 og 3 af 5 af investigator global, patient global, handicap, visuelle analoge smerter og ESR for undersøgelser 2008, 654 og 302.
Undersøgelse 651 inkluderede 264 patienter med aktiv reumatoid arthritis med mindst 20 involverede led, som havde svigtet mindst ét større RA-lægemiddel, ved at anvende en 3:3:2 randomisering til en af følgende tre grupper: (1) cyclosporin doseret ved 2,5 til 5 mg/kg/dag, (2) methotrexat ved 7,5 til 15 mg/uge eller (3) placebo. Behandlingsvarighed var 24 uger. Den gennemsnitlige cyclosporindosis ved sidste besøg var 3,1 mg/kg/dag. Se grafen nedenfor.
Undersøgelse 652 inkluderede 250 patienter med aktiv RA med > 6 aktive smertefulde eller ømme led, som havde svigtet mindst ét større RA-lægemiddel. Patienterne blev randomiseret ved hjælp af en 3:3:2 randomisering til 1 af 3 behandlingsarme: (1) 1,5 til 5 mg/kg/dag cyclosporin, (2) 2,5 til 5 mg/kg/dag cyclosporin og (3) placebo. Behandlingsvarighed var 16 uger. Den gennemsnitlige cyclosporindosis for gruppe 2 ved sidste besøg var 2,92 mg/kg/dag. Se grafen nedenfor.
Undersøgelse 2008 inkluderede 144 patienter med aktiv RA og > 6 aktive led, som havde mislykkede behandlingsforløb med aspirin og guld eller penicillamin. Patienterne blev randomiseret til 1 ud af 2 behandlingsgrupper (1) cyclosporin 2,5 til 5 mg/kg/dag med justeringer efter den første måned for at opnå et måltrough-niveau og (2) placebo. Behandlingsvarighed var 24 uger. Den gennemsnitlige cyclosporindosis ved sidste besøg var 3,63 mg/kg/dag. Se grafen nedenfor.
Studie 654 inkluderede 148 patienter, som forblev med aktive led på 6 eller mere på trods af behandling med maksimalt tolererede methotrexatdoser i mindst tre måneder. Patienterne fortsatte med at tage deres nuværende dosis methotrexat og blev randomiseret til at modtage en af følgende medikamenter: (1) cyclosporin 2,5 mg/kg/dag med dosisstigninger på 0,5 mg/kg/dag i uge 2 og 4, hvis der var ingen tegn på toksicitet og yderligere stigninger på 0,5 mg/kg/dag i uge 8 og 16, hvis der forekom et
Undersøgelse 302 inkluderede 299 patienter med svær aktiv RA, hvoraf 99 % ikke reagerede eller var intolerante over for mindst ét tidligere lægemiddel mod alvorlig RA. Patienterne blev randomiseret til 1 ud af 2 behandlingsgrupper (1) Neoral 25 mg og (2) cyclosporin, som begge blev startet med 2,5 mg/kg/dag og øget efter 4 uger for ineffektivitet i trin på 0,5 mg/kg/dag til en maksimalt 5 mg/kg/dag og faldet til enhver tid for toksicitet. Behandlingsvarighed var 24 uger. Den gennemsnitlige cyclosporindosis ved det sidste besøg var 2,91 mg/kg/dag (interval: 0,72 til 5,17) for Neoral og 3,27 mg/kg/dag (interval: 0,73 til 5,68) for cyclosporin. Se grafen nedenfor.
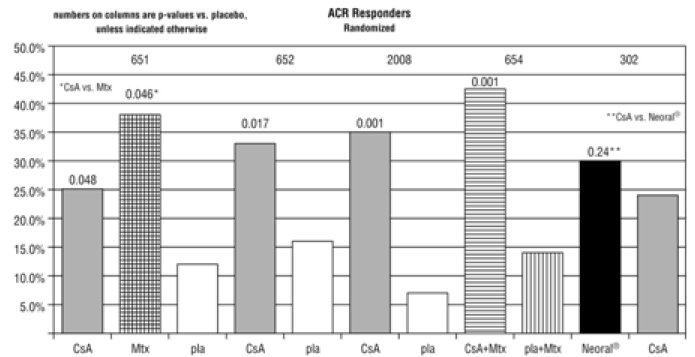
Kliniske Studier
I kontrollerede undersøgelser var arten, sværhedsgraden og forekomsten af de bivirkninger, der blev observeret hos 493 transplanterede patienter behandlet med Neoral, sammenlignelige med dem, der blev observeret hos 208 transplanterede patienter, som fik Sandimmune i disse samme undersøgelser, når dosis af de to lægemidler blev justeret. for at opnå de samme bundkoncentrationer af cyclosporin i blodet.
Baseret på den historiske erfaring med Sandimmune forekom følgende reaktioner hos 3 % eller mere af 892 patienter involveret i kliniske forsøg med nyre-, hjerte- og levertransplantationer.
Blandt 705 nyretransplanterede patienter behandlet med cyclosporin oral opløsning (Sandimmune) i kliniske undersøgelser var årsagen til behandlingsophør hos 5,4 % nyretoksicitet, infektion hos 0,9 %, manglende effekt hos 1,4 %, akut tubulær nekrose hos 1,0 %, lymfoproliferative lidelser hos 0,3 %, hypertension hos 0,3 % og andre årsager hos 0,7 % af patienterne.
Følgende reaktioner forekom hos 2 % eller mindre af ciclosporin-behandlede patienter: allergiske reaktioner, anæmi, anoreksi, forvirring, konjunktivitis, ødem, feber, skøre negle, gastritis, høretab, hikke, hyperglykæmi, migræne (neoral), muskelsmerter, mavesår, trombocytopeni, tinnitus.
Følgende reaktioner forekom sjældent: angst, brystsmerter, forstoppelse, depression, hårbrud, hæmaturi, ledsmerter, sløvhed, mundsår, myokardieinfarkt, nattesved, pancreatitis, kløe, synkebesvær, snurren, blødning fra øvre mave, synsforstyrrelser, svaghed, vægttab.
Patienter, der får immunsuppressive behandlinger, herunder cyklosporin- og cyclosporinholdige regimer, har øget risiko for infektioner (virale, bakterielle, svampe, parasitære). Både generaliserede og lokaliserede infektioner kan forekomme. Eksisterende infektioner kan også forværres. Dødelige udfald er blevet rapporteret (se ADVARSLER ).
Postmarketing-erfaring, nyre-, lever- og hjertetransplantation
Hepatotoksicitet
Tilfælde af hepatotoksicitet og leverskade, herunder kolestase, gulsot, hepatitis og leversvigt; alvorlige og/eller dødelige udfald er blevet rapporteret (se ADVARSLER , Hepatotoksicitet ).
Øget risiko for infektioner
Tilfælde af JC-virus-associeret progressiv multifokal leukoencefalopati (PML), nogle gange dødelig; og polyomavirus-associeret nefropati (PVAN), især BK-virus, der resulterer i grafttab, er blevet rapporteret (se ADVARSLER , Polyoma virus infektion ).
Hovedpine, inklusive migræne
Tilfælde af migræne er blevet rapporteret. I nogle tilfælde har patienterne ikke været i stand til at fortsætte med ciclosporin, men den endelige beslutning om behandlingsophør bør træffes af den behandlende læge efter en omhyggelig vurdering af fordele versus risici.
Smerter af underekstremiteter
Isolerede tilfælde af smerter i nedre ekstremiteter er blevet rapporteret i forbindelse med ciclosporin. Smerter i nedre ekstremiteter er også blevet noteret som en del af Calcineurin-hæmmer-induceret smertesyndrom (CIPS) som beskrevet i litteraturen.
Rheumatoid arthritis
De vigtigste bivirkninger forbundet med brugen af cyclosporin til reumatoid arthritis er nyreinsufficiens (se ADVARSLER ), hypertension (se FORHOLDSREGLER ), hovedpine, mave-tarmforstyrrelser og hirsutisme/hypertrichosis.
Hos patienter med reumatoid artrit, der blev behandlet i kliniske forsøg inden for det anbefalede dosisområde, blev ciclosporinbehandling afbrudt hos 5,3 % af patienterne på grund af hypertension og hos 7 % af patienterne på grund af øget kreatinin. Disse ændringer er normalt reversible med rettidig dosisnedsættelse eller seponering af lægemidlet. Hyppigheden og sværhedsgraden af forhøjede serumkreatinin stiger med dosis og varighed af ciclosporinbehandling. Disse stigninger vil sandsynligvis blive mere udtalte uden dosisreduktion eller seponering.
Følgende bivirkninger forekom i kontrollerede kliniske forsøg:
Derudover er følgende bivirkninger blevet rapporteret hos 1 % til
Autonome nervesystem: mundtørhed, øget svedtendens
Kroppen som helhed: allergi, asteni, hedeture, utilpashed, overdosering, procedure NOS*, tumor NOS*, vægttab, vægtstigning
Kardiovaskulær: unormale hjertelyde, hjertesvigt, myokardieinfarkt, perifer iskæmi
Centrale og perifere nervesystem: hypoæstesi, neuropati, vertigo
Endokrine: struma
Gastrointestinale: obstipation, dysfagi, enanthema, udbrud, esophagitis, mavesår, gastritis, gastroenteritis, tandkødsblødning, glossitis, mavesår, spytkirtelforstørrelse, tungelidelse, tandlidelse
Infektion: byld, bakteriel infektion, cellulitis, folliculitis, svampeinfektion, herpes simplex, herpes zoster, renal byld, moniliasis, tonsillitis, virusinfektion
Hæmatologisk: anæmi, epistaxis, leukopeni, lymfadenopati
Lever og galdesystem: bilirubinæmi
Metabolisk og ernæringsmæssig: diabetes mellitus, hyperkaliæmi, hyperurikæmi, hypoglykæmi
Muskuloskeletale system: artralgi, knoglebrud, bursitis, ledluksation, myalgi, stivhed, synovial cyste, senelidelse
Neoplasmer: brystfibroadenose, karcinom
Psykiatrisk: angst, forvirring, nedsat libido, følelsesmæssig labilitet, nedsat koncentrationsevne, øget libido, nervøsitet, paroniria, somnolens
Reproduktiv (kvinde): brystsmerter, livmoderblødning
Åndedrætsorganerne: unormale brystlyde, bronkospasmer
Hud og vedhæng: unormal pigmentering, angioødem, dermatitis, tør hud, eksem, neglelidelse, kløe, hudlidelse, nældefeber
Særlige sanser: unormalt syn, grå stær, konjunktivitis, døvhed, øjensmerter, smagsforstyrrelser, tinnitus, vestibulær lidelse
Urinsystemet: unormal urin, hæmaturi, øget BUN, vandladningstrang, nocturi, polyuri, pyelonefritis, urininkontinens
*NOS = Ikke andet angivet
Psoriasis
De vigtigste bivirkninger forbundet med brugen af ciclosporin hos patienter med psoriasis er nyreinsufficiens, hovedpine, hypertension, hypertriglyceridæmi, hirsutisme/hypertrichose, paræstesi eller hyperæstesi, influenzalignende symptomer, kvalme/opkastning, diarré, abdominalt ubehag og muskelsvaghed, eller ledsmerter.
Hos psoriasispatienter behandlet i amerikanske kontrollerede kliniske undersøgelser inden for det anbefalede dosisområde, blev ciclosporinbehandling afbrudt hos 1,0 % af patienterne på grund af hypertension og hos 5,4 % af patienterne på grund af øget kreatinin. I de fleste tilfælde var disse ændringer reversible efter dosisreduktion eller seponering af ciclosporin.
Der har været et rapporteret dødsfald forbundet med brugen af cyclosporin ved psoriasis. En 27-årig mand udviklede nyreforringelse og blev fortsat på cyclosporin. Han havde progressiv nyresvigt, der førte til døden.
Hyppighed og sværhedsgrad af serumkreatinin stiger med dosis og varighed af ciclosporinbehandling. Disse forhøjelser vil sandsynligvis blive mere udtalte og kan resultere i irreversibel nyreskade uden dosisreduktion eller seponering.
Følgende hændelser forekom hos 1 % til mindre end 3 % af psoriasispatienter behandlet med ciclosporin:
Kroppen som helhed: feber, rødmen, hedeture
Kardiovaskulær: brystsmerter
Centrale og perifere nervesystem: øget appetit, søvnløshed, svimmelhed, nervøsitet, svimmelhed
Gastrointestinale: abdominal udspilning, forstoppelse, tandkødsblødning
Lever og galdesystem: hyperbilirubinæmi
Neoplasmer: ondartede hudsygdomme [pladecelle- (0,9 %) og basalcelle- (0,4 %) karcinomer]
Retikuloendothelial: blodplade-, blødnings- og koagulationsforstyrrelser, røde blodlegemer
Åndedræt: infektion, viral og anden infektion
Hud og vedhæng: acne, folliculitis, keratose, pruritus, udslæt, tør hud
Urinsystemet: vandladningsfrekvens
Vision: unormalt syn
Mild hypomagnesæmi og hyperkaliæmi kan forekomme, men er asymptomatiske. Der kan forekomme stigninger i urinsyre, og anfald af gigt er sjældent rapporteret. En mindre og dosisrelateret hyperbilirubinæmi er blevet observeret i fravær af hepatocellulær skade. Cyclosporinbehandling kan være forbundet med en beskeden stigning i serumtriglycerider eller kolesterol. Forhøjelser af triglycerider (> 750 mg/dL) forekommer hos ca. 15 % af psoriasispatienterne; forhøjelser af kolesterol (> 300 mg/dL) ses hos mindre end 3 % af psoriasispatienterne. Generelt er disse laboratorieabnormaliteter reversible ved dosisreduktion eller seponering af ciclosporin.
Postmarketing-erfaring, psoriasis
Tilfælde af transformation til erytrodermisk psoriasis eller generaliseret pustuløs psoriasis ved enten seponering eller reduktion af cyclosporin hos patienter med kronisk plaque-psoriasis er blevet rapporteret.
PATIENTOPLYSNINGER
Patienter bør informeres om, at enhver ændring af ciclosporinformuleringen bør foretages med forsigtighed og kun under overvågning af en læge, da det kan medføre behov for en ændring i dosis.
Patienter bør informeres om nødvendigheden af gentagne laboratorietests, mens de får ciclosporin. Patienter bør informeres om de potentielle risici under graviditet og informeres om den øgede risiko for neoplasi. Patienter bør også informeres om risikoen for hypertension og nyreinsufficiens.
Patienter bør informeres om, at vaccination under behandling med ciclosporin kan være mindre effektiv, og brug af levende svækkede vacciner bør undgås.
Patienterne skal have omhyggelige doseringsinstruktioner. Neoral oral opløsning (cyclosporin oral opløsning, USP) MODIFIED bør fortyndes, helst med appelsin- eller æblejuice, der er ved stuetemperatur. Kombinationen af Neoral Oral Solution (cyclosporin oral opløsning, USP) MODIFICERET med mælk kan være ubehagelig.
Patienter bør rådes til at tage Neoral 100 mg efter en konsekvent tidsplan med hensyn til tidspunkt på dagen og forhold til måltider. Grapefrugt og grapefrugtjuice påvirker stofskiftet, hvilket øger blodkoncentrationen af cyclosporin, bør derfor undgås.
