Naprosyn 250mg, 500mg Naproxen Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Naprosyn 500mg, og hvordan bruges det?
Naprosyn 250mg er en receptpligtig medicin, der bruges til at behandle symptomer på smerte eller betændelse forårsaget af gigt, ankyloserende spondylitis, tendinitis, bursitis, gigt eller menstruationssmerter. Naprosyn kan bruges alene eller sammen med anden medicin.
Naprosyn 250mg er en ikke-steroid antiinflammatorisk medicin (NSAID).
Det vides ikke, om Naprosyn er sikkert og effektivt til børn under 2 år.
Hvad er de mulige bivirkninger af Naprosyn?
Naprosyn kan forårsage alvorlige bivirkninger, herunder:
- stakåndet,
- hævelse eller hurtig vægtøgning,
- hududslæt eller vabler,
- blodig eller tjæreagtig afføring,
- hoste blod eller opkast, der ligner kaffegrums,
- kvalme,
- smerter i øvre mave,
- mistet appetiten,
- mørk urin,
- lerfarvede afføring,
- gulfarvning af huden eller øjnene (gulsot),
- lidt eller ingen vandladning,
- smertefuld vandladning,
- hævelse i dine fødder eller ankler,
- anæmi (lavt antal røde blodlegemer),
- bleg hud,
- træthed,
- føler sig svimmel, og
- kolde hænder eller fødder
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Naprosyn omfatter:
- hovedpine,
- dårlig fordøjelse,
- halsbrand, og
- influenza symptomer
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Naprosyn. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
RISIKO FOR ALVORLIG Hjerte- og kardiovaskulære hændelser
Kardiovaskulære trombotiske hændelser
- Ikke-steroide antiinflammatoriske lægemidler (NSAID'er) forårsager en øget risiko for alvorlige kardiovaskulære trombotiske hændelser, herunder myokardieinfarkt og slagtilfælde, som kan være dødelige. Denne risiko kan opstå tidligt i behandlingen og kan stige med varigheden af brugen [se ADVARSLER OG FORHOLDSREGLER].
- NAPROSYN-tabletter, EC-NAPROSYN og ANAPROX DS er kontraindiceret i forbindelse med koronararterie-bypass-operationer (CABG) [se KONTRAINDIKATIONER, ADVARSLER OG FORHOLDSREGLER].
Gastrointestinal blødning, ulceration og perforation
- NSAID'er forårsager en øget risiko for alvorlige gastrointestinale (GI) bivirkninger, herunder blødning, ulceration og perforering af maven eller tarmene, som kan være dødelige. Disse hændelser kan forekomme når som helst under brug og uden advarselssymptomer. Ældre patienter og patienter med en tidligere anamnese med mavesår og/eller GI-blødning har større risiko for alvorlige GI-hændelser [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
NAPROSYN (naproxen) tabletter, EC-NAPROSYN (naproxen) tabletter med forsinket frigivelse og ANAPROX DS (naproxen natrium) tabletter er ikke-steroide antiinflammatoriske lægemidler, der fås som følger: NAPROSYN 250 mg tabletter er tilgængelige som gule tabletter indeholdende 500 mg naproxen til oral administration .
EC-NAPROSYN tabletter med forsinket frigivelse er tilgængelige som enterisk overtrukne hvide tabletter indeholdende 375 mg naproxen eller 500 mg naproxen til oral administration.
ANAPROX DS tabletter fås som mørkeblå tabletter indeholdende 550 mg naproxennatrium til oral administration.
Naproxen er et propionsyrederivat relateret til aryleddikesyregruppen af ikke-steroide antiinflammatoriske lægemidler. De kemiske navne for naproxen og naproxennatrium er henholdsvis (S)-6-methoxy-α-methyl-2-naphthaleneddikesyre og (S)-6methoxy-α-methyl-2-naphthaleneddikesyre, natriumsalt. Naproxen har en molekylvægt på 230,26 og en molekylær formel på C14H14O3. Naproxennatrium har en molekylvægt på 252,23 og en molekylformel på C14H13NaO3. Naproxen og naproxennatrium har henholdsvis følgende strukturer:
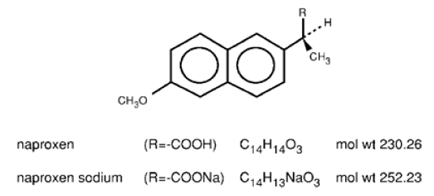
Naproxen er et lugtfrit, hvidt til råhvidt krystallinsk stof. Det er lipidopløseligt, praktisk talt uopløseligt i vand ved lav pH og frit opløseligt i vand ved høj pH. Octanol/vand-fordelingskoefficienten for naproxen ved pH 7,4 er 1,6 til 1,8. Naproxennatrium er et hvidt til cremehvidt, krystallinsk fast stof, frit opløseligt i vand ved neutral pH.
De inaktive ingredienser i NAPROSYN 250 mg tabletter inkluderer: croscarmellosenatrium, jernoxider, povidon og magnesiumstearat.
De inaktive ingredienser i EC-NAPROSYN tabletter med forsinket frigivelse omfatter: croscarmellosenatrium, povidon og magnesiumstearat. Den enteriske coatingdispersion indeholder methacrylsyrecopolymer, talkum, triethylcitrat, natriumhydroxid og renset vand. Præget på tabletterne er sort blæk. Opløsningen af denne enterisk overtrukne naproxen-tablet er pH-afhængig med hurtig opløsning over pH 6. Der er ingen opløsning under pH 4.
De inaktive ingredienser i ANAPROX DS tabletter omfatter: magnesiumstearat, mikrokrystallinsk cellulose, povidon og talkum. Belægningssuspensionen kan indeholde hydroxypropylmethylcellulose 2910, Opaspray K-1-4227, polyethylenglycol 8000 eller Opadry YS-1-4216.
INDIKATIONER
NAPROSYN 500 mg tabletter, EC-NAPROSYN 250 mg og ANAPROX DS er indiceret til:
lindring af tegn og symptomer på:
- rheumatoid arthritis
- slidgigt
- ankyloserende spondylitis
- Polyartikulær juvenil idiopatisk arthritis
NAPROSYN tabletter og ANAPROX DS er også indiceret til:
lindring af tegn og symptomer på:
- senebetændelse
- bursitis
- akut gigt
ledelsen af:
- smerte
- primær dysmenoré
DOSERING OG ADMINISTRATION
Generelle doseringsanvisninger
Overvej omhyggeligt de potentielle fordele og risici ved NAPROSYN tabletter, EC-NAPROSYN og ANAPROX DS og andre behandlingsmuligheder, før du beslutter dig for at bruge NAPROSYN 250mg tabletter, EC-NAPROSYN 500mg og ANAPROX DS. Brug den laveste effektive dosis til den korteste varighed i overensstemmelse med individuelle patientbehandlingsmål [se ADVARSLER OG FORHOLDSREGLER ].
Efter at have observeret responsen på den indledende behandling med NAPROSYN 250 mg tabletter, EC-NAPROSYN 500 mg eller ANAPROX DS, bør dosis og hyppighed justeres, så den passer til den enkelte patients behov.
For at bevare integriteten af den enteriske coating bør EC-NAPROSYN tabletten ikke knækkes, knuses eller tygges under indtagelse.
Naproxenholdige produkter såsom NAPROSYN 500mg, EC-NAPROSYN 250mg og ANAPROX DS og andre naproxenprodukter bør ikke anvendes samtidig, da de alle cirkulerer i plasmaet som naproxenanionen.
Reumatoid arthritis, slidgigt og ankyloserende spondylitis
De anbefalede doser af NAPROSYN 500 mg tabletter, ANAPROX DS og EC-NAPROSYN 250 mg er vist i tabel 1.
Ved langvarig administration kan dosis af naproxen justeres op eller ned afhængigt af patientens kliniske respons. En lavere daglig dosis kan være tilstrækkelig til langvarig administration.
Morgen- og aftendoserne behøver ikke at være lige store, og administration af lægemidlet hyppigere end to gange dagligt gør generelt ikke en forskel i respons.
Hos patienter, der tåler lavere doser godt, kan dosis øges til naproxen 1500 mg/dag i begrænsede perioder på op til 6 måneder, når et højere niveau af antiinflammatorisk/analgetisk aktivitet er påkrævet. Ved behandling af sådanne patienter med naproxen 1500 mg/dag, bør lægen observere tilstrækkeligt øgede kliniske fordele til at opveje den potentielle øgede risiko.
Polyartikulær juvenil idiopatisk arthritis
Naproxen fast-orale doseringsformer tillader muligvis ikke den fleksible dosistitrering, der er nødvendig hos pædiatriske patienter med polyartikulær juvenil idiopatisk arthritis. En flydende formulering kan være mere passende til vægtbaseret dosering og på grund af behovet for dosisfleksibilitet hos børn.
Hos pædiatriske patienter gav doser på 5 mg/kg/dag plasmaniveauer af naproxen svarende til dem, der ses hos voksne, der tog 500 mg naproxen [se KLINISK FARMAKOLOGI ]. Den anbefalede samlede daglige dosis af naproxen er ca. 10 mg/kg givet i 2 opdelte doser. Dosering med NAPROSYN tabletter er ikke egnet til børn, der vejer mindre end 50 kg.
Håndtering af smerter, primær dysmenoré og akut tendonitis og bursitis
Den anbefalede startdosis af ANAPROX DS (naproxennatrium) tabletter er 550 mg efterfulgt af 550 mg hver 12. time eller 275 mg (den halve af en 550 mg tablet) hver 6. til 8. time efter behov. Den indledende samlede daglige dosis bør ikke overstige 1375 mg (to og en halv tablet) naproxennatrium. Derefter bør den samlede daglige dosis ikke overstige 1100 mg naproxennatrium. Fordi natriumsaltet af naproxen absorberes hurtigere, anbefales ANAPROX DS til behandling af akutte smertefulde tilstande, når hurtig indtræden af smertelindring ønskes. NAPROSYN tabletter kan også anvendes. Den anbefalede startdosis af NAPROSYN tabletter er 500 mg efterfulgt af 250 mg (den ene halvdel af en 500 mg NAPROSYN tablet) hver 6.-8. time efter behov. Den samlede daglige dosis bør ikke overstige 1250 mg naproxen.
EC-NAPROSYN 250mg anbefales ikke til initial behandling af akutte smerter, fordi absorptionen af naproxen er forsinket sammenlignet med andre naproxenholdige produkter [se KLINISK FARMAKOLOGI ].
Akut gigt
Den anbefalede startdosis er 750 mg (en og en halv tablet) NAPROSYN 250 mg tabletter efterfulgt af 250 mg (en halv tablet) hver 8. time, indtil anfaldet er aftaget. ANAPROX DS kan også anvendes i en startdosis på 825 mg (halven tablet) efterfulgt af 275 mg (en halv tablet) hver 8. time. EC-NAPROSYN anbefales ikke på grund af den forsinkede absorption.
Ikke-udskiftelighed med andre formuleringer af naproxen
Forskellige dosisstyrker og formuleringer (f.eks. tabletter, suspension) af naproxen er ikke udskiftelige. Denne forskel bør tages i betragtning ved ændring af styrker eller formuleringer.
HVORDAN LEVERET
Doseringsformer og styrker
NAPROSYN® (naproxen) tabletter: 500 mg: gule, kapselformede, indgraveret med NPR LE 500 på den ene side og delekærv på den anden.
EC-NAPROSYN® (naproxen) tabletter med forsinket frigivelse: 375 mg: hvide, ovale bikonvekse tabletter præget med NPR EC 375 på den ene side.
EC-NAPROSYN® (naproxen) tabletter med forsinket frigivelse: 500 mg: hvide, aflange overtrukne tabletter præget med NPR EC 500 på den ene side.
ANAPROX® DS (naproxennatrium) tabletter: 550 mg: mørkeblå, aflange, indgraveret med NPS 550 på den ene side og delekærv på begge sider.
Opbevaring og håndtering
NAPROSYN (naproxen) tabletter 500 mg : gule, kapselformede tabletter, præget med NPR LE 500 på den ene side og delekærv på den anden. Pakket i lysbestandige flasker á 100 stk. Leveres som:
NDC 69437-316-01 100's (flaske)
Opbevares ved 15°C til 30°C (59°F til 86°F) i godt lukkede beholdere; dispensere i lysbestandige beholdere.
EC-NAPROSYN (naproxen) tabletter med forsinket frigivelse 375 mg : hvide, ovale bikonvekse tabletter præget med NPR EC 375 på den ene side. Pakket i lysbestandige flasker á 100 stk. Leveres som:
NDC 69437-415-01 100's (flaske)
500 mg hvide, aflange overtrukne tabletter præget med NPR EC 500 på den ene side. Pakket i lysbestandige flasker á 100 stk. Leveres som:
NDC 69437-416-01 100's (flaske)
Opbevares ved 15°C til 30°C (59°F til 86°F) i godt lukkede beholdere; dispensere i lysbestandige beholdere.
ANAPROX DS (naproxennatrium) Tabletter 550 mg : mørkeblå, aflange tabletter, indgraveret med NPS 550 på den ene side og delekærv på begge sider. Pakket i flasker á 100. Leveres som:
NDC 69437-203-01 100'er (flaske)
Opbevares ved 15° til 30°C (59° til 86°F) i godt lukkede beholdere.
Fremstillet til: Atnahs Pharma, Miles Gray Road, Basildon, Essex, SS14 3FR, Storbritannien. Distribueret af: Canton Laboratories, LLC., Alpharetta, GA 30004-5945, USA. Revideret: april 2021
BIVIRKNINGER
Følgende bivirkninger er beskrevet mere detaljeret i andre afsnit af mærkningen:
- Kardiovaskulære trombotiske hændelser [se ADVARSLER OG FORHOLDSREGLER ]
- GI-blødning, ulceration og perforation [se ADVARSLER OG FORHOLDSREGLER ]
- Hepatotoksicitet [se ADVARSLER OG FORHOLDSREGLER ]
- Hypertension [se ADVARSLER OG FORHOLDSREGLER ]
- Hjertesvigt og ødem [se ADVARSLER OG FORHOLDSREGLER ]
- Nyretoksicitet og hyperkaliæmi [se ADVARSLER OG FORHOLDSREGLER ]
- Anafylaktiske reaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Alvorlige hudreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Hæmatologisk toksicitet [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
Bivirkninger rapporteret i kontrollerede kliniske forsøg hos 960 patienter behandlet for reumatoid arthritis eller slidgigt er anført nedenfor. Generelt blev reaktioner hos patienter behandlet kronisk rapporteret 2 til 10 gange hyppigere, end de var i korttidsundersøgelser hos de 962 patienter, der blev behandlet for milde til moderate smerter eller for dysmenoré. De hyppigste rapporterede klager vedrørte mave-tarmkanalen.
En klinisk undersøgelse viste, at gastrointestinale reaktioner var hyppigere og mere alvorlige hos patienter med reumatoid arthritis, der tog daglige doser på 1500 mg naproxen sammenlignet med dem, der tog 750 mg naproxen.
kontrollerede kliniske forsøg med omkring 80 pædiatriske patienter og i velovervågede, åbne undersøgelser med omkring 400 pædiatriske patienter med polyartikulær juvenil idiopatisk arthritis behandlet med naproxen, var forekomsten af udslæt og forlængede blødningstider større, forekomsten af gastrointestinale og centrale nervesystemets reaktioner var omtrent det samme, og forekomsten af andre reaktioner var lavere hos pædiatriske patienter end hos voksne.
Hos patienter, der tog naproxen i kliniske forsøg, var de hyppigst rapporterede bivirkninger hos ca. 1 % til 10 % af patienterne:
Gastrointestinale (GI) oplevelser, herunder: halsbrand*, mavesmerter*, kvalme*, forstoppelse*, diarré, dyspepsi, stomatitis
Centralnervesystemet: hovedpine*, svimmelhed*, døsighed*, svimmelhed, svimmelhed
Dermatologisk: pruritus (kløe)*, hududbrud*, ekkymoser*, svedtendens, purpura
Særlige sanser: tinnitus*, synsforstyrrelser, høreforstyrrelser
Kardiovaskulær: ødem*, hjertebanken
Generel: dyspnø*, tørst
*Forekomst af rapporteret reaktion mellem 3% og 9%. De reaktioner, der forekommer hos mindre end 3 % af patienterne, er umarkerede.
Hos patienter, der tager NSAID'er, er følgende bivirkninger også blevet rapporteret hos ca. 1 % til 10 % af patienterne.
Gastrointestinale (GI) oplevelser, herunder: flatulens, kraftig blødning/perforation, mave-/duodenalsår (mave/duodenal), opkastning
Generel: unormal nyrefunktion, anæmi, forhøjede leverenzymer, øget blødningstid, udslæt
Følgende er yderligere bivirkninger rapporteret hos
Gastrointestinale: pancreatitis, opkastning
Lever og galde: gulsot
Hemisk og lymfatisk: melena, trombocytopeni, agranulocytose
Nervesystem: manglende evne til at koncentrere sig
Dermatologisk: hududslæt
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af naproxen efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Følgende er yderligere bivirkninger rapporteret hos
Kroppen som helhed: anafylaktoide reaktioner, angioneurotisk ødem, menstruationsforstyrrelser, pyreksi (kulderystelser og feber)
Kardiovaskulær: kongestiv hjertesvigt, vaskulitis, hypertension, lungeødem
Gastrointestinale: betændelse, blødning (nogle gange dødelig, især hos ældre), ulceration, perforering og obstruktion af den øvre eller nedre mave-tarmkanal. Øsofagitis, stomatitis, hæmatemese, colitis, forværring af inflammatorisk tarmsygdom (colitis ulcerosa, Crohns sygdom).
Lever og galde: unormale leverfunktionsprøver, hepatitis (nogle tilfælde har været dødelige)
Hemisk og lymfatisk: eosinofili, leukopeni, granulocytopeni, hæmolytisk anæmi, aplastisk anæmi
Metabolisk og ernæringsmæssig: hyperglykæmi, hypoglykæmi
Nervesystem: depression, drømmeabnormiteter, søvnløshed, utilpashed, myalgi, muskelsvaghed, aseptisk meningitis, kognitiv dysfunktion, kramper
Åndedræt: eosinofil pneumonitis, astma
Dermatologisk: alopeci, nældefeber, toksisk epidermal nekrolyse, erythema multiforme, erythema nodosum, fikseret lægemiddeludbrud, lichen planus, pustulær reaktion, systemisk lupus erythematoser, bulløse reaktioner, herunder Stevens-Johnsons syndrom, lysfølsom dermatitis, fotosensitivitetsreaktioner, der ligner porfysreaktioner, inkl. (pseudoporfyri) eller epidermolysis bullosa. Hvis hudens skrøbelighed, blærer eller andre symptomer, der tyder på pseudoporfyri, opstår, bør behandlingen seponeres, og patienten overvåges.
Særlige sanser: hørenedsættelse, hornhindeopacitet, papillitis, retrobulbar optisk neuritis, papilleødem
Urogenital: glomerulær nefritis, hæmaturi, hyperkaliæmi, interstitiel nefritis, nefrotisk syndrom, nyresygdom, nyresvigt, nyrepapillær nekrose, forhøjet serumkreatinin
Reproduktion (kvinde): infertilitet
Hos patienter, der tager NSAID'er, er følgende bivirkninger også blevet rapporteret hos
Kroppen som helhed: feber, infektion, sepsis, anafylaktiske reaktioner, appetitændringer, død
Kardiovaskulær: hypertension, takykardi, synkope, arytmi, hypotension, myokardieinfarkt
Gastrointestinale: mundtørhed, esophagitis, mavesår/mavesår, gastritis, glossitis, udbrud
Lever og galde: hepatitis, leversvigt
Hemisk og lymfatisk: rektal blødning, lymfadenopati, pancytopeni
Metabolisk og ernæringsmæssig: vægtændringer
Nervesystem: angst, asteni, forvirring, nervøsitet, paræstesi, somnolens, rysten, kramper, koma, hallucinationer
Åndedræt: astma, respirationsdepression, lungebetændelse
Dermatologisk: eksfoliativ dermatitis
Særlige sanser: sløret syn, konjunktivitis
Urogenital: blærebetændelse, dysuri, oliguri/polyuri, proteinuri
DRUGSINTERAKTIONER
Se tabel 1 for klinisk signifikante lægemiddelinteraktioner med naproxen.
Interaktioner med lægemiddel/laboratorietest
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Kardiovaskulære trombotiske hændelser
Kliniske forsøg med flere COX-2 selektive og ikke-selektive NSAID'er af op til tre års varighed har vist en øget risiko for alvorlige kardiovaskulære (CV) trombotiske hændelser, herunder myokardieinfarkt (MI) og slagtilfælde, som kan være fatale. Baseret på tilgængelige data er det uklart, at risikoen for CV-trombotiske hændelser er ens for alle NSAID'er. Den relative stigning i alvorlige CV-trombotiske hændelser over baseline forårsaget af NSAID-brug synes at være ens hos dem med og uden kendt CV-sygdom eller risikofaktorer for CV-sygdom. Patienter med kendt CV-sygdom eller risikofaktorer havde dog en højere absolut forekomst af overskydende alvorlige CV-trombotiske hændelser på grund af deres øgede baseline-rate. Nogle observationsstudier viste, at denne øgede risiko for alvorlige CV-trombotiske hændelser begyndte allerede i de første uger af behandlingen. Stigningen i CV-trombotisk risiko er blevet observeret mest konsekvent ved højere doser.
For at minimere den potentielle risiko for en uønsket CV-hændelse hos NSAID-behandlede patienter skal du bruge den laveste effektive dosis i den kortest mulige varighed. Læger og patienter bør forblive opmærksomme på udviklingen af sådanne hændelser under hele behandlingsforløbet, selv i fravær af tidligere CV-symptomer. Patienter bør informeres om symptomerne på alvorlige CV-hændelser og de skridt, der skal tages, hvis de opstår.
Der er ingen konsekvent evidens for, at samtidig brug af aspirin mindsker den øgede risiko for alvorlige CV-trombotiske hændelser forbundet med NSAID-brug. Samtidig brug af aspirin og et NSAID, såsom naproxen, øger risikoen for alvorlige gastrointestinale (GI) hændelser.
Status Post Koronararterie Bypass Graft (CABG) kirurgi
To store, kontrollerede kliniske forsøg med et COX-2 selektivt NSAID til behandling af smerte i de første 10-14 dage efter CABG-operation fandt en øget forekomst af myokardieinfarkt og slagtilfælde. NSAID'er er kontraindiceret i forbindelse med CABG [se KONTRAINDIKATIONER ].
Post-MI-patienter
Observationsundersøgelser udført i det danske folkeregister har vist, at patienter behandlet med NSAID i post-MI-perioden havde øget risiko for reinfarkt, CV-relateret død og dødelighed af alle årsager begyndende i den første uge af behandlingen. I denne samme kohorte var forekomsten af dødsfald i det første år efter MI 20 pr. 100 personår hos NSAID-behandlede patienter sammenlignet med 12 pr. 100 personår hos ikke-NSAID-eksponerede patienter. Selvom den absolutte dødsrate faldt noget efter det første år efter MI, var den øgede relative risiko for død hos NSAID-brugere ved i mindst de næste fire års opfølgning.
Undgå brugen af NAPROSYN tabletter, EC-NAPROSYN og ANAPROX DS til patienter med nylig MI, medmindre fordelene forventes at opveje risikoen for tilbagevendende CV-trombotiske hændelser. Hvis NAPROSYN 250 mg tabletter, EC-NAPROSYN og ANAPROX DS anvendes til patienter med nyligt hjerteinfarkt, skal patienter overvåges for tegn på hjerteiskæmi.
Gastrointestinal blødning, ulceration og perforering
NSAID'er, inklusive naproxen, forårsager alvorlige gastrointestinale (GI) bivirkninger, herunder betændelse, blødning, ulceration og perforering af spiserøret, maven, tyndtarmen eller tyktarmen, hvilket kan være dødeligt. Disse alvorlige bivirkninger kan forekomme til enhver tid, med eller uden advarselssymptomer, hos patienter behandlet med NSAID'er.
Kun én ud af fem patienter, som udvikler en alvorlig øvre GI-bivirkning under NSAID-behandling, er symptomatisk. Øvre mavesår, grov blødning eller perforation forårsaget af NSAID'er forekom hos ca. 1 % af patienterne behandlet i 3-6 måneder og hos ca. 2 %-4 % af patienterne behandlet i et år. Selv kortvarig NSAID-behandling er dog ikke uden risiko.
Risikofaktorer for GI-blødning, ulceration og perforering
Patienter med en tidligere anamnese med mavesår og/eller GI-blødning, som brugte NSAID'er, havde en større end 10 gange øget risiko for at udvikle GI-blødning sammenlignet med patienter uden disse risikofaktorer. Andre faktorer, der øger risikoen for GI-blødning hos patienter behandlet med NSAID'er, omfatter længere varighed af NSAID-behandling; samtidig brug af orale kortikosteroider, aspirin, antikoagulantia eller selektive serotoningenoptagshæmmere (SSRI'er); rygning; brug af alkohol; ældre alder; og dårlig generel sundhedstilstand. De fleste postmarketingrapporter om fatale gastrointestinale hændelser forekom hos ældre eller svækkede patienter. Derudover har patienter med fremskreden leversygdom og/eller koagulopati øget risiko for GI-blødning.
Strategier til at minimere GI-risici hos NSAID-behandlede patienter
- Brug den laveste effektive dosis i den kortest mulige varighed.
- Undgå administration af mere end ét NSAID ad gangen.
- Undgå brug til patienter med højere risiko, medmindre fordelene forventes at opveje den øgede risiko for blødning. For sådanne patienter, såvel som dem med aktiv gastrointestinale blødning, bør du overveje alternative behandlinger, bortset fra NSAID'er.
- Vær opmærksom på tegn og symptomer på GI-ulceration og blødning under NSAID-behandling.
- Hvis der er mistanke om en alvorlig GI-bivirkning, påbegynd omgående evaluering og behandling og seponér NAPROSYN-tabletter, EC-NAPROSYN eller ANAPROX DS, indtil en alvorlig GI-bivirkning er udelukket.
- Ved samtidig brug af lavdosis aspirin til hjerteprofylakse skal patienterne overvåges tættere for tegn på GI-blødning [se DRUGSINTERAKTIONER ].
Hepatotoksicitet
Forhøjelser af ALAT eller ASAT (tre eller flere gange den øvre grænse for normal [ULN]) er blevet rapporteret hos ca. 1 % af NSAID-behandlede patienter i kliniske forsøg. Derudover er der rapporteret sjældne, nogle gange fatale, tilfælde af alvorlig leverskade, herunder fulminant hepatitis, levernekrose og leversvigt.
Forhøjelser af ALAT eller ASAT (mindre end tre gange ULN) kan forekomme hos op til 15 % af patienter, der behandles med NSAID, inklusive naproxen.
Informer patienterne om advarselstegn og symptomer på hepatotoksicitet (f.eks. kvalme, træthed, sløvhed, diarré, kløe, gulsot, ømhed i højre øvre kvadrant og "influenzalignende" symptomer). Hvis der udvikles kliniske tegn og symptomer, der stemmer overens med leversygdom, eller hvis der opstår systemiske manifestationer (f.eks. eosinofili, udslæt osv.), skal du straks afbryde behandlingen med NAPROSYN 500 mg tabletter, EC-NAPROSYN 250 mg eller ANAPROX DS og udføre en klinisk evaluering af patienten .
Forhøjet blodtryk
NSAID'er, inklusive NAPROSYN 250 mg tabletter, EC-NAPROSYN og ANAPROX DS, kan føre til ny indtræden af hypertension eller forværring af allerede eksisterende hypertension, som begge kan bidrage til den øgede forekomst af CV-hændelser. Patienter, der tager angiotensin-konverterende enzym (ACE)-hæmmere, thiaziddiuretika eller loop-diuretika, kan have nedsat respons på disse behandlinger, når de tager NSAID'er [se DRUGSINTERAKTIONER ].
Overvåg blodtrykket (BP) under påbegyndelse af NSAID-behandling og under hele behandlingsforløbet.
Hjertesvigt og ødem
Coxib og traditionelle NSAID Trialists' Collaboration meta-analyse af randomiserede kontrollerede undersøgelser viste en ca. to gange stigning i hospitalsindlæggelser for hjertesvigt hos COX-2 selektivt behandlede patienter og ikke-selektive NSAID-behandlede patienter sammenlignet med placebo-behandlede patienter. I et dansk folkeregisterundersøgelse af patienter med hjertesvigt øgede NSAID-brug risikoen for MI, hospitalsindlæggelse for hjertesvigt og død.
Derudover er væskeretention og ødem blevet observeret hos nogle patienter behandlet med NSAID'er. Brug af naproxen kan sløve CV-virkningerne af flere terapeutiske midler, der bruges til at behandle disse medicinske tilstande (f.eks. diuretika, ACE-hæmmere eller angiotensinreceptorblokkere [ARB'er]) [se DRUGSINTERAKTIONER ].
Undgå brugen af NAPROSYN 250 mg tabletter, EC-NAPROSYN eller ANAPROX DS til patienter med alvorligt hjertesvigt, medmindre fordelene forventes at opveje risikoen for forværring af hjertesvigt. Hvis NAPROSYN 250 mg tabletter, EC-NAPROSYN 250 mg eller ANAPROX DS anvendes til patienter med alvorligt hjertesvigt, skal patienter overvåges for tegn på forværret hjertesvigt.
Da hver ANAPROX DS-tablet indeholder 50 mg natrium (ca. 2 mEq pr. hver 500 mg naproxen), bør dette overvejes hos patienter, hvis samlede indtag af natrium skal være stærkt begrænset.
Nyretoksicitet og hyperkaliæmi
Renal toksicitet
Langvarig administration af NSAID'er har resulteret i nyrepapillær nekrose og anden nyreskade.
Renal toksicitet er også set hos patienter, hvor renale prostaglandiner har en kompenserende rolle i opretholdelsen af renal perfusion. Hos disse patienter kan administration af et NSAID forårsage en dosisafhængig reduktion i prostaglandindannelsen og sekundært i renal blodgennemstrømning, hvilket kan fremkalde åbenlys nyreinsufficiens. Patienter med størst risiko for denne reaktion er dem med nedsat nyrefunktion, dehydrering, hypovolæmi, hjertesvigt, leverdysfunktion, dem, der tager diuretika og ACE-hæmmere eller ARB'er, og ældre. Seponering af NSAID-behandling efterfølges sædvanligvis af genopretning til forbehandlingstilstanden.
Der er ingen tilgængelig information fra kontrollerede kliniske undersøgelser vedrørende brugen af NAPROSYN 500 mg tabletter, EC-NAPROSYN eller ANAPROX DS hos patienter med fremskreden nyresygdom. Nyrevirkningerne af NAPROSYN 500 mg tabletter, EC-NAPROSYN eller ANAPROX DS kan fremskynde udviklingen af nyreinsufficiens hos patienter med allerede eksisterende nyresygdom.
Korrekt volumenstatus hos dehydrerede eller hypovolæmiske patienter før påbegyndelse af NAPROSYN-tabletter, EC-NAPROSYN 250 mg eller ANAPROX DS. Overvåg nyrefunktionen hos patienter med nedsat nyre- eller leverfunktion, hjertesvigt, dehydrering eller hypovolæmi under brug af NAPROSYN 500 mg tabletter, EC-NAPROSYN og ANAPROX DS [se DRUGSINTERAKTIONER ]. Undgå brugen af NAPROSYN 250 mg tabletter, EC-NAPROSYN 500 mg og ANAPROX DS til patienter med fremskreden nyresygdom, medmindre fordelene forventes at opveje risikoen for forværring af nyrefunktionen. Hvis NAPROSYN 500 mg tabletter, EC-NAPROSYN 500 mg eller ANAPROX DS anvendes til patienter med fremskreden nyresygdom, skal patienter overvåges for tegn på forværret nyrefunktion.
Hyperkaliæmi
Stigninger i serumkaliumkoncentrationen, inklusive hyperkaliæmi, er blevet rapporteret ved brug af NSAID'er, selv hos nogle patienter uden nedsat nyrefunktion. Hos patienter med normal nyrefunktion er disse virkninger blevet tilskrevet en tilstand af hyporeninemhypoaldosteronisme.
Anafylaktiske reaktioner
Naproxen er blevet forbundet med anafylaktiske reaktioner hos patienter med og uden kendt overfølsomhed over for naproxen og hos patienter med aspirinfølsom astma [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Søg akut hjælp, hvis der opstår en anafylaktisk reaktion.
Forværring af astma relateret til aspirinfølsomhed
En subpopulation af patienter med astma kan have aspirinfølsom astma, som kan omfatte kronisk rhinosinusitis kompliceret af næsepolypper; alvorlig, potentielt dødelig bronkospasme; og/eller intolerance over for aspirin og andre NSAID'er.
Fordi krydsreaktivitet mellem aspirin og andre NSAID'er er blevet rapporteret hos sådanne aspirinfølsomme patienter, er NAPROSYN 250 mg tabletter, EC-NAPROSYN 500 mg og ANAPROX DS kontraindiceret hos patienter med denne form for aspirinfølsomhed [se KONTRAINDIKATIONER ]. Når NAPROSYN 250 mg tabletter, EC-NAPROSYN 250 mg eller ANAPROX DS anvendes til patienter med allerede eksisterende astma (uden kendt aspirinfølsomhed), skal du overvåge patienter for ændringer i tegn og symptomer på astma.
Alvorlige hudreaktioner
NSAID'er, herunder naproxen, kan forårsage alvorlige hudbivirkninger såsom eksfoliativ dermatitis, Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), som kan være dødelig. Disse alvorlige hændelser kan forekomme uden varsel. Informer patienterne om tegn og symptomer på alvorlige hudreaktioner, og om at stoppe brugen af NAPROSYN 250 mg tabletter, EC-NAPROSYN 500 mg eller ANAPROX DS ved den første forekomst af hududslæt eller andre tegn på overfølsomhed. NAPROSYN tabletter, EC-NAPROSYN og ANAPROX DS er kontraindiceret til patienter med tidligere alvorlige hudreaktioner på NSAID'er [se KONTRAINDIKATIONER ].
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS)
Lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS) er blevet rapporteret hos patienter, der tager NSAID'er, såsom NAPROSYN tabletter, EC-NAPROSYN 500 mg og ANAPROX DS. Nogle af disse hændelser har været fatale eller livstruende. DRESS viser sig typisk, men ikke udelukkende, med feber, udslæt, lymfadenopati og/eller hævelse i ansigtet. Andre kliniske manifestationer kan omfatte hepatitis, nefritis, hæmatologiske abnormiteter, myocarditis eller myositis. Nogle gange kan symptomer på DRESS minde om en akut virusinfektion. Eosinofili er ofte til stede. Fordi denne lidelse er variabel i sin præsentation, kan andre organsystemer, der ikke er nævnt her, være involveret. Det er vigtigt at bemærke, at tidlige manifestationer af overfølsomhed, såsom feber eller lymfadenopati, kan være til stede, selvom udslæt ikke er tydeligt. Hvis sådanne tegn eller symptomer er til stede, skal du afbryde behandlingen med NAPROSYN 500 mg tabletter, EC-NAPROSYN og ANAPROX DS og straks evaluere patienten.
Føtal toksicitet
For tidlig lukning af føtal ductus arteriosus
Undgå brug af NSAID'er, inklusive NAPROSYN 500 mg tabletter, EC-NAPROSYN og ANAPROX DS, hos gravide kvinder ved ca. 30 ugers graviditet og senere. NSAID'er, inklusive NAPROSYN 500 mg tabletter, EC-NAPROSYN og ANAPROX DS, øger risikoen for for tidlig lukning af fosterets ductus arteriosus ved omtrent denne svangerskabsalder.
Oligohydramnios/neonatal nyreinsufficiens
Brug af NSAID'er, inklusive NAPROSYN tabletter, EC-NAPROSYN 250mg og ANAPROX DS, ved ca. 20 ugers graviditet eller senere i graviditeten kan forårsage føtal nyreinsufficiens, hvilket fører til oligohydramnios og i nogle tilfælde neonatal nyreinsufficiens. Disse uønskede resultater ses i gennemsnit efter dage til ugers behandling, selvom oligohydramnios sjældent er blevet rapporteret så snart som 48 timer efter NSAID-start. Oligohydramnios er ofte, men ikke altid, reversibel med seponering af behandlingen. Komplikationer af forlænget oligohydramnios kan for eksempel omfatte lemmerkontrakturer og forsinket lungemodning. I nogle tilfælde efter markedsføring af nedsat nyrefunktion hos nyfødte var invasive procedurer såsom udvekslingstransfusion eller dialyse påkrævet.
Hvis NSAID-behandling er nødvendig mellem ca. 20 uger og 30 ugers graviditet, begrænses brugen af NAPROSYN 250 mg tabletter, EC-NAPROSYN 250 mg eller ANAPROX DS til den lavest mulige effektive dosis og kortest mulige varighed. Overvej ultralydsovervågning af fostervand, hvis behandlingen med NAPROSYN tabletter, EC-NAPROSYN eller ANAPROX DS strækker sig ud over 48 timer. Afbryd NAPROSYN 500 mg tabletter, EC-NAPROSYN og ANAPROX DS, hvis der opstår oligohydramnios, og opfølg i henhold til klinisk praksis [se Brug i specifikke populationer ].
Hæmatologisk toksicitet
Anæmi er forekommet hos NSAID-behandlede patienter. Dette kan skyldes okkult eller groft blodtab, væskeophobning eller en ufuldstændigt beskrevet effekt på erytropoiese. Hvis en patient behandlet med NAPROSYN-tabletter, EC-NAPROSYN 500mg eller ANAPROX DS har tegn eller symptomer på anæmi, skal du overvåge hæmoglobin eller hæmatokrit.
NSAID'er, inklusive NAPROSYN tabletter, EC-NAPROSYN og ANAPROX DS, kan øge risikoen for blødningshændelser. Komorbide tilstande såsom koagulationsforstyrrelser eller samtidig brug af warfarin og andre antikoagulantia, trombocythæmmende midler (f.eks. aspirin), serotoningenoptagelseshæmmere (SSRI'er) og serotonin-noradrenalin-genoptagelseshæmmere (SNRI'er) kan øge denne risiko. Overvåg disse patienter for tegn på blødning [se DRUGSINTERAKTIONER ].
Maskering af betændelse og feber
Den farmakologiske aktivitet af NAPROSYN-tabletter, EC-NAPROSYN 500mg og ANAPROX DS til at reducere inflammation og muligvis feber, kan mindske anvendeligheden af diagnostiske tegn til påvisning af infektioner.
Langtidsbrug og laboratorieovervågning
Da alvorlig GI-blødning, levertoksicitet og nyreskade kan forekomme uden advarselssymptomer eller tegn, bør du overveje at overvåge patienter i langvarig NSAID-behandling med en CBC og en kemiprofil med jævne mellemrum [se ADVARSLER OG FORHOLDSREGLER ].
Patienter med initiale hæmoglobinværdier på 10 g eller mindre, som skal modtage langtidsbehandling, bør have hæmoglobinværdier fastlagt periodisk.
På grund af uønskede øjenfund i dyreforsøg med lægemidler af denne klasse, anbefales det, at der udføres oftalmiske undersøgelser, hvis der opstår en ændring eller forstyrrelse i synet.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning (medicinvejledning), der følger med hver udleveret recept. Informer patienter, familier eller deres pårørende om følgende information, før behandling med NAPROSYN tabletter, EC-NAPROSYN eller ANAPROX DS påbegyndes og med jævne mellemrum i løbet af den igangværende behandling.
Kardiovaskulære trombotiske hændelser
Rådgiv patienterne om at være opmærksomme på symptomer på kardiovaskulære trombotiske hændelser, herunder brystsmerter, åndenød, svaghed eller sløret tale, og at rapportere alle disse symptomer til deres læge med det samme [se ADVARSLER OG FORHOLDSREGLER ].
Gastrointestinal blødning, ulceration og perforering
Rådgiv patienterne om at rapportere symptomer på ulcerationer og blødninger, herunder epigastriske smerter, dyspepsi, melena og hæmatemese til deres læge. I forbindelse med samtidig brug af lavdosis aspirin til hjerteprofylakse, informere patienterne om den øgede risiko for og tegn og symptomer på gastrointestinale blødninger [se ADVARSLER OG FORHOLDSREGLER ].
Hepatotoksicitet
Informer patienterne om advarselstegn og symptomer på hepatotoksicitet (f.eks. kvalme, træthed, sløvhed, kløe, diarré, gulsot, ømhed i højre øvre kvadrant og "influenzalignende" symptomer). Hvis disse opstår, instruer patienterne i at stoppe med NAPROSYN 500 mg tabletter, EC-NAPROSYN 250 mg eller ANAPROX DS og søge øjeblikkelig medicinsk behandling [se ADVARSLER OG FORHOLDSREGLER ].
Hjertesvigt og ødem
Rådgiv patienterne om at være opmærksomme på symptomer på kongestiv hjertesvigt, herunder åndenød, uforklarlig vægtøgning eller ødem, og at kontakte deres læge, hvis sådanne symptomer opstår [se ADVARSLER OG FORHOLDSREGLER ].
Anafylaktiske reaktioner
Informer patienterne om tegn på en anafylaktisk reaktion (f.eks. åndedrætsbesvær, hævelse af ansigt eller hals). Instruer patienterne i at søge øjeblikkelig nødhjælp, hvis disse opstår [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Alvorlige hudreaktioner, inklusive DRESS
Rådgive patienter om at stoppe med at tage NAPROSYN 250 mg tabletter, EC-NAPROSYN 500 mg eller ANAPROX DS øjeblikkeligt, hvis de udvikler nogen form for udslæt eller feber, og at kontakte deres læge så hurtigt som muligt [se ADVARSLER OG FORHOLDSREGLER ].
Kvindelig fertilitet
Informer kvinder med reproduktionspotentiale, som ønsker graviditet, at NSAID'er, inklusive NAPROSYN-tabletter, ECNAPROSYN 250 mg og ANAPROX DS, kan være forbundet med en reversibel forsinkelse i ægløsning (se Brug i specifikke populationer .]
Føtal toksicitet
Informer gravide kvinder om at undgå brug af NAPROSYN 250 mg tabletter, EC-NAPROSYN eller ANAPROX DS og andre NSAID'er, der starter ved 30 ugers graviditet på grund af risikoen for for tidlig lukning af føtal ductus arteriosus. Hvis behandling med NAPROSYN tabletter, EC-NAPROSYN 500 mg eller ANAPROX DS er nødvendig for en gravid kvinde mellem ca. 20 og 30 ugers graviditet, skal du rådgive hende om, at hun muligvis skal overvåges for oligohydramnios, hvis behandlingen fortsætter i mere end 48 timer [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Undgå samtidig brug af NSAID'er
Informer patienterne om, at samtidig brug af NAPROSYN tabletter, EC-NAPROSYN 500mg og ANAPROX DS med andre NSAID'er eller salicylater (f.eks. diflunisal, salsalat) ikke anbefales på grund af den øgede risiko for gastrointestinal toksicitet og ringe eller ingen stigning i effekt [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ]. Advarer patienter om, at NSAID'er kan være til stede i "håndkøbsmedicin" til behandling af forkølelse, feber eller søvnløshed.
Brug af NSAID og lavdosis aspirin
Informer patienterne om ikke at bruge lavdosis aspirin samtidig med NAPROSYN 500mg tabletter, EC-NAPROSYN og ANAPROX DS, før de taler med deres læge [se DRUGSINTERAKTIONER ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Et 2-årigt studie blev udført med rotter for at evaluere det carcinogene potentiale af naproxen ved rottedoser på 8, 16 og 24 mg/kg/dag (0,05, 0,1 og 0,16 gange den maksimale anbefalede daglige dosis til mennesker [MRHD] på 1500 mg/dag baseret på en sammenligning af kropsoverfladeareal). Der blev ikke fundet tegn på tumorigenicitet.
Mutagenese
Naproxen testede positivt i in vivo søsterkromatidudvekslingsassayet for, men var ikke mutagent i in vitro bakteriel revers mutationsassay (Ames test).
Forringelse af fertilitet
Hanrotter blev behandlet med 2, 5, 10 og 20 mg/kg naproxen ved oral gavage i 60 dage før parring, og hunrotter blev behandlet med de samme doser i 14 dage før parring og i de første 7 dage af graviditeten. Der var ingen negative virkninger på fertiliteten (op til 0,13 gange MRDH baseret på kropsoverfladeareal).
Brug i specifikke populationer
Graviditet
Risikooversigt
Brug af NSAID'er, inklusive NAPROSYN 250 mg tabletter, EC-NAPROSYN og ANAPROX DS, kan forårsage for tidlig lukning af fosterets ductus arteriosus og føtal nyreinsufficiens, hvilket fører til oligohydramnios og i nogle tilfælde neonatal nyreinsufficiens. På grund af disse risici skal du begrænse dosis og varighed af NAPROSYN-tabletter, EC-NAPROSYN 500mg eller ANAPROX DS-brug mellem ca. 20 og 30 ugers graviditet, og undgå brug af NAPROSYN 500mg-tabletter, EC-NAPROSYN og ANAPROX DS efter ca. 30 uger. graviditet og senere i graviditeten (se Kliniske overvejelser , Data ).
For tidlig lukning af føtal ductus arteriosus
Brug af NSAID'er, herunder NAPROSYN tabletter, EC-NAPROSYN og ANAPROX DS, ved ca. 30 ugers graviditet eller senere i graviditeten øger risikoen for for tidlig lukning af fosterets ductus arteriosus.
Oligohydramnios/neonatal nyreinsufficiens
Brug af NSAID'er ved omkring 20 ugers graviditet eller senere i graviditeten har været forbundet med tilfælde af føtal nyreinsufficiens, der fører til oligohydramnios og i nogle tilfælde neonatal nyreinsufficiens.
Data fra observationsundersøgelser vedrørende andre potentielle embryoføtale risici ved brug af NSAID hos kvinder i graviditetens første eller andet trimester er ikke konklusive. I dyrereproduktionsstudier med rotter, kaniner og mus ingen tegn på teratogenicitet eller fosterskade, når naproxen blev administreret i løbet af organogeneseperioden i doser på henholdsvis 0,13, 0,26 og 0,6 gange den maksimale anbefalede daglige dosis til mennesker på 1500 mg/dag [ se Data ]. Baseret på dyredata har prostaglandiner vist sig at have en vigtig rolle i endometrievaskulær permeabilitet, blastocystimplantation og decidualisering. I dyreforsøg resulterede administration af prostaglandinsyntesehæmmere såsom naproxen i øget præ- og postimplantationstab. Prostaglandiner har også vist sig at have en vigtig rolle i fosterets nyreudvikling. I publicerede dyreforsøg er prostaglandinsyntesehæmmere blevet rapporteret at hæmme nyreudviklingen, når de administreres i klinisk relevante doser.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for de(n) angivne population(er) er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre ugunstige udfald. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske overvejelser
Fetale/neonatale bivirkninger
For tidlig lukning af føtal ductus arteriosus
Undgå brug af NSAID'er hos kvinder ved ca. 30. svangerskabsuge og senere i graviditeten, da NSAID'er, inklusive NAPROSYN 500 mg tabletter, EC-NAPROSYN 250 mg og ANAPROX DS, kan forårsage for tidlig lukning af føtal ductus arteriosus (se Data ).
Oligohydramnios/neonatal nyreinsufficiens
Hvis et NSAID er nødvendigt ved ca. 20 ugers graviditet eller senere i graviditeten, skal du begrænse brugen til den laveste effektive dosis og kortest mulige varighed. Hvis behandlingen med NAPROSYN tabletter, EC-NAPROSYN eller ANAPROX DS strækker sig ud over 48 timer, skal du overveje at monitorere med ultralyd for oligohydramnios. Hvis der opstår oligohydramnios, skal du seponere NAPROSYN 250 mg tabletter, ECNAPROSYN 250 mg og ANAPROX DS og følge op i henhold til klinisk praksis (se Data ).
Arbejde eller levering
Der er ingen undersøgelser af virkningerne af NAPROSYN tabletter, EC-NAPROSYN eller ANAPROX DS under fødsel eller fødsel. I dyreforsøg hæmmer NSAID'er, herunder naproxen, prostaglandinsyntesen, forårsager forsinket fødsel og øger forekomsten af dødfødsler.
Data
Menneskelige data
Der er noget, der tyder på, at når hæmmere af prostaglandinsyntese bruges til at forsinke for tidlig fødsel, er der en øget risiko for neonatale komplikationer såsom nekrotiserende enterocolitis, patent ductus arteriosus og intrakraniel blødning. Naproxen-behandling givet sent i graviditeten for at forsinke fødslen er blevet forbundet med vedvarende pulmonal hypertension, nyreinsufficiens og unormale prostaglandin E-niveauer hos præmature spædbørn. På grund af de kendte virkninger af ikke-steroide antiinflammatoriske lægemidler på det føtale kardiovaskulære system (lukning af ductus arteriosus), bør brug under graviditet (især begyndende ved 30-ugers graviditet eller tredje trimester) undgås.
For tidlig lukning af føtal ductus arteriosus
Publiceret litteratur rapporterer, at brugen af NSAID'er ved ca. 30 ugers graviditet og senere i graviditeten kan forårsage for tidlig lukning af føtal ductus arteriosus.
Oligohydramnios/neonatal nyreinsufficiens
Publicerede undersøgelser og postmarketingrapporter beskriver moderbrug af NSAID ved ca. 20 ugers svangerskab eller senere i graviditeten forbundet med føtal nyreinsufficiens, der fører til oligohydramnios og i nogle tilfælde neonatal nyreinsufficiens. Disse uønskede resultater ses i gennemsnit efter dage til ugers behandling, selvom oligohydramnios sjældent er blevet rapporteret så snart som 48 timer efter NSAID-start. I mange tilfælde, men ikke alle, var faldet i fostervand forbigående og reversibelt med ophør af lægemidlet. Der har været et begrænset antal case-rapporter af moderbrug af NSAID og neonatal nyreinsufficiens uden oligohydramnios, hvoraf nogle var irreversible. Nogle tilfælde af neonatal nyredysfunktion krævede behandling med invasive procedurer, såsom udvekslingstransfusion eller dialyse.
Metodiske begrænsninger af disse postmarketing undersøgelser og rapporter omfatter mangel på en kontrolgruppe; begrænset information om dosis, varighed og tidspunkt for lægemiddeleksponering; og samtidig brug af anden medicin. Disse begrænsninger udelukker etablering af et pålideligt estimat af risikoen for uønskede føtale og neonatale resultater ved brug af NSAID hos moderen. Da de offentliggjorte sikkerhedsdata om neonatale udfald hovedsageligt involverede præmature spædbørn, er generaliserbarheden af visse rapporterede risici for fuldbårne spædbørn, der er udsat for NSAID'er gennem moderbrug, usikker.
Dyredata
Reproduktionsundersøgelser er blevet udført på rotter med 20 mg/kg/dag (0,13 gange den maksimalt anbefalede daglige dosis på 1500 mg/dag baseret på sammenligning af kropsoverfladearealer), kaniner med 20 mg/kg/dag (0,26 gange den maksimale anbefalede dosis) human daglig dosis, baseret på kropsoverfladesammenligning), og mus på 170 mg/kg/dag (0,6 gange den maksimale anbefalede humane daglige dosis baseret på kropsoverfladesammenligning) uden tegn på nedsat fertilitet eller skade på fosteret pga. stoffet.
Amning
Risikooversigt
Naproxen-anionen er fundet i mælken hos ammende kvinder i en koncentration svarende til ca. 1 % af den maksimale naproxenkoncentration i plasma. De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for NAPROSYN-tabletter, EC-NAPROSYN 500mg eller ANAPROX DS og eventuelle negative virkninger på det ammede spædbarn fra NAPROSYN-tabletter, EC-NAPROSYN, eller ANAPROX DS eller fra den underliggende moderens tilstand.
Hunner og mænd med reproduktionspotentiale
Infertilitet
Kvinder
Baseret på virkningsmekanismen kan brugen af prostaglandin-medierede NSAID'er, inklusive NAPROSYN tabletter, ECNAPROSYN og ANAPROX DS, forsinke eller forhindre brud på ovariefollikler, som er blevet forbundet med reversibel infertilitet hos nogle kvinder. Publicerede dyreforsøg har vist, at administration af prostaglandinsyntesehæmmere har potentialet til at forstyrre prostaglandin-medieret follikulær ruptur, der er nødvendig for ægløsning. Små undersøgelser af kvinder behandlet med NSAID'er har også vist en reversibel forsinkelse i ægløsning. Overvej seponering af NSAID'er, herunder NAPROSYN tabletter, EC-NAPROSYN og ANAPROX DS, hos kvinder, der har svært ved at blive gravide, eller som er under undersøgelse af infertilitet.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter under 2 år er ikke blevet fastlagt. Pædiatriske doseringsanbefalinger for polyartikulær juvenil idiopatisk arthritis er baseret på velkontrollerede undersøgelser [se DOSERING OG ADMINISTRATION ]. Der er ingen tilstrækkelige effektivitets- eller dosis-responsdata for andre pædiatriske tilstande, men erfaringen med polyartikulær juvenil idiopatisk arthritis og anden brugserfaring har vist, at enkeltdoser på 2,5 til 5 mg/kg som naproxensuspension, med en samlet daglig dosis på ikke over 15 mg/kg/dag, tolereres godt hos pædiatriske patienter over 2 år.
Geriatrisk brug
Den hepatiske og renale tolerabilitet af langtidsindgivelse af naproxen blev undersøgt i to dobbeltblindede kliniske forsøg med 586 patienter. Af de undersøgte patienter var 98 patienter 65 år og ældre, og 10 af de 98 patienter var 75 år og ældre. NAPROXEN blev administreret i doser på 375 mg to gange dagligt eller 750 mg to gange dagligt i op til 6 måneder. Forbigående abnormiteter i laboratorieundersøgelser, der vurderede lever- og nyrefunktion, blev noteret hos nogle patienter, selvom der ikke var bemærket forskelle i forekomsten af unormale værdier blandt forskellige aldersgrupper.
Ældre patienter, sammenlignet med yngre patienter, har større risiko for NSAID-associerede alvorlige kardiovaskulære, gastrointestinale og/eller renale bivirkninger. Hvis den forventede fordel for den ældre patient opvejer disse potentielle risici, skal du begynde at dosere i den lave ende af doseringsområdet og overvåge patienterne for bivirkninger [se ADVARSLER OG FORHOLDSREGLER ].
Undersøgelser viser, at selvom den totale plasmakoncentration af naproxen er uændret, er den ubundne plasmafraktion af naproxen øget hos ældre. Den kliniske betydning af dette fund er uklar, selvom det er muligt, at stigningen i koncentrationen af frit naproxen kan være forbundet med en stigning i antallet af bivirkninger pr. given dosis hos nogle ældre patienter. Forsigtighed tilrådes, når høje doser er påkrævet, og en vis justering af dosis kan være nødvendig hos ældre patienter. Som med andre lægemidler, der anvendes til ældre, er det klogt at bruge den laveste effektive dosis.
Erfaring viser, at geriatriske patienter kan være særligt følsomme over for visse bivirkninger af ikke-steroide antiinflammatoriske lægemidler. Ældre eller svækkede patienter synes at tolerere mavesår eller blødning mindre godt, når disse hændelser opstår. De fleste spontane rapporter om fatale GI-hændelser er i den geriatriske population [se ADVARSLER OG FORHOLDSREGLER ].
Naproxen er kendt for at blive udskilt væsentligt af nyrerne, og risikoen for toksiske reaktioner på dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og det kan være nyttigt at overvåge nyrefunktionen [se KLINISK FARMAKOLOGI ]. Geriatriske patienter kan have en større risiko for udvikling af en form for nyretoksicitet fremkaldt af reduceret prostaglandindannelse under administration af ikke-steroide antiinflammatoriske lægemidler [se ADVARSLER OG FORHOLDSREGLER ].
Nedsat leverfunktion
Forsigtighed tilrådes, når høje doser er påkrævet, og en vis justering af dosis kan være nødvendig hos disse patienter. Det er klogt at bruge den laveste effektive dosis [se KLINISK FARMAKOLOGI ].
Nedsat nyrefunktion
Naproxen-holdige produkter anbefales ikke til brug hos patienter med moderat til svær og svær nyreinsufficiens (kreatininclearance ADVARSLER OG FORHOLDSREGLER , KLINISK FARMAKOLOGI ].
OVERDOSIS
Symptomer efter akutte NSAID-overdoseringer har typisk været begrænset til sløvhed, døsighed, kvalme, opkastning og epigastriske smerter, som generelt har været reversible med støttende behandling. Der er opstået gastrointestinal blødning. Hypertension, akut nyresvigt, respirationsdepression og koma er forekommet, men var sjældne [se ADVARSLER OG FORHOLDSREGLER ].Fordi naproxennatrium kan absorberes hurtigt, bør høje og tidlige blodniveauer forventes.
Nogle få patienter har oplevet kramper, men det er ikke klart, om disse var lægemiddelrelaterede eller ej. Det vides ikke, hvilken dosis af lægemidlet der ville være livstruende. [se ADVARSLER OG FORHOLDSREGLER ].
Håndter patienter med symptomatisk og understøttende behandling efter en NSAID-overdosering. Der er ingen specifikke modgifte.
Overvej emeser og/eller aktivt kul (60 til 100 gram hos voksne, 1 til 2 gram pr. kg kropsvægt hos pædiatriske patienter) og/eller osmotisk katarsis hos symptomatiske patienter, der ses inden for fire timer efter indtagelse eller hos patienter med en stor overdosering ( 5 til 10 gange den anbefalede dosis). Tvungen diurese, alkalinisering af urin, hæmodialyse eller hemoperfusion er muligvis ikke nyttige på grund af høj proteinbinding.
For yderligere information om overdoseringsbehandling kontakt et giftkontrolcenter (1-800-222-1222).
KONTRAINDIKATIONER
NAPROSYN 500 mg tabletter, EC-NAPROSYN og ANAPROX DS er kontraindiceret til følgende patienter:
- Kendt overfølsomhed (f.eks. anafylaktiske reaktioner og alvorlige hudreaktioner) over for naproxen eller andre komponenter i lægemidlet [se ADVARSLER OG FORHOLDSREGLER ]
- Anamnese med astma, nældefeber eller andre allergiske reaktioner efter indtagelse af aspirin eller andre NSAID'er. Alvorlige, nogle gange fatale, anafylaktiske reaktioner på NSAID'er er blevet rapporteret hos sådanne patienter [se ADVARSLER OG FORHOLDSREGLER ]
- I forbindelse med koronar bypass-operation (CABG) [se ADVARSLER OG FORHOLDSREGLER ]
KLINISK FARMAKOLOGI
Handlingsmekanisme
Naproxen har smertestillende, anti-inflammatoriske og antipyretiske egenskaber. ANAPROX DS (naproxennatrium) er udviklet som en hurtigere absorberet formulering af naproxen til brug som et smertestillende middel.
Virkningsmekanismen for naproxen, ligesom andre NSAID'er, er ikke fuldstændigt forstået, men involverer hæmning af cyclooxygenase (COX-1 og COX-2).
Naproxen er en potent hæmmer af prostaglandinsyntese in vitro. Naproxen-koncentrationer opnået under behandlingen har fremkaldt in vivo-effekter. Prostaglandiner sensibiliserer afferente nerver og forstærker virkningen af bradykinin til at inducere smerte i dyremodeller. Prostaglandiner er mediatorer af inflammation. Da naproxen er en hæmmer af prostaglandinsyntese, kan dets virkemåde skyldes et fald i prostaglandiner i perifere væv.
Farmakodynamik
et studie med raske frivillige viste 10 dages samtidig administration af naproxen 220 mg én gang dagligt med lavdosis aspirin med øjeblikkelig frigivelse (81 mg) en interaktion med den trombocythæmmende aktivitet af aspirin målt ved % serum-thromboxan B2-hæmning efter 24 timer efter dag 10 dosis [98,7% (aspirin alene) vs. 93,1% (naproxen og aspirin)]. Interaktionen blev observeret selv efter seponering af naproxen på dag 11 (mens aspirindosis blev fortsat), men normaliseret på dag 13. I samme undersøgelse var interaktionen større, når naproxen blev administreret 30 minutter før aspirin [98,7 % vs. 87,7 %] og minimal, når aspirin blev administreret 30 minutter før naproxen [98,7 % vs. 95,4 %].
Efter administration af naproxen 220 mg to gange dagligt med lavdosis aspirin med øjeblikkelig frigivelse (første dosis af naproxen givet 30 minutter før aspirin), var interaktionen minimal 24 timer efter dosis dag 10 [98,7 % vs. 95,7 %]. Imidlertid var interaktionen mere fremtrædende efter seponering af naproxen (udvaskning) på dag 11 [98,7 % vs. 84,3 %] og normaliserede ikke fuldstændigt på dag 13 [98,5 % vs. 90,7 %]. [se DRUGSINTERAKTIONER ].
Farmakokinetik
Naproxen og naproxennatrium absorberes hurtigt og fuldstændigt fra mave-tarmkanalen med en in vivo biotilgængelighed på 95 %. De forskellige doseringsformer af NAPROSYN 250mg er bioækvivalente med hensyn til omfang af absorption (AUC) og peak-koncentration (Cmax); dog adskiller produkterne sig i deres absorptionsmønster. Disse forskelle mellem naproxen-produkter er relateret til både den anvendte kemiske form af naproxen og dens formulering. Selv med de observerede forskelle i absorptionsmønsteret, er eliminationshalveringstiden for naproxen uændret på tværs af produkter i området fra 12 til 17 timer. Steady-state-niveauer af naproxen nås på 4 til 5 dage, og graden af naproxen-akkumulering er i overensstemmelse med denne halveringstid. Dette tyder på, at forskellene i frigivelsesmønster kun spiller en ubetydelig rolle i opnåelsen af steady-state plasmaniveauer.
Absorption
NAPROSYN Tabletter/ANAPROX DS
Efter administration af NAPROSYN 500 mg tabletter opnås maksimale plasmaniveauer efter 2 til 4 timer. Efter oral administration af ANAPROX DS opnås maksimale plasmaniveauer efter 1 til 2 timer. Forskellen i hastigheder mellem de to produkter skyldes den øgede vandopløselighed af natriumsaltet af naproxen anvendt i ANAPROX DS.
EC-NAPROSYN
EC-NAPROSYN er designet med en pH-følsom belægning for at give en barriere mod opløsning i det sure miljø i maven og for at miste integritet i det mere neutrale miljø i tyndtarmen. Den enteriske polymercoating, der er valgt til EC-NAPROSYN 250 mg, opløses over pH 6. Når EC-NAPROSYN blev givet til fastende personer, blev maksimale plasmaniveauer opnået omkring 4 til 6 timer efter den første dosis (interval: 2 til 12 timer). En in vivo undersøgelse hos mennesker med radiomærkede EC-NAPROSYN 250 mg tabletter viste, at EC-NAPROSYN primært opløses i tyndtarmen frem for i maven, så absorptionen af lægemidlet forsinkes, indtil maven er tømt.
Når EC-NAPROSYN og NAPROSYN 500 mg tabletter blev givet til fastende forsøgspersoner (n=24) i et crossover-studie efter 1 uges dosering, blev der observeret forskelle i tid til maksimale plasmaniveauer (Tmax), men der var ingen forskelle i total absorption som f.eks. målt ved Cmax og AUC:
Antacida virkninger
Når EC-NAPROSYN 250 mg blev givet som en enkelt dosis med antacida (54 mEq bufferkapacitet), var de maksimale plasmaniveauer af naproxen uændrede, men tiden til peak blev reduceret (gennemsnitlig Tmax fastet 5,6 timer, middel Tmax med antacida 5 timer) , skønt ikke væsentligt [se DRUGSINTERAKTIONER ].
Mad effekter
Når EC-NAPROSYN 500 mg blev givet som en enkelt dosis sammen med mad, blev maksimale plasmaniveauer hos de fleste forsøgspersoner opnået på ca. 12 timer (interval: 4 til 24 timer). Opholdstid i tyndtarmen indtil disintegration var uafhængig af fødeindtagelse. Tilstedeværelsen af mad forlængede den tid, tabletterne forblev i maven, tid til første påviselige serumnaproxenniveauer og tid til maksimale naproxenniveauer (Tmax), men påvirkede ikke maksimale naproxenniveauer (Cmax).
Fordeling
Naproxen har et distributionsvolumen på 0,16 l/kg. Ved terapeutiske niveauer er naproxen mere end 99 % albuminbundet. Ved doser af naproxen større end 500 mg/dag er der mindre end proportional stigning i plasmaniveauer på grund af en stigning i clearance forårsaget af mætning af plasmaproteinbinding ved højere doser (gennemsnitlig dal Css 36,5, 49,2 og 56,4 mg/L med 500, 1000 og 1500 mg daglige doser af henholdsvis naproxen). Naproxen-anionen er fundet i mælken hos ammende kvinder i en koncentration svarende til ca. 1 % af den maksimale naproxenkoncentration i plasma [se Brug i specifikke populationer ].
Elimination
Metabolisme
Naproxen metaboliseres i udstrakt grad i leveren til 6-0-desmethylnaproxen, og både forælder og metabolitter inducerer ikke metaboliserende enzymer. Både naproxen og 6-0-desmethylnaproxen metaboliseres yderligere til deres respektive acylglucuronid-konjugerede metabolitter.
Udskillelse
Clearance af naproxen er 0,13 ml/min/kg. Ca. 95 % af naproxen fra enhver dosis udskilles i urinen, primært som naproxen ( ADVARSLER OG FORHOLDSREGLER ].
Specifikke populationer
Pædiatrisk
Hos pædiatriske patienter i alderen 5 til 16 år med arthritis, plasmaniveauer af naproxen efter en enkeltdosis af naproxensuspension på 5 mg/kg [se DOSERING OG ADMINISTRATION viste sig at svare til dem, der blev fundet hos normale voksne efter en dosis på 500 mg. Den terminale halveringstid synes at være ens hos pædiatriske og voksne patienter. Farmakokinetiske undersøgelser af naproxen blev ikke udført hos pædiatriske patienter under 5 år. Farmakokinetiske parametre synes at være ens efter administration af naproxen suspension eller tabletter til pædiatriske patienter.
Geriatrisk
Undersøgelser viser, at selvom den totale plasmakoncentration af naproxen er uændret, er den ubundne plasmafraktion af naproxen øget hos ældre, selvom den ubundne fraktion er
Nedsat leverfunktion
Naproxens farmakokinetik er ikke blevet bestemt hos personer med leverinsufficiens.
Kronisk alkoholisk leversygdom og sandsynligvis andre sygdomme med nedsatte eller unormale plasmaproteiner (albumin) reducerer den totale plasmakoncentration af naproxen, men plasmakoncentrationen af ubundet naproxen øges.
Nedsat nyrefunktion
Naproxens farmakokinetik er ikke blevet bestemt hos personer med nyreinsufficiens. Da naproxen, dets metabolitter og konjugater primært udskilles af nyrerne, er der mulighed for, at naproxen-metabolitter kan akkumulere ved nyreinsufficiens. Elimination af naproxen er nedsat hos patienter med svært nedsat nyrefunktion.
Lægemiddelinteraktionsstudier
Aspirin
Når NSAID'er blev administreret sammen med aspirin, blev proteinbindingen af NSAID'er reduceret, selvom clearance af frit NSAID ikke blev ændret. Den kliniske betydning af denne interaktion er ikke kendt. Se tabel 1 for klinisk signifikante lægemiddelinteraktioner af NSAID'er med aspirin [se DRUGSINTERAKTIONER ].
Kliniske Studier
Naproxen er blevet undersøgt hos patienter med rheumatoid arthritis, slidgigt, polyartikulær juvenil idiopatisk arthritis, ankyloserende spondylitis, senebetændelse og bursitis og akut gigt. Forbedring hos patienter behandlet for leddegigt blev påvist ved en reduktion i ledhævelse, en reduktion i varigheden af morgenstivhed, en reduktion i sygdomsaktivitet som vurderet af både investigator og patient, og ved øget mobilitet som påvist ved en reduktion i gangtid . Generelt har respons på naproxen ikke vist sig at være afhængig af alder, køn, sværhedsgrad eller varighed af reumatoid arthritis.
Hos patienter med slidgigt er den terapeutiske virkning af naproxen vist ved en reduktion i ledsmerter eller ømhed, en stigning i bevægeligheden i knæleddene, øget mobilitet som vist ved en reduktion i gangtid og forbedring af kapaciteten til at udføre aktiviteter dagligdagen svækket af sygdommen.
et klinisk forsøg, der sammenlignede standardformuleringer af naproxen 375 mg to gange dagligt (750 mg dagligt) mod 750 mg to gange dagligt (1500 mg/dag), afsluttede 9 patienter i 750 mg-gruppen for tidligt på grund af bivirkninger. Nitten patienter i 1500 mg-gruppen afsluttede for tidligt på grund af bivirkninger. De fleste af disse bivirkninger var gastrointestinale hændelser.
I kliniske undersøgelser af patienter med reumatoid arthritis, slidgigt og polyartikulær juvenil idiopatisk arthritis har naproxen vist sig at være sammenlignelig med aspirin og indomethacin til at kontrollere de førnævnte mål for sygdomsaktivitet, men hyppigheden og sværhedsgraden af de mildere gastrointestinale bivirkninger (nause uønskede virkninger) , dyspepsi, halsbrand) og bivirkninger på nervesystemet (tinnitus, svimmelhed, svimmelhed) var mindre hos naproxen-behandlede patienter end hos dem, der blev behandlet med aspirin eller indomethacin.
Hos patienter med ankyloserende spondylitis har naproxen vist sig at mindske nattesmerter, morgenstivhed og hvilesmerter. I dobbeltblindede undersøgelser har stoffet vist sig at være lige så effektivt som aspirin, men med færre bivirkninger.
Hos patienter med akut gigt blev et gunstigt respons på naproxen vist ved signifikant udrensning af inflammatoriske forandringer (f.eks. fald i hævelse, varme) inden for 24 til 48 timer, samt ved lindring af smerte og ømhed.
Naproxen er blevet undersøgt hos patienter med lette til moderate smerter sekundært til postoperativ, ortopædisk, postpartum episiotomi og uteruskontraktionssmerter og dysmenoré. Smertelindring kan begynde inden for 1 time hos patienter, der tager naproxen og inden for 30 minutter hos patienter, der tager naproxennatrium. Analgetisk effekt blev vist ved sådanne mål som reduktion af smerteintensitetsscorer, stigning i smertelindringsscore, fald i antallet af patienter, der havde behov for yderligere smertestillende medicin, og forsinkelse i tid til remedicinering. Den smertestillende effekt har vist sig at vare i op til 12 timer.
Naproxen kan anvendes sikkert i kombination med guldsalte og/eller kortikosteroider; i kontrollerede kliniske forsøg syntes det dog ikke at forårsage større forbedring, når det blev tilføjet til regimet for patienter, der fik kortikosteroider, i forhold til det, der ses med kortikosteroider alene. Hvorvidt naproxen har en "steroidbesparende" effekt er ikke tilstrækkeligt undersøgt. Når naproxen blev tilføjet til kuren for patienter, der fik guldsalte, resulterede naproxen i en større forbedring. Dets anvendelse i kombination med salicylater anbefales ikke, fordi der er bevis for, at aspirin øger udskillelseshastigheden af naproxen, og data er utilstrækkelige til at påvise, at naproxen og aspirin giver større forbedring i forhold til, hvad der opnås med aspirin alene. Derudover kan kombinationen, som med andre NSAID'er, resultere i en højere frekvens af bivirkninger end påvist for begge produkter alene.
51Cr-blodtabs- og gastroskopiundersøgelser med normale frivillige er det påvist, at daglig administration af 1000 mg naproxen som 1000 mg NAPROSYN (naproxen) eller 1100 mg ANAPROX DS (naproxennatrium) forårsager statistisk signifikant mindre gastrisk blødning end 3250. mg aspirin.
Tre 6-ugers, dobbeltblindede, multicenterundersøgelser med EC-NAPROSYN (naproxen) (375 eller 500 mg to gange dagligt, n=385) og NAPROSYN (375 eller 500 mg to gange dagligt, n=279) blev udført til sammenligning af EC -NAPROSYN med NAPROSYN, inklusive 355 reumatoid arthritis- og slidgigtpatienter, som havde en nylig historie med NSAID-relaterede GI-symptomer. Disse undersøgelser indikerede, at EC-NAPROSYN og NAPROSYN 500 mg ikke viste nogen signifikante forskelle i effektivitet eller sikkerhed og havde en lignende forekomst af mindre gastrointestinale lidelser. Individuelle patienter kan dog finde en formulering at foretrække frem for den anden.
Fem hundrede og treoghalvtreds patienter fik EC-NAPROSYN under langsigtede åbne forsøg (gennemsnitlig behandlingslængde var 159 dage). Hyppigheden for klinisk diagnosticerede mavesår og gastrointestinale blødninger svarede til, hvad der historisk er blevet rapporteret for langvarig NSAID-brug.
PATIENTOPLYSNINGER
Medicinvejledning til ikke-steroide antiinflammatoriske lægemidler (NSAID'er)
Hvad er den vigtigste information, jeg bør vide om medicin kaldet ikke-steroide antiinflammatoriske lægemidler (NSAID'er)?
NSAID'er kan forårsage alvorlige bivirkninger, herunder:
- Øget risiko for et hjerteanfald eller slagtilfælde, der kan føre til døden. Denne risiko kan forekomme tidligt i behandlingen og kan stige:
- med stigende doser af NSAID'er
- ved længere brug af NSAID
Tag ikke NSAID'er lige før eller efter en hjerteoperation kaldet "koronararterie bypassgraft (CABG)."
Undgå at tage NSAID'er efter et nyligt hjerteanfald, medmindre din læge fortæller dig det. Du kan have en øget risiko for endnu et hjerteanfald, hvis du tager NSAID'er efter et nyligt hjerteanfald.
- Øget risiko for blødning, sår og rifter (perforering) af spiserøret (rør der fører fra munden til maven), mave og tarme:
- når som helst under brug
- uden advarselssymptomer
- der kan forårsage død
Risikoen for at få et sår eller blødning øges med:
- tidligere historie med mavesår, eller mave- eller tarmblødninger ved brug af NSAID'er
- tager medicin kaldet "kortikosteroider", "antikoagulantia", "SSRI" eller "SNRI"
- stigende doser af NSAID'er
- længere brug af NSAID
- rygning
- drikke alkohol
- ældre alder
- dårligt helbred
- fremskreden leversygdom
- blødningsproblemer
NSAID bør kun anvendes:
- præcis som foreskrevet
- ved den lavest mulige dosis til din behandling
- for den kortest nødvendige tid
Hvad er NSAID'er?
NSAID'er bruges til at behandle smerter og rødme, hævelse og varme (betændelse) fra medicinske tilstande såsom forskellige typer gigt, menstruationssmerter og andre typer kortvarige smerter.
Hvem bør ikke tage NSAID'er?
Tag ikke NSAID'er:
- hvis du har haft et astmaanfald, nældefeber eller anden allergisk reaktion med aspirin eller andre NSAID'er.
- lige før eller efter en bypassoperation.
Inden du tager NSAID, skal du fortælle din læge om alle dine medicinske tilstande, herunder hvis du:
- har lever- eller nyreproblemer
- har forhøjet blodtryk
- har astma
- er gravid eller planlægger at blive gravid. Hvis du tager NSAID'er omkring 20 uger af graviditeten eller senere, kan det skade dit ufødte barn. Hvis du har brug for at tage NSAID'er i mere end 2 dage, når du er mellem 20 og 30 uger af graviditeten, skal din læge muligvis overvåge mængden af væske i din livmoder omkring din baby. Du bør ikke tage NSAID'er efter omkring 30 ugers graviditet.
- ammer eller planlægger at amme.
Fortæl din sundhedsudbyder om al den medicin, du tager, inklusive receptpligtig eller håndkøbsmedicin, vitaminer eller naturlægemidler. NSAID'er og nogle andre lægemidler kan interagere med hinanden og forårsage alvorlige bivirkninger. Begynd ikke at tage ny medicin uden først at tale med din læge.
Hvad er de mulige bivirkninger af NSAID'er?
NSAID'er kan forårsage alvorlige bivirkninger, herunder:
Se "Hvad er den vigtigste information, jeg bør vide om medicin kaldet ikke-steroide antiinflammatoriske lægemidler (NSAID'er)?"
- nyt eller værre forhøjet blodtryk
- hjertefejl
- leverproblemer inklusive leversvigt
- nyreproblemer, herunder nyresvigt
- lavt antal røde blodlegemer (anæmi)
- livstruende hudreaktioner
- livstruende allergiske reaktioner
Andre bivirkninger af NSAID omfatter: mavesmerter, forstoppelse, diarré, gas, halsbrand, kvalme, opkastning og svimmelhed. Få akut hjælp med det samme, hvis du får nogle af følgende symptomer:
- åndenød eller åndedrætsbesvær
- brystsmerter
- svaghed i en del eller side af din krop
- utydelig tale
- hævelse af ansigt eller hals
Stop med at tage dit NSAID og ring til din læge med det samme, hvis du får nogle af følgende symptomer:
- kvalme
- mere træt eller svagere end normalt
- diarré
- kløe
- din hud eller øjne ser gule ud
- fordøjelsesbesvær eller mavesmerter
- influenzalignende symptomer
- opkast blod
- der er blod i din afføring, eller den er sort og klistret som tjære
- usædvanlig vægtøgning
- hududslæt eller blærer med feber
- hævelse af arme, ben, hænder og fødder
Hvis du tager for meget af dit NSAID, skal du kontakte din læge eller få lægehjælp med det samme.
Disse er ikke alle de mulige bivirkninger af NSAID'er. For mere information, spørg din læge eller apotek om NSAID'er.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Andre oplysninger om NSAID'er
- Aspirin er et NSAID, men det øger ikke chancen for et hjerteanfald. Aspirin kan forårsage blødninger i hjernen, maven og tarmene. Aspirin kan også forårsage sår i maven og tarmene.
- Nogle NSAID'er sælges i lavere doser uden recept (håndkøb). Tal med din læge, før du bruger NSAID'er i mere end 10 dage.
Generel information om sikker og effektiv brug af NSAID'er
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en medicinvejledning. Brug ikke NSAID til en tilstand, som det ikke er ordineret til. Giv ikke NSAID til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Hvis du ønsker mere information om NSAID'er, så tal med din læge. Du kan bede din apoteker eller sundhedsplejerske om oplysninger om NSAID'er, der er skrevet til sundhedspersonale.
Denne medicinvejledning er godkendt af US Food and Drug Administration.
