Antibakteriel medicin: Bactrim 400/80mg, 800/160mg Trimethoprim Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Mærkenavn: Bactrim
Generisk navn: Sulfamethoxazol og trimethoprim injektion til intravenøs infusion
Hvad er Bactrim 800mg?
Bactrim (sulfamethoxazol og trimethoprim) DS er en kombination af to antibiotika, der bruges til at behandle urinvejsinfektioner, akut mellemørebetændelse, bronkitis, Shigellose, Pneumocystis lungebetændelse, rejsendes diarré, methicillin-resistent Staphylococcus aureus og andre bakterier (MRSA), infektioner modtagelige for dette antibiotikum.
Hvad er bivirkninger af Bactrim?
Almindelige bivirkninger af Bactrim omfatter:
- mistet appetiten,
- kvalme,
- opkastning,
- smertefuld eller hævet tunge,
- svimmelhed,
- snurrende fornemmelse,
- ringen for dine ører,
- træthed, eller
- søvnproblemer (søvnløshed).
Fortæl det til din læge, hvis du oplever alvorlige bivirkninger af Bactrim 800mg, herunder:
- blå mærker eller blødninger,
- aplastisk anæmi,
- gulsot,
- levernekrose,
- sår i munden,
- ledsmerter,
- alvorlige hududslæt,
- kløe, og
- ondt i halsen.
BESKRIVELSE
BACTRIM™ (trimethoprim og sulfamethoxazol) injektion, en steril opløsning kun til intravenøs infusion, er en kombination af sulfamethoxazol, et sulfonamid antimikrobielt middel, og trimethoprim, en dihydrofolatreduktaseinhibitor antibakteriel. Hver 5 ml indeholder 80 mg trimethoprim (16 mg/ml) og 400 mg sulfamethoxazol (80 mg/ml) blandet med 40 % propylenglycol, 10 % ethylalkohol og 0,3 % diethanolamin; 1 % benzylalkohol og 0,1 % natriummetabisulfit tilsat som konserveringsmidler, vand til injektion og pH justeret til ca. 10 med natriumhydroxid.
Trimethoprim er 2,4-diamino-5-(3,4,5-trimethoxybenzyl)pyrimidin. Det er en hvid til lysegul, lugtfri, bitter forbindelse med en molekylvægt på 290,3 og følgende strukturformel:
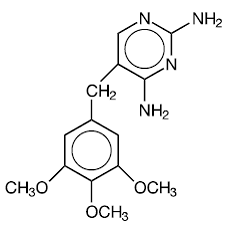
C14H18N4O3 MW 290,3
Sulfamethoxazol er N1-(5-methyl-3-isoxazolyl)sulfanilamid. Det er en næsten hvid, lugtfri, smagløs forbindelse med en molekylvægt på 253,28 og følgende strukturformel:
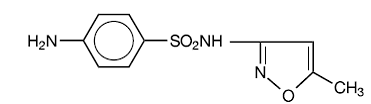
C10H11N3O3S MW 253,28
INDIKATIONER
Pneumocystis jirovecii Lungebetændelse
BACTRIM er indiceret til behandling af Pneumocystis jirovecii lungebetændelse hos voksne og pædiatriske patienter to måneder og ældre.
Shigellose
BACTRIM 400mg er indiceret til behandling af enteritis forårsaget af modtagelige stammer af Shigella flexneri og Shigella sonnei hos voksne og pædiatriske patienter i alderen to måneder og ældre.
Urinvejsinfektioner
BACTRIM er indiceret til behandling af alvorlige eller komplicerede urinvejsinfektioner hos voksne og pædiatriske patienter i alderen to måneder og ældre på grund af modtagelige stammer af Escherichia coli, Klebsiella-arter, Enterobacter-arter, Morganella morganii, Proteus mirabilis og Proteus vulgaris ved oral administration af BACTRIM er ikke gennemførligt, og når organismen ikke er modtagelig over for antibakterielle midler med et enkelt middel, der er effektive i urinvejene.
Brug
For at reducere udviklingen af lægemiddelresistente bakterier og bevare effektiviteten af BACTRIM og andre antibakterielle lægemidler, bør BACTRIM kun bruges til at behandle eller forebygge infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når kultur- og modtagelighedsoplysninger er tilgængelige, bør de overvejes ved udvælgelse eller ændring af antibakteriel behandling. I mangel af sådanne data kan lokal epidemiologi og modtagelighedsmønstre bidrage til empirisk udvælgelse af terapi.
Selvom passende dyrknings- og modtagelighedsundersøgelser bør udføres, kan behandlingen påbegyndes, mens man afventer resultaterne af disse undersøgelser.
DOSERING OG ADMINISTRATION
Dosering til voksne og pædiatriske patienter (to måneder og ældre)
Den maksimale anbefalede daglige dosis er 60 ml (960 mg trimethoprim) om dagen.
Dosisændringer hos patienter med nedsat nyrefunktion
Når nyrefunktionen er nedsat, bør der anvendes en reduceret dosis, som vist i tabel 2.
Vigtige administrationsinstruktioner
Administrer opløsningen ved intravenøs infusion over en periode på 60 til 90 minutter. Undgå administration ved hurtig infusion eller bolusinjektion. Administrer IKKE BACTRIM 400mg intramuskulært.
Inspicer parenterale lægemidler visuelt for partikler og misfarvning før administration, når opløsningen og beholderen tillader det.
Fremgangsmåde
Fortynding af enkelt-og flerdosis-hætteglas
BACTRIM skal fortyndes. Hver 5 mL skal tilsættes 125 mL 5 % dextrose i vand. Efter fortynding med 5 % dextrose i vand, bør opløsningen ikke opbevares i køleskab og skal bruges inden for 6 timer.
Ønskes en fortynding på 5 ml pr. 100 ml 5 % dextrose i vand, skal den bruges inden for 4 timer. I de tilfælde, hvor væskerestriktion er ønskelig, kan hver 5 ml tilsættes til 75 ml 5% dextrose i vand. Under disse omstændigheder skal opløsningen blandes lige før brug og bør administreres inden for 2 timer.
Hvis der ved visuel inspektion er uklarhed eller tegn på krystallisation efter blanding, skal opløsningen kasseres og en frisk opløsning tilberedes.
Gør IKKE bland Bactrim i 5 % dextrose i vand med lægemidler eller opløsninger i samme beholder.
Flerdosishætteglas (håndtering)
Efter første indføring i hætteglasset skal det resterende indhold bruges inden for 48 timer.
Infusionssystemer til intravenøs administration
Følgende infusionssystemer er blevet testet og fundet tilfredsstillende: enhedsdosis glasbeholdere; enhedsdosisbeholdere af polyvinylchlorid og polyolefin. Ingen andre systemer er blevet testet, og derfor kan ingen andre anbefales.
HVORDAN LEVERET
Doseringsformer og styrker
BACTRIM er tilgængelig som en injektion indeholdende 80 mg/ml sulfamethoxazol og 16 mg/ml trimethoprim i 10 ml enkeltdosis- og 30 ml flerdosishætteglas.
Opbevaring og håndtering
BACTRIM™ (sulfamethoxazol og trimethoprim) injektion leveres som følger:
10 ml hætteglas indeholdende 160 mg trimethoprim (16 mg/ml) og 800 mg sulfamethoxazol (80 mg/ml) til infusion med 5 % dextrose i vand.
10 ml hætteglas: NDC 49708-001-4210 mL hætteglas (æske med 10): NDC 49708-001-45
30 ml hætteglas med flere doser , hver 5 ml indeholdende 80 mg trimethoprim (16 mg/ml) og 400 mg sulfamethoxazol (80 mg/ml) til infusion med 5 % dextrose i vand.
30 ml hætteglas (æske med 1): NDC 49708-002-47
Opbevares ved stuetemperatur (15°C – 30°C eller 59°F – 86°F). MÅ IKKE KØLE.
REFERENCER
1. Winston DJ, Lau WK, Gale RP, Young LS. Trimethoprim-Sulfamethoxazol til behandling af Pneumocystis carinii lungebetændelse. Ann Praktikant Med. juni 1980;92:762-769.
Distribueret af: Sun Pharmaceutical Industries, Inc. Cranbury, NJ 08512. Revideret: juli 2020
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet andetsteds i mærkningen:
- Embryo-føtal toksicitet [se ADVARSLER OG FORHOLDSREGLER ]
- Overfølsomhed og andre dødelige reaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Trombocytopeni [se ADVARSLER OG FORHOLDSREGLER ]
- Clostridioides difficile-associeret diarré [se ADVARSLER OG FORHOLDSREGLER ]
- Sulfitfølsomhed [se ADVARSLER OG FORHOLDSREGLER ]
- Risiko forbundet med samtidig brug af Leucovorin til Pneumocystis jirovecii lungebetændelse [se ADVARSLER OG FORHOLDSREGLER ]
- Propylenglycol toksicitet [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ]
- Infusionsreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Hypoglykæmi [se ADVARSLER OG FORHOLDSREGLER ]
- Elektrolytabnormiteter [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
De mest almindelige bivirkninger er gastrointestinale forstyrrelser (kvalme, opkastning og anoreksi) og allergiske hudreaktioner (såsom udslæt og nældefeber).
Lokal reaktion, smerte og let irritation ved intravenøs (IV) administration er sjældne. Tromboflebitis er blevet observeret.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af BACTRIM efter godkendelse. Fordi disse reaktioner blev rapporteret frivilligt fra en population af usikker størrelse, er det ikke muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering:
- Trombotisk trombocytopeni purpura
- Idiopatisk trombocytopenisk purpura
- QT-forlængelse resulterer i ventrikulær takykardi og torsade de pointes
- Metabolisk acidose
DRUGSINTERAKTIONER
Potentiale for BACTRIM 400mg til at påvirke andre lægemidler
Trimethoprim er en hæmmer af CYP2C8 såvel som OCT2 transporter. Sulfamethoxazol er en hæmmer af CYP2C9. Undgå samtidig administration af BACTRIM 80 mg med lægemidler, der er substrater for CYP2C8 og 2C9 eller OCT2.
Interaktioner med laboratorie- eller diagnostiske tests
BACTRIM, specifikt trimethoprim-komponenten, kan interferere med et serummethotrexat-assay som bestemt ved den kompetitive bindingsproteinteknik (CBPA), når en bakteriel dihydrofolatreduktase bruges som bindingsprotein. Der opstår dog ingen interferens, hvis methotrexat måles ved en radioimmunoassay (RIA).
Tilstedeværelsen af BACTRIM kan også interferere med Jaffes alkaliske piratreaktionsanalyse for kreatinin, hvilket resulterer i overvurderinger på ca. 10 % i området af normale værdier.
REFERENCER
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Hvad klinikere bør vide om QT-intervallet. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Anmeldelse: Dofetilids farmakologi og toksikologi. Int J Med Toxicol. 2001;4(2):16.
5. London NJ, Garg SJ, Moorthy RS, Cunningham ET. Lægemiddelinduceret uveitis. J Ophthalmic Inflamm Infect. 2013;3:43.
6. Marinella MA. Trimethoprim-induceret hyperkaliæmi: En analyse af rapporterede tilfælde. Gerontol. 1999;45:209-212.
7. Margassery S, Bastani B. Livstruende hyperkaliæmi og acidose sekundært til behandling med trimethoprimsulfamethoxazol. J. Nephrol. 2001;14(5):410-414.
8. Moh R, et al. Hæmatologiske ændringer hos voksne, der får et zidovudinholdigt HAART-regime i kombination med cotrimoxazol i Elfenbenskysten. Antivir Ther. 2005;10(5):615-24.
9. Kosoglou T, Rocci ML Jr., Vlasses PH. Trimethoprim ændrer dispositionen af procainamid og Nacetylprocainamid. Clin Pharmacol Ther. okt. 1988;44(4):467-77.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Embryo-føtal toksicitet
Nogle epidemiologiske undersøgelser tyder på, at eksponering for BACTRIM under graviditet kan være forbundet med en øget risiko for medfødte misdannelser, især neuralrørsdefekter, kardiovaskulære misdannelser, urinvejsdefekter, mundspalter og klumpfod. Hvis BACTRIM 400 mg anvendes under graviditet, eller hvis patienten bliver gravid, mens du tager dette lægemiddel, skal patienten informeres om de potentielle farer for fosteret [se Brug i specifikke populationer ].
Overfølsomhed og andre dødelige reaktioner
Dødsfald forbundet med administration af sulfonamider er forekommet på grund af alvorlige reaktioner, herunder Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, fulminant hepatisk nekrose, agranulocytose, aplastisk anæmi og andre bloddyskrasier.
Sulfonamider, herunder sulfonamidholdige produkter såsom BACTRIM, bør seponeres ved første forekomst af hududslæt eller ethvert tegn på bivirkning. Kliniske tegn, såsom udslæt, ondt i halsen, feber, artralgi, hoste, åndenød, bleghed, purpura eller gulsot kan være tidlige tegn på alvorlige reaktioner. Et hududslæt kan efterfølges af mere alvorlige reaktioner, såsom Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, levernekrose eller alvorlig blodsygdom. Fuldstændige blodtællinger bør foretages hyppigt hos patienter, der får sulfonamider. Hoste, åndenød og pulmonale infiltrater er overfølsomhedsreaktioner i luftvejene, der er blevet rapporteret i forbindelse med sulfonamidbehandling.
Trombocytopeni
BACTRIM-induceret trombocytopeni kan være en immunmedieret lidelse. Alvorlige tilfælde af trombocytopeni, som er dødelige eller livstruende, er blevet rapporteret. Overvåg patienter for hæmatologisk toksicitet. Trombocytopeni forsvinder normalt inden for en uge efter seponering af BACTRIM.
Streptokokinfektioner og gigtfeber
Undgå brug af BACTRIM til behandling af streptokok pharyngitis. Kliniske undersøgelser har dokumenteret, at patienter med gruppe A β-hæmolytisk streptokok tonsillopharyngitis har en større forekomst af bakteriologisk svigt, når de behandles med BACTRIM 800mg, end de patienter, der behandles med penicillin, hvilket fremgår af manglende udryddelse af denne organisme fra tonsillopharyngeal området. Derfor vil BACTRIM ikke forhindre følgesygdomme såsom gigtfeber.
Clostridioides Difficile-associeret diarré
Clostridioides difficile-associeret diarré (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, inklusive BACTRIM 80 mg, og kan variere i sværhedsgrad fra mild diarré til fatal colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.
C. difficile producerer toksinerne A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget morbiditet og dødelighed, da disse infektioner kan være modstandsdygtige over for antimikrobiel behandling og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, som får diarré efter antibakteriel brug. Omhyggelig sygehistorie er nødvendig, da CDAD er blevet rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde igangværende antibakteriel brug, der ikke er rettet mod C. difficile. Passende væske- og elektrolythåndtering, proteintilskud, antibakteriel behandling af
C. difficile, og kirurgisk evaluering bør iværksættes som klinisk indiceret.
Sulfit følsomhed
BACTRIM 400mg indeholder natriummetabisulfit, en sulfit, der kan forårsage allergiske reaktioner, herunder anafylaktiske symptomer og livstruende eller mindre alvorlige astmatiske episoder hos visse modtagelige personer. Den overordnede prævalens af sulfitfølsomhed i den generelle befolkning er ukendt. Sulfitfølsomhed ses hyppigere hos astmatikere end hos ikke-astmatiske.
Benzylalkoholtoksicitet hos pædiatriske patienter ("Gasping Syndrome")
BACTRIM 160mg indeholder benzylalkohol som konserveringsmiddel. Alvorlige og fatale bivirkninger inklusive "gispende syndrom" kan forekomme hos nyfødte og spædbørn med lav fødselsvægt behandlet med benzylalkoholkonserverede formuleringer i infusionsopløsninger, inklusive BACTRIM. Det "gispende syndrom" er karakteriseret ved depression af centralnervesystemet, metabolisk acidose og gispende vejrtrækninger. BACTRIM 160 mg er kontraindiceret til pædiatriske patienter under to måneder gamle [se KONTRAINDIKATIONER ].
Når du ordinerer BACTRIM 400 mg til pædiatriske patienter (to måneder gamle og ældre), skal du overveje den kombinerede daglige metaboliske belastning af benzylalkohol fra alle kilder, inklusive BACTRIM (indeholder 10 mg benzylalkohol pr. ml) og andre lægemidler, der indeholder benzylalkohol. Den mindste mængde benzylalkohol, ved hvilken der kan opstå alvorlige bivirkninger, kendes ikke [se Brug i specifikke populationer ].
Risiko forbundet med samtidig brug af Leucovorin til Pneumocystis jirovecii lungebetændelse
Behandlingssvigt og overdødelighed blev observeret, når BACTRIM blev brugt samtidig med leucovorin til behandling af HIV-positive patienter med Pneumocystis jirovecii pneumoni i et randomiseret placebokontrolleret forsøg.4 Undgå samtidig administration af BACTRIM og leucovorin under behandling af Pneumocystis pneumrovecii.
Propylenglycol toksicitet
BACTRIM indeholder propylenglycol som opløsningsmiddel (40 % v/v). Når det administreres i høje doser som til behandling af P. jirovecii pneumoni og samtidig med andre produkter, der indeholder propylenglycol, kan der forekomme hyperosmolaritet med aniongab metabolisk acidose, herunder laktatacidose. Propylenglycol-toksicitet kan føre til akut nyreskade, CNS-toksicitet og multiorgansvigt. Overvåg for det samlede daglige indtag af propylenglycol fra alle kilder og for syre-base-forstyrrelser. Afbryd BACTRIM 400 mg, hvis der er mistanke om propylenglykoltoksicitet [se BIVIRKNINGER ].
Folatmangel
Undgå brug af BACTRIM 160mg til patienter med nedsat nyre- eller leverfunktion, hos patienter med mulig folatmangel (f.eks. ældre, kroniske alkoholikere, patienter i antikonvulsiv behandling, patienter med malabsorptionssyndrom og patienter i underernæringstilstande) og hos dem med alvorlige allergi eller bronkial astma.
Hæmatologiske ændringer, der indikerer folinsyremangel, kan forekomme hos ældre patienter eller hos patienter med allerede eksisterende folinsyremangel eller nyresvigt. Disse virkninger er reversible ved folinsyrebehandling [se Brug i specifikke populationer ].
Hæmolyse
Hos personer med mangel på glucose-6-phosphatdehydrogenase kan hæmolyse forekomme. Denne reaktion er ofte dosisrelateret.
Infusionsreaktioner
Lokal irritation og inflammation på grund af ekstravaskulær infiltration af infusionen er blevet observeret med BACTRIM. Hvis disse forekommer, skal infusionen afbrydes og genoptages på et andet sted.
Hypoglykæmi
Der er set tilfælde af hypoglykæmi hos ikke-diabetespatienter behandlet med BACTRIM 400 mg, som normalt optræder efter et par dages behandling. Patienter med nyreinsufficiens, leversygdomme, fejlernæring eller dem, der får høje doser af BACTRIM 800 mg, er særligt udsatte.
Nedsat phenylalanin metabolisme
Trimethoprim, en komponent i BACTRIM, er blevet bemærket at hæmme phenylalanin-metabolismen, men dette er uden betydning hos phenylketonuriske patienter med passende diætrestriktioner.
Porfyri og hypothyroidisme
Ligesom andre lægemidler, der indeholder sulfonamider, kan BACTRIM fremkalde porfyri-krise og hypothyroidisme. Undgå brug af BACTRIM til patienter med porfyri eller skjoldbruskkirteldysfunktion.
Potentiel risiko ved behandling af Pneumocystis jirovecii lungebetændelse hos patienter med erhvervet immundefektsyndrom (AIDS)
AIDS-patienter tolererer eller reagerer muligvis ikke på BACTRIM på samme måde som ikke-AIDS-patienter. Forekomsten af bivirkninger, især udslæt, feber, leukopeni og forhøjede aminotransferase (transaminase)-værdier, med BACTRIM-behandling hos AIDS-patienter, der behandles for Pneumocystis jirovecii-lungebetændelse, er blevet rapporteret at være meget øget sammenlignet med forekomsten, der normalt er forbundet med brug af BACTRIM 800 mg til ikke-aids-patienter. Hvis en patient udvikler hududslæt eller tegn på en bivirkning, skal behandlingen med BACTRIM revurderes [se ADVARSLER OG FORHOLDSREGLER ].
Undgå samtidig administration af BACTRIM 80 mg og leucovorin under behandling af Pneumocystis jirovecii pneumoni [se ADVARSLER OG FORHOLDSREGLER ].
Elektrolytabnormiteter
Høje doser af trimethoprim, som anvendt til patienter med P. jirovecii pneumoni, inducerer en progressiv, men reversibel stigning i serumkaliumkoncentrationer hos et betydeligt antal patienter. Selv behandling med anbefalede doser kan forårsage hyperkaliæmi, når trimethoprim administreres til patienter med underliggende forstyrrelser i kaliummetabolismen, med nyreinsufficiens, eller hvis lægemidler, der vides at inducere hyperkaliæmi, gives samtidig. Tæt monitorering af serumkalium er berettiget hos disse patienter.
Alvorlig og symptomatisk hyponatriæmi kan forekomme hos patienter, der får BACTRIM 800 mg, især til behandling af P. jirovecii pneumoni. Evaluering for hyponatriæmi og passende korrektion er nødvendig hos symptomatiske patienter for at forhindre livstruende komplikationer.
Under behandlingen skal du sørge for tilstrækkelig væskeindtagelse og urinafgang for at forhindre krystalluri. Patienter, der er "langsomme acetylatorer" kan være mere tilbøjelige til at få idiosynkratiske reaktioner på sulfonamider.
Overvågning af laboratorieundersøgelser
Fuldstændige blodtællinger bør foretages hyppigt hos patienter, der får BACTRIM. Afbryd BACTRIM 800 mg, hvis der bemærkes en signifikant reduktion i antallet af dannede blodelementer. Udfør urinanalyse med omhyggelig mikroskopisk undersøgelse og nyrefunktionstest under behandlingen, især for patienter med nedsat nyrefunktion.
Udvikling af lægemiddelresistente bakterier
Udskrivning af BACTRIM i fravær af en påvist eller stærkt mistænkt bakteriel infektion eller en profylaktisk indikation er usandsynligt, at gavn for patienten og øger risikoen for udvikling af lægemiddelresistente bakterier.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Sulfamethoxazol var ikke kræftfremkaldende, når det blev vurderet i et 26-ugers tumorigent mus (Tg-rasH2) studie ved doser op til 400 mg/kg/dag sulfamethoxazol; svarende til 2 gange den humane systemiske eksponering (ved en daglig dosis på 800 mg sulfamethoxazol to gange dagligt).
Mutagenese
In vitro revers mutation bakterielle tests i henhold til standardprotokollen er ikke blevet udført med sulfamethoxazol og trimethoprim i kombination. En in vitro kromosomafvigelsestest i humane lymfocytter med sulfamethoxazol/trimethoprim var negativ. I in vitro og in vivo forsøg på dyrearter beskadigede sulfamethoxazol/trimethoprim ikke kromosomerne. In vivo mikronukleusassays var positive efter oral administration af sulfamethoxazol/trimethoprim. Observationer af leukocytter opnået fra patienter behandlet med sulfamethoxazol og trimethoprim viste ingen kromosomale abnormiteter.
Sulfamethoxazol alene var positivt i en in vitro revers mutation bakteriel assay og i in vitro mikronucleus assays med dyrkede humane lymfocytter.
Trimethoprim alene var negativ i in vitro revers mutation bakterielle assays og i in vitro kromosomafvigelsesassays med kinesisk hamster ovarie- eller lungeceller med eller uden S9-aktivering. In vitro Comet-, mikronukleus- og kromosomskadeassays ved brug af dyrkede humane lymfocytter var trimethoprim positiv. Hos mus efter oral administration af trimethoprim blev der ikke registreret DNA-skade i Comet-analyser af lever, nyre, lunge, milt eller knoglemarv.
Forringelse af fertilitet
Ingen bivirkninger på fertilitet eller generel reproduktionsevne blev observeret hos rotter, der fik orale doser så høje som 350 mg/kg/dag sulfamethoxazol plus 70 mg/kg/dag trimethoprim, doser omtrent to gange den anbefalede humane daglige dosis på basis af kropsoverfladeareal. .
Brug i specifikke populationer
Graviditet
Risikooversigt
BACTRIM kan forårsage fosterskader, hvis det administreres til en gravid kvinde. Nogle epidemiologiske undersøgelser tyder på, at eksponering for BACTRIM 400 mg under graviditet kan være forbundet med en øget risiko for medfødte misdannelser, især neuralrørsdefekter, kardiovaskulære abnormiteter, urinvejsdefekter, mundspalter og køllefod (se Menneskelige data ).
Et af 3 rottestudier viste ganespalte ved doser på ca. 5 gange den anbefalede humane dosis på basis af kropsoverfladeareal; de andre 2 undersøgelser viste ikke teratogenicitet ved lignende doser. Undersøgelser med gravide kaniner viste øget fostertab ved ca. 6 gange den humane dosis på basis af kropsoverfladen (se Dyredata ).
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og aborter for den angivne population er ukendt. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %. Rådgiv gravide kvinder om den potentielle skade af BACTRIM 400 mg på fosteret (se Kliniske overvejelser ).
Kliniske overvejelser
Sygdomsassocieret moder- og/eller embryo-/fosterrisiko
Urinvejsinfektion under graviditet er forbundet med ugunstige perinatale udfald såsom for tidlig fødsel, lav fødselsvægt og præeklampsi og øget dødelighed hos den gravide kvinde. P. jirovecii pneumoni under graviditet er forbundet med for tidlig fødsel og øget sygelighed og dødelighed for den gravide kvinde. BACTRIM bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Data
Menneskelige data
Selvom der ikke er nogen store, prospektive, velkontrollerede undersøgelser af gravide kvinder og deres babyer, tyder nogle retrospektive epidemiologiske undersøgelser på en sammenhæng mellem første trimester eksponering for BACTRIM 80 mg med en øget risiko for medfødte misdannelser, især neuralrørsdefekter, kardiovaskulære abnormiteter, urinveje. tarmfejl, mundspalter og køllefod. Disse undersøgelser var imidlertid begrænset af det lille antal eksponerede tilfælde og manglen på justering for flere statistiske sammenligninger og konfoundere. Disse undersøgelser er yderligere begrænset af tilbagekaldelse, udvælgelse og informationsforstyrrelser og af begrænset generaliserbarhed af deres resultater. Endelig varierede resultatmål mellem undersøgelser, hvilket begrænsede sammenligninger på tværs af undersøgelser. Alternativt påviste andre epidemiologiske undersøgelser ikke statistisk signifikante sammenhænge mellem BACTRIM 160 mg eksponering og specifikke misdannelser. Brumfitt og Pursell10 rapporterede i en retrospektiv undersøgelse resultatet af 186 graviditeter, hvor moderen fik enten placebo eller oral trimethoprim og sulfamethoxazol. Hyppigheden af medfødte abnormiteter var 4,5 % (3 ud af 66) hos dem, der fik placebo, og 3,3 % (4 ud af 120) hos dem, der fik trimethoprim og sulfamethoxazol. Der var ingen abnormiteter hos de 10 børn, hvis mødre fik stoffet i første trimester. I en separat undersøgelse fandt Brumfitt og Pursell heller ingen medfødte abnormiteter hos 35 børn, hvis mødre havde fået oral trimethoprim og sulfamethoxazol på tidspunktet for undfangelsen eller kort efter.
Dyredata
Hos rotter frembragte orale doser af enten 533 mg/kg sulfamethoxazol eller 200 mg/kg trimethoprim teratologiske virkninger, der hovedsageligt manifesterede sig som ganespalte. Disse doser er ca. 5 og 6 gange den anbefalede humane samlede daglige dosis på basis af kropsoverfladen. I to studier med rotter blev der ikke observeret nogen teratologi, når 512 mg/kg sulfamethoxazol blev brugt i kombination med 128 mg/kg trimethoprim. I nogle kaninundersøgelser var en samlet stigning i fostertab (døde og resorberede begreber) forbundet med doser af trimethoprim 6 gange den humane terapeutiske dosis baseret på kropsoverfladeareal.
Amning
Risikooversigt
Niveauer af BACTRIM i modermælk er ca. 2 til 5 % af den anbefalede daglige dosis til pædiatriske patienter over to måneder. Der er ingen information om virkningen af BACTRIM på det ammede spædbarn eller virkningen på mælkeproduktionen. På grund af den potentielle risiko for bilirubinforskydning og kernicterus på det ammede barn [se KONTRAINDIKATIONER ], råder kvinder til at undgå amning under behandling med BACTRIM.
Pædiatrisk brug
BACTRIM er kontraindiceret til pædiatriske patienter yngre end to måneder på grund af den potentielle risiko for bilirubinforskydning og kernicterus [se KONTRAINDIKATIONER ].
Alvorlige bivirkninger inklusive fatale reaktioner og "gispende syndrom" forekom hos præmature nyfødte og spædbørn med lav fødselsvægt på neonatal intensivafdeling, som fik benzylalkohol som konserveringsmiddel i infusionsopløsninger. I disse tilfælde producerede benzylalkoholdoser på 99 til 234 mg/kg/dag høje niveauer af benzylalkohol og dets metabolitter i blodet og urinen (blodniveauerne af benzylalkohol var 0,61 til 1,378 mmol/L). Yderligere bivirkninger omfattede gradvis neurologisk forværring, kramper, intrakraniel blødning, hæmatologiske abnormiteter, hudnedbrydning, lever- og nyresvigt, hypotension, bradykardi og kardiovaskulær kollaps. For tidligt fødte spædbørn med lav fødselsvægt kan være mere tilbøjelige til at udvikle disse reaktioner, fordi de kan være mindre i stand til at metabolisere benzylalkohol.
Når du ordinerer BACTRIM 800 mg til pædiatriske patienter, skal du overveje den kombinerede daglige metaboliske belastning af benzylalkohol fra alle kilder, inklusive BACTRIM (BACTRIM 160 mg indeholder 10 mg benzylalkohol pr. ml) og andre lægemidler, der indeholder benzylalkohol. Den mindste mængde benzylalkohol, ved hvilken der kan opstå alvorlige bivirkninger, kendes ikke [se ADVARSLER OG FORHOLDSREGLER ].
Geriatrisk brug
Kliniske undersøgelser af BACTRIM omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner.
Der kan være en øget risiko for alvorlige bivirkninger hos ældre patienter, især når der eksisterer komplicerede tilstande, f.eks. nedsat nyre- og/eller leverfunktion eller samtidig brug af andre lægemidler. Alvorlige hudreaktioner, generaliseret knoglemarvssuppression [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ], et specifikt fald i blodplader (med eller uden purpura) og hyperkaliæmi er de hyppigst rapporterede alvorlige bivirkninger hos ældre patienter.
Hos dem, der samtidig får visse diuretika, primært thiazider, er en øget forekomst af trombocytopeni med purpura blevet rapporteret. Forhøjede digoxinniveauer i blodet kan forekomme ved samtidig behandling med BACTRIM 80 mg, især hos ældre patienter. Serumdigoxinniveauer bør overvåges [se DRUGSINTERAKTIONER ].
Hæmatologiske ændringer, der tyder på folinsyremangel, kan forekomme hos ældre patienter. Disse virkninger er reversible ved behandling med folinsyre. Der bør foretages passende dosisjusteringer for patienter med nedsat nyrefunktion, og brugsvarigheden bør være så kort som muligt for at minimere risikoen for uønskede reaktioner [se DOSERING OG ADMINISTRATION ].
Trimethoprim-komponenten i BACTRIM kan forårsage hyperkaliæmi, når den administreres til patienter med underliggende forstyrrelser i kaliummetabolismen, med nyreinsufficiens, eller når den gives samtidig med lægemidler, der vides at inducere hyperkaliæmi, såsom angiotensinkonverterende enzymhæmmere. Tæt monitorering af serumkalium er berettiget hos disse patienter. Seponering af BACTRIM 160 mg-behandling anbefales for at hjælpe med at sænke serumniveauet af kalium.
Farmakokinetiske parametre for sulfamethoxazol var ens for geriatriske forsøgspersoner og yngre voksne forsøgspersoner. Den gennemsnitlige maksimale serumtrimethoprimkoncentration var højere, og den gennemsnitlige renal clearance af trimethoprim var lavere hos geriatriske forsøgspersoner sammenlignet med yngre forsøgspersoner [se KLINISK FARMAKOLOGI ].
REFERENCER
4. Safrin S, Lee BL, Sande MA. Supplerende folinsyre med trimethoprim-sulfamethoxazol til Pneumocystis carinii pneumoni hos AIDS-patienter er forbundet med en øget risiko for terapeutisk svigt og død. J Infect Dis. okt 1994;170(4):912-7.
10. Brumfitt W, Pursell R. Trimethoprim/Sulfamethoxazole in the Treatment of Bacteriuria in Women. J Infect Dis. Nov 1973;128 (Suppl): S657-S663.
OVERDOSIS
Spids
Da der ikke har været omfattende erfaring hos mennesker med enkeltdoser af BACTRIM 160 mg på over 25 ml (400 mg trimethoprim og 2000 mg sulfamethoxazol), er den maksimalt tolererede dosis til mennesker ukendt.
Tegn og symptomer på overdosering rapporteret med sulfonamider omfatter anoreksi, kolik, kvalme, opkastning, svimmelhed, hovedpine, døsighed og bevidstløshed. Pyreksi, hæmaturi og krystalluri kan bemærkes. Bloddyskrasier og gulsot er potentielle sene manifestationer af overdosering.
Tegn på akut overdosering med trimethoprim omfatter kvalme, opkastning, svimmelhed, hovedpine, mental depression, forvirring og knoglemarvsdepression.
Generelle principper for behandling omfatter administration af intravenøse væsker, hvis urinproduktionen er lav, og nyrefunktionen er normal. Forsuring af urinen vil øge renal elimination af trimethoprim. Patienten skal overvåges med blodtal og passende blodkemi, inklusive elektrolytter. Hvis der opstår en betydelig bloddyskrasi eller gulsot, bør specifik behandling igangsættes for disse komplikationer. Peritonealdialyse er ikke effektiv, og hæmodialyse er kun moderat effektiv til at eliminere trimethoprim og sulfamethoxazol.
Kronisk
Brug af BACTRIM 800 mg i høje doser og/eller i længere perioder kan forårsage knoglemarvsdepression, manifesteret som trombocytopeni, leukopeni og/eller megaloblastisk anæmi. Hvis der opstår tegn på knoglemarvsdepression, skal patienten gives leucovorin 5 til 15 mg dagligt, indtil normal hæmatopoiese er genoprettet.
KONTRAINDIKATIONER
BACTRIM er kontraindiceret i følgende tilfælde:
- Kendt overfølsomhed over for trimethoprim eller sulfonamider [se ADVARSLER OG FORHOLDSREGLER ]
- Anamnese med lægemiddelinduceret immuntrombocytopeni ved brug af trimethoprim og/eller sulfonamider [se ADVARSLER OG FORHOLDSREGLER ]
- Patienter med dokumenteret megaloblastisk anæmi på grund af folatmangel [se ADVARSLER OG FORHOLDSREGLER ]
- Pædiatriske patienter under to måneder gamle [se Brug i specifikke populationer ]
- Udtalt leverskade [se ADVARSLER OG FORHOLDSREGLER ]
- Alvorlig nyreinsufficiens, når nyrefunktionsstatus ikke kan overvåges [se ADVARSLER OG FORHOLDSREGLER ]
- Samtidig administration med dofetilid2,3 [se DRUGSINTERAKTIONER ]
REFERENCER
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Hvad klinikere bør vide om QT-intervallet. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Anmeldelse: Dofetilids farmakologi og toksikologi. Int J Med Toxicol. 2001;4(2):16.
KLINISK FARMAKOLOGI
Handlingsmekanisme
BACTRIM er et antimikrobielt lægemiddel [se Mikrobiologi ].
Farmakokinetik
Efter en 1-times intravenøs infusion af en enkeltdosis på 160 mg trimethoprim og 800 mg sulfamethoxazol til 11 patienter, hvis vægt varierede fra 105 lbs til 165 lbs (gennemsnit, 143 lbs), var de maksimale plasmakoncentrationer af trimethoprim og sulfamethox4± 0334azol. henholdsvis μg/mL og 46,3 ± 2,7 μg/mL. Efter gentagen intravenøs administration af den samme dosis med 8-timers intervaller var de gennemsnitlige plasmakoncentrationer lige før og umiddelbart efter hver infusion ved steady state 5,6 ± 0,6 μg/ml og 8,8 ± 0,9 μg/ml for trimethoprim og 70,6 ± 7,3 μg /mL og 105,6 ± 10,9 μg/mL for sulfamethoxazol. Den gennemsnitlige plasmahalveringstid var 11,3 ± 0,7 timer for trimethoprim og 12,8 ± 1,8 timer for sulfamethoxazol. Alle disse 11 patienter havde normal nyrefunktion, og deres alder varierede fra 17 til 78 år (median, 60 år).11
Farmakokinetiske undersøgelser hos børn og voksne tyder på en aldersafhængig halveringstid for trimethoprim, som angivet i tabel 5.12
Patienter med alvorligt nedsat nyrefunktion udviser en stigning i halveringstiden for begge komponenter, hvilket kræver justering af dosisregimen [se DOSERING OG ADMINISTRATION ].
Fordeling
Både trimethoprim og sulfamethoxazol findes i blodet som ubundne, proteinbundne og metaboliserede former; sulfamethoxazol eksisterer også som den konjugerede form.
Ca. 44 % af trimethoprim og 70 % af sulfamethoxazol er bundet til plasmaproteiner. Tilstedeværelsen af 10 mg procent sulfamethoxazol i plasma nedsætter proteinbindingen af trimethoprim i en ubetydelig grad; trimethoprim påvirker ikke proteinbindingen af sulfamethoxazol.
Både trimethoprim og sulfamethoxazol distribueres til sputum og skedevæske; trimethoprim distribueres også til bronkial sekret, og begge passerer placentabarrieren og udskilles i modermælken.
Elimination
Metabolisme
Sulfamethoxazol metaboliseres hos mennesker til mindst 5 metabolitter: N4-acetyl-, N4-hydroxy-, 5methylhydroxy-, N4-acetyl-5-methylhydroxysulfamethoxazol-metabolitter og et N-glucuronidkonjugat. Dannelsen af N4-hydroxymetabolit medieres via CYP2C9.
Trimethoprim metaboliseres in vitro til 11 forskellige metabolitter, hvoraf fem er glutathionaddukter og seks er oxidative metabolitter, herunder hovedmetabolitterne 1- og 3-oxider og 3- og 4-hydroxyderivaterne.
De frie former af trimethoprim og sulfamethoxazol anses for at være de terapeutisk aktive former. In vitro undersøgelser tyder på, at trimethoprim er et substrat for P-glycoprotein, OCT1 og OCT2, og at sulfamethoxazol ikke er et substrat for P-glycoprotein.
Udskillelse
Udskillelse af trimethoprim og sulfamethoxazol sker primært via nyrerne gennem både glomerulær filtration og tubulær sekretion. Urinkoncentrationerne af både trimethoprim og sulfamethoxazol er betydeligt højere end koncentrationerne i blodet. Procentdelen af dosis udskilt i urinen over en 12-timers periode efter intravenøs administration af den første dosis på 240 mg trimethoprim og 1200 mg sulfamethoxazol på dag 1 varierede fra 17 % til 42,4 % som fri trimethoprim; 7% til 12,7% som fri sulfamethoxazol; og 36,7 % til 56 % som total (fri plus den N4-acetylerede metabolit) sulfamethoxazol. Når det administreres sammen som BACTRIM 400 mg, påvirker hverken trimethoprim eller sulfamethoxazol den andens urinudskillelsesmønster.
Specifikke populationer
Geriatriske patienter
Farmakokinetikken af sulfamethoxazol 800 mg og trimethoprim 160 mg blev undersøgt hos seks geriatriske forsøgspersoner (gennemsnitsalder: 78,6 år) og seks unge raske forsøgspersoner (gennemsnitsalder: 29,3 år) ved anvendelse af en ikke-amerikansk godkendt formulering. Farmakokinetiske værdier for sulfamethoxazol hos geriatriske forsøgspersoner svarede til dem, der blev observeret hos unge voksne forsøgspersoner. Den gennemsnitlige renale clearance af trimethoprim var signifikant lavere hos geriatriske forsøgspersoner sammenlignet med unge voksne forsøgspersoner (19 ml/time/kg vs. 55 ml/time/kg). Efter normalisering efter kropsvægt var den tilsyneladende totale kropsclearance af trimethoprim dog i gennemsnit 19 % lavere hos geriatriske forsøgspersoner sammenlignet med unge voksne forsøgspersoner.
Mikrobiologi
Handlingsmekanisme
Sulfamethoxazol hæmmer bakteriel syntese af dihydrofolsyre ved at konkurrere med para-aminobenzoesyre (PABA). Trimethoprim blokerer produktionen af tetrahydrofolinsyre fra dihydrofolinsyre ved at binde sig til og reversibelt hæmme det nødvendige enzym, dihydrofolatreduktase. Sulfamethoxazol og trimethoprim blokerer således to på hinanden følgende trin i biosyntesen af nukleinsyrer og proteiner, der er essentielle for mange bakterier.
Modstand
In vitro undersøgelser har vist, at bakteriel resistens udvikler sig langsommere med både sulfamethoxazol og trimethoprim i kombination end med enten sulfamethoxazol eller trimethoprim alene.
Antimikrobiel aktivitet
BACTRIM har vist sig at være aktiv mod de fleste isolater af følgende mikroorganismer, både in vitro og ved kliniske infektioner [se INDIKATIONER OG BRUG ].
Aerobe gramnegative bakterier
Escherichia coliKlebsiella-arterEnterobacter-arterMorganella morganiiProteus mirabilisProteus vulgarisShigella flexneriShigella sonnei
Andre mikroorganismer
Pneumocystis jirovecii
Følgende in vitro-data er tilgængelige, men deres kliniske betydning er ukendt. Mindst 90 procent af de følgende bakterier udviser en in vitro minimal hæmmende koncentration (MIC) mindre end eller lig med det modtagelige brudpunkt for BACTRIM 160 mg mod isolater af lignende slægt eller organismegruppe. Effekten af BACTRIM 400 mg til behandling af kliniske infektioner forårsaget af disse bakterier er imidlertid ikke blevet fastslået i tilstrækkelige og velkontrollerede kliniske forsøg.
Aerobe grampositive bakterier
Streptococcus pneumoniae
Aerobe gramnegative bakterier
Haemophilus influenzae
Modtagelighedstest
For specifik information om fortolkningskriterier for følsomhedstest og tilhørende testmetoder og kvalitetskontrolstandarder anerkendt af FDA for dette lægemiddel, se venligst https://www.fda.gov/STIC.
REFERENCER
11. Grose WE, Bodey GP, Loo TL. Klinisk farmakologi af intravenøst administreret trimethoprim-sulfamethoxazol. Antimikrobielle midler Kemother. Mar 1979;15:447-451.
12. Siber GR, Gorham C, Durbin W, Lesko L, Levin MJ. Farmakologi af intravenøs trimethoprim-sulfamethoxazol hos børn og voksne. Nuværende kemoterapi og infektionssygdomme. American Society for Microbiology, Washington, DC 1980; Vol. 1, s. 691-692.
PATIENTOPLYSNINGER
Embryo føtal toksicitet
Rådgiv kvindelige patienter med reproduktionspotentiale om, at BACTRIM kan forårsage fosterskade, og at informere deres læge om en kendt eller formodet graviditet [se Brug i specifikke populationer ].
Amning
Råd ammende kvinder om at undgå amning under behandling med BACTRIM.
Antibakteriel resistens
Rådgiv patienterne om, at antibakterielle lægemidler inklusive BACTRIM kun bør anvendes til behandling af bakterielle infektioner. Det behandler ikke virusinfektioner (f.eks. forkølelse).
Instruer patienterne i at opretholde et tilstrækkeligt væskeindtag for at forhindre krystalluri og stendannelse.
Diarré
Rådgiv patienterne, at diarré er et almindeligt problem forårsaget af antibiotika, som normalt ophører, når antibiotikaen seponeres. Nogle gange kan patienter efter start af behandling med antibiotika udvikle vandig og blodig afføring (med eller uden mavekramper og feber) selv så sent som to eller flere måneder efter at have taget den sidste dosis af antibiotika. Hvis dette sker, skal patienter kontakte deres læge hurtigst muligt.
