Zocor 5mg, 10mg, 20mg, 40mg Simvastatin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Zocor, og hvordan bruges det?
Zocor (simvastatin) er en receptpligtig medicin, der bruges til at sænke niveauet af "dårligt" kolesterol (low-density lipoprotein eller LDL) og til at øge niveauet af "gode" kolesterol (high-density lipoprotein eller HDL) og til at sænke triglycerin samt til at reducere risikoen for slagtilfælde og hjerteanfald. Zocor kan bruges alene eller sammen med anden medicin.
Zocor tilhører en klasse af lægemidler kaldet lipidsænkende midler, statiner, HMG-CoA-reduktasehæmmere.
Det vides ikke, om Zocor er sikkert og effektivt til børn under 10 år.
Hvad er mulige bivirkninger af Zocor?
Zocor 20mg kan forårsage alvorlige bivirkninger, herunder:
- mistet appetiten,
- mavesmerter øverst til højre,
- træthed,
- kløe,
- mørk urin,
- lerfarvet skammel, og
- gulfarvning af hud eller øjne
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Zocor omfatter:
- hovedpine,
- kvalme,
- mavesmerter,
- forstoppelse, og
- forkølelsessymptomer (tilstoppet næse, nysen eller ondt i halsen)
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Zocor. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
ZOCOR (simvastatin) er et lipidsænkende middel, der er afledt syntetisk fra et fermenteringsprodukt af Aspergillus terreus. Efter oral indtagelse hydrolyseres simvastatin, som er en inaktiv lacton, til den tilsvarende β-hydroxysyreform. Dette er en hæmmer af 3-hydroxy-3-methylglutaryl-coenzym A (HMG-CoA) reduktase. Dette enzym katalyserer omdannelsen af HMG-CoA til mevalonat, som er et tidligt og hastighedsbegrænsende trin i biosyntesen af kolesterol.
Simvastatin er butansyre, 2,2-dimethyl-,1,2,3,7,8,8a-hexahydro-3,7-dimethyl-8-[2-(tetrahydro-4hydroxy-6-oxo-2H-pyran- 2-yl)-ethyl]-1-naphthalenylester, [1S-[la,3a,7β,8β(2S*,4S*),-8aβ]]. Den empiriske formel for simvastatin er C25H38O5 og dens molekylvægt er 418,57. Dens strukturformel er:
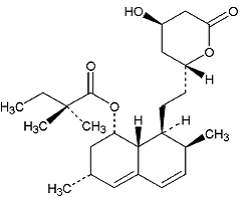
Simvastatin er et hvidt til råhvidt, ikke-hygroskopisk, krystallinsk pulver, der er praktisk talt uopløseligt i vand og frit opløseligt i chloroform, methanol og ethanol.
Tabletter ZOCOR til oral administration indeholder enten 5 mg, 10 mg, 20 mg, 40 mg eller 80 mg simvastatin og følgende inaktive ingredienser: ascorbinsyre, citronsyre, hydroxypropylcellulose, hypromellose, jernoxider, lactose, magnesiumstearat, mikrokrystallinsk cellulose stivelse, talkum og titaniumdioxid. Butyleret hydroxyanisol tilsættes som konserveringsmiddel.
INDIKATIONER
Terapi med lipidændrende midler bør kun være en komponent i multipel risikofaktorintervention hos personer med signifikant øget risiko for aterosklerotisk vaskulær sygdom på grund af hyperkolesterolæmi. Lægemiddelbehandling er indiceret som et supplement til diæt, når responsen på en diæt begrænset i mættet fedt og kolesterol og andre ikke-farmakologiske foranstaltninger alene har været utilstrækkelig. Hos patienter med koronar hjertesygdom (CHD) eller med høj risiko for CHD, kan ZOCOR® startes samtidigt med diæt.
Reduktion af risikoen for CHD-dødelighed og kardiovaskulære hændelser
Hos patienter med høj risiko for koronare hændelser på grund af eksisterende koronar hjertesygdom, diabetes, perifer karsygdom, anamnese med slagtilfælde eller anden cerebrovaskulær sygdom, er ZOCOR 5mg indiceret til:
- Reducer risikoen for total dødelighed ved at reducere CHD-dødsfald.
- Reducer risikoen for ikke-dødelig myokardieinfarkt og slagtilfælde.
- Reducer behovet for koronare og ikke-koronare revaskulariseringsprocedurer.
Hyperlipidæmi
ZOCOR er angivet til:
- Reducer forhøjet totalkolesterol (total-C), low-density lipoprotein-kolesterol (LDL-C), apolipoprotein B (Apo B) og triglycerider (TG), og for at øge high-density lipoprotein-kolesterol (HDL-C) hos patienter med primær hyperlipidæmi (Fredrickson type IIa, heterozygot familiær og ikke-familiær) eller blandet dyslipidæmi (Fredrickson type IIb).
- Reducer forhøjet TG hos patienter med hypertriglyceridæmi (Fredrickson type lV hyperlipidæmi).
- Reducer forhøjet TG og VLDL-C hos patienter med primær dysbetalipoproteinæmi (Fredrickson type III hyperlipidæmi).
- Reducer total-C og LDL-C hos patienter med homozygot familiær hyperkolesterolæmi (HoFH) som et supplement til andre lipidsænkende behandlinger (f.eks. LDL-aferese), eller hvis sådanne behandlinger ikke er tilgængelige.
Unge patienter med heterozygot familiær hyperkolesterolæmi (HeFH)
ZOCOR er indiceret som et supplement til diæt for at reducere total-C, LDL-C og Apo B-niveauer hos unge drenge og piger, der er mindst et år efter menarche, 10-17 år gamle, med HeFH, hvis efter en tilstrækkelig afprøvning af diætterapi følgende resultater er til stede:
- Der er en positiv familiehistorie med for tidlig kardiovaskulær sygdom (CVD) eller
- To eller flere andre CVD-risikofaktorer er til stede hos den unge patient.
Minimumsmålet for behandling hos pædiatriske og unge patienter er at opnå en gennemsnitlig LDL-C
Brugsbegrænsninger
ZOCOR 20mg er ikke blevet undersøgt under tilstande, hvor den største abnormitet er forhøjelse af chylomikroner (dvs. hyperlipidæmi Fredrickson type I og V).
DOSERING OG ADMINISTRATION
Anbefalet dosering
Det sædvanlige dosisområde er 5 til 40 mg/dag. Hos patienter med CHD eller med høj risiko for CHD kan ZOCOR startes samtidigt med diæt. Den anbefalede sædvanlige startdosis er 10 eller 20 mg én gang dagligt om aftenen. For patienter med høj risiko for en CHD-hændelse på grund af eksisterende CHD, diabetes, perifer karsygdom, anamnese med slagtilfælde eller anden cerebrovaskulær sygdom, er den anbefalede startdosis 40 mg/dag. Lipidbestemmelser bør udføres efter 4 ugers behandling og periodisk derefter.
Begrænset dosering til 80 mg
På grund af den øgede risiko for myopati, herunder rhabdomyolyse, især i det første behandlingsår, bør brugen af 80 mg dosis af ZOCOR begrænses til patienter, der har taget simvastatin 80 mg kronisk (f.eks. i 12 måneder eller mere) uden tegn på muskeltoksicitet [se ADVARSLER OG FORHOLDSREGLER ].
Patienter, der i øjeblikket tolererer 80 mg-dosis af ZOCOR, som skal startes på et interagerende lægemiddel, der er kontraindiceret eller er forbundet med en dosisgrænse for simvastatin, bør skiftes til et alternativt statin med mindre potentiale for lægemiddelinteraktionen.
På grund af den øgede risiko for myopati, inklusive rhabdomyolyse, forbundet med 80 mg-dosis af ZOCOR 40 mg, bør patienter, der ikke er i stand til at nå deres LDL-C-mål ved at bruge 40 mg-dosis af ZOCOR 5 mg, ikke titreres til 80 mg-dosis. , men bør placeres i alternativ LDL-C-sænkende behandling(er), der giver større LDL-C-sænkning.
Samtidig administration med andre lægemidler
Patienter, der tager Verapamil, Diltiazem eller Dronedaron
- Dosis af ZOCOR bør ikke overstige 10 mg/dag [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER , og KLINISK FARMAKOLOGI ].
Patienter, der tager Amiodaron, Amlodipin eller Ranolazin
- Dosis af ZOCOR 10 mg bør ikke overstige 20 mg/dag [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER , og KLINISK FARMAKOLOGI ].
Patienter med homozygot familiær hyperkolesterolæmi
Den anbefalede dosis er 40 mg/dag om aftenen [Se DOSERING OG ADMINISTRATION , Begrænset dosering til 80 mg ]. ZOCOR 5mg bør anvendes som et supplement til andre lipidsænkende behandlinger (f.eks. LDL-aferese) hos disse patienter, eller hvis sådanne behandlinger ikke er tilgængelige.
Simvastatin eksponering er ca. fordoblet ved samtidig brug af lomitapid; derfor bør dosis af ZOCOR reduceres med 50 %, hvis lomitapid påbegyndes. ZOCOR 5 mg dosis bør ikke overstige 20 mg/dag (eller 40 mg/dag for patienter, der tidligere har taget ZOCOR 80 mg/dag kronisk, f.eks. i 12 måneder eller mere, uden tegn på muskeltoksicitet), mens de tager lomitapid.
Unge (10-17 år) med heterozygot familiær hyperkolesterolæmi
Den anbefalede sædvanlige startdosis er 10 mg én gang dagligt om aftenen. Det anbefalede doseringsområde er 10 til 40 mg/dag; den maksimalt anbefalede dosis er 40 mg/dag. Doser bør individualiseres i henhold til det anbefalede mål for behandlingen [se Retningslinjer for NCEP Pædiatrisk Panel1 og Kliniske Studier ]. Justeringer bør foretages med intervaller på 4 uger eller mere.
Patienter med nedsat nyrefunktion
Da ZOCOR 5mg ikke udskilles væsentligt via nyrerne, bør dosisændring ikke være nødvendig hos patienter med let til moderat nedsat nyrefunktion. Der skal dog udvises forsigtighed, når ZOCOR 20 mg administreres til patienter med svært nedsat nyrefunktion; sådanne patienter bør startes med 5 mg/dag og overvåges nøje [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
HVORDAN LEVERET
Doseringsformer og styrker
- Tabletter ZOCOR 5 mg er brune, ovale, filmovertrukne tabletter, kodet MSD 726 på den ene side og ZOCOR 5 på den anden.
- Tabletter ZOCOR 10 mg er ferskenfarvede, ovale, filmovertrukne tabletter, kodet MSD 735 på den ene side og almindelige på den anden side.
- Tabletter ZOCOR 20 mg er solbrune, ovale, filmovertrukne tabletter, kodet MSD 740 på den ene side og almindelige på den anden side.
- Tabletter ZOCOR 40 mg er murstensrøde, ovale, filmovertrukne tabletter, kodet MSD 749 på den ene side og almindelige på den anden side.
- Tabletter ZOCOR 80 mg er murstensrøde, kapselformede, filmovertrukne tabletter, kodet 543 på den ene side og 80 på den anden.
Opbevaring og håndtering
nr. 8146 - Tabletter ZOCOR 10 mg er ferskenfarvede, ovale, filmovertrukne tabletter, kodet MSD 735 på den ene side og almindelige på den anden side. De leveres som følger:
NDC 0006-0735-31 flasker med 30 brugsenheder NDC 0006-0735-54 brugsenhedsflasker á 90.
nr. 8147 - Tabletter ZOCOR 20 mg er solbrune, ovale, filmovertrukne tabletter, kodet MSD 740 på den ene side og almindelige på den anden side. De leveres som følger:
NDC 0006-0740-31 flasker med 30 stk NDC 0006-0740-54 flasker med 90 brugsenheder.
nr. 8148 - Tabletter ZOCOR 40 mg er murstensrøde, ovale, filmovertrukne tabletter, kodet MSD 749 på den ene side og almindelige på den anden. De leveres som følger:
NDC 0006-0749-31 flasker med 30 brugsenheder NDC 0006-0749-54 flasker med 90 stk.
nr. 6577 - Tabletter ZOCOR 80 mg er murstensrøde, kapselformede, filmovertrukne tabletter, kodet 543 på den ene side og 80 på den anden. De leveres som følger:
NDC 0006-0543-31 flasker med 30 brugsenheder NDC 0006-0543-54 flasker med 90 stk.
Opbevaring
Opbevares mellem 5-30°C (41-86°F).
1National Cholesterol Education Program (NCEP): Højdepunkter i rapporten fra ekspertpanelet om blodkolesterolniveauer hos børn og unge. Pædiatri. 89(3):495-501. 1992.
Fremstillet af: Merck Sharp & Dohme Ltd. Cramlington, Northumberland, UK NE23 3JU. Revideret: september 2020
BIVIRKNINGER
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
de præ-marketing kontrollerede kliniske undersøgelser og deres åbne forlængelser (2.423 patienter med median varighed af opfølgning på ca. 18 måneder), blev 1,4 % af patienterne seponeret på grund af bivirkninger. De mest almindelige bivirkninger, der førte til seponering af behandlingen, var: mave-tarmlidelser (0,5 %), myalgi (0,1 %) og artralgi (0,1 %). De mest almindeligt rapporterede bivirkninger (incidens ≥5 %) i simvastatinkontrollerede kliniske forsøg var: øvre luftvejsinfektioner (9,0 %), hovedpine (7,4 %), mavesmerter (7,3 %), forstoppelse (6,6 %) og kvalme (5,4 %). %).
Skandinavisk Simvastatin Survival Study
I 4S, der involverede 4.444 (aldersinterval 35-71 år, 19 % kvinder, 100 % kaukasiere) behandlet med 20-40 mg/dag ZOCOR (n=2.221) eller placebo (n=2.223) over en median på 5,4 år, negativ Reaktioner rapporteret hos ≥2 % af patienterne og med en højere hastighed end placebo er vist i tabel 2.
Hjertebeskyttelsesundersøgelse
Heart Protection Study (HPS), der involverede 20.536 patienter (aldersinterval 40-80 år, 25 % kvinder, 97 % kaukasiere, 3 % andre racer) behandlet med ZOCOR 40 mg/dag (n=10.269) eller placebo (n= 10.267) over et gennemsnit på 5 år blev der kun registreret alvorlige bivirkninger og seponeringer på grund af eventuelle bivirkninger. Seponeringsraten på grund af bivirkninger var 4,8 % hos patienter behandlet med ZOCOR 10 mg sammenlignet med 5,1 % hos patienter behandlet med placebo. Incidensen af myopati/rhabdomyolyse var
Andre kliniske undersøgelser
et klinisk forsøg, hvor 12.064 patienter med myokardieinfarkt i anamnesen blev behandlet med ZOCOR (gennemsnitlig opfølgning 6,7 år), var forekomsten af myopati (defineret som uforklarlig muskelsvaghed eller smerte med en serumkreatinkinase [CK] >10 gange) øvre grænse for normal [ULN]) hos patienter på 80 mg/dag var ca. 0,9 % sammenlignet med 0,02 % for patienter på 20 mg/dag. Incidensen af rhabdomyolyse (defineret som myopati med en CK >40 gange ULN) hos patienter på 80 mg/dag var ca. 0,4 % sammenlignet med 0 % for patienter på 20 mg/dag. Forekomsten af myopati, inklusive rabdomyolyse, var højest i løbet af det første år og faldt derefter markant i løbet af de efterfølgende behandlingsår. I dette forsøg blev patienterne overvåget nøje, og nogle interagerende lægemidler blev udelukket.
Andre bivirkninger rapporteret i kliniske forsøg var: diarré, udslæt, dyspepsi, flatulens og asteni.
Laboratorieprøver
Markante vedvarende stigninger af levertransaminaser er blevet observeret [se ADVARSLER OG FORHOLDSREGLER ]. Forhøjet alkalisk fosfatase og y-glutamyl transpeptidase er også blevet rapporteret. Omkring 5 % af patienterne havde forhøjede CK-niveauer på 3 eller flere gange den normale værdi ved en eller flere lejligheder. Dette kunne tilskrives den ikke-kardiale fraktion af CK. [se ADVARSLER OG FORHOLDSREGLER ]
Unge patienter (10-17 år)
I en 48-ugers kontrolleret undersøgelse med unge drenge og piger, som var mindst 1 år efter menarche, 10-17 år (43,4 % kvinder, 97,7 % kaukasiere, 1,7 % latinamerikanere, 0,6 % multiraciale) med heterozygot familiær hyperkolesterolæmi (n=175), behandlet med placebo eller ZOCOR (10-40 mg dagligt), var de mest almindelige bivirkninger observeret i begge grupper øvre luftvejsinfektion, hovedpine, mavesmerter og kvalme [se Brug i specifikke populationer og Kliniske Studier ].
Postmarketing oplevelse
Fordi nedenstående reaktioner er rapporteret frivilligt fra en population af usikker størrelse, er det generelt ikke muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering. Følgende yderligere bivirkninger er blevet identificeret under brug af simvastatin efter godkendelse: kløe, alopeci, en række forskellige hudforandringer (f.eks. knuder, misfarvning, tør hud/slimhinder, ændringer i hår/negle), svimmelhed, muskelkramper, myalgi , pancreatitis, paræstesi, perifer neuropati, opkastning, anæmi, erektil dysfunktion, interstitiel lungesygdom, rhabdomyolyse, hepatitis/gulsot, fatalt og ikke-fatalt leversvigt og depression.
Der har været sjældne rapporter om immunmedieret nekrotiserende myopati forbundet med statinbrug [se ADVARSLER OG FORHOLDSREGLER ].
Der er sjældent rapporteret om et tilsyneladende overfølsomhedssyndrom, som har omfattet nogle af følgende træk: anafylaksi, angioødem, lupus erythematous-lignende syndrom, polymyalgia rheumatica, dermatomyositis, vaskulitis, purpura, trombocytopeni, leukopeni, hæmolytisk anæmi, ESR-positiv, ANA-filemi, ANA-positiv stigning. , arthritis, artralgi, nældefeber, asteni, lysfølsomhed, feber, kulderystelser, rødmen, utilpashed, dyspnø, toksisk epidermal nekrolyse, erythema multiforme, herunder Stevens-Johnsons syndrom.
Der har været sjældne postmarketingrapporter om kognitiv svækkelse (f.eks. hukommelsestab, glemsomhed, hukommelsestab, hukommelsessvækkelse, forvirring) forbundet med statinbrug. Disse kognitive problemer er blevet rapporteret for alle statiner. Indberetningerne er generelt ikke-seriøse og reversible ved seponering af statin med varierende tidspunkter til symptomdebut (1 dag til år) og symptomopløsning (median på 3 uger).
DRUGSINTERAKTIONER
Stærke CYP3A4-hæmmere, Cyclosporin eller Danazol
Stærke CYP3A4-hæmmere: Simvastatin er ligesom flere andre hæmmere af HMG-CoA-reduktase et substrat for CYP3A4. Simvastatin metaboliseres af CYP3A4, men har ingen CYP3A4-hæmmende aktivitet; derfor forventes det ikke at påvirke plasmakoncentrationerne af andre lægemidler, der metaboliseres af CYP3A4.
Forhøjede plasmaniveauer af HMG-CoA-reduktasehæmmende aktivitet øger risikoen for myopati og rabdomyolyse, især ved højere doser af simvastatin. [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ] Samtidig brug af lægemidler mærket som havende en stærk hæmmende effekt på CYP3A4 er kontraindiceret [se KONTRAINDIKATIONER ]. Hvis behandling med itraconazol, ketoconazol, posaconazol, voriconazol, erythromycin, clarithromycin eller telithromycin er uundgåelig, skal behandling med simvastatin seponeres under behandlingsforløbet.
Cyclosporin eller Danazol: Risikoen for myopati, herunder rhabdomyolyse, øges ved samtidig administration af cyclosporin eller danazol. Derfor er samtidig brug af disse lægemidler kontraindiceret [se KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Lipidsænkende lægemidler, der kan forårsage myopati, når de gives alene
Gemfibrozil
Kontraindiceret med simvastatin [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
Andre fibrater
Der skal udvises forsigtighed ved ordinering med simvastatin [se ADVARSLER OG FORHOLDSREGLER ].
Amiodaron, Dronedaron, Ranolazin eller Calciumkanalblokkere
Risikoen for myopati, herunder rhabdomyolyse, øges ved samtidig administration af amiodaron, dronedaron, ranolazin eller calciumkanalblokkere såsom verapamil, diltiazem eller amlodipin [Se DOSERING OG ADMINISTRATION og ADVARSLER OG FORHOLDSREGLER , og tabel 3 in KLINISK FARMAKOLOGI ].
Niacin
Tilfælde af myopati/rhabdomyolyse er blevet observeret med simvastatin givet sammen med lipid-modificerende doser (≥1 g/dag niacin) af niacinholdige produkter. Risikoen for myopati er større hos kinesiske patienter. I et klinisk forsøg (median opfølgning 3,9 år) med patienter med høj risiko for kardiovaskulær sygdom og med velkontrollerede LDL-C-niveauer på simvastatin 40 mg/dag med eller uden ezetimib 10 mg/dag, var der ingen trinvis fordel ved kardiovaskulære udfald med tilføjelse af lipid-modificerende doser (≥1 g/dag) af niacin. Samtidig administration af ZOCOR med lipid-modificerende doser (≥1 g/dag) af niacin anbefales ikke til kinesiske patienter. Det er ukendt, om denne risiko gælder for andre asiatiske patienter [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Digoxin
I en undersøgelse resulterede samtidig administration af digoxin og simvastatin i en let stigning i digoxinkoncentrationen i plasma. Patienter, der tager digoxin, bør overvåges korrekt, når simvastatin påbegyndes [se KLINISK FARMAKOLOGI ].
Coumarin antikoagulantia
to kliniske undersøgelser, det ene med normale frivillige og det andet med hyperkolesterolæmiske patienter, forstærkede simvastatin 20-40 mg/dag beskedent effekten af coumarinantikoagulantia: protrombintiden, rapporteret som International Normalized Ratio (INR), steg fra en baseline på 1,7 til 1,8 og fra 2,6 til 3,4 i henholdsvis frivillig- og patientstudiet. Med andre statiner er der rapporteret klinisk tydelig blødning og/eller øget protrombintid hos nogle få patienter, der samtidig tager coumarinantikoagulantia. Hos sådanne patienter bør protrombintiden bestemmes før start med simvastatin og hyppigt nok under tidlig behandling til at sikre, at der ikke sker nogen signifikant ændring af protrombintiden. Når en stabil protrombintid er blevet dokumenteret, kan protrombintider overvåges med de intervaller, der normalt anbefales til patienter på coumarinantikoagulantia. Hvis dosis af simvastatin ændres eller seponeres, skal den samme procedure gentages. Simvastatinbehandling er ikke blevet forbundet med blødning eller med ændringer i protrombintid hos patienter, der ikke tager antikoagulantia.
Colchicin
Tilfælde af myopati, herunder rhabdomyolyse, er blevet rapporteret med simvastatin administreret sammen med colchicin, og der bør udvises forsigtighed ved ordinering af simvastatin med colchicin.
Daptomycin
Tilfælde af rabdomyolyse er blevet rapporteret med simvastatin administreret sammen med daptomycin. Både simvastatin og daptomycin kan forårsage myopati og rhabdomyolyse, når de gives alene, og risikoen for myopati og rhabdomyolyse kan øges ved samtidig administration. Stop ZOCOR midlertidigt hos patienter, der tager daptomycin [se ADVARSLER OG FORHOLDSREGLER ].
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Myopati/Rhabdomyolyse
Simvastatin forårsager lejlighedsvis myopati manifesteret som muskelsmerter, ømhed eller svaghed med kreatinkinase (CK) over ti gange den øvre normalgrænse (ULN). Myopati tager nogle gange form af rabdomyolyse med eller uden akut nyresvigt sekundært til myoglobinuri, og sjældne dødsfald er forekommet. Risikoen for myopati øges af forhøjede plasmaniveauer af simvastatin og simvastatinsyre. Disponerende faktorer for myopati omfatter fremskreden alder (≥65 år), kvindeligt køn, ukontrolleret hypothyroidisme og nedsat nyrefunktion. Kinesiske patienter kan have øget risiko for myopati [se Brug i specifikke populationer ].
Risikoen for myopati, herunder rabdomyolyse, er dosisrelateret. en database med kliniske forsøg, hvor 41.413 patienter blev behandlet med ZOCOR 10 mg, hvoraf 24.747 (ca. 60%) var inkluderet i undersøgelser med en median opfølgning på mindst 4 år, var forekomsten af myopati ca. 0,03 % og 0,08 % ved henholdsvis 20 og 40 mg/dag. Forekomsten af myopati med 80 mg (0,61 %) var uforholdsmæssigt højere end den, der blev observeret ved de lavere doser. I disse forsøg blev patienterne overvåget nøje, og nogle interagerende lægemidler blev udelukket.
et klinisk forsøg, hvor 12.064 patienter med myokardieinfarkt i anamnesen blev behandlet med ZOCOR (gennemsnitlig opfølgning 6,7 år), var forekomsten af myopati (defineret som uforklarlig muskelsvaghed eller smerte med en serumkreatinkinase [CK] >10 gange) øvre grænse for normal [ULN]) hos patienter på 80 mg/dag var ca. 0,9 % sammenlignet med 0,02 % for patienter på 20 mg/dag. Incidensen af rhabdomyolyse (defineret som myopati med en CK >40 gange ULN) hos patienter på 80 mg/dag var ca. 0,4 % sammenlignet med 0 % for patienter på 20 mg/dag. Forekomsten af myopati, inklusive rabdomyolyse, var højest i løbet af det første år og faldt derefter markant i løbet af de efterfølgende behandlingsår. I dette forsøg blev patienterne overvåget nøje, og nogle interagerende lægemidler blev udelukket.
Risikoen for myopati, inklusive rhabdomyolyse, er større hos patienter på simvastatin 80 mg sammenlignet med andre statinbehandlinger med lignende eller større LDL-C-sænkende effekt og sammenlignet med lavere doser af simvastatin. Derfor bør 80 mg-dosis af ZOCOR kun anvendes til indlagte patienter, der har taget simvastatin 80 mg kronisk (f.eks. i 12 måneder eller mere) uden tegn på muskeltoksicitet [Se DOSERING OG ADMINISTRATION , Begrænset dosering til 80 mg ]. Men hvis en patient, der i øjeblikket tåler 80 mg-dosis af ZOCOR, skal påbegyndes med et interagerende lægemiddel, som er kontraindiceret eller er forbundet med en dosisgrænse for simvastatin, skal denne patient skiftes til et alternativt statin med mindre potentiale for lægemiddel-lægemiddel interaktion. Patienterne skal informeres om den øgede risiko for myopati, herunder rabdomyolyse, og omgående rapportere enhver uforklarlig muskelsmerte, ømhed eller svaghed. Hvis der opstår symptomer, skal behandlingen seponeres med det samme. [se Immun-medieret nekrotiserende myopati ]
Alle patienter, der starter behandling med ZOCOR 20 mg, eller hvis dosis af ZOCOR øges, skal informeres om risikoen for myopati, inklusive rabdomyolyse, og informeres om øjeblikkeligt at rapportere enhver uforklarlig muskelsmerte, ømhed eller svaghed, især hvis de ledsages af utilpashed eller feber, hvis muskeltegn. og symptomerne fortsætter efter seponering af ZOCOR. ZOCOR-behandlingen bør seponeres øjeblikkeligt, hvis der er diagnosticeret eller mistanke om myopati. de fleste tilfælde forsvandt muskelsymptomer og CK-stigninger, når behandlingen blev stoppet omgående. Periodiske CK-bestemmelser kan overvejes hos patienter, der starter behandling med ZOCOR 5 mg, eller hvis dosis øges, men der er ingen sikkerhed for, at en sådan overvågning vil forhindre myopati.
Mange af de patienter, som har udviklet rabdomyolyse under behandling med simvastatin, har haft komplicerede sygehistorier, herunder nyreinsufficiens, normalt som følge af langvarig diabetes mellitus. Sådanne patienter fortjener tættere overvågning. Behandling med ZOCOR bør seponeres, hvis der opstår markant forhøjede CPK-niveauer, eller hvis der er diagnosticeret eller mistanke om myopati. ZOCOR-behandling bør også midlertidigt seponeres hos enhver patient, der oplever en akut eller alvorlig tilstand, der disponerer for udvikling af nyresvigt sekundært til rhabdomyolyse, f.eks. sepsis; hypotension; større operation; trauma; alvorlige metaboliske, endokrine eller elektrolytlidelser; eller ukontrolleret epilepsi.
Lægemiddelinteraktioner
Risikoen for myopati og rhabdomyolyse øges af forhøjede plasmaniveauer af simvastatin og simvastatinsyre. Simvastatin metaboliseres af cytochrom P450 isoform 3A4. Visse lægemidler, som hæmmer denne metaboliske vej, kan øge plasmaniveauerne af simvastatin og kan øge risikoen for myopati. Disse omfatter itraconazol, ketoconazol, posaconazol, voriconazol, makrolidantibiotika erythromycin og clarithromycin og ketolidantibiotikum telithromycin, HIV-proteasehæmmere, boceprevir, telaprevir, antidepressivum nefazodon, cobicistat-holdige juice-produkter, KLINISK FARMAKOLOGI ]. Kombination af disse lægemidler med simvastatin er kontraindiceret. Hvis kortvarig behandling med stærke CYP3A4-hæmmere er uundgåelig, skal behandlingen med simvastatin seponeres under behandlingsforløbet [se KONTRAINDIKATIONER og DRUGSINTERAKTIONER ].
Den kombinerede brug af simvastatin med gemfibrozil, cyclosporin eller danazol er kontraindiceret [se KONTRAINDIKATIONER og DRUGSINTERAKTIONER ].
Der bør udvises forsigtighed ved ordinering af andre fibrater med simvastatin, da disse midler kan forårsage myopati, når de gives alene, og risikoen er øget, når de administreres samtidigt [se DRUGSINTERAKTIONER ].
Tilfælde af myopati, inklusive rhabdomyolyse, er blevet rapporteret med simvastatin administreret sammen med colchicin, og der bør udvises forsigtighed ved ordinering af simvastatin med colchicin [se DRUGSINTERAKTIONER ].
Fordelene ved den kombinerede brug af simvastatin med følgende lægemidler bør nøje afvejes mod de potentielle risici ved kombinationer: andre lipidsænkende lægemidler (fibrater eller, for patienter med HoFH, lomitapid), amiodaron, dronedaron, verapamil, diltiazem, amlodipin, eller ranolazin [Se DOSERING OG ADMINISTRATION , DRUGSINTERAKTIONER ].
Tilfælde af myopati, herunder rhabdomyolyse, er blevet observeret med simvastatin givet sammen med lipidmodificerende doser (≥1 g/dag niacin) af niacinholdige produkter [se DRUGSINTERAKTIONER ].
Tilfælde af rabdomyolyse er blevet rapporteret med simvastatin administreret sammen med daptomycin. Stop ZOCOR midlertidigt hos patienter, der tager daptomycin [se DRUGSINTERAKTIONER ].
Udskrivningsanbefalinger for interagerende midler er opsummeret i tabel 1 [se også DOSERING OG ADMINISTRATION , DRUGSINTERAKTIONER , KLINISK FARMAKOLOGI ].
Immun-medieret nekrotiserende myopati
Der har været sjældne rapporter om immunmedieret nekrotiserende myopati (IMNM), en autoimmun myopati, forbundet med statinbrug. IMNM er karakteriseret ved: proksimal muskelsvaghed og forhøjet serumkreatinkinase, som fortsætter på trods af seponering af statinbehandling; positivt anti-HMG CoA-reduktase-antistof; muskelbiopsi, der viser nekrotiserende myopati; og forbedring med immunsuppressive midler. Yderligere neuromuskulær og serologisk test kan være nødvendig. Behandling med immunsuppressive midler kan være nødvendig. Overvej nøje risikoen for IMNM før påbegyndelse af et andet statin. Hvis behandlingen påbegyndes med et andet statin, skal du overvåge for tegn og symptomer på IMNM.
Leverdysfunktion
Vedvarende stigninger (til mere end 3X ULN) i serumtransaminaser er forekommet hos ca. 1 % af de patienter, der fik simvastatin i kliniske undersøgelser. Når lægemiddelbehandlingen blev afbrudt eller afbrudt hos disse patienter, faldt transaminaseniveauerne normalt langsomt til niveauerne før behandlingen. Forøgelserne var ikke forbundet med gulsot eller andre kliniske tegn eller symptomer. Der var ingen tegn på overfølsomhed.
I Scandinavian Simvastatin Survival Study (4S) [se Kliniske Studier ], var antallet af patienter med mere end én transaminaseforhøjelse til >3X ULN i løbet af undersøgelsen ikke signifikant forskelligt mellem simvastatin- og placebogrupperne (14 [0,7 %] vs. 12 [0,6 %]). Forhøjede transaminaser resulterede i seponering af 8 patienter fra behandling i simvastatingruppen (n=2.221) og 5 i placebogruppen (n=2.223). Ud af de 1.986 simvastatinbehandlede patienter i 4S med normale leverfunktionstests (LFT'er) ved baseline udviklede 8 (0,4 %) konsekutive LFT-stigninger til >3X ULN og/eller blev afbrudt på grund af transaminasestigninger i løbet af de 5,4 år (median opfølgning ) af undersøgelsen. Blandt disse 8 patienter udviklede 5 oprindeligt disse abnormiteter inden for det første år. Alle patienterne i denne undersøgelse fik en startdosis på 20 mg simvastatin; 37 % blev titreret til 40 mg.
2 kontrollerede kliniske studier med 1.105 patienter var 12-måneders forekomsten af vedvarende hepatisk transaminaseforhøjelse uden hensyntagen til lægemiddelforhold 0,9 % og 2,1 % ved henholdsvis 40 og 80 mg dosis. Ingen patienter udviklede vedvarende leverfunktionsabnormiteter efter de første 6 måneders behandling med en given dosis.
Det anbefales, at der udføres leverfunktionsprøver før påbegyndelse af behandlingen og derefter, når det er klinisk indiceret. Der har været sjældne rapporter efter markedsføring om fatalt og ikke-fatalt leversvigt hos patienter, der tager statiner, inklusive simvastatin. Hvis der opstår alvorlig leverskade med kliniske symptomer og/eller hyperbilirubinæmi eller gulsot under behandling med ZOCOR 5mg, afbrydes behandlingen omgående. Hvis en alternativ ætiologi ikke findes, skal du ikke genstarte ZOCOR. Bemærk, at ALT kan komme fra muskler, derfor kan ALT, der stiger med CK, indikere myopati [se Myopati/Rhabdomyolyse ].
Lægemidlet bør anvendes med forsigtighed til patienter, som indtager betydelige mængder alkohol og/eller har tidligere haft leversygdomme. Aktive leversygdomme eller uforklarlige transaminasestigninger er kontraindikationer for brugen af simvastatin.
Moderate (mindre end 3X ULN) forhøjelser af serumtransaminaser er blevet rapporteret efter behandling med simvastatin. Disse ændringer optrådte kort efter påbegyndelse af behandling med simvastatin, var ofte forbigående, var ikke ledsaget af nogen symptomer og krævede ikke afbrydelse af behandlingen.
Endokrin funktion
Stigninger i HbA1c og fastende serumglukoseniveauer er blevet rapporteret med HMG-CoA-reduktasehæmmere, inklusive ZOCOR.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
et 72-ugers karcinogenicitetsstudie fik mus daglige doser af simvastatin på 25, 100 og 400 mg/kg kropsvægt, hvilket resulterede i gennemsnitlige plasma-lægemiddelniveauer på ca. 1, 4 og 8 gange højere end det gennemsnitlige humane plasmalægemiddel. niveau (som total hæmmende aktivitet baseret på AUC) efter en 80 mg oral dosis. Leverkarcinomer var signifikant øget hos højdosis hunner og mid- og højdosis mænd med en maksimal forekomst på 90% hos mænd. Forekomsten af adenomer i leveren var signifikant øget hos kvinder i mellem- og højdosis. Lægemiddelbehandling øgede også signifikant forekomsten af lungeadenomer hos mænd og kvinder i mellem- og højdosis. Adenomer i Harderian-kirtlen (en kirtel i øjet hos gnavere) var signifikant højere hos højdosismus end hos kontroller. Der blev ikke observeret tegn på en tumorigen effekt ved 25 mg/kg/dag.
et separat 92-ugers karcinogenicitetsstudie med mus i doser op til 25 mg/kg/dag blev der ikke observeret tegn på en tumorigen effekt (gennemsnitlige plasmalægemiddelniveauer var 1 gange højere end mennesker, der fik 80 mg simvastatin målt ved AUC).
I et toårigt studie med rotter med 25 mg/kg/dag var der en statistisk signifikant stigning i forekomsten af follikulære adenomer i skjoldbruskkirtlen hos hunrotter udsat for ca. 11 gange højere niveauer af simvastatin end hos mennesker, der fik 80 mg simvastatin (som målt ved AUC).
Et andet toårigt karcinogenicitetsstudie med rotter med doser på 50 og 100 mg/kg/dag frembragte hepatocellulære adenomer og karcinomer (i hunrotter ved begge doser og hos hanner ved 100 mg/kg/dag). Skjoldbruskkirtelfollikulære celleadenomer blev øget hos mænd og kvinder ved begge doser; skjoldbruskkirtelfollikulære cellekarcinomer blev øget hos kvinder med 100 mg/kg/dag. Den øgede forekomst af thyroidea-neoplasmer ser ud til at være i overensstemmelse med fund fra andre statiner. Disse behandlingsniveauer repræsenterede plasmalægemiddelniveauer (AUC) på ca. 7 og 15 gange (mænd) og 22 og 25 gange (kvinder) den gennemsnitlige humane plasmalægemiddeleksponering efter en daglig dosis på 80 milligram.
Der blev ikke observeret tegn på mutagenicitet i en mikrobiel mutagenicitetstest (Ames) med eller uden metabolisk aktivering af rotte- eller muselever. Derudover blev der ikke noteret tegn på beskadigelse af genetisk materiale i en in vitro alkalisk elueringsanalyse med rottehepatocytter, en V-79 pattedyrcelle fremad mutationsundersøgelse, en in vitro kromosomafvigelsesundersøgelse i CHO-celler eller en in vivo kromosomafvigelsesanalyse i musens knoglemarv.
Der var nedsat fertilitet hos hanrotter behandlet med simvastatin i 34 uger ved 25 mg/kg legemsvægt (4 gange det maksimale humane eksponeringsniveau, baseret på AUC, hos patienter, der fik 80 mg/dag); denne effekt blev dog ikke observeret under et efterfølgende fertilitetsstudie, hvor simvastatin blev administreret i samme dosisniveau til hanrotter i 11 uger (hele spermatogenesecyklussen inklusive epididymal modning). Ingen mikroskopiske ændringer blev observeret i testiklerne hos rotter fra nogen af undersøgelserne. Ved 180 mg/kg/dag (hvilket giver eksponeringsniveauer 22 gange højere end hos mennesker, der tager 80 mg/dag baseret på overfladeareal, mg/m2), blev der observeret degeneration af sædrøre (nekrose og tab af spermatogent epitel). Hos hunde var der lægemiddelrelateret testikelatrofi, nedsat spermatogenese, spermatocytisk degeneration og kæmpecelledannelse ved 10 mg/kg/dag (ca. 2 gange den humane eksponering, baseret på AUC, ved 80 mg/dag). Den kliniske betydning af disse fund er uklar.
Brug i specifikke populationer
Graviditet
Graviditetskategori X [Se KONTRAINDIKATIONER ]
ZOCOR er kontraindiceret til kvinder, der er eller kan blive gravide. Lipidsænkende lægemidler giver ingen fordel under graviditet, fordi kolesterol og kolesterolderivater er nødvendige for normal fosterudvikling. Åreforkalkning er en kronisk proces, og seponering af lipidsænkende medicin under graviditet bør have ringe indflydelse på langsigtede resultater af primær hyperkolesterolæmibehandling. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af brug med ZOCOR under graviditet; der er dog sjældne rapporter om medfødte anomalier hos spædbørn, der er udsat for statiner in utero. Dyreproduktionsundersøgelser af simvastatin hos rotter og kaniner viste ingen tegn på teratogenicitet. Serumkolesterol og triglycerider stiger under normal graviditet, og kolesterol eller kolesterolderivater er afgørende for fostrets udvikling. Fordi statiner nedsætter kolesterolsyntesen og muligvis syntesen af andre biologisk aktive stoffer afledt af kolesterol, kan ZOCOR forårsage fosterskader, når det administreres til en gravid kvinde. Hvis ZOCOR 5mg anvendes under graviditet, eller hvis patienten bliver gravid, mens han tager dette lægemiddel, skal patienten informeres om den potentielle fare for fosteret.
Der er sjældne rapporter om medfødte anomalier efter intrauterin eksponering for statiner. I en gennemgang2 af ca. 100 prospektivt fulgte graviditeter hos kvinder udsat for simvastatin eller et andet strukturelt beslægtet statin oversteg forekomsten af medfødte anomalier, spontane aborter og føtale dødsfald/dødfødsler ikke det forventede i den generelle befolkning. Undersøgelsen var dog kun i stand til at udelukke en 3- til 4 gange øget risiko for medfødte anomalier i forhold til baggrundsraten. I 89 % af disse tilfælde blev lægemiddelbehandling påbegyndt før graviditeten og blev afbrudt i første trimester, hvor graviditet blev identificeret.
Simvastatin var ikke teratogent hos rotter eller kaniner ved doser (henholdsvis 25, 10 mg/kg/dag), der resulterede i 3 gange den humane eksponering baseret på mg/m2 overfladeareal. I undersøgelser med et andet strukturelt beslægtet statin blev der imidlertid observeret skeletmisdannelser hos rotter og mus.
Manson, JM, Freyssinges, C., Ducrocq, MB, Stephenson, WP, Postmarketing Surveillance of Lovastatin and Simvastatin Exposure Under Pregnancy, Reproductive Toxicology, 10(6):439-446, 1996.
Kvinder i den fødedygtige alder, som kræver behandling med ZOCOR 5 mg for en lipidlidelse, bør rådes til at bruge effektiv prævention. For kvinder, der forsøger at blive gravide, bør seponering af ZOCOR overvejes. Hvis der opstår graviditet, skal ZOCOR seponeres øjeblikkeligt.
Ammende mødre
Det vides ikke, om simvastatin udskilles i modermælk. Da en lille mængde af et andet lægemiddel i denne klasse udskilles i modermælk og på grund af potentialet for alvorlige bivirkninger hos ammende spædbørn, bør kvinder, der tager simvastatin, ikke amme deres spædbørn. Der bør træffes en beslutning om, hvorvidt sygeplejen skal ophøre eller medicinen skal afbrydes under hensyntagen til lægemidlets betydning for moderen [se KONTRAINDIKATIONER ].
Pædiatrisk brug
Simvastatins sikkerhed og effektivitet hos patienter i alderen 10-17 år med heterozygot familiær hyperkolesterolæmi er blevet evalueret i et kontrolleret klinisk forsøg med unge drenge og piger, som var mindst 1 år efter menarche. Patienter behandlet med simvastatin havde en bivirkningsprofil svarende til den for patienter behandlet med placebo. Doser større end 40 mg er ikke blevet undersøgt i denne population. I denne begrænsede kontrollerede undersøgelse var der ingen signifikant effekt på vækst eller seksuel modning hos de unge drenge eller piger eller på menstruationscykluslængden hos piger. [Se DOSERING OG ADMINISTRATION , BIVIRKNINGER , Kliniske Studier ] Unge kvinder bør rådgives om passende præventionsmetoder, mens de er i behandling med simvastatin [se KONTRAINDIKATIONER og Graviditet ]. Simvastatin er ikke blevet undersøgt hos patienter under 10 år eller hos præmenarkalske piger.
Geriatrisk brug
Af de 2.423 patienter, der fik ZOCOR 5 mg i kliniske fase III-studier og de 10.269 patienter i hjertebeskyttelsesstudiet, som fik ZOCOR 40 mg, var henholdsvis 363 (15 %) og 5.366 (52 %) ≥65 år gamle. I HPS var 615 (6%) ≥75 år. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes. Da høj alder (≥65 år) er en disponerende faktor for myopati, bør ZOCOR ordineres med forsigtighed til ældre. [Se KLINISK FARMAKOLOGI ]
Et farmakokinetisk studie med simvastatin viste, at det gennemsnitlige plasmaniveau af statinaktivitet var ca. 45 % højere hos ældre patienter mellem 70-78 år sammenlignet med patienter mellem 18-30 år. I 4S var 1.021 (23 %) af 4.444 patienter 65 år eller ældre. Den lipidsænkende effekt var mindst lige så stor hos ældre patienter sammenlignet med yngre patienter, og ZOCOR reducerede signifikant total mortalitet og CHD-dødelighed hos ældre patienter med en historie med CHD. I HPS var 52 % af patienterne ældre (4.891 patienter 65-69 år og 5.806 patienter 70 år eller ældre). De relative risikoreduktioner af CHD-død, ikke-fatal MI, koronare og ikke-koronare revaskulariseringsprocedurer og slagtilfælde var ens hos ældre og yngre patienter [se Kliniske Studier ]. I HPS var der blandt 32.145 patienter, der gik ind i den aktive indkøringsperiode, 2 tilfælde af myopati/rhabdomyolyse; disse patienter var i alderen 67 og 73. Ud af de 7 tilfælde af myopati/rhabdomyolyse blandt 10.269 patienter, der fik simvastatin, var 4 i alderen 65 år eller derover (ved baseline), hvoraf en var over 75. Der var ingen overordnede forskelle i sikkerhed mellem ældre og yngre patienter i enten 4S eller HPS.
Da fremskreden alder (≥65 år) er en disponerende faktor for myopati, herunder rabdomyolyse, bør ZOCOR 40 mg ordineres med forsigtighed til ældre. I et klinisk forsøg med patienter behandlet med simvastatin 80 mg/dag havde patienter ≥65 år en øget risiko for myopati, inklusive rhabdomyolyse, sammenlignet med patienter ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ]
Nedsat nyrefunktion
Der bør udvises forsigtighed, når ZOCOR 20 mg administreres til patienter med svært nedsat nyrefunktion.[Se DOSERING OG ADMINISTRATION ]
Nedsat leverfunktion
ZOCOR 10mg er kontraindiceret til patienter med aktiv leversygdom, som kan omfatte uforklarlige vedvarende stigninger i levertransaminaseniveauer [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ].
kinesiske patienter
I et klinisk forsøg, hvor patienter med høj risiko for kardiovaskulær sygdom blev behandlet med simvastatin 40 mg/dag (median opfølgning 3,9 år), var forekomsten af myopati ca. 0,05 % for ikke-kinesiske patienter (n=7367) sammenlignet med 0,24 % for kinesiske patienter (n=5468). Hyppigheden af myopati hos kinesiske patienter på simvastatin 40 mg/dag eller ezetimib/simvastatin 10/40 mg/dag samtidig administreret med forlænget frigivelse niacin 2 g/dag var 1,24 %.
Kinesiske patienter kan have højere risiko for myopati, overvåg patienterne passende. Samtidig administration af ZOCOR 10mg med lipid-modificerende doser (≥1 g/dag niacin) af niacinholdige produkter anbefales ikke til kinesiske patienter [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER ].
OVERDOSIS
Signifikant dødelighed blev observeret hos mus efter en enkelt oral dosis på 9 g/m2. Der blev ikke observeret tegn på dødelighed hos rotter eller hunde behandlet med doser på henholdsvis 30 og 100 g/m2. Ingen specifikke diagnostiske tegn blev observeret hos gnavere. Ved disse doser var de eneste tegn, der blev set hos hunde, emesis og slimet afføring.
Nogle få tilfælde af overdosering med ZOCOR er blevet rapporteret; den maksimale dosis, der blev taget, var 3,6 g. Alle patienter kom sig uden følgesygdomme. Støttende foranstaltninger bør træffes i tilfælde af en overdosis. Dialyserbarheden af simvastatin og dets metabolitter hos mennesker er ikke kendt på nuværende tidspunkt.
KONTRAINDIKATIONER
ZOCOR 40mg er kontraindiceret under følgende forhold:
- Samtidig administration af stærke CYP3A4-hæmmere (f.eks. itraconazol, ketoconazol, posaconazol, voriconazol, HIV-proteasehæmmere, boceprevir, telaprevir, erythromycin, clarithromycin, telithromycin, nefazodon og cobicistat-holdige produkter) ADVARSLER OG FORHOLDSREGLER ].
- Samtidig administration af gemfibrozil, cyclosporin eller danazol [se ADVARSLER OG FORHOLDSREGLER ].
- Overfølsomhed over for enhver komponent i denne medicin [se BIVIRKNINGER ].
- Aktiv leversygdom, som kan omfatte uforklarlige vedvarende stigninger i levertransaminaseniveauer [se ADVARSLER OG FORHOLDSREGLER ].
- Kvinder, der er gravide eller kan blive gravide. Serumkolesterol og triglycerider stiger under normal graviditet, og kolesterol eller kolesterolderivater er afgørende for fostrets udvikling. Fordi HMG-CoA-reduktasehæmmere (statiner) nedsætter kolesterolsyntesen og muligvis syntesen af andre biologisk aktive stoffer afledt af kolesterol, kan ZOCOR 40mg forårsage fosterskader, når det administreres til en gravid kvinde. Åreforkalkning er en kronisk proces, og seponering af lipidsænkende lægemidler under graviditet bør have ringe indflydelse på resultatet af langtidsbehandling af primær hyperkolesterolæmi. Der er ingen tilstrækkelige og velkontrollerede undersøgelser af brug med ZOCOR under graviditet; dog i sjældne rapporter blev medfødte anomalier observeret efter intrauterin eksponering for statiner. I reproduktionsstudier med rotter og kaniner afslørede simvastatin ingen tegn på teratogenicitet. ZOCOR bør kun administreres til kvinder i den fødedygtige alder, når det er højst usandsynligt, at sådanne patienter bliver gravide. Hvis patienten bliver gravid, mens du tager dette lægemiddel, skal ZOCOR seponeres øjeblikkeligt, og patienten skal informeres om den potentielle fare for fosteret [se Brug i specifikke populationer ].
- Ammende mødre. Det vides ikke, om simvastatin udskilles i modermælk; dog går en lille mængde af et andet lægemiddel i denne klasse over i modermælken. Da statiner har potentiale for alvorlige bivirkninger hos ammende spædbørn, bør kvinder, der har behov for behandling med ZOCOR, ikke amme deres spædbørn [se Brug i specifikke populationer ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Simvastatin er et prodrug og hydrolyseres til dets aktive β-hydroxysyreform, simvastatinsyre, efter administration. Simvastatin er en specifik hæmmer af 3-hydroxy-3-methylglutaryl-coenzym A (HMG-CoA) reduktase, enzymet, der katalyserer omdannelsen af HMG-CoA til mevalonat, et tidligt og hastighedsbegrænsende trin i den biosyntesevej for kolesterol. Derudover reducerer simvastatin VLDL og TG og øger HDL-C.
Farmakodynamik
Epidemiologiske undersøgelser har vist, at forhøjede niveauer af total-C, LDL-C samt nedsatte niveauer af HDL-C er forbundet med udviklingen af aterosklerose og øget kardiovaskulær risiko. Sænkning af LDL-C nedsætter denne risiko. Imidlertid er den uafhængige effekt af at hæve HDL-C eller sænke TG på risikoen for koronar og kardiovaskulær morbiditet og dødelighed ikke blevet bestemt.
Farmakokinetik
Simvastatin er en lacton, der let hydrolyseres in vivo til den tilsvarende β-hydroxysyre, en potent hæmmer af HMG-CoA-reduktase. Hæmning af HMG-CoA-reduktase er grundlaget for et assay i farmakokinetiske undersøgelser af β-hydroxysyremetabolitter (aktive hæmmere) og, efter basehydrolyse, aktive plus latente hæmmere (totale hæmmere) i plasma efter administration af simvastatin.
Efter en oral dosis af 14C-mærket simvastatin til mennesker blev 13 % af dosis udskilt i urinen og 60 % i fæces. Plasmakoncentrationer af total radioaktivitet (simvastatin plus 14C-metabolitter) toppede efter 4 timer og faldt hurtigt til ca. 10 % af maksimum 12 timer efter dosis. Da simvastatin gennemgår omfattende first-pass ekstraktion i leveren, er tilgængeligheden af lægemidlet til det generelle kredsløb lav (
Både simvastatin og dets β-hydroxysyremetabolit er stærkt bundet (ca. 95%) til humane plasmaproteiner. Rotteundersøgelser indikerer, at når radioaktivt mærket simvastatin blev administreret, krydsede simvastatinderiveret radioaktivitet blod-hjerne-barrieren.
De vigtigste aktive metabolitter af simvastatin til stede i humant plasma er β-hydroxysyren af simvastatin og dets 6'-hydroxy-, 6'-hydroxymethyl- og 6'-exomethylenderivater. Maksimal plasmakoncentration af både aktive og totale inhibitorer blev opnået inden for 1,3 til 2,4 timer efter dosis. Mens det anbefalede terapeutiske dosisområde er 5 til 40 mg/dag, var der ingen væsentlig afvigelse fra lineariteten af AUC for inhibitorer i det generelle kredsløb med en stigning i dosis til så høj som 120 mg. I forhold til fastetilstanden blev plasmaprofilen af inhibitorer ikke påvirket, når simvastatin blev administreret umiddelbart før en American Heart Association anbefalede fedtfattigt måltid.
en undersøgelse, der omfattede 16 ældre patienter mellem 70 og 78 år, som fik ZOCOR 40 mg/dag, var det gennemsnitlige plasmaniveau af HMG-CoA-reduktasehæmmende aktivitet øget med ca. 45 % sammenlignet med 18 patienter mellem 18-30 år. Erfaring fra kliniske undersøgelser hos ældre (n=1522) tyder på, at der ikke var nogen overordnede forskelle i sikkerhed mellem ældre og yngre patienter [se Brug i specifikke populationer ].
Kinetiske undersøgelser med et andet statin, der har en lignende primær eliminationsvej, har antydet, at der for et givet dosisniveau kan opnås højere systemisk eksponering hos patienter med svær nyreinsufficiens (målt ved kreatininclearance).
Simvastatinsyre er et substrat for transportproteinet OATP1B1. Samtidig administration af lægemidler, der hæmmer transportproteinet OATP1B1, kan føre til øgede plasmakoncentrationer af simvastatinsyre og en øget risiko for myopati. For eksempel har cyclosporin vist sig at øge AUC af statiner; Selvom mekanismen ikke er fuldt ud forstået, skyldes stigningen i AUC for simvastatinsyre formodentlig delvist hæmning af CYP3A4 og/eller OATP1B1.
Risikoen for myopati øges af høje niveauer af HMG-CoA-reduktasehæmmende aktivitet i plasma. Hæmmere af CYP3A4 kan hæve plasmaniveauerne af HMG-CoA-reduktasehæmmende aktivitet og øge risikoen for myopati [se ADVARSLER OG FORHOLDSREGLER og DRUGSINTERAKTIONER ].
et studie med 12 raske frivillige havde simvastatin i en dosis på 80 mg ingen effekt på metabolismen af probe cytochrom P450 isoform 3A4 (CYP3A4) substraterne midazolam og erythromycin. Dette indikerer, at simvastatin ikke er en hæmmer af CYP3A4, og derfor forventes det ikke at påvirke plasmaniveauerne af andre lægemidler, der metaboliseres af CYP3A4.
Samtidig administration af simvastatin (40 mg dagligt i 10 dage) resulterede i en stigning i de maksimale gennemsnitlige niveauer af kardioaktivt digoxin (givet som en enkelt 0,4 mg dosis på dag 10) med ca. 0,3 ng/ml.
Dyretoksikologi og/eller farmakologi
CNS toksicitet
Synsnervedegeneration blev set hos klinisk normale hunde behandlet med simvastatin i 14 uger ved 180 mg/kg/dag, en dosis, der producerede gennemsnitlige plasma-lægemiddelniveauer omkring 12 gange højere end det gennemsnitlige plasma-lægemiddelniveau hos mennesker, der tog 80 mg/dag.
Et kemisk lignende lægemiddel i denne klasse producerede også optisk nervedegeneration (Wallerian degeneration af retinogene fibre) hos klinisk normale hunde på en dosisafhængig måde startende ved 60 mg/kg/dag, en dosis, der producerede gennemsnitlige plasma-lægemiddelniveauer omkring 30 gange højere end det gennemsnitlige plasmalægemiddelniveau hos mennesker, der tager den højeste anbefalede dosis (målt ved total enzymhæmmende aktivitet). Det samme lægemiddel producerede også vestibulocochleær Wallerian-lignende degeneration og retinal ganglioncellekromatolyse hos hunde behandlet i 14 uger med 180 mg/kg/dag, en dosis, der resulterede i et gennemsnitligt plasmalægemiddelniveau svarende til det, der ses med 60 mg/kg/ dags dosis.
CNS vaskulære læsioner, karakteriseret ved perivaskulær blødning og ødem, mononukleær celleinfiltration af perivaskulære rum, perivaskulær fibrinaflejringer og nekrose af små kar blev set hos hunde behandlet med simvastatin i en dosis på 360 mg/kg/dag, en dosis der producerede gennemsnitlig plasma lægemiddelniveauer, der var omkring 14 gange højere end de gennemsnitlige plasmalægemiddelniveauer hos mennesker, der tog 80 mg/dag. Lignende CNS vaskulære læsioner er blevet observeret med flere andre lægemidler af denne klasse.
Der var grå stær hos hunrotter efter to års behandling med 50 og 100 mg/kg/dag (henholdsvis 22 og 25 gange den humane AUC ved 80 mg/dag) og hos hunde efter tre måneder med 90 mg/kg/dag ( 19 gange) og efter to år ved 50 mg/kg/dag (5 gange).
Kliniske Studier
Kliniske undersøgelser hos voksne
Reduktion af risikoen for CHD-dødelighed og kardiovaskulære hændelser
4S blev effekten af behandling med ZOCOR 20 mg på total dødelighed vurderet hos 4.444 patienter med CHD og baseline total kolesterol 212-309 mg/dL (5,5-8,0 mmol/L). I dette multicenter, randomiserede, dobbeltblindede, placebokontrollerede studie blev patienter behandlet med standardbehandling, inklusive diæt, og enten ZOCOR 20-40 mg/dag (n=2.221) eller placebo (n=2.223) i en median varighed på 5,4 år. I løbet af undersøgelsen førte behandling med ZOCOR til gennemsnitlige reduktioner i total-C, LDL-C og TG på henholdsvis 25%, 35% og 10% og en gennemsnitlig stigning i HDL-C på 8%. ZOCOR reducerede signifikant risikoen for dødelighed med 30 % (p=0,0003, 182 dødsfald i ZOCOR 40 mg-gruppen mod 256 dødsfald i placebogruppen). Risikoen for CHD-dødelighed blev signifikant reduceret med 42 % (p=0,00001, 111 vs. 189 dødsfald). Der var ingen statistisk signifikant forskel mellem grupperne i ikke-kardiovaskulær dødelighed. ZOCOR reducerede signifikant risikoen for at få større koronare hændelser (CHD-dødelighed plus hospitalsverificeret og stille ikke-dødelig myokardieinfarkt [MI]) med 34 % (p
Hjertebeskyttelsesundersøgelsen (HPS) var et stort, multicenter, placebokontrolleret, dobbeltblindt studie med en gennemsnitlig varighed på 5 år udført i 20.536 patienter (10.269 på ZOCOR 40 mg og 10.267 på placebo). Patienterne blev allokeret til behandling ved hjælp af en kovariat adaptiv metode3, som tog hensyn til fordelingen af 10 vigtige baseline-karakteristika for patienter, der allerede var indskrevet og minimerede ubalancen af disse karakteristika på tværs af grupperne. Patienterne havde en gennemsnitsalder på 64 år (interval 40-80 år), var 97 % kaukasiske og havde høj risiko for at udvikle en større koronar hændelse på grund af eksisterende CHD (65 %), diabetes (type 2, 26 %; Type 1 , 3%), anamnese med slagtilfælde eller anden cerebrovaskulær sygdom (16%), perifer karsygdom (33%) eller hypertension hos mænd ≥65 år (6%). Ved baseline havde 3.421 patienter (17%) LDL-C-niveauer under 100 mg/dL, hvoraf 953 (5%) havde LDL-C-niveauer under 80 mg/dL; 7.068 patienter (34%) havde niveauer mellem 100 og 130 mg/dL; og 10.047 patienter (49 %) havde niveauer over 130 mg/dL.
DR Taves, minimering: en ny metode til at inddele patienter i behandlings- og kontrolgrupper. Clin. Pharmacol. Ther. 15 (1974), s. 443-453
HPS-resultaterne viste, at ZOCOR 40 mg/dag signifikant reducerede: total- og CHD-dødelighed; ikke-fatale MI, slagtilfælde og revaskulariseringsprocedurer (koronar og ikke-koronar) (se tabel 4).
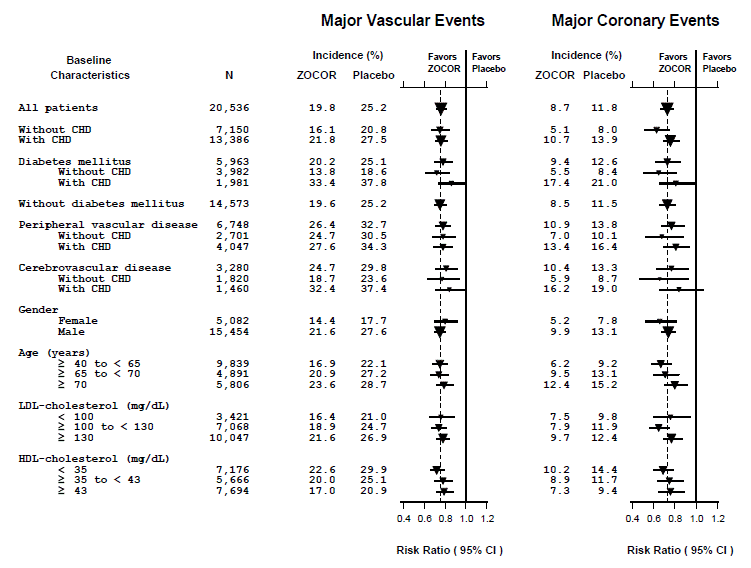
To sammensatte endepunkter blev defineret for at have tilstrækkelige hændelser til at vurdere relative risikoreduktioner på tværs af en række baseline-karakteristika (se figur 1). En sammensætning af større koronare hændelser (MCE) bestod af CHD-dødelighed og ikke-dødelig MI (analyseret efter tid til første hændelse; 898 patienter behandlet med ZOCOR 5 mg havde hændelser og 1.212 patienter på placebo havde hændelser). En sammensætning af større vaskulære hændelser (MVE) bestod af MCE, slagtilfælde og revaskulariseringsprocedurer inklusive koronare, perifere og andre ikke-koronare procedurer (analyseret efter tid til første hændelse; 2.033 patienter behandlet med ZOCOR 10 mg havde hændelser og 2.585 patienter på placebo havde hændelser). Signifikante relative risikoreduktioner blev observeret for begge sammensatte endepunkter (27 % for MCE og 24 % for MVE, p
Figur 1 Effekterne af behandling med ZOCOR 5mg på større vaskulære hændelser og større koronare hændelser i HPS
Angiografiske studier
I Multicenter Anti-Atheroma Studiet blev effekten af simvastatin på åreforkalkning vurderet ved kvantitativ koronar angiografi hos hyperkolesterolæmiske patienter med CHD. I denne randomiserede, dobbeltblindede, kontrollerede undersøgelse blev patienterne behandlet med simvastatin 20 mg/dag eller placebo. Angiogrammer blev evalueret ved baseline, to og fire år. De co-primære undersøgelses endepunkter var gennemsnitlig ændring pr. patient i minimale og gennemsnitlige lumendiametre, hvilket indikerer henholdsvis fokal og diffus sygdom. ZOCOR sænkede signifikant progressionen af læsioner målt i år 4-angiogrammet ved begge parametre såvel som ved ændring i procentdiameterstenose. Derudover reducerede simvastatin signifikant andelen af patienter med nye læsioner og med nye totale okklusioner.
Ændringer af lipidprofiler
Primær hyperlipidæmi (Fredrickson type lla og llb)
ZOCOR har vist sig at være effektiv til at reducere total-C og LDL-C i heterozygote familiære og ikke-familiære former for hyperlipidæmi og ved blandet hyperlipidæmi. Maksimal til næsten maksimal respons opnås generelt inden for 4-6 uger og opretholdes under kronisk behandling. ZOCOR reducerede signifikant total-C, LDL-C, total-C/HDL-C ratio og LDL-C/HDL-C ratio; ZOCOR reducerede også TG og øgede HDL-C (se tabel 5).
Hypertriglyceridæmi (Fredrickson Type lV)
Resultaterne af en undergruppeanalyse hos 74 patienter med type lV-hyperlipidæmi fra en 130-patienter, dobbeltblind, placebokontrolleret, 3-perioders crossover-undersøgelse er vist i tabel 6.
Dysbetalipoproteinæmi (Fredrickson Type III)
Resultaterne af en undergruppeanalyse hos 7 patienter med type lll hyperlipidæmi (dysbetalipoproteinæmi) (apo E2/2) (VLDL-C/TG>0,25) fra et 130-patienter, dobbeltblindt, placebokontrolleret, 3-perioders crossover-studie er vist i tabel 7.
Homozygot familiær hyperkolesterolæmi
I et kontrolleret klinisk studie fik 12 patienter i alderen 15-39 år med homozygot familiær hyperkolesterolæmi simvastatin 40 mg/dag i en enkelt dosis eller i 3 opdelte doser eller 80 mg/dag i 3 opdelte doser. Hos 11 patienter med reduktioner i LDL-C var de gennemsnitlige LDL-C-ændringer for 40 og 80 mg doser 14 % (interval 8 % til 23 %, median 12 %) og 30 % (interval 14 % til 46 % , henholdsvis median 29 %). En patient havde en stigning på 15 % i LDL-C. En anden patient med manglende LDL-C-receptorfunktion havde en LDL-C-reduktion på 41 % med 80 mg dosis.
Endokrin funktion
kliniske undersøgelser nedsatte simvastatin ikke binyrereserven eller reducerede den basale plasmakortisolkoncentration signifikant. Små reduktioner fra baseline i basal plasmatestosteron hos mænd blev observeret i kliniske undersøgelser med simvastatin, en effekt, der også blev observeret med andre statiner og galdesyrebinderen kolestyramin. Der var ingen effekt på plasmagonadotropinniveauer. I et placebokontrolleret, 12-ugers studie var der ingen signifikant effekt af simvastatin 80 mg på plasmatestosteronresponset på humant choriongonadotropin. I et andet 24-ugers studie havde simvastatin 20-40 mg ingen påviselig effekt på spermatogenesen. I 4S, hvor 4.444 patienter blev randomiseret til simvastatin 20-40 mg/dag eller placebo i en median varighed på 5,4 år, var forekomsten af seksuelle bivirkninger hos mænd i de to behandlingsgrupper ikke signifikant forskellig. På grund af disse faktorer er det usandsynligt, at de små ændringer i plasma testosteron er klinisk signifikante. Virkningerne, hvis nogen, på hypofyse-gonadeaksen hos præmenopausale kvinder er ukendte.
Kliniske undersøgelser hos unge
I et dobbeltblindt, placebokontrolleret studie blev 175 patienter (99 unge drenge og 76 postmenarkalske piger) i alderen 10-17 år (gennemsnitsalder 14,1 år) med heterozygot familiær hyperkolesterolæmi (HeFH) randomiseret til simvastatin (n= 106) eller placebo (n=67) i 24 uger (basisundersøgelse). Inkludering i undersøgelsen krævede et baseline LDL-C-niveau mellem 160 og 400 mg/dL og mindst én forælder med et LDL-C-niveau >189 mg/dL. Doseringen af simvastatin (en gang dagligt om aftenen) var 10 mg i de første 8 uger, 20 mg i de anden 8 uger og 40 mg derefter. I en forlængelse på 24 uger valgte 144 patienter at fortsætte behandlingen med simvastatin 40 mg eller placebo.
ZOCOR 20 mg reducerede signifikant plasmaniveauer af total-C, LDL-C og Apo B (se tabel 8). Resultaterne fra forlængelsen efter 48 uger var sammenlignelige med dem, der blev observeret i basisstudiet.
Efter 24 ugers behandling var den gennemsnitlige opnåede LDL-C-værdi 124,9 mg/dL (interval: 64,0289,0 mg/dL) i ZOCOR 40 mg-gruppen sammenlignet med 207,8 mg/dL (interval: 128,0-334,0 mg/dL) i placebogruppen.
Sikkerheden og effekten af doser over 40 mg dagligt er ikke blevet undersøgt hos børn med HeFH. Den langsigtede effekt af simvastatinbehandling i barndommen til at reducere morbiditet og dødelighed i voksenalderen er ikke blevet fastlagt.
PATIENTOPLYSNINGER
Patienter bør rådes til at følge deres anbefalede diæt i deres National Cholesterol Education Program (NCEP), et regelmæssigt træningsprogram og periodisk test af et fastende lipidpanel.
Patienter bør informeres om stoffer, de ikke bør tage samtidig med simvastatin [se KONTRAINDIKATIONER og ADVARSLER OG FORHOLDSREGLER ]. Patienter bør også rådes til at informere andet sundhedspersonale, der ordinerer en ny medicin eller øger dosen af en eksisterende medicin, at de tager ZOCOR.
Muskelsmerter
Alle patienter, der starter behandling med ZOCOR, skal informeres om risikoen for myopati, inklusive rhabdomyolyse, og informeres om straks at rapportere enhver uforklarlig muskelsmerte, ømhed eller svaghed, især hvis de ledsages af utilpashed eller feber, eller hvis disse muskeltegn eller symptomer fortsætter efter ophør med ZOCOR. Patienter, der bruger en dosis på 80 mg, skal informeres om, at risikoen for myopati, herunder rabdomyolyse, øges ved brug af dosis på 80 mg. Risikoen for myopati, herunder rhabdomyolyse, der opstår ved brug af ZOCOR 40 mg, er øget, når du tager visse typer medicin eller indtager grapefrugtjuice. Patienter bør diskutere al medicin, både receptpligtig og i håndkøb, med deres sundhedspersonale.
Leverenzymer
Det anbefales, at der udføres leverfunktionsprøver før påbegyndelse af ZOCOR 20 mg og derefter, når det er klinisk indiceret. Alle patienter, der behandles med ZOCOR, bør rådes til straks at rapportere symptomer, der kan indikere leverskade, herunder træthed, anoreksi, ubehag i højre øvre del af maven, mørk urin eller gulsot.
Graviditet
Kvinder i den fødedygtige alder bør rådes til at bruge en effektiv præventionsmetode for at forhindre graviditet, mens de bruger ZOCOR. Diskuter fremtidige graviditetsplaner med dine patienter, og diskuter, hvornår de skal stoppe med at tage ZOCOR 40 mg, hvis de forsøger at blive gravide. Patienter skal informeres om, at hvis de bliver gravide, skal de stoppe med at tage ZOCOR og ringe til deres sundhedspersonale.
Amning
Kvinder, der ammer, bør ikke bruge ZOCOR. Patienter, der har en lipidforstyrrelse og ammer, bør rådes til at diskutere mulighederne med deres sundhedspersonale.
