Tricor 160mg, 200mg Fenofibrate Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Tricor, og hvordan bruges det?
Tricor er et receptpligtigt lægemiddel, der bruges til at reducere symptomer på kolesterol og triglycerider (fedtsyrer) i blodet. Tricor kan bruges alene eller sammen med anden medicin.
- Tricor tilhører en klasse af lægemidler kaldet Fibric Acid Agents.
- Det vides ikke, om Tricor 200mg er sikkert og effektivt til børn
Hvad er de mulige bivirkninger af Tricor?
Tricor 200mg kan forårsage alvorlige bivirkninger, herunder:
- skarpe mavesmerter spreder sig til din ryg eller skulderblad,
- mistet appetiten,
- mavesmerter efter blot at have spist,
- gulfarvning af huden eller øjnene (gulsot),
- feber,
- kuldegysninger,
- svaghed,
- ondt i halsen,
- sår i munden,
- usædvanlige blå mærker eller blødninger,
- brystsmerter,
- pludselig hoste,
- hvæsen,
- hurtig vejrtrækning,
- hoste blod op, og
- hævelse, varme eller rødme i en arm eller et ben
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Tricor omfatter:
- løbende næse,
- nysen, og
- unormale laboratorieprøver
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Tricor. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
TRICOR (fenofibrat tabletter), er et lipidregulerende middel, der fås som tabletter til oral administration. Hver tablet indeholder 54 mg eller 160 mg fenofibrat. Det kemiske navn for fenofibrat er 2-[4-(4-chlorbenzoyl)phenoxy]-2-methylpropansyre, 1-methylethylester med følgende strukturformel:
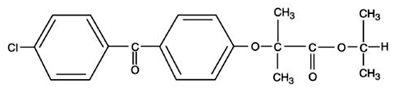
Den empiriske formel er C20H21O4Cl og molekylvægten er 360,83; fenofibrat er uopløseligt i vand. Smeltepunktet er 79-82°C. Fenofibrat er et hvidt fast stof, som er stabilt under almindelige forhold.
inaktive ingredienser
Hver tablet indeholder kolloid siliciumdioxid, crospovidon, lactosemonohydrat, lecithin, mikrokrystallinsk cellulose, polyvinylalkohol, povidon, natriumlaurylsulfat, natriumstearylfumarat, talkum, titaniumdioxid og xanthangummi. Derudover indeholder 54 mg individuelle tabletter D&C Yellow No. 10, FD&C Yellow No. 6, FD&C Blue No. 2.
INDIKATIONER
Primær hyperkolesterolæmi eller blandet dyslipidæmi
TRICOR er indiceret som supplerende terapi til diæt for at reducere forhøjet low-density lipoprotein kolesterol (LDL-C), total kolesterol (Total-C), triglycerider og apolipoprotein B (Apo B) og for at øge high-density lipoprotein kolesterol (HDL-) C) hos voksne patienter med primær hyperkolesterolæmi eller blandet dyslipidæmi.
Alvorlig hypertriglyceridæmi
TRICOR 200mg er også indiceret som supplerende terapi til diæt til behandling af voksne patienter med svær hypertriglyceridæmi. Forbedring af den glykæmiske kontrol hos diabetespatienter, der udviser fastende chylomikronæmi, vil normalt undgå behovet for farmakologisk intervention.
Markant forhøjede niveauer af serumtriglycerider (f.eks. > 2.000 mg/dL) kan øge risikoen for at udvikle pancreatitis. Effekten af fenofibratbehandling på at reducere denne risiko er ikke blevet tilstrækkeligt undersøgt.
Vigtige brugsbegrænsninger
Fenofibrat i en dosis svarende til 145 mg TRICOR blev ikke vist at reducere koronar hjertesygdom morbiditet og dødelighed i et stort, randomiseret kontrolleret forsøg med patienter med type 2 diabetes mellitus [se ADVARSLER OG FORHOLDSREGLER ].
DOSERING OG ADMINISTRATION
Generelle betragtninger
Patienter bør placeres på en passende lipidsænkende diæt, før de får TRICOR 160 mg, og bør fortsætte denne diæt under behandling med TRICOR. TRICOR tabletter kan gives uden hensyntagen til måltider.
Den indledende behandling for dyslipidæmi er diætterapi, der er specifik for typen af lipoproteinabnormitet. Overskydende kropsvægt og overdreven alkoholindtagelse kan være vigtige faktorer i hypertriglyceridæmi og bør behandles før enhver medikamentel behandling. Fysisk træning kan være en vigtig hjælpeforanstaltning. Sygdomme, der er medvirkende til hyperlipidæmi, såsom hypothyroidisme eller diabetes mellitus, bør ledes efter og behandles tilstrækkeligt. Østrogenbehandling, thiaziddiuretika og betablokkere er nogle gange forbundet med massive stigninger i plasmatriglycerider, især hos personer med familiær hypertriglyceridæmi. I sådanne tilfælde kan seponering af det specifikke ætiologiske middel undgå behovet for specifik lægemiddelbehandling af hypertriglyceridæmi.
Lipidniveauer bør overvåges med jævne mellemrum, og det bør overvejes at reducere dosis af TRICOR, hvis lipidniveauerne falder væsentligt under det tilsigtede område.
Behandlingen bør seponeres hos patienter, som ikke har tilstrækkelig respons efter to måneders behandling med den maksimalt anbefalede dosis på 145 mg én gang dagligt.
Primær hyperkolesterolæmi eller blandet dyslipidæmi
Startdosis af TRICOR 200 mg er 145 mg én gang dagligt.
Alvorlig hypertriglyceridæmi
Startdosis er 48 til 145 mg dagligt. Dosis bør individualiseres i henhold til patientens respons og bør justeres om nødvendigt efter gentagne lipidbestemmelser med 4 til 8 ugers intervaller. Den maksimale dosis er 145 mg én gang dagligt.
Nedsat nyrefunktion
Behandling med TRICOR 200 mg bør påbegyndes med en dosis på 48 mg dagligt hos patienter med let til moderat nedsat nyrefunktion, og bør kun øges efter evaluering af virkningen på nyrefunktionen og lipidniveauer ved denne dosis. Brugen af TRICOR bør undgås til patienter med svært nedsat nyrefunktion [se Brug i specifikke populationer og KLINISK FARMAKOLOGI ].
Geriatriske patienter
Dosisvalg til ældre bør foretages på baggrund af nyrefunktionen [se Brug i specifikke populationer ].
HVORDAN LEVERET
Doseringsformer og styrker
- 48 mg gule tabletter, præget med kode-identifikationsbogstaverne "FI".
- 48 mg gule tabletter, præget med "a"-logoet og kode-identifikationsbogstaver "FI".
- 145 mg hvide tabletter, præget med kode-identifikationsbogstaverne "FO".
- 145 mg hvide tabletter, præget med "a"-logoet og kode-identifikationsbogstaver "FO".
Opbevaring og håndtering
TRICOR® (fenofibrat tabletter) fås i to styrker:
48 mg
Gule tabletter, præget med kode-identifikationsbogstaverne "FI", fås i flasker med 90 ( NDC 0074-3173-90).
Gule tabletter, præget med "a"-logoet og kodeidentifikationsbogstaver "FI", fås i flasker med 90 ( NDC 0074-6122-90).
145 mg
Hvide tabletter, præget med kode-identifikationsbogstaverne "FO", fås i flasker med 90 ( NDC 0074-3189-90).
Hvide tabletter, præget med "a"-logoet og kodeidentifikationsbogstaver "FO", fås i flasker med 90 ( NDC 0074-6123-90).
Opbevaring
Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F).
[Se USP-styret rumtemperatur]. Opbevares utilgængeligt for børn. Beskyt mod fugt.
Fremstillet for AbbVie Inc., North Chicago, IL 60064, USA af Fournier Laboratories Ireland Limited, Anngrove, Carrigtwohill Co. Cork, Irland. Revideret: Marts 2021
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andetsteds i mærkningen:
- Mortalitet og morbiditet i koronar hjertesygdom [se ADVARSLER OG FORHOLDSREGLER ]
- Hepatoksicitet [se ADVARSLER OG FORHOLDSREGLER ]
- Pancreatitis [se ADVARSLER OG FORHOLDSREGLER ]
- Overfølsomhedsreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
- Venotromboembolisk sygdom [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i praksis.
Bivirkninger rapporteret af 2 % eller flere af patienter behandlet med fenofibrat (og mere end placebo) under de dobbeltblindede, placebokontrollerede forsøg, uanset årsagssammenhæng, er anført i tabel 1 nedenfor. Bivirkninger førte til seponering af behandlingen hos 5,0 % af patienterne behandlet med fenofibrat og hos 3,0 % behandlet med placebo. Forøgelser i leverfunktionsprøver var de hyppigste hændelser, der forårsagede seponering af fenofibratbehandling hos 1,6 % af patienterne i dobbeltblindede forsøg.
Nældefeber blev set hos 1,1 % vs. 0 % og udslæt hos 1,4 % vs. 0,8 % af henholdsvis fenofibrat- og placebopatienter i kontrollerede forsøg.
Stigning i leverenzymer
I en samlet analyse af 10 placebokontrollerede forsøg forekom stigninger til > 3 gange den øvre grænse for normal i ALAT hos 5,3 % af patienterne, der fik fenofibrat i doser svarende til 96 mg til 145 mg TRICOR dagligt versus 1,1 % af patienterne behandlet med placebo [se ADVARSLER OG FORHOLDSREGLER ]. I en 8-ugers undersøgelse var forekomsten af ALAT- eller ASAT-stigninger ≥ 3 gange den øvre normalgrænse 13 % hos patienter, der modtog doser svarende til 96 mg til 145 mg TRICOR dagligt og var 0 % hos dem, der fik doser svarende til 48 mg. eller mindre TRICOR dagligt eller placebo.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under anvendelse af fenofibrat efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering: myalgi, rhabdomyolyse, pancreatitis, akut nyresvigt, muskelspasmer, hepatitis, cirrhose, øget total bilirubin, anæmi, artralgi, fald i hæmoglobin, fald i hæmatokrit, fald i hvide blodlegemer, asteni, alvorligt nedsatte HDL-kolesterolniveauer og interstitiel lungesygdom. Fotosensitivitetsreaktioner er opstået dage til måneder efter påbegyndelse; i nogle af disse tilfælde rapporterede patienter en tidligere lysfølsomhedsreaktion over for ketoprofen.
DRUGSINTERAKTIONER
Coumarin antikoagulantia
Potentiering af antikoagulerende virkninger af coumarin-typen er blevet observeret ved forlængelse af PT/INR.
Der bør udvises forsigtighed, når coumarinantikoagulantia gives sammen med TRICOR. Doseringen af antikoagulantia bør reduceres for at opretholde PT/INR på det ønskede niveau for at forhindre blødningskomplikationer. Hyppige PT/INR-bestemmelser er tilrådeligt, indtil det med sikkerhed er fastslået, at PT/INR er stabiliseret [se ADVARSLER OG FORHOLDSREGLER ].
Immunsuppressiva
Immunsuppressiva såsom cyclosporin og tacrolimus kan producere nefrotoksicitet med fald i kreatininclearance og stigninger i serumkreatinin, og fordi nyreudskillelse er den primære eliminationsvej for fibratlægemidler, herunder TRICOR, er der risiko for, at en interaktion vil føre til forringelse af nyrefunktionen. Fordelene og risiciene ved at bruge TRICOR (fenofibrat-tabletter) sammen med immunsuppressiva og andre potentielt nefrotoksiske midler bør overvejes nøje, og den laveste effektive dosis, der anvendes, og nyrefunktionen skal overvåges.
Galdesyrebindende harpikser
Da galdesyrebindende harpikser kan binde andre lægemidler givet samtidig, bør patienter tage TRICOR 200 mg mindst 1 time før eller 4 til 6 timer efter en galdesyrebindende harpiks for at undgå at hæmme dets absorption.
Colchicin
Tilfælde af myopati, herunder rhabdomyolyse, er blevet rapporteret med fenofibrat administreret sammen med colchicin, og der bør udvises forsigtighed ved ordinering af fenofibrat med colchicin.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Mortalitet og koronar hjertesygdom Sygelighed
Effekten af TRICOR 160 mg på morbiditet og mortalitet i koronar hjertesygdom og ikke-kardiovaskulær mortalitet er ikke blevet fastlagt.
The Action to Control Cardiovascular Risk in Diabetes Lipid (ACCORD Lipid)-forsøg var et randomiseret placebo-kontrolleret studie af 5518 patienter med type 2-diabetes mellitus i baggrundsbehandling med statin behandlet med fenofibrat. Den gennemsnitlige varighed af opfølgningen var 4,7 år. Fenofibrat plus statin kombinationsbehandling viste en ikke-signifikant 8 % relativ risikoreduktion i det primære resultat af alvorlige kardiovaskulære hændelser (MACE), en sammensætning af ikke-dødelig myokardieinfarkt, ikke-dødelig slagtilfælde og dødsfald ved hjertekarsygdom (hazard ratio [hazard ratio] HR] 0,92, 95 % CI 0,79-1,08) (p=0,32) sammenlignet med statin monoterapi. I en kønsundergruppeanalyse var hazard ratio for MACE hos mænd, der fik kombinationsbehandling versus statin monoterapi, 0,82 (95 % CI 0,69-0,99), og hazard ratio for MACE hos kvinder, der fik kombinationsbehandling versus statin monoterapi, var 1,38 (95 % CI) 0,98-1,94) (interaktion p=0,01). Den kliniske betydning af dette undergruppefund er uklar.
Fenofibrat-intervention og hændelsessænkning ved diabetes (FIELD)-undersøgelsen var et 5-årigt randomiseret, placebokontrolleret studie af 9795 patienter med type 2-diabetes mellitus behandlet med fenofibrat. Fenofibrat viste en ikke-signifikant 11 % relativ reduktion i det primære resultat af koronar hjertesygdom (hazard ratio [HR] 0,89, 95 % CI 0,75-1,05, p=0,16) og en signifikant 11 % reduktion i det sekundære resultat af det samlede resultat kardiovaskulære sygdomsbegivenheder (HR 0,89 [0,80-0,99], p=0,04). Der var en ikke-signifikant stigning på 11 % (HR 1,11 [0,95, 1,29], p=0,18) og 19 % (HR 1,19 [0,90, 1,57], p=0,22) i henholdsvis total og koronar hjertesygdomsdødelighed med fenofibrat sammenlignet med placebo.
På grund af kemiske, farmakologiske og kliniske ligheder mellem TRICOR (fenofibrat-tabletter), clofibrat og gemfibrozil, kan de negative resultater i 4 store randomiserede, placebokontrollerede kliniske undersøgelser med disse andre fibratlægemidler også gælde for TRICOR.
Coronary Drug Project, en stor undersøgelse af post myokardieinfarkt hos patienter behandlet i 5 år med clofibrat, var der ingen forskel i dødelighed set mellem clofibratgruppen og placebogruppen. Der var dog en forskel i hyppigheden af kolelithiasis og kolecystitis, der krævede operation mellem de to grupper (3,0 % mod 1,8 %).
en undersøgelse udført af Verdenssundhedsorganisationen (WHO) blev 5000 forsøgspersoner uden kendt koronararteriesygdom behandlet med placebo eller clofibrat i 5 år og fulgt i yderligere et år. Der var en statistisk signifikant, højere alderskorrigeret dødelighed af alle årsager i clofibratgruppen sammenlignet med placebogruppen (5,70 % vs. 3,96 %, p =
Helsinki Heart Study var en stor (n=4081) undersøgelse af midaldrende mænd uden en historie med koronararteriesygdom. Forsøgspersonerne fik enten placebo eller gemfibrozil i 5 år, med en 3,5 års åben forlængelse efterfølgende. Den samlede dødelighed var numerisk højere i randomiseringsgruppen med gemfibrozil, men opnåede ikke statistisk signifikans (p = 0,19, 95 % konfidensinterval for relativ risiko G:P = 0,91-1,64). Selvom kræftdødsfald havde en højere tendens i gemfibrozil-gruppen (p = 0,11), blev kræftformer (eksklusive basalcellekarcinom) diagnosticeret med samme hyppighed i begge undersøgelsesgrupper. På grund af undersøgelsens begrænsede størrelse blev den relative risiko for død uanset årsag ikke vist at være anderledes end den, der ses i 9 års opfølgningsdata fra Verdenssundhedsorganisationens undersøgelse (RR=1,29).
En sekundær forebyggelseskomponent i Helsinki Heart Study indskrev midaldrende mænd, der blev udelukket fra den primære forebyggelsesundersøgelse på grund af kendt eller mistænkt koronar hjertesygdom. Forsøgspersonerne fik gemfibrozil eller placebo i 5 år. Selvom hjertedødsfald havde en højere tendens i gemfibrozil-gruppen, var dette ikke statistisk signifikant (hazard ratio 2,2, 95 % konfidensinterval: 0,94-5,05). Hyppigheden af galdeblærekirurgi var ikke statistisk signifikant mellem undersøgelsesgrupperne, men havde en højere tendens i gemfibrozil-gruppen (1,9 % vs. 0,3 %, p = 0,07).
Hepatotoksicitet
Alvorlig lægemiddelinduceret leverskade (DILI), inklusive levertransplantation og død, er blevet rapporteret efter markedsføring med TRICOR. DILI er blevet rapporteret inden for de første par uger af behandlingen eller efter flere måneders behandling og er i nogle tilfælde vendt med seponering af TRICOR 200 mg behandling. Patienter med DILI har oplevet tegn og symptomer, herunder mørk urin, unormal afføring, gulsot, utilpashed, mavesmerter, myalgi, vægttab, kløe og kvalme. Mange patienter havde samtidige forhøjelser af total bilirubin, serumalanintransaminase (ALT) og aspartattransaminase (AST). DILI er blevet karakteriseret som hepatocellulær, kronisk aktiv og kolestatisk hepatitis, og cirrose er opstået i forbindelse med kronisk aktiv hepatitis.
I kliniske forsøg er fenofibrat i doser svarende til 96 mg til 145 mg TRICOR 160 mg dagligt blevet forbundet med stigninger i serum ASAT eller ALAT. Hyppigheden af stigninger i transaminaser kan være dosisrelateret [se BIVIRKNINGER ].
TRICOR 160mg er kontraindiceret til patienter med aktiv leversygdom, inklusive dem med primær galdecirrhose og uforklarlige vedvarende leverfunktionsabnormiteter [se KONTRAINDIKATIONER ]. Overvåg patientens leverfunktion, inklusive serum ALT, ASAT og total bilirubin, ved baseline og periodisk under behandlingen med TRICOR. Seponer TRICOR 200 mg, hvis der udvikles tegn eller symptomer på leverskade, eller hvis forhøjede enzymniveauer fortsætter (ALT eller AST > 3 gange den øvre grænse for normal, eller hvis det ledsages af forhøjet bilirubin). Genstart ikke TRICOR 160mg hos disse patienter, hvis der ikke er nogen alternativ forklaring på leverskaden.
Myopati og rabdomyolyse
Fibrater øger risikoen for myopati og er blevet forbundet med rabdomyolyse. Risikoen for alvorlig muskeltoksicitet ser ud til at være øget hos ældre patienter og hos patienter med diabetes, nyreinsufficiens eller hypothyroidisme.
Myopati bør overvejes hos enhver patient med diffus myalgi, muskelømhed eller -svaghed og/eller markante forhøjelser af kreatinfosfokinase-niveauer (CPK).
Patienter bør rådes til straks at rapportere uforklarlige muskelsmerter, ømhed eller svaghed, især hvis de ledsages af utilpashed eller feber. CPK-niveauer bør vurderes hos patienter, der rapporterer disse symptomer, og behandling med TRICOR 200 mg bør seponeres, hvis der opstår markant forhøjede CPK-niveauer, eller hvis der er mistanke om eller diagnosticeret myopati/myositis.
Data fra observationsstudier indikerer, at risikoen for rabdomyolyse øges, når fibrater, især gemfibrozil, administreres sammen med et statin. Kombinationen bør undgås, medmindre fordelen ved yderligere ændringer i lipidniveauer sandsynligvis vil opveje den øgede risiko ved denne lægemiddelkombination [se KLINISK FARMAKOLOGI ].
Tilfælde af myopati, herunder rhabdomyolyse, er blevet rapporteret med fenofibrat administreret sammen med colchicin, og der bør udvises forsigtighed ved ordinering af fenofibrat med colchicin [se DRUGSINTERAKTIONER ].
Serum kreatinin
Forhøjelser i serumkreatinin er blevet rapporteret hos patienter på fenofibrat. Disse stigninger har en tendens til at vende tilbage til baseline efter seponering af fenofibrat. Den kliniske betydning af disse observationer er ukendt. Overvåg nyrefunktionen hos patienter med nedsat nyrefunktion, der tager TRICOR. Nyremonitorering bør også overvejes for patienter, der tager TRICOR med risiko for nyreinsufficiens, såsom ældre og patienter med diabetes.
Kolelithiasis
Fenofibrat kan ligesom clofibrat og gemfibrozil øge kolesteroludskillelsen i galden, hvilket fører til kolelithiasis. Hvis der er mistanke om kolelithiasis, er galdeblæreundersøgelser indiceret. Behandling med TRICOR 160 mg bør seponeres, hvis der konstateres galdesten.

Coumarin antikoagulantia
Der bør udvises forsigtighed, når coumarin-antikoagulantia gives sammen med TRICOR 160 mg på grund af forstærkningen af coumarin-type antikoagulerende virkninger ved at forlænge protrombintid/internationalt normaliseret forhold (PT/INR). For at forhindre blødningskomplikationer anbefales hyppig monitorering af PT/INR og dosisjustering af antikoagulanten, indtil PT/INR er stabiliseret [se DRUGSINTERAKTIONER ].
Pancreatitis
Pancreatitis er blevet rapporteret hos patienter, der tager fenofibrat, gemfibrozil og clofibrat. Denne forekomst kan repræsentere en svigtende virkning hos patienter med svær hypertriglyceridæmi, en direkte lægemiddeleffekt eller et sekundært fænomen medieret gennem galdevejssten eller slamdannelse med obstruktion af den fælles galdegang.
Hæmatologiske ændringer
Milde til moderate fald i hæmoglobin, hæmatokrit og hvide blodlegemer er blevet observeret hos patienter efter påbegyndelse af fenofibratbehandling. Disse niveauer stabiliseres dog under langvarig administration. Trombocytopeni og agranulocytose er blevet rapporteret hos personer behandlet med fenofibrat. Periodisk monitorering af røde og hvide blodlegemer anbefales i løbet af de første 12 måneder af TRICOR administration.
Overfølsomhedsreaktioner
Akut overfølsomhed
Anafylaksi og angioødem er blevet rapporteret efter markedsføring med fenofibrat. I nogle tilfælde var reaktionerne livstruende og krævede akut behandling. Hvis en patient udvikler tegn eller symptomer på en akut overfølsomhedsreaktion, rådes vedkommende til omgående at søge lægehjælp og seponere fenofibrat.
Forsinket overfølsomhed
Alvorlige kutane bivirkninger (SCAR), inklusive Stevens-Johnsons syndrom, toksisk epidermal nekrolyse og lægemiddelreaktion med eosinofili og systemiske symptomer (DRESS), er blevet rapporteret efter markedsføring, som optræder dage til uger efter påbegyndelse af fenofibrat. Tilfældene af DRESS var forbundet med kutane reaktioner (såsom udslæt eller eksfoliativ dermatitis) og en kombination af eosinofili, feber, systemisk organpåvirkning (nyre-, lever- eller respiratorisk). Afbryd fenofibrat og behandl patienterne passende, hvis der er mistanke om SCAR.
Venotromboembolisk sygdom
FIELD-forsøget blev lungeemboli (PE) og dyb venetrombose (DVT) observeret i højere frekvenser i fenofibrat- end den placebobehandlede gruppe. Ud af 9.795 patienter inkluderet i FIELD var der 4.900 i placebogruppen og 4.895 i fenofibratgruppen. For DVT var der 48 hændelser (1%) i placebogruppen og 67 (1%) i fenofibratgruppen (p = 0,074); og for PE var der 32 (0,7 %) hændelser i placebogruppen og 53 (1 %) i fenofibratgruppen (p = 0,022).
I Coronary Drug Project oplevede en højere andel af clofibratgruppen sikker eller formodet dødelig eller ikke-dødelig lungeemboli eller tromboflebitis end placebogruppen (5,2 % vs. 3,3 % efter fem år; p
Paradoksale fald i HDL-kolesterolniveauer
Der har efter markedsføring og kliniske undersøgelser været rapporter om alvorlige fald i HDL-kolesterolniveauer (så lave som 2 mg/dL) hos diabetiske og ikke-diabetespatienter, der er påbegyndt med fibratbehandling. Faldet i HDL-C afspejles af et fald i apolipoprotein A1. Dette fald er blevet rapporteret at forekomme inden for 2 uger til år efter påbegyndelse af fibratbehandling. HDL-C-niveauerne forbliver undertrykte, indtil fibratbehandlingen er afbrudt; reaktionen på seponering af fibratbehandling er hurtig og vedvarende. Den kliniske betydning af dette fald i HDL-C er ukendt. Det anbefales, at HDL-C-niveauer kontrolleres inden for de første par måneder efter påbegyndelse af fibratbehandling. Hvis der påvises et alvorligt nedsat HDL-C-niveau, skal fibratbehandlingen seponeres, og HDL-C-niveauet overvåges, indtil det er vendt tilbage til baseline, og fibratbehandlingen bør ikke genoptages.
Ikke-klinisk toksikologi
Karcinogenese og mutagenese og svækkelse af fertilitet
To diætcarcinogenicitetsundersøgelser er blevet udført på rotter med fenofibrat. I det første 24-måneders studie blev Wistar-rotter doseret med fenofibrat på 10, 45 og 200 mg/kg/dag, ca. 0,3, 1 og 6 gange den maksimale anbefalede humane dosis (MRHD) på 300 mg fenofibrat dagligt, svarende til 145 mg TRICOR 160 mg dagligt, baseret på sammenligninger af kropsoverfladearealer. Ved en dosis på 200 mg/kg/dag (ved 6 gange MRHD) var forekomsten af leverkarcinomer signifikant øget hos begge køn. En statistisk signifikant stigning i pancreascarcinomer blev observeret hos mænd ved 1 og 6 gange MRHD; en stigning i bugspytkirteladenomer og benigne testikel-interstitielle celletumorer blev observeret ved 6 gange MRHD hos mænd. I et andet 24-måneders carcinogenicitetsstudie hos rotter i en anden rottesamme (Sprague-Dawley), gav doser på 10 og 60 mg/kg/dag (0,3 og 2 gange MRHD) signifikante stigninger i forekomsten af pancreas acinare adenomer i begge køn og stigninger i testikel-interstitielle celletumorer hos mænd på 2 gange MRHD.
En 117-ugers karcinogenicitetsundersøgelse blev udført i rotter, hvor tre lægemidler blev sammenlignet: fenofibrat 10 og 60 mg/kg/dag (0,3 og 2 gange MRHD, baseret på kropsoverflade-sammenligninger), clofibrat (400 mg/kg/dag; 2 gange den humane dosis) og gemfibrozil (250 mg/kg/dag; 2 gange den humane dosis, baseret på mg/m² overfladeareal). Fenofibrat øgede pancreas acinare adenomer hos begge køn. Clofibrat øgede hepatocellulært karcinom og pancreas acinare adenomer hos mænd og hepatiske neoplastiske knuder hos kvinder. Gemfibrozil øgede hepatiske neoplastiske knuder hos mænd og kvinder, mens alle tre lægemidler øgede testikel-interstitielle celletumorer hos mænd.
et 21-måneders studie med CF-1-mus øgede fenofibrat 10, 45 og 200 mg/kg/dag (ca. 0,2, 1 og 3 gange MRHD, baseret på kropsoverflade-sammenligninger) signifikant leverkarcinomerne i begge køn på 3 gange MRHD. I et andet 18-måneders studie med 10, 60 og 200 mg/kg/dag øgede fenofibrat signifikant leverkarcinomerne hos hanmus og leveradenomer hos hunmus med 3 gange MRHD.
Elektronmikroskopiske undersøgelser har vist peroxisomal proliferation efter fenofibratadministration til rotter. En tilstrækkelig undersøgelse til at teste for peroxisomproliferation hos mennesker er ikke blevet udført, men ændringer i peroxisommorfologi og antal er blevet observeret hos mennesker efter behandling med andre medlemmer af fibratklassen, når leverbiopsier blev sammenlignet før og efter behandling hos det samme individ.
Fenofibrat har vist sig at være fri for mutagent potentiale i følgende tests: Ames, muselymfom, kromosomafvigelse og ikke-planlagt DNA-syntese i primære rottehepatocytter.
I fertilitetsundersøgelser fik rotter orale diætdoser af fenofibrat, hanner fik 61 dage før parring og hunner 15 dage før parring gennem fravænning, hvilket ikke resulterede i nogen negativ effekt på fertiliteten ved doser op til 300 mg/kg/dag (10 gange MRHD, baseret på kropsoverfladesammenligninger).
Brug i specifikke populationer
Graviditet
Risikooversigt
Begrænsede tilgængelige data med brug af fenofibrat til gravide kvinder er utilstrækkelige til at bestemme en lægemiddelassocieret risiko for alvorlige fødselsdefekter, abort eller uønskede maternel- eller føtale udfald. I dyrereproduktionsstudier blev der ikke observeret tegn på embryo-føtal toksicitet ved oral administration af fenofibrat til rotter og kaniner under organogenese ved doser mindre end eller svarende til den maksimalt anbefalede kliniske dosis på 145 mg dagligt baseret på kropsoverfladeareal (mg/ m²). Uønskede reproduktionseffekter forekom ved højere doser i nærvær af maternel toksicitet (se Data ). TRICOR 200 mg bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2-4 % og 15-20 %.
Data
Dyredata
Hos drægtige rotter, der fik orale diætdoser på 14, 127 og 361 mg/kg/dag fra drægtighedsdag 6-15 i perioden med organogenese, blev der ikke observeret uønskede udviklingsfund ved 14 mg/kg/dag (mindre end den kliniske eksponering). ved den maksimalt anbefalede humane dosis [MRHD] på 300 mg fenofibrat dagligt, svarende til 145 mg TRICOR dagligt, baseret på sammenligninger af kropsoverfladearealer). Forøgede føtale skeletmisdannelser blev observeret ved maternal toksiske doser (361 mg/kg/dag, svarende til 12 gange den kliniske eksponering ved MRHD), som signifikant undertrykte moderens vægtøgning.
Hos drægtige kaniner, som fik orale sondeernæringsdoser på 15, 150 og 300 mg/kg/dag fra drægtighedsdag 618 i perioden med organogenese og fik lov til at føde, blev der ikke observeret uønskede udviklingsfund ved 15 mg/kg/dag (en dosis, der tilnærmer den kliniske eksponering ved MRHD baseret på sammenligninger af kropsoverfladearealer). Aborterede kuld blev observeret ved maternal toksiske doser (≥ 150 mg/kg/dag, svarende til ≥ 10 gange den kliniske eksponering ved MRHD), som undertrykte moderens vægtøgning.
Hos drægtige rotter, der fik orale diætdoser på 15, 75 og 300 mg/kg/dag fra drægtighedsdag 15 til og med diegivningsdag 21 (fravænning), blev der ikke observeret uønskede udviklingseffekter ved 15 mg/kg/dag (mindre end den kliniske eksponering). ved MRHD, baseret på kropsoverfladesammenligninger), på trods af maternel toksicitet (nedsat vægtøgning). Post-implantationstab blev observeret ved ≥ 75 mg/kg/dag (≥ 2 gange den kliniske eksponering ved MRHD) ved tilstedeværelse af maternel toksicitet (nedsat vægtøgning). Nedsat hvalpeoverlevelse blev noteret ved 300 mg/kg/dag (10 gange den kliniske eksponering ved MRHD), hvilket var forbundet med nedsat moderens kropsvægtforøgelse/maternel omsorgssvigt.
Amning
Risikooversigt
Der er ingen tilgængelig information om tilstedeværelsen af fenofibrat i modermælk, virkningerne af lægemidlet på det ammede spædbarn eller virkningerne på mælkeproduktionen. Fenofibrat er til stede i mælken fra rotter og er derfor sandsynligvis til stede i modermælk. På grund af potentialet for alvorlige bivirkninger hos ammede spædbørn, såsom forstyrrelse af spædbørns lipidmetabolisme, bør kvinder ikke amme under behandling med TRICOR 200 mg og i 5 dage efter den sidste dosis [se KONTRAINDIKATIONER ].
Pædiatrisk brug
Sikkerhed og effektivitet er ikke blevet fastslået hos pædiatriske patienter.
Geriatrisk brug
Fenofibsyre er kendt for at udskilles væsentligt af nyrerne, og risikoen for bivirkninger af dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Fenofibsyreeksponering er ikke påvirket af alder. Da ældre patienter har en højere forekomst af nedsat nyrefunktion, bør dosisvalg til ældre foretages på basis af nyrefunktionen [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ]. Ældre patienter med normal nyrefunktion bør ikke kræve dosisændringer. Overvej at monitorere nyrefunktionen hos ældre patienter, der tager TRICOR.
Nedsat nyrefunktion
Brugen af TRICOR 160mg bør undgås til patienter, som har svært nedsat nyrefunktion [se KONTRAINDIKATIONER ]. Dosisreduktion er nødvendig hos patienter med let til moderat nedsat nyrefunktion [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ]. Overvågning af nyrefunktionen hos patienter med nedsat nyrefunktion anbefales.
Nedsat leverfunktion
Brugen af TRICOR 200 mg er ikke blevet evalueret hos personer med nedsat leverfunktion [se KONTRAINDIKATIONER og KLINISK FARMAKOLOGI ].
OVERDOSIS
Der er ingen specifik behandling for overdosering med TRICOR. Generel understøttende behandling af patienten er indiceret, herunder monitorering af vitale tegn og observation af klinisk status, hvis der skulle opstå en overdosis. Hvis det er indiceret, bør eliminering af uabsorberet lægemiddel opnås ved emesis eller maveskylning; sædvanlige forholdsregler skal overholdes for at opretholde luftvejene. Da fenofibrinsyre er stærkt bundet til plasmaproteiner, bør hæmodialyse ikke overvejes.
KONTRAINDIKATIONER
TRICOR 200mg er kontraindiceret til:
- patienter med svær nyreinsufficiens, inklusive dem, der får dialyse [se KLINISK FARMAKOLOGI ].
- patienter med aktiv leversygdom, herunder dem med primær biliær cirrhose og uforklarlige vedvarende leverfunktionsabnormiteter [se ADVARSLER OG FORHOLDSREGLER ].
- patienter med allerede eksisterende galdeblæresygdom [se ADVARSLER OG FORHOLDSREGLER ].
- ammende mødre [se Brug i specifikke populationer ].
- patienter med kendt overfølsomhed over for fenofibrat eller fenofibrinsyre [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Den aktive del af TRICOR er fenofibrinsyre. De farmakologiske virkninger af fenofibrinsyre hos både dyr og mennesker er blevet grundigt undersøgt gennem oral administration af fenofibrat.
De lipidmodificerende virkninger af fenofibrinsyre set i klinisk praksis er blevet forklaret in vivo i transgene mus og in vitro i humane hepatocytkulturer ved aktivering af peroxisomproliferatoraktiveret receptor α (PPARα). Gennem denne mekanisme øger fenofibrat lipolyse og eliminering af triglyceridrige partikler fra plasma ved at aktivere lipoproteinlipase og reducere produktionen af apoprotein C-III (en hæmmer af lipoproteinlipaseaktivitet).
Det resulterende fald i TG producerer en ændring i størrelsen og sammensætningen af LDL fra små, tætte partikler (som menes at være aterogene på grund af deres modtagelighed for oxidation) til store flydende partikler. Disse større partikler har en større affinitet til kolesterolreceptorer og kataboliseres hurtigt. Aktivering af PPARa inducerer også en stigning i syntesen af apolipoproteinerne AI, A-II og HDL-kolesterol.
Fenofibrat reducerer også serumurinsyreniveauet hos hyperurikæmiske og normale individer ved at øge urinudskillelsen af urinsyre.
Farmakodynamik
En række kliniske undersøgelser har vist, at forhøjede niveauer af total-C, LDL-C og apo B, et LDL-membrankompleks, er forbundet med human aterosklerose. Tilsvarende er nedsatte niveauer af HDL-C og dets transportkompleks, apolipoprotein A (apo AI og apo AII) forbundet med udviklingen af aterosklerose. Epidemiologiske undersøgelser har fastslået, at kardiovaskulær morbiditet og dødelighed varierer direkte med niveauet af total-C, LDL-C og TG, og omvendt med niveauet af HDL-C. Den uafhængige effekt af at hæve HDL-C eller sænke triglycerider (TG) på risikoen for kardiovaskulær morbiditet og dødelighed er ikke blevet bestemt.
Fenofibric syre, den aktive metabolit af fenofibrat, producerer reduktioner i total kolesterol, LDL kolesterol, apolipoprotein B, totale triglycerider og triglycerid rigt lipoprotein (VLDL) hos behandlede patienter. Derudover resulterer behandling med fenofibrat i stigninger i high density lipoprotein (HDL) og apolipoproteiner apoAI og apoAII.
Farmakokinetik
Plasmakoncentrationer af fenofibrinsyre efter administration af tre 48 mg eller én 145 mg tabletter svarer under foderforhold til en 200 mg mikroniseret fenofibratkapsel.
Fenofibrat er et prodrug af den aktive kemiske del fenofibrinsyre. Fenofibrat omdannes ved esterhydrolyse i kroppen til fenofibrinsyre, som er den aktive bestanddel, der kan måles i kredsløbet.
Absorption
Den absolutte biotilgængelighed af fenofibrat kan ikke bestemmes, da forbindelsen er praktisk talt uopløselig i vandige medier, der er egnede til injektion. Men fenofibrat absorberes godt fra mave-tarmkanalen. Efter oral administration hos raske frivillige forekom ca. 60 % af en enkelt dosis af radioaktivt mærket fenofibrat i urinen, primært som fenofibrinsyre og dets glukuronatkonjugat, og 25 % blev udskilt i fæces. Maksimal plasmaniveauer af fenofibrinsyre forekommer inden for 6 til 8 timer efter administration.
Eksponering for fenofibrinsyre i plasma, målt ved Cmax og AUC, er ikke signifikant forskellig, når en enkelt dosis på 145 mg fenofibrat administreres under fastende eller ikke-fastende forhold.
Fordeling
Ved gentagen dosering af fenofibrat opnås fenofibsyre-steady state inden for 9 dage. Plasmakoncentrationer af fenofibrinsyre ved steady state er ca. det dobbelte af dem efter en enkelt dosis. Serumproteinbinding var ca. 99 % hos normale og hyperlipidæmiske forsøgspersoner.
Metabolisme
Efter oral administration hydrolyseres fenofibrat hurtigt af esteraser til den aktive metabolit, fenofibrinsyre; der påvises ikke uændret fenofibrat i plasma.
Fenofibrinsyre konjugeres primært med glucuronsyre og udskilles derefter i urinen. En lille mængde fenofibrinsyre reduceres ved carbonyldelen til en benzhydrolmetabolit, som igen konjugeres med glucuronsyre og udskilles i urinen.
In vivo-metabolismedata indikerer, at hverken fenofibrat eller fenofibrinsyre undergår oxidativ metabolisme (f.eks. cytokrom P450) i væsentlig grad.
Elimination
Efter absorption udskilles fenofibrat hovedsageligt i urinen i form af metabolitter, primært fenofibrinsyre og fenofibrinsyreglucuronid. Efter administration af radioaktivt mærket fenofibrat forekom ca. 60 % af dosis i urinen, og 25 % blev udskilt i fæces.
Fenofibrinsyre elimineres med en halveringstid på 20 timer, hvilket tillader dosering én gang dagligt.
Særlige Populationer
Geriatri
Hos ældre frivillige i alderen 77 til 87 år var den orale clearance af fenofibrinsyre efter en enkelt oral dosis fenofibrat 1,2 l/time, hvilket sammenlignes med 1,1 l/time hos unge voksne. Dette indikerer, at et lignende doseringsregime kan anvendes til ældre med normal nyrefunktion uden at øge ophobningen af lægemidlet eller metabolitter [se DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Pædiatri
Farmakokinetikken af TRICOR 160 mg er ikke blevet undersøgt i pædiatriske populationer.
Køn
Der er ikke observeret nogen farmakokinetisk forskel mellem mænd og kvinder for fenofibrat.
Race
Racens indflydelse på fenofibrats farmakokinetik er ikke blevet undersøgt, men fenofibrat metaboliseres ikke af enzymer, der er kendt for at udvise inter-etnisk variabilitet.
Nedsat nyrefunktion
Farmakokinetikken af fenofibrinsyre blev undersøgt hos patienter med mild, moderat og svær nyreinsufficiens. Patienter med svær nyreinsufficiens (estimeret glomerulær filtrationshastighed [eGFR] DOSERING OG ADMINISTRATION ].
Nedsat leverfunktion
Der er ikke udført farmakokinetiske undersøgelser hos patienter med nedsat leverfunktion.
Lægemiddel-lægemiddel-interaktioner
In vitro undersøgelser med humane levermikrosomer indikerer, at fenofibrat og fenofibrinsyre ikke er hæmmere af cytokrom (CYP) P450 isoformerne CYP3A4, CYP2D6, CYP2E1 eller CYP1A2. De er svage hæmmere af CYP2C8, CYP2C19 og CYP2A6 og milde til moderate hæmmere af CYP2C9 i terapeutiske koncentrationer.
Tabel 2 beskriver virkningerne af samtidig administrerede lægemidler på systemisk eksponering af fenofibrinsyre. Tabel 3 beskriver virkningerne af co-administreret fenofibrat eller fenofibrinsyre på andre lægemidler.
Kliniske Studier
Primær hyperkolesterolæmi (heterozygot familiær og ikke-familiær) og blandet dyslipidæmi
Virkningerne af fenofibrat ved en dosis svarende til 145 mg TRICOR (fenofibrat-tabletter) pr. dag blev vurderet ud fra fire randomiserede, placebokontrollerede, dobbeltblindede, parallelgruppeundersøgelser, inklusive patienter med følgende gennemsnitlige baseline-lipidværdier: total-C 306,9 mg/dL; LDL-C 213,8 mg/dL; HDL-C 52,3 mg/dL; og triglycerider 191,0 mg/dL. TRICOR 200 mg-behandling sænkede LDL-C, Total-C og LDL-C/HDL-C-forholdet. TRICOR-behandling sænkede også triglycerider og hævede HDL-C (se tabel 4).
I en undergruppe af forsøgspersonerne blev målinger af apo B udført. TRICOR 200 mg-behandling reducerede apo B signifikant fra baseline til endepunkt sammenlignet med placebo (henholdsvis -25,1 % vs. 2,4 %, p
Alvorlig hypertriglyceridæmi
Effekten af fenofibrat på serumtriglycerider blev undersøgt i to randomiserede, dobbeltblindede, placebokontrollerede kliniske forsøg med 147 hypertriglyceridæmiske patienter. Patienterne blev behandlet i otte uger efter protokoller, der kun adskilte sig ved, at den ene kom ind i patienter med baseline TG-niveauer på 500 til 1500 mg/dL, og den anden TG-niveauer på 350 til 500 mg/dL. Hos patienter med hypertriglyceridæmi og normal kolesterolæmi med eller uden hyperchylomikronæmi reducerede behandling med fenofibrat i doser svarende til TRICOR 145 mg dagligt primært meget lavdensitetslipoprotein (VLDL) triglycerider og VLDL-kolesterol. Behandling af patienter med forhøjede triglycerider resulterer ofte i en stigning i LDL-C (se tabel 5).
Effekten af TRICOR 160 mg på kardiovaskulær morbiditet og dødelighed er ikke blevet bestemt.
PATIENTOPLYSNINGER
Patienter bør informeres om:
- af de potentielle fordele og risici ved TRICOR.
- ikke at bruge TRICOR, hvis der er kendt overfølsomhed over for fenofibrat eller fenofibrinsyre.
- af medicin, der ikke bør tages i kombination med TRICOR.
- at hvis de tager kumarinantikoagulantia, kan TRICOR 160mg øge deres antikoagulerende effekt, og øget overvågning kan være nødvendig.
- at fortsætte med at følge en passende lipid-modificerende diæt, mens du tager TRICOR.
- at tage TRICOR 160 mg én gang dagligt, uden hensyntagen til mad, i den foreskrevne dosis, ved at synke hver tablet hel.
- at vende tilbage til deres læges kontor for rutinemæssig overvågning.
- at informere deres læge om al medicin, kosttilskud og urtepræparater, de tager, og enhver ændring i deres medicinske tilstand. Patienter bør også rådes til at informere deres læger, der ordinerer en ny medicin, om, at de tager TRICOR.
- at informere deres læge om symptomer på leverskade (f.eks. gulsot, mavesmerter, kvalme, utilpashed, mørk urin, unormal afføring, pruritus); enhver muskelsmerte, ømhed eller svaghed; eller andre nye symptomer.
- ikke at amme under behandling med TRICOR og i 5 dage efter den sidste dosis.
