Lopid 300mg Gemfibrozil Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Lopid 300mg, og hvordan bruges det?
Lopid (gemfibrozil) er et lipidregulerende middel, der bruges til at behandle meget høje kolesterol- og triglyceridniveauer hos mennesker med pancreatitis, og bruges også til at sænke risikoen for slagtilfælde, hjerteanfald eller andre hjertekomplikationer hos mennesker med højt kolesteroltal og triglycerider, der har ikke blevet hjulpet af andre behandlinger. Lopid er tilgængelig i generisk form.
Hvad er bivirkninger af Lopid 300mg?
Almindelige bivirkninger af Lopid 300mg omfatter:
- ondt i maven,
- mave/mavesmerter,
- kvalme,
- opkastning,
- diarré,
- hovedpine,
- svimmelhed,
- døsighed,
- led- eller muskelsmerter,
- tab af interesse for sex,
- impotens,
- svært ved at få orgasme,
- følelsesløshed eller prikkende følelse,
- usædvanlig smag, eller
- forkølelsessymptomer såsom tilstoppet næse, nysen, ondt i halsen.
Lopid 300mg kan sjældent forårsage galdesten og leverproblemer.
Fortæl det til din læge, hvis du bemærker nogen af følgende usandsynlige, men alvorlige bivirkninger af Lopid 300mg, herunder:
- stærke mave-/mavesmerter,
- vedvarende kvalme eller opkastning,
- gulne øjne eller hud, og
- mørk urin.
BESKRIVELSE
LOPID® (gemfibrozil tabletter, USP) er et lipidregulerende middel. Det fås som tabletter til oral administration. Hver tablet indeholder 600 mg gemfibrozil. Hver tablet indeholder også calciumstearat, NF; candelilla voks, FCC; mikrokrystallinsk cellulose, NF; hydroxypropylcellulose, NF; hypromellose, USP; methylparaben, NF; Opaspray hvid; polyethylenglycol, NF; polysorbat 80, NF; propylparaben, NF; kolloid siliciumdioxid, NF; prægelatineret stivelse, NF. Det kemiske navn er 5-(2,5-dimethylphenoxy)-2,2-dimethylpentansyre, med følgende strukturformel:
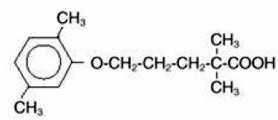
Den empiriske formel er C15H22O3 og molekylvægten er 250,35; opløseligheden i vand og syre er 0,0019% og i fortyndet base er den større end 1%. Smeltepunktet er 58° –61°C. Gemfibrozil er et hvidt fast stof, som er stabilt under almindelige forhold.
INDIKATIONER
LOPID (gemfibrozil tabletter, USP) er indiceret som supplerende terapi til diæt for:
en undergruppeanalyse af patienter i Helsinki Heart Study med over-median HDL-kolesterolværdier ved baseline (større end 46,4 mg/dL), var forekomsten af alvorlige koronare hændelser ens for gemfibrozil og placebo undergrupper (se tabel I).
Den indledende behandling for dyslipidæmi er diætterapi, der er specifik for typen af lipoproteinabnormitet. Overskydende kropsvægt og overskydende alkoholindtagelse kan være vigtige faktorer ved hypertriglyceridæmi og bør behandles før enhver medikamentel behandling. Fysisk træning kan være en vigtig hjælpeforanstaltning og har været forbundet med stigninger i HDL-kolesterol. Sygdomme, der er medvirkende til hyperlipidæmi, såsom hypothyroidisme eller diabetes mellitus, bør ledes efter og behandles tilstrækkeligt. Østrogenbehandling er nogle gange forbundet med massive stigninger i plasmatriglycerider, især hos personer med familiær hypertriglyceridæmi. I sådanne tilfælde kan seponering af østrogenbehandling undgå behovet for specifik lægemiddelbehandling af hypertriglyceridæmi. Brug af lægemidler bør kun overvejes, når der er gjort rimelige forsøg på at opnå tilfredsstillende resultater med ikke-medicinske metoder. Hvis der træffes beslutning om at bruge lægemidler, bør patienten instrueres i, at dette ikke mindsker vigtigheden af at overholde kosten.
DOSERING OG ADMINISTRATION
Den anbefalede dosis til voksne er 1200 mg indgivet i to opdelte doser 30 minutter før morgen- og aftenmåltidet (se KLINISK FARMAKOLOGI ).
HVORDAN LEVERET
LOPID (Tablet 737), hvide, elliptiske, filmovertrukne tabletter med delekærv, som hver indeholder 600 mg gemfibrozil, er tilgængelige som følger:
NDC 0071-0737-20: Flasker med 60 stk NDC 0071-0737-30: Flasker á 500
Opbevares ved kontrolleret stuetemperatur 20° – 25°C (68° – 77°F) [se USP]. Beskyt mod lys og fugt.
Distribueret af Parke-Davis Division of Pfizer Inc, NY, NY 10017. Revideret: Dec 2020
BIVIRKNINGER
I den dobbeltblindede kontrollerede fase af den primære forebyggelseskomponent i Helsinki Heart Study fik 2046 patienter LOPID i op til fem år. I denne undersøgelse var følgende bivirkninger statistisk hyppigere hos forsøgspersoner i LOPID-gruppen:
Galdeblære kirurgi blev udført hos 0,9 % af LOPID 300 mg og 0,5 % af placebo-personer i den primære forebyggelseskomponent, et overskud på 64 %, hvilket ikke er statistisk forskelligt fra overskydende galdeblærekirurgi observeret i clofibratgruppen sammenlignet med placebogruppen i WHO-studiet . Galdeblærekirurgi blev også udført hyppigere i LOPID-gruppen sammenlignet med placebogruppen (1,9 % versus 0,3 %, p=0,07) i den sekundære forebyggelseskomponent. En statistisk signifikant stigning i appendektomi i gemfibrozil-gruppen blev også set i den sekundære forebyggelseskomponent (6 på gemfibrozil versus 0 på placebo, p=0,014).
Bivirkninger fra nervesystemet og særlige sanser var mere almindelige i LOPID 300 mg-gruppen. Disse omfattede hypestesi, paræstesier og smagsforstyrrelser. Andre bivirkninger, der var mere almindelige blandt LOPID 300 mg-behandlingsgruppen, men hvor en årsagssammenhæng ikke blev fastslået, omfatter grå stær, perifer vaskulær sygdom og intracerebral blødning.
Ud fra andre undersøgelser forekommer det sandsynligt, at LOPID 300mg er kausalt relateret til forekomsten af MUSKULOSKELETALE SYMPTOMER (se ADVARSLER ), og til ABNORMALE LEVERFUNKTIONSTESTER og HEMATOLOGISKE ÆNDRINGER (se FORHOLDSREGLER ).
Rapporter om virale og bakterielle infektioner (almindelig forkølelse, hoste, urinvejsinfektioner) var mere almindelige hos gemfibrozil-behandlede patienter i andre kontrollerede kliniske forsøg med 805 patienter. Yderligere bivirkninger, der er blevet rapporteret for gemfibrozil, er listet nedenfor efter system. Disse er kategoriseret efter, om en årsagssammenhæng til behandling med LOPID er sandsynlig eller ikke etableret:
Yderligere bivirkninger, der er blevet rapporteret, omfatter kolecystitis og kolelithiasis (se ADVARSLER ).
DRUGSINTERAKTIONER
HMG-CoA-reduktasehæmmere
Samtidig administration af LOPID 300 mg og simvastatin er kontraindiceret (se KONTRAINDIKATIONER og ADVARSLER ). Undgå samtidig brug af LOPID og rosuvastatin. Hvis samtidig brug ikke kan undgås, påbegyndes rosuvastatin med 5 mg én gang dagligt. Dosis af rosuvastatin bør ikke overstige 10 mg én gang dagligt. Risikoen for myopati og rhabdomyolyse øges ved kombineret behandling med gemfibrozil og HMG-CoA-reduktasehæmmer. Myopati eller rhabdomyolyse med eller uden akut nyresvigt er blevet rapporteret så tidligt som tre uger efter påbegyndelse af kombineret behandling eller efter flere måneder (se ADVARSLER ). Der er ingen sikkerhed for, at periodisk overvågning af kreatinkinase vil forhindre forekomsten af alvorlig myopati og nyreskade.
Antikoagulanter
FORSIGTIG SKAL UDØVES, NÅR WARFARIN GIVES I FORBINDELSE MED LOPID. DOSERING AF WARFARIN BØR REDUCERES FOR AT OPHOLDE PROTHROMBINTIDEN PÅ DET ØNSKEDE NIVEAU FOR AT FOREBYGGE BLØDNINGSKOMPLIKATIONER. HYPPIGE PROTHROMBINBESTEMMELSER ER TILVALDELIGT, INDTIL DET ENDELIG ER BESTEMT AT PROTHROMBIN-NIVEAUET ER STABILISERT.
CYP2C8 substrater
Gemfibrozil er en stærk hæmmer af CYP2C8 og kan øge eksponeringen af lægemidler, der hovedsageligt metaboliseres af CYP2C8 (f.eks. dabrafenib, enzalutamid, loperamid, montelukast, paclitaxel, pioglitazon, rosiglitazon). Derfor kan dosisreduktion af lægemidler, der hovedsageligt metaboliseres af CYP2C8-enzym, være nødvendig, når gemfibrozil anvendes samtidigt (se ADVARSLER ).
Repaglinid
Hos raske frivillige resulterede samtidig administration med gemfibrozil (600 mg to gange dagligt i 3 dage) i en 8,1-fold (interval 5,5- til 15,0-fold) højere repaglinid-AUC og en 28,6-fold (interval 18,5- til 80,1-fold) højere plasmakoncentration af repaglinid 7 timer efter dosis. I samme undersøgelse resulterede gemfibrozil (600 mg to gange dagligt i 3 dage) + itraconazol (200 mg om morgenen og 100 mg om aftenen på dag 1, derefter 100 mg to gange dagligt på dag 2-3) i en 19,4-( område 12,9 til 24,7 gange højere repaglinid AUC og en 70,4 gange (interval 42,9 til 119,2 gange) højere plasmakoncentration af repaglinid 7 timer efter dosis. Derudover forlængede gemfibrozil alene eller gemfibrozil + itraconazol den hypoglykæmiske virkning af repaglinid. Samtidig administration af gemfibrozil og repaglinid øger risikoen for svær hypoglykæmi og er kontraindiceret (se KONTRAINDIKATIONER ).
Dasabuvir
Samtidig administration af gemfibrozil og dasabuvir øgede dasabuvirs AUC og Cmax (forhold: henholdsvis 11,3 og 2,01) på grund af CYP2C8-hæmning. Øget dasabuvir eksponering kan øge risikoen for QT forlængelse, derfor er samtidig administration af gemfibrozil og dasabuvir kontraindiceret (se KONTRAINDIKATIONER ).
Selexipag
Samtidig administration af gemfibrozil og selexipag fordoblede eksponeringen for selexipag og øgede eksponeringen for den aktive metabolit med ca. 11 gange. Samtidig administration af gemfibrozil og selexipag er kontraindiceret (se KONTRAINDIKATIONER ).
Enzalutamid
Hos raske frivillige, der fik en enkelt dosis på 160 mg enzalutamid efter gemfibrozil 600 mg to gange dagligt, blev AUC for enzalutamid plus aktiv metabolit (N-desmethylenzalutamid) øget med 2,2 gange, og den tilsvarende Cmax blev reduceret med 16 %. Øget eksponering for enzalutamid kan øge risikoen for anfald. Hvis samtidig administration anses for nødvendig, bør dosis af enzalutamid reduceres (se ADVARSLER ).
OATP1B1 substrater
Gemfibrozil er en hæmmer af OATP1B1-transportør og kan øge eksponeringen af lægemidler, der er substrater for OATP1B1 (f.eks. atrasentan, atorvastatin, bosentan, ezetimibe, fluvastatin, glyburid, SN-38 [aktiv metabolit af irinotecan], rosuvastatin, rifinavastatin, pravinavastatin, . , valsartan, olmesartan). Derfor kan dosisreduktioner af lægemidler, der er substrater for OATP1B1, være påkrævet, når gemfibrozil anvendes samtidigt (se ADVARSLER ). Kombinationsbehandling af gemfibrozil med simvastatin eller med repaglinid, som er OATP1B1-substrater, er kontraindiceret (se KONTRAINDIKATIONER ).
In vitro undersøgelser af CYP-enzymer, UGTA-enzymer og OATP1B1-transporter
In vitro undersøgelser har vist, at gemfibrozil er en hæmmer af CYP1A2, CYP2C8, CYP2C9, CYP2C19, OATP1B1 og UDP-glucuronosyltransferase (UGT) 1A1 og 1A3 (se ADVARSLER ).
Galdesyrebindende harpikser
Gemfibrozil AUC blev reduceret med 30 %, når gemfibrozil blev givet (600 mg) samtidig med harpiksgranulatlægemidler såsom colestipol (5 g). Administration af lægemidlerne med to timers mellemrum eller mere anbefales, fordi eksponeringen af gemfibrozil ikke var signifikant påvirket, når den blev administreret med to timers mellemrum fra colestipol.
Colchicin
Myopati, herunder rabdomyolyse, er blevet rapporteret ved kronisk administration af colchicin i terapeutiske doser. Samtidig brug af LOPID kan forstærke udviklingen af myopati. Patienter med nedsat nyrefunktion og ældre patienter er i øget risiko. Der bør udvises forsigtighed ved ordinering af LOPID sammen med colchicin, især hos ældre patienter eller patienter med nedsat nyrefunktion.
ADVARSLER
På grund af den mere begrænsede størrelse af Helsinki Heart Study er den observerede forskel i dødelighed uanset årsag mellem LOPID 300 mg og placebogruppen ikke statistisk signifikant forskellig fra de 29 % overdødelighed rapporteret i clofibratgruppen i den separate WHO-undersøgelse på ni års opfølgning (se KLINISK FARMAKOLOGI ). Ikke-koronar hjertesygdomsrelateret dødelighed viste et overskud i gruppen, der oprindeligt var randomiseret til LOPID, primært på grund af kræftdødsfald observeret under den åbne udvidelse.
løbet af den femårige primære forebyggelseskomponent af Helsinki Heart Study var dødeligheden uanset årsag 44 (2,2 %) i LOPID 300 mg-gruppen og 43 (2,1 %) i placebogruppen; inklusive den 3,5-årige opfølgningsperiode, siden forsøget blev afsluttet, var kumulativ dødelighed uanset årsag 101 (4,9 %) i LOPID-gruppen og 83 (4,1 %) i gruppen, der oprindeligt var randomiseret til placebo (hazard ratio 1:20 i favør) af placebo). På grund af den mere begrænsede størrelse af Helsinki Heart Study er den observerede forskel i dødelighed af enhver årsag mellem LOPID 300 mg og placebogruppen ved år-5 eller ved år-8,5 ikke statistisk signifikant forskellig fra de 29 % overdødelighed rapporteret i clofibrat-gruppen i det separate WHO-studie ved den ni års opfølgning. Ikke-koronar hjertesygdomsrelateret dødelighed viste et overskud i gruppen, der oprindeligt var randomiseret til LOPID 300 mg ved 8,5 års opfølgning (65 LOPID 300 mg versus 45 placebo ikke-koronare dødsfald).
Forekomsten af cancer (eksklusive basalcellekarcinom) opdaget under forsøget og i de 3,5 år efter forsøget var afsluttet var 51 (2,5%) i begge oprindeligt randomiserede grupper. Derudover var der 16 basalcellekarcinomer i gruppen, der oprindeligt var randomiseret til LOPID 300 mg og 9 i gruppen, der oprindeligt var randomiseret til placebo (p=0,22). Der var 30 (1,5 %) dødsfald tilskrevet kræft i gruppen, der oprindeligt var randomiseret til LOPID 300 mg og 18 (0,9 %) i gruppen, der oprindeligt var randomiseret til placebo (p=0,11). Bivirkninger, herunder koronare hændelser, var højere hos gemfibrozil-patienter i et tilsvarende studie med mænd med en anamnese med kendt eller formodet koronar hjertesygdom i den sekundære forebyggelseskomponent af Helsinki Heart Study (se KLINISK FARMAKOLOGI ).
En sammenlignende karcinogenicitetsundersøgelse blev også udført i rotter, der sammenlignede tre lægemidler i denne klasse: fenofibrat (10 og 60 mg/kg; henholdsvis 0,3 og 1,6 gange den humane dosis), clofibrat (400 mg/kg; 1,6 gange den humane dosis), og gemfibrozil (250 mg/kg; 1,7 gange den humane dosis). Pancreas acinare adenomer var øget hos mænd og kvinder på fenofibrat; hepatocellulært carcinom og pancreas acinare adenomer var øget hos mænd og hepatiske neoplastiske knuder hos kvinder behandlet med clofibrat; hepatiske neoplastiske knuder blev øget hos mænd og kvinder behandlet med clofibrat; hepatiske neoplastiske knuder blev øget hos mænd og kvinder behandlet med gemfibrozil, mens testikel-interstitielle celle (Leydig-celle) tumorer blev øget hos mænd på alle tre lægemidler.
FORHOLDSREGLER
Indledende terapi
Laboratorieundersøgelser bør udføres for at sikre, at lipidniveauerne konsekvent er unormale. Inden LOPID-behandling påbegyndes, bør der gøres ethvert forsøg på at kontrollere serumlipider med passende diæt, motion, vægttab hos overvægtige patienter og kontrol af eventuelle medicinske problemer såsom diabetes mellitus og hypothyroidisme, der bidrager til lipidabnormiteterne.
Fortsat terapi
Periodisk bestemmelse af serumlipider bør foretages, og lægemidlet skal seponeres, hvis lipidresponsen er utilstrækkelig efter tre måneders behandling.
Karcinogenese, mutagenese, svækkelse af fertilitet
Langtidsundersøgelser er blevet udført på rotter med 0,2 og 1,3 gange den humane eksponering (baseret på AUC). Forekomsten af godartede leverknuder og leverkarcinomer var signifikant øget hos hanrotter med høj dosis. Forekomsten af leverkarcinomer steg også hos mænd med lav dosis, men denne stigning var ikke statistisk signifikant (p=0,1). Hanrotter havde en dosisrelateret og statistisk signifikant stigning i benigne Leydig-celletumorer. Hunrotterne med højere dosis havde en signifikant stigning i den kombinerede forekomst af benigne og maligne leverneoplasmer.
Langtidsundersøgelser er blevet udført på mus med 0,1 og 0,7 gange den humane eksponering (baseret på AUC). Der var ingen statistisk signifikante forskelle fra kontroller i forekomsten af levertumorer, men de testede doser var lavere end dem, der viste sig at være kræftfremkaldende med andre fibrater.
Elektronmikroskopiundersøgelser har vist en florid hepatisk peroxisomproliferation efter LOPID-administration til hanrotten. En tilstrækkelig undersøgelse til at teste for peroxisomproliferation er ikke blevet udført hos mennesker, men ændringer i peroxisommorfologi er blevet observeret. Peroxisomproliferation har vist sig at forekomme hos mennesker med et af to andre lægemidler af fibratklassen, når leverbiopsier blev sammenlignet før og efter behandling hos det samme individ.
Administration af ca. 2 gange den humane dosis (baseret på overfladeareal) til hanrotter i 10 uger resulterede i et dosisrelateret fald i fertiliteten. Efterfølgende undersøgelser viste, at denne effekt blev vendt efter en medicinfri periode på omkring otte uger, og den blev ikke overført til afkommet.
Graviditet
LOPID 300 mg har vist sig at give bivirkninger hos rotter og kaniner ved doser mellem 0,5 og 3 gange den humane dosis (baseret på overfladeareal). Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. LOPID 300mg bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Administration af LOPID 300 mg til hunrotter ved 2 gange den humane dosis (baseret på overfladeareal) før og gennem hele drægtighedsperioden forårsagede et dosisrelateret fald i undfangelsesraten, en stigning i dødfødte børn og en lille reduktion i hvalpevægten under diegivning. Der var også dosisrelaterede øgede skeletvariationer. Anophthalmia forekom, men sjældent.
Administration af 0,6 og 2 gange den humane dosis (baseret på overfladeareal) af LOPID til hunrotter fra drægtighedsdag 15 til fravænning forårsagede dosisrelaterede fald i fødselsvægt og undertrykkelse af hvalpenes vækst under laktation.
Administration af 1 og 3 gange den humane dosis (baseret på overfladeareal) af LOPID 300 mg til hunkaniner under organogenese forårsagede et dosisrelateret fald i kuldstørrelse og, ved den høje dosis, en øget forekomst af parietale knoglevariationer.
Ammende mødre
Det vides ikke, om dette lægemiddel udskilles i modermælk. Fordi mange lægemidler udskilles i modermælk og på grund af potentialet for tumorigenicitet vist for LOPID i dyreforsøg, bør der tages en beslutning om at afbryde amningen eller seponere lægemidlet under hensyntagen til lægemidlets betydning for moderen.
Hæmatologiske ændringer
Mildt fald i hæmoglobin, hæmatokrit og hvide blodlegemer er blevet observeret hos lejlighedsvise patienter efter påbegyndelse af LOPID-behandling. Disse niveauer stabiliseres dog under langvarig administration. Sjældent er alvorlig anæmi, leukopeni, trombocytopeni og knoglemarvshypoplasi blevet rapporteret.
Derfor anbefales periodiske blodtællinger i løbet af de første 12 måneder af LOPID 300 mg administration.
Leverfunktion
Unormale leverfunktionsprøver er lejlighedsvis blevet observeret under LOPID-administration, inklusive forhøjelser af ASAT, ALAT, LDH, bilirubin og alkalisk fosfatase. Disse er normalt reversible, når LOPID 300mg seponeres. Derfor anbefales periodiske leverfunktionsundersøgelser, og behandling med LOPID 300 mg bør afbrydes, hvis abnormiteterne fortsætter.
Nyrefunktion
Der har været rapporter om forværring af nyreinsufficiens efter tilføjelse af LOPID-behandling hos personer med baseline plasmakreatinin >2,0 mg/dL. Hos sådanne patienter bør brugen af alternativ behandling overvejes i forhold til risici og fordele ved en lavere dosis LOPID.
Pædiatrisk brug
Sikkerhed og effekt hos pædiatriske patienter er ikke blevet fastslået.
OVERDOSIS
Der er rapporteret tilfælde af overdosering med LOPID. I et tilfælde kom et 7-årigt barn sig efter at have indtaget op til 9 gram LOPID. Symptomer rapporteret ved overdosering var mavekramper, unormale leverfunktionsprøver, diarré, øget CPK, led- og muskelsmerter, kvalme og opkastning. Symptomatisk understøttende foranstaltninger bør tages, hvis en overdosis opstår.
KONTRAINDIKATIONER
KLINISK FARMAKOLOGI
LOPID er et lipidregulerende middel, som nedsætter serumtriglycerider og meget lavdensitetslipoprotein (VLDL) kolesterol og øger højdensitetslipoproteinkolesterol (HDL). Mens beskedne fald i total- og low-density lipoprotein (LDL)-kolesterol kan observeres ved behandling med LOPID 300 mg, resulterer behandling af patienter med forhøjede triglycerider på grund af type IV hyperlipoproteinæmi ofte i en stigning i LDL-kolesterol. LDL-kolesterolniveauer hos type IIb-patienter med forhøjelser af både serum-LDL-kolesterol og triglycerider påvirkes generelt minimalt af LOPID 300 mg-behandling; dog hæver LOPID 300mg normalt HDL-kolesterol signifikant i denne gruppe. LOPID 300mg øger niveauet af HDL-subfraktionerne HDL2 og HDL3 samt apolipoproteinerne AI og AII. Epidemiologiske undersøgelser har vist, at både lavt HDL-kolesterol og højt LDL-kolesterol er uafhængige risikofaktorer for koronar hjertesygdom.
den primære forebyggelseskomponent af Helsinki Heart Study, hvor 4081 mandlige patienter mellem 40 og 55 år blev undersøgt på en randomiseret, dobbeltblind, placebokontrolleret måde, var LOPID 300 mg behandling forbundet med signifikante reduktioner i det totale plasmatriglycerider og en signifikant stigning i højdensitetslipoproteinkolesterol. Moderat reduktion i totalt plasmakolesterol og lavdensitetslipoproteinkolesterol blev observeret for LOPID-behandlingsgruppen som helhed, men lipidresponset var heterogent, især blandt forskellige Fredrickson-typer. Undersøgelsen involverede forsøgspersoner med serum non-HDL-kolesterol på over 200 mg/dL og ingen tidligere historie med koronar hjertesygdom. I løbet af den femårige undersøgelsesperiode oplevede LOPID 300 mg-gruppen en 1,4 % absolut (34 % relativ) reduktion i antallet af alvorlige koronare hændelser (pludselige hjertedødsfald plus fatale og ikke-dødelige myokardieinfarkter) sammenlignet med placebo, p=0,04 (se tabel I). Der var en relativ reduktion på 37 % i antallet af ikke-dødelige myokardieinfarkter sammenlignet med placebo, svarende til en behandlingsrelateret forskel på 13,1 hændelser pr. tusinde personer. Dødsfald uanset årsag under den dobbeltblinde del af undersøgelsen udgjorde i alt 44 (2,2 %) i LOPID 300 mg randomiseringsgruppen og 43 (2,1 %) i placebogruppen.
Blandt Fredrickson-typerne, under den 5-årige dobbeltblinde del af den primære forebyggelseskomponent af Helsinki Heart Study, forekom den største reduktion i forekomsten af alvorlige koronare hændelser hos type IIb-patienter, som havde forhøjelser af både LDL-kolesterol og total plasma triglycerider. Denne undergruppe af type IIb-gemfibrozil-gruppepatienter havde et lavere gennemsnitligt HDL-kolesterolniveau ved baseline end type IIa-undergruppen, der havde forhøjelser af LDL-kolesterol og normale plasmatriglycerider. Den gennemsnitlige stigning i HDL-kolesterol blandt type IIb-patienterne i denne undersøgelse var 12,6 % sammenlignet med placebo. Den gennemsnitlige ændring i LDL-kolesterol blandt type IIb-patienter var –4,1 % med LOPID sammenlignet med en stigning på 3,9 % i placebo-undergruppen. Type IIb-personerne i Helsinki Heart Study havde 26 færre koronare hændelser pr. tusinde personer over fem år i gemfibrozil-gruppen sammenlignet med placebo. Forskellen i koronare hændelser var væsentligt større mellem LOPID 300 mg og placebo for den undergruppe af patienter med triaden af LDL-kolesterol >175 mg/dL (>4,5 mmol), triglycerider >200 mg/dL (>2,2 mmol) og HDL -cholesterol
Yderligere information er tilgængelig fra en 3,5 års (8,5 års kumulativ) opfølgning af alle forsøgspersoner, der havde deltaget i Helsinki Heart Study. Ved afslutningen af Helsinki Heart Study kunne forsøgspersoner vælge at starte, stoppe eller fortsætte med at modtage LOPID; uden kendskab til deres egne lipidværdier eller dobbeltblind behandling, begyndte 60 % af de patienter, der oprindeligt var randomiseret til placebo, behandling med LOPID 300 mg, og 60 % af patienterne, der oprindeligt var randomiseret til LOPID, fortsatte med medicinering. Efter ca. 6,5 år efter randomisering blev alle patienter informeret om deres oprindelige behandlingsgruppe og lipidværdier i løbet af de fem år af den dobbeltblindede behandling. Efter yderligere elektive ændringer i LOPID-behandlingsstatus tog 61 % af patienterne i gruppen, der oprindeligt var randomiseret til LOPID, medicin; i gruppen, der oprindeligt var randomiseret til placebo, tog 65 % LOPID. Hændelsesraten pr. 1000, der forekommer i løbet af den åbne opfølgningsperiode, er detaljeret beskrevet i tabel II.
Kumulativ dødelighed gennem 8,5 år viste et 20 % relativt overskud af dødsfald i gruppen oprindeligt randomiseret til LOPID 300 mg versus den oprindeligt randomiserede placebogruppe og et 20 % relativt fald i hjertehændelser i gruppen oprindeligt randomiseret til LOPID 300 mg versus den oprindeligt randomiserede placebogruppe (se tabel III). Denne analyse af den oprindeligt randomiserede "intent-to-treat"-population ignorerer de mulige komplicerende virkninger af behandlingsskift under den åbne fase. Justering af fareforhold, under hensyntagen til åben-label behandlingsstatus fra år 6,5 til 8,5, kan ændre de rapporterede fareforhold for dødelighed mod enhed.
Det er ikke klart, i hvilket omfang resultaterne af den primære forebyggelseskomponent i Helsinki Heart Study kan ekstrapoleres til andre segmenter af den dyslipidæmiske population, der ikke er undersøgt (såsom kvinder, yngre eller ældre mænd eller dem med lipidabnormiteter, der udelukkende er begrænset til HDL -kolesterol) eller til andre lipidændrende lægemidler.
Den sekundære forebyggelseskomponent i Helsinki Heart Study blev udført over fem år parallelt og på de samme centre i Finland i 628 midaldrende mænd, der var udelukket fra den primære forebyggelseskomponent i Helsinki Heart Study på grund af en historie med angina, myokardieinfarkt, eller uforklarlige EKG-ændringer. Studiets primære effektmål var hjertehændelser (summen af fatale og ikke-dødelige myokardieinfarkter og pludselige hjertedødsfald). Hazard ratio (LOPID:placebo) for hjertehændelser var 1,47 (95 % konfidensgrænser 0,88–2,48, p=0,14). Ud af de 35 patienter i LOPID 300 mg-gruppen, som oplevede hjertehændelser, led 12 patienter hændelser efter afbrydelse af undersøgelsen. Ud af de 24 patienter i placebogruppen med hjertehændelser, led 4 patienter hændelser efter afbrydelse af undersøgelsen. Der var 17 hjertedødsfald i LOPID-gruppen og 8 i placebogruppen (hazard ratio 2,18; 95 % konfidensgrænser 0,94-5,05, p=0,06). Ti af disse dødsfald i LOPID-gruppen og 3 i placebogruppen skete efter seponering af behandlingen. I denne undersøgelse af patienter med kendt eller formodet koronar hjertesygdom blev der ikke observeret nogen fordel ved LOPID 300 mg behandling med hensyn til at reducere hjertehændelser eller hjertedødsfald. LOPID 300mg har således kun vist fordel hos udvalgte dyslipidæmiske patienter uden mistanke om eller etableret koronar hjertesygdom. Selv hos patienter med koronar hjertesygdom og triaden af forhøjet LDL-kolesterol, forhøjede triglycerider plus lavt HDL-kolesterol, er den mulige effekt af LOPID på koronare hændelser ikke blevet tilstrækkeligt undersøgt.
Der blev ikke observeret nogen effekt hos patienter med etableret koronar hjertesygdom under Coronary Drug Project med det kemisk og farmakologisk relaterede lægemiddel, clofibrat. Coronary Drug Project var et 6-årigt randomiseret, dobbeltblindt studie, der involverede 1000 clofibrat-, 1000 nikotinsyre- og 3000 placebopatienter med kendt koronar hjertesygdom. En klinisk og statistisk signifikant reduktion af myokardieinfarkter blev set i den samtidige nikotinsyregruppe sammenlignet med placebo; ingen reduktion blev set med clofibrat.
Virkningsmekanismen for gemfibrozil er ikke fastslået med sikkerhed. Hos mennesker har LOPID 300mg vist sig at hæmme perifer lipolyse og at mindske den hepatiske ekstraktion af frie fedtsyrer og dermed reducere levertriglyceridproduktionen. LOPID 300mg hæmmer syntesen og øger clearance af VLDL-bærer-apolipoprotein B, hvilket fører til et fald i VLDL-produktionen.
Dyreforsøg tyder på, at gemfibrozil, udover at hæve HDL-kolesterol, kan reducere inkorporering af langkædede fedtsyrer i nydannede triglycerider, accelerere omsætning og fjernelse af kolesterol fra leveren og øge udskillelsen af kolesterol i fæces. LOPID 300mg absorberes godt fra mave-tarmkanalen efter oral administration. Maksimale plasmaniveauer forekommer efter 1 til 2 timer med en plasmahalveringstid på 1,5 time efter gentagne doser.
Gemfibrozil absorberes fuldstændigt efter oral administration af LOPID 300 mg tabletter og når maksimal plasmakoncentration 1 til 2 timer efter dosering. Gemfibrozils farmakokinetik påvirkes af tidspunktet for måltider i forhold til tidspunktet for dosering. I en undersøgelse (ref. 4) var både hastigheden og omfanget af absorptionen af lægemidlet signifikant øget, når det blev administreret 0,5 time før måltider. Gennemsnitlig AUC blev reduceret med 14-44 %, når LOPID blev administreret efter måltider sammenlignet med 0,5 time før måltider. I en efterfølgende undersøgelse var absorptionshastigheden af LOPID 300 mg maksimal, når den blev administreret 0,5 time før måltider med Cmax 50-60 % højere, end når det blev givet enten sammen med måltider eller faste. I denne undersøgelse var der ingen signifikant effekt på AUC af timing af dosis i forhold til måltider (se DOSERING OG ADMINISTRATION ).
LOPID gennemgår hovedsageligt oxidation af en ringmethylgruppe for successivt at danne en hydroxymethyl- og en carboxylmetabolit. Ca. halvfjerds procent af den administrerede humane dosis udskilles i urinen, hovedsagelig som glucuronidkonjugatet, med mindre end 2 % udskilt som uændret gemfibrozil. Seks procent af dosen står i afføringen. Gemfibrozil er stærkt bundet til plasmaproteiner, og der er potentiale for forskydningsinteraktioner med andre lægemidler (se FORHOLDSREGLER ).
PATIENTOPLYSNINGER
Ingen oplysninger angivet. Der henvises til ADVARSLER og FORHOLDSREGLER sektioner.
