Zetia 10mg Ezetimibe Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Zetia, og hvordan bruges det?
Zetia er en receptpligtig medicin, der bruges til at behandle symptomerne på forhøjet kolesterol og til at reducere kolesterol. Zetia kan bruges alene eller sammen med anden medicin.
Zetia tilhører en klasse af lægemidler kaldet lipidsænkende midler, 2-azetidinoner.
Det vides ikke, om Zetia 10 mg er sikkert og effektivt til børn under 10 år.
Hvad er de mulige bivirkninger af Zetia?
Zetia kan forårsage alvorlige bivirkninger, herunder:
- muskelsmerter,
- muskelømhed eller svaghed,
- feber,
- usædvanlig træthed, og
- mørk farvet urin
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Zetia 10mg omfatter:
- muskel- eller ledsmerter,
- tilstoppet næse,
- sinus smerter,
- ondt i halsen,
- diarré, og
- smerter i en arm eller et ben
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Zetia. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
ZETIA (ezetimibe) er i en klasse af lipidsænkende forbindelser, der selektivt hæmmer den intestinale absorption af kolesterol og relaterede phytosteroler. Det kemiske navn for ezetimib er 1-(4-fluorphenyl)-3(R)-[3-(4-fluorphenyl)-3(S)-hydroxypropyl]-4(S)-(4-hydroxyphenyl)-2-azetidinon . Den empiriske formel er C24H21F2NO3. Dens molekylvægt er 409,4 og dens strukturformel er:
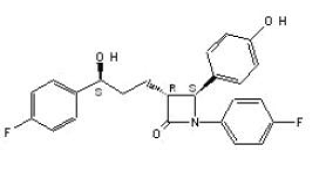
Ezetimibe er et hvidt, krystallinsk pulver, der er frit til meget opløseligt i ethanol, methanol og acetone og praktisk talt uopløseligt i vand. Ezetimib har et smeltepunkt på ca. 163°C og er stabilt ved omgivelsestemperatur. ZETIA 10mg fås som en tablet til oral administration indeholdende 10 mg ezetimib og følgende inaktive ingredienser: croscarmellosenatrium NF, lactosemonohydrat NF, magnesiumstearat NF, mikrokrystallinsk cellulose NF, povidon USP og natriumlaurylsulfat NF.
INDIKATIONER
Terapi med lipidændrende midler bør kun være en komponent i multipel risikofaktorintervention hos personer med signifikant øget risiko for aterosklerotisk vaskulær sygdom på grund af hyperkolesterolæmi. Lægemiddelbehandling er indiceret som et supplement til diæt, når responsen på en diæt begrænset i mættet fedt og kolesterol og andre ikke-farmakologiske foranstaltninger alene har været utilstrækkelig.
Primær hyperlipidæmi
Monoterapi
ZETIA®, administreret alene, er indiceret som supplerende terapi til diæt til reduktion af forhøjet totalkolesterol (total-C), lavdensitetslipoproteinkolesterol (LDL-C), apolipoprotein B (Apo B) og ikke-højdensitetslipoproteinkolesterol (non-HDL-C) hos patienter med primær (heterozygot familiær og ikke-familiær) hyperlipidæmi.
Kombinationsterapi med HMG-CoA-reduktasehæmmere (statiner)
ZETIA 10 mg, administreret i kombination med en 3-hydroxy-3-methylglutaryl-coenzym A (HMG-CoA) reduktasehæmmer (statin), er indiceret som supplerende terapi til diæt til reduktion af forhøjet total-C, LDL-C, Apo B og non-HDL-C hos patienter med primær (heterozygot familiær og ikke-familiær) hyperlipidæmi.
Kombinationsterapi med fenofibrat
ZETIA 10 mg, administreret i kombination med fenofibrat, er indiceret som supplerende terapi til diæt til reduktion af forhøjet total-C, LDL-C, Apo B og non-HDL-C hos voksne patienter med blandet hyperlipidæmi.
Homozygot familiær hyperkolesterolæmi (HoFH)
Kombinationen af ZETIA 10mg og atorvastatin eller simvastatin er indiceret til reduktion af forhøjede total-C- og LDL-C-niveauer hos patienter med HoFH, som et supplement til andre lipidsænkende behandlinger (f.eks. LDL-aferese), eller hvis sådanne behandlinger ikke er tilgængelige .
Homozygot sitosterolæmi
ZETIA 10mg er indiceret som supplerende terapi til diæt til reduktion af forhøjede sitosterol- og campesterolniveauer hos patienter med homozygot familiær sitosterolæmi.
Brugsbegrænsninger
Effekten af ZETIA på kardiovaskulær morbiditet og mortalitet er ikke blevet bestemt.
ZETIA er ikke blevet undersøgt ved Fredrickson Type I, III, IV og V dyslipidæmi.
DOSERING OG ADMINISTRATION
Generel doseringsinformation
Den anbefalede dosis af ZETIA er 10 mg én gang dagligt.
ZETIA 10 mg kan indgives med eller uden mad.
Samtidig lipidsænkende terapi
ZETIA 10 mg kan administreres sammen med et statin (hos patienter med primær hyperlipidæmi) eller med fenofibrat (hos patienter med blandet hyperlipidæmi) for at opnå øget effekt. For nemheds skyld kan den daglige dosis af ZETIA tages samtidig med statinet eller fenofibrat i henhold til doseringsanbefalingerne for de respektive lægemidler.
Coadminis med galdesyrebindende midler
Dosering af ZETIA bør ske enten ≥2 timer før eller ≥4 timer efter administration af et galdesyrebindende middel [se DRUGSINTERAKTIONER ].
Patienter med nedsat leverfunktion
Dosisjustering er ikke nødvendig hos patienter med let nedsat leverfunktion [se ADVARSLER OG FORHOLDSREGLER ].
Patienter med nedsat nyrefunktion
Dosisjustering er ikke nødvendig hos patienter med nedsat nyrefunktion [se KLINISK FARMAKOLOGI ]. Når det gives sammen med simvastatin til patienter med moderat til svær nyreinsufficiens (estimeret glomerulær filtrationshastighed Brug i specifikke populationer ].
Geriatriske patienter
Ingen dosisjustering er nødvendig hos geriatriske patienter [se KLINISK FARMAKOLOGI ].
HVORDAN LEVERET
Doseringsformer og styrker
10 mg tabletter er hvide til råhvide, kapselformede tabletter præget med "414" på den ene side.
Opbevaring og håndtering
nr. 3861 - Tabletter ZETIA, 10 mg , er hvide til råhvide, kapselformede tabletter præget med "414" på den ene side. De leveres som følger:
NDC 66582-414-31 flasker á 30 NDC 66582-414-54 flasker á 90 NDC 66582-414-74 flasker á 500 NDC 66582-414-76 flasker á 5000 NDC 66582-414-28 enhedsdosispakker med 100 stk.
Opbevaring
Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F). [Se USP kontrolleret rumtemperatur .] Beskyt mod fugt.
Merck Sharp & Dohme Corp., et datterselskab af MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revideret: august 2013
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet mere detaljeret i andre sektioner af etiketten:
- Leverenzymabnormiteter [se ADVARSLER OG FORHOLDSREGLER ]
- Rhabdomyolyse og myopati [se ADVARSLER OG FORHOLDSREGLER ]
Monoterapi studier
ZETIA 10 mg kontrollerede kliniske forsøgsdatabase (placebokontrolleret) af 2396 patienter med en median behandlingsvarighed på 12 uger (interval 0 til 39 uger), seponerede 3,3 % af patienterne på ZETIA 10 mg og 2,9 % af patienterne på placebo på grund af bivirkninger reaktioner. De mest almindelige bivirkninger i gruppen af patienter, der blev behandlet med ZETIA 10 mg, som førte til afbrydelse af behandlingen og forekom med en højere hastighed end placebo, var:
- Artralgi (0,3 %)
- Svimmelhed (0,2 %)
- Gamma-glutamyltransferase øget (0,2 %)
De mest almindeligt rapporterede bivirkninger (hyppighed ≥2 % og større end placebo) i ZETIA monoterapi-kontrollerede kliniske forsøgsdatabase med 2396 patienter var: øvre luftvejsinfektion (4,3 %), diarré (4,1 %), artralgi (3,0 %), bihulebetændelse (2,8%) og smerter i ekstremiteter (2,7%).
Statin Coadministration Studier
ZETIA + statin-kontrollerede kliniske forsøgsdatabase med 11.308 patienter med en median behandlingsvarighed på 8 uger (interval 0 til 112 uger), seponerede 4,0 % af patienterne på ZETIA + statin og 3,3 % af patienterne på statin alene på grund af bivirkninger. De mest almindelige bivirkninger i gruppen af patienter, der blev behandlet med ZETIA + statin, som førte til afbrydelse af behandlingen og forekom med en højere hastighed end statin alene, var:
- Alaninaminotransferase øget (0,6 %)
- Myalgi (0,5 %)
- Træthed, øget aspartataminotransferase, hovedpine og smerter i ekstremiteter (hver på 0,2 %)
De mest almindeligt rapporterede bivirkninger (hyppighed ≥2 % og større end statin alene) i ZETIA + statin-kontrollerede kliniske forsøgsdatabase med 11.308 patienter var: nasopharyngitis (3,7 %), myalgi (3,2 %), øvre luftvejsinfektion (2,9 % ), artralgi (2,6%) og diarré (2,5%).
Erfaring med kliniske forsøg
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan frekvensen af bivirkninger observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenserne i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
Monoterapi
I 10 dobbeltblindede, placebokontrollerede kliniske forsøg, 2396 patienter med primær hyperlipidæmi (aldersinterval 9-86 år, 50 % kvinder, 90 % kaukasiere, 5 % sorte, 3 % latinamerikanere, 2 % asiater) og forhøjet LDL-C blev behandlet med ZETIA 10 mg/dag i en median behandlingsvarighed på 12 uger (fra 0 til 39 uger).
Bivirkninger rapporteret hos ≥2 % af patienterne behandlet med ZETIA og med en hyppighed større end placebo i placebokontrollerede undersøgelser af ZETIA 10 mg, uanset kausalitetsvurdering, er vist i tabel 1.
TABEL 1: Kliniske bivirkninger, der forekommer hos ≥2 % af patienter behandlet med ZETIA 10 mg og med en forekomst større end placebo, uanset årsagssammenhæng
Hyppigheden af mindre almindelige bivirkninger var sammenlignelig mellem ZETIA 10 mg og placebo.
Kombination med en statin
I 28 dobbeltblindede, kontrollerede (placebo eller aktivt kontrollerede) kliniske forsøg, 11.308 patienter med primær hyperlipidæmi (aldersinterval 10-93 år, 48 % kvinder, 85 % kaukasiere, 7 % sorte, 4 % latinamerikanere, 3 % asiater) og forhøjet LDL-C blev behandlet med ZETIA 10 mg/dag samtidig med eller tilføjet til igangværende statinbehandling i en median behandlingsvarighed på 8 uger (interval 0 til 112 uger).
Hyppigheden af på hinanden følgende øgede transaminaser (≥3 × ULN) var højere hos patienter, der fik ZETIA 10 mg administreret med statiner (1,3 %) end hos patienter behandlet med statiner alene (0,4 %). [Se ADVARSLER OG FORHOLDSREGLER ]
Kliniske bivirkninger rapporteret hos ≥2 % af patienterne behandlet med ZETIA + statin og med en forekomst større end statin, uanset kausalitetsvurdering, er vist i tabel 2.
TABEL 2: Kliniske bivirkninger, der forekommer hos ≥2 % af patienterne behandlet med ZETIA 10 mg sammen med et statin og med en forekomst større end statin, uanset årsagssammenhæng
Kombination med fenofibrat
Denne kliniske undersøgelse involverede 625 patienter med blandet dyslipidæmi (aldersinterval 20-76 år, 44 % kvinder, 79 % kaukasiere, 0,1 % sorte, 11 % latinamerikanere, 5 % asiater) behandlet i op til 12 uger og 576 patienter behandlet i op til yderligere 48 uger evalueret samtidig administration af ZETIA og fenofibrat. Denne undersøgelse var ikke designet til at sammenligne behandlingsgrupper for sjældne hændelser. Incidensrater (95 % CI) for klinisk vigtige stigninger (≥3 — ULN, fortløbende) i levertransaminaseniveauer var 4,5 % (1,9, 8,8) og 2,7 % (1,2, 5,4) for fenofibrat monoterapi (n=188) og ZETIA administreret samtidigt med fenofibrat (n=183), henholdsvis justeret for behandlingseksponering. Tilsvarende incidensrater for kolecystektomi var henholdsvis 0,6 % (95 % CI: 0,0 %, 3,1 %) og 1,7 % (95 % CI: 0,6 %, 4,0 %) for fenofibrat monoterapi og ZETIA 10 mg samtidig administreret med fenofibrat [se DRUGSINTERAKTIONER ]. Antallet af patienter, der blev udsat for samtidig administrationsbehandling samt fenofibrat og ezetimib monoterapi var utilstrækkeligt til at vurdere risikoen for galdeblæresygdom. Der var ingen CPK-stigninger > 10 — ULN i nogen af behandlingsgrupperne.
Post-marketing oplevelse
Fordi nedenstående reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det generelt ikke muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Følgende yderligere bivirkninger er blevet identificeret under brug af ZETIA efter godkendelse:
Overfølsomhedsreaktioner, herunder anafylaksi, angioødem, udslæt og nældefeber; erythema multiforme; artralgi; myalgi; forhøjet kreatinfosfokinase; myopati/rhabdomyolyse [se ADVARSLER OG FORHOLDSREGLER ]; stigninger i levertransaminaser; hepatitis; mavesmerter; trombocytopeni; pancreatitis; kvalme; svimmelhed; paræstesi; depression; hovedpine; kolelithiasis; kolecystitis.
DRUGSINTERAKTIONER
[Se KLINISK FARMAKOLOGI ]
Cyclosporin
Der bør udvises forsigtighed ved samtidig brug af ZETIA 10 mg og ciclosporin på grund af øget eksponering for både ezetimib og ciclosporin. Cyclosporinkoncentrationer bør overvåges hos patienter, der får ZETIA og cyclosporin.
Graden af stigning i eksponeringen for ezetimib kan være større hos patienter med svær nyreinsufficiens. Hos patienter behandlet med ciclosporin bør de potentielle virkninger af den øgede eksponering for ezetimib ved samtidig brug omhyggeligt afvejes i forhold til fordelene ved ændringer i lipidniveauer, som ezetimib giver.
Fibrater
Effekten og sikkerheden ved samtidig administration af ezetimib med andre fibrater end fenofibrat er ikke blevet undersøgt.
Fibrater kan øge kolesteroludskillelsen i galden, hvilket fører til kolelithiasis. I et præklinisk studie med hunde øgede ezetimib kolesterol i galdeblærens galde [se Ikke-klinisk toksikologi ]. Samtidig administration af ZETIA med andre fibrater end fenofibrat anbefales ikke, før brug hos patienter er tilstrækkeligt undersøgt.
Fenofibrat
Hvis der er mistanke om kolelithiasis hos en patient, der får ZETIA 10 mg og fenofibrat, er galdeblæreundersøgelser indiceret, og alternativ lipidsænkende behandling bør overvejes [se BIVIRKNINGER og produktmærkningen for fenofibrat].
Kolestyramin
Samtidig administration af cholestyramin reducerede det gennemsnitlige areal under kurven (AUC) for total ezetimib med ca. 55 %. Den trinvise LDL-C-reduktion som følge af tilføjelse af ezetimib til cholestyramin kan reduceres af denne interaktion.
Coumarin antikoagulantia
Hvis ezetimib sættes til warfarin, et coumarinantikoagulant, bør International Normalized Ratio (INR) monitoreres passende.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Brug sammen med statiner eller fenofibrat
Samtidig administration af ZETIA med et specifikt statin eller fenofibrat bør være i overensstemmelse med produktmærkningen for den pågældende medicin.
Leverenzymer
kontrollerede kliniske monoterapistudier var forekomsten af på hinanden følgende stigninger (≥3 x den øvre grænse for normal [ULN]) i levertransaminaseniveauer ens mellem ZETIA (0,5 %) og placebo (0,3 %).
I kontrollerede kliniske kombinationsstudier af ZETIA 10 mg, der blev påbegyndt samtidig med et statin, var forekomsten af på hinanden følgende stigninger (≥3 x ULN) i levertransaminaseniveauer 1,3 % for patienter behandlet med ZETIA administreret med statiner og 0,4 % for patienter behandlet med statiner alene. Disse stigninger i transaminaser var generelt asymptomatiske, ikke forbundet med kolestase og vendte tilbage til baseline efter seponering af behandlingen eller med fortsat behandling. Når ZETIA administreres samtidigt med et statin, skal leverprøver udføres ved påbegyndelse af behandlingen og i henhold til anbefalingerne fra statinet. Hvis en stigning i ALAT eller ASAT ≥3 x ULN fortsætter, skal du overveje seponering af ZETIA 10 mg og/eller statinet.
Myopati/Rhabdomyolyse
kliniske forsøg var der ingen overskydende myopati eller rabdomyolyse forbundet med ZETIA 10 mg sammenlignet med den relevante kontrolarm (placebo eller statin alene). Imidlertid er myopati og rabdomyolyse kendte bivirkninger på statiner og andre lipidsænkende lægemidler. I kliniske forsøg var forekomsten af kreatinfosphokinase (CPK) > 10 x ULN 0,2 % for ZETIA vs. 0,1 % for placebo, og 0,1 % for ZETIA administreret sammen med et statin vs. 0,4 % for statiner alene. Risikoen for skeletmuskeltoksicitet stiger med højere doser af statin, fremskreden alder (> 65), hypothyroidisme, nedsat nyrefunktion og afhængigt af det anvendte statin, samtidig brug af andre lægemidler.
Efter markedsføring af ZETIA er der rapporteret tilfælde af myopati og rabdomyolyse. De fleste patienter, som udviklede rabdomyolyse, tog et statin før påbegyndelse af ZETIA. Imidlertid er rabdomyolyse blevet rapporteret med ZETIA 10 mg monoterapi og med tilføjelse af ZETIA 10 mg til midler, der vides at være forbundet med øget risiko for rabdomyolyse, såsom fibrater. ZETIA og enhver statin eller fibrat, som patienten tager samtidig, skal seponeres øjeblikkeligt, hvis der er diagnosticeret eller mistanke om myopati. Tilstedeværelsen af muskelsymptomer og et CPK-niveau > 10 x ULN indikerer myopati.
Nedsat leverfunktion
På grund af de ukendte virkninger af den øgede eksponering for ezetimib hos patienter med moderat til svær leverinsufficiens, anbefales ZETIA ikke til disse patienter. [Se KLINISK FARMAKOLOGI ]
Patientrådgivningsinformation
Se FDA-godkendt patientmærkning (PATIENTINFORMATION).
Patienter bør rådes til at overholde deres National Cholesterol Education Program (NCEP) anbefalede diæt, et regelmæssigt træningsprogram og periodisk test af et fastende lipidpanel.
Muskelsmerter
Alle patienter, der starter behandling med ezetimibe, skal informeres om risikoen for myopati og informeres om øjeblikkeligt at rapportere enhver uforklarlig muskelsmerte, ømhed eller svaghed. Risikoen for dette er øget, når du tager visse typer medicin. Patienter bør diskutere al medicin, både receptpligtig og håndkøbsmedicin, med deres læge.
Leverenzymer
Leverprøver bør udføres, når ZETIA 10 mg tilføjes til statinbehandling og i henhold til statin-anbefalinger.
Graviditet
Kvinder i den fødedygtige alder bør rådes til at bruge en effektiv præventionsmetode for at forhindre graviditet, mens de bruger ZETIA tilsat statinbehandling. Diskuter fremtidige graviditetsplaner med dine patienter, og diskuter, hvornår de skal stoppe kombinationen ZETIA 10 mg og statinbehandling, hvis de forsøger at blive gravide. Patienter skal informeres om, at hvis de bliver gravide, skal de stoppe med at tage kombinationen ZETIA 10 mg og statinbehandling og ringe til deres sundhedspersonale.
Amning
Kvinder, der ammer, bør rådes til ikke at bruge ZETIA tilsat statinbehandling. Patienter, der har en lipidforstyrrelse og ammer, bør rådes til at drøfte mulighederne med deres sundhedspersonale.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
En 104-ugers diætcarcinogenicitetsundersøgelse med ezetimib blev udført i rotter i doser op til 1500 mg/kg/dag (hanner) og 500 mg/kg/dag (hun) (~20 x den humane eksponering ved 10 mg dagligt baseret på AUC0 -24 timer for total ezetimib). En 104-ugers diætcarcinogenicitetsundersøgelse med ezetimibe blev også udført på mus i doser på op til 500 mg/kg/dag (> 150 x den humane eksponering ved 10 mg dagligt baseret på AUC0-24 timer for total ezetimib). Der var ingen statistisk signifikante stigninger i tumorforekomster hos lægemiddelbehandlede rotter eller mus.
Der blev ikke observeret tegn på mutagenicitet in vitro i en mikrobiel mutagenicitetstest (Ames) med Salmonella typhimurium og Escherichia coli med eller uden metabolisk aktivering. Der blev ikke observeret tegn på klastogenicitet in vitro i en kromosomafvigelsesanalyse i humane perifere blodlymfocytter med eller uden metabolisk aktivering. Derudover var der ingen tegn på genotoksicitet i in vivo-muse mikronukleustesten.
orale (gavage) fertilitetsundersøgelser af ezetimib udført i rotter var der ingen tegn på reproduktionstoksicitet ved doser op til 1000 mg/kg/dag hos han- eller hunrotter (~7 x den humane eksponering ved 10 mg dagligt baseret på AUC0- 24 timer for total ezetimib).
Brug i specifikke populationer
Graviditet
Graviditetskategori C
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af ezetimib hos gravide kvinder. Ezetimib bør kun anvendes under graviditet, hvis den potentielle fordel opvejer risikoen for fosteret.
orale (gavage) embryo-føtale udviklingsundersøgelser af ezetimib udført i rotter og kaniner under organogenese, var der ingen tegn på embryoletale virkninger ved de testede doser (250, 500, 1000 mg/kg/dag). Hos rotter blev der observeret en øget forekomst af almindelige føtale skeletfund (ekstra par thoraxribben, uskadet cervikal vertebral centra, forkortede ribben) ved 1000 mg/kg/dag (~10 x den humane eksponering ved 10 mg dagligt baseret på AUC0-24 timer for total ezetimib). Hos kaniner behandlet med ezetimibe blev der observeret en øget forekomst af ekstra thorax ribben ved 1000 mg/kg/dag (150 x den humane eksponering ved 10 mg dagligt baseret på AUC0-24 timer for total ezetimib). Ezetimib krydsede placenta, når gravide rotter og kaniner fik flere orale doser.
Multipel-dosis undersøgelser af ezetimib givet i kombination med statiner hos rotter og kaniner under organogenese resulterer i højere eksponeringer for ezetimib og statiner. Reproduktive fund forekommer ved lavere doser i kombinationsterapi sammenlignet med monoterapi.
Alle statiner er kontraindiceret til gravide og ammende kvinder. Når ZETIA 10 mg administreres sammen med et statin til en kvinde i den fødedygtige alder, henvises til graviditetskategorien og produktmærkningen for statinet. [Se KONTRAINDIKATIONER]
Ammende mødre
Det vides ikke, om ezetimib udskilles i human modermælk. I rotteundersøgelser var eksponeringen for total ezetimibe hos diende unger op til halvdelen af den, der blev observeret i moderens plasma. Da mange lægemidler udskilles i modermælk, bør der udvises forsigtighed, når ZETIA 10 mg administreres til en ammende kvinde. ZETIA bør ikke anvendes til ammende mødre, medmindre den potentielle fordel opvejer den potentielle risiko for spædbarnet.
Pædiatrisk brug
Virkningerne af ZETIA administreret sammen med simvastatin (n=126) sammenlignet med simvastatin monoterapi (n=122) er blevet evalueret hos unge drenge og piger med heterozygot familiær hyperkolesterolæmi (HeFH). I et multicenter, dobbeltblindt, kontrolleret studie efterfulgt af en åben fase, 142 drenge og 106 postmenarkale piger, 10 til 17 år (gennemsnitsalder 14,2 år, 43 % kvinder, 82 % kaukasiere, 4 % asiatiske, 2 % sorte , 13 % multi-race) med HeFH blev randomiseret til at modtage enten ZETIA 10 mg samtidig administreret med simvastatin eller simvastatin monoterapi. Inkludering i undersøgelsen krævede 1) et baseline LDL-C-niveau mellem 160 og 400 mg/dL og 2) en sygehistorie og klinisk præsentation i overensstemmelse med HeFH. Den gennemsnitlige baseline LDL-C-værdi var 225 mg/dL (interval: 161-351 mg/dL) i ZETIA 10 mg administreret sammen med simvastatin-gruppen sammenlignet med 219 mg/dL (interval: 149-336 mg/dL) i simvastatin-monoterapien gruppe. Patienterne fik samtidig administreret ZETIA og simvastatin (10 mg, 20 mg eller 40 mg) eller simvastatin monoterapi (10 mg, 20 mg eller 40 mg) i 6 uger, samtidig administreret ZETIA og 40 mg simvastatin eller 40 mg simvastatin monoterapi for de næste 27 uger, og åben samtidig administreret ZETIA og simvastatin (10 mg, 20 mg eller 40 mg) i 20 uger derefter.
Resultaterne af undersøgelsen i uge 6 er opsummeret i tabel 3. Resultaterne i uge 33 var i overensstemmelse med dem i uge 6.
TABEL 3: Gennemsnitlig procentforskel i uge 6 mellem den samlede ZETIA 10 mg administreret sammen med Simvastatin-gruppen og den samlede simvastatin-monoterapigruppe hos unge patienter med heterozygot familiær hyperkolesterolæmi
Fra starten af forsøget til slutningen af uge 33 forekom seponeringer på grund af en bivirkning hos 7 (6 %) patienter i ZETIA-gruppen, der blev administreret sammen med simvastatin-gruppen og hos 2 (2 %) patienter i monoterapigruppen med simvastatin.
Under forsøget forekom stigninger i levertransaminase (to på hinanden følgende målinger for ALAT og/eller ASAT ≥3 x ULN) hos fire (3 %) individer i ZETIA 10 mg administreret sammen med simvastatin-gruppen og hos to (2 %) individer i simvastatin-monoterapien. gruppe. Forhøjelser af CPK (≥10 x ULN) forekom hos to (2%) individer i ZETIA-gruppen, der blev administreret sammen med simvastatin-gruppen og hos nul individer i simvastatin-monoterapigruppen.
I denne begrænsede kontrollerede undersøgelse var der ingen signifikant effekt på vækst eller seksuel modning hos de unge drenge eller piger eller på menstruationscykluslængden hos piger.
Samtidig administration af ZETIA 10 mg og simvastatin i doser større end 40 mg/dag er ikke blevet undersøgt hos unge. ZETIA 10 mg er heller ikke blevet undersøgt hos patienter yngre end 10 år eller hos præmenarkalske piger.
Baseret på total ezetimib (ezetimib + ezetimib-glucuronid) er der ingen farmakokinetiske forskelle mellem unge og voksne. Farmakokinetiske data for den pædiatriske population
Geriatrisk brug
Monoterapi studier
Af de 2396 patienter, der fik ZETIA 10 mg i kliniske undersøgelser, var 669 (28%) 65 år og ældre, og 111 (5%) var 75 år og ældre.
Statin Coadministration Studier
Af de 11.308 patienter, der fik ZETIA + statin i kliniske undersøgelser, var 3587 (32%) 65 år og ældre, og 924 (8%) var 75 år og ældre.
Der blev ikke observeret nogen overordnede forskelle i sikkerhed og effektivitet mellem disse patienter og yngre patienter, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre personer kan ikke udelukkes [se KLINISK FARMAKOLOGI ].
Nedsat nyrefunktion
Når det anvendes som monoterapi, er dosisjustering af ZETIA 10 mg ikke nødvendig.
studiet af hjerte- og nyrebeskyttelse (SHARP) forsøget med 9270 patienter med moderat til svært nedsat nyrefunktion (6247 ikke-dialysepatienter med median serumkreatinin 2,5 mg/dL og median estimeret glomerulær filtrationshastighed 25,6 ml/min/1,73 m², og 3023 dialysepatienter), var forekomsten af alvorlige bivirkninger, bivirkninger, der førte til afbrydelse af undersøgelsesbehandlingen, eller bivirkninger af særlig interesse (muskuloskeletale bivirkninger, leverenzymabnormaliteter, hændelig cancer) ens for patienter, der nogensinde er blevet tildelt ezetimib 10 mg plus simvastatin 20 mg (n=4650) eller placebo (n=4620) under en median opfølgning på 4,9 år. Men da nedsat nyrefunktion er en risikofaktor for statin-associeret myopati, bør doser af simvastatin på over 20 mg anvendes med forsigtighed og nøje monitorering, når det administreres samtidig med ZETIA til patienter med moderat til svær nyreinsufficiens.
Nedsat leverfunktion
ZETIA anbefales ikke til patienter med moderat til svært nedsat leverfunktion [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
ZETIA 10 mg givet samtidig med et statin er kontraindiceret til patienter med aktiv leversygdom eller uforklarlige vedvarende stigninger i levertransaminaseniveauer [se KONTRAINDIKATIONER ; ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
OVERDOSIS
I kliniske undersøgelser, administration af ezetimibe, 50 mg/dag til 15 raske forsøgspersoner i op til 14 dage, 40 mg/dag til 18 patienter med primær hyperlipidæmi i op til 56 dage og 40 mg/dag til 27 patienter med homozygot sitosterolæmi for 26 uger var generelt godt tolereret. En kvindelig patient med homozygot sitosterolæmi tog en utilsigtet overdosis af ezetimibe 120 mg/dag i 28 dage uden rapporterede kliniske eller laboratoriemæssige bivirkninger.
I tilfælde af en overdosis bør symptomatiske og understøttende foranstaltninger anvendes.
KONTRAINDIKATIONER
ZETIA er kontraindiceret under følgende forhold:
- Kombinationen af ZETIA 10mg med et statin er kontraindiceret hos patienter med aktiv leversygdom eller uforklarlige vedvarende stigninger i levertransaminaseniveauer.
- Kvinder, der er gravide eller kan blive gravide. Da statiner nedsætter kolesterolsyntesen og muligvis syntesen af andre biologisk aktive stoffer afledt af kolesterol, kan ZETIA i kombination med et statin forårsage fosterskader, når det administreres til gravide kvinder. Derudover er der ingen tilsyneladende fordele ved terapi under graviditet, og sikkerheden hos gravide kvinder er ikke blevet fastslået. Hvis patienten bliver gravid, mens hun tager dette lægemiddel, skal patienten informeres om den potentielle fare for fosteret og manglen på kendte kliniske fordele ved fortsat brug under graviditet. [Se Brug i specifikke populationer ]
- Ammende mødre. Fordi statiner kan gå over i modermælken, og fordi statiner har potentiale til at forårsage alvorlige bivirkninger hos ammende spædbørn, bør kvinder, der har behov for ZETIA-behandling i kombination med et statin, rådes til ikke at amme deres spædbørn [se Brug i specifikke populationer ].
- Patienter med kendt overfølsomhed over for en hvilken som helst komponent i dette produkt. Overfølsomhedsreaktioner inklusive anafylaksi, angioødem, udslæt og nældefeber er blevet rapporteret med ZETIA [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Ezetimib reducerer kolesterol i blodet ved at hæmme absorptionen af kolesterol i tyndtarmen. I et 2-ugers klinisk studie med 18 hyperkolesterolæmiske patienter hæmmede ZETIA 10 mg intestinal kolesterolabsorption med 54 % sammenlignet med placebo. ZETIA havde ingen klinisk betydningsfuld effekt på plasmakoncentrationerne af de fedtopløselige vitaminer A, D og E (i en undersøgelse med 113 patienter), og forringede ikke produktionen af binyrebarksteroidhormon (i en undersøgelse med 118 patienter).
Kolesterolindholdet i leveren stammer overvejende fra tre kilder. Leveren kan syntetisere kolesterol, optage kolesterol fra blodet fra cirkulerende lipoproteiner eller optage kolesterol absorberet af tyndtarmen. Intestinalt kolesterol stammer primært fra kolesterol udskilt i galden og fra kostens kolesterol.
Ezetimib har en virkningsmekanisme, der adskiller sig fra andre klasser af kolesterol-reducerende forbindelser (statiner, galdesyrebindende midler [harpikser], fibrinsyrederivater og plantestanoler). Det molekylære mål for ezetimib har vist sig at være steroltransportøren, Niemann-Pick C1-Like 1 (NPC1L1), som er involveret i tarmens optagelse af kolesterol og phytosteroler.
Ezetimib hæmmer ikke kolesterolsyntesen i leveren eller øger udskillelsen af galdesyre. I stedet lokaliseres ezetimibe ved børstekanten af tyndtarmen og hæmmer absorptionen af kolesterol, hvilket fører til et fald i leveringen af intestinalt kolesterol til leveren. Dette forårsager en reduktion af hepatiske kolesteroldepoter og en stigning i clearance af kolesterol fra blodet; denne særskilte mekanisme er komplementær til den for statiner og fenofibrat [se Kliniske Studier ].
Farmakodynamik
Kliniske undersøgelser har vist, at forhøjede niveauer af total-C, LDL-C og Apo B, hovedproteinbestanddelen af LDL, fremmer human aterosklerose. Derudover er nedsatte niveauer af HDL-C forbundet med udviklingen af åreforkalkning. Epidemiologiske undersøgelser har fastslået, at kardiovaskulær morbiditet og dødelighed varierer direkte med niveauet af total-C og LDL-C og omvendt med niveauet af HDL-C. Ligesom LDL kan kolesterolberigede triglyceridrige lipoproteiner, herunder meget-lavdensitetslipoproteiner (VLDL), intermediate-density lipoproteins (IDL) og rester, også fremme åreforkalkning. Den uafhængige effekt af at hæve HDL-C eller sænke TG på risikoen for koronar og kardiovaskulær morbiditet og dødelighed er ikke blevet bestemt.
ZETIA reducerer total-C, LDL-C, Apo B, non-HDL-C og TG og øger HDL-C hos patienter med hyperlipidæmi. Administration af ZETIA 10mg med et statin er effektivt til at forbedre serum total-C, LDL-C, Apo B, non-HDL-C, TG og HDL-C ud over hver behandling alene. Administration af ZETIA 10 mg med fenofibrat er effektiv til at forbedre serum total-C, LDL-C, Apo B og non-HDL-C hos patienter med blandet hyperlipidæmi sammenlignet med begge behandlinger alene. Effekten af ezetimib givet enten alene eller som supplement til et statin eller fenofibrat på kardiovaskulær morbiditet og mortalitet er ikke fastlagt.
Farmakokinetik
Absorption
Efter oral administration absorberes ezetimib og konjugeres i vid udstrækning til et farmakologisk aktivt phenolglucuronid (ezetimib-glucuronid). Efter en enkelt 10 mg dosis af ZETIA 10 mg til fastende voksne, blev gennemsnitlige ezetimib peak plasmakoncentrationer (Cmax) på 3,4 til 5,5 ng/ml opnået inden for 4 til 12 timer (Tmax). Gennemsnitlige Cmax-værdier for ezetimib-glucuronid på 45 til 71 ng/ml blev opnået mellem 1 og 2 timer (Tmax). Der var ingen væsentlig afvigelse fra dosisproportionalitet mellem 5 og 20 mg. Den absolutte biotilgængelighed af ezetimib kan ikke bestemmes, da forbindelsen er praktisk talt uopløselig i vandige medier, der er egnede til injektion.
Effekt af mad på oral absorption
Samtidig fødeindtagelse (fedtrige eller fedtfrie måltider) havde ingen effekt på absorptionsgraden af ezetimib, når det blev administreret som ZETIA 10 mg tabletter. C-værdien af ezetimib blev øget med 38 % ved indtagelse af fedtrige måltider. ZETIA kan indgives med eller uden mad.
Fordeling
Ezetimib og ezetimib-glucuronid er stærkt bundet (> 90%) til humane plasmaproteiner.
Metabolisme og udskillelse
Ezetimib metaboliseres primært i tyndtarmen og leveren via glucuronidkonjugering (en fase II-reaktion) med efterfølgende galde- og nyreudskillelse. Minimal oxidativ metabolisme (en fase I-reaktion) er blevet observeret hos alle evaluerede arter.
Hos mennesker metaboliseres ezetimib hurtigt til ezetimib-glucuronid. Ezetimib og ezetimibeglucuronid er de vigtigste lægemiddelafledte forbindelser påvist i plasma, der udgør henholdsvis ca. 10 til 20 % og 80 til 90 % af det samlede lægemiddel i plasma. Både ezetimib og ezetimibeglucuronid elimineres fra plasma med en halveringstid på ca. 22 timer for både ezetimib og ezetimibeglucuronid. Plasmakoncentration-tidsprofiler udviser flere toppe, hvilket tyder på enterohepatisk genbrug.
Efter oral administration af 14C-ezetimib (20 mg) til mennesker udgjorde total ezetimib (ezetimib + ezetimib-glucuronid) ca. 93 % af den samlede radioaktivitet i plasma. Efter 48 timer var der ingen påviselige niveauer af radioaktivitet i plasmaet.
Ca. 78 % og 11 % af den administrerede radioaktivitet blev genfundet i henholdsvis fæces og urin over en 10-dages indsamlingsperiode. Ezetimib var hovedbestanddelen i fæces og tegnede sig for 69 % af den administrerede dosis, mens ezetimib-glucuronid var hovedbestanddelen i urinen og udgjorde 9 % af den administrerede dosis.
Specifikke populationer
Geriatriske patienter: I et flerdosisstudie med ezetimib givet 10 mg én gang dagligt i 10 dage var plasmakoncentrationerne for total ezetimib ca. 2 gange højere hos ældre (≥65 år) raske forsøgspersoner sammenlignet med yngre forsøgspersoner.
Pædiatriske patienter: [Se Brug i specifikke populationer ]
Køn: et flerdosisstudie med ezetimib givet 10 mg én gang dagligt i 10 dage var plasmakoncentrationerne for total ezetimib lidt højere (
Race: Baseret på en metaanalyse af farmakokinetiske undersøgelser med flere doser var der ingen farmakokinetiske forskelle mellem sorte og kaukasiske forsøgspersoner. Undersøgelser med asiatiske forsøgspersoner viste, at ezetimibs farmakokinetik svarede til dem, der ses hos kaukasiske forsøgspersoner.
Nedsat leverfunktion: Efter en enkelt dosis på 10 mg ezetimib var den gennemsnitlige AUC for total ezetimib øget ca. 1,7 gange hos patienter med let nedsat leverfunktion (Child-Pugh score 5 til 6) sammenlignet med raske forsøgspersoner. De gennemsnitlige AUC-værdier for total ezetimib og ezetimib blev øget henholdsvis ca. 3- til 4-fold og 5- til 6-fold hos patienter med moderat (Child-Pugh score 7 til 9) eller svær leverinsufficiens (Child-Pugh score 10 til 15). I et 14-dages studie med flere doser (10 mg dagligt) hos patienter med moderat nedsat leverfunktion, blev de gennemsnitlige AUC-værdier for total ezetimib og ezetimibe øget ca. 4 gange på dag 1 og dag 14 sammenlignet med raske forsøgspersoner. På grund af de ukendte virkninger af den øgede eksponering for ezetimib hos patienter med moderat eller svær leverinsufficiens, anbefales ZETIA ikke til disse patienter [se ADVARSLER OG FORHOLDSREGLER ].
Nedsat nyrefunktion: Efter en enkelt dosis på 10 mg ezetimib til patienter med alvorlig nyresygdom (n=8; gennemsnitlig CrCl ≥ 30 ml/min/1,73 m²) blev de gennemsnitlige AUC-værdier for total ezetimib, ezetimib-glucuronid og ezetimib øget med ca. 1,5 -fold sammenlignet med raske forsøgspersoner (n=9).
Lægemiddelinteraktioner
[Se også DRUGSINTERAKTIONER ]
ZETIA 10mg havde ingen signifikant effekt på en række probelægemidler (koffein, dextromethorphan, tolbutamid og IV midazolam), der vides at blive metaboliseret af cytochrom P450 (1A2, 2D6, 2C8/9 og 3A4) i en "cocktail" undersøgelse af tolv raske voksne mænd. Dette indikerer, at ezetimib hverken er en hæmmer eller en inducer af disse cytokrom P450-isozymer, og det er usandsynligt, at ezetimib vil påvirke metabolismen af lægemidler, der metaboliseres af disse enzymer.
TABEL 4: Effekt af samtidig administrerede lægemidler på total ezetimibe
TABEL 5: Effekt af samtidig administration af ezetimib på systemisk eksponering for andre lægemidler
Dyretoksikologi og/eller farmakologi
Den hypokolesterolæmiske virkning af ezetimib blev evalueret i kolesterolfodrede Rhesus-aber, hunde, rotter og musemodeller af humant kolesterolmetabolisme. Ezetimib viste sig at have en ED50-værdi på 0,5 μg/kg/dag for at hæmme stigningen i plasmakolesterolniveauer hos aber. ED50-værdierne hos hunde, rotter og mus var henholdsvis 7, 30 og 700 μg/kg/dag. Disse resultater stemmer overens med, at ZETIA er en potent kolesterolabsorptionshæmmer.
I en rottemodel, hvor glucuronidmetabolitten af ezetimib (SCH 60663) blev administreret intraduodenalt, var metabolitten lige så potent som moderforbindelsen (SCH 58235) til at hæmme absorptionen af kolesterol, hvilket tyder på, at glucuronidmetabolitten havde aktivitet svarende til moderstoffet. medicin.
1-måneders undersøgelser med hunde, der fik ezetimib (0,03 til 300 mg/kg/dag), steg koncentrationen af kolesterol i galdeblæren ~2- til 4 gange. Dog resulterede en dosis på 300 mg/kg/dag administreret til hunde i et år ikke i galdestensdannelse eller andre uønskede lever- og galdevirkninger. I en 14-dages undersøgelse med mus, der fik ezetimib (0,3 til 5 mg/kg/dag) og fodret med en fedtfattig eller kolesterolrig diæt, var koncentrationen af kolesterol i galdeblærens galde henholdsvis upåvirket eller reduceret til normale niveauer.
En række akutte prækliniske undersøgelser blev udført for at bestemme ZETIA's selektivitet til hæmning af kolesterolabsorption. Ezetimib hæmmede absorptionen af 14C-kolesterol uden effekt på absorptionen af triglycerider, fedtsyrer, galdesyrer, progesteron, ethinylestradiol eller de fedtopløselige vitaminer A og D.
4- til 12-ugers toksicitetsundersøgelser med mus inducerede ezetimib ikke cytokrom P450 lægemiddelmetaboliserende enzymer. I toksicitetsundersøgelser blev der set en farmakokinetisk interaktion mellem ezetimib og statiner (forældre eller deres aktive hydroxysyremetabolitter) hos rotter, hunde og kaniner.
Kliniske Studier
Primær hyperlipidæmi
ZETIA 10mg reducerer total-C, LDL-C, Apo B, non-HDL-C og TG og øger HDL-C hos patienter med hyperlipidæmi. Maksimal til næsten maksimal respons opnås generelt inden for 2 uger og opretholdes under kronisk behandling.
Monoterapi
I to multicenter, dobbeltblindede, placebokontrollerede, 12-ugers undersøgelser med 1719 patienter med primær hyperlipidæmi, sænkede ZETIA signifikant total-C, LDL-C, Apo B, non-HDL-C og TG og øgede HDL- C sammenlignet med placebo (se tabel 6). Reduktionen i LDL-C var konsistent på tværs af alder, køn og baseline LDL-C.
TABEL 6: Respons på ZETIA 10 mg hos patienter med primær hyperlipidæmi (gennemsnitlig % ændring fra ubehandlet baseline†)
Kombination med statiner
ZETIA 10mg tilføjet til igangværende statinterapi
I et multicenter, dobbeltblindt, placebokontrolleret, 8-ugers studie, 769 patienter med primær hyperlipidæmi, kendt koronar hjertesygdom eller flere kardiovaskulære risikofaktorer, som allerede fik statin monoterapi, men som ikke havde opfyldt deres NCEP ATP II-mål LDL -C mål blev randomiseret til at modtage enten ZETIA 10 mg eller placebo ud over deres igangværende statin.
ZETIA 10 mg, tilføjet til igangværende statinbehandling, sænkede total-C, LDL-C, Apo B, non-HDL-C og TG signifikant og øgede HDL-C sammenlignet med et statin administreret alene (se tabel 7). LDL-C-reduktioner induceret af ZETIA 10mg var generelt konsistente på tværs af alle statiner.
TABEL 7: Respons på tilføjelse af ZETIA 10 mg til igangværende statinterapi hos patienter med hyperlipidæmi (gennemsnitlig % ændring fra behandlet baseline‡)
ZETIA påbegyndt samtidig med en statin
fire multicenter, dobbeltblindede, placebokontrollerede, 12-ugers forsøg, hos 2382 hyperlipidæmiske patienter, blev ZETIA eller placebo administreret alene eller sammen med forskellige doser af atorvastatin, simvastatin, pravastatin eller lovastatin.
Når alle patienter, der fik ZETIA med et statin, blev sammenlignet med alle dem, der fik det tilsvarende statin alene, sænkede ZETIA 10 mg signifikant total-C, LDL-C, Apo B, non-HDL-C og TG, og med undtagelse af pravastatin , øget HDL-C sammenlignet med statinet administreret alene. LDL-C-reduktioner induceret af ZETIA 10mg var generelt konsistente på tværs af alle statiner. (Se fodnote, tabel 8 til 11.)
TABEL 8: Respons på ZETIA 10 mg og atorvastatin initieret samtidigt hos patienter med primær hyperlipidæmi (gennemsnitlig % ændring fra ubehandlet baseline†)
TABEL 9: Respons på ZETIA 10 mg og simvastatin initieret samtidigt hos patienter med primær hyperlipidæmi (gennemsnitlig % ændring fra ubehandlet baseline†)
TABEL 10: Respons på ZETIA og Pravastatin initieret samtidigt hos patienter med primær hyperlipidæmi (gennemsnitlig % ændring fra ubehandlet baseline†)
TABEL 11: Respons på ZETIA og Lovastatin initieret samtidigt hos patienter med primær hyperlipidæmi (gennemsnitlig % ændring fra ubehandlet baseline†)
Kombination med fenofibrat
I et multicenter, dobbeltblindt, placebokontrolleret, klinisk studie med patienter med blandet hyperlipidæmi blev 625 patienter behandlet i op til 12 uger og 576 i op til yderligere 48 uger. Patienterne blev randomiseret til at modtage placebo, ZETIA alene, 160 mg fenofibrat alene eller ZETIA 10 mg og 160 mg fenofibrat i det 12-ugers studie. Efter at have afsluttet det 12-ugers studie, blev kvalificerede patienter tildelt ZETIA sammen med fenofibrat eller fenofibrat monoterapi i yderligere 48 uger.
ZETIA 10 mg sammen med fenofibrat sænkede total-C, LDL-C, Apo B og non-HDL-C signifikant sammenlignet med fenofibrat administreret alene. Den procentvise reduktion i TG og den procentvise stigning i HDLC for ZETIA administreret sammen med fenofibrat var sammenlignelige med dem for fenofibrat administreret alene (se tabel 12).
TABEL 12: Respons på ZETIA 10 mg og fenofibrat initieret samtidigt hos patienter med blandet hyperlipidæmi (gennemsnitlig % ændring fra ubehandlet baseline† efter 12 uger†)
Ændringerne i lipid-endepunkter efter yderligere 48 ugers behandling med ZETIA administreret sammen med fenofibrat eller med fenofibrat alene var i overensstemmelse med de 12-ugers data vist ovenfor.
Homozygot familiær hyperkolesterolæmi (HoFH)
En undersøgelse blev udført for at vurdere effektiviteten af ZETIA i behandlingen af HoFH. Dette dobbeltblindede, randomiserede, 12-ugers studie inkluderede 50 patienter med en klinisk og/eller genotypisk diagnose af HoFH, med eller uden samtidig LDL-aferese, som allerede fik atorvastatin eller simvastatin (40 mg). Patienterne blev randomiseret til en af tre behandlingsgrupper, atorvastatin eller simvastatin (80 mg), ZETIA 10 mg administreret med atorvastatin eller simvastatin (40 mg), eller ZETIA administreret med atorvastatin eller simvastatin (80 mg). På grund af nedsat biotilgængelighed af ezetimib hos patienter, der samtidig får kolestyramin [se DRUGSINTERAKTIONER ], blev ezetimib doseret mindst 4 timer før eller efter administration af harpikser. Den gennemsnitlige baseline LDL-C var 341 mg/dL hos de patienter, der var randomiseret til atorvastatin 80 mg eller simvastatin 80 mg alene og 316 mg/dL i gruppen randomiseret til ZETIA 10 mg plus atorvastatin 40 eller 80 mg eller simvastatin 40 eller 80 mg. ZETIA 10 mg, administreret med atorvastatin eller simvastatin (40- og 80-mg statingrupper, samlet), reducerede LDL-C signifikant (21 %) sammenlignet med at øge dosen af simvastatin eller atorvastatin monoterapi fra 40 til 80 mg (7 %). Hos dem, der blev behandlet med ZETIA 10 mg plus 80 mg atorvastatin eller med ZETIA 10 mg plus 80 mg simvastatin, blev LDL-C reduceret med 27 %.
Homozygot sitosterolæmi (fytosterolæmi)
En undersøgelse blev udført for at vurdere effektiviteten af ZETIA til behandling af homozygot sitosterolæmi. I dette multicenter, dobbeltblindede, placebokontrollerede, 8-ugers forsøg, 37 patienter med homozygot sitosterolæmi med forhøjede plasma sitosterolniveauer (> 5 mg/dL) på deres nuværende terapeutiske regime (diæt, galdesyrebindende harpikser, statiner, ileal bypass-operation og/eller LDL-aferese), blev randomiseret til at modtage ZETIA (n=30) eller placebo (n=7). På grund af nedsat biotilgængelighed af ezetimib hos patienter, der samtidig får kolestyramin [se DRUGSINTERAKTIONER ], blev ezetimib doseret mindst 2 timer før eller 4 timer efter, harpiks blev administreret. Udelukket den ene patient, der fik LDL-aferese, sænkede ZETIA plasma sitosterol og campesterol signifikant med henholdsvis 21 % og 24 % fra baseline. I modsætning hertil havde patienter, der fik placebo, stigninger i sitosterol og campesterol på henholdsvis 4 % og 3 % fra baseline. For patienter behandlet med ZETIA 10 mg blev de gennemsnitlige plasmaniveauer af plantesteroler reduceret progressivt i løbet af undersøgelsen. Virkningerne af at reducere plasma sitosterol og campesterol på at reducere risikoen for kardiovaskulær morbiditet og dødelighed er ikke blevet fastlagt.
Reduktioner i sitosterol og campesterol var konsistente mellem patienter, der tog ZETIA 10 mg samtidig med galdesyrebindende midler (n=8) og patienter, der ikke fik samtidig behandling med galdesyrebindende midler (n=21).
Brugsbegrænsninger
Effekten af ZETIA 10 mg på kardiovaskulær morbiditet og mortalitet er ikke blevet bestemt.
PATIENTOPLYSNINGER
ZETIA® (ezetimib) Tabletter
Patientinformation om ZETIA (zet´-ea)
Generisk navn: ezetimibe (e-zet´-e-mib)
Læs denne information omhyggeligt, før du begynder at tage ZETIA®, og hver gang du får mere ZETIA. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din læge om din medicinske tilstand eller din behandling. Spørg din læge, hvis du har spørgsmål om ZETIA. Kun din læge kan afgøre, om ZETIA er det rigtige for dig.
Hvad er ZETIA?
ZETIA er et lægemiddel, der bruges til at sænke niveauet af totalt kolesterol og LDL (dårligt) kolesterol i blodet. ZETIA er til patienter, som ikke kan kontrollere deres kolesteroltal alene ved diæt og motion. Det kan bruges alene eller sammen med andre lægemidler til behandling af forhøjet kolesterol. Du bør forblive på en kolesterolsænkende diæt, mens du tager denne medicin.
ZETIA arbejder på at reducere mængden af kolesterol, som din krop optager. ZETIA 10mg hjælper dig ikke med at tabe dig. ZETIA 10mg har ikke vist sig at forhindre hjertesygdomme eller hjerteanfald.
For mere information om kolesterol, se "Hvad skal jeg vide om højt kolesterol?" afsnit, der følger.
Hvem bør ikke tage ZETIA 10mg?
- Tag ikke ZETIA 10 mg, hvis du er allergisk over for ezetimib, det aktive stof i ZETIA, eller over for de inaktive ingredienser. For en liste over inaktive ingredienser, se afsnittet "Inaktive ingredienser" som følger.
- Hvis du har aktiv leversygdom, må du ikke tage ZETIA 10 mg, mens du tager kolesterolsænkende medicin kaldet statiner.
- Hvis du er gravid eller ammer, må du ikke tage ZETIA, mens du tager et statin.
- Hvis du er en kvinde i den fødedygtige alder, bør du bruge en effektiv præventionsmetode for at forhindre graviditet, mens du bruger ZETIA tilsat statinbehandling.
ZETIA er ikke blevet undersøgt hos børn under 10 år.
Hvad skal jeg fortælle min læge før og mens jeg tager ZETIA 10mg?
Fortæl din læge om enhver receptpligtig og ikke-receptpligtig medicin, du tager eller planlægger at tage, inklusive natur- eller naturlægemidler.
Fortæl din læge om alle dine medicinske tilstande, herunder allergier.
Fortæl det til din læge, hvis du:
- nogensinde har haft leverproblemer. ZETIA 10mg er muligvis ikke det rigtige for dig.
- er gravid eller planlægger at blive gravid. Din læge vil diskutere med dig, om ZETIA 10mg er det rigtige for dig.
- ammer. Vi ved ikke, om ZETIA 10 mg kan passere til din baby gennem din mælk. Din læge vil diskutere med dig, om ZETIA 10mg er det rigtige for dig.
- oplever uforklarlige muskelsmerter, ømhed eller svaghed.
Hvordan skal jeg tage ZETIA 10mg?
- Tag ZETIA én gang dagligt, med eller uden mad. Det kan være nemmere at huske at tage din dosis, hvis du gør det på samme tidspunkt hver dag, såsom med morgenmad, aftensmad eller ved sengetid. Hvis du også tager anden medicin for at sænke dit kolesteroltal, så spørg din læge, om du kan tage dem på samme tid.
- Hvis du glemmer at tage ZETIA, så tag det, så snart du kommer i tanke om det. Tag dog ikke mere end én dosis ZETIA om dagen.
- Fortsæt med at følge en kolesterolsænkende diæt, mens du tager ZETIA. Spørg din læge, hvis du har brug for kostoplysninger.
- Fortsæt med at tage ZETIA 10 mg, medmindre din læge fortæller dig at stoppe. Det er vigtigt, at du fortsætter med at tage ZETIA 10 mg, selvom du ikke føler dig syg.
- Se din læge regelmæssigt for at kontrollere dit kolesterolniveau og for at tjekke for bivirkninger. Din læge kan tage blodprøver for at kontrollere din lever, før du begynder at tage ZETIA med et statin og under behandlingen.
Hvad er de mulige bivirkninger af ZETIA?
kliniske undersøgelser rapporterede patienter få bivirkninger, mens de tog ZETIA. Disse omfattede diarré, ledsmerter og træthedsfølelse.
Patienter har oplevet alvorlige muskelproblemer, mens de tog ZETIA 10 mg, normalt når ZETIA 10 mg blev tilføjet til et statinlægemiddel. Hvis du oplever uforklarlige muskelsmerter, ømhed eller svaghed, mens du tager ZETIA, skal du straks kontakte din læge. Du skal gøre dette med det samme, for i sjældne tilfælde kan disse muskelproblemer være alvorlige, med muskelnedbrydning, der resulterer i nyreskade.
Derudover er følgende bivirkninger blevet rapporteret ved almindelig brug: allergiske reaktioner (som kan kræve behandling med det samme) inklusive hævelse af ansigt, læber, tunge og/eller hals, der kan forårsage vejrtræknings- eller synkebesvær, udslæt og nældefeber ; hævet rødt udslæt, nogle gange med målformede læsioner; ledsmerter; muskelsmerter; ændringer i nogle laboratorieblodprøver; leverproblemer; mavesmerter; betændelse i bugspytkirtlen; kvalme; svimmelhed; prikkende fornemmelse; depression; hovedpine; galdesten; betændelse i galdeblæren.
Fortæl din læge, hvis du har disse eller andre medicinske problemer, mens du er på ZETIA. Spørg din læge eller apoteket for at få en komplet liste over bivirkninger.
Hvad skal jeg vide om højt kolesteroltal?
Kolesterol er en type fedt, der findes i dit blod. Dit samlede kolesterol består af LDL- og HDL-kolesterol.
LDL-kolesterol kaldes "dårligt" kolesterol, fordi det kan opbygge sig i væggen af dine arterier og danne plak. Over tid kan plakopbygning forårsage en forsnævring af arterierne. Denne indsnævring kan bremse eller blokere blodgennemstrømningen til dit hjerte, hjerne og andre organer. Højt LDL-kolesterol er en væsentlig årsag til hjertesygdomme og en af årsagerne til slagtilfælde.
HDL-kolesterol kaldes "godt" kolesterol, fordi det forhindrer det dårlige kolesterol i at opbygge sig i arterierne.
Triglycerider er også fedtstoffer, der findes i dit blod.
Generel information om ZETIA
Lægemidler ordineres nogle gange til tilstande, der ikke er nævnt i indlægssedler. Brug ikke ZETIA 10 mg til en tilstand, som det ikke er ordineret til. Giv ikke ZETIA til andre mennesker, selvom de har samme lidelse, som du har. Det kan skade dem.
Dette opsummerer de vigtigste oplysninger om ZETIA. Hvis du vil have mere information, så tal med din læge. Du kan spørge din apoteker eller læge om information om ZETIA 10mg, der er skrevet til sundhedspersonale.
Inaktive ingredienser :
Croscarmellosenatrium, lactosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose, povidon og natriumlaurylsulfat.
