Crestor 10mg, 20mg, 5mg Rosuvastatin Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Crestor, og hvordan bruges det?
Crestor er en receptpligtig medicin, der bruges til at sænke LDL-kolesterol (lavdensitetslipoprotein) og triglycerider i blodet, bremse udviklingen af plak i blodkarrene, reducere risikoen for slagtilfælde og hjerteanfald. Crestor 20mg kan bruges alene eller sammen med anden medicin.
Crestor er et lipidsænkende middel, statiner, HMG-CoA-reduktasehæmmere.
Det vides ikke, om Crestor er sikkert og effektivt til børn under 8 år.
Hvad er de mulige bivirkninger af Crestor?
Crestor kan forårsage alvorlige bivirkninger, herunder:
- uforklarlige muskelsmerter
- muskelømhed
- muskelsvaghed
- forvirring
- hukommelsesproblemer
- smerter i øvre mave
- træthed
- mistet appetiten
- mørk urin
- gulfarvning af hud eller øjne (gulsot)
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Crestor omfatter:
- hovedpine
- svaghed
- muskelsmerter
- kvalme
- mavesmerter
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Crestor. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
CRESTOR (rosuvastatin calcium) er et syntetisk lipidsænkende middel til oral administration.
Det kemiske navn for rosuvastatincalcium er bis[(E)-7-[4-(4-fluorphenyl)-6-isopropyl-2-[methyl(methylsulfonyl)amino]pyrimidin-5-yl](3R,5S)-3 ,5-dihydroxyhept-6-ensyre] calciumsalt med følgende strukturformel:
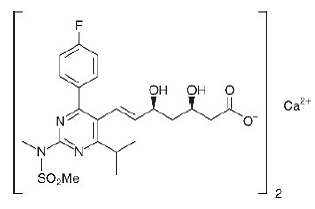
Den empiriske formel for rosuvastatincalcium er (C22H27FN3O6S)2Ca, og molekylvægten er 1001,14. Rosuvastatin calcium er et hvidt amorft pulver, der er tungtopløseligt i vand og methanol og let opløseligt i ethanol. Rosuvastatin calcium er en hydrofil forbindelse med en fordelingskoefficient (octanol/vand) på 0,13 ved pH på 7,0.
CRESTOR tabletter til oral administration indeholder 5, 10, 20 eller 40 mg rosuvastatin og følgende inaktive ingredienser: Hver tablet indeholder: mikrokrystallinsk cellulose NF, lactosemonohydrat NF, tribasisk calciumphosphat NF, crospovidon NF, magnesiumstearat NF, hypromellose triacetin NF, titaniumdioxid USP, gult ferrioxid og rødt ferrioxid NF.
INDIKATIONER
Hyperlipidæmi og blandet dyslipidæmi
CRESTOR er indiceret som supplerende terapi til diæt for at reducere forhøjet total-C, LDL-C, ApoB, non-HDL-C og triglycerider og for at øge HDL-C hos voksne patienter med primær hyperlipidæmi eller blandet dyslipidæmi. Lipidændrende midler bør anvendes som supplement til en diæt, der er begrænset i mættet fedt og kolesterol, når respons på diæt og ikke-farmakologiske indgreb alene har været utilstrækkelig.
Pædiatriske patienter med familiær hyperkolesterolæmi
CRESTOR 10mg er indiceret som et supplement til diæt til:
- reducere total-C, LDL-C og ApoB-niveauer hos børn og unge i alderen 8 til 17 år med heterozygot familiær hyperkolesterolæmi, hvis følgende resultater er til stede efter et tilstrækkeligt forsøg med diætterapi: LDL-C >190 mg/dL eller >160 mg/dL sammen med en positiv familiehistorie med for tidlig kardiovaskulær sygdom (CVD) eller to eller flere andre CVD-risikofaktorer.
- reducere LDL-C, Total-C, non-HDL-C og ApoB hos børn og unge i alderen 7 til 17 år med homozygot familiær hyperkolesterolæmi, enten alene eller sammen med andre lipidsænkende behandlinger (f.eks. LDL-aferese).
Hypertriglyceridæmi
CRESTOR er indiceret som supplerende terapi til diæt til behandling af voksne patienter med hypertriglyceridæmi.
Primær dysbetalipoproteinæmi (type III hyperlipoproteinæmi)
CRESTOR er indiceret som et supplement til diæt til behandling af voksne patienter med primær dysbetalipoproteinæmi (type III hyperlipoproteinæmi).
Voksne patienter med homozygot familiær hyperkolesterolæmi
CRESTOR er indiceret som supplerende terapi til andre lipidsænkende behandlinger (f.eks. LDL-aferese) eller alene, hvis sådanne behandlinger ikke er tilgængelige for at reducere LDL-C, Total-C og ApoB hos voksne patienter med homozygot familiær hyperkolesterolæmi.
Opbremsning af udviklingen af åreforkalkning
CRESTOR 5mg er indiceret som supplerende terapi til diæt for at bremse progressionen af åreforkalkning hos voksne patienter som en del af en behandlingsstrategi for at sænke Total-C og LDL-C til målniveauer.
Primær forebyggelse af kardiovaskulær sygdom
Hos personer uden klinisk tydelig koronar hjertesygdom, men med en øget risiko for hjertekarsygdom baseret på alder ≥50 år hos mænd og ≥60 år hos kvinder, hsCRP ≥2 mg/L og tilstedeværelsen af mindst én yderligere hjerte-kar-sygdom risikofaktor såsom hypertension, lavt HDL-C, rygning eller en familiehistorie med for tidlig koronar hjertesygdom, CRESTOR er indiceret til:
- reducere risikoen for slagtilfælde
- reducere risikoen for myokardieinfarkt
- reducere risikoen for arterielle revaskulariseringsprocedurer
Brugsbegrænsninger
CRESTOR er ikke blevet undersøgt ved Fredrickson Type I og V dyslipidæmi.
DOSERING OG ADMINISTRATION
Generel doseringsinformation
Dosisområdet for CRESTOR 5 mg til voksne er 5 til 40 mg oralt én gang dagligt. Den sædvanlige startdosis er 10 til 20 mg én gang dagligt. Den sædvanlige startdosis til voksne patienter med homozygot familiær hyperkolesterolæmi er 20 mg én gang dagligt.
Den maksimale CRESTOR 20 mg dosis på 40 mg bør kun anvendes til de patienter, der ikke har nået deres LDL-C mål ved at bruge 20 mg dosis [se ADVARSLER OG FORHOLDSREGLER ].
CRESTOR 5 mg kan administreres som en enkelt dosis på ethvert tidspunkt af dagen, med eller uden mad. Tabletten skal synkes hel.
Ved påbegyndelse af CRESTOR-behandling eller skift fra en anden HMG-CoA-reduktasehæmmerbehandling, bør den passende CRESTOR 10 mg startdosis først anvendes og først derefter titreres i henhold til patientens respons og individuelle mål med behandlingen.
Efter påbegyndelse af eller efter titrering af CRESTOR bør lipidniveauer analyseres inden for 2 til 4 uger, og dosis justeres i overensstemmelse hermed.
Pædiatrisk dosering
Ved heterozygot familiær hyperkolesterolæmi er det anbefalede dosisområde 5 til 10 mg oralt én gang dagligt hos patienter i alderen 8 til under 10 år og 5 til 20 mg oralt én gang dagligt hos patienter i alderen 10 til 17 år.
Ved homozygot familiær hyperkolesterolæmi er den anbefalede dosis 20 mg oralt én gang dagligt hos patienter i alderen 7 til 17 år.
Dosering hos asiatiske patienter
Overvej initiering af CRESTOR 20 mg behandling hos asiatiske patienter med 5 mg én gang dagligt på grund af øgede plasmakoncentrationer af rosuvastatin. Den øgede systemiske eksponering bør tages i betragtning ved behandling af asiatiske patienter, der ikke er tilstrækkeligt kontrolleret ved doser op til 20 mg/dag [se Brug i specifikke populationer og KLINISK FARMAKOLOGI ].
Brug sammen med samtidig terapi
Patienter, der tager Cyclosporin
Dosis af CRESTOR 20 mg bør ikke overstige 5 mg én gang dagligt [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
Patienter, der tager Gemfibrozil
Undgå samtidig brug af CRESTOR og gemfibrozil. Hvis samtidig brug ikke kan undgås, påbegyndes CRESTOR med 5 mg én gang dagligt. Dosis af CRESTOR bør ikke overstige 10 mg én gang dagligt [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
Patienter, der tager atazanavir og ritonavir, lopinavir og ritonavir eller simeprevir
Start CRESTOR 10 mg-behandling med 5 mg én gang dagligt. Dosis af CRESTOR bør ikke overstige 10 mg én gang dagligt [se ADVARSLER OG FORHOLDSREGLER , DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
Dosering hos patienter med svær nyreinsufficiens
For patienter med svært nedsat nyrefunktion (CLcr Brug i specifikke populationer og KLINISK FARMAKOLOGI ].
HVORDAN LEVERET
Doseringsformer og styrker
5 mg: Gule, runde, bikonvekse, overtrukne tabletter. Præget "CRESTOR" og "5" på den ene side af tabletten.
10 mg: Lyserøde, runde, bikonvekse, overtrukne tabletter. Præget "CRESTOR" og "10" på den ene side af tabletten.
20 mg: Lyserøde, runde, bikonvekse, overtrukne tabletter. Præget "CRESTOR" og "20" på den ene side af tabletten.
40 mg: Pink, ovale, bikonvekse, overtrukne tabletter. Præget "CRESTOR" på den ene side og "40" på den anden side af tabletten.
Opbevaring og håndtering
CRESTOR® (rosuvastatin calcium) tabletter leveres som:
NDC 0310-0755-90: 5 mg. Gule, runde, bikonvekse, overtrukne tabletter. Præget "CRESTOR" og "5" på den ene side; flaske med 90 tabletter
NDC 0310-0751-90: 10 mg. Lyserøde, runde, bikonvekse, overtrukne tabletter. Præget "CRESTOR" og "10" på den ene side; flaske med 90 tabletter
NDC 0310-0751-39: 10 mg. Lyserøde, runde, bikonvekse, overtrukne tabletter. Præget "CRESTOR" og "10" på den ene side; enhedsdosispakninger med 100 stk
NDC 0310-0752-90: 20 mg. Lyserøde, runde, bikonvekse, overtrukne tabletter. Præget "CRESTOR" og "20" på den ene side; flasker á 90 stk
NDC 0310-0752-39: 20 mg. Lyserøde, runde, bikonvekse, overtrukne tabletter. Præget "CRESTOR" og "20" på den ene side; enhedsdosispakninger med 100 stk
NDC 0310-0754-30: 40 mg. Pink, ovale, bikonvekse, overtrukne tabletter. Præget "CRESTOR" på den ene side og "40" på den anden side; flasker á 30 stk
Opbevaring
Opbevares ved kontrolleret stuetemperatur, 20-25°C (68-77°F) [se USP kontrolleret rumtemperatur ]. Beskyt mod fugt.
Distribueret af: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revideret: Sep 2018
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet mere detaljeret i andre sektioner af etiketten:
- Rhabdomyolyse med myoglobinuri og akut nyresvigt og myopati (inklusive myositis) [se ADVARSLER OG FORHOLDSREGLER ]
- Leverenzymabnormiteter [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske studier
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan frekvensen af bivirkninger observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenserne i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
I databasen med CRESTOR kontrollerede kliniske forsøg (placebo eller aktivt kontrolleret) med 5394 patienter med en gennemsnitlig behandlingsvarighed på 15 uger, seponerede 1,4 % af patienterne på grund af bivirkninger. De mest almindelige bivirkninger, der førte til seponering af behandlingen, var:
- myalgi
- mavesmerter
- kvalme
De mest almindeligt rapporterede bivirkninger (incidens ≥2%) i CRESTOR 5mg kontrollerede kliniske forsøgsdatabase med 5394 patienter var:
- hovedpine
- myalgi
- mavesmerter
- asteni
- kvalme
Bivirkninger rapporteret hos ≥2 % af patienterne i placebokontrollerede kliniske undersøgelser og med en højere hastighed end placebo er vist i tabel 1. Disse undersøgelser havde en behandlingsvarighed på op til 12 uger.
Andre bivirkninger rapporteret i kliniske undersøgelser var mavesmerter, svimmelhed, overfølsomhed (inklusive udslæt, pruritus, nældefeber og angioødem) og pancreatitis. Følgende laboratorieabnormaliteter er også blevet rapporteret: dipstick-positiv proteinuri og mikroskopisk hæmaturi [se ADVARSLER OG FORHOLDSREGLER ]; forhøjet kreatinphosphokinase, transaminaser, glucose, glutamyltranspeptidase, alkalisk phosphatase og bilirubin; og unormal skjoldbruskkirtelfunktion.
METEOR-studiet, der involverede 981 deltagere behandlet med rosuvastatin 40 mg (n=700) eller placebo (n=281) med en gennemsnitlig behandlingsvarighed på 1,7 år, var 5,6 % af forsøgspersonerne behandlet med CRESTOR 5 mg versus 2,8 % af de placebobehandlede forsøgspersoner. seponeret på grund af bivirkninger. De mest almindelige bivirkninger, der førte til seponering af behandlingen, var: myalgi, øget leverenzym, hovedpine og kvalme [se Kliniske Studier ].
Bivirkninger rapporteret hos ≥2 % af patienterne og med en højere frekvens end placebo er vist i tabel 2.
I JUPITER-studiet blev 17.802 deltagere behandlet med rosuvastatin 20 mg (n=8901) eller placebo (n=8901) i en gennemsnitlig varighed på 2 år. En højere procentdel af rosuvastatin-behandlede patienter versus placebo-behandlede patienter, henholdsvis 6,6 % og 6,2 %, seponerede undersøgelsesmedicin på grund af en uønsket hændelse, uanset behandlingsårsagssammenhæng. Myalgi var den mest almindelige bivirkning, der førte til afbrydelse af behandlingen.
JUPITER var der en signifikant højere frekvens af diabetes mellitus rapporteret hos patienter, der tog rosuvastatin (2,8 %) sammenlignet med patienter, der fik placebo (2,3 %). Gennemsnitlig HbA1c var signifikant øget med 0,1 % hos rosuvastatin-behandlede patienter sammenlignet med placebo-behandlede patienter. Antallet af patienter med en HbA1c >6,5 % ved afslutningen af forsøget var signifikant højere hos rosuvastatin-behandlede versus placebo-behandlede patienter [se ADVARSLER OG FORHOLDSREGLER og Kliniske Studier ].
Bivirkninger rapporteret hos ≥2 % af patienterne og med en højere frekvens end placebo er vist i tabel 3.
Pædiatriske patienter med heterozygot familiær hyperkolesterolæmi
I en 12-ugers kontrolleret undersøgelse med drenge og postmenarkæale piger i alderen 10 til 17 år med heterozygot familiær hyperkolesterolæmi med CRESTOR 5 til 20 mg dagligt [se Brug i specifikke populationer og Kliniske Studier stigninger i serum kreatinfosfokinase (CK) >10 x ULN blev observeret hyppigere hos rosuvastatin sammenlignet med placebo-behandlede børn. Fire ud af 130 (3%) børn behandlet med rosuvastatin (2 behandlet med 10 mg og 2 behandlet med 20 mg) havde øget CK >10 x ULN sammenlignet med 0 ud af 46 børn på placebo.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af CRESTOR efter godkendelse: artralgi, fatalt og ikke-fatalt leversvigt, hepatitis, gulsot, trombocytopeni, depression, søvnforstyrrelser (inklusive søvnløshed og mareridt), perifer neuropati, interstitiel lungesygdom og gynækomasti. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Der har været sjældne rapporter om immunmedieret nekrotiserende myopati forbundet med statinbrug [se ADVARSLER OG FORHOLDSREGLER ].
Der har været sjældne rapporter efter markedsføring om kognitiv svækkelse (f.eks. hukommelsestab, glemsomhed, hukommelsestab, hukommelsessvækkelse og forvirring) forbundet med statinbrug. Disse kognitive problemer er blevet rapporteret for alle statiner. Indberetningerne er generelt ikke-seriøse og reversible ved seponering af statin med varierende tidspunkter til symptomdebut (1 dag til år) og symptomopløsning (median på 3 uger).
DRUGSINTERAKTIONER
Cyclosporin
Cyclosporin øgede eksponeringen for rosuvastatin og kan resultere i øget risiko for myopati. Hos patienter, der tager ciclosporin, bør dosis af CRESTOR 10 mg derfor ikke overstige 5 mg én gang dagligt [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Gemfibrozil
Gemfibrozil øgede eksponeringen for rosuvastatin signifikant. På grund af en observeret øget risiko for myopati/rhabdomyolyse bør kombinationsbehandling med CRESTOR og gemfibrozil undgås. Hvis det bruges sammen, bør dosis af CRESTOR 10 mg ikke overstige 10 mg én gang dagligt [se KLINISK FARMAKOLOGI ].
Proteasehæmmere
Samtidig administration af rosuvastatin med visse proteasehæmmere har forskellige virkninger på rosuvastatineksponering og kan øge risikoen for myopati. Simeprevir, som er en hepatitis C-virus (HCV) proteasehæmmer, eller kombinationer af atazanavir/ritonavir eller lopinavir/ritonavir, som er HIV-1 proteasehæmmere, øger eksponeringen for rosuvastatin [se tabel 4 - KLINISK FARMAKOLOGI ]. For disse proteasehæmmere bør dosis af CRESTOR 5 mg ikke overstige 10 mg én gang dagligt. Kombinationerne af fosamprenavir/ritonavir eller tipranavir/ritonavir, som er HIV-1-proteasehæmmere, giver ringe eller ingen ændring i eksponeringen for rosuvastatin. Der bør udvises forsigtighed, når rosuvastatin administreres sammen med proteasehæmmere [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Coumarin antikoagulantia
CRESTOR 20 mg øgede signifikant INR hos patienter, der fik coumarin antikoagulantia. Derfor bør der udvises forsigtighed, når coumarinantikoagulantia gives sammen med CRESTOR. Hos patienter, der samtidig tager coumarinantikoagulantia og CRESTOR, bør INR bestemmes før start af CRESTOR og hyppigt nok under tidlig behandling til at sikre, at der ikke forekommer nogen signifikant ændring af INR [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Niacin
Risikoen for skeletmuskelpåvirkning kan øges, når CRESTOR 5 mg anvendes i kombination med lipidmodificerende doser (≥1 g/dag) af niacin; der skal udvises forsigtighed, når der ordineres sammen med CRESTOR [se ADVARSLER OG FORHOLDSREGLER ].
Fenofibrat
Når CRESTOR 20 mg blev administreret samtidigt med fenofibrat, blev der ikke observeret nogen klinisk signifikant stigning i AUC for rosuvastatin eller fenofibrat. Da det er kendt, at risikoen for myopati under behandling med HMG-CoA-reduktasehæmmere øges ved samtidig brug af fenofibrater, bør der udvises forsigtighed ved ordinering af fenofibrater med CRESTOR [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Colchicin
Tilfælde af myopati, inklusive rhabdomyolyse, er blevet rapporteret med HMG-CoA-reduktasehæmmere, inklusive rosuvastatin, administreret sammen med colchicin, og der bør udvises forsigtighed ved ordinering af CRESTOR med colchicin [se ADVARSLER OG FORHOLDSREGLER ].
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Skeletmuskeleffekter
Tilfælde af myopati og rhabdomyolyse med akut nyresvigt sekundært til myoglobinuri er blevet rapporteret med HMG-CoA-reduktasehæmmere, inklusive CRESTOR. Disse risici kan forekomme ved ethvert dosisniveau, men øges ved den højeste dosis (40 mg).
CRESTOR 5 mg bør ordineres med forsigtighed til patienter med disponerende faktorer for myopati (f.eks. alder ≥65 år, utilstrækkeligt behandlet hypothyroidisme, nedsat nyrefunktion). Risikoen for myopati under behandling med CRESTOR 5 mg kan øges ved samtidig administration af nogle andre lipidsænkende behandlinger (fibrater eller niacin), gemfibrozil, cyclosporin, atazanavir/ritonavir, lopinavir/ritonavir eller simeprevir [se DOSERING OG ADMINISTRATION og DRUGSINTERAKTIONER ]. Tilfælde af myopati, herunder rhabdomyolyse, er blevet rapporteret med HMG-CoA-reduktasehæmmere, inklusive rosuvastatin, administreret sammen med colchicin, og der bør udvises forsigtighed ved ordinering af CRESTOR med colchiciner [se DRUGSINTERAKTIONER ].
CRESTOR-behandlingen bør seponeres, hvis der opstår markant forhøjede kreatinkinase-niveauer, eller der er diagnosticeret eller mistanke om myopati. Behandling med CRESTOR 5 mg bør også midlertidigt seponeres hos enhver patient med en akut, alvorlig tilstand, der tyder på myopati eller disponerer for udvikling af nyresvigt sekundært til rhabdomyolyse (f.eks. sepsis, hypotension, dehydrering, større operationer, traumer, svær metabolisk, endokrin, og elektrolytforstyrrelser eller ukontrollerede anfald).
Der har været sjældne rapporter om immunmedieret nekrotiserende myopati (IMNM), en autoimmun myopati, forbundet med statinbrug. IMNM er karakteriseret ved: proksimal muskelsvaghed og forhøjet serumkreatinkinase, som fortsætter på trods af seponering af statinbehandling; muskelbiopsi, der viser nekrotiserende myopati uden signifikant inflammation; forbedring med immunsuppressive midler.
Alle patienter bør rådes til straks at rapportere uforklarlige muskelsmerter, ømhed eller svaghed til deres læge, især hvis de ledsages af utilpashed eller feber, eller hvis muskeltegn og symptomer fortsætter efter seponering af CRESTOR.
Leverenzym abnormiteter
Det anbefales, at leverenzymtest udføres før påbegyndelse af CRESTOR 10 mg, og hvis der opstår tegn eller symptomer på leverskade.
Stigninger i serumtransaminaser [AST (SGOT) eller ALT (SGPT)] er blevet rapporteret med HMG-CoA-reduktasehæmmere, inklusive CRESTOR. I de fleste tilfælde var stigningerne forbigående og forsvandt eller forbedredes ved fortsat behandling eller efter en kort afbrydelse i behandlingen. Der var to tilfælde af gulsot, for hvilke der ikke kunne fastslås en sammenhæng med CRESTOR-behandling, som forsvandt efter seponering af behandlingen. Der var ingen tilfælde af leversvigt eller irreversibel leversygdom i disse forsøg. I en samlet analyse af placebokontrollerede undersøgelser forekom stigninger i serumtransaminaser til >3 gange den øvre normalgrænse hos 1,1 % af patienterne, der fik CRESTOR 5 mg versus 0,5 % af patienterne behandlet med placebo.
Der har været sjældne rapporter efter markedsføring om fatalt og ikke-fatalt leversvigt hos patienter, der tager statiner, inklusive rosuvastatin. Hvis der opstår alvorlig leverskade med kliniske symptomer og/eller hyperbilirubinæmi eller gulsot under behandling med CRESTOR 20 mg, afbrydes behandlingen omgående. Hvis en alternativ ætiologi ikke findes, skal du ikke genstarte CRESTOR.
CRESTOR 5mg bør anvendes med forsigtighed til patienter, der indtager betydelige mængder alkohol og/eller har en historie med kronisk leversygdom [se KLINISK FARMAKOLOGI ]. Aktiv leversygdom, som kan omfatte uforklarlige vedvarende transaminasestigninger, er en kontraindikation for brugen af CRESTOR [se KONTRAINDIKATIONER ].
Samtidig kumarin antikoagulantia
Der bør udvises forsigtighed, når antikoagulantia gives sammen med CRESTOR på grund af dets forstærkning af virkningen af antikoagulantia af coumarin-typen til at forlænge protrombintiden/INR. Hos patienter, der samtidig tager coumarinantikoagulantia og CRESTOR, bør INR bestemmes før start med CRESTOR 10 mg og hyppigt nok under tidlig behandling til at sikre, at der ikke sker nogen signifikant ændring af INR [se DRUGSINTERAKTIONER ].
Proteinuri og hæmaturi
CRESTORs kliniske forsøgsprogram blev der observeret dipstick-positiv proteinuri og mikroskopisk hæmaturi blandt CRESTOR-behandlede patienter. Disse fund var hyppigere hos patienter, der tog CRESTOR 40 mg, sammenlignet med lavere doser af CRESTOR 20 mg eller komparator HMG-CoA-reduktasehæmmere, selvom det generelt var forbigående og ikke var forbundet med forværring af nyrefunktionen. Selvom den kliniske betydning af dette fund er ukendt, bør en dosisreduktion overvejes for patienter i CRESTOR-behandling med uforklarlig vedvarende proteinuri og/eller hæmaturi under rutinemæssig urinanalyse.
Endokrine virkninger
Stigninger i HbA1c og fastende serumglukoseniveauer er blevet rapporteret med HMG-CoA-reduktasehæmmere, inklusive CRESTOR. Baseret på data fra kliniske forsøg med CRESTOR kan disse stigninger i nogle tilfælde overstige tærsklen for diagnosticering af diabetes mellitus [se BIVIRKNINGER ].
Selvom kliniske undersøgelser har vist, at CRESTOR 10 mg alene ikke reducerer basal plasmakortisolkoncentration eller forringer binyrereserven, skal der udvises forsigtighed, hvis CRESTOR administreres samtidig med lægemidler, der kan nedsætte niveauet eller aktiviteten af endogene steroidhormoner såsom ketoconazol, spironolacton og cimetidin.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER ).
Patienterne skal instrueres i ikke at tage 2 doser CRESTOR inden for 12 timer efter hinanden.
Skeletmuskeleffekter
Patienter bør rådes til straks at rapportere uforklarlige muskelsmerter, ømhed eller svaghed, især hvis de ledsages af utilpashed eller feber, eller hvis disse muskeltegn eller symptomer fortsætter efter seponering af CRESTOR.
Samtidig brug af antacida
Når du tager CRESTOR 5 mg sammen med et antacidum af aluminium og magnesiumhydroxid, skal antacida tages mindst 2 timer efter CRESTOR 10 mg administration.
Embryofetal toksicitet
Rådgiv kvinder om reproduktionspotentiale om risikoen for et foster, om at bruge effektiv prævention under behandlingen og at informere deres læge om en kendt eller formodet graviditet. [se KONTRAINDIKATIONER og Brug i specifikke populationer ].
Amning
Advis kvinder til ikke at amme under behandling med CRESTOR [se KONTRAINDIKATIONER og Brug i specifikke populationer ].
Leverenzymer
Det anbefales, at leverenzymtest udføres før påbegyndelse af CRESTOR, og hvis der opstår tegn eller symptomer på leverskade. Alle patienter, der behandles med CRESTOR, skal rådes til straks at rapportere symptomer, der kan tyde på leverskade, herunder træthed, anoreksi, ubehag i højre øvre del af maven, mørk urin eller gulsot.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
I et 104-ugers karcinogenicitetsstudie i rotter ved dosisniveauer på 2, 20, 60 eller 80 mg/kg/dag ved oral sonde, var forekomsten af uterus stromale polypper signifikant øget hos hunner ved 80 mg/kg/dag ved systemisk eksponering 20 gange den humane eksponering ved 40 mg/dag baseret på AUC. Øget forekomst af polypper blev ikke set ved lavere doser.
et 107-ugers karcinogenicitetsstudie med mus, der fik 10, 60 eller 200 mg/kg/dag ved oral sonde, blev en øget forekomst af hepatocellulært adenom/carcinom observeret ved 200 mg/kg/dag ved systemiske eksponeringer 20 gange den humane eksponering. ved 40 mg/dag baseret på AUC. En øget forekomst af hepatocellulære tumorer blev ikke set ved lavere doser.
Rosuvastatin var ikke mutagent eller klastogent med eller uden metabolisk aktivering i Ames-testen med Salmonella typhimurium og Escherichia coli, muselymfomanalysen og kromosomafvigelsesanalysen i kinesisk hamster-lungeceller. Rosuvastatin var negativ i in vivo-muse mikronukleustesten.
fertilitetsundersøgelser med rotter med orale gavage-doser på 5, 15, 50 mg/kg/dag blev hannerne behandlet i 9 uger før og under parringen, og hunnerne blev behandlet 2 uger før parringen og gennem hele parringen indtil drægtighedsdag 7. Ingen bivirkninger. effekt på fertiliteten blev observeret ved 50 mg/kg/dag (systemisk eksponering op til 10 gange den humane eksponering ved 40 mg/dag baseret på AUC). I testikler fra hunde behandlet med rosuvastatin ved 30 mg/kg/dag i en måned, blev der set spermatidiske kæmpeceller. Spermatidiske kæmpeceller blev observeret hos aber efter 6-måneders behandling med 30 mg/kg/dag foruden vakuolering af sædrørepitel. Eksponeringerne hos hunden var 20 gange og hos aben 10 gange den menneskelige eksponering ved 40 mg/dag baseret på kropsoverfladeareal. Lignende fund er set med andre lægemidler i denne klasse.
Brug i specifikke populationer
Graviditet
Risikooversigt
CRESTOR 5mg er kontraindiceret til brug hos gravide kvinder, da sikkerheden hos gravide kvinder ikke er blevet fastslået, og der ikke er nogen åbenlys fordel ved behandling med CRESTOR 20mg under graviditet. Fordi HMG-CoA-reduktasehæmmere nedsætter kolesterolsyntesen og muligvis syntesen af andre biologisk aktive stoffer afledt af kolesterol, kan CRESTOR forårsage fosterskader, når det administreres til gravide kvinder. CRESTOR 5mg bør seponeres, så snart graviditet er erkendt [se KONTRAINDIKATIONER ]. Begrænsede offentliggjorte data om brugen af rosuvastatin er utilstrækkelige til at bestemme en lægemiddelassocieret risiko for alvorlige medfødte misdannelser eller abort. I reproduktionsstudier på dyr var der ingen uønskede udviklingsmæssige virkninger ved oral administration af rosuvastatin under organogenese ved systemiske eksponeringer svarende til en maksimal anbefalet human dosis (MRHD) på 40 mg/dag hos rotter eller kaniner (baseret på henholdsvis AUC og kropsoverfladeareal). ). Hos rotter og kaniner forekom der nedsat hvalpe/føtal overlevelse ved 12 gange og svarende til henholdsvis MRHD på 40 mg/dag [se Data ].
Den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort for den angivne population er ukendt. I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2-4 % og 15-20 %.
Data
Menneskelige data
Begrænsede offentliggjorte data om rosuvastatin har ikke vist en øget risiko for alvorlige medfødte misdannelser eller abort. Sjældne rapporter om medfødte anomalier er modtaget efter intrauterin eksponering for andre statiner. I en gennemgang af ca. 100 prospektivt fulgte graviditeter hos kvinder udsat for simvastatin eller lovastatin oversteg forekomsten af medfødte anomalier, spontane aborter og føtale dødsfald/dødfødsler ikke, hvad man kunne forvente i den generelle befolkning. Antallet af tilfælde er tilstrækkeligt til at udelukke en ≥3 til 4 gange stigning i medfødte anomalier i forhold til baggrundsincidensen. I 89 % af de prospektivt fulgte graviditeter blev lægemiddelbehandling påbegyndt før graviditeten og blev afbrudt på et tidspunkt i første trimester, da graviditet blev identificeret.
Dyredata
Rosuvastatin krydser placenta hos rotter og kaniner og findes i føtalt væv og fostervand ved henholdsvis 3 % og 20 % af den maternelle plasmakoncentration efter en enkelt 25 mg/kg oral sondemadosis på drægtighedsdag 16 hos rotter. En højere føtal vævsfordeling (25 % maternel plasmakoncentration) blev observeret hos kaniner efter en enkelt oral sondemadosis på 1 mg/kg på drægtighedsdag 18.
Rosuvastatin-administration indikerede ikke en teratogene virkning hos rotter ved ≤25 mg/kg/dag eller hos kaniner ≤3 mg/kg/dag (doser svarende til MRHD på 40 mg/dag baseret på henholdsvis AUC og kropsoverfladeareal).
Hos hunrotter, der fik 5, 15 og 50 mg/kg/dag før parring og fortsatte til drægtighedsdag 7, resulterede det i nedsat føtal kropsvægt (hununger) og forsinket knogledannelse ved 50 mg/kg/dag (10 gange den menneskelige eksponering kl. MRHD-dosis på 40 mg/dag baseret på AUC).
Hos drægtige rotter, der fik 2, 10 og 50 mg/kg/dag rosuvastatin fra drægtighedsdag 7 til og med diegivningsdag 21 (fravænning), forekom der nedsat overlevelse af hvalpe ved 50 mg/kg/dag (dosis svarende til 12 gange MRHD på 40 mg /dag baseret kropsoverfladeareal).
Hos drægtige kaniner, der fik 0,3, 1 og 3 mg/kg/dag rosuvastatin fra drægtighedsdag 6 til dag 18, blev der observeret nedsat føtal levedygtighed og mødredødelighed ved 3 mg/kg/dag (dosis svarende til MRHD på 40 mg/ dag baseret på kropsoverflade).
Amning
Risikooversigt
Brug af rosuvastatin er kontraindiceret under amning [se KONTRAINDIKATIONER ]. Begrænsede data indikerer, at CRESTOR findes i modermælk. Der er ingen tilgængelig information om lægemidlets virkning på det ammede spædbarn eller lægemidlets virkning på mælkeproduktionen. På grund af risikoen for alvorlige bivirkninger hos et ammet spædbarn, skal du rådgive patienterne om, at amning ikke anbefales under behandling med CRESTOR.
Hunner og mænd med reproduktionspotentiale
Svangerskabsforebyggelse
CRESTOR kan forårsage fosterskader, når det administreres til en gravid kvinde [se Brug i specifikke populationer ]. Rådgiv kvinder med reproduktionspotentiale til at bruge effektiv prævention under behandling med CRESTOR.
Pædiatrisk brug
Hos børn og unge i alderen 8 til 17 år med heterozygot familiær hyperkolesterolæmi, sikkerheden og effektiviteten af CRESTOR 10 mg som et supplement til diæt for at reducere totalkolesterol, LDL-C og ApoB-niveauer, når LDL efter et tilstrækkeligt forsøg med diætterapi. -C overstiger 190 mg/dL, eller når LDL-C overstiger 160 mg/dL, og der er en positiv familiehistorie med præmatur hjerte-kar-sygdomme eller to eller flere andre risikofaktorer for hjerte-kar-sygdomme, blev etableret i et kontrolleret forsøg og i et åbent, ukontrolleret retssag [se Kliniske Studier ]. Den langsigtede effekt af CRESTOR-behandling påbegyndt i barndommen for at reducere morbiditet og dødelighed i voksenalderen er ikke blevet fastlagt.
Sikkerheden og effektiviteten af CRESTOR 5 mg hos børn og unge i alderen 10 til 17 år med heterozygot familiær hyperkolesterolæmi blev evalueret i et kontrolleret klinisk forsøg af 12 ugers varighed efterfulgt af 40 ugers åben eksponering. Patienter behandlet med 5 mg, 10 mg og 20 mg dagligt CRESTOR 10 mg havde en bivirkningsprofil, der generelt svarer til den for patienter behandlet med placebo. Der var ingen påviselig effekt af CRESTOR på vækst, vægt, BMI (body mass index) eller seksuel modning [se Kliniske Studier ] hos børn og unge (10 til 17 år).
CRESTOR er ikke blevet undersøgt i kontrollerede kliniske forsøg med præpubertale patienter eller patienter yngre end 10 år med heterozygot familiær hyperkolesterolæmi. Imidlertid blev sikkerheden og effektiviteten af CRESTOR evalueret i et toårigt åbent ukontrolleret forsøg, der omfattede børn og unge i alderen 8 til 17 år med heterozygot familiær hyperkolesterolæmi [se Kliniske Studier ]. Sikkerheden og effekten af CRESTOR 5 mg til at sænke LDL-C syntes generelt at være i overensstemmelse med den, der blev observeret for voksne patienter, på trods af begrænsninger af det ukontrollerede studiedesign.
Børn og unge i alderen 7 til 15 år med homozygot familiær hyperkolesterolæmi blev undersøgt i et 6-ugers randomiseret, placebokontrolleret, cross-over-studie med CRESTOR 20 mg én gang dagligt efterfulgt af 12 ugers åben behandling [se Kliniske Studier ]. Generelt var sikkerhedsprofilen i dette forsøg i overensstemmelse med den tidligere etablerede sikkerhedsprofil hos voksne.
Selvom ikke alle bivirkninger identificeret i den voksne befolkning er blevet observeret i kliniske forsøg med børn og unge patienter, bør de samme advarsler og forholdsregler for voksne overvejes for børn og unge. Unge kvinder bør rådgives om passende præventionsmetoder, mens de er i behandling med CRESTOR 5 mg [se Brug i specifikke populationer ].
Geriatrisk brug
Af de 10.275 patienter i kliniske studier med CRESTOR var 3159 (31 %) 65 år og ældre, og 698 (6,8 %) var 75 år og ældre. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes.
Ældre patienter har højere risiko for myopati, og CRESTOR bør ordineres med forsigtighed til ældre [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Nedsat nyrefunktion
Rosuvastatin-eksponering påvirkes ikke af let til moderat nedsat nyrefunktion (CLcr ≥30 ml/min/1,73 m²). Eksponering for rosuvastatin er øget i et klinisk signifikant omfang hos patienter med svært nedsat nyrefunktion (CLcr DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
CRESTOR er kontraindiceret til patienter med aktiv leversygdom, som kan omfatte uforklarlige vedvarende stigninger i levertransaminaseniveauer. Kronisk alkoholleversygdom er kendt for at øge eksponeringen for rosuvastatin; CRESTOR 20 mg bør anvendes med forsigtighed til disse patienter [se KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
asiatiske patienter
Farmakokinetiske undersøgelser har vist en ca. 2 gange stigning i median eksponering for rosuvastatin hos asiatiske forsøgspersoner sammenlignet med kaukasiske kontroller. CRESTOR-dosis bør justeres til asiatiske patienter [se DOSERING OG ADMINISTRATION og KLINISK FARMAKOLOGI ].
OVERDOSIS
Der er ingen specifik behandling i tilfælde af overdosering. I tilfælde af overdosering skal patienten behandles symptomatisk og støttende foranstaltninger iværksættes efter behov. Hæmodialyse øger ikke clearance af rosuvastatin signifikant.
KONTRAINDIKATIONER
CRESTOR 20mg er kontraindiceret under følgende forhold:
- Patienter med kendt overfølsomhed over for en hvilken som helst komponent i dette produkt. Overfølsomhedsreaktioner inklusive udslæt, kløe, nældefeber og angioødem er blevet rapporteret med CRESTOR [se BIVIRKNINGER ].
- Patienter med aktiv leversygdom, som kan omfatte uforklarlige vedvarende stigninger i levertransaminaseniveauer [se ADVARSLER OG FORHOLDSREGLER ].
- Graviditet [se Brug i specifikke populationer ].
- Amning. Begrænsede data indikerer, at CRESTOR 20 mg er til stede i modermælk. Da statiner har potentiale for alvorlige bivirkninger hos ammende spædbørn, bør kvinder, der har behov for CRESTOR-behandling, ikke amme deres spædbørn [se Brug i specifikke populationer ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
CRESTOR 10mg er en selektiv og kompetitiv hæmmer af HMG-CoA-reduktase, det hastighedsbegrænsende enzym, der omdanner 3-hydroxy-3-methylglutaryl-coenzym A til mevalonat, en forløber for kolesterol. In vivo undersøgelser på dyr og in vitro undersøgelser i dyrkede dyre- og menneskeceller har vist, at rosuvastatin har en høj optagelse i og selektivitet for virkning i leveren, målorganet for kolesterolsænkning. I in vivo og in vitro undersøgelser fremkalder rosuvastatin sin lipidmodificerende virkning på to måder. For det første øger det antallet af hepatiske LDL-receptorer på celleoverfladen for at øge optagelsen og katabolismen af LDL. For det andet hæmmer rosuvastatin hepatisk syntese af VLDL, hvilket reducerer det samlede antal VLDL- og LDL-partikler.
Farmakodynamik
CRESTOR 5mg dosis afhængig reducerer forhøjet LDL-kolesterol og reducerer total kolesterol og triglycerider og øger HDL-kolesterol [se Kliniske Studier ]. Et terapeutisk respons på CRESTOR 5 mg er tydeligt inden for 1 uge efter påbegyndelse af behandlingen, og 90 % af det maksimale respons opnås normalt inden for 2 uger. Den maksimale respons opnås normalt efter 4 uger og opretholdes derefter. Individualisering af lægemiddeldosering bør baseres på den terapeutiske respons [se DOSERING OG ADMINISTRATION ].
Farmakokinetik
Absorption
I kliniske farmakologiske undersøgelser hos mennesker blev maksimale plasmakoncentrationer af rosuvastatin nået 3 til 5 timer efter oral dosering. Både Cmax og AUC steg omtrentligt i forhold til CRESTOR 10 mg dosis. Den absolutte biotilgængelighed af rosuvastatin er ca. 20 %.
Administration af CRESTOR sammen med mad påvirkede ikke AUC for rosuvastatin.
AUC for rosuvastatin afviger ikke efter indgivelse af lægemiddel om aftenen eller morgenen.
Fordeling
Gennemsnitlig distributionsvolumen ved steady-state af rosuvastatin er ca. 134 liter. Rosuvastatin er 88 % bundet til plasmaproteiner, hovedsageligt albumin. Denne binding er reversibel og uafhængig af plasmakoncentrationer.
Elimination
Rosuvastatin elimineres primært ved udskillelse i fæces. Eliminationshalveringstiden for rosuvastatin er ca. 19 timer.
Metabolisme
Rosuvastatin metaboliseres ikke i udstrakt grad; ca. 10 % af en radioaktivt mærket dosis genfindes som metabolit. Hovedmetabolitten er N-desmethyl rosuvastatin, som hovedsageligt dannes af cytochrom P450 \ 2C9, og in vitro undersøgelser har vist, at N-desmethyl rosuvastatin har cirka en sjettedel til halvdelen af den HMG-CoA reduktasehæmmende aktivitet af moderstoffet . Overordnet set er mere end 90 % af den aktive plasma-HMG-CoA-reduktase-hæmmende aktivitet tegnet af moderforbindelsen.
Udskillelse
Efter oral administration udskilles rosuvastatin og dets metabolitter primært i fæces (90%). Efter en intravenøs dosis foregik ca. 28 % af den totale kropsclearance via nyrerne og 72 % ad levervejen.
Specifikke populationer
Race- eller etniske grupper
En populationsfarmakokinetisk analyse afslørede ingen klinisk relevante forskelle i farmakokinetik blandt kaukasiske, latinamerikanske og sorte eller afro-caribiske grupper. Imidlertid har farmakokinetiske undersøgelser, herunder et udført i USA, vist en omtrentlig 2-fold stigning i medianeksponering (AUC og Cmax) hos asiatiske forsøgspersoner sammenlignet med en kaukasisk kontrolgruppe.
Mandlige og kvindelige patienter
Der var ingen forskelle i plasmakoncentrationer af rosuvastatin mellem mænd og kvinder.
Pædiatriske patienter
I en populationsfarmakokinetisk analyse af to pædiatriske undersøgelser, der involverede patienter med heterozygot familiær hyperkolesterolæmi i alderen 10 til 17 år henholdsvis 8 til 17 år, så rosuvastatineksponeringen ud til at være sammenlignelig med eller lavere end eksponeringen for rosuvastatin hos voksne patienter.
Geriatriske patienter
Der var ingen forskelle i plasmakoncentrationer af rosuvastatin mellem ikke-ældre og ældre populationer (alder ≥65 år).
Patienter med nedsat nyrefunktion
Mild til moderat nedsat nyrefunktion (CLcr ≥30 ml/min/1,73 m²) havde ingen indflydelse på plasmakoncentrationerne af rosuvastatin. Plasmakoncentrationer af rosuvastatin steg dog til et klinisk signifikant omfang (ca. 3 gange) hos patienter med alvorligt nedsat nyrefunktion (CLcr 80 ml/min/ 1,73 m²).
Hæmodialyse
Steady-state plasmakoncentrationer af rosuvastatin hos patienter i kronisk hæmodialyse var ca. 50 % højere sammenlignet med raske frivillige forsøgspersoner med normal nyrefunktion.
Patienter med nedsat leverfunktion
Hos patienter med kronisk alkoholleversygdom var plasmakoncentrationerne af rosuvastatin moderat øget.
Hos patienter med Child-Pugh A-sygdom var Cmax og AUC øget med henholdsvis 60 % og 5 % sammenlignet med patienter med normal leverfunktion. Hos patienter med Child-Pugh B-sygdom var Cmax og AUC øget med henholdsvis 100 % og 21 % sammenlignet med patienter med normal leverfunktion.
Lægemiddelinteraktionsundersøgelser
Rosuvastatins clearance er ikke afhængig af metabolisme af cytokrom P450 3A4 i et klinisk signifikant omfang.
Rosuvastatin er et substrat for visse transporterproteiner, herunder leveroptagelsestransportøren organisk anion-transporterende polyprotein 1B1 (OATP1B1) og efflux transporter breast cancer resistensprotein (BCRP). Samtidig administration af CRESTOR 10 mg og medicin, der er hæmmere af disse transportproteiner (f.eks. cyclosporin, visse HIV-proteasehæmmere) kan resultere i øgede plasmakoncentrationer af rosuvastatin [se DOSERING OG ADMINISTRATION og DRUGSINTERAKTIONER ].
Farmakogenomi
Disponering af HMG-CoA-reduktasehæmmere, herunder rosuvastatin, involverer OATP1B1 og andre transporterproteiner. Højere plasmakoncentrationer af rosuvastatin er blevet rapporteret hos meget små grupper af patienter (n=3 til 5), som har to alleler med nedsat funktion af genet, der koder for OATP1B1 (SLCO1B1 521T > C). Hyppigheden af denne genotype (dvs. SLCO1B1 521 C/C) er generelt lavere end 5 % i de fleste race/etniske grupper. Indvirkningen af denne polymorfi på virkningen og/eller sikkerheden af rosuvastatin er ikke klart fastlagt.
Dyretoksikologi og/eller farmakologi
Toksicitet i centralnervesystemet
CNS vaskulære læsioner, karakteriseret ved perivaskulær blødning, ødem og mononukleær celleinfiltration af perivaskulære rum, er blevet observeret hos hunde behandlet med adskillige andre medlemmer af denne lægemiddelklasse. Et kemisk lignende lægemiddel i denne klasse producerede dosisafhængig optisk nervedegeneration (Wallerian degeneration af retinogene fibre) hos hunde i en dosis, der producerede plasma-lægemiddelniveauer omkring 30 gange højere end det gennemsnitlige lægemiddelniveau hos mennesker, der tog den højeste anbefalede dosis. Ødem, blødning og partiel nekrose i interstitium af plexus choroid blev observeret hos en hunhund, der blev ofret døende på dag 24 ved 90 mg/kg/dag ved oral sonde (systemisk eksponering 100 gange den menneskelige eksponering ved 40 mg/dag baseret på AUC). Hornhindeopacitet blev set hos hunde behandlet i 52 uger med 6 mg/kg/dag ved oral sonde (systemisk eksponering 20 gange den humane eksponering ved 40 mg/dag baseret på AUC). Grå stær blev set hos hunde behandlet i 12 uger med oral sondeernæring ved 30 mg/kg/dag (systemisk eksponering 60 gange den humane eksponering ved 40 mg/dag baseret på AUC). Nethindedysplasi og retinalt tab blev set hos hunde behandlet i 4 uger med oral sondeernæring ved 90 mg/kg/dag (systemisk eksponering 100 gange den humane eksponering ved 40 mg/dag baseret på AUC). Doser ≤30 mg/kg/dag (systemisk eksponering ≤60 gange den humane eksponering ved 40 mg/dag baseret på AUC) afslørede ikke retinale fund under behandling i op til et år.
Juvenil toksikologisk undersøgelse
I en juvenil undersøgelse blev rotter doseret ved oral sondeernæring med 10 eller 50 mg/kg/dag fra fravænning i 9 uger før parring, gennem hele parringen og op til dagen før obduktion for hanner eller op til drægtighedsdag 7 for hunner. Ingen påvirkninger på seksuel udvikling, testikel- og epididymal udseende eller fertilitet blev observeret ved hverken dosisniveauer (2 gange eller op til 24 gange human eksponering (AUC) ved den maksimale pædiatriske dosis på 20 mg/dag).
Kliniske Studier
Hyperlipidæmi og blandet dyslipidæmi
CRESTOR 5mg reducerer Total-C, LDL-C, ApoB, nonHDL-C og TG og øger HDL-C hos voksne patienter med hyperlipidæmi og blandet dyslipidæmi.
Dosisvarierende undersøgelse
I et multicenter, dobbeltblindt, placebokontrolleret, dosisvarierende studie hos patienter med hyperlipidæmi, CRESTOR givet som en enkelt daglig dosis i 6 uger reducerede total-C, LDL-C, non-HDL-C og ApoB signifikant på tværs af dosis rækkevidde (tabel 6).
Aktivt kontrolleret undersøgelse
CRESTOR 5mg blev sammenlignet med HMG-CoA-reduktasehæmmerne atorvastatin, simvastatin og pravastatin i et multicenter, åbent, dosisvarierende studie af 2240 patienter med hyperlipidæmi eller blandet dyslipidæmi. Efter randomisering blev patienterne behandlet i 6 uger med en enkelt daglig dosis af enten CRESTOR 20 mg, atorvastatin, simvastatin eller pravastatin (figur 1 og tabel 7).
Figur 1: Procentvis LDL-C-ændring efter dosis af CRESTOR 20 mg, Atorvastatin, Simvastatin og Pravastatin i uge 6 hos patienter med hyperlipidæmi eller blandet dyslipidæmi 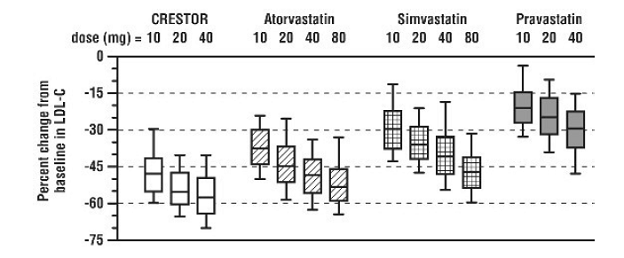
Boksplot er en repræsentation af 25., 50. og 75. percentilværdierne, hvor whiskers repræsenterer 10. og 90. percentilværdierne. Gennemsnitlig baseline LDL-C: 189 mg/Dl
Heterozygot familiær hyperkolesterolæmi
Aktivt kontrolleret undersøgelse
en undersøgelse af patienter med heterozygot FH (baseline middel LDL på 291) blev patienterne randomiseret til CRESTOR 20 mg eller atorvastatin 20 mg. Dosis blev øget med 6-ugers intervaller. Signifikante LDL-C-reduktioner fra baseline blev set ved hver dosis i begge behandlingsgrupper (tabel 8).
Hypertriglyceridæmi
Dosis-respons undersøgelse
I et dobbeltblindt, placebokontrolleret dosis-respons-studie hos patienter med baseline TG-niveauer fra 273 til 817 mg/dL, reducerede CRESTOR 10 mg givet som en enkelt daglig dosis (5 til 40 mg) over 6 uger signifikant serum-TG-niveauer ( Tabel 9).
Primær dysbetalipoproteinæmi (type III hyperlipoproteinæmi)
et randomiseret, multicenter, dobbeltblindt crossover-studie gik 32 patienter (27 med ε2/ε2 og 4 med apo E-mutation [Arg145Cys] med primær dysbetalipoproteinæmi (Type III Hyperlipoproteinæmi) ind i en 6-ugers kosttilførselsperiode på NCEP. Therapeutic Lifestyle Change (TLC) diæt Efter diætindledning blev patienterne randomiseret til en sekvens af behandlinger i forbindelse med TLC diæten i hver 6 uger: rosuvastatin 10 mg efterfulgt af rosuvastatin 20 mg eller rosuvastatin 20 mg efterfulgt af rosuvastatin 10 mg CRESTOR reducerede niveauer af non-HDL-C (primært slutpunkt) og cirkulerende rest lipoprotein. Resultaterne er vist i nedenstående tabel.
Homozygot familiær hyperkolesterolæmi
Dosis-titreringsundersøgelse
et åbent, tvungen titreringsstudie blev homozygote FH-patienter (n=40, 8-63 år) evalueret for deres respons på CRESTOR 20 til 40 mg titreret med et 6-ugers interval. I den samlede population var den gennemsnitlige LDL-C-reduktion fra baseline 22 %. Omkring en tredjedel af patienterne havde gavn af at øge deres dosis fra 20 mg til 40 mg med yderligere LDL-sænkning på mere end 6 %. Hos de 27 patienter med mindst 15 % reduktion i LDL-C var den gennemsnitlige LDL-C-reduktion 30 % (median 28 % reduktion). Blandt 13 patienter med en LDL-C-reduktion på
Pædiatriske patienter med homozygot familiær hyperkolesterolæmi
CRESTOR blev undersøgt i et randomiseret, dobbeltblindt, placebokontrolleret, multicenter, crossover-studie med 14 børn og unge med homozygot familiær hyperkolesterolæmi. Undersøgelsen omfattede en 4-ugers diætindledningsfase, hvor patienterne fik CRESTOR 10 mg dagligt, en cross-over-fase, der omfattede to 6-ugers behandlingsperioder med enten CRESTOR 20 mg eller placebo i tilfældig rækkefølge, efterfulgt af en 12-ugers behandlingsperiode. uge åben fase, hvor alle patienter fik CRESTOR 20 mg. Patienter varierede i alderen fra 7 til 15 år (median 11 år), 50 % var mænd, 71 % var kaukasiske, 21 % var asiatiske, 7 % var sorte, og ingen patienter var af latinamerikansk etnicitet. Halvtreds procent var i aferesebehandling, og 57 % tog ezetimibe. Patienter, der deltog i undersøgelsen med afereseterapi eller ezetimib, fortsatte behandlingen gennem hele undersøgelsen. Gennemsnitlig LDL-C ved baseline var 416 mg/dL (interval 152 til 716 mg/dL). I alt 13 patienter gennemførte begge behandlingsperioder af den randomiserede overkrydsningsfase; en patient trak samtykket tilbage på grund af manglende evne til at få udtaget blod under overkrydsningsfasen.
CRESTOR 20 mg reducerede signifikant LDL-C, totalt kolesterol, ApoB og non-HDL-C sammenlignet med placebo (tabel 11).
Pædiatriske patienter med heterozygot familiær hyperkolesterolæmi
I et dobbeltblindt, randomiseret, multicenter, placebokontrolleret, 12-ugers studie blev 176 (97 mænd og 79 kvinder) børn og unge med heterozygot familiær hyperkolesterolæmi randomiseret til rosuvastatin 5, 10 eller 20 mg eller placebo dagligt. Patienterne varierede i alderen fra 10 til 17 år (medianalder på 14 år) med cirka 30 % af patienterne 10 til 13 år og cirka 17 %, 18 %, 40 % og 25 % i Tanner-stadier II, III, IV, og V, henholdsvis. Kvinder var mindst 1 år postmenarche. Gennemsnitlig LDL-C ved baseline var 233 mg/dL (interval fra 129 til 399). Den 12-ugers dobbeltblinde fase blev efterfulgt af en 40 ugers åben dosistitreringsfase, hvor alle patienter (n=173) fik 5 mg, 10 mg eller 20 mg rosuvastatin dagligt.
Rosuvastatin reducerede signifikant LDL-C (primært slutpunkt), total kolesterol og ApoB niveauer ved hver dosis sammenlignet med placebo. Resultater er vist i tabel 12 nedenfor.
Ved afslutningen af den 12-ugers dobbeltblinde behandlingsperiode var procentdelen af patienter, der nåede LDL-C-målet på mindre end 110 mg/dL (2,8 mmol/L) 0 % for placebo, 12 % for rosuvastatin 5 mg , 41 % for rosuvastatin 10 mg og 41 % for rosuvastatin 20 mg. I den 40-ugers åbne fase blev 71 % af patienterne titreret til den maksimale dosis på 20 mg, og 41 % af patienterne nåede LDL-C-målet på 110 mg/dL.
Rosuvastatin blev også undersøgt i et toårigt åbent, ukontrolleret titrerings- til målforsøg, der omfattede 175 børn og unge med heterozygot familiær hyperkolesterolæmi, som var 8 til 17 år gamle (79 drenge og 96 piger). Alle patienter havde en dokumenteret genetisk defekt i LDL-receptoren eller i ApoB. Cirka 89 % var kaukasiske, 7 % var asiatiske, 1 % var sorte, og mindre end 1 % var latinamerikanske. Gennemsnitlig LDL-C ved baseline var 236 mg/dL. 58 (33%) patienter var præpubertale ved baseline. Startdosis af rosuvastatin til alle børn og unge var 5 mg én gang dagligt. Børn i alderen 8 til under 10 år (n=41 ved baseline) kunne titrere til en maksimal dosis på 10 mg én gang dagligt, og børn og unge i alderen 10 til 17 år kunne titrere til en maksimal dosis på 20 mg én gang dagligt.
Reduktionerne i LDL-C fra baseline var generelt konsistente på tværs af aldersgrupper i forsøget såvel som med tidligere erfaring i både kontrollerede voksne og pædiatrisk forsøg.
Den langsigtede effekt af rosuvastatinbehandling påbegyndt i barndommen for at reducere morbiditet og mortalitet i voksenalderen er ikke blevet fastlagt.
Opbremsning af udviklingen af åreforkalkning
undersøgelsen Measuring Effects on Intima Media Thickness: an Evaluation Of Rosuvastatin 40 mg (METEOR) undersøgelsen blev effekten af behandling med CRESTOR på carotis aterosklerose vurderet ved B-mode ultralyd hos patienter med forhøjet LDL-C, med lav risiko (Framingham-risiko)
Den årlige ændringsrate fra baseline for placebogruppen var +0,0131 mm/år (p
På individuelt patientniveau i gruppen behandlet med CRESTOR udviste 52,1 % af patienterne fravær af sygdomsprogression (defineret som en negativ årlig ændringsrate) sammenlignet med 37,7 % af patienterne i placebogruppen.
Primær forebyggelse af kardiovaskulær sygdom
begrundelsen for brugen af statiner i primær forebyggelse: et interventionsforsøg, der evaluerer rosuvastatin (JUPITER) undersøgelse, blev effekten af CRESTOR (rosuvastatin calcium) på forekomsten af alvorlige kardiovaskulære (CV) sygdomsbegivenheder vurderet hos 17.802 mænd (≥50 år) ) og kvinder (≥ 60 år), som ikke havde nogen klinisk tydelig kardiovaskulær sygdom, LDL-C-niveauer
Det primære endepunkt var et sammensat endepunkt, der bestod af tid til første forekomst af en af følgende større CV-hændelser: CV-død, ikke-fatalt myokardieinfarkt, ikke-fatalt slagtilfælde, hospitalsindlæggelse for ustabil angina eller en arteriel revaskulariseringsprocedure.
Rosuvastatin reducerede signifikant risikoen for større CV-hændelser (252 hændelser i placebogruppen vs. 142 hændelser i rosuvastatin-gruppen) med en statistisk signifikant (p
Figur 2: Tid til første forekomst af større kardiovaskulære hændelser i JUPITER 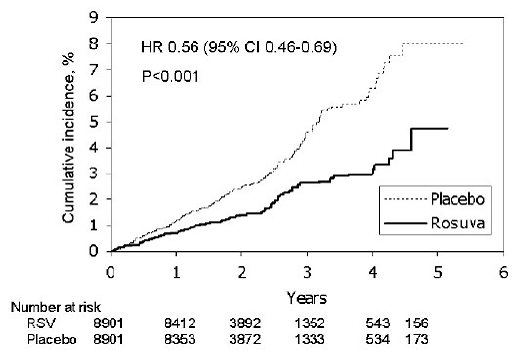
De individuelle komponenter af det primære endepunkt er vist i figur 3. Rosuvastatin reducerede signifikant risikoen for ikke-fatalt myokardieinfarkt, ikke-fatalt slagtilfælde og arterielle revaskulariseringsprocedurer. Der var ingen signifikante behandlingsforskelle mellem rosuvastatin- og placebogruppen for død på grund af kardiovaskulære årsager eller hospitalsindlæggelser for ustabil angina.
Rosuvastatin reducerede signifikant risikoen for myokardieinfarkt (6 fatale hændelser og 62 ikke-fatale hændelser hos placebo-behandlede personer mod 9 fatale hændelser og 22 ikke-dødelige hændelser hos rosuvastatin-behandlede personer) og risikoen for slagtilfælde (6 fatale hændelser og 58 ikke-dødelige hændelser i placebo-behandlede forsøgspersoner vs. 3 fatale hændelser og 30 ikke-dødelige hændelser hos rosuvastatin-behandlede forsøgspersoner).
en post-hoc undergruppeanalyse af JUPITER-personer (n=1405; rosuvastatin=725, placebo=680) med en hsCRP ≥2 mg/L og ingen andre traditionelle risikofaktorer (rygning, BP ≥140/90 eller tager antihypertensiva, lav HDL-C) bortset fra alder, efter justering for høj HDL-C, var der ingen signifikant behandlingsfordel med rosuvastatinbehandling.
Figur 3: Større CV-begivenheder efter behandlingsgruppe i JUPITER 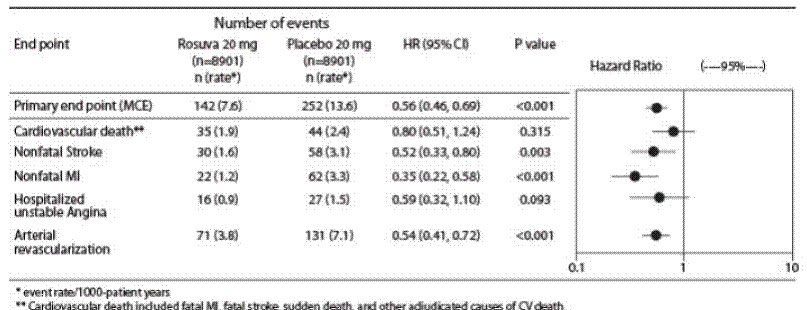
Efter et år øgede rosuvastatin HDL-C og reducerede LDL-C, hsCRP, total kolesterol og serum triglyceridniveauer (p
PATIENTOPLYSNINGER
CRESTOR® (Kres-tor) rosuvastatin calcium tabletter
Læs denne patientinformation omhyggeligt, før du begynder at tage CRESTOR 20 mg, og hver gang du får en genopfyldning. Spørg din læge, hvis du har spørgsmål om CRESTOR. Kun din læge kan afgøre, om CRESTOR er det rigtige for dig.
Hvad er CRESTOR?
CRESTOR 20mg er et receptpligtigt lægemiddel, der indeholder et kolesterolsænkende lægemiddel kaldet rosuvastatin calcium. Det meste af kolesterolet i dit blod dannes i leveren. CRESTOR 20mg virker ved at reducere kolesterol på to måder: CRESTOR 5mg blokerer et enzym i leveren, hvilket får leveren til at lave mindre kolesterol, og CRESTOR 20mg øger leverens optagelse og nedbrydning af kolesterol, der allerede er i blodet.
- CRESTOR bruges sammen med diæt til:
- sænke niveauet af dit "dårlige" kolesterol (LDL)
- øge niveauet af dit "gode" kolesterol (HDL)
- sænke niveauet af fedt i dit blod (triglycerider)
- bremse opbygningen af fedtaflejringer (plak) i væggene i blodkarrene
- CRESTOR bruges til at behandle:
- voksne, der ikke kan kontrollere deres kolesteroltal ved kost og motion alene
- børn i alderen 8 til 17 år med heterozygot familiær hyperkolesterolæmi (en arvelig tilstand, der forårsager høje niveauer af LDL)
- børn i alderen 7 til 17 år med homozygot familiær hyperkolesterolæmi (en arvelig tilstand, der forårsager høje niveauer af LDL).
CRESTOR 20mg er ikke godkendt til brug hos børn med heterozygot familiær hyperkolesterolæmi under 8 år eller til børn med homozygot familiær hyperkolesterolæmi under 7 år.
CRESTOR 5mg bruges til at reducere risikoen for hjerteanfald og slagtilfælde hos mænd på 50 år og ældre og kvinder på 60 år og ældre, som ikke har kendt hjertesygdom, men som dog har visse yderligere risikofaktorer.
Det vides ikke, om CRESTOR 10mg er sikkert og effektivt hos personer, der har Fredrickson Type I og V dyslipidæmi.
Hvem bør ikke tage CRESTOR?
Tag ikke CRESTOR, hvis du:
- er allergisk over for rosuvastatincalcium eller et af indholdsstofferne i CRESTOR. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i CRESTOR.
- har leverproblemer.
- er gravid eller tror, du kan være gravid, eller planlægger at blive gravid. CRESTOR 20mg kan skade dit ufødte barn. Hvis du bliver gravid, skal du stoppe med at tage CRESTOR og kontakte din læge med det samme. Hvis du ikke planlægger at blive gravid, skal du bruge effektiv prævention (prævention), mens du tager CRESTOR.
- ammer. Medicin som CRESTOR 5mg kan passere over i din modermælk og kan skade din baby.
Hvad skal jeg fortælle min læge før og mens jeg tager CRESTOR?
Fortæl det til din læge, hvis du:
- har uforklarlige muskelsmerter eller -svaghed
- har eller har haft nyreproblemer
- har eller har haft leverproblemer
- drik mere end 2 glas alkohol dagligt
- har problemer med skjoldbruskkirtlen
- er 65 år eller ældre
- er af asiatisk afstamning
- er gravid eller tror, du kan være gravid, eller planlægger at blive gravid
- ammer
Fortæl din læge om al den medicin du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler.
Tal med din læge, før du begynder at tage ny medicin.
Hvis du tager CRESTOR 20 mg sammen med visse andre lægemidler, kan det påvirke hinanden og forårsage bivirkninger. CRESTOR kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke, hvordan CRESTOR virker.
Fortæl det især din læge, hvis du tager:
- cyclosporin (et lægemiddel til dit immunsystem)
- gemfibrozil (en fibrinsyremedicin til at sænke kolesterol)
- antivirale lægemidler, herunder HIV eller hepatitis C proteasehæmmere (såsom lopinavir, ritonavir, fosamprenavir, tipranavir, atazanavir eller simeprevir)
- visse anti-svampemidler (såsom itraconazol, ketoconazol og fluconazol)
- coumarin antikoagulantia (medicin, der forhindrer blodpropper, såsom warfarin)
- niacin eller nikotinsyre
- fibrinsyrederivater (såsom fenofibrat)
- colchicin (et lægemiddel til behandling af gigt)
Spørg din læge eller apoteket om en liste over disse lægemidler, hvis du er i tvivl.
Kend alle de lægemidler, du tager. Hold en liste over dem for at vise din læge og apotek, når du får ny medicin.
Hvordan skal jeg tage CRESTOR 10mg?
- Tag CRESTOR nøjagtigt som din læge fortæller dig at tage det.
- Tag CRESTOR gennem munden 1 gang hver dag. Synk tabletten hel.
- CRESTOR kan tages når som helst på dagen, med eller uden mad.
- Lade være med ændre din dosis eller stop CRESTOR 10 mg uden at tale med din læge, selvom du har det godt.
- Din læge kan tage blodprøver for at kontrollere dit kolesteroltal før og under din behandling med CRESTOR. Din læge kan ændre din dosis af CRESTOR 10 mg, hvis det er nødvendigt.
- Din læge kan starte dig på en kolesterolsænkende diæt, før du giver dig CRESTOR. Bliv på denne diæt, når du tager CRESTOR.
- Vent mindst 2 timer efter at have taget CRESTOR med at tage et antacidum, der indeholder en kombination af aluminium og magnesiumhydroxid.
- Hvis du glemmer en dosis af CRESTOR 10 mg, skal du tage den, så snart du husker det. Imidlertid, tag ikke 2 doser CRESTOR 10 mg inden for 12 timer efter hinanden.
- Hvis du tager for meget CRESTOR 20 mg eller overdosis, skal du straks ringe til din læge eller gå til den nærmeste skadestue.
Hvad er de mulige bivirkninger af CRESTOR 20mg?
CRESTOR 10mg kan forårsage alvorlige bivirkninger, herunder:
- Muskelsmerter, ømhed og svaghed (myopati). Muskelproblemer, herunder muskelnedbrydning, kan hos nogle mennesker være alvorlige og forårsager sjældent nyreskade, der kan føre til døden. Fortæl din læge med det samme, hvis:
- du har uforklarlige muskelsmerter, ømhed eller svaghed, især hvis du har feber eller føler dig mere træt end normalt, mens du tager CRESTOR.
- du har muskelproblemer, som ikke forsvinder, selv efter din læge har bedt dig om at stoppe med at tage CRESTOR. Din læge kan lave yderligere test for at diagnosticere årsagen til dine muskelproblemer.
Dine chancer for at få muskelproblemer er højere, hvis du:
- tager visse andre lægemidler, mens du tager CRESTOR
- er 65 år eller ældre
- har skjoldbruskkirtelproblemer (hypothyroidisme), som ikke er kontrolleret
- har nyreproblemer
- tager højere doser af CRESTOR
- Leverproblemer. Din læge bør tage blodprøver for at kontrollere din lever, før du begynder at tage CRESTOR 5 mg, og hvis du har symptomer på leverproblemer, mens du tager CRESTOR. Ring til din læge med det samme, hvis du har nogle af følgende symptomer på leverproblemer:
- føler sig usædvanlig træt eller svag
- mistet appetiten
- smerter i øvre mave
- mørk urin
- gulfarvning af din hud eller det hvide i dine øjne
De mest almindelige bivirkninger kan omfatte: hovedpine, muskelsmerter, mavesmerter, svaghed og kvalme.
Yderligere bivirkninger, der er blevet rapporteret med CRESTOR, omfatter hukommelsestab og forvirring.
Fortæl det til din læge, hvis du har en bivirkning, som generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af CRESTOR. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare CRESTOR 20mg?
- Opbevar CRESTOR 10mg ved stuetemperatur, mellem 68°F til 77°F (20°C til 25°C) og på et tørt sted.
- Smid sikkert medicin ud, der er forældet eller ikke længere er nødvendigt.
Opbevar CRESTOR 10 mg og al medicin utilgængeligt for børn.
Hvad er ingredienserne i CRESTOR?
Aktiv ingrediens: rosuvastatin som rosuvastatin calcium
Inaktive ingredienser: mikrokrystallinsk cellulose NF, lactosemonohydrat NF, tribasisk calciumphosphat NF, crospovidon NF, magnesiumstearat NF, hypromellose NF, triacetin NF, titaniumdioxid USP, gult ferrioxid og rødt ferrioxid NF.
Generel information om sikker og effektiv brug af CRESTOR
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en patientinformationsfolder. Brug ikke CRESTOR 10 mg til en tilstand, som det ikke er ordineret til. Giv ikke CRESTOR 20 mg til andre mennesker, selvom de har den samme medicinske tilstand, som du har. Det kan skade dem.
Du kan spørge din apoteker eller læge om oplysninger om CRESTOR 5mg, som er skrevet til sundhedspersonale.
Denne patientinformation er blevet godkendt af US Food and Drug Administration Revideret 9/2018
