Zanaflex 2mg, 4mg Tizanidine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Zanaflex 2mg, og hvordan bruges det?
Zanaflex 2mg er en receptpligtig medicin, der bruges til at behandle symptomer på muskelstivhed (spasticitet) forbundet med tilstande som cerebral parese eller andre neurologiske lidelser. Zanaflex 2mg kan bruges alene eller sammen med anden medicin.
Zanaflex 2mg tilhører en klasse af lægemidler kaldet Central Alpha-2-Adrenerge Agonist.
Det vides ikke, om Zanaflex er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Zanaflex?
Zanaflex 2mg kan forårsage alvorlige bivirkninger, herunder:
- lavt blodtryk,
- unormale leverfunktionsprøver,
- døsighed,
- hallucinationer,
- overdreven døsighed,
- langsom hjerterytme,
- tør mund,
- træthed, og
- svaghed
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Zanaflex omfatter:
- tør mund,
- træthed,
- svaghed,
- træthed,
- træthed,
- svimmelhed,
- urinvejsinfektion,
- forstoppelse,
- unormale leverfunktionsprøver,
- opkastning,
- taleforstyrrelse,
- dovent øje (amblyopi),
- hyppighed af urin,
- influenza symptomer,
- ukontrollerede muskelbevægelser,
- nervøsitet,
- ondt i halsen, og
- løbende næse
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Zanaflex. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
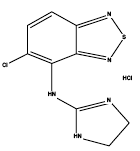
Zanaflex® (tizanidinhydrochlorid) er en central alfa2-adrenerg agonist. Tizanidine HCl er et hvidt til råhvidt, fint krystallinsk pulver, som er lugtfrit eller med en svag karakteristisk lugt. Tizanidin er let opløseligt i vand og methanol; opløseligheden i vand falder, når pH stiger. Dets kemiske navn er 5-chlor-4-(2-imidazolin-2-ylamino)-2,1,3-benzothiadiazol-monohydrochlorid. Tizanidins molekylformel er C9H8ClN5S-HCl, dens molekylvægt er 290,2 og dens strukturformel er:
Zanaflex 4mg Capsules® leveres som 2, 4 og 6 mg kapsler til oral administration. Zanaflex Capsules® indeholder den aktive ingrediens, tizanidinhydrochlorid (2,29 mg svarende til 2 mg tizanidinbase, 4,58 mg svarende til 4 mg tizanidinbase og 6,87 mg svarende til 6 mg tizanidinbase), og de inaktive ingredienser, hypromellose, siliciumdioxid sukkerkugler, titaniumdioxid, gelatine og farvestoffer.
Zanaflex® tabletter leveres som 4 mg tabletter til oral administration. Zanaflex® tabletter indeholder den aktive ingrediens, tizanidinhydrochlorid (4,58 mg svarende til 4 mg tizanidinbase), og de inaktive ingredienser, kolloid siliciumdioxid, stearinsyre, mikrokrystallinsk cellulose og vandfri laktose.
INDIKATIONER
Zanaflex er indiceret til behandling af spasticitet. På grund af den korte varighed af terapeutisk effekt, bør behandling med Zanaflex forbeholdes de daglige aktiviteter og tidspunkter, hvor lindring af spasticitet er vigtigst [se DOSERING OG ADMINISTRATION ].
DOSERING OG ADMINISTRATION
Doseringsoplysninger
Zanaflex 2mg Capsules® eller Zanaflex® tabletter kan ordineres med eller uden mad. Når først formuleringen er blevet valgt, og beslutningen om at tage med eller uden mad er truffet, bør denne kur ikke ændres.
Mad har komplekse virkninger på tizanidins farmakokinetik, som adskiller sig med de forskellige formuleringer. Zanaflex kapsler og Zanaflex tabletter er bioækvivalente med hinanden under fastende forhold (mere end 3 timer efter et måltid), men ikke under fodringsforhold (inden for 30 minutter efter et måltid). Disse farmakokinetiske forskelle kan resultere i klinisk signifikante forskelle, når der skiftes administration af tablet og kapsler, og når der skiftes administration mellem føde- eller fastetilstand. Disse ændringer kan resultere i øgede uønskede hændelser eller forsinket eller hurtigere indtræden af aktivitet, afhængigt af skiftets art. Af denne grund bør den ordinerende læge være grundigt bekendt med ændringerne i kinetikken forbundet med disse forskellige tilstande [se KLINISK FARMAKOLOGI ].
Den anbefalede startdosis er 2 mg. Da virkningen af Zanaflex topper ca. 1 til 2 timer efter dosis og forsvinder mellem 3 til 6 timer efter dosis, kan behandlingen gentages med 6 til 8 timers intervaller efter behov til maksimalt tre doser på 24 timer.
Dosis kan øges gradvist med 2 mg til 4 mg ved hver dosis, med 1 til 4 dage mellem dosisforøgelser, indtil en tilfredsstillende reduktion af muskeltonus opnås. Den samlede daglige dosis bør ikke overstige 36 mg. Enkeltdoser større end 16 mg er ikke blevet undersøgt.
Dosering hos patienter med nedsat nyrefunktion
Zanaflex bør anvendes med forsigtighed til patienter med nyreinsufficiens (kreatininclearance ADVARSLER OG FORHOLDSREGLER ].
Dosering hos patienter med nedsat leverfunktion
Zanaflex 4mg bør anvendes med forsigtighed til patienter med nedsat leverfunktion. Hos disse patienter bør de individuelle doser reduceres under titrering. Hvis højere doser er påkrævet, bør individuelle doser øges i stedet for doseringsfrekvensen. Monitorering af aminotransferaseniveauer anbefales for baseline og 1 måned efter maksimal dosis er opnået, eller hvis der er mistanke om leverskade [se Brug i specifikke populationer ].
Lægemiddelophør
Hvis det er nødvendigt at seponere behandlingen, især hos patienter, der har fået høje doser (20 mg til 36 mg dagligt) i lange perioder (9 uger eller mere), eller som kan være i samtidig behandling med narkotika, skal dosis nedsættes langsomt ( 2 mg til 4 mg om dagen) for at minimere risikoen for abstinenser og rebound hypertension, takykardi og hypertoni [se Stofmisbrug og afhængighed ].
HVORDAN LEVERET
Doseringsformer og styrker
Kapsler
mg: Lyseblå uigennemsigtig krop med en lyseblå uigennemsigtig hætte med "2 MG" trykt på hætten 4 mg: Hvid uigennemsigtig krop med en blå uigennemsigtig hætte med "4 MG" trykt på hætten 6 mg: Blå uigennemsigtig krop med en hvid stribe og blå uigennemsigtig hætte med "6 MG" trykt på hætten
Tabletter
4 mg hvide, uovertrukne tabletter med firkantede delekærv på den ene side og præget med "A594" på den anden side
Opbevaring og håndtering
Zanaflex kapsler®
Zanaflex Capsules® (tizanidinhydrochlorid) kapsler fås i tre styrker som todelte hårde gelatinekapsler indeholdende tizanidinhydrochlorid 2,29 mg, 4,58 mg og 6,87 mg, svarende til 2 mg, 4 mg og 6 mg tizanidinbase.
2 mg kapslerne har en lyseblå uigennemsigtig krop med en lyseblå uigennemsigtig låg med "2 MG" trykt på låget: flasker med 150 kapsler ( NDC 70515-602-15)
4 mg kapslerne har en hvid uigennemsigtig krop med en blå uigennemsigtig låg med "4 MG" trykt på låget: flasker med 150 kapsler ( NDC 70515-604-15)
mg kapslerne har en blå uigennemsigtig krop med en hvid stribe og blå uigennemsigtig låg med "6 MG" trykt på kapslerne: flasker med 150 kapsler ( NDC 70515-606-15)
Opbevares ved 25°C (77°F); udflugter tilladt til 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur ]. Dispenser i beholdere med børnesikret lukning.
Zanaflex® tabletter
Zanaflex® (tizanidinhydrochlorid) tabletter fås som 4 mg hvide, uovertrukne tabletter indeholdende tizanidinhydrochlorid 4,58 mg, svarende til 4 mg tizanidinbase. Tabletterne har en firkantet delekærv på den ene side og er præget med "A594" på den anden side. Tabletter leveres som følger: flasker med 150 tabletter (NDC 70515-594-15).
Opbevares ved 25°C (77°F); udflugter tilladt til 15°C til 30°C (59°F til 86°F) [se USP kontrolleret rumtemperatur ].
Dispenser i beholdere med børnesikret lukning.
Fremstillet for: Covis Pharma Zug, 6300 Schweiz. Revideret: december 2020
BIVIRKNINGER
Følgende bivirkninger er beskrevet andetsteds i andre afsnit af ordinationsinformationen:
- Hypotension [se ADVARSLER OG FORHOLDSREGLER ]
- Leverskade [se ADVARSLER OG FORHOLDSREGLER ]
- Sedation [se ADVARSLER OG FORHOLDSREGLER ]
- Hallucinose/psykotisk-lignende symptomer [se ADVARSLER OG FORHOLDSREGLER ]
- Overfølsomhedsreaktioner [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske undersøgelser udføres under vidt forskellige forhold, kan frekvensen af bivirkninger observeret i de kliniske undersøgelser af et lægemiddel ikke direkte sammenlignes med frekvenserne i de kliniske undersøgelser af et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
Tre dobbeltblindede, randomiserede, placebokontrollerede kliniske undersøgelser blev udført for at evaluere effekten af tizanidin på spasticitetskontrol. To undersøgelser blev udført med patienter med multipel sklerose og én med patienter med rygmarvsskade. Hver undersøgelse havde en 13-ugers aktiv behandlingsperiode, som omfattede en 3-ugers titreringsfase til den maksimalt tolererede dosis op til 36 mg/dag i tre opdelte doser, en 9-ugers plateaufase, hvor dosis af tizanidin blev holdt konstant og en 1-uges dosisnedtrapning. I alt fik 264 patienter tizanidin og 261 patienter fik placebo. På tværs af de tre undersøgelser var patienternes alder fra 15-69 år, og 51,4 procent var kvinder. Median dosis under plateaufasen varierede fra 20-28 mg/dag.
De hyppigste bivirkninger rapporteret i placebokontrollerede kliniske undersøgelser med multiple doser med 264 patienter med spasticitet var mundtørhed, somnolens/sedation, asteni (svaghed, træthed og/eller træthed) og svimmelhed. Tre fjerdedele af patienterne vurderede hændelserne som milde til moderate, og en fjerdedel af patienterne vurderede hændelserne som værende alvorlige. Disse hændelser så ud til at være dosisrelaterede.
Tabel 1 viser tegn og symptomer, der blev rapporteret hos mere end 2 % af patienterne i tre placebo-kontrollerede multiple doser undersøgelser, som fik Zanaflex, hvor hyppigheden i Zanaflex-gruppen var større end placebogruppen. Til sammenligning er den tilsvarende hyppighed af hændelsen (pr. 100 patienter) blandt placebobehandlede patienter også angivet.
I det placebokontrollerede enkeltdosis studie med 142 patienter med spasticitet på grund af dissemineret sklerose (undersøgelse 1) [se Kliniske Studier ], blev patienterne specifikt spurgt, om de havde oplevet nogen af de fire mest almindelige bivirkninger: mundtørhed, døsighed (døsighed), asteni (svaghed, træthed og/eller træthed) og svimmelhed. Derudover blev hypotension og bradykardi observeret. Forekomsten af disse reaktioner er opsummeret i tabel 2. Andre hændelser blev generelt rapporteret med en hastighed på 2 % eller mindre.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af Zanaflex efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering.
Visse hændelser, såsom døsighed, mundtørhed, hypotension, nedsat blodtryk, bradykardi, svimmelhed, svaghed eller asteni, muskelspasmer, hallucinationer, træthed, unormal leverfunktionstest og levertoksicitet, er blevet observeret i postmarketing og kliniske forsøg og diskuteres. i tidligere afsnit af dette dokument.
Følgende bivirkninger er blevet identificeret som forekommende efter markedsføringen af Zanaflex. Baseret på oplysningerne vedrørende disse reaktioner kan en årsagssammenhæng med Zanaflex ikke helt udelukkes. Hændelserne er opført i rækkefølge efter faldende klinisk betydning; sværhedsgraden i postmarketingindstillingen rapporteres ikke.
- Stevens Johnsons syndrom
- Anafylaktisk reaktion
- Eksfoliativ dermatitis
- Ventrikulær takykardi
- Hepatitis
- Konvulsion
- Depression
- Artralgi
- Paræstesi
- Udslæt
- Rysten
DRUGSINTERAKTIONER
Fluvoxamin
Samtidig brug af fluvoxamin og Zanaflex 4mg er kontraindiceret. Ændringer i tizanidins farmakokinetik, når det blev givet sammen med fluvoxamin, resulterede i signifikant nedsat blodtryk, øget døsighed og øget psykomotorisk svækkelse [se KONTRAINDIKATIONER og KLINISK FARMAKOLOGI ].
Ciprofloxacin
Samtidig brug af ciprofloxacin og Zanaflex er kontraindiceret. Ændringer i tizanidins farmakokinetik, når det blev givet sammen med ciprofloxacin, resulterede i signifikant nedsat blodtryk, øget døsighed og øget psykomotorisk svækkelse [se KONTRAINDIKATIONER og KLINISK FARMAKOLOGI ].
Andre CYP1A2-hæmmere end fluvoxamin og ciprofloxacin
På grund af potentielle lægemiddelinteraktioner, samtidig brug af Zanaflex med andre CYP1A2-hæmmere, såsom zileuton, andre fluoroquinoloner end stærke CYP1A2-hæmmere (som er kontraindiceret), antiarytmika (amiodaron, mexiletin, propafenon og verapamil), præventionsmiddel, facimetidin, oral, prævention. acyclovir og ticlopidin) bør undgås. Hvis deres anvendelse er klinisk nødvendig, bør behandlingen påbegyndes med 2 mg dosis og øges i trin på 2-4 mg dagligt baseret på patientens respons på behandlingen. Hvis der opstår bivirkninger såsom hypotension, bradykardi eller overdreven døsighed, skal du reducere eller afbryde Zanaflex-behandlingen [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Orale præventionsmidler
Samtidig brug af Zanaflex 2mg og orale præventionsmidler anbefales ikke. Men hvis samtidig brug er klinisk nødvendig, påbegyndes Zanaflex 4 mg med en enkelt dosis på 2 mg og øges i trin på 2-4 mg dagligt baseret på patientens respons på behandlingen. Hvis der opstår bivirkninger såsom hypotension, bradykardi eller overdreven døsighed, skal du reducere eller afbryde Zanaflex-behandlingen [se KLINISK FARMAKOLOGI ].
Alkohol
Alkohol øger den samlede mængde lægemiddel i blodbanen efter en dosis af Zanaflex. Dette var forbundet med en stigning i bivirkninger af Zanaflex. De CNS-depressive virkninger af Zanaflex og alkohol er additive [se KLINISK FARMAKOLOGI ].
Andre CNS-depressiva
De beroligende virkninger af Zanaflex med CNS-depressiva (f.eks. benzodiazepiner, opioider, tricykliske antidepressiva) kan være additive. Overvåg patienter, der tager Zanaflex 2mg med et andet CNS-depressivt middel for symptomer på overdreven sedation [se KLINISK FARMAKOLOGI ].
α2-adrenerge agonister
Da hypotensive virkninger kan være kumulative, anbefales det ikke, at Zanaflex 4mg anvendes sammen med andre α2-adrenerge agonister [se ADVARSLER OG FORHOLDSREGLER ].
Stofmisbrug og afhængighed
Misbrug
Misbrugspotentiale blev ikke evalueret i humane undersøgelser. Rotter var i stand til at skelne tizanidin fra saltvand i et standard diskriminationsparadigme efter træning, men de formåede ikke at generalisere virkningerne af morfin, kokain, diazepam eller phenobarbital til tizanidin.
Afhængighed
Tizanidin er tæt beslægtet med clonidin, som ofte misbruges i kombination med narkotika og er kendt for at forårsage symptomer på rebound ved pludselig abstinens. Tre tilfælde af rebound-symptomer ved pludselig seponering af tizanidin er blevet rapporteret. Sagsrapporterne tyder på, at disse patienter også misbrugte narkotika. Abstinenssymptomer omfattede hypertension, takykardi, hypertoni, tremor og angst. Abstinenssymptomer er mere tilbøjelige til at forekomme i tilfælde, hvor høje doser anvendes, især i længere perioder, eller ved samtidig brug af narkotika. Hvis behandlingen skal seponeres, skal dosis nedsættes langsomt for at minimere risikoen for abstinenssymptomer [se DOSERING OG ADMINISTRATION ].
Aber blev vist selv at administrere tizanidin på en dosisafhængig måde, og pludseligt ophør med tizanidin gav forbigående tegn på abstinenser ved doser > 35 gange den maksimalt anbefalede humane dosis på mg/m²-basis. Disse forbigående abstinenstegn (øget bevægelse, kropstrækninger og aversiv adfærd over for observatøren) blev ikke vendt ved administration af naloxon.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Hypotension
Tizanidin er en α2-adrenerg agonist, der kan fremkalde hypotension. Synkope er blevet rapporteret i postmarketingindstillingen. Chancen for signifikant hypotension kan muligvis minimeres ved at titrere dosis og ved at fokusere opmærksomheden på tegn og symptomer på hypotension før dosisforøgelse. Derudover kan patienter, der bevæger sig fra liggende til fast oprejst stilling, have øget risiko for hypotension og ortostatiske effekter.
Overvåg for hypotension, når Zanaflex anvendes til patienter, der samtidig får antihypertensiv behandling. Det anbefales ikke, at Zanaflex 2mg anvendes sammen med andre α2-adrenerge agonister. Klinisk signifikant hypotension (fald i både systolisk og diastolisk tryk) er blevet rapporteret ved samtidig administration af enten fluvoxamin eller ciprofloxacin og enkeltdoser på 4 mg Zanaflex. Derfor er samtidig brug af Zanaflex og fluvoxamin eller med ciprofloxacin, potente hæmmere af CYP1A2, kontraindiceret [se KONTRAINDIKATIONER og DRUGSINTERAKTIONER ].
Risiko for leverskade
Zanaflex kan forårsage hepatocellulær leverskade. Zanaflex 4mg bør anvendes med forsigtighed til patienter med nedsat leverfunktion. Monitorering af aminotransferaseniveauer anbefales for baseline og 1 måned efter maksimal dosis er opnået, eller hvis der er mistanke om leverskade [se DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Sedation
Zanaflex kan forårsage sedation, som kan forstyrre den daglige aktivitet. I multidosis-undersøgelserne toppede prævalensen af patienter med sedation efter den første uges titrering og forblev derefter stabil i varigheden af undersøgelsens vedligeholdelsesfase. De CNS-depressive virkninger af Zanaflex med alkohol og andre CNS-depressiva (f.eks. benzodiazepiner, opioider, tricykliske antidepressiva) kan være additive. Overvåg patienter, der tager Zanaflex 4mg med et andet CNS-depressivt middel for symptomer på overdreven sedation [se DRUGSINTERAKTIONER ].

Hallucinose/psykotisk-lignende symptomer
Zanaflex 4mg brug er blevet forbundet med hallucinationer. Dannede, visuelle hallucinationer eller vrangforestillinger er blevet rapporteret hos 5 ud af 170 patienter (3%) i to nordamerikanske kontrollerede kliniske undersøgelser. De fleste af patienterne var klar over, at begivenhederne var uvirkelige. En patient udviklede psykose i forbindelse med hallucinationerne. En patient blandt disse 5 fortsatte med at have problemer i mindst 2 uger efter seponering af tizanidin. Overvej at seponere Zanaflex hos patienter, som udvikler hallucinationer.
Interaktion med CYP1A2-hæmmere
På grund af potentielle lægemiddelinteraktioner er Zanaflex 4mg kontraindiceret til patienter, der tager potente CYP1A2-hæmmere, såsom fluvoxamin eller ciprofloxacin. Bivirkninger såsom hypotension, bradykardi eller overdreven døsighed kan forekomme, når Zanaflex tages sammen med andre CYP1A2-hæmmere, såsom zileuton, andre fluoroquinoloner end ciprofloxacin (som er kontraindiceret), antiarytmika (amiodaron, mexiletin, oralt, propafenidin, oralt). præventionsmidler, acyclovir og ticlopidin). Samtidig brug bør undgås, medmindre nødvendigheden af Zanaflex 2 mg-behandling er klinisk indlysende. Brug i sådanne tilfælde med forsigtighed [se DRUGSINTERAKTIONER og KLINISK FARMAKOLOGI ].
Overfølsomhedsreaktioner
Zanaflex kan forårsage anafylaksi. Tegn og symptomer inklusive respiratorisk kompromittering, nældefeber og angioødem i halsen og tungen er blevet rapporteret. Patienterne skal informeres om tegn og symptomer på alvorlige allergiske reaktioner og instrueres i at seponere Zanaflex og søge omgående lægehjælp, hvis disse tegn og symptomer opstår [se KONTRAINDIKATIONER ].
Øget risiko for uønskede reaktioner hos patienter med nedsat nyrefunktion
Zanaflex bør anvendes med forsigtighed til patienter med nyreinsufficiens (kreatininclearance DOSERING OG ADMINISTRATION og Brug i specifikke populationer ].
Tilbagetrækningsbivirkninger
Seponeringsbivirkninger omfatter rebound-hypertension, takykardi og hypertoni. For at minimere risikoen for disse reaktioner, især hos patienter, der har fået høje doser (20 til 28 mg dagligt) i lange perioder (9 uger eller mere), eller som kan være i samtidig behandling med narkotika, bør dosis nedsættes. langsomt (2 til 4 mg pr. dag) [se DOSERING OG ADMINISTRATION ].
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Tizanidin blev givet til mus i 78 uger i orale doser op til 16 mg/kg/dag, hvilket er 2 gange den maksimale anbefalede humane dosis (MRHD) på 36 mg/dag på basis af kropsoverfladeareal (mg/m²). Tizanidin blev givet til rotter i 104 uger i orale doser op til 9 mg/kg/dag, hvilket er 2,5 gange MRHD på mg/m²-basis. Der var ingen stigning i tumorer i nogen af arterne.
Mutagenese
Tizanidin var negativ i in vitro (bakteriel omvendt mutation [Ames], pattedyrsgenmutation og kromosomafvigelsestest i pattedyrsceller) og in vivo (knoglemarvsmikronukleus og cytogenetik) assay.
Forringelse af fertilitet
Oral administration af tizanidin til rotter før og under parring og fortsat under tidlig graviditet hos hunner resulterede i nedsat fertilitet hos han- og hunrotter ved doser på henholdsvis 30 og 10 mg/kg/dag. Der blev ikke observeret nogen effekt på fertiliteten ved doser på 10 (mandlige) og 3 (hunlige) mg/kg/dag, hvilket er ca. 3 gange og svarer til henholdsvis MRHD på mg/m²-basis.
Brug i specifikke populationer
Graviditet
Risikooversigt
Der er ikke tilstrækkelige data om den udviklingsmæssige risiko forbundet med brug af Zanaflex 2mg hos gravide kvinder. I dyreforsøg resulterede administration af tizanidin under graviditet i udviklingstoksicitet (embryofetal og postnatal afkomsdødelighed og vækstmangel) ved doser mindre end dem, der blev anvendt klinisk, som ikke var forbundet med maternel toksicitet (se Dyredata ).
I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % - 4 % og 15 % - 20 %. Baggrundsrisikoen for alvorlige fødselsdefekter og abort for den angivne population er ukendt.
Data
Dyredata
Oral administration af tizanidin (0,3 til 100 mg/kg/dag) til drægtige rotter i løbet af organogeneseperioden resulterede i embryoføtal og postnatal afkomsdødelighed og reduktioner i kropsvægt ved doser på 30 mg/kg/dag og derover. Maternel toksicitet blev observeret ved den højeste testede dosis. No-effect dosis for embryoføtal udviklingstoksicitet hos rotter (3 mg/kg/dag) svarer til den maksimalt anbefalede humane dosis (MRHD) på 36 mg/dag på basis af kropsoverfladeareal (mg/m²).
Oral administration af tizanidin (1 til 100 mg/kg/dag) til drægtige kaniner i løbet af organogeneseperioden resulterede i embryoføtal og postnatal afkomsdødelighed ved alle doser. Maternel toksicitet blev observeret ved den højeste testede dosis. Oral administration af tizanidin (10 og 30 mg/kg/dag) under den perinatale periode af graviditeten (2-6 dage før fødslen) resulterede i øget postnatal afkomsdødelighed ved begge doser. En dosis uden effekt for embryoføtal udviklingstoksicitet hos kanin blev ikke identificeret. Den laveste testede dosis (1 mg/kg/dag) er mindre end MRHD på mg/m²-basis.
I et præ- og postnatalt udviklingsstudie med rotter resulterede oral administration af tizanidin (3 til 30 mg/kg/dag) i øget postnatal afkomsdødelighed. En dosis uden effekt for præ- og postnatal udviklingstoksicitet blev ikke identificeret. Den laveste testede dosis (3 mg/kg/dag) svarer til MRHD på henholdsvis mg/m²-basis.
Amning
Risikooversigt
Der er ingen data om tilstedeværelsen af tizanidin i modermælk, virkningerne på det ammede spædbarn eller virkningerne på produktionen af modermælk. Dyreforsøg har rapporteret tilstedeværelsen af tizanidin i mælken fra diegivende dyr.
De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for Zanaflex 4mg og eventuelle negative virkninger på det ammede spædbarn fra Zanaflex eller fra den underliggende moderens tilstand.
Hunner og mænd med reproduktionspotentiale
Der er ingen tilstrækkelige og velkontrollerede undersøgelser hos mennesker af virkningen af Zanaflex 4mg på kvindelig eller mandlig reproduktionspotentiale. Oral administration af tizanidin til han- og hunrotter resulterede i uønskede virkninger på fertiliteten [se Ikke-klinisk toksikologi ].
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Zanaflex 2mg er kendt for at blive udskilt væsentligt af nyrerne, og risikoen for bivirkninger af dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, bør der udvises forsigtighed ved dosisvalg, og det kan være nyttigt at overvåge nyrefunktionen.
Kliniske undersøgelser af Zanaflex 2mg omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Krydsundersøgelsessammenligning af farmakokinetiske data efter enkeltdosisadministration på 6 mg Zanaflex 2mg viste, at yngre forsøgspersoner clearede lægemidlet fire gange hurtigere end ældre forsøgspersoner. Hos ældre patienter med nyreinsufficiens (kreatininclearance
Nedsat nyrefunktion
Zanaflex er kendt for at udskilles væsentligt af nyrerne, og risikoen for bivirkninger af dette lægemiddel kan være større hos patienter med nedsat nyrefunktion. Hos patienter med nyreinsufficiens (kreatininclearance DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Indflydelsen af nedsat leverfunktion på tizanidins farmakokinetik er ikke blevet evalueret. Fordi tizanidin i vid udstrækning metaboliseres i leveren, forventes nedsat leverfunktion at have betydelige virkninger på tizanidins farmakokinetik [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER , og KLINISK FARMAKOLOGI ].
OVERDOSIS
En gennemgang af sikkerhedsovervågningsdatabasen afslørede tilfælde af tilsigtet og utilsigtet overdosis af Zanaflex. Nogle af tilfældene resulterede i dødsfald, og mange af de forsætlige overdoser var med flere lægemidler, herunder CNS-depressiva. De kliniske manifestationer af tizanidin overdosis var i overensstemmelse med dets kendte farmakologi. I de fleste tilfælde blev der observeret et fald i sensorium, herunder sløvhed, somnolens, forvirring og koma. Nedsat hjertefunktion observeres også, herunder oftest bradykardi og hypotension. Respirationsdepression er et andet almindeligt træk ved overdosis af tizanidin.
Hvis der opstår en overdosis, bør der tages grundlæggende trin for at sikre tilstrækkeligheden af en luftvej og overvågning af kardiovaskulære og respiratoriske systemer. Tizanidin er et lipidopløseligt lægemiddel, som kun er lidt opløseligt i vand og methanol. Derfor er dialyse sandsynligvis ikke en effektiv metode til at fjerne lægemiddel fra kroppen. Generelt forsvinder symptomerne inden for en til tre dage efter seponering af tizanidin og indgivelse af passende behandling. På grund af den lignende virkningsmekanisme ligner symptomer og behandling af overdosering af tizanidin det efter overdosis af clonidin. For den seneste information om håndtering af overdosering, kontakt et giftkontrolcenter.
KONTRAINDIKATIONER
Zanaflex er kontraindiceret til patienter, der tager potente hæmmere af CYP1A2, såsom fluvoxamin eller ciprofloxacin [se DRUGSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Tizanidin er en central alfa-2-adrenerg receptoragonist og reducerer formentlig spasticitet ved at øge præsynaptisk hæmning af motoriske neuroner. Virkningerne af tizanidin er størst på polysynaptiske veje. Den samlede effekt af disse handlinger menes at reducere facilitering af spinale motoriske neuroner.
Farmakokinetik
Absorption og distribution
Efter oral administration absorberes tizanidin stort set fuldstændigt. Den absolutte orale biotilgængelighed af tizanidin er ca. 40 % (CV = 24 %) på grund af omfattende first-pass hepatisk metabolisme. Tizanidin distribueres omfattende i hele kroppen med et gennemsnitligt steady state-fordelingsvolumen på 2,4 l/kg (CV = 21%) efter intravenøs administration til raske voksne frivillige. Tizanidin er ca. 30 % bundet til plasmaproteiner.
Forskelle mellem Zanaflex 4mg Capsules® og Zanaflex® tabletter
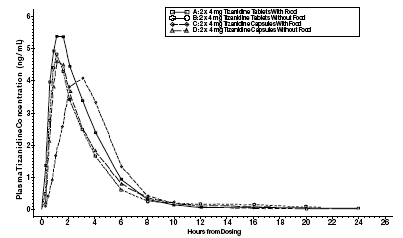
Zanaflex 2mg Capsules® og Zanaflex® tabletter er bioækvivalente med hinanden under fastende forhold, men ikke under fodringsforhold. En enkelt dosis på enten to 4 mg tabletter eller to 4 mg kapsler blev administreret under fodrede og fastende forhold i et åbent, fire-perioders, randomiseret overkrydsningsstudie med 96 frivillige forsøgspersoner, hvoraf 81 var kvalificerede til den statistiske analyse. Efter oral administration af enten tabletten eller kapslen (i fastende tilstand) forekom maksimale plasmakoncentrationer af tizanidin 1,0 time efter dosering med en halveringstid på ca. 2 timer. Når to 4 mg tabletter blev administreret sammen med mad, blev den gennemsnitlige maksimale plasmakoncentration øget med ca. 30 %, og mediantiden til maksimal plasmakoncentration blev øget med 25 minutter til 1 time og 25 minutter. I modsætning hertil, når to 4 mg kapsler blev administreret sammen med mad, blev den gennemsnitlige maksimale plasmakoncentration reduceret med 20 %, mediantiden til maksimal plasmakoncentration blev øget med 2 til 3 timer. Som følge heraf er den gennemsnitlige Cmax for kapslen, når den administreres sammen med mad, ca. 66 % af Cmax for tabletten, når den administreres sammen med mad. Mad øgede også omfanget af absorption for både tabletterne og kapslerne. Stigningen med tabletten (~30%) var signifikant større end med kapslen (~10%). Følgelig, når hver blev indgivet sammen med mad, var mængden absorberet fra kapslen ca. 80 % af mængden absorberet fra tabletten. Administration af kapselindholdet drysset på æblemos var ikke bioækvivalent med administration af en intakt kapsel under fastende forhold. Administration af kapselindholdet på æblemos resulterede i en stigning på 15 %-20 % i Cmax og AUC for tizanidin og et 15 minutters fald i median forsinkelsestid og tid til maksimal koncentration sammenlignet med administration af en intakt kapsel under fastende.
Figur 1: Gennemsnitlig Tizanidin-koncentration vs. tidsprofiler for Zanaflex-tabletter og -kapsler (2 × 4 mg) under faste- og fodringsbetingelser
Metabolisme og udskillelse
Tizanidin har lineær farmakokinetik i forhold til de undersøgte doser i klinisk udvikling (1-20 mg). Tizanidin har en halveringstid på ca. 2,5 timer (CV=33%). Ca. 95 % af en administreret dosis metaboliseres. Det primære cytokrom P450-isoenzym, der er involveret i tizanidinmetabolisme, er CYP1A2. Tizanidin-metabolitter vides ikke at være aktive; deres halveringstid varierer fra 20 til 40 timer.
Efter enkelt og multipel oral dosering af 14C-tizanidin blev et gennemsnit på 60 % og 20 % af den samlede radioaktivitet genfundet i henholdsvis urin og fæces.
Specifikke populationer
Alderseffekter
Der blev ikke udført nogen specifik farmakokinetisk undersøgelse for at undersøge alderspåvirkninger. Krydsundersøgelsessammenligning af farmakokinetiske data efter enkeltdosisadministration på 6 mg Zanaflex 2mg viste, at yngre forsøgspersoner clearede lægemidlet fire gange hurtigere end ældre forsøgspersoner. Zanaflex 4mg er ikke blevet evalueret hos børn [se Brug i specifikke populationer ].
Nedsat leverfunktion
Indflydelsen af nedsat leverfunktion på tizanidins farmakokinetik er ikke blevet evalueret. Da tizanidin i vid udstrækning metaboliseres i leveren, forventes nedsat leverfunktion at have betydelige effekter på tizanidins farmakokinetik. Zanaflex anbefales ikke til denne patientpopulation [se Brug i specifikke populationer ].
Nedsat nyrefunktion
Tizanidinclearance er reduceret med mere end 50 % hos ældre patienter med nyreinsufficiens (kreatininclearance ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Kønseffekter
Der blev ikke udført nogen specifik farmakokinetisk undersøgelse for at undersøge kønseffekter. Retrospektiv analyse af farmakokinetiske data efter enkelt- og multiple doser af 4 mg Zanaflex 2mg viste imidlertid, at køn ikke havde nogen effekt på tizanidins farmakokinetik.
Race effekter
Farmakokinetiske forskelle på grund af race er ikke blevet undersøgt.
Lægemiddelinteraktioner
CYP1A2-hæmmere
Interaktionen mellem Zanaflex og enten fluvoxamin eller ciprofloxacin skyldes højst sandsynligt hæmning af CYP1A2 med fluvoxamin eller ciprofloxacin. Effekten af fluvoxamin på farmakokinetikken af en enkelt 4 mg dosis af Zanaflex blev undersøgt hos 10 raske forsøgspersoner. Cmax, AUC og halveringstid for tizanidin steg med henholdsvis 12 gange, 33 gange og 3 gange. Virkningen af ciprofloxacin på farmakokinetikken af en enkelt 4 mg dosis af Zanaflex 4 mg blev undersøgt hos 10 raske forsøgspersoner. Cmax og AUC for tizanidin steg med henholdsvis 7 gange og 10 gange [se KONTRAINDIKATIONER ].
Selvom der ikke har været nogen kliniske undersøgelser, der har evalueret virkningen af andre CYP1A2-hæmmere på tizanidin, andre CYP1A2-hæmmere, såsom zileuton, andre fluoroquinoloner, antiarytmika (amiodaron, mexiletin, propafenon og verapamil), cimetidin, cyclo- og antiarytmika, cimetidin, cyclo- og antiarytmika, favirin, kan også føre til væsentlige stigninger i tizanidin blodkoncentrationer [se ADVARSLER OG FORHOLDSREGLER ].
In vitro undersøgelser af cytokrom P450 isoenzymer under anvendelse af humane levermikrosomer indikerer, at hverken tizanidin eller hovedmetabolitterne sandsynligvis påvirker metabolismen af andre lægemidler, der metaboliseres af cytokrom P450 isoenzymer.
Orale præventionsmidler
Der blev ikke udført nogen specifik farmakokinetisk undersøgelse for at undersøge interaktion mellem orale præventionsmidler og Zanaflex. Retrospektiv analyse af populationsfarmakokinetiske data efter administration af enkelt- og multiple doser af 4 mg Zanaflex viste imidlertid, at kvinder, der samtidig tog orale præventionsmidler, havde 50 % lavere clearance af tizanidin sammenlignet med kvinder, der ikke fik orale præventionsmidler [se ADVARSLER OG FORHOLDSREGLER ].
Acetaminophen
Tizanidin forsinkede Tmax for acetaminophen med 16 minutter. Acetaminophen påvirkede ikke tizanidins farmakokinetik.
Alkohol
Alkohol øgede tizanidins AUC med ca. 20 %, mens det også øgede dets Cmax med ca. 15 %. Dette var forbundet med en stigning i bivirkninger af tizanidin. De CNS-depressive virkninger af tizanidin og alkohol er additive.
Kliniske Studier
Tizanidins evne til at reducere øget muskeltonus forbundet med spasticitet blev påvist i to tilstrækkelige og velkontrollerede undersøgelser hos patienter med multipel sklerose eller rygmarvsskade (studie 1 og 2).
Enkeltdosisundersøgelse hos patienter med multipel sklerose med spasticitet
I undersøgelse 1 blev patienter med multipel sklerose randomiseret til at modtage enkelt orale doser af lægemiddel eller placebo. Patienter og bedømmere var blinde for behandlingstildeling, og der blev gjort bestræbelser på at reducere sandsynligheden for, at bedømmere indirekte ville blive opmærksomme på behandlingstildeling (f.eks. ydede de ikke direkte pleje til patienter og fik forbud mod at stille spørgsmål om bivirkninger). I alt fik 140 patienter placebo, 8 mg eller 16 mg Zanaflex.
Respons blev vurderet ved fysisk undersøgelse; muskeltonus blev vurderet på en 5-punktsskala (Ashworth-score), med en score på 0 brugt til at beskrive normal muskeltonus. En score på 1 indikerede en let spastisk fangst, mens en score på 2 indikerede mere markant muskelmodstand. En score på 3 blev brugt til at beskrive en betydelig stigning i tonus, hvilket gjorde passiv bevægelse vanskelig. En muskel immobiliseret af spasticitet fik en score på 4. Spasmetal blev også opsamlet.
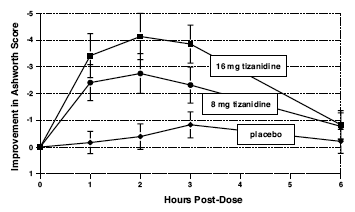
Vurderinger blev foretaget 1, 2, 3 og 6 timer efter behandlingen. En statistisk signifikant reduktion af Ashworth-scoren for Zanaflex 2 mg sammenlignet med placebo blev påvist 1, 2 og 3 timer efter behandling. Figur 2 nedenfor viser en sammenligning af den gennemsnitlige ændring i muskeltonus fra baseline målt ved Ashworth-skalaen. Den største reduktion i muskeltonus var 1 til 2 timer efter behandlingen. 6 timer efter behandlingen var muskeltonus i grupperne på 8 og 16 mg Zanaflex 2 mg ikke til at skelne fra muskeltonus hos placebobehandlede patienter. Inden for en given patient var forbedring i muskeltonus korreleret med plasmakoncentration. Plasmakoncentrationer var variable fra patient til patient ved en given dosis. Selvom 16 mg gav en større effekt, var bivirkninger inklusive hypotension mere almindelige og mere alvorlige end i 8 mg-gruppen. Der var ingen forskelle i antallet af spasmer i hver gruppe.
Figur 2: Enkeltdosisundersøgelse - Gennemsnitlig ændring i muskeltonus fra baseline som målt ved Ashworth-skalaen ± 95 % konfidensinterval (en negativ Ashworth-score betyder en forbedring i muskeltonus fra baseline)
Syv-ugers undersøgelse i patienter med rygmarvsskade med spasticitet
I et 7-ugers studie (studie 2) blev 118 patienter med spasticitet sekundært til rygmarvsskade randomiseret til enten placebo eller Zanaflex. Trin svarende til dem, der blev taget i den første undersøgelse, blev anvendt for at sikre integriteten af blinding.
Patienterne blev titreret over 3 uger op til en maksimal tolereret dosis eller 36 mg dagligt givet i tre ulige doser (f.eks. 10 mg givet om morgenen og eftermiddagen og 16 mg givet om natten). Patienterne blev derefter holdt på deres maksimalt tolererede dosis i yderligere 4 uger (dvs. vedligeholdelsesfasen). Igennem vedligeholdelsesfasen blev muskeltonus vurderet på Ashworth-skalaen inden for en periode på 2,5 timer efter enten morgen- eller eftermiddagsdosis. Antallet af spasmer i dagtimerne blev registreret dagligt af patienterne.
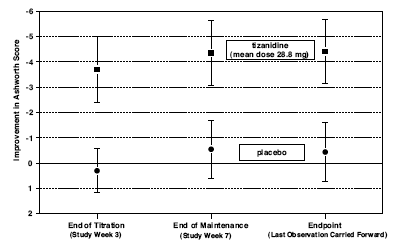
Ved endepunktet (det protokolspecificerede tidspunkt for udfaldsvurdering) var der en statistisk signifikant reduktion i muskeltonus og hyppigheden af spasmer i den Zanaflex-behandlede gruppe sammenlignet med placebo. Reduktionen i muskeltonus var ikke forbundet med en reduktion i muskelstyrke (et ønskeligt resultat), men førte heller ikke til nogen konsekvent fordel for Zanaflex-behandlede patienter med mål for daglige aktiviteter. Figur 3 nedenfor viser en sammenligning af den gennemsnitlige ændring i muskeltonus fra baseline målt ved Ashworth-skalaen.
Figur 3: Syv ugers undersøgelse - gennemsnitlig ændring i muskeltonus 0,5 - 2,5 timer efter dosering målt ved Ashworth-skalaen ± 95 % konfidensinterval (en negativ Ashworth-score betyder en forbedring i muskeltonus fra baseline)
PATIENTOPLYSNINGER
Alvorlige lægemiddelinteraktioner
Rådgiv patienter, at de ikke bør tage Zanaflex, hvis de tager fluvoxamin eller ciprofloxacin på grund af den øgede risiko for alvorlige bivirkninger, herunder alvorlig blodtrykssænkning og sedation. Instruer patienterne i at informere deres læger eller farmaceuter, når de begynder eller stopper med at tage medicin på grund af de risici, der er forbundet med interaktion mellem Zanaflex og andre lægemidler.
Zanaflex Dosering
Fortæl patienterne, at de skal tage Zanaflex 2 mg nøjagtigt som foreskrevet (konsekvent enten med eller uden mad) og ikke skifte mellem tabletter og kapsler. Informer patienterne om, at de ikke bør tage mere Zanaflex 2 mg end foreskrevet på grund af risikoen for bivirkninger ved enkeltdoser på over 8 mg eller samlede daglige doser på mere end 36 mg. Fortæl patienterne, at de ikke pludselig bør seponere Zanaflex 4mg, da rebound-hypertension og takykardi kan forekomme.
Virkninger af Zanaflex
Advar patienterne om, at de kan opleve hypotension, og at de skal være forsigtige, når de skifter fra liggende eller siddende til stående stilling. Fortæl patienterne, at Zanaflex kan få dem til at blive beroligende eller døsige, og de skal være forsigtige, når de udfører aktiviteter, der kræver årvågenhed, såsom at køre bil eller betjene maskiner. Fortæl patienterne, at sedationen kan være additiv, når Zanaflex 4 mg tages sammen med lægemidler (baclofen, benzodiazepiner) eller stoffer (f.eks. alkohol), der virker som CNS-depressiva. Mind patienterne om, at hvis de er afhængige af deres spasticitet for at opretholde kropsholdning og balance i bevægelse, eller når spasticitet bruges til at opnå øget funktion, skal Zanaflex nedsætte spasticiteten, og der skal udvises forsigtighed.
