Robaxin 500mg Methocarbamol Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Robaxin 500mg, og hvordan bruges det?
Robaxin 500mg er en receptpligtig medicin, der bruges til at behandle symptomerne på muskelspasmer forårsaget af smerte eller skade og stivkrampe. Robaxin 500mg kan bruges alene eller sammen med anden medicin.
- Robaxin 500mg tilhører en klasse af lægemidler kaldet skeletmuskelafslappende midler.
- Det vides ikke, om Robaxin 500mg er sikkert og effektivt til børn under 16 år.
Hvad er de mulige bivirkninger af Robaxin 500mg?
Robaxin 500mg kan forårsage alvorlige bivirkninger, herunder:
- svimmelhed,
- langsomme hjerteslag,
- feber,
- kuldegysninger,
- influenza symptomer,
- anfald (kramper), og
- gulfarvning af din hud eller øjne (gulsot)
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Robaxin omfatter:
- svimmelhed,
- døsighed,
- kvalme,
- opkastning,
- dårlig mave,
- rødmen (varme, rødme eller prikkende følelse),
- forvirring,
- problemer med hukommelsen,
- sløret syn,
- Dobbelt syn,
- søvnproblemer (søvnløshed), og
- manglende koordinering
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Robaxin. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
robaxin®/robaxin®-750 (methocarbamol tabletter, USP), et carbamatderivat af guaifenesin, er et centralnervesystem (CNS) depressivt middel med beroligende og muskel-skeletafslappende egenskaber.
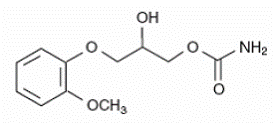
Det kemiske navn på methocarbamol er 3-(2-methoxyphenoxy)-1,2propandiol-1-carbamat og har den empiriske formel C11H15NO5. Dens molekylvægt er 241,24. Strukturformlen er vist nedenfor.
Methocarbamol er et hvidt pulver, tungtopløseligt i vand og chloroform, opløseligt i alkohol (kun ved opvarmning) og propylenglycol og uopløseligt i benzen og n-hexan.
robaxin® fås som en lys orange, rund filmovertrukket tablet indeholdende 500 mg methocarbamol, USP til oral administration. De tilstedeværende inaktive ingredienser er majsstivelse, FD&C Yellow 6, hydroxypropylcellulose, hypromellose, magnesiumstearat, polysorbat 20, povidon, propylenglycol, saccharinnatrium, natriumlaurylsulfat, natriumstivelsesglycolat, stearinsyre, titaniumdioxid.
robaxin®-750 er tilgængelig som en orange kapselformet, filmovertrukket tablet indeholdende 750 mg methocarbamol, USP til oral administration. Ud over de inaktive ingredienser, der findes i robaxin®, indeholder robaxin® 750 også D&C Yellow 10.
INDIKATIONER
Den injicerbare form af methocarbamol er indiceret som et supplement til hvile, fysioterapi og andre foranstaltninger til lindring af ubehag i forbindelse med akutte, smertefulde muskuloskeletale tilstande. Virkningsmåden af dette lægemiddel er ikke blevet klart identificeret, men kan være relateret til dets beroligende egenskaber. Methocarbamol afspænder ikke direkte spændte skeletmuskler hos mennesker.
DOSERING OG ADMINISTRATION
Kun til intravenøs og intramuskulær brug. Den samlede voksendosis bør ikke overstige 30 ml (3 hætteglas) om dagen i mere end 3 på hinanden følgende dage undtagen ved behandling af stivkrampe. Hvis tilstanden fortsætter, kan et lignende forløb gentages efter et lægemiddelfrit interval på 48 timer. Dosering og injektionshyppighed bør være baseret på sværhedsgraden af den tilstand, der behandles, og terapeutisk respons noteret.
Til lindring af symptomer af moderat grad kan en dosis på 1 gram (et 10 ml hætteglas) være tilstrækkeligt. Normalt behøver denne injektion ikke at blive gentaget, da administrationen af den orale form sædvanligvis vil opretholde den lindring, som injektionen initierede. I de alvorligste tilfælde eller under postoperative tilstande, hvor oral administration ikke er mulig, kan yderligere doser på 1 gram gentages hver 8. time op til maksimalt 3 g/dag i højst 3 på hinanden følgende dage.
Vejledning til intravenøs brug
ROBAXIN Injectable kan administreres ufortyndet direkte i venen med en maksimal hastighed på 3 ml pr. minut. Det kan også tilsættes til et intravenøst drop af natriumchloridinjektion (steril isotonisk natriumkloridopløsning til parenteral brug) eller fem procent dextroseinjektion (steril 5 procent dextroseopløsning); et hætteglas givet som en enkelt dosis bør ikke fortyndes til mere end 250 ml til IV infusion. EFTER BLANDING MED IV INFUSIONSVÆSKER MÅ IKKE OPBEVARES. Der skal udvises forsigtighed for at undgå vaskulær ekstravasation af denne hypertone opløsning, hvilket kan resultere i tromboflebitis. Det foretrækkes, at patienten er i liggende stilling under og i mindst 10 til 15 minutter efter injektionen.
Vejledning til intramuskulær brug
Når den intramuskulære vej er indiceret, bør der ikke injiceres mere end fem ml (et halvt hætteglas) i hver gluteal region. Injektionerne kan om nødvendigt gentages med otte timers mellemrum. Når der opnås tilfredsstillende lindring af symptomer, kan den normalt opretholdes med tabletter.
Anbefales ikke til subkutan administration.
Særlige brugsanvisninger ved stivkrampe
Der er klinisk evidens, der tyder på, at methocarbamol kan have en gavnlig effekt i kontrollen af de neuromuskulære manifestationer af stivkrampe. Det erstatter dog ikke den sædvanlige procedure med debridement, stivkrampe-antitoksin, penicillin, trakeotomi, opmærksomhed på væskebalance og understøttende pleje. ROBAXIN Injectable bør tilføjes til kuren så hurtigt som muligt.
Til voksne
Injicer et eller to hætteglas direkte i slangen på den tidligere indsatte kanyle. Yderligere 10 mL eller 20 mL kan tilsættes til infusionsflasken, så der gives i alt op til 30 mL (tre hætteglas) som startdosis (se FORHOLDSREGLER ). Denne procedure skal gentages hver sjette time, indtil forholdene tillader indsættelse af en nasogastrisk sonde. Knust methocarbamol-tabletter suspenderet i vand eller saltvand kan derefter gives gennem dette rør. Samlede daglige orale doser på op til 24 gram kan være påkrævet afhængigt af patientens respons.
Til pædiatriske patienter
En minimums startdosis på 15 mg/kg eller 500 mg/m² anbefales. Denne dosis kan om nødvendigt gentages hver sjette time. Den samlede dosis bør ikke overstige 1,8 g/m² i 3 på hinanden følgende dage. Vedligeholdelsesdosis kan gives ved injektion i slange eller ved IV-infusion med en passende mængde væske. Se instruktionerne for IV-brug.
HVORDAN LEVERET
ROBAXIN 500 mg injicerbar (100 mg/ml) leveres i - 10 mL enkeltdosis hætteglas i pakninger med 25 ( NDC 0641-6103-25).
Opbevares ved 20°- 25°C (68°- 77°F), udløbsioner tilladt til 15°-30°C (59°- 86°F).
Ikke lavet af naturgummilatex.
Kontakt West-Ward Pharmaceuticals Corp. på 1- 877-845-0689 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch for at rapportere MÆNKTE BIVIRKNINGER.
For produktforespørgsler ring 1-877-845-0689.
Fremstillet af: WEST-WARD A HIKMA COMPANY, Eatontown, NJ 07724 USA. Revideret: oktober 2017
BIVIRKNINGER
Følgende bivirkninger er blevet rapporteret sammenfaldende med administration af methocarbamol. Nogle hændelser kan have været på grund af en for høj hastighed af intravenøs injektion.
Kroppen som helhed: Anafylaktisk reaktion, angioneurotisk ødem, feber, hovedpine
Kardiovaskulære system: Bradykardi, rødmen, hypotension, synkope, tromboflebitis
de fleste tilfælde af synkope var der spontan bedring. I andre blev epinephrin, injicerbare steroider og/eller injicerbare antihistaminer anvendt for at fremskynde bedring.
Fordøjelsessystemet: Dyspepsi, gulsot (herunder kolestatisk gulsot), kvalme og opkastning
Hemisk og lymfesystem: Leukopeni
Immunsystem: Overfølsomhedsreaktioner

Nervesystem: Amnesi, forvirring, diplopi, svimmelhed eller svimmelhed, døsighed, søvnløshed, let muskulær ukoordination, nystagmus, sedation, krampeanfald (inklusive grand mal), vertigo
Begyndelse af krampeanfald under intravenøs administration af methocarbamol er blevet rapporteret hos patienter med anfaldssygdomme. Det psykiske traume ved proceduren kan have været en medvirkende faktor. Selvom flere observatører har rapporteret succes med at afslutte epileptiforme anfald med ROBAXIN Injectable, anbefales det ikke at administrere det til patienter med epilepsi (se FORHOLDSREGLER , Generel ).
Hud og særlige sanser: Sløret syn, konjunktivitis, tilstoppet næse, metallisk smag, kløe, udslæt, nældefeber
Andet: Smerter og sloughing på injektionsstedet
DRUGSINTERAKTIONER
Se ADVARSLER OG FORHOLDSREGLER for interaktion med CNS-lægemidler og alkohol.
Methocarbamol kan hæmme virkningen af pyridostigminbromid. Derfor bør methocarbamol anvendes med forsigtighed til patienter med myasthenia gravis, der får anticholinesterasemidler.
Interaktioner med lægemiddel/laboratorietest
Methocarbamol kan forårsage en farveinterferens i visse screeningstest for 5-hydroxyindoleddikesyre (5-HIAA) ved brug af nitrosonaphthol-reagens og i screeningstest for urin-vanillylmandelsyre (VMA) ved brug af Gitlow-metoden.
ADVARSLER
Da methocarbamol kan have en generel CNS-depressiv effekt, bør patienter, der får ROBAXIN Injectable, advares om kombinerede virkninger med alkohol og andre CNS-depressiva.
Sikker brug af ROBAXIN Injectable er ikke blevet fastlagt med hensyn til mulige bivirkninger på fosterudviklingen. Der har været meget sjældne rapporter om føtale og medfødte abnormiteter efter in utero eksponering for methocarbamol. Derfor bør ROBAXIN Injectable ikke anvendes til kvinder, der er eller kan blive gravide og især under tidlig graviditet, medmindre lægens vurdering opvejer de potentielle fordele (se FORHOLDSREGLER , Graviditet ).
Brug i aktiviteter, der kræver mental årvågenhed
Methocarbamol kan svække mentale og/eller fysiske evner, der kræves til udførelse af farlige opgaver, såsom at betjene maskiner eller køre et motorkøretøj. Patienter bør advares om at betjene maskiner, inklusive biler, indtil de er rimeligt sikre på, at methocarbamolbehandling ikke påvirker deres evne til at deltage i sådanne aktiviteter negativt.
FORHOLDSREGLER
Generel
Som med andre midler indgivet enten intravenøst eller intramuskulært, bør omhyggelig overvågning af dosis og injektionshastighed observeres. Injektionshastigheden bør ikke overstige 3 mL pr. minut - dvs. et 10 mL hætteglas på ca. tre minutter. Da ROBAXIN 500mg injicerbar er hypertonisk, skal vaskulær ekstravasation undgås. En liggende stilling vil reducere sandsynligheden for bivirkninger.
Blod, der aspireres ind i sprøjten, blandes ikke med den hypertoniske opløsning. Dette fænomen opstår med mange andre intravenøse præparater. Blodet kan injiceres med methocarbamol, eller injektionen kan stoppes, når stemplet når blodet, alt efter hvad lægen foretrækker.
Den samlede dosis bør ikke overstige 30 ml (tre hætteglas) om dagen i mere end tre på hinanden følgende dage undtagen ved behandling af stivkrampe.
Der skal udvises forsigtighed ved brug af den injicerbare form hos patienter med mistanke om eller kendte anfaldslidelser.
Karcinogenese, mutagenese, svækkelse af fertilitet
Langtidsundersøgelser til evaluering af methocarbamols karcinogene potentiale er ikke blevet udført. Der er ikke udført undersøgelser for at vurdere effekten af methocarbamol på mutagenese eller dets potentiale til at forringe fertiliteten.
Graviditet
Teratogene virkninger
Graviditetskategori C
Dyreproduktionsundersøgelser er ikke blevet udført med methocarbamol. Det vides heller ikke, om methocarbamol kan forårsage fosterskader, når det administreres til en gravid kvinde eller kan påvirke reproduktionsevnen. ROBAXIN 500mg injicerbar bør kun gives til en gravid kvinde, hvis det er klart nødvendigt.
Sikker brug af ROBAXIN Injectable er ikke blevet fastlagt med hensyn til mulige bivirkninger på fosterudviklingen. Der har været rapporter om føtale og medfødte abnormiteter efter in utero eksponering for methocarbamol. Derfor bør ROBAXIN 500mg Injectable ikke anvendes til kvinder, der er eller kan blive gravide, og især ikke under tidlig graviditet, medmindre lægens vurdering opvejer de mulige risici (se ADVARSLER ).
Ammende mødre
Methocarbamol og/eller dets metabolitter udskilles i mælken hos hunde; det vides dog ikke, om methocarbamol eller dets metabolitter udskilles i human mælk. Da mange lægemidler udskilles i modermælk, bør der udvises forsigtighed, når ROBAXIN 500mg injicerbar gives til en ammende kvinde.
Pædiatrisk brug
Sikkerhed og effektivitet af ROBAXIN Injectable til pædiatriske patienter er ikke blevet fastslået undtagen ved stivkrampe. Se DOSERING OG ADMINISTRATION , Særlige retninger til Brug ved stivkrampe , Til pædiatriske patienter .
OVERDOSIS
Der er begrænset information tilgængelig om methocarbamols akutte toksicitet. Overdosering af methocarbamol er ofte i forbindelse med alkohol eller andre CNS-depressiva og inkluderer følgende symptomer: kvalme, døsighed, sløret syn, hypotension, kramper og koma. Efter markedsføring er der rapporteret dødsfald med en overdosis af methocarbamol alene eller i nærværelse af andre CNS-depressiva, alkohol eller psykotrope stoffer.
Behandling
Håndtering af overdosering omfatter symptomatisk og understøttende behandling. Støttende foranstaltninger omfatter vedligeholdelse af en passende luftvej, overvågning af urinproduktion og vitale tegn og administration af intravenøse væsker, hvis det er nødvendigt. Nytten af hæmodialyse til at håndtere overdosering er ukendt.
KONTRAINDIKATIONER
ROBAXIN 500mg injicerbar bør ikke administreres til patienter med kendt eller mistænkt nyrepatologi. Denne forsigtighed er nødvendig på grund af tilstedeværelsen af polyethylenglycol 300 i bæreren.
En meget større mængde polyethylenglycol 300, end der er til stede i anbefalede doser af ROBAXIN Injectable, er kendt for at have øget allerede eksisterende acidose og urinstofretention hos patienter med nedsat nyrefunktion. Selvom mængden til stede i dette præparat er et godt stykke inden for sikkerhedsgrænserne, tilsiger forsigtighed denne kontraindikation.
ROBAXIN Injectable er kontraindiceret til patienter, der er overfølsomme over for methocarbamol eller nogen af injektionskomponenterne.
KLINISK FARMAKOLOGI
Virkningsmekanismen for methocarbamol hos mennesker er ikke fastlagt, men kan skyldes generel CNS-depression. Det har ingen direkte virkning på sammentrækningsmekanismen af tværstribede muskler, den motoriske endeplade eller nervefiberen.
Farmakokinetik
Hos raske frivillige varierer plasmaclearancen af methocarbamol mellem 0,20 og 0,80 l/time/kg, den gennemsnitlige plasmaelimineringshalveringstid varierer mellem 1 og 2 timer, og plasmaproteinbindingen varierer mellem 46 % og 50 %.
Methocarbamol metaboliseres via dealkylering og hydroxylering. Konjugering af methocarbamol er også sandsynlig. I det væsentlige alle methocarbamol metabolitter elimineres i urinen. Små mængder uændret methocarbamol udskilles også i urinen.
Særlige Populationer
Ældre
Den gennemsnitlige (± SD) eliminationshalveringstid for methocarbamol hos ældre raske frivillige (gennemsnitlig (± SD) alder, 69 (± 4) år) var lidt forlænget sammenlignet med en yngre (gennemsnitlig (± SD) alder, 53,3 (± 8,8) ) år), rask befolkning (henholdsvis 1,5 (± 0,4) timer versus 1,1 (± 0,27) timer). Fraktionen af bundet methocarbamol var en smule nedsat hos ældre versus yngre frivillige (henholdsvis 41 til 43 % mod 46 til 50 %).
Nedsat nyrefunktion
Clearance af methocarbamol hos 8 patienter med nedsat nyrefunktion i vedligeholdelseshæmodialyse blev reduceret med ca. 40 % sammenlignet med 17 normale forsøgspersoner, selvom den gennemsnitlige (± SD) eliminationshalveringstid i disse to grupper var ens (1,2 (± 0,6) versus 1,1 ( ± 0,3) timer).
Leversvigt
Hos 8 patienter med cirrhose sekundært til alkoholmisbrug blev den gennemsnitlige totale clearance af methocarbamol reduceret med ca. 70 % sammenlignet med den, der blev opnået hos 8 normale forsøgspersoner, der matchede alder og vægt. Den gennemsnitlige (± SD) eliminationshalveringstid hos cirrhotiske patienter og de normale forsøgspersoner var henholdsvis 3,38 (± 1,62) timer og 1,11 (± 0,27) timer. Procentdelen af methocarbamol bundet til plasmaproteiner blev reduceret til ca. 40 til 45 % sammenlignet med 46 til 50 % hos de normale forsøgspersoner.
PATIENTOPLYSNINGER
Patienter skal advares om, at methocarbamol kan forårsage døsighed eller svimmelhed, hvilket kan svække deres evne til at betjene motorkøretøjer eller maskiner.
Da methocarbamol kan have en generel CNS-depressiv effekt, bør patienter advares om kombinerede virkninger med alkohol og andre CNS-depressiva.
