Elocon 5g Mometasone Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Elocon 5g, og hvordan bruges det?
Elocon (mometasonfuroat) creme, 0,1 % er en topisk creme, lotion eller salve til kortikosteroider indiceret til lindring af de inflammatoriske og kløende manifestationer af kortikosteroid-responsive dermatoser hos patienter på 2 år eller ældre.
Hvad er bivirkninger af Elocon 5g?
Almindelige bivirkninger af Elocon omfatter:
- udslæt,
- kløe,
- brændende,
- rødme,
- tørhed,
- udtynding eller blødgøring af din hud,
- hududslæt eller irritation omkring munden,
- hævede hårsække,
- edderkopper,
- følelsesløshed eller prikken,
- ændringer i farven på behandlet hud,
- blærer,
- bumser,
- skorpedannelse af behandlet hud, eller
- strækmærker.
BESKRIVELSE
ELOCON (mometasonfuroat) Creme, 0,1% indeholder mometasonfuroat til topisk brug. Mometasonfuroat er et syntetisk kortikosteroid med antiinflammatorisk aktivitet.
Kemisk er mometasonfuroat 9α,21-dichlor-11β,17-dihydroxy-16α-methylpregna-1,4-dien3,20-dion 17-(2-furoat), med den empiriske formel C27 H30CI2O6, en molekylvægt på 521,4 og følgende strukturformel:
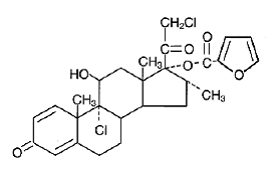
Mometasonfuroat er et hvidt til råhvidt pulver, der er praktisk talt uopløseligt i vand, let opløseligt i octanol og moderat opløseligt i ethylalkohol.
Hvert gram ELOCON 5g creme, 0,1 % indeholder 1 mg mometasonfuroat i en hvid til råhvid cremebase af aluminiumstivelse octenylsuccinat (gammabestrålet), hexylenglycol, hydrogeneret sojabønnelecithin, fosforsyre, renset vand, blødt titandioxid, hvidt titaniumdioxid. paraffin og hvid voks.
INDIKATIONER
ELOCON® Cream er et kortikosteroid indiceret til lindring af de inflammatoriske og kløende manifestationer af corticosteroid-responsive dermatoser hos patienter på 2 år eller ældre.
DOSERING OG ADMINISTRATION
Påfør en tynd film ELOCON Cream på de berørte hudområder én gang dagligt. ELOCON Cream kan anvendes til pædiatriske patienter på 2 år eller ældre. Da sikkerhed og effekt af ELOCON Cream ikke er blevet fastslået hos pædiatriske patienter under 2 år; brug i denne aldersgruppe anbefales ikke [se ADVARSLER OG FORHOLDSREGLER og Brug i specifikke populationer ].
Behandlingen bør seponeres, når kontrol er opnået. Hvis ingen bedring ses inden for 2 uger, kan det være nødvendigt at revurdere diagnosen. Sikkerhed og effekt af ELOCON Cream hos pædiatriske patienter i mere end 3 ugers brug er ikke blevet fastslået.
ELOCON Cream bør ikke bruges sammen med okklusiv forbindinger, medmindre det er instrueret af en læge. ELOCON 5g Creme bør ikke påføres i bleområdet, hvis barnet stadig har brug for bleer eller plastikbukser, da disse beklædningsgenstande kan udgøre okklusiv forbinding.
ELOCON Cream er kun til topisk brug. Det er ikke til oral, oftalmisk eller intravaginal brug.
Undgå brug i ansigt, lyske eller aksiller.
HVORDAN LEVERET
Doseringsformer og styrker
Fløde, 0,1%. Hvert gram ELOCON Cream indeholder 1 mg mometasonfuroat i en hvid til råhvid glat og homogen cremebase.
Opbevaring og håndtering
ELOCON creme er hvid til råhvid i farven og leveres i 15 gram (NDC 0085-3149-01) og 50 gram ( NDC 0085-3149-03) rør.
Opbevares ved 25°C (77°F); udflugter tilladt til 15-30°C (59-86°F) [se USP kontrolleret rumtemperatur ]. Undgå overdreven varme.
Fremstillet for: Merck Sharp & Dohme Corp., et datterselskab af Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Fremstillet af: Schering-Plough Labo NV Heist-op-den-Berg, Belgien. Revideret: april 2013
BIVIRKNINGER
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan frekvenser af bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
I kontrollerede kliniske forsøg med 319 forsøgspersoner var forekomsten af bivirkninger forbundet med brugen af ELOCON 5g creme 1,6 %. Rapporterede reaktioner omfattede svie, kløe og hudatrofi. Der er også modtaget rapporter om rosacea i forbindelse med brugen af ELOCON 5g Cream. I kontrollerede kliniske forsøg (n=74) med pædiatriske forsøgspersoner i alderen 2 til 12 år, var forekomsten af bivirkninger forbundet med brugen af ELOCON 5g creme ca. 7 %. Rapporterede reaktioner omfattede svie, kløe og furunkulose.
Følgende bivirkninger blev rapporteret at være muligvis eller sandsynligvis relateret til behandling med ELOCON 5g Cream under kliniske forsøg hos 4 % af 182 pædiatriske forsøgspersoner i alderen 6 måneder til 2 år: nedsatte glukokortikoidniveauer, 2; paræstesi, 2; folliculitis, 1; moniliasis, 1; bakteriel infektion, 1; huddepigmentering, 1. Følgende tegn på hudatrofi blev også observeret blandt 97 forsøgspersoner behandlet med ELOCON Cream i et klinisk forsøg: glans, 4; telangiektasi, 1; tab af elasticitet, 4; tab af normale hudmærker, 4; tyndhed, 1; og blå mærker, 1.
Følgende yderligere lokale bivirkninger er blevet rapporteret med topikale kortikosteroider, men kan forekomme hyppigere ved brug af okklusiv forbinding. Disse reaktioner er: irritation, tørhed, folliculitis, hypertrichosis, acneiforme udbrud, hypopigmentering, perioral dermatitis, allergisk kontaktdermatitis, sekundær infektion, striae og miliaria.
DRUGSINTERAKTIONER
Der er ikke udført lægemiddelinteraktionsstudier med ELOCON Cream.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Virkninger på det endokrine system
Systemisk absorption af topikale kortikosteroider kan forårsage reversibel hypothalamus-hypofyse-binyre (HPA) aksesuppression med potentiale for glukokortikosteroidinsufficiens. Dette kan forekomme under behandlingen eller efter seponering af behandlingen. Manifestationer af Cushings syndrom, hyperglykæmi og glucosuri kan også frembringes hos nogle patienter ved systemisk absorption af topikale kortikosteroider under behandling. Faktorer, der disponerer en patient, der anvender et topisk kortikosteroid for HPA-aksesuppression, omfatter brugen af højpotente steroider, store behandlingsoverflader, langvarig brug, brug af okklusiv forbinding, ændret hudbarriere, leversvigt og ung alder.
På grund af potentialet for systemisk absorption kan brug af topikale kortikosteroider kræve, at patienter periodisk evalueres for HPA-aksesuppression. Dette kan gøres ved at bruge stimulationstesten for adrenokortikotropt hormon (ACTH).
I en undersøgelse, der evaluerede virkningerne af mometasonfuroatcreme på HPA-aksen, blev 15 gram påført to gange dagligt i 7 dage til seks voksne forsøgspersoner med psoriasis eller atopisk dermatitis. Resultaterne viser, at lægemidlet forårsagede en let sænkning af binyrebarksteroidsekretionen.
Hvis HPA-akseundertrykkelse bemærkes, bør der forsøges gradvist at seponere lægemidlet, for at reducere applikationshyppigheden eller at erstatte et mindre potent kortikosteroid. Genopretning af HPA-aksefunktionen er generelt hurtig ved seponering af topikale kortikosteroider. Sjældent kan der forekomme tegn og symptomer på glukokortikosteroidinsufficiens, hvilket kræver supplerende systemiske kortikosteroider.
Pædiatriske patienter kan være mere modtagelige for systemisk toksicitet fra ækvivalente doser på grund af deres større forhold mellem hudoverflade og kropsmasse [se Brug i specifikke populationer ].
Allergisk kontaktdermatitis
Hvis der opstår irritation, skal ELOCON Cream seponeres og passende behandling iværksættes. Allergisk kontaktdermatitis med kortikosteroider diagnosticeres sædvanligvis ved at observere en manglende helbredelse i stedet for at bemærke en klinisk forværring som med de fleste topiske produkter, der ikke indeholder kortikosteroider. En sådan observation bør bekræftes med passende diagnostisk lappetest.
Samtidige hudinfektioner
Hvis samtidige hudinfektioner er til stede eller udvikles, bør et passende antifungalt eller antibakterielt middel anvendes. Hvis en gunstig reaktion ikke indtræffer med det samme, skal brugen af ELOCON 5g creme afbrydes, indtil infektionen er blevet tilstrækkeligt kontrolleret.

Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Der er ikke udført langtidsforsøg på dyr for at evaluere det kræftfremkaldende potentiale af ELOCON 5g Cream. Langsigtede carcinogenicitetsundersøgelser af mometasonfuroat blev udført ad inhalationsvejen hos rotter og mus. I et 2-årigt carcinogenicitetsstudie i Sprague Dawley-rotter viste mometasonfuroat ingen statistisk signifikant stigning i tumorer ved inhalationsdoser op til 67 mcg/kg (ca. 0,04 gange den estimerede maksimale kliniske topiske dosis fra ELOCON 5g creme på en mcg/m²-basis ). I et 19-måneders carcinogenicitetsstudie i schweiziske CD-1-mus viste mometasonfuroat ingen statistisk signifikant stigning i forekomsten af tumorer ved inhalationsdoser op til 160 mcg/kg (ca. 0,05 gange den estimerede maksimale kliniske topiske dosis fra ELOCON Cream på en mcg/m² basis).
Mometasonfuroat øgede kromosomafvigelser i en in vitro kinesisk hamster-ovariecelleanalyse, men øgede ikke kromosomafvigelser i en in vitro kinesisk hamster-lungecelleanalyse. Mometasonfuroat var ikke mutagent i Ames-testen eller muselymfomanalysen og var ikke klastogen i et in vivo-musemikronukleusassay, et kromosomafvigelsesassay for rotteknoglemarv eller et kromosomafvigelsesassay for hankimceller. Mometasonfuroat inducerede heller ikke uplanlagt DNA-syntese in vivo i rottehepatocytter.
I reproduktionsstudier med rotter blev der ikke forårsaget svækkelse af fertiliteten hos han- eller hunrotter ved subkutane doser på op til 15 mcg/kg (ca. 0,01 gange den estimerede maksimale kliniske topiske dosis fra ELOCON 5g creme på en mcg/m²-basis).
Brug i specifikke populationer
Graviditet
Teratogene virkninger - Graviditetskategori C
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Derfor bør ELOCON 5g Cream kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Kortikosteroider har vist sig at være teratogene hos laboratoriedyr, når de administreres systemisk i relativt lave dosisniveauer. Nogle kortikosteroider har vist sig at være teratogene efter dermal applikation hos laboratoriedyr.
Når det administreres til gravide rotter, kaniner og mus, øgede mometasonfuroat føtale misdannelser. De doser, der frembragte misdannelser, reducerede også fostervæksten, målt ved lavere fostervægt og/eller forsinket ossifikation. Mometasonfuroat forårsagede også dystoci og relaterede komplikationer, når det blev givet til rotter i slutningen af graviditeten.
Hos mus forårsagede mometasonfuroat ganespalte ved subkutane doser på 60 mcg/kg og derover. Fosterets overlevelse blev reduceret med 180 mcg/kg. Ingen toksicitet blev observeret ved 20 mcg/kg. (Doser på 20, 60 og 180 mcg/kg i musen er ca. 0,01, 0,02 og 0,05 gange den estimerede maksimale kliniske topiske dosis fra ELOCON Cream på en mcg/m²-basis.)
Hos rotter producerede mometasonfuroat navlebrok ved topiske doser på 600 mcg/kg og derover. En dosis på 300 mcg/kg gav forsinkelser i ossifikationen, men ingen misdannelser. (Doser på 300 og 600 mcg/kg hos rotter er ca. 0,2 og 0,4 gange den estimerede maksimale kliniske topiske dosis fra ELOCON 5g Cream på en mcg/m²-basis.)
Hos kaniner forårsagede mometasonfuroat multiple misdannelser (f.eks. bøjede forpoter, galdeblære-agenese, navlebrok, hydrocefali) ved topiske doser på 150 mcg/kg og derover (ca. 0,2 gange den estimerede maksimale kliniske topiske dosis fra ELOCON Cream på en mcg/mcg/mcg) m² basis). I en oral undersøgelse øgede mometasonfuroat resorptionerne og forårsagede ganespalte og/eller hovedmisdannelser (hydrocefali og hvælvet hoved) ved 700 mcg/kg. Ved 2800 mcg/kg blev de fleste kuld aborteret eller resorberet. Ingen toksicitet blev observeret ved 140 mcg/kg. (Doser på 140, 700 og 2800 mcg/kg i kaninen er ca. 0,2, 0,9 og 3,6 gange den estimerede maksimale kliniske topiske dosis fra ELOCON 5g creme på en mcg/m²-basis.)
Når rotter modtog subkutane doser af mometasonfuroat gennem hele graviditeten eller i de senere stadier af graviditeten, forårsagede 15 mcg/kg langvarig og vanskelig fødsel og reducerede antallet af levende fødte, fødselsvægt og tidlig hvalpeoverlevelse. Lignende virkninger blev ikke observeret ved 7,5 mcg/kg. (Doser på 7,5 og 15 mcg/kg hos rotter er ca. 0,005 og 0,01 gange den estimerede maksimale kliniske topiske dosis fra ELOCON Cream på en mcg/m²-basis.)
Ammende mødre
Systemisk administrerede kortikosteroider forekommer i modermælk og kan undertrykke vækst, interferere med endogen kortikosteroidproduktion eller forårsage andre uheldige virkninger. Det vides ikke, om topisk administration af kortikosteroider kan resultere i tilstrækkelig systemisk absorption til at producere påviselige mængder i modermælk. Da mange lægemidler udskilles i modermælk, bør der udvises forsigtighed, når ELOCON 5g creme administreres til en ammende kvinde.
Pædiatrisk brug
ELOCON Cream kan anvendes med forsigtighed til pædiatriske patienter på 2 år eller ældre, selvom sikkerheden og effekten af lægemiddelbrug i mere end 3 uger ikke er blevet fastslået. Da sikkerhed og virkning af ELOCON 5g Cream ikke er blevet fastslået hos pædiatriske patienter under 2 år, anbefales det ikke at bruge det til denne aldersgruppe.
et pædiatrisk forsøg blev 24 forsøgspersoner med atopisk dermatitis, hvoraf 19 forsøgspersoner var i alderen 2 til 12 år, behandlet med ELOCON Cream én gang dagligt. Størstedelen af forsøgspersonerne klarede sig inden for 3 uger.ELOCON 5g creme forårsagede HPA-akseundertrykkelse hos ca. 16 % af pædiatriske forsøgspersoner i alderen 6 til 23 måneder, som viste normal binyrefunktion ved Cortrosyn-test før behandlingsstart, og blev behandlet i ca. 3 uger over en gennemsnitlig kropsoverfladeareal på 41 % (interval 15 %-94 %). Kriterierne for suppression var: basalt cortisolniveau på ≤ 5 mcg/dL, 30-minutters post-stimuleringsniveau på ≤ 18 mcg/dL eller en stigning på KLINISK FARMAKOLOGI ].
På grund af et højere forhold mellem hudoverfladeareal og kropsmasse har pædiatriske patienter en større risiko end voksne for HPA-aksesuppression og Cushings syndrom, når de behandles med topikale kortikosteroider. De har derfor også større risiko for binyrebarkinsufficiens under og/eller efter seponering af behandlingen. Pædiatriske patienter kan være mere modtagelige end voksne for hudatrofi, herunder striae, når de behandles med topikale kortikosteroider. Pædiatriske patienter, der anvender topikale kortikosteroider på mere end 20 % af kropsoverfladen, har højere risiko for HPA-akseundertrykkelse.
HPA-akseundertrykkelse, Cushings syndrom, lineær vækstretardering, forsinket vægtøgning og intrakraniel hypertension er blevet rapporteret hos pædiatriske patienter, der får topikale kortikosteroider. Manifestationer af binyrebarksuppression hos børn omfatter lave plasmakortisolniveauer og fravær af respons på ACTH-stimulering. Manifestationer af intrakraniel hypertension omfatter svulmende fontaneller, hovedpine og bilateralt papilleødem.
ELOCON Cream bør ikke anvendes til behandling af bleeksem.
Geriatrisk brug
Kliniske undersøgelser af ELOCON 5g Cream omfattede 190 forsøgspersoner, der var 65 år og derover, og 39 forsøgspersoner, der var 75 år og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Større følsomhed hos nogle ældre individer kan dog ikke udelukkes.
OVERDOSIS
Topisk påført ELOCON Cream kan absorberes i tilstrækkelige mængder til at fremkalde systemiske effekter [se ADVARSLER OG FORHOLDSREGLER ].
KONTRAINDIKATIONER
Ingen.
KLINISK FARMAKOLOGI
Virkningsmekanisme
Som andre topiske kortikosteroider har mometasonfuroat antiinflammatoriske, kløestillende og vasokonstriktive egenskaber. Mekanismen for den antiinflammatoriske aktivitet af de topiske steroider er generelt uklar. Imidlertid menes kortikosteroider at virke ved induktion af phospholipase A2-hæmmende proteiner, der under ét kaldes lipocortiner. Det postuleres, at disse proteiner styrer biosyntesen af potente mediatorer af inflammation, såsom prostaglandiner og leukotriener, ved at hæmme frigivelsen af deres almindelige precursor arachidonsyre. Arachidonsyre frigives fra membranfosfolipider af fosfolipase A2.
Farmakodynamik
Undersøgelser udført med ELOCON 5g Cream indikerer, at den er i middelstyrkeområdet sammenlignet med andre topiske kortikosteroider.
en undersøgelse, der evaluerede virkningerne af mometasonfuroatcreme på HPA-aksen, blev 15 gram påført to gange dagligt i 7 dage til seks voksne forsøgspersoner med psoriasis eller atopisk dermatitis. Cremen blev påført uden okklusion på mindst 30 % af kropsoverfladen. Resultaterne viste, at lægemidlet forårsagede en let sænkning af binyrebarksteroidsekretion [se ADVARSLER OG FORHOLDSREGLER ].
97 pædiatriske forsøgspersoner i alderen 6 til 23 måneder med atopisk dermatitis blev indskrevet i et åbent HPA-aksesikkerhedsstudie. ELOCON Cream blev påført én gang dagligt i ca. 3 uger over et gennemsnitligt kropsoverfladeareal på 41 % (interval 15 %-94 %). Hos ca. 16 % af forsøgspersonerne, som viste normal binyrefunktion ved Cortrosyn-test før behandlingsstart, blev der observeret binyrebarksuppression ved afslutningen af behandlingen med ELOCON 5g Cream. Kriterierne for suppression var: basalt cortisolniveau på ≤ 5 mcg/dL, 30-minutters post-stimuleringsniveau på ≤ 18 mcg/dL eller en stigning på Brug i specifikke populationer ].
Farmakokinetik
Omfanget af perkutan absorption af topikale kortikosteroider bestemmes af mange faktorer, herunder bæreren og integriteten af den epidermale barriere. Undersøgelser på mennesker indikerer, at ca. 0,4 % af den påførte dosis af ELOCON 5g Creme kommer ind i kredsløbet efter 8 timers kontakt med normal hud uden okklusion. Inflammation og/eller andre sygdomsprocesser i huden kan øge den perkutane absorption.
Kliniske Studier
Sikkerheden og effektiviteten af ELOCON 5g-cremen til behandling af kortikosteroid-responderende dermatoser blev evalueret i to randomiserede, dobbeltblindede, vehikelkontrollerede kliniske forsøg, et i psoriasis og et i atopisk dermatitis. I alt 366 forsøgspersoner (12-81 år), hvoraf 177 modtog ELOCON Cream og 181 forsøgspersoner modtog vehikelcreme, blev evalueret i disse forsøg. ELOCON Cream eller vehikelcremen blev påført én gang dagligt i 21 dage.
De to forsøg viste, at ELOCON 5g Cream er effektiv til behandling af psoriasis og atopisk dermatitis.
PATIENTOPLYSNINGER
Informer patienterne om følgende:
- Brug ELOCON 5g creme som anvist af lægen. Den er kun til ekstern brug.
- Undgå kontakt med øjnene.
- Brug ikke ELOCON Cream på ansigt, armhuler eller lyskeområder, medmindre lægen har anvist det.
- Brug ikke ELOCON 5g Cream til andre lidelser end den, den er ordineret til.
- Det behandlede hudområde må ikke bindes eller på anden måde dækkes eller pakkes ind, så det er okklusivt, medmindre lægen har ordineret det.
- Rapporter eventuelle tegn på lokale bivirkninger til lægen.
- Advis patienter om ikke at bruge ELOCON 5g Cream til behandling af bleeksem. Påfør ikke ELOCON Cream i bleområdet, da bleer eller plastikbukser kan udgøre okklusiv forbinding.
- Afbryd behandlingen, når kontrol er opnået. Hvis ingen bedring ses inden for 2 uger, skal du kontakte lægen.
- Brug ikke andre kortikosteroidholdige produkter sammen med ELOCON Cream uden først at rådføre sig med lægen.
