Brand Temovate 15g Clobetasol Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Temovate, og hvordan bruges det?
Temovate er en receptpligtig medicin, der bruges til at behandle symptomerne på plaque- og hovedbundspsoriasis og kortikosteroid-reagerende dermatoser. Temovate kan bruges alene eller sammen med anden medicin.
Temovate tilhører en klasse af lægemidler kaldet kortikosteroider, topisk.
Det vides ikke, om Temovate er sikkert og effektivt til børn under 12 år.
Hvad er de mulige bivirkninger af Temovate?
Temovate kan forårsage alvorlige bivirkninger, herunder:
- forværring af din hudtilstand,
- rødme, varme, hævelse, væskende eller alvorlig irritation af enhver behandlet hud,
- sløret syn,
- tunnelsyn,
- øjensmerter,
- ser glorier omkring lys,
- øget tørst,
- tør mund,
- frugtig ånde lugt,
- vægtøgning i dit ansigt og skuldre,
- langsom sårheling,
- misfarvning af huden,
- tyndere hud,
- øget kropsbehåring,
- træthed,
- humørsvingninger,
- menstruationsændringer, og
- seksuelle ændringer
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Temovate omfatter:
- brændende, kløe, hævelse eller irritation af behandlet hud,
- tør eller revnet hud,
- rødme eller skorpedannelse omkring dine hårsække,
- edderkopper,
- strækmærker,
- tyndere hud,
- udslæt eller nældefeber,
- acne, og
- midlertidigt hårtab
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Temovate. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
TEMOVATE® (clobetasol propionat creme og salve) Creme og salve, 0,05% indeholder det aktive stof clobetasol propionat, et syntetisk kortikosteroid, til topisk dermatologisk brug. Clobetasol, en analog af prednisolon, har en høj grad af glukokortikoid aktivitet og en lille grad af mineralokortikoid aktivitet.
Kemisk er clobetasolpropionat (11ß,16ß)-21-chlor-9-fluor-11-hydroxy-16-methyl-17-(1-oxopropoxy)-pregna-1,4-dien-3,20-dion og den har følgende strukturformel:
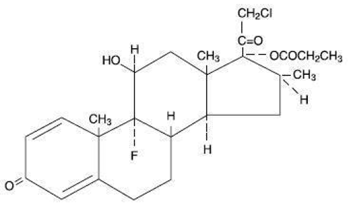
Clobetasolpropionat har molekylformlen C25H32CIFO5 og en molekylvægt på 467. Det er et hvidt til cremefarvet krystallinsk pulver, der er uopløseligt i vand.
TEMOVATE® Cream indeholder clobetasolpropionat 0,5 mg/g i en cremebase af propylenglycol, glycerylmonostearat, cetostearylalkohol, glycerylstearat, PEG 100 stearat, hvid voks, chlorocresol, natriumcitrat, citronsyremonohydrat, og renset vand.
TEMOVATE® salve indeholder clobetasolpropionat 0,5 mg/g i en base af propylenglycol, sorbitan sesquioleat og hvid vaseline.
INDIKATIONER
TEMOVATE® creme og salve er super-høj styrke corticos-teroid formuleringer indiceret til lindring af de inflammatoriske og kløende manifestationer af corticosteroid-responsive dermatoser. Behandling ud over 2 på hinanden følgende uger anbefales ikke, og den samlede dosis bør ikke overstige 50 g/uge på grund af potentialet for lægemidlet til at undertrykke hypothalamus-hypofyse-binyre-aksen (HPA). Brug til pædiatriske patienter under 12 år anbefales ikke.
Som med andre højaktive kortikosteroider bør behandlingen seponeres, når kontrol er opnået. Hvis der ikke ses bedring inden for 2 uger, kan det være nødvendigt at revurdere diagnosen.
DOSERING OG ADMINISTRATION
Påfør et tyndt lag TEMOVATE® creme eller salve på de berørte hudområder to gange dagligt og gnid blidt og fuldstændigt ind (se INDIKATIONER OG BRUG ).
TEMOVATE® creme og salve er topiske kortikosteroider med super høj styrke; derfor, behandling bør begrænses til 2 på hinanden følgende uger, og mængder større end 50 g/uge bør ikke anvendes.
Som med andre højaktive kortikosteroider bør behandlingen seponeres, når kontrol er opnået. Hvis ingen bedring ses inden for 2 uger, kan det være nødvendigt at revurdere diagnosen.
TEMOVATE® creme og salve bør ikke bruges sammen med okklusiv forbinding.
Geriatrisk brug
I undersøgelser, hvor geriatriske patienter (65 år eller ældre, se FORHOLDSREGLER er blevet behandlet med TEMOVATE® creme eller salve, var sikkerheden ikke anderledes end hos yngre patienter; derfor anbefales ingen dosisjustering.
HVORDAN LEVERET
TEMOVATE® (clobetasol propionatcreme) Creme, 0,05 % leveres i:
30 g rør ( NDC 10337-163-30) og 60-g rør ( NDC 10337-163-60).
TEMOVATE® (clobetasol propionat salve) salve, 0,05% leveres i:
15 g rør ( NDC 10337-162-15) og 30-g rør ( NDC 10337-162-30).
Opbevares mellem 15° og 30°C (59° og 86°F). TEMOVATE® Cream bør ikke opbevares i køleskab. PharmaDerm
En afdeling af Fougera Pharmaceuticals Inc., Melville, NY 11747 USA. Revideret: januar 2012
BIVIRKNINGER
I kontrollerede kliniske forsøg var de hyppigste rapporterede bivirkninger for TEMOVATE® Cream brændende og stikkende fornemmelse hos 1 % af de behandlede patienter. Mindre hyppige bivirkninger var kløe, hudatrofi og revner og revner i huden.
kontrollerede kliniske forsøg var de hyppigste bivirkninger rapporteret for TEMOVATE® salve brændende fornemmelse, irritation og kløe hos 0,5 % af de behandlede patienter. Mindre hyppige bivirkninger var svie, revner, erytem, folliculitis, følelsesløshed i fingre, hudatrofi og telangiektasi.
Cushings syndrom er blevet rapporteret hos spædbørn og voksne som følge af langvarig brug af topiske clobetasolpropionatformuleringer.
Følgende yderligere lokale bivirkninger er blevet rapporteret med topikale kortikosteroider, og de kan forekomme hyppigere ved brug af okklusiv forbinding og kortikosteroider med højere styrke. Disse reaktioner er angivet i en tilnærmelsesvis faldende rækkefølge af forekomst: tørhed, acneiforme udbrud, hypopigmentering, perioral dermatitis, allergisk kontaktdermatitis, sekundær infektion, irritation, striae og miliaria.

DRUGSINTERAKTIONER
Ingen oplysninger angivet.
ADVARSLER
Ingen oplysninger angivet. Se venligst FORHOLDSREGLER afsnit nedenfor.
FORHOLDSREGLER
Generel
TEMOVATE® creme og salve bør ikke anvendes til behandling af rosacea eller perioral dermatitis, og bør ikke anvendes i ansigtet, lysken eller aksiller.
Systemisk absorption af topikale kortikosteroider kan give reversibel HPA-akseundertrykkelse med potentiale for glukokortikosteroidinsufficiens efter seponering fra behandlingen. Manifestationer af Cushings syndrom, hyperglykæmi og glucosuri kan også frembringes hos nogle patienter ved systemisk absorption af topikale kortikosteroider under behandling.
Patienter, der anvender et topisk steroid på et stort overfladeareal eller på områder under okklusion, bør evalueres med jævne mellemrum for tegn på HPA-akseundertrykkelse. Dette kan gøres ved at bruge ACTH-stimulering, AM-plasmakortisol og urinfri cortisoltest. Patienter, der får superpotente kortikosteroider, bør ikke behandles i mere end 2 uger ad gangen, og kun små områder bør behandles ad gangen på grund af den øgede risiko for HPA-undertrykkelse.
TEMOVATE® creme og salve producerede HPA-akseundertrykkelse, når det blev brugt i doser så lave som 2 g/dag i 1 uge hos patienter med eksem.
Hvis HPA-aksen undertrykkes, bør der gøres et forsøg på at trække lægemidlet tilbage, reducere applikationshyppigheden eller erstatte et mindre potent kortikosteroid. Genopretning af HPA-aksefunktionen er generelt hurtig ved seponering af topikale kortikosteroider. Sjældent kan der forekomme tegn og symptomer på glukokortikosteroidinsufficiens, som kræver supplerende systemiske kortikosteroider. For information om systemisk tilskud, se ordinationsinformation for disse produkter.
Pædiatriske patienter kan være mere modtagelige for systemisk toksicitet fra ækvivalente doser på grund af deres større forhold mellem hudoverflade og kropsmasse (se FORHOLDSREGLER : Pædiatrisk brug ).
Hvis der opstår irritation, bør TEMOVATE® creme og salve seponeres og passende behandling iværksættes. Allergisk kontaktdermatitis med kortikosteroider diagnosticeres sædvanligvis ved at observere en manglende helbredelse i stedet for at bemærke en klinisk forværring som med de fleste topiske produkter, der ikke indeholder kortikosteroider. En sådan observation bør bekræftes med passende diagnostisk lappetest.
Hvis samtidige hudinfektioner er til stede eller udvikles, bør et passende antifungalt eller antibakterielt middel anvendes. Hvis en gunstig reaktion ikke indtræder omgående, skal brugen af TEMOVATE® creme og salve afbrydes, indtil infektionen er blevet tilstrækkeligt kontrolleret.
Laboratorieprøver
Følgende tests kan være nyttige til at evaluere patienter for HPA-akseundertrykkelse:
ACTH stimulationstest AM plasma cortisol test Urinfri cortisol test
Karcinogenese, mutagenese, svækkelse af fertilitet
Der er ikke udført langtidsforsøg på dyr for at evaluere det karcinogene potentiale af clobetasolpropionat.
Undersøgelser med rotter efter subkutan administration i dosisniveauer på op til 50 mcg/kg/dag viste, at hunnerne udviste en stigning i antallet af resorberede embryoner og et fald i antallet af levende fostre ved den højeste dosis.
Clobetasolpropionat var ikke-mutagent i 3 forskellige testsystemer: Ames-testen, Saccharomyces cerevisiae-genkonverteringsanalysen og E. coli B WP2-fluktuationstesten.
Graviditet
Teratogene virkninger
Graviditetskategori C. Kortikosteroider har vist sig at være teratogene hos laboratoriedyr, når de administreres systemisk i relativt lave dosisniveauer. Nogle kortikosteroider har vist sig at være teratogene efter dermal påføring på laboratoriedyr.
Clobetasolpropionat er ikke blevet testet for teratogenicitet ved topisk anvendelse; det absorberes imidlertid perkutant, og når det administreres subkutant, var det et signifikant teratogent i både kanin og mus. Clobetasolpropionat har større teratogent potentiale end steroider, der er mindre potente.
Teratogenicitetsundersøgelser i mus ved anvendelse af subkutan vej resulterede i føtotoksicitet ved den højeste testede dosis (1 mg/kg) og teratogenicitet ved alle dosisniveauer testet ned til 0,03 mg/kg. Disse doser er henholdsvis ca. 1,4 og 0,04 gange den humane topiske dosis af TEMOVATE® creme og salve. Abnormiteter, der blev set, omfattede ganespalte og skeletabnormiteter.
Hos kaniner var clobetasolpropionat teratogent ved doser på 3 og 10 mcg/kg. Disse doser er henholdsvis ca. 0,02 og 0,05 gange den humane topiske dosis af TEMOVATE® creme og salve. Abnormiteter, der blev set, omfattede ganespalte, kranioschisis og andre skeletabnormiteter.
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af det teratogene potentiale af clobetasolpropionat hos gravide kvinder. TEMOVATE® creme og salve bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Ammende mødre
Systemisk administrerede kortikosteroider forekommer i modermælk og kan undertrykke vækst, interferere med endogen kortikosteroidproduktion eller forårsage andre uheldige virkninger. Det vides ikke, om topisk administration af kortikosteroider kan resultere i tilstrækkelig systemisk absorption til at producere påviselige mængder i modermælk. Da mange lægemidler udskilles i modermælk, bør der udvises forsigtighed, når TEMOVATE® creme eller salve administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerhed og effektivitet af TEMOVATE® creme og salve hos pædiatriske patienter er ikke blevet fastslået. Brug til pædiatriske patienter under 12 år anbefales ikke. På grund af et højere forhold mellem hudoverfladeareal og kropsmasse har pædiatriske patienter en større risiko end voksne for HPA-akseundertrykkelse og Cushings syndrom, når de behandles med topikale kortikosteroider. De har derfor også større risiko for binyrebarkinsufficiens under eller efter seponering af behandlingen. Bivirkninger inklusive striae er blevet rapporteret ved uhensigtsmæssig brug af topikale kortikosteroider til spædbørn og børn.
HPA-akseundertrykkelse, Cushings syndrom, lineær vækstretardering, forsinket vægtøgning og intrakraniel hypertension er blevet rapporteret hos børn, der får topikale kortikosteroider. Manifestationer af binyrebarksuppression hos børn omfatter lave plasmakortisolniveauer og fravær af respons på ACTH-stimulering. Manifestationer af intrakraniel hypertension omfatter svulmende fontaneller, hovedpine og bilateralt papilleødem.
Geriatrisk brug
Et begrænset antal patienter på eller over 65 år er blevet behandlet med TEMOVATE® Cream (n = 231) og med TEMOVATE® Ointment (n = 101) i amerikanske og ikke-amerikanske kliniske forsøg. Mens antallet af patienter er for lille til at tillade separat analyse af effekt og sikkerhed, svarede de rapporterede bivirkninger i denne population til dem, der blev rapporteret af yngre patienter. Baseret på tilgængelige data er ingen justering af dosis af TEMOVATE® creme og salve til geriatriske patienter berettiget.
OVERDOSIS
Topisk påført TEMOVATE® creme og salve kan absorberes i tilstrækkelige mængder til at fremkalde systemiske effekter (se FORHOLDSREGLER ).
KONTRAINDIKATIONER
TEMOVATE® (clobetasol propionat creme og salve) Creme og salve, 0,05% er kontraindiceret hos de patienter med en historie med overfølsomhed over for nogen af præparaternes komponenter.
KLINISK FARMAKOLOGI
Som andre topiske kortikosteroider har clobetasolpropionat antiinflammatoriske, kløestillende og vasokonstriktive egenskaber. Mekanismen for den antiinflammatoriske aktivitet af de topiske steroider er generelt uklar. Imidlertid menes kortikosteroider at virke ved induktion af phospholipase A2-hæmmende proteiner, der under ét kaldes lipocortiner. Det postuleres, at disse proteiner styrer biosyntesen af potente mediatorer af inflammation, såsom prostaglandiner og leukotriener, ved at hæmme frigivelsen af deres almindelige precursor, arachidonsyre. Arachidonsyre frigives fra membranfosfolipider af fosfolipase A2.
Farmakokinetik
Omfanget af perkutan absorption af topikale kortikosteroider bestemmes af mange faktorer, herunder bæreren og integriteten af den epidermale barriere. Okklusiv forbinding med hydrocortison i op til 24 timer er ikke blevet påvist at øge penetrationen; dog øger okklusion af hydrocortison i 96 timer markant penetration. Topikale kortikosteroider kan absorberes fra normal intakt hud. Inflammation og/eller andre sygdomsprocesser i huden kan øge den perkutane absorption.
Undersøgelser udført med TEMOVATE® creme og salve indikerer, at de er i det superhøje styrkeområde sammenlignet med andre topikale kortikosteroider.
PATIENTOPLYSNINGER
Patienter, der bruger topikale kortikosteroider, bør modtage følgende information og instruktioner:
