Microzide 25mg Hydrochlorothiazide Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Microzide 25mg, og hvordan bruges det?
Microzide er en receptpligtig medicin, der bruges til at behandle symptomerne på forhøjet blodtryk (hypertension) og hævelse (ødem). Microzide kan bruges alene eller sammen med anden medicin.
Microzide tilhører en klasse af lægemidler kaldet diuretika, thiazid.
Det vides ikke, om Microzide er sikkert og effektivt til børn under 6 måneder.
Hvad er de mulige bivirkninger af Microzide?
Microzide kan forårsage alvorlige bivirkninger, herunder:
- svimmelhed,
- øjensmerter,
- synsproblemer,
- gulfarvning af huden eller øjnene (gulsot),
- bleg hud,
- let blå mærker,
- usædvanlig blødning (næse, mund, vagina eller endetarm),
- stakåndet,
- hvæsen,
- hoste med skummende slim,
- brystsmerter,
- tør mund,
- tørst,
- døsighed,
- mangel på energi,
- rastløshed,
- muskelsmerter eller svaghed,
- hurtig puls,
- kvalme,
- opkastning,
- lidt eller ingen urin,
- feber,
- ondt i halsen,
- hævelse i dit ansigt eller tunge,
- brændende i dine øjne, og
- hudsmerter efterfulgt af et rødt eller lilla hududslæt, der breder sig (især i ansigtet eller overkroppen) og forårsager blærer og afskalning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Microzide omfatter:
- kvalme,
- opkastning,
- mistet appetiten,
- diarré,
- forstoppelse,
- muskelspasme,
- svimmelhed, og
- hovedpine
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Microzide. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
MICROZIDE® (hydrochlorthiazid, USP 12,5 mg) er 3,4-dihydro-derivatet af chlorthiazid. Dets kemiske navn er 6-chlor-3,4-dihydro-2H-1,2,4-benzothiadiazin-7-sulfonamid-1,1-dioxid. Dens empiriske formel er C7H8CIN304S2; dens molekylvægt er 297,74; og dens strukturformel er:
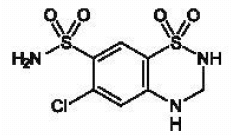
Det er et hvidt eller praktisk talt hvidt krystallinsk pulver, som er let opløseligt i vand, men let opløseligt i natriumhydroxidopløsning.
MICROZIDE (hydrochlorthiazid kapsel) leveres som 12,5 mg kapsler til oral brug.
Inaktive ingredienser : kolloid siliciumdioxid, majsstivelse, lactosemonohydrat, magnesiumstearat. Gelatinekapsler indeholder D&C Red No. 28, D&C Yellow No. 10, FD&C Blue No. 1, gelatine, titaniumdioxid. Kapslerne er trykt med spiselig blæk, der indeholder sort jernoxid, D&C Yellow No. 10, FD&C Blue No. 1, FD&C Blue No. 2, FD&C Red No. 40.
INDIKATIONER
MICROZIDE (hydrochlorthiazidkapsel) er indiceret til behandling af hypertension enten som det eneste terapeutiske middel eller i kombination med andre antihypertensiva. I modsætning til kaliumbesparende kombinationsdiuretika kan MICROZIDE (hydrochlorthiazidkapsel) anvendes til de patienter, hvor udviklingen af hyperkaliæmi ikke kan risikeres, herunder patienter, der tager ACE-hæmmere.
Brug under graviditet
Den rutinemæssige brug af diuretika hos en ellers rask kvinde er uhensigtsmæssig og udsætter mor og foster for unødvendig fare. Diuretika forhindrer ikke udvikling af toksæmi ved graviditet, og der er ingen tilfredsstillende bevis for, at de er nyttige i behandlingen af udviklet toksæmi.
Ødem under graviditet kan opstå af patologiske årsager eller fra de fysiologiske og mekaniske konsekvenser af graviditeten. Diuretika er indiceret under graviditet, når ødemer skyldes patologiske årsager, ligesom de er i fravær af graviditet. Afhængigt ødem i graviditeten som følge af begrænsning af venøs tilbagevenden af den udvidede livmoder behandles korrekt gennem hævning af underekstremiteterne og brug af støtteslange; brug af diuretika til at sænke intravaskulært volumen i dette tilfælde er ulogisk og unødvendig. Der er hypervolæmi under normal graviditet, som hverken er skadelig for fosteret eller moderen (i fravær af hjertekarsygdomme), men som er forbundet med ødem, herunder generaliseret ødem hos størstedelen af gravide kvinder. Hvis dette ødem giver ubehag, vil øget liggende ofte give lindring. I sjældne tilfælde kan dette ødem forårsage ekstremt ubehag, som ikke lindres ved hvile. I disse tilfælde kan en kort kur med diuretika give lindring og kan være passende.
DOSERING OG ADMINISTRATION
Til kontrol af hypertension : Voksenstartdosis af MICROZIDE (hydrochlorthiazidkapsel) er én kapsel givet én gang dagligt, uanset om det gives alene eller i kombination med andre antihypertensiva. Totale daglige doser større end 50 mg anbefales ikke.
HVORDAN LEVERET
MICROZIDE (hydrochlorthiazid kapsel) Kapsler er #4 Teal Opaque/Teal Opaque todelte hårde gelatinekapsler præget med MICROZIDE (hydrochlorthiazidkapsel) og 12,5 mg i sort blæk. De leveres i flasker á 100 stk med børnesikrede lukninger ( NDC 52544-622-01).
Dispenser i en tæt, lysbestandig beholder som defineret i USP.
Holde utilgængeligt for børn.
Opbevares ved 20°-25°C (68°-77°F). [Se USP kontrolleret rumtemperatur.] Beskyt mod lys, fugt, frysning, -20°C (-4°F). Hold beholderen tæt lukket.
Ret medicinske forespørgsler til: WATSON., Medical Communications PO Box 1953, Morristown, NJ 07962-1953. 800-272-5525. Fremstillet af: Watson Pharma Private Limited. Verna, Salcette, Goa 403 722 INDIEN. Distribueret af: Watson Pharma, Inc. Morristown, NJ 07962 USA. Revideret: februar 2011
BIVIRKNINGER
Bivirkningerne forbundet med hydrochlorthiazid har vist sig at være dosisrelaterede. I kontrollerede kliniske forsøg var bivirkningerne rapporteret med doser på 12,5 mg hydrochlorthiazid én gang dagligt sammenlignelige med placebo. Følgende bivirkninger er blevet rapporteret for doser af hydrochlorthiazid på 25 mg og derover, og inden for hver kategori er de anført i rækkefølgen efter faldende sværhedsgrad.
Kroppen som helhed : Svaghed.
Kardiovaskulær : Hypotension inklusive ortostatisk hypotension (kan forværres af alkohol, barbiturater, narkotika eller antihypertensiva).
Fordøjelse Pancreatitis, gulsot (intrahepatisk kolestatisk gulsot), diarré, opkastning, sialadenitis, kramper, forstoppelse, maveirritation, kvalme, anoreksi.
Hæmatologisk : Aplastisk anæmi, agranulocytose, leukopeni, hæmolytisk anæmi, trombocytopeni.
Overfølsomhed : Anafylaktiske reaktioner, nekrotiserende angiitis (vaskulitis og kutan vaskulitis), åndedrætsbesvær, herunder pneumonitis og lungeødem, lysfølsomhed, feber, nældefeber, udslæt, purpura.
Metabolisk : Elektrolyt-ubalance (se FORHOLDSREGLER ), hyperglykæmi, glykosuri, hyperurikæmi.
Muskuloskeletale : Muskelspasme.
Nervesystem/Psykiatrisk : Vertigo, paræstesi, svimmelhed, hovedpine, rastløshed.
Renal : Nyresvigt, nyreinsufficiens, interstitiel nefritis (se ADVARSLER ).
Hud : Erythema multiforme inklusive Stevens-Johnsons syndrom, eksfoliativ dermatitis inklusive toksisk epidermal nekrolyse, alopeci.
Særlige sanser Forbigående sløret syn, xantopsi.
Urogenital : Impotens.
Når bivirkningerne er moderate eller alvorlige, bør thiaziddosis reduceres eller behandlingen seponeres.
DRUGSINTERAKTIONER
Når de gives samtidigt, kan følgende lægemidler interagere med thiaziddiuretika:
Alkohol, barbiturater eller narkotika - Potentiering af ortostatisk hypotension kan forekomme.
Antidiabetiske lægemidler - (orale midler og insulin) dosisjustering af det antidiabetiske lægemiddel kan være påkrævet.
Andre antihypertensiva - additiv effekt eller potensering.
Kolestyramin og colestipol harpikser - Kolestyramin- og colestipolharpikser binder hydrochlorthiazidet og reducerer dets absorption fra mave-tarmkanalen med henholdsvis op til 85 og 43 procent.
Kortikosteroid, ACTH - intensiveret elektrolytudtømning, især hypokaliæmi.
Pressoraminer (f.eks. noradrenalin) - mulig nedsat respons på pressoraminer, men ikke tilstrækkelig til at udelukke deres anvendelse.
Skeletmuskelafslappende midler, ikke-depolariserende (f.eks. tubocurarin) mulig øget reaktionsevne over for muskelafslappende midler.
Lithium - bør generelt ikke gives sammen med diuretika. Diuretika reducerer den renale clearance af lithium og øger i høj grad risikoen for lithiumtoksicitet. Se indlægssedlen for lithiumpræparater før brug af sådanne præparater med MICROZIDE (hydrochlorthiazidkapsel).
Ikke-steroide antiinflammatoriske lægemidler - Hos nogle patienter kan administration af et ikke-steroidt antiinflammatorisk middel reducere de diuretiske, natriuretiske og antihypertensive virkninger af loop-, kaliumbesparende og thiaziddiuretika. Når MICROZIDE (hydrochlorthiazidkapsel) og ikke-steroide antiinflammatoriske midler anvendes samtidig, bør patienterne observeres nøje for at afgøre, om den ønskede effekt af diuretika opnås.
Interaktioner med lægemiddel/laboratorietest
Thiazider bør seponeres, før der udføres test for biskjoldbruskkirtlens funktion (se FORHOLDSREGLER, Generelt ).
ADVARSLER
Diabetes og hypoglykæmi: Latent diabetes mellitus kan blive manifest, og diabetespatienter, der får thiazider, kan kræve justering af deres insulindosis.
Nyresygdom: Kumulative virkninger af thiaziderne kan udvikle sig hos patienter med nedsat nyrefunktion. Hos sådanne patienter kan thiazider udløse azotæmi.
FORHOLDSREGLER
Status for elektrolyt- og væskebalance
I offentliggjorte undersøgelser har klinisk signifikant hypokalæmi været konsekvent mindre almindelig hos patienter, der fik 12,5 mg hydrochlorthiazid, end hos patienter, der fik højere doser. Ikke desto mindre bør der udføres periodisk bestemmelse af serumelektrolytter hos patienter, som kan have risiko for udvikling af hypokaliæmi. Patienter bør observeres for tegn på væske- eller elektrolytforstyrrelser, dvs. hyponatriæmi, hypokloræmisk alkalose og hypokaliæmi og hypomagnesæmi.
Advarselstegn eller symptomer på væske- og elektrolyt-ubalance omfatter mundtørhed, tørst, svaghed, sløvhed, døsighed, rastløshed, muskelsmerter eller -kramper, muskeltræthed, hypotension, oliguri, takykardi og mave-tarmforstyrrelser såsom kvalme og opkastning.
Hypokaliæmi kan udvikle sig, især med rask diurese, når alvorlig cirrose er til stede, under samtidig brug af kortikosteroid eller adrenokortikotropt hormon (ACTH) eller efter længere tids behandling. Interferens med tilstrækkelig oral elektrolytindtagelse vil også bidrage til hypokaliæmi. Hypokalæmi og hypomagnesæmi kan fremkalde ventrikulære arytmier eller sensibilisere eller overdrive hjertets reaktion på digitalis toksiske virkninger. Hypokaliæmi kan undgås eller behandles med kaliumtilskud eller øget indtag af kaliumrige fødevarer.
Fortyndingshyponatriæmi er livstruende og kan forekomme hos ødematøse patienter i varmt vejr; passende behandling er vandrestriktion snarere end saltindgivelse, undtagen i sjældne tilfælde, hvor hyponatriæmien er livstruende. Ved faktisk saltudtømning er passende erstatning den foretrukne terapi.
Hyperurikæmi
Hyperurikæmi eller akut gigt kan udløses hos visse patienter, der får thiaziddiuretika.
Nedsat leverfunktion
Thiazider bør anvendes med forsigtighed til patienter med nedsat leverfunktion. De kan fremkalde hepatisk koma hos patienter med alvorlig leversygdom.
Parathyroid sygdom
Calciumudskillelse er nedsat af thiazider, og patologiske ændringer i biskjoldbruskkirtlerne med hypercalcæmi og hypofosfatæmi er blevet observeret hos nogle få patienter i langvarig thiazidbehandling.
Karcinogenese, mutagenese, svækkelse af fertilitet
To-årige fodringsundersøgelser i mus og rotter udført i regi af National Toxicology Program (NTP) afslørede ingen tegn på et kræftfremkaldende potentiale af hydrochlorthiazid hos hunmus (ved doser på op til ca. 600 mg/kg/dag) eller hos hankøn. og hunrotter (ved doser på ca. 100 mg/kg/dag). NTP fandt imidlertid tvetydige beviser for hepatokarcinogenicitet hos hanmus. Hydrochlorthiazid var ikke genotoksisk in vitro i Ames-mutagenicitetsanalysen af Salmonella typhimurium-stammer TA 98, TA 100, TA 1535, TA 1537 og TA 1538 og i den kinesiske hamsterovarie (CHO)-test for kromosomafvigelser ved brug af vibrationer, eller kimcellekromosomer fra mus, knoglemarvskromosomer fra kinesisk hamster og det kønsbundne recessive letale træk ved Drosophila. Positive testresultater blev kun opnået i in vitro CHO Sister Chromatid Exchange (klastogenicitet) og i muselymfomcelle (mutagenicitet) assays ved anvendelse af koncentrationer af hydrochlorthiazid fra 43 til 1300 mcg/ml og i Aspergillus nidulans non-disjunction assay kl. en uspecificeret koncentration.
Hydrochlorthiazid havde ingen bivirkninger på fertiliteten hos mus og rotter af begge køn i undersøgelser, hvor disse arter via deres diæt blev eksponeret for doser på henholdsvis op til 100 og 4 mg/kg før undfangelse og gennem hele graviditeten.
Graviditet
Teratogene virkninger
Graviditetskategori B: Undersøgelser, hvor hydrochlorthiazid blev indgivet oralt til gravide mus og rotter i deres respektive perioder med større organogenese i doser op til henholdsvis 3000 og 1000 mg hydrochlorthiazid/kg, viste ingen tegn på skade på fosteret.
Der er dog ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. Da reproduktionsstudier på dyr ikke altid forudsiger human respons, bør dette lægemiddel kun anvendes under graviditet, hvis det er klart nødvendigt.
Ikke-ratatogene virkninger
Thiazider krydser placentabarrieren og optræder i navlestrengsblod. Der er risiko for føtal eller neonatal gulsot, trombocytopeni og muligvis andre bivirkninger, der er opstået hos voksne.
Ammende mødre
Thiazider udskilles i modermælk. På grund af risikoen for alvorlige bivirkninger hos ammende spædbørn, bør der tages en beslutning om at afbryde amningen eller seponere hydrochlorthiazid under hensyntagen til lægemidlets betydning for moderen.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået.
Ældre Brug
En større blodtryksreduktion og en stigning i bivirkninger kan observeres hos ældre (dvs. > 65 år) med hydrochlorthiazid. Det anbefales derfor at starte behandlingen med den lavest tilgængelige dosis af hydrochlorthiazid (12,5 mg). Hvis yderligere titrering er påkrævet, skal der anvendes 12,5 mg trin.
OVERDOSIS
De mest almindelige observerede tegn og symptomer er dem, der er forårsaget af elektrolytmangel (hypokalæmi, hypochloræmi, hyponatriæmi) og dehydrering som følge af overdreven diurese. Hvis digitalis også er blevet administreret, kan hypokaliæmi accentuere hjertearytmier.
tilfælde af overdosering bør symptomatiske og understøttende foranstaltninger anvendes. Emesis bør induceres eller maveskylning udføres. Korriger dehydrering, elektrolyt-ubalance, hepatisk koma og hypotension ved etablerede procedurer. Giv om nødvendigt ilt eller kunstigt åndedræt ved åndedrætsnedsættelse. I hvilken grad hydrochlorthiazid fjernes ved hæmodialyse er ikke fastlagt.
Den orale LD50 af hydrochlorthiazid er større end 10 g/kg hos mus og rotter.
KONTRAINDIKATIONER
Hydrochlorthiazid er kontraindiceret hos patienter med anuri. Overfølsomhed over for dette produkt eller andre sulfonamidafledte lægemidler er også kontraindiceret.
KLINISK FARMAKOLOGI
Hydrochlorthiazid blokerer reabsorptionen af natrium- og chloridioner, og det øger derved mængden af natrium, der passerer den distale tubuli, og mængden af udskilt vand. En del af det yderligere natrium, der præsenteres i den distale tubuli, udskiftes der med kalium- og hydrogenioner. Ved fortsat brug af hydrochlorthiazid og depletering af natrium har kompensatoriske mekanismer en tendens til at øge denne udskiftning og kan forårsage for stort tab af kalium-, hydrogen- og chloridioner. Hydrochlorthiazid nedsætter også udskillelsen af calcium og urinsyre, kan øge udskillelsen af iodid og kan reducere glomerulær filtrationshastighed. Metaboliske toksiciteter forbundet med for store elektrolytændringer forårsaget af hydrochlorthiazid har vist sig at være dosisrelaterede.
Farmakokinetik og metabolisme
Hydrochlorthiazid absorberes godt (65 % til 75 %) efter oral administration. Absorption af hydrochlorthiazid er reduceret hos patienter med kongestiv hjerteinsufficiens.
Maksimal plasmakoncentration observeres inden for 1 til 5 timer efter dosering og varierer fra 70 til 490 ng/ml efter orale doser på 12,5 til 100 mg. Plasmakoncentrationer er lineært relateret til den administrerede dosis. Koncentrationer af hydrochlorthiazid er 1,6 til 1,8 gange højere i fuldblod end i plasma. Binding til serumproteiner er blevet rapporteret at være ca. 40 % til 68 %. Plasmaelimineringshalveringstiden er blevet rapporteret til at være 6 til 15 timer. Hydrochlorthiazid elimineres primært via nyrerne. Efter orale doser på 12,5 til 100 mg vises 55 % til 77 % af den administrerede dosis i urinen, og mere end 95 % af den absorberede dosis udskilles i urinen som uændret lægemiddel. Hos patienter med nyresygdom øges plasmakoncentrationerne af hydrochlorthiazid, og eliminationshalveringstiden forlænges.
Når MICROZIDE (hydrochlorthiazidkapsel) administreres sammen med mad, reduceres dets biotilgængelighed med 10 %, den maksimale plasmakoncentration reduceres med 20 %, og tiden til maksimal koncentration øges fra 1,6 til 2,9 timer.
Farmakodynamik
Akutte antihypertensive virkninger af thiazider menes at skyldes en reduktion i blodvolumen og hjertevolumen, sekundært til en natriuretisk effekt, selvom en direkte vasodilatorisk mekanisme også er blevet foreslået. Ved kronisk administration vender plasmavolumenet tilbage til det normale, men perifer vaskulær modstand er nedsat. Den nøjagtige mekanisme for den antihypertensive virkning af hydrochlorthiazid er ikke kendt.
Thiazider påvirker ikke det normale blodtryk. Virkningen indtræder inden for 2 timer efter dosering, maksimal effekt observeres efter ca. 4 timer, og aktiviteten vedvarer i op til 24 timer.
Kliniske Studier
et 4-ugers dobbeltblindt, placebokontrolleret parallelgruppeforsøg med 87 patienter havde patienter, der fik MICROZIDE (hydrochlorthiazidkapsel), reduktioner i siddende systolisk og diastolisk blodtryk, der var signifikant større end dem, der blev set hos patienter, der fik placebo. I publicerede placebokontrollerede forsøg, der sammenlignede 12,5 mg hydrochlorthiazid med 25 mg, bevarede 12,5 mg-dosis det meste af den placebokorrigerede blodtryksreduktion set med 25 mg.
PATIENTOPLYSNINGER
Ingen oplysninger angivet. Der henvises til ADVARSLER og FORHOLDSREGLER sektioner.
