Proscar 5mg Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Proscar 5mg, og hvordan bruges det?
Proscar er en receptpligtig medicin, der bruges til at behandle symptomerne på benign prostatahyperplasi og androgen alopeci. Denne medicin er kun til brug hos mænd. Proscar 5mg kan bruges alene eller sammen med anden medicin.
Proscar tilhører en klasse af lægemidler kaldet 5-alfa-reduktasehæmmere.
Det vides ikke, om Proscar 5mg er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Proscar 5mg?
Proscar kan forårsage alvorlige bivirkninger, herunder:
- alvorlig eller vedvarende kvalme,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- brystklumper,
- brystsmerter eller ømhed,
- udflåd fra brystvorten, og
- andre brystforandringer
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Proscar omfatter:
- tab af interesse for sex,
- impotens,
- problemer med at få orgasme, og
- unormal ejakulation
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Proscar. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
PROSCAR (finasterid), en syntetisk 4-azasteroidforbindelse, er en specifik hæmmer af steroid Type II 5α-reduktase, et intracellulært enzym, der omdanner androgenet testosteron til 5α-dihydrotestosteron (DHT).
Finasterid er 4-azaandrost-1-en-17-carboxamid, N-(1,1-dimethylethyl)-3-oxo-,(5α,17ß)-. Den empiriske formel for finasterid er C23H36N2O2 og dens molekylvægt er 372,55. Dens strukturformel er:
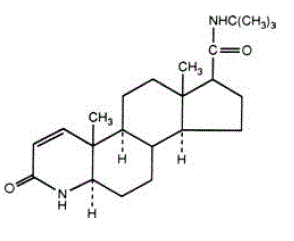
Finasteride er et hvidt krystallinsk pulver med et smeltepunkt nær 250°C. Det er frit opløseligt i chloroform og i opløsningsmidler med lavere alkohol, men er praktisk talt uopløseligt i vand.
PROSCAR (finasterid) tabletter til oral administration er filmovertrukne tabletter, der indeholder 5 mg finasterid og følgende inaktive ingredienser: vandholdig lactose, mikrokrystallinsk cellulose, prægelatineret stivelse, natriumstivelsesglycolat, hydroxypropylcellulose LF, hydroxypropylmethylcellulose, titaniumdioxid, magnesiumstearat , talkum, docusate natrium, FD&C Blue 2 aluminium lake og gul jernoxid.
INDIKATIONER
Monoterapi
PROSCAR® er indiceret til behandling af symptomatisk benign prostatahyperplasi (BPH) hos mænd med en forstørret prostata til:
- Forbedre symptomer
- Reducer risikoen for akut urinretention
- Reducer risikoen for behovet for operation, herunder transurethral resektion af prostata (TURP) og prostatektomi.
Kombination med Alpha-Blocker
PROSCAR 5mg administreret i kombination med alfa-blokkeren doxazosin er indiceret til at reducere risikoen for symptomatisk progression af BPH (en bekræftet ≥4 point stigning i American Urological Association (AUA) symptomscore).
Brugsbegrænsninger
PROSCAR er ikke godkendt til forebyggelse af prostatacancer.
DOSERING OG ADMINISTRATION
PROSCAR kan administreres med eller uden måltider.
Monoterapi
Den anbefalede dosis af PROSCAR er én tablet (5 mg) taget én gang dagligt [se Kliniske Studier ].
Kombination med Alpha-Blocker
Den anbefalede dosis af PROSCAR er én tablet (5 mg) taget én gang dagligt i kombination med alfa-blokkeren doxazosin [se Kliniske Studier ].
HVORDAN LEVERET
Doseringsformer og styrker
5-mg blå, modificerede æbleformede, filmovertrukne tabletter med koden MSD 72 på den ene side og PROSCAR 5mg på den anden.
Opbevaring og håndtering
nr. 3094 - PROSCAR tabletter 5 mg er blå, modificerede æbleformede, filmovertrukne tabletter med koden MSD 72 på den ene side og PROSCAR på den anden. De leveres som følger:
NDC 0006-0072-31 flasker med 30 brugsenheder NDC 0006-0072-58 flasker med 100 brugsenheder.
Opbevaring og håndtering
Opbevares ved stuetemperatur under 30°C (86°F). Beskyt mod lys og hold beholderen tæt lukket.
Kvinder bør ikke håndtere knuste eller ødelagte PROSCAR 5 mg tabletter, når de er gravide eller potentielt kan være gravide på grund af muligheden for absorption af finasterid og den efterfølgende potentielle risiko for et mandligt foster [se ADVARSLER OG FORHOLDSREGLER  og Brug i specifikke populationer ].
Distribueret af: Merck Sharp & Dohme Corp., et datterselskab af MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revideret: juni 2021
BIVIRKNINGER
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan frekvenser af bivirkninger observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
4-årig placebokontrolleret undersøgelse (PLESS)
I PLESS blev 1524 patienter behandlet med PROSCAR og 1516 patienter behandlet med placebo vurderet for sikkerhed over en periode på 4 år. De hyppigst rapporterede bivirkninger var relateret til seksuel funktion. 3,7 % (57 patienter) behandlet med PROSCAR 5 mg og 2,1 % (32 patienter) behandlet med placebo afbrød behandlingen som følge af bivirkninger relateret til seksuel funktion, som er de hyppigst rapporterede bivirkninger.
Tabel 1 viser de eneste kliniske bivirkninger, der anses for muligvis, sandsynligvis eller helt sikkert lægemiddelrelaterede af investigator, for hvilke incidensen på PROSCAR 5mg var ≥1 % og større end placebo i løbet af de 4 år af undersøgelsen. I studiets år 2-4 var der ingen signifikant forskel mellem behandlingsgrupperne i forekomsten af impotens, nedsat libido og ejakulationsforstyrrelser.
Fase III-studier og 5-årige åbne forlængelser
Bivirkningsprofilen i de 1-årige, placebokontrollerede, fase III-studier, de 5-årige åbne forlængelser og PLESS var ens.
Medicinsk behandling af prostatasymptomer (MTOPS) undersøgelse
I MTOPS-studiet blev 3047 mænd med symptomatisk BPH randomiseret til at modtage PROSCAR 5 mg/dag (n=768), doxazosin 4 eller 8 mg/dag (n=756), kombinationen af PROSCAR 5 mg/dag og doxazosin 4 eller 8 mg/dag (n=786) eller placebo (n=737) i 4 til 6 år. [Se Kliniske Studier .]
Hyppigheden af lægemiddelrelaterede bivirkninger rapporteret af ≥2 % af patienterne i enhver behandlingsgruppe i MTOPS-undersøgelsen er angivet i tabel 2.
De individuelle bivirkninger, der forekom hyppigere i kombinationsgruppen sammenlignet med begge lægemidler alene, var: asteni, postural hypotension, perifert ødem, svimmelhed, nedsat libido, rhinitis, unormal ejakulation, impotens og unormal seksuel funktion (se tabel 2). Af disse var forekomsten af unormal ejakulation hos patienter, der fik kombinationsbehandling, sammenlignelig med summen af forekomsten af denne uønskede oplevelse rapporteret for de to monoterapier.
Kombinationsbehandling med finasterid og doxazosin var forbundet med ingen nye kliniske bivirkninger.
Fire patienter i MTOPS rapporterede den negative oplevelse af brystkræft. Tre af disse patienter fik kun finasterid, og én var i kombinationsbehandling. [Se Langsigtede data .]
MTOPS-undersøgelsen var ikke specifikt designet til at foretage statistiske sammenligninger mellem grupper for rapporterede uønskede oplevelser. Derudover er direkte sammenligninger af sikkerhedsdata mellem MTOPS-studiet og tidligere undersøgelser af de enkelte midler muligvis ikke passende baseret på forskelle i patientpopulation, dosis eller dosisregime og andre proceduremæssige og undersøgelsesdesignelementer.
Langsigtede data
Højgradig prostatakræft
PCPT-studiet var et 7-årigt randomiseret, dobbelt-blindt, placebokontrolleret forsøg, der inkluderede 18.882 mænd ≥55 år med en normal digital rektal undersøgelse og en PSA ≤3,0 ng/ml. Mænd fik enten PROSCAR (finasterid 5 mg) eller placebo dagligt. Patienterne blev evalueret årligt med PSA og digitale rektale undersøgelser. Biopsier blev udført for forhøjet PSA, en unormal digital rektalundersøgelse eller afslutningen af undersøgelsen. Hyppigheden af Gleason score 8-10 prostatacancer var højere hos mænd behandlet med finasterid (1,8 %) end hos dem behandlet med placebo (1,1 %) [se INDIKATIONER  og ADVARSLER OG FORHOLDSREGLER ]. I et 4-årigt placebokontrolleret klinisk forsøg med en anden 5α-reduktasehæmmer (dutasterid, AVODART) blev der observeret lignende resultater for Gleason score 8-10 prostatacancer (1 % dutasterid vs. 0,5 % placebo).
Der er ikke påvist nogen klinisk fordel hos patienter med prostatacancer behandlet med PROSCAR.
Brystkræft
løbet af det 4-6-årige placebo- og komparatorkontrollerede MTOPS-studie, der inkluderede 3047 mænd, var der 4 tilfælde af brystkræft hos mænd behandlet med finasterid, men ingen tilfælde hos mænd, der ikke blev behandlet med finasterid. I løbet af det 4-årige, placebokontrollerede PLESS-studie, der indskrev 3040 mænd, var der 2 tilfælde af brystkræft hos placebo-behandlede mænd, men ingen tilfælde hos mænd behandlet med finasterid. I løbet af det 7-årige placebokontrollerede prostatacancerforebyggende forsøg (PCPT), der omfattede 18.882 mænd, var der 1 tilfælde af brystkræft hos mænd behandlet med finasterid og 1 tilfælde af brystkræft hos mænd behandlet med placebo. Forholdet mellem langvarig brug af finasterid og mandlig bryst neoplasi er i øjeblikket ukendt.
Seksuel funktion
Der er ingen tegn på øgede seksuelle bivirkninger med forlænget behandlingsvarighed med PROSCAR. Nye rapporter om lægemiddelrelaterede seksuelle bivirkninger faldt med behandlingens varighed.
Postmarketing oplevelse
Følgende yderligere bivirkninger er blevet rapporteret efter markedsføring med PROSCAR. Fordi disse hændelser rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering:
- overfølsomhedsreaktioner, såsom kløe, nældefeber og angioødem (inklusive hævelse af læber, tunge, svælg og ansigt)
- testikelsmerter
- hæmatospermi
- seksuel dysfunktion, der fortsatte efter seponering af behandlingen, herunder erektil dysfunktion, nedsat libido og ejakulationsforstyrrelser (f.eks. reduceret ejakulatvolumen). Disse hændelser blev sjældent rapporteret hos mænd, der tog PROSCAR til behandling af BPH. De fleste mænd var ældre og tog samtidig medicin og/eller havde komorbide tilstande. Den uafhængige rolle af PROSCAR 5mg i disse hændelser er ukendt.
- mandlig infertilitet og/eller dårlig sædkvalitet blev sjældent rapporteret hos mænd, der tog PROSCAR 5 mg til behandling af BPH. Normalisering eller forbedring af dårlig sædkvalitet er blevet rapporteret efter seponering af finasterid. PROSCARs uafhængige rolle i disse begivenheder er ukendt.
- depression
- mandlig brystkræft.
Følgende yderligere uønskede hændelse relateret til seksuel dysfunktion, som fortsatte efter seponering af behandlingen, er blevet rapporteret i postmarketingerfaringer med finasterid i lavere doser til behandling af skaldethed hos mænd. Fordi hændelsen rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at estimere dens hyppighed pålideligt eller etablere en årsagssammenhæng til lægemiddeleksponering:
- orgasme lidelser
DRUGSINTERAKTIONER
Cytochrome P450-Linked Drug Metabolizing Enzyme System
Ingen lægemiddelinteraktioner af klinisk betydning er blevet identificeret. Finasterid ser ikke ud til at påvirke det cytochrom P450-forbundne lægemiddelmetaboliserende enzymsystem. Forbindelser, der er blevet testet hos mennesker, har inkluderet antipyrin, digoxin, propranolol, theophyllin og warfarin, og der blev ikke fundet nogen klinisk betydningsfulde interaktioner.
Anden samtidig terapi
Selvom der ikke blev udført specifikke interaktionsundersøgelser, blev PROSCAR 5mg brugt samtidig i kliniske undersøgelser med acetaminophen, acetylsalicylsyre, α-blokkere, angiotensin-konverterende enzym (ACE) hæmmere, analgetika, anti-epileptika, beta-adrenerge blokerende midler, diuretika, calcium kanalblokkere, hjertenitrater, HMG-CoA-reduktasehæmmere, ikke-steroide antiinflammatoriske lægemidler (NSAID), benzodiazepiner, H2Â-antagonister og quinolon-anti-infektionsmidler uden tegn på klinisk signifikante uønskede interaktioner.
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Effekter på prostataspecifikt antigen (PSA) og brugen af PSA til påvisning af prostatakræft
kliniske undersøgelser reducerede PROSCAR serum-PSA-koncentrationen med ca. 50 % inden for seks måneder efter behandlingen. Dette fald er forudsigeligt over hele området af PSA-værdier hos patienter med symptomatisk BPH, selvom det kan variere fra individ til person.
Til fortolkning af serielle PSA'er hos mænd, der tager PROSCAR, bør en ny PSA-baseline etableres mindst seks måneder efter påbegyndelse af behandlingen, og PSA monitoreres periodisk derefter. Enhver bekræftet stigning fra den laveste PSA-værdi under behandling med PROSCAR 5mg kan signalere tilstedeværelsen af prostatacancer og bør evalueres, selvom PSA-niveauerne stadig er inden for det normale område for mænd, der ikke tager en 5α-reduktasehæmmer. Manglende overholdelse af PROSCAR-behandling kan også påvirke PSA-testresultater. For at fortolke en isoleret PSA-værdi hos patienter behandlet med PROSCAR 5mg i seks måneder eller mere, bør PSA-værdier fordobles til sammenligning med normale intervaller hos ubehandlede mænd. Disse justeringer bevarer nytten af PSA til at opdage prostatacancer hos mænd behandlet med PROSCAR.
PROSCAR kan også forårsage fald i serum-PSA i nærvær af prostatacancer.
Forholdet mellem fri og total PSA (procent fri PSA) forbliver konstant selv under påvirkning af PROSCAR. Hvis klinikere vælger at bruge procent fri PSA som en hjælp til påvisning af prostatacancer hos mænd, der gennemgår finasteridbehandling, synes det ikke at være nødvendigt at justere dets værdi.
Øget risiko for højgradig prostatakræft
Mænd på 55 år og derover med en normal digital rektalundersøgelse og PSA ≤3,0 ng/ml ved baseline, der tog finasterid 5 mg/dag i det 7-årige prostatacancerforebyggende forsøg (PCPT) havde en øget risiko for Gleason score 8-10 prostatacancer (finasterid 1,8 % vs placebo 1,1 %). [Se INDIKATIONER  og BIVIRKNINGER .] Lignende resultater blev observeret i et 4-årigt placebokontrolleret klinisk forsøg med en anden 5α-reduktasehæmmer (dutasterid, AVODART) (1 % dutasterid vs. 0,5 % placebo). 5α-reduktasehæmmere kan øge risikoen for udvikling af højgradig prostatacancer. Hvorvidt effekten af 5α-reduktasehæmmere til at reducere prostatavolumen, eller undersøgelsesrelaterede faktorer, påvirkede resultaterne af disse undersøgelser, er ikke blevet fastslået.
Eksponering af kvinder
Risiko for mandligt foster
PROSCAR er kontraindiceret til gravide kvinder og til kvinder, der potentielt kan være gravide og ikke indiceret til brug hos kvinder. Baseret på dyreforsøg og virkningsmekanismen kan PROSCAR 5mg forårsage unormal udvikling af ydre kønsorganer hos et mandligt foster, hvis det administreres til en gravid kvinde. Kvinder, der er gravide eller potentielt kan være gravide, bør ikke håndtere knuste eller ødelagte PROSCAR 5mg tabletter. PROSCAR 5mg tabletter er overtrukket og vil forhindre kontakt med den aktive ingrediens under normal håndtering, forudsat at tabletterne ikke er blevet knust eller knust. Hvis en gravid kvinde kommer i kontakt med knuste eller ødelagte PROSCAR 5mg tabletter, skal kontaktområdet straks vaskes med vand og sæbe. [Se KONTRAINDIKATIONER ,EN Brug i specifikke populationer ,EN KLINISK FARMAKOLOGI , og HVORDAN LEVERET .]
Pædiatriske patienter og kvinder
PROSCAR er ikke indiceret til brug hos pædiatriske patienter [se Brug i specifikke populationer  og KLINISK FARMAKOLOGI ] eller hunner [se også ADVARSLER OG FORHOLDSREGLER ,EN Brug i specifikke populationer ,EN KLINISK FARMAKOLOGI , og HVORDAN LEVERET ].
Effekt på sædkarakteristika
Behandling med PROSCAR i 24 uger for at evaluere sædparametre hos raske mandlige frivillige afslørede ingen klinisk betydningsfulde virkninger på sædkoncentration, mobilitet, morfologi eller pH. Et medianfald på 0,6 ml (22,1 %) i ejakulatvolumen med en samtidig reduktion i den samlede sædcelle pr. ejakulat blev observeret. Disse parametre forblev inden for det normale område og var reversible efter seponering af behandlingen med en gennemsnitlig tid på 84 uger til at vende tilbage til baseline.
Overvejelse af andre urologiske tilstande
Inden påbegyndelse af behandling med PROSCAR 5mg, bør der tages hensyn til andre urologiske tilstande, der kan forårsage lignende symptomer. Derudover kan prostatacancer og BPH eksistere side om side.
Patienter med stort resterende urinvolumen og/eller alvorligt nedsat urinflow bør overvåges nøje for obstruktiv uropati. Disse patienter er muligvis ikke kandidater til finasteridbehandling.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER ).
Øget risiko for højgradig prostatakræft
Patienterne skal informeres om, at der var en stigning i højgradig prostatacancer hos mænd behandlet med 5α-reduktasehæmmere indiceret til BPH-behandling, inklusive PROSCAR 5mg, sammenlignet med dem, der blev behandlet med placebo i undersøgelser, der kiggede på brugen af disse lægemidler til forebyggelse af prostata kræft [se INDIKATIONER ,EN ADVARSLER OG FORHOLDSREGLER , og BIVIRKNINGER ].
Eksponering af kvinder - risiko for mandligt foster
Læger bør informere patienter om, at kvinder, der er gravide eller potentielt kan være gravide, ikke bør håndtere knuste eller ødelagte PROSCAR-tabletter på grund af muligheden for absorption af finasterid og den efterfølgende potentielle risiko for det mandlige foster. PROSCAR tabletter er coatet og vil forhindre kontakt med det aktive stof under normal håndtering, forudsat at tabletterne ikke er blevet knust eller knust. Hvis en kvinde, der er gravid eller potentielt kan være gravid, kommer i kontakt med knuste eller ødelagte PROSCAR-tabletter, skal kontaktområdet straks vaskes med vand og sæbe [se KONTRAINDIKATIONER ,EN ADVARSLER OG FORHOLDSREGLER ,EN Brug i specifikke populationer  og HVORDAN LEVERET ].
Yderligere instruktioner
Læger bør informere patienterne om, at volumen af ejakulat kan være nedsat hos nogle patienter under behandling med PROSCAR. Dette fald ser ikke ud til at forstyrre normal seksuel funktion. Imidlertid kan impotens og nedsat libido forekomme hos patienter behandlet med PROSCAR [se BIVIRKNINGER ].
Læger bør instruere deres patienter om straks at rapportere ændringer i deres bryster, såsom klumper, smerter eller udflåd fra brystvorten. Brystforandringer inklusive brystforstørrelse, ømhed og neoplasmer er blevet rapporteret [se BIVIRKNINGER ].
Læger bør instruere deres patienter i at læse indlægssedlen til patienten, inden behandlingen påbegyndes med PROSCAR 5mg, og genlæse den, hver gang recepten fornyes, så de er opmærksomme på aktuelle informationer til patienter vedrørende PROSCAR.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Der blev ikke observeret tegn på en tumorigen effekt i et 24-måneders studie med Sprague-Dawley-rotter, der fik doser af finasterid på op til 160 mg/kg/dag hos hanner og 320 mg/kg/dag hos hunner. Disse doser gav henholdsvis systemisk eksponering hos rotter på 111 og 274 gange dem, der blev observeret hos mennesker, der fik den anbefalede humane dosis på 5 mg/dag. Alle eksponeringsberegninger var baseret på beregnet AUC(0-24 timer) for dyr og gennemsnitlig AUC(0-24 timer) for mennesker (0,4 μg•time/ml).
et 19-måneders karcinogenicitetsstudie i CD-1-mus blev der observeret en statistisk signifikant (p≤0,05) stigning i forekomsten af testikel-Leydig-celleadenomer ved 228 gange den humane eksponering (250 mg/kg/dag). Hos mus ved 23 gange den humane eksponering, estimeret (25 mg/kg/dag) og hos rotter ved 39 gange den humane eksponering (40 mg/kg/dag), blev der observeret en stigning i forekomsten af Leydig-cellehyperplasi. En positiv sammenhæng mellem de proliferative ændringer i Leydig-cellerne og en stigning i serum-LH-niveauer (2-3 gange over kontrol) er blevet påvist i begge gnaverarter behandlet med høje doser finasterid. Der blev ikke set lægemiddelrelaterede Leydig-celleforandringer hos hverken rotter eller hunde behandlet med finasterid i 1 år ved 30 og 350 gange (henholdsvis 20 mg/kg/dag og 45 mg/kg/dag) eller hos mus behandlet i 19 måneder kl. 2,3 gange den menneskelige eksponering, estimeret (2,5 mg/kg/dag).
Mutagenese
Der blev ikke observeret tegn på mutagenicitet i et in vitro bakteriel mutageneseassay, et pattedyrcellemutageneseassay eller i et in vitro alkalisk elueringsassay. I et in vitro-kromosomafvigelsesassay, ved brug af kinesisk hamster-ovarieceller, var der en lille stigning i kromosomafvigelser. Disse koncentrationer svarer til 4000-5000 gange de maksimale plasmaniveauer hos mennesker givet en total dosis på 5 mg. I et in vivo-kromosomafvigelsesassay hos mus blev der ikke observeret nogen behandlingsrelateret stigning i kromosomafvigelser med finasterid ved den maksimalt tolererede dosis på 250 mg/kg/dag (228 gange den humane eksponering) som bestemt i carcinogenicitetsundersøgelserne.
Forringelse af fertilitet
Hos seksuelt modne hankaniner behandlet med finasterid ved 543 gange den humane eksponering (80 mg/kg/dag) i op til 12 uger, sås ingen effekt på fertilitet, sædtal eller ejakulatvolumen. Hos seksuelt modne hanrotter behandlet med 61 gange den humane eksponering (80 mg/kg/dag), var der ingen signifikant effekt på fertiliteten efter 6 eller 12 ugers behandling; men når behandlingen blev fortsat i op til 24 eller 30 uger, var der et tilsyneladende fald i fertilitet, frugtbarhed og et associeret signifikant fald i vægten af sædblærerne og prostata. Alle disse virkninger var reversible inden for 6 uger efter seponering af behandlingen. Der er ikke set nogen lægemiddelrelateret effekt på testikler eller på parringsydelse hos rotter eller kaniner. Dette fald i fertilitet hos finasterid-behandlede rotter er sekundært til dets virkning på accessoriske kønsorganer (prostata og sædblærer), hvilket resulterer i manglende dannelse af en sædprop. Sædproppen er afgørende for normal fertilitet hos rotter og er ikke relevant hos mennesker.
Brug i specifikke populationer
Graviditet
Risikooversigt
PROSCAR er kontraindiceret til gravide kvinder og ikke indiceret til brug hos kvinder. Baseret på dyreforsøg og virkningsmekanismen kan PROSCAR 5mg forårsage unormal udvikling af ydre kønsorganer hos et mandligt foster, hvis det administreres til en gravid kvinde [se ADVARSLER OG FORHOLDSREGLER  og KLINISK FARMAKOLOGI ].
I et embryo-føtalt udviklingsstudie hos rotter var der en dosisafhængig stigning i hypospadier, som forekom hos 3,6 til 100 % af hanafkom af gravide rotter, der fik oralt finasterid i perioden med større organogenese i doser på ca. 0,1 til 86 gange maksimum anbefalet human dosis (MRHD) på 5 mg/dag (baseret på AUC ved dyredoser på 0,1 til 100 mg/kg/dag).
Nedsat prostata- og sædvesikulære vægte, forsinket præputial separation og forbigående brystvorteudvikling blev også observeret hos mandlige afkom ved orale maternelle doser ca. 0,03 gange MRHD (baseret på AUC ved dyredosis på 0,03 mg/kg/dag) sammen med nedsat anogenital afstand hos mandlige afkom ved orale maternelle doser ca. 0,003 gange MRHD (baseret på AUC ved dyredosis på 0,003 mg/kg/dag).
PROSCAR er en Type II 5α-reduktasehæmmer, der forhindrer omdannelse af testosteron til 5α-dihydrotestosteron (DHT), et hormon, der er nødvendigt for normal udvikling af mandlige kønsorganer. Hvis dette lægemiddel bruges under graviditet, eller hvis patienten bliver gravid, mens han tager dette lægemiddel, skal patienten informeres om den potentielle fare for det mandlige foster.
Unormal mandlig genital udvikling er en forventet konsekvens, når omdannelse af testosteron til 5α-dihydrotestosteron (DHT) hæmmes af 5α-reduktasehæmmere. Disse resultater ligner dem, der er rapporteret hos mandlige spædbørn med genetisk 5α-reduktase-mangel. Hunnerne kan blive udsat for finasterid ved kontakt med knuste eller ødelagte PROSCAR-tabletter eller sæd fra en mandlig partner, der tager PROSCAR. Med hensyn til finasterideksponering gennem huden er PROSCAR 5mg tabletter coatede og vil forhindre hudkontakt med finasterid under normal håndtering, hvis tabletterne ikke er blevet knust eller knust. Kvinder, der er gravide eller potentielt kan være gravide, bør ikke håndtere knuste eller ødelagte PROSCAR 5mg tabletter på grund af mulig eksponering af et mandligt foster. Med hensyn til potentiel finasterideksponering gennem sæd er der udført tre undersøgelser, der målte finasteridkoncentrationer i sæd hos mænd, der fik PROSCAR 5 mg/dag. I disse undersøgelser blev den højeste mængde finasterid i sæd estimeret til at være 50 til 100 gange mindre end dosen af finasterid (5 μg), som ikke havde nogen effekt på cirkulerende DHT-niveauer hos mænd [se Data  og KLINISK FARMAKOLOGI ].
Data
Menneskelige data
2 undersøgelser af raske forsøgspersoner (n=69), der fik PROSCAR 5 mg/dag i 6-24 uger, varierede finasteridkoncentrationerne i sæden fra uopdagelige ( KLINISK FARMAKOLOGI ].
Dyredata
en embryo-føtal udviklingsundersøgelse fik gravide rotter finasterid i perioden med større organogenese (drægtighedsdage 6 til 17). Ved moderdoser af oralt finasterid ca. 0,1 til 86 gange den maksimalt anbefalede humane dosis (MRHD) på 5 mg/dag (baseret på AUC ved dyredoser på 0,1 til 100 mg/kg/dag) var der en dosisafhængig stigning i hypospadier der forekom hos 3,6 til 100 % af mandlige afkom. Eksponeringsmultipler blev estimeret ved hjælp af data fra ikke-gravide rotter. Dage 16 til 17 af drægtighed er en kritisk periode i føtale hanrotter for differentiering af de ydre kønsorganer. Ved orale maternelle doser ca. 0,03 gange MRHD (baseret på AUC ved dyredosis på 0,03 mg/kg/dag) havde mandlige afkom nedsat prostata- og sædvesikulær vægt, forsinket præputial separation og forbigående brystvorteudvikling. Nedsat anogenital afstand forekom hos han-afkom af drægtige rotter, der modtog ca. 0,003 gange MRHD (baseret på AUC ved dyredosis på 0,003 mg/kg/dag). Der blev ikke observeret nogen abnormiteter hos kvindelige afkom ved nogen maternal dosis af finasterid.
Der blev ikke observeret udviklingsmæssige abnormiteter hos afkommet af ubehandlede hunner parret med finasteridbehandlede hanrotter, som modtog ca. 61 gange MRHD (baseret på AUC ved en dyredosis på 80 mg/kg/dag). Lidt nedsat fertilitet blev observeret hos han-afkom efter administration af ca. 3 gange MRHD (baseret på AUC ved dyredosis på 3 mg/kg/dag) til hunrotter under sen drægtighed og laktation. Der blev ikke set nogen virkninger på fertiliteten hos kvindelige afkom under disse forhold.
Der blev ikke observeret tegn på ydre mandlige genitale misdannelser eller andre abnormiteter hos kaninfostre, der blev eksponeret for finasterid i perioden med større organogenese (drægtighedsdage 6-18) ved orale doser op til 100 mg/kg/dag hos moderen (eksponeringsniveauer for finasterid var ikke målt i kaniner). Imidlertid har denne undersøgelse muligvis ikke inkluderet den kritiske periode for finasteride-effekter på udviklingen af hankøns ydre kønsorganer hos kaninen.
De føtale virkninger af maternal finasterideksponering i perioden med embryonal og føtal udvikling blev evalueret hos rhesus-aben (drægtighedsdage 20-100), i en art og udviklingsperiode, der er mere forudsigelig for specifikke virkninger hos mennesker end studierne med rotter og kaniner. Intravenøs administration af finasterid til gravide aber i doser så høje som 800 ng/dag (estimeret maksimal blodkoncentration på 1,86 ng/ml eller ca. 143 gange den højeste estimerede eksponering af gravide kvinder for finasterid fra sæd fra mænd, der tog 5 mg/dag) resulterede i i ingen abnormiteter hos mandlige fostre. Som bekræftelse af relevansen af rhesus-modellen for menneskelig føtal udvikling, oral administration af en dosis finasterid (2 mg/kg/dag eller ca. 18.000 gange de højeste estimerede blodniveauer af finasterid fra sæd fra mænd, der tager 5 mg/dag) til gravide aber resulterede i eksterne genitale abnormiteter hos hanfostre. Der blev ikke observeret andre abnormiteter hos mandlige fostre, og ingen finasterid-relaterede abnormiteter blev observeret hos kvindelige fostre ved nogen dosis.
Amning
Risikooversigt
PROSCAR er ikke indiceret til brug hos kvinder.
Hunner og mænd med reproduktionspotentiale
Infertilitet
Kvinder
PROSCAR er ikke indiceret til brug hos kvinder.
Hanner
Behandling med PROSCAR i 24 uger for at evaluere sædparametre hos raske mandlige frivillige afslørede ingen klinisk betydningsfulde virkninger på sædkoncentration, mobilitet, morfologi eller pH. Et medianfald på 0,6 ml (22,1 %) i ejakulatvolumen med en samtidig reduktion i den samlede sædcelle pr. ejakulat blev observeret. Disse parametre forblev inden for det normale område og var reversible ved seponering af behandlingen med en gennemsnitlig tid til at vende tilbage til baseline på 84 uger [se ADVARSLER OG FORHOLDSREGLER ].
Der har efter markedsføring været rapporter om mandlig infertilitet og/eller dårlig sædkvalitet; normalisering eller forbedring af sædkvaliteten er blevet rapporteret efter seponering af finasterid [se BIVIRKNINGER ].
Pædiatrisk brug
PROSCAR 5mg er ikke indiceret til brug hos pædiatriske patienter.
Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Af det samlede antal forsøgspersoner inkluderet i PLESS var 1480 og 105 forsøgspersoner henholdsvis 65 og derover og 75 og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse forsøgspersoner og yngre forsøgspersoner, og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter. Ingen dosisjustering er nødvendig hos ældre [se KLINISK FARMAKOLOGI  og Kliniske Studier ].
Nedsat leverfunktion
Der bør udvises forsigtighed ved administration af PROSCAR til patienter med leverfunktionsabnormiteter, da finasterid metaboliseres i udstrakt grad i leveren [se KLINISK FARMAKOLOGI ].
Nedsat nyrefunktion
Dosisjustering er ikke nødvendig hos patienter med nedsat nyrefunktion [se KLINISK FARMAKOLOGI ].
OVERDOSIS
Patienter har modtaget enkeltdoser af PROSCAR 5 mg op til 400 mg og flere doser af PROSCAR 5 mg op til 80 mg/dag i tre måneder uden bivirkninger. Indtil yderligere erfaring er opnået, kan ingen specifik behandling for en overdosis med PROSCAR anbefales.
Signifikant dødelighed blev observeret hos han- og hunmus ved enkelt orale doser på 1500 mg/m2 (500 mg/kg) og hos hun- og hanrotter ved enkelt orale doser på 2360 mg/m2 (400 mg/kg) og 5900 mg/m2 (henholdsvis 1000 mg/kg).
KONTRAINDIKATIONER
PROSCAR er kontraindiceret i følgende:
- Overfølsomhed over for enhver komponent i denne medicin.
- Graviditet. Brug af Finasteride er kontraindiceret hos kvinder, når de er eller potentielt kan være gravide. På grund af type II 5α-reduktasehæmmeres evne til at hæmme omdannelsen af testosteron til 5α-dihydrotestosteron (DHT), kan finasterid forårsage abnormiteter i de ydre kønsorganer hos et mandligt foster hos en gravid kvinde, der får finasterid. Hvis dette lægemiddel bruges under graviditet, eller hvis graviditet opstår, mens du tager dette lægemiddel, skal den gravide kvinde informeres om den potentielle fare for det mandlige foster. [Se også ADVARSLER OG FORHOLDSREGLER ,EN Brug i specifikke populationer , og HVORDAN LEVERET .] Hos hunrotter har lave doser af finasterid administreret under graviditeten frembragt abnormiteter i de ydre kønsorganer hos hanafkom.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Udviklingen og udvidelsen af prostatakirtlen er afhængig af det potente androgen, 5α-dihydrotestosteron (DHT). Type II 5α-reduktase metaboliserer testosteron til DHT i prostatakirtlen, leveren og huden. DHT inducerer androgene virkninger ved at binde sig til androgenreceptorer i disse organers cellekerner.
Finasteride er en kompetitiv og specifik inhibitor af Type II 5α-reduktase, hvormed det langsomt danner et stabilt enzymkompleks. Omsætningen fra dette kompleks er ekstremt langsom (t½ ∼ 30 dage). Dette er blevet demonstreret både in vivo og in vitro. Finasterid har ingen affinitet for androgenreceptoren. Hos mennesker er de 5α-reducerede steroidmetabolitter i blod og urin nedsat efter administration af finasterid.
Farmakodynamik
Hos mennesker giver en enkelt 5 mg oral dosis af PROSCAR en hurtig reduktion i serum-DHT-koncentrationen, med den maksimale effekt observeret 8 timer efter den første dosis. Undertrykkelsen af DHT opretholdes i hele 24-timers doseringsintervallet og med fortsat behandling. Daglig dosering af PROSCAR på 5 mg/dag i op til 4 år har vist sig at reducere serum-DHT-koncentrationen med ca. 70%. Det mediane cirkulerende niveau af testosteron steg med ca. 10-20%, men forblev inden for det fysiologiske område. I en separat undersøgelse med raske mænd behandlet med finasterid 1 mg dagligt (n=82) eller placebo (n=69), var de gennemsnitlige cirkulerende niveauer af testosteron og østradiol øget med ca. 15 % sammenlignet med baseline, men disse forblev inden for fysiologisk rækkevidde.
Hos patienter, der fik PROSCAR 5 mg/dag, blev der observeret stigninger på ca. 10 % i luteiniserende hormon (LH) og follikelstimulerende hormon (FSH), men niveauerne forblev inden for det normale område. Hos raske frivillige ændrede behandling med PROSCAR 5mg ikke responsen af LH og FSH på gonadotropinfrigivende hormon, hvilket indikerer, at hypothalamus-hypofyse-testikelaksen ikke var påvirket.
Hos patienter med BPH har PROSCAR ingen effekt på cirkulerende niveauer af cortisol, prolaktin, thyreoidea-stimulerende hormon eller thyroxin. Der blev ikke observeret nogen klinisk betydningsfuld effekt på plasmalipidprofilen (dvs. totalt kolesterol, lavdensitetslipoproteiner, højdensitetslipoproteiner og triglycerider) eller knoglemineraltæthed.
Voksne mænd med genetisk arvelig type II 5α-reduktase-mangel har også nedsatte niveauer af DHT. Bortset fra de associerede urogenitale defekter, der er til stede ved fødslen, er der ikke observeret andre kliniske abnormiteter relateret til type II 5α-reduktasemangel hos disse personer. Disse personer har en lille prostata gennem hele livet og udvikler ikke BPH.
Hos patienter med BPH behandlet med finasterid (1-100 mg/dag) i 7-10 dage før prostatektomi, blev der målt et ca. 80 % lavere DHT-indhold i prostatavæv fjernet ved operation sammenlignet med placebo; testosteronvævskoncentrationen var øget op til 10 gange i forhold til niveauerne før behandling i forhold til placebo. Intraprostatisk indhold af PSA var også faldet.
Hos raske mandlige frivillige, der blev behandlet med PROSCAR 5 mg i 14 dage, resulterede afbrydelse af behandlingen i en tilbagevenden af DHT-niveauerne til niveauerne før behandlingen i løbet af ca. 2 uger. Hos patienter behandlet i tre måneder vendte prostatavolumen, som faldt med ca. 20 %, tilbage til tæt på baselineværdien efter ca. tre måneders seponering af behandlingen.
Farmakokinetik
Absorption
I en undersøgelse af 15 raske unge forsøgspersoner var den gennemsnitlige biotilgængelighed af finasterid 5 mg tabletter 63 % (interval 34-108 %), baseret på forholdet mellem arealet under kurven (AUC) i forhold til en intravenøs (IV) referencedosis . Den maksimale plasmakoncentration af finasterid var i gennemsnit 37 ng/ml (interval, 27-49 ng/ml) og blev nået 1-2 timer efter dosis. Biotilgængeligheden af finasterid blev ikke påvirket af mad.
Fordeling
Gennemsnitligt steady-state distributionsvolumen var 76 liter (interval, 44-96 liter). Ca. 90 % af det cirkulerende finasterid er bundet til plasmaproteiner. Der er en langsom akkumuleringsfase for finasterid efter gentagen dosering. Efter dosering med 5 mg/dag finasterid i 17 dage var plasmakoncentrationerne af finasterid 47 og 54 % højere end efter den første dosis hos mænd 45-60 år (n=12) og ≥70 år (n=12) , henholdsvis. Gennemsnitlige dalkoncentrationer efter 17 dages dosering var henholdsvis 6,2 ng/ml (interval, 2,49,8 ng/ml) og 8,1 ng/ml (interval, 1,8-19,7 ng/ml) i de to aldersgrupper. Selvom steady state ikke blev nået i denne undersøgelse, var den gennemsnitlige laveste plasmakoncentration i et andet studie hos patienter med BPH (gennemsnitsalder 65 år), der fik 5 mg/dag, 9,4 ng/ml (interval, 7,1-13,3 ng/ml; n= 22) efter mere end et års dosering.
Finasterid har vist sig at krydse blod-hjernebarrieren, men det ser ikke ud til at fordele sig fortrinsvis til CSF.
2 undersøgelser af raske forsøgspersoner (n=69), der fik PROSCAR 5 mg/dag i 6-24 uger, varierede finasteridkoncentrationerne i sæden fra uopdagelige ( Brug i specifikke populationer ].
Metabolisme
Finasterid metaboliseres i vid udstrækning i leveren, primært via cytochrom P450 3A4 enzymunderfamilien. To metabolitter, t-butyl-sidekæde-monohydroxylerede og monocarboxylsyremetabolitter, er blevet identificeret, som ikke besidder mere end 20 % af finasterids 5α-reduktasehæmmende aktivitet.
Udskillelse
Hos raske unge forsøgspersoner (n=15) var den gennemsnitlige plasmaclearance af finasterid 165 ml/min (interval, 70279 ml/min), og den gennemsnitlige eliminationshalveringstid i plasma var 6 timer (interval, 3-16 timer). Efter en oral dosis af 14C-finasterid til mennesker (n=6) blev et gennemsnit på 39 % (interval, 32-46 %) af dosis udskilt i urinen i form af metabolitter; 57 % (interval, 51-64 %) blev udskilt i fæces.
Den gennemsnitlige terminale halveringstid for finasterid hos forsøgspersoner ≥70 år var ca. 8 timer (interval, 6-15 timer; n=12), sammenlignet med 6 timer (interval, 4-12 timer; n=12) hos forsøgspersoner 45-60 år. Som følge heraf var den gennemsnitlige AUC(0-24 timer) efter 17 dages dosering 15 % højere hos forsøgspersoner ≥70 år end hos forsøgspersoner i alderen 45-60 år (p=0,02).
Pædiatrisk
Finasterids farmakokinetik er ikke blevet undersøgt hos patienter
Finasteride er ikke indiceret til brug hos pædiatriske patienter [se ADVARSLER OG FORHOLDSREGLER ,EN Brug i specifikke populationer ].
Køn
Finasteride er ikke indiceret til brug hos kvinder [se KONTRAINDIKATIONER ,EN ADVARSLER OG FORHOLDSREGLER ,EN Brug i specifikke populationer , og HVORDAN LEVERET ].
Geriatrisk
Dosisjustering er ikke nødvendig hos ældre. Selvom eliminationshastigheden af finasterid er nedsat hos ældre, er disse fund uden klinisk betydning. [Se Farmakokinetik  og Brug i specifikke populationer .]
Race
Effekten af race på finasterids farmakokinetik er ikke blevet undersøgt.
Nedsat leverfunktion
Virkningen af nedsat leverfunktion på finasterids farmakokinetik er ikke blevet undersøgt. Der bør udvises forsigtighed ved administration af PROSCAR 5mg til patienter med leverfunktionsabnormiteter, da finasterid metaboliseres omfattende i leveren. Nedsat nyrefunktion
Dosisjustering er ikke nødvendig hos patienter med nedsat nyrefunktion. Hos patienter med kronisk nedsat nyrefunktion, med kreatininclearance i området fra 9,0 til 55 ml/min, svarede AUC, maksimal plasmakoncentration, halveringstid og proteinbinding efter en enkelt dosis 14C-finasterid til værdier opnået hos raske frivillige. Urinudskillelse af metabolitter var nedsat hos patienter med nedsat nyrefunktion. Dette fald var forbundet med en stigning i fækal udskillelse af metabolitter. Plasmakoncentrationer af metabolitter var signifikant højere hos patienter med nedsat nyrefunktion (baseret på en 60 % stigning i total radioaktivitet AUC). Finasterid er dog blevet godt tolereret hos BPH-patienter med normal nyrefunktion, der fik op til 80 mg/dag i 12 uger, hvor eksponeringen af disse patienter for metabolitter formodentlig ville være meget større.
Kliniske Studier
Monoterapi
PROSCAR 5 mg/dag blev oprindeligt evalueret hos patienter med symptomer på BPH og forstørret prostata ved digital rektal undersøgelse i to 1-årige, placebokontrollerede, randomiserede, dobbeltblinde undersøgelser og deres 5-årige åbne forlængelser.
PROSCAR 5mg blev yderligere evalueret i PROSCAR Long-Term Efficacy and Safety Study (PLESS), et dobbeltblindt, randomiseret, placebokontrolleret, 4-årigt multicenterstudie. 3040 patienter mellem 45 og 78 år, med moderate til svære symptomer på BPH og forstørret prostata ved digital rektal undersøgelse, blev randomiseret til undersøgelsen (1524 til finasterid, 1516 til placebo), og 3016 patienter kunne evalueres for effektivitet. 1883 patienter gennemførte det 4-årige studie (1000 i finasteridgruppen, 883 i placebogruppen).
Effekt på symptomscore
Symptomerne blev kvantificeret ved hjælp af en score svarende til American Urological Association Symptom Score, som evaluerede både obstruktive symptomer (forringelse af størrelse og kraft af strøm, fornemmelse af ufuldstændig blæretømning, forsinket eller afbrudt vandladning) og irritative symptomer (nokturi, dagtimers frekvens, behov at belaste eller skubbe urinstrømmen) ved at vurdere på en skala fra 0 til 5 for seks symptomer og en skala fra 0 til 4 for et symptom, for en samlet mulig score på 34.
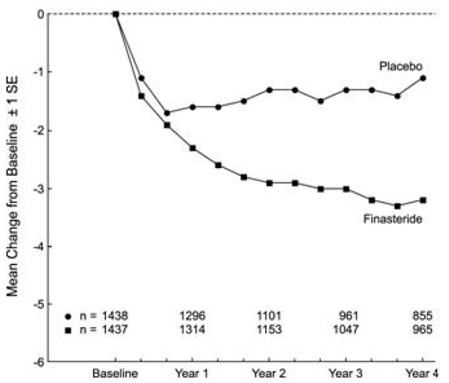
Patienter i PLESS havde moderate til svære symptomer ved baseline (gennemsnit på ca. 15 point på en 0-34 point skala). Patienter randomiseret til PROSCAR, som forblev i behandling i 4 år, havde et gennemsnitligt (± 1 SD) fald i symptomscore på 3,3 (± 5,8) point sammenlignet med 1,3 (± 5,6) point i placebogruppen. (Se figur 1.) En statistisk signifikant forbedring i symptomscore var tydelig efter 1 år hos patienter behandlet med PROSCAR vs. placebo (-2,3 vs. -1,6), og denne forbedring fortsatte gennem år 4.
Figur 1 Symptomscore i PLESS
Resultater set i tidligere undersøgelser var sammenlignelige med dem set i PLESS. Selvom en tidlig bedring af urinsymptomer blev set hos nogle patienter, var et terapeutisk forsøg på mindst 6 måneder generelt nødvendigt for at vurdere, om der var opnået en gavnlig respons i symptomlindring. Forbedringen i BPH-symptomer blev set i løbet af det første år og opretholdt gennem yderligere 5 års åbne forlængelsesstudier.
Effekt på akut urinretention og behovet for kirurgi
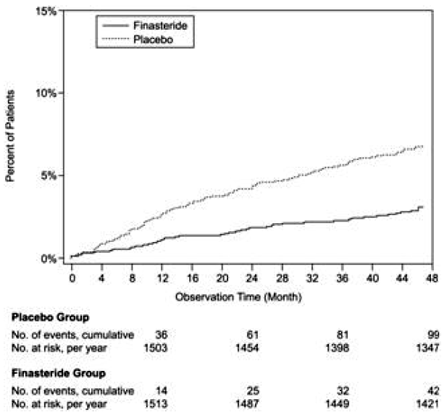
PLESS blev effekten også vurderet ved at evaluere behandlingssvigt. Behandlingssvigt blev prospektivt defineret som BPH-relaterede urologiske hændelser eller klinisk forværring, manglende forbedring og/eller behov for alternativ behandling. BPH-relaterede urologiske hændelser blev defineret som urologisk kirurgisk indgreb og akut urinretention, der krævede kateterisering. Fuldstændig hændelsesinformation var tilgængelig for 92 % af patienterne. Følgende tabel (tabel 5) opsummerer resultaterne.
Sammenlignet med placebo var PROSCAR forbundet med en signifikant lavere risiko for akut urinretention eller behov for BPH-relateret kirurgi [13,2 % for placebo mod 6,6 % for PROSCAR; 51 % reduktion i risiko, 95 % CI: (34 til 63 %)]. Sammenlignet med placebo var PROSCAR 5 mg forbundet med en signifikant lavere risiko for operation [10,1 % for placebo mod 4,6 % for PROSCAR; 55 % reduktion i risiko, 95 % CI: (37 til 68 %)] og med en signifikant lavere risiko for akut urinretention [6,6 % for placebo mod 2,8 % for PROSCAR; 57 % reduktion i risiko, 95 % CI: (34 til 72 %)]; se figur 2 og 3.
Figur 2 Procent af patienter, der blev opereret for BPH, inklusive TURP
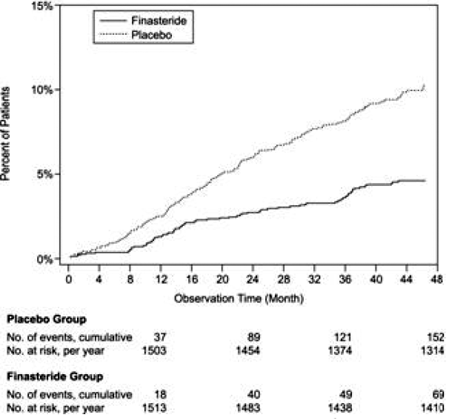
Figur 3 Procent af patienter, der udvikler akut urinretention (spontan og udfældet)
Effekt på maksimal urinstrømshastighed
Hos patienterne i PLESS, som forblev i behandling under undersøgelsens varighed og havde evaluerbare urinstrømsdata, øgede PROSCAR 5mg den maksimale urinstrømshastighed med 1,9 ml/sek. sammenlignet med 0,2 ml/sek. i placebogruppen.
Der var en klar forskel mellem behandlingsgrupperne i maksimal urinstrømshastighed til fordel for PROSCAR 5 mg efter 4. måned (1,0 vs. 0,3 ml/sek.), som blev opretholdt gennem hele undersøgelsen. I de tidligere 1-årige undersøgelser var stigningen i maksimal urinstrømshastighed sammenlignelig med PLESS og blev opretholdt gennem det første år og gennem yderligere 5 års åbne forlængelsesstudier.
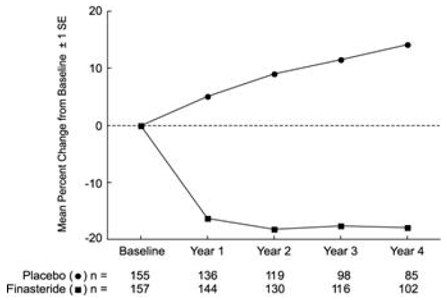
Effekt på prostatavolumen
PLESS blev prostatavolumen vurderet årligt ved magnetisk resonansbilleddannelse (MRI) hos en undergruppe af patienter. Hos patienter behandlet med PROSCAR 5mg, som forblev i behandling, blev prostatavolumen reduceret sammenlignet med både baseline og placebo gennem hele det 4-årige studie. PROSCAR reducerede prostatavolumen med 17,9 % (fra 55,9 cc ved baseline til 45,8 cc efter 4 år) sammenlignet med en stigning på 14,1 % (fra 51,3 cc til 58,5 cc) i placebogruppen (p
Resultater set i tidligere undersøgelser var sammenlignelige med dem set i PLESS. Gennemsnitlig prostatavolumen ved baseline varierede mellem 40-50 cc. Reduktionen i prostatavolumen blev set i løbet af det første år og opretholdt gennem yderligere fem års åbne forlængelsesstudier.
Figur 4 Prostatavolumen i PLESS
Prostatavolumen som en forudsigelse af terapeutisk respons
En metaanalyse, der kombinerede 1-års data fra syv dobbeltblindede, placebokontrollerede undersøgelser af lignende design, inklusive 4491 patienter med symptomatisk BPH, viste, at hos patienter behandlet med PROSCAR, størrelsen af symptomrespons og graden af forbedring i maksimum urinflowhastigheden var større hos patienter med forstørret prostata ved baseline.
Kombination med Alpha-Blocker terapi
The Medical Therapy of Prostatic Symptoms (MTOPS) forsøg var et dobbeltblindt, randomiseret, placebokontrolleret, multicenter, 4-6-årigt studie (gennemsnitligt 5 år) med 3047 mænd med symptomatisk BPH, som blev randomiseret til at modtage PROSCAR 5 mg/dag (n=768), doxazosin 4 eller 8 mg/dag (n=756), kombinationen af PROSCAR 5 mg/dag og doxazosin 4 eller 8 mg/dag (n=786), eller placebo (n=737 ). Alle deltagere gennemgik ugentlig titrering af doxazosin (eller dets placebo) fra 1 til 2 til 4 til 8 mg/dag. Kun dem, der tolererede dosisniveauet på 4 eller 8 mg, blev holdt på doxazosin (eller dets placebo) i undersøgelsen. Deltagerens endelige tolererede dosis (enten 4 mg eller 8 mg) blev administreret fra slutningen af uge 4. Den endelige doxazosin-dosis blev administreret én gang dagligt ved sengetid.
Den gennemsnitlige patientalder ved randomisering var 62,6 år (±7,3 år). Patienterne var kaukasiske (82 %), afroamerikanere (9 %), latinamerikanske (7 %), asiatiske (1 %) eller indianske (
Det primære endepunkt var et sammensat mål for den første forekomst af et af følgende fem udfald: en ≥4 point bekræftet stigning fra baseline i symptomscore, akut urinretention, BPH-relateret nyreinsufficiens (kreatininstigning), tilbagevendende urinvejsinfektioner eller urosepsis eller inkontinens. Sammenlignet med placebo resulterede behandling med PROSCAR 5mg, doxazosin eller kombinationsbehandling i en reduktion i risikoen for at opleve en af disse fem udfaldshændelser med 34 % (p=0,002), 39 % (p
Størstedelen af hændelserne (274 ud af 351; 78 %) var en bekræftet ≥4 point stigning i symptomscore, kaldet symptomscore progression. Risikoen for symptomscore-progression blev reduceret med 30 % (p=0,016), 46 % (p
Figur 5 Kumulativ forekomst af en stigning på 4 point i AUA-symptomscore efter behandlingsgruppe
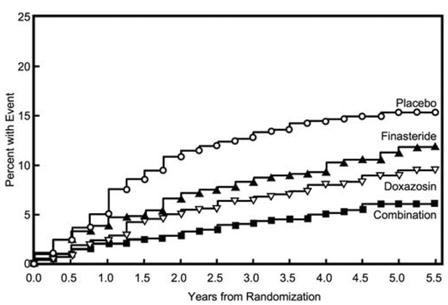
Behandling med PROSCAR 5mg, doxazosin eller kombinationen af PROSCAR med doxazosin reducerede den gennemsnitlige symptomscore fra baseline ved år 4. Tabel 7 viser den gennemsnitlige ændring fra baseline for AUA symptomscore efter behandlingsgruppe for patienter, der forblev i behandling i fire år.
Resultaterne af MTOPS er i overensstemmelse med resultaterne af det 4-årige, placebokontrollerede studie PLESS [se Monoterapi ] i, at behandling med PROSCAR reducerer risikoen for akut urinretention og behovet for BPH-relateret operation. I MTOPS var risikoen for at udvikle akut urinretention reduceret med 67 % hos patienter behandlet med PROSCAR sammenlignet med patienter behandlet med placebo (0,8 % for PROSCAR og 2,4 % for placebo). Desuden blev risikoen for at kræve BPH-relateret invasiv behandling reduceret med 64 % hos patienter behandlet med PROSCAR sammenlignet med patienter behandlet med placebo (2,0 % for PROSCAR 5 mg og 5,4 % for placebo).
Sammenfatning af kliniske undersøgelser
Data fra disse undersøgelser, der viser forbedring i BPH-relaterede symptomer, reduktion i behandlingssvigt (BPH-relaterede urologiske hændelser), øget maksimale urinstrømningshastigheder og faldende prostatavolumen, tyder på, at PROSCAR standser sygdomsprocessen af BPH hos mænd med en forstørret prostata.
PATIENTOPLYSNINGER
Ingen oplysninger angivet. Der henvises til ADVARSLER OG FORHOLDSREGLER afsnit.
