Medicin mod hårtab: Avodart 0.5mg Dutasteride Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Avodart 0,5 mg, og hvordan bruges det?
Avodart 0,5 mg er en receptpligtig medicin, der bruges til at behandle symptomerne på en forstørret prostata (godartet prostatahyperplasi). Avodart kan bruges alene eller sammen med anden medicin.
Avodart 0,5 mg tilhører en klasse af lægemidler kaldet 5-alfa-reduktasehæmmere.
Det vides ikke, om Avodart 0,5 mg er sikkert og effektivt til børn.
Hvad er bivirkninger af Avodart?
Bivirkninger af Avodart 0,5 mg omfatter:
- nældefeber,
- åndedrætsbesvær,
- hævelse i dit ansigt eller hals,
- feber,
- ondt i halsen,
- brændende øjne,
- hudsmerter og
- rødt eller lilla hududslæt med blærer og afskalning
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Avodart 0,5 mg omfatter:
- nedsat libido (sexlyst),
- nedsat mængde sæd, der frigives under sex,
- impotens (besvær med at få eller bevare erektion), og
- ømhed eller forstørrelse af brysterne
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Avodart. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
AVODART 0,5 mg er en syntetisk 4-azasteroidforbindelse, der er en selektiv hæmmer af både type 1 og type 2 isoformerne af steroid 5 alfa-reduktase, et intracellulært enzym, der omdanner testosteron til DHT.
Dutasterid er kemisk betegnet som (5α,17β)-N-{2,5 bis(trifluormethyl)phenyl}-3-oxo-4-azaandrost-1-en-17-carboxamid. Den empiriske formel for dutasterid er C27H30F6N2O2, der repræsenterer en molekylvægt på 528,5 med følgende strukturformel:
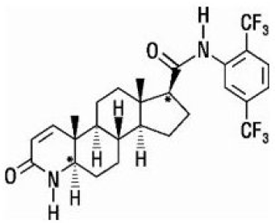
Dutasterid er et hvidt til bleggult pulver med et smeltepunkt på 242° til 250°C. Det er opløseligt i ethanol (44 mg/ml), methanol (64 mg/ml) og polyethylenglycol 400 (3 mg/ml), men det er uopløseligt i vand.
Hver AVODART 0,5 mg blød gelatinekapsel, administreret oralt, indeholder 0,5 mg dutasterid opløst i en blanding af mono-diglycerider af caprylsyre/caprinsyre og butyleret hydroxytoluen. De inaktive hjælpestoffer i kapselskallen er jernoxid (gul), gelatine (fra certificerede BSE-fri kvægkilder), glycerin og titaniumdioxid. De bløde gelatinekapsler er trykt med spiselig rød blæk.
INDIKATIONER
Monoterapi
AVODART (dutasterid) bløde gelatinekapsler er indiceret til behandling af symptomatisk benign prostatahyperplasi (BPH) hos mænd med en forstørret prostata til:
- forbedre symptomer,
- reducere risikoen for akut urinretention (AUR), og
- reducere risikoen for behovet for BPH-relateret operation.
Kombination med alfa-adrenerg antagonist
AVODART i kombination med den alfa-adrenerge antagonist, tamsulosin, er indiceret til behandling af symptomatisk BPH hos mænd med forstørret prostata.
Brugsbegrænsninger
AVODART 0,5 mg er ikke godkendt til forebyggelse af prostatacancer.
DOSERING OG ADMINISTRATION
Kapslerne skal sluges hele og ikke tygges eller åbnes, da kontakt med kapslens indhold kan resultere i irritation af mundhulens slimhinde. AVODART kan administreres med eller uden mad.
Monoterapi
Den anbefalede dosis af AVODART er 1 kapsel (0,5 mg) én gang dagligt.
Kombination med alfa-adrenerg antagonist
Den anbefalede dosis af AVODART 0,5 mg er 1 kapsel (0,5 mg) én gang dagligt og tamsulosin 0,4 mg én gang dagligt.
HVORDAN LEVERET
Doseringsformer og styrker
0,5 mg, uigennemsigtige, mat gule, gelatinekapsler præget med "GX CE2" med rødt blæk på den ene side.
Opbevaring og håndtering
AVODART bløde gelatinekapsler 0,5 mg er aflange, uigennemsigtige, mat gule gelatinekapsler påtrykt "GX CE2" med rødt spiseligt blæk på den ene side, pakket i flasker med 30 stk. NDC 0173-0712-15) og 90 ( NDC 0173-0712-04) med børnesikrede lukninger.
Opbevares ved 25°C (77°F); udflugter tilladt til 15° til 30°C (59° til 86°F) [se USP kontrolleret rumtemperatur ].
Dutasterid absorberes gennem huden. AVODART 0,5 mg kapsler bør ikke håndteres af kvinder, der er gravide, eller som kan blive gravide på grund af potentialet for absorption af dutasterid og den efterfølgende potentielle risiko for et mandligt foster under udvikling [se ADVARSLER OG FORHOLDSREGLER ].
Fremstillet til: GlaxoSmithKline Research Triangle Park. Revideret: januar 2020
BIVIRKNINGER
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan de bivirkninger, der er observeret i de kliniske forsøg med et lægemiddel, ikke direkte sammenlignes med hastigheder i det kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de i praksis observerede hastigheder.
Fra kliniske forsøg med AVODART 0,5 mg som monoterapi eller i kombination med tamsulosin:
- De mest almindelige bivirkninger rapporteret hos forsøgspersoner, der fik AVODART 0,5 mg, var impotens, nedsat libido, brystlidelser (inklusive brystforstørrelse og ømhed) og ejakulationsforstyrrelser. De mest almindelige bivirkninger rapporteret hos forsøgspersoner, der fik kombinationsbehandling (AVODART 0,5 mg plus tamsulosin) var impotens, nedsat libido, brystlidelser (inklusive brystforstørrelse og ømhed), ejakulationsforstyrrelser og svimmelhed. Ejakulationsforstyrrelser forekom signifikant mere hos forsøgspersoner, der fik kombinationsbehandling (11 %) sammenlignet med dem, der fik AVODART (2 %) eller tamsulosin (4 %) som monoterapi.
- Afbrydelse af forsøg på grund af bivirkninger forekom hos 4 % af forsøgspersonerne, der fik AVODART 0,5 mg, og 3 % af forsøgspersonerne, der fik placebo i placebokontrollerede forsøg med AVODART. Den mest almindelige bivirkning, der førte til tilbagetrækning af forsøget, var impotens (1%).
- det kliniske forsøg, der evaluerede kombinationsterapien, forekom undersøgelsesafbrydelse på grund af bivirkninger hos 6 % af forsøgspersonerne, der fik kombinationsbehandling (AVODART plus tamsulosin), og 4 % af forsøgspersonerne, der fik AVODART 0,5 mg eller tamsulosin som monoterapi. Den mest almindelige bivirkning i alle behandlingsarme, der førte til tilbagetrækning af forsøget, var erektil dysfunktion (1 % til 1,5 %).
Monoterapi
Over 4.300 mandlige forsøgspersoner med BPH blev tilfældigt fordelt til at modtage placebo eller 0,5 mg daglige doser af AVODART i 3 identiske 2-årige, placebokontrollerede, dobbeltblindede fase 3-behandlingsforsøg, hver efterfulgt af en 2-årig åben-label. udvidelse. I løbet af den dobbeltblindede behandlingsperiode blev 2.167 mandlige forsøgspersoner eksponeret for AVODART 0,5 mg, herunder 1.772 eksponerede i 1 år og 1.510 eksponerede i 2 år. Når de åbne forlængelser blev inkluderet, blev 1.009 mandlige forsøgspersoner eksponeret for AVODART 0,5 mg i 3 år, og 812 blev eksponeret i 4 år. Befolkningen var i alderen 47 til 94 år (gennemsnitsalder: 66 år), og mere end 90% var hvide. Tabel 1 opsummerer kliniske bivirkninger rapporteret hos mindst 1 % af forsøgspersonerne, der fik AVODART, og med en højere forekomst end forsøgspersoner, der fik placebo.
Langtidsbehandling (op til 4 år)
Højgradig prostatakræft
REDUCE-studiet var et randomiseret, dobbelt-blindt, placebokontrolleret forsøg, der inkluderede 8.231 mænd i alderen 50 til 75 år med en serum-PSA på 2,5 ng/ml til 10 ng/ml og en negativ prostatabiopsi inden for de foregående 6 måneder. Forsøgspersonerne blev randomiseret til at modtage placebo (n = 4.126) eller 0,5 mg daglige doser af AVODART (n = 4.105) i op til 4 år. Gennemsnitsalderen var 63 år, og 91% var hvide. Forsøgspersonerne gennemgik protokolpligtige planlagte prostatabiopsier ved 2 og 4 års behandling eller fik "for-cause biopsier" på ikke-planlagte tidspunkter, hvis det var klinisk indiceret. Der var en højere forekomst af Gleason score 8-10 prostatacancer hos mænd, der fik AVODART (1,0 %) sammenlignet med mænd på placebo (0,5 %) [se INDIKATIONER OG BRUG , ADVARSLER OG FORHOLDSREGLER ]. I et 7-årigt placebokontrolleret klinisk forsøg med en anden 5 alfa-reduktasehæmmer (finasterid 5 mg, PROSCAR) blev der observeret lignende resultater for Gleason score 8-10 prostatacancer (finasterid 1,8 % versus placebo 1,1 %).
Der er ikke påvist nogen klinisk fordel hos patienter med prostatacancer behandlet med AVODART.
Reproduktions- og brystlidelser
I de 3 pivotale placebokontrollerede BPH-forsøg med AVODART 0,5 mg, hvert 4. år, var der ingen tegn på øgede seksuelle bivirkninger (impotens, nedsat libido og ejakulationsforstyrrelser) eller brystlidelser med forlænget behandlingsvarighed. Blandt disse 3 forsøg var der 1 tilfælde af brystkræft i dutasteridgruppen og 1 tilfælde i placebogruppen. Ingen tilfælde af brystkræft blev rapporteret i nogen behandlingsgruppe i det 4-årige CombAT-studie eller det 4-årige REDUCE-studie.
Forholdet mellem langvarig brug af dutasterid og mandlig bryst neoplasi er i øjeblikket ukendt.
Kombination med alfablokkerterapi (CombAT)
Over 4.800 mandlige forsøgspersoner med BPH blev tilfældigt tildelt til at modtage 0,5 mg AVODART 0,5 mg, 0,4 mg tamsulosin eller kombinationsbehandling (0,5 mg AVODART plus 0,4 mg tamsulosin) administreret én gang dagligt i et 4-årigt dobbeltblindet forsøg. Samlet set modtog 1.623 forsøgspersoner monoterapi med AVODART; 1.611 forsøgspersoner modtog monoterapi med tamsulosin; og 1.610 forsøgspersoner modtog kombinationsbehandling. Befolkningen var i alderen 49 til 88 år (gennemsnitsalder: 66 år), og 88% var hvide. Tabel 2 opsummerer bivirkninger rapporteret hos mindst 1 % af forsøgspersonerne i kombinationsgruppen og med en højere incidens end forsøgspersoner, der får monoterapi med AVODART 0,5 mg eller tamsulosin.
Hjertesvigt
CombAT, efter 4 års behandling, var forekomsten af den sammensatte term hjerteinsufficiens i kombinationsterapigruppen (12/1.610; 0,7 %) højere end i begge monoterapigrupper: AVODART 0,5 mg, 2/1.623 (0,1 %) og tamsulosin, 9/1.611 (0,6%). Sammensat hjerteinsufficiens blev også undersøgt i et separat 4-årigt placebokontrolleret forsøg, der evaluerede AVODART hos mænd med risiko for udvikling af prostatacancer. Hyppigheden af hjertesvigt hos forsøgspersoner, der tog AVODART 0,5 mg, var 0,6 % (26/4.105) sammenlignet med 0,4 % (15/4.126) hos forsøgspersoner på placebo. Et flertal af forsøgspersoner med hjertesvigt i begge forsøg havde komorbiditeter forbundet med en øget risiko for hjertesvigt. Derfor er den kliniske betydning af de numeriske ubalancer ved hjertesvigt ukendt. Der er ikke påvist nogen årsagssammenhæng mellem AVODART alene eller i kombination med tamsulosin og hjertesvigt. Der blev ikke observeret nogen ubalance i forekomsten af overordnede kardiovaskulære bivirkninger i nogen af forsøgene.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af AVODART efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering. Disse reaktioner er blevet valgt til inklusion på grund af en kombination af deres alvor, hyppighed af rapportering eller potentielle årsagssammenhænge til AVODART.
Forstyrrelser i immunsystemet
Overfølsomhedsreaktioner, herunder udslæt, pruritus, nældefeber, lokaliseret ødem, alvorlige hudreaktioner og angioødem.
Neoplasmer
Mandlig brystkræft.
Psykiatriske lidelser
Nedtrykt humør.
Reproduktionssystem og brystsygdomme
Testikelsmerter og testikelhævelse.
DRUGSINTERAKTIONER
Cytokrom P450 3A-hæmmere
Dutasterid metaboliseres i vid udstrækning hos mennesker af cytokrom P450 (CYP)3A4 og CYP3A5 isoenzymer. Effekten af potente CYP3A4-hæmmere på dutasterid er ikke blevet undersøgt. På grund af potentialet for lægemiddelinteraktioner, udvis forsigtighed, når du ordinerer AVODART til patienter, der tager potente, kroniske CYP3A4-enzymhæmmere (f.eks. ritonavir) [se KLINISK FARMAKOLOGI ].
Alfa-adrenerge antagonister
Administration af AVODART i kombination med tamsulosin eller terazosin har ingen effekt på steady-state farmakokinetikken af nogen af alfa-adrenerge antagonister. Effekten af administration af tamsulosin eller terazosin på dutasterids farmakokinetiske parametre er ikke blevet evalueret.
Calciumkanalantagonister
Samtidig administration af verapamil eller diltiazem nedsætter dutasterid-clearance og fører til øget eksponering for dutasterid. Ændringen i dutasterideksponering anses ikke for at være klinisk signifikant. Ingen dosisjustering anbefales [se KLINISK FARMAKOLOGI ].
Kolestyramin
Administration af en enkelt dosis på 5 mg AVODART 0,5 mg efterfulgt 1 time senere af 12 g kolestyramin påvirker ikke den relative biotilgængelighed af dutasterid [se KLINISK FARMAKOLOGI ].
Digoxin
AVODART 0,5 mg ændrer ikke digoxins steady-state farmakokinetik, når det administreres samtidig med en dosis på 0,5 mg/dag i 3 uger [se KLINISK FARMAKOLOGI ].
Warfarin
Samtidig administration af AVODART 0,5 mg/dag i 3 uger med warfarin ændrer ikke steady-state farmakokinetikken af S- eller R-warfarin isomererne eller ændrer virkningen af warfarin på protrombintiden [se KLINISK FARMAKOLOGI ].
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Effekter på prostata-specifikt antigen (PSA) og brugen af PSA til påvisning af prostatakræft
kliniske forsøg reducerede AVODART 0,5 mg serum-PSA-koncentrationen med ca. 50 % inden for 3 til 6 måneders behandling. Dette fald var forudsigeligt over hele intervallet af PSA-værdier hos forsøgspersoner med symptomatisk BPH, selvom det kan variere hos individer. AVODART 0,5 mg kan også forårsage fald i serum-PSA ved tilstedeværelse af prostatacancer. For at fortolke serielle PSA'er hos mænd, der tager AVODART 0,5 mg, bør en ny PSA-baseline etableres mindst 3 måneder efter påbegyndelse af behandlingen, og PSA monitoreres periodisk derefter. Enhver bekræftet stigning fra den laveste PSA-værdi under AVODART kan signalere tilstedeværelsen af prostatacancer og bør evalueres, selvom PSA-niveauerne stadig er inden for det normale område for mænd, der ikke tager en 5 alphareductase-hæmmer. Manglende overholdelse af AVODART kan også påvirke PSA-testresultater.
For at fortolke en isoleret PSA-værdi hos en mand behandlet med AVODART 0,5 mg i 3 måneder eller mere, bør PSA-værdien fordobles til sammenligning med normale værdier hos ubehandlede mænd. Fri-total PSA-forholdet (procent fri PSA) forbliver konstant, selv under påvirkning af AVODART. Hvis klinikere vælger at bruge procent fri PSA som en hjælp til påvisning af prostatacancer hos mænd, der får AVODART, ser det ikke ud til, at det er nødvendigt at justere dets værdi.
Samtidig administration af dutasterid og tamsulosin resulterede i lignende ændringer i serum-PSA som dutasterid monoterapi.
Øget risiko for højgradig prostatakræft
Hos mænd i alderen 50 til 75 år med en tidligere negativ biopsi for prostatacancer og en baseline PSA mellem 2,5 ng/ml og 10,0 ng/ml, der tog AVODART i det 4-årige Reduction by Dutasteride of Prostate Cancer Events (REDUCE) forsøg, var der en øget forekomst af Gleason score 810 prostatacancer sammenlignet med mænd, der fik placebo (AVODART 1,0% versus placebo 0,5%) [se INDIKATIONER OG BRUG , BIVIRKNINGER ]. I et 7-årigt placebokontrolleret klinisk forsøg med en anden 5 alfa-reduktasehæmmer (finasterid 5 mg, PROSCAR) blev der observeret lignende resultater for Gleason score 8-10 prostatacancer (finasterid 1,8 % versus placebo 1,1 %).
alfa-reduktasehæmmere kan øge risikoen for udvikling af højgradig prostatacancer. Hvorvidt effekten af 5 alfa-reduktasehæmmere til at reducere prostatavolumen eller forsøgsrelaterede faktorer påvirkede resultaterne af disse forsøg er ikke blevet fastslået.
Evaluering for andre urologiske sygdomme
Inden behandling med AVODART 0,5 mg påbegyndes, bør andre urologiske tilstande, der kan forårsage lignende symptomer, tages i betragtning. Derudover kan BPH og prostatacancer eksistere side om side.
Transdermal eksponering af AVODART 0,5 mg hos gravide kvinder – risiko for mandligt foster
AVODART kapsler bør ikke håndteres af kvinder, der er gravide eller kan være gravide. Dutasterid kan absorberes gennem huden og kan resultere i utilsigtet føtal eksponering og potentiel risiko for et mandligt foster. Hvis en gravid kvinde kommer i kontakt med utætte dutasteridkapsler, skal kontaktområdet straks vaskes med vand og sæbe [se Brug i specifikke populationer ]. Dutasterid kan absorberes gennem huden baseret på dyreforsøg [se Ikke-klinisk toksikologi ].
Blod donation
Mænd, der behandles med AVODART, bør ikke donere blod, før der er gået mindst 6 måneder efter deres sidste dosis. Formålet med denne udskudte periode er at forhindre administration af dutasterid til en gravid kvindelig transfusionsmodtager.
Effekt på sædkarakteristika
Virkningerne af dutasterid 0,5 mg/dag på sædkarakteristika blev evalueret hos raske mænd gennem 52 ugers behandling og 24 ugers efterbehandlingsopfølgning. Ved 52 uger, sammenlignet med placebo, resulterede dutasteridbehandling i gennemsnitlig reduktion i det samlede sædtal, sædvolumen og sædmotilitet; virkningerne på det samlede sædtal var ikke reversible efter 24 ugers opfølgning. Spermkoncentration og sædmorfologi var upåvirket, og middelværdier for alle sædparametre forblev inden for det normale område på alle tidspunkter. Den kliniske betydning af virkningen af dutasterid på sædens egenskaber for en individuel patients fertilitet er ikke kendt [se Brug i specifikke populationer ].
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning ( PATIENTOPLYSNINGER ).
PSA overvågning
Informer patienterne om, at AVODART reducerer serum-PSA-niveauer med ca. 50 % inden for 3 til 6 måneder efter behandlingen, selvom det kan variere for den enkelte. For patienter, der gennemgår PSA-screening, kan stigninger i PSA-niveauer under behandling med AVODART signalere tilstedeværelsen af prostatacancer og bør evalueres af en sundhedsudbyder [se ADVARSLER OG FORHOLDSREGLER ].
Øget risiko for højgradig prostatakræft
Informer patienterne om, at der var en stigning i højgradig prostatacancer hos mænd behandlet med 5 alfa-reduktasehæmmere (som er indiceret til BPH-behandling), inklusive AVODART 0,5 mg, sammenlignet med dem, der blev behandlet med placebo i forsøg, der kiggede på brugen af disse lægemidler til at reducere risikoen for prostatacancer [se INDIKATIONER OG BRUG , ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ].
Transdermal eksponering af AVODART hos gravide eller potentielt gravide kvinder – risiko for mandligt foster
Informer patienterne om, at AVODART 0,5 mg kapsler ikke bør håndteres af kvinder, der er gravide eller potentielt kan være gravide på grund af potentialet for absorption af dutasterid og den efterfølgende potentielle risiko for et mandligt foster under udvikling. Dutasterid kan absorberes gennem huden og kan resultere i utilsigtet føtal eksponering. Hvis en gravid eller potentielt gravid kvinde kommer i kontakt med utætte AVODART 0,5 mg kapsler, skal kontaktområdet straks vaskes med vand og sæbe [se ADVARSLER OG FORHOLDSREGLER , Brug i specifikke populationer ].
Effekter på sædparametre
Rådfør mænd om, at AVODART 0,5 mg kan påvirke sædens egenskaber, men virkningen på fertiliteten er ukendt [se ADVARSLER OG FORHOLDSREGLER , Brug i specifikke populationer ].
Blod donation
Informer mænd behandlet med AVODART 0,5 mg, at de ikke bør donere blod før mindst 6 måneder efter deres sidste dosis for at forhindre gravide kvinder i at få dutasterid gennem blodtransfusion [se ADVARSLER OG FORHOLDSREGLER ]. Serumniveauer af dutasterid kan påvises i 4 til 6 måneder efter behandlingens afslutning [se KLINISK FARMAKOLOGI ].
AVODART er et varemærke ejet af eller licenseret til GSK-gruppen af virksomheder.
De andre anførte mærker er varemærker ejet af eller licenseret til deres respektive ejere og er ikke ejet af eller licenseret til GSK-gruppen af virksomheder. Producenterne af disse mærker er ikke tilknyttet og støtter ikke GSK-gruppen af virksomheder eller dens produkter.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Et 2-årigt carcinogenicitetsstudie blev udført i B6C3F1-mus i doser på 3, 35, 250 og 500 mg/kg/dag for hanner og 3, 35 og 250 mg/kg/dag for hunner; en øget forekomst af benigne hepatocellulære adenomer blev kun observeret ved 250 mg/kg/dag (290 gange MRHD af en daglig dosis på 0,5 mg) hos hunmus. To af de 3 vigtigste humane metabolitter er blevet påvist i mus. Eksponeringen for disse metabolitter hos mus er enten lavere end hos mennesker eller er ikke kendt.
et 2-årigt carcinogenicitetsstudie i Han Wistar-rotter, ved doser på 1,5, 7,5 og 53 mg/kg/dag hos hanner og 0,8, 6,3 og 15 mg/kg/dag hos hunner, var der en stigning i Leydig-celler adenomer i testiklerne ved 135 gange MRHD (53 mg/kg/dag og mere). En øget forekomst af Leydig-cellehyperplasi var til stede ved 52 gange MRHD (hanrottedoser på 7,5 mg/kg/dag og mere). En positiv sammenhæng mellem proliferative ændringer i Leydig-cellerne og en stigning i cirkulerende luteiniserende hormonniveauer er blevet påvist med 5 alfa-reduktasehæmmere og er i overensstemmelse med en effekt på hypothalamus-hypofyse-testikelaksen efter 5 alfa-reduktasehæmning. Ved tumorogene doser blev luteiniserende hormonniveauer hos rotter øget med 167 %. I denne undersøgelse blev de vigtigste humane metabolitter testet for carcinogenicitet ved ca. 1 til 3 gange den forventede kliniske eksponering.
Mutagenese
Dutasterid blev testet for genotoksicitet i et bakteriel mutagenese-assay (Ames-test), et kromosomafvigelsesassay i kinesisk hamster-ovarieceller og et mikronukleusassay i rotter. Resultaterne indikerede ikke noget genotoksisk potentiale af moderlægemidlet. To store humane metabolitter var også negative i enten Ames-testen eller en forkortet Ames-test.
Forringelse af fertilitet
Behandling af seksuelt modne hanrotter med dutasterid på 0,1 gange MRHD (dyredosis på 0,05 mg/kg/dag eller mere i op til 31 uger) baseret på gennemsnitlig serumkoncentration resulterede i dosis- og tidsafhængige fald i fertilitet ved alle doser ; reduceret cauda epididymal (absolut) sædtal, men ikke sædkoncentration (ved 50 og 500 mg/kg/dag); reduceret vægt af epididymis, prostata og sædblærer; og mikroskopiske ændringer (cytoplasmatisk vakuolation af tubulært epitel i epididymiderne og/eller nedsat cytoplasmatisk indhold af epitel, i overensstemmelse med nedsat sekretorisk aktivitet i prostata og sædblærer) i reproduktionsorganerne ved alle doser i fravær af paternal toksicitet. Fertilitetseffekterne blev vendt ved restitutionsuge 6 ved alle doser, og sædceller var normale ved slutningen af en 14-ugers restitutionsperiode. De mikroskopiske forandringer var ikke længere til stede ved Recovery Week 14 ved 0,1 gange MRHD og blev delvis genvundet i de resterende behandlingsgrupper. Lave niveauer af dutasterid (0,6 til 17 ng/ml) blev påvist i serum fra ubehandlede hunrotter parret med behandlede hanner (10 til 500 mg/kg/dag i 29 til 30 uger), som er 16 til 110 gange MRHD baseret på gennemsnitlig serumkoncentration. Der forekom ingen feminisering hos han-afkom af ubehandlede hunrotter parret med behandlede hanrotter, selvom påviselige blodniveauer af dutasterid blev observeret hos hunrotterne.
et fertilitetsstudie med hunrotter med dosering 4 uger før parring gennem tidlig drægtighed, resulterede oral administration af dutasterid i doser på 0,05, 2,5, 12,5 og 30 mg/kg/dag i reduceret kuldstørrelse på grund af øgede resorptioner og feminisering af mandlige fostre (nedsat anogenital afstand) ved 2 til 10 gange MRHD (dyredosis på 2,5 mg/kg/dag eller mere) baseret på gennemsnitlig serumkoncentration, i nærværelse af maternel toksicitet (nedsat vægtøgning). Fosterets kropsvægt blev også reduceret med ca. 0,02 gange MRHD (rottedosis på 0,05 mg/kg/dag eller mere) baseret på gennemsnitlig serumkoncentration, uden ingen effektniveau, i fravær af maternel toksicitet.
Brug i specifikke populationer
Graviditet
Risikooversigt
AVODART 0,5 mg er kontraindiceret til brug under graviditet, fordi det kan forårsage skade på det mandlige foster [se KONTRAINDIKATIONER ]. AVODART er ikke indiceret til brug hos kvinder.
AVODART 0,5 mg er en 5 alfa-reduktasehæmmer, der forhindrer omdannelse af testosteron til dihydrotestosteron (DHT), et hormon, der er nødvendigt for normal udvikling af mandlige kønsorganer. Abnormiteter i kønsorganerne hos mandlige fostre er en forventet fysiologisk konsekvens af hæmning af denne omdannelse. Disse resultater ligner observationer hos mandlige spædbørn med genetisk 5 alfa-reduktase-mangel.
I den generelle befolkning i USA er den estimerede baggrundsrisiko for alvorlige fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
reproduktionsstudier på dyr hæmmede dutasterid normal udvikling af ydre kønsorganer hos han-afkom, når det blev givet til rotter eller kaniner under organogenese ved mindre end den maksimalt anbefalede humane dosis (MRHD) på 0,5 mg dagligt i fravær af maternel toksicitet. Ved 15 gange MRHD blev forlænget graviditet, nedsat reproduktionsorganvægt og forsinket pubertet hos han-afkom observeret hos rotter med ingen effektniveauer mindre end MRHD på 0,5 mg dagligt. Forøget placentavægt hos kaniner blev også observeret, med ingen effekt niveauer mindre end MRHD på 0,5 mg dagligt (se Data ).
Selvom dutasterid udskilles i sæd fra mennesker, er lægemiddelkoncentrationen i den menneskelige kvindelige partner cirka 100 gange mindre end koncentrationer, der producerer abnormiteter i mandlige kønsorganer i dyreforsøg (se Data ). Hos aber doseret under organogenese i blodkoncentrationer, der er sammenlignelige med eller over niveauer, som en kvindelig partner skønnes at være udsat for, blev de ydre kønsorganer af hankøn ikke påvirket negativt. Der forekom ingen feminisering hos hanafkom af ubehandlede hunrotter parret med behandlede hanrotter, selvom der blev observeret påviselige blodniveauer af dutasterid hos hunrotterne [se Ikke-klinisk toksikologi ].
Data
Menneskelige data
Den højeste målte sædkoncentration af dutasterid hos behandlede mænd var 14 ng/ml. Selvom dutasterid påvises i sæd, forudsat at en kvinde på 50 kg udsættes for 5 ml sæd og 100 % absorption, ville kvindens forventede dutasterid-blodkoncentration gennem sæd være omkring 0,0175 ng/ml. Denne koncentration er cirka 100 gange mindre end blodkoncentrationer, der producerer abnormiteter i mandlige kønsorganer i dyreforsøg. Dutasterid er stærkt proteinbundet i human sæd (større end 96%), hvilket kan reducere mængden af dutasterid, der er tilgængeligt til vaginal absorption.
Dyredata
en embryo-føtal udviklingsundersøgelse hos rotter resulterede oral administration af dutasterid ved 10 gange mindre end MRHD på 0,5 mg dagligt (baseret på gennemsnitlige blodniveauer hos mænd) i feminisering af mandlige kønsorganer i fosteret (nedsat anogenital afstand ved 0,05 mg /kg/dag, med mangel på et nul-effekt niveau) i fravær af maternel toksicitet. Derudover forekom brystvortens udvikling, hypospadier og udspilede præputiale kirtler hos fostre af moderdyr behandlet med doser på 2,5 mg/kg/dag eller mere (ca. 15 gange MRHD). Reduceret føtal kropsvægt og associeret forsinket ossifikation i nærvær af maternel toksicitet (nedsat kropsvægtøgning) blev observeret ved maternel eksponering ca. 15 gange MRHD (dosis på 2,5 mg/kg/dag eller mere). En stigning i dødfødte unger blev observeret hos moderdyr behandlet med 30 mg/kg/dag (ca. 111 gange MRHD), med et nul-effekt niveau på 12,5 mg/kg/dag.
et kaninembryo-føtalt udviklingsstudie blev doser på 28 gange MRHD (doser på 30 mg/kg/dag eller mere), baseret på gennemsnitlige blodniveauer hos mænd, administreret oralt på drægtighedsdage 7 til 29 (under organogenese og den sene periode med udvikling af ydre kønsorganer). Histologisk evaluering af genitalpapillen hos fostre afslørede tegn på feminisering af det mandlige foster såvel som sammensmeltede kranieknogler og øget placentavægt ved alle doser i fravær af maternel toksicitet. En anden undersøgelse af embryo-føtal udvikling hos kaniner doseret gennem hele graviditeten (organogenese og senere periode med udvikling af eksterne kønsorganer [drægtighedsdage 6 til 29]) med 0,3 gange MRHD (doser på 0,05 mg/kg/dag eller mere, uden ingen- effektniveau), frembragte også bevis for feminisering af kønsorganerne hos mandlige fostre og øget placentavægt ved alle doser i fravær af maternel toksicitet.
et embryo-føtalt udviklingsstudie blev drægtige rhesusaber eksponeret intravenøst under organogenese (drægtighedsdage 20 til 100) for et dutasterid-blodniveau, der var sammenligneligt med eller over den estimerede dutasterid-eksponering af en kvindelig partner. Dutasterid blev administreret på drægtighedsdage 20 til 100 (under organogenese) i doser på 400, 780, 1.325 eller 2.010 ng/dag (12 aber/gruppe). Der blev ikke observeret feminisering af ydre hankønsorganer hos abeafkom. Reduktion af føtal binyrevægt, reduktion i føtal prostatavægt og stigninger i føtale ovarie- og testisvægte blev observeret ved den højeste testede dosis. Baseret på den højeste målte sædkoncentration af dutasterid hos behandlede mænd (14 ng/ml), repræsenterer disse doser i aben op til 16 gange den potentielle maksimale eksponering af en 50 kg kvindelig kvinde for 5 ml sæd dagligt fra en dutasterid- behandlet han, forudsat 100% absorption. Dosisniveauerne (på ng/kg-basis) administreret til aber i denne undersøgelse er 32 til 186 gange den nominelle (ng/kg) dosis, som en hun potentielt ville blive udsat for via sæden. Det vides ikke, om kaniner eller næseaber producerer nogen af de vigtigste humane metabolitter.
en oral præ- og postnatal udviklingsundersøgelse hos rotter blev der observeret feminisering af hankønsorganerne. Nedsat anogenital afstand blev observeret ved 0,05 gange MRHD og mere (0,05 mg/kg/dag og mere), med en mangel på et nul-effekt niveau, baseret på gennemsnitlige blodniveauer hos mænd som en estimering af AUC. Hypospadi og udvikling af brystvorter blev observeret ved 2,5 mg/kg/dag eller mere (14 gange MRHD eller mere, med et niveau uden effekt ved 0,05 mg/kg/dag). Doser på 2,5 mg/kg/dag og mere resulterede også i forlænget drægtighed hos forældrehunerne, en stigning i tid til balano-præputial adskillelse hos mandligt afkom, et fald i tid til vaginal åbenhed for kvindelige afkom og et fald i prostata og sædblærevægte hos mandlige afkom. Øget dødfødsel og nedsat neonatal levedygtighed hos afkom blev noteret ved 30 mg/kg/dag (102 gange MRHD i nærvær af maternel toksicitet [nedsat kropsvægt]).
Amning
Risikooversigt
AVODART er ikke indiceret til brug hos kvinder. Der er ingen tilgængelig information om tilstedeværelsen af dutasterid i modermælk, virkningerne på det ammede barn eller virkningerne på mælkeproduktionen.
Hunner og mænd med reproduktionspotentiale
Infertilitet
Hanner
Virkningerne af dutasterid 0,5 mg/dag på sædkarakteristika blev evalueret hos normale frivillige i alderen 18 til 52 år (n = 27 dutasterider, n = 23 placebo) gennem 52 ugers behandling og 24 ugers efterbehandlingsopfølgning. Ved 52 uger var den gennemsnitlige procentvise reduktion fra baseline i det samlede sædtal, sædvolumen og sædmotilitet henholdsvis 23 %, 26 % og 18 % i dutasteridgruppen, når der blev justeret for ændringer fra baseline i placebogruppen. Spermkoncentration og sædmorfologi var upåvirket. Efter 24 ugers opfølgning forblev den gennemsnitlige procentvise ændring i det samlede sædtal i dutasteridgruppen 23 % lavere end baseline. Mens middelværdier for alle sædparametre på alle tidspunkter forblev inden for de normale områder og ikke opfyldte foruddefinerede kriterier for en klinisk signifikant ændring (30 %), havde 2 forsøgspersoner i dutasterid-gruppen fald i sædtal på mere end 90 % fra baseline kl. 52 uger, med delvis bedring ved 24-ugers opfølgning. Den kliniske betydning af dutasterids effekt på sædens egenskaber for en individuel patients fertilitet er ikke kendt [se ADVARSLER OG FORHOLDSREGLER ].
Pædiatrisk brug
AVODART 0,5 mg er ikke indiceret til brug til pædiatriske patienter. Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Ud af 2.167 mandlige forsøgspersoner, der blev behandlet med AVODART 0,5 mg i 3 kliniske forsøg, var 60 % i alderen 65 år og ældre, og 15 % var i alderen 75 år og ældre. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effekt mellem disse forsøgspersoner og yngre forsøgspersoner. Andre rapporterede kliniske erfaringer har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes [se KLINISK FARMAKOLOGI ].
Nedsat nyrefunktion
Dosisjustering er ikke nødvendig for AVODART 0,5 mg til patienter med nedsat nyrefunktion [se KLINISK FARMAKOLOGI ].
Nedsat leverfunktion
Virkningen af nedsat leverfunktion på dutasterids farmakokinetik er ikke blevet undersøgt. Da dutasterid metaboliseres i vidt omfang, kan eksponeringen være højere hos patienter med nedsat leverfunktion. I et klinisk forsøg, hvor 60 forsøgspersoner fik 5 mg (10 gange den terapeutiske dosis) dagligt i 24 uger, blev der dog ikke observeret yderligere bivirkninger sammenlignet med dem, der blev observeret ved den terapeutiske dosis på 0,5 mg [se KLINISK FARMAKOLOGI ].
OVERDOSIS
I forsøg med frivillige er enkeltdoser af dutasterid op til 40 mg (80 gange den terapeutiske dosis) i 7 dage blevet administreret uden væsentlige sikkerhedsproblemer. I et klinisk forsøg blev daglige doser på 5 mg (10 gange den terapeutiske dosis) administreret til 60 forsøgspersoner i 6 måneder uden yderligere bivirkninger end dem, der ses ved terapeutiske doser på 0,5 mg.
Der er ingen specifik modgift mod dutasterid. I tilfælde af mistanke om overdosering bør symptomatisk og understøttende behandling derfor gives efter behov under hensyntagen til dutasterids lange halveringstid.
KONTRAINDIKATIONER
AVODART 0,5 mg er kontraindiceret til brug i:

- Graviditet. Brug af dutasterid er kontraindiceret hos kvinder, der er gravide. I dyrereproduktions- og udviklingstoksicitetsundersøgelser hæmmede dutasterid udviklingen af hanfosterets ydre kønsorganer. Derfor kan AVODART 0,5 mg forårsage fosterskader, når det administreres til en gravid kvinde [se ADVARSLER OG FORHOLDSREGLER , Brug i specifikke populationer ].
- Patienter med tidligere påvist klinisk signifikant overfølsomhed (f.eks. alvorlige hudreaktioner, angioødem) over for AVODART eller andre 5-alfa-reduktasehæmmere [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Dutasterid hæmmer omdannelsen af testosteron til DHT. DHT er det androgen, der primært er ansvarlig for den indledende udvikling og efterfølgende udvidelse af prostatakirtlen. Testosteron omdannes til DHT af enzymet 5 alfa-reduktase, som eksisterer som 2 isoformer, type 1 og type 2. Type 2 isoenzymet er primært aktivt i reproduktive væv, mens type 1 isoenzymet også er ansvarlig for testosteron omdannelsen i hud og lever.
Dutasterid er en kompetitiv og specifik hæmmer af både type 1 og type 2 5 alfa-reduktase isoenzymer, hvormed det danner et stabilt enzymkompleks. Dissociation fra dette kompleks er blevet evalueret under in vitro og in vivo betingelser og er ekstremt langsom. Dutasterid binder ikke til den humane androgenreceptor.
Farmakodynamik
Effekt på 5 alfa-dihydrotestosteron og testosteron
Den maksimale effekt af daglige doser af dutasterid på reduktionen af DHT er dosisafhængig og observeres inden for 1 til 2 uger. Efter 1 og 2 ugers daglig dosering med dutasterid 0,5 mg, blev median serum-DHT-koncentrationer reduceret med henholdsvis 85 % og 90 %. Hos patienter med BPH behandlet med dutasterid 0,5 mg/dag i 4 år var medianfaldet i serum-DHT 94 % efter 1 år, 93 % efter 2 år og 95 % efter både 3 og 4 år. Den gennemsnitlige stigning i serumtestosteron var 19 % efter både 1 og 2 år, 26 % efter 3 år og 22 % efter 4 år, men middel- og medianniveauerne forblev inden for det fysiologiske område.
Hos patienter med BPH behandlet med 5 mg/dag dutasterid eller placebo i op til 12 uger før transurethral resektion af prostata, var gennemsnitlige DHT-koncentrationer i prostatavæv signifikant lavere i dutasteridgruppen sammenlignet med placebo (784 og 5.793 pg/g) P
Voksne mænd med genetisk arvelig type 2 5 alfa-reduktase-mangel har også nedsatte DHT-niveauer. Disse 5 alfa-reduktase-mangelfulde mænd har en lille prostata gennem hele livet og udvikler ikke BPH. Bortset fra de associerede urogenitale defekter til stede ved fødslen, er der ikke observeret andre kliniske abnormiteter relateret til 5-alfa-reduktase-mangel hos disse personer.
Virkninger på andre hormoner
Hos raske frivillige resulterede 52 ugers behandling med dutasterid 0,5 mg/dag (n = 26) ikke i nogen klinisk signifikant ændring sammenlignet med placebo (n = 23) i kønshormonbindende globulin, østradiol, luteiniserende hormon, follikelstimulerende hormon, thyroxin (fri T4) og dehydroepiandrosteron. Statistisk signifikante, baseline-justerede gennemsnitlige stigninger sammenlignet med placebo blev observeret for total testosteron efter 8 uger (97,1 ng/dL, P
Andre effekter
Plasmalipidpanel og knoglemineraltæthed blev evalueret efter 52 ugers dutasterid 0,5 mg én gang dagligt hos raske frivillige. Der var ingen ændring i knoglemineraltæthed målt ved dobbeltenergi røntgenabsorptiometri sammenlignet med hverken placebo eller baseline. Desuden var plasmalipidprofilen (dvs. totalt kolesterol, lavdensitetslipoproteiner, højdensitetslipoproteiner, triglycerider) upåvirket af dutasterid. Der blev ikke observeret nogen klinisk signifikante ændringer i binyrehormonrespons på stimulering af adrenokortikotropt hormon (ACTH) i en undergruppepopulation (n = 13) af det 1-årige forsøg med raske frivillige.
Farmakokinetik
Absorption
Efter administration af en enkelt dosis på 0,5 mg af en blød gelatinekapsel indtræffer tiden til maksimal serumkoncentration (Tmax) af dutasterid inden for 2 til 3 timer. Absolut biotilgængelighed hos 5 raske forsøgspersoner er ca. 60 % (interval: 40 % til 94 %). Når lægemidlet administreres sammen med mad, blev de maksimale serumkoncentrationer reduceret med 10% til 15%. Denne reduktion er uden klinisk betydning.
Fordeling
Farmakokinetiske data efter enkelt- og gentagne orale doser viser, at dutasterid har et stort distributionsvolumen (300 til 500 l). Dutasterid er stærkt bundet til plasmaalbumin (99,0 %) og alfa-1-syreglycoprotein (96,6 %).
I et forsøg med raske forsøgspersoner (n = 26), der fik dutasterid 0,5 mg/dag i 12 måneder, var sæddutasteridkoncentrationerne i gennemsnit 3,4 ng/ml (interval: 0,4 til 14 ng/ml) efter 12 måneder og opnåede, i lighed med serum, stabile -angiv koncentrationer ved 6 måneder. I gennemsnit fordelte 11,5 % af serumdutasteridkoncentrationerne sig efter 12 måneder i sæd.
Metabolisme og eliminering
Dutasterid metaboliseres i vid udstrækning hos mennesker. In vitro undersøgelser viste, at dutasterid metaboliseres af CYP3A4 og CYP3A5 isoenzymer. Begge disse isoenzymer producerede metabolitterne 4'-hydroxydutasteride, 6-hydroxydutasteride og 6,4'-dihydroxydutasteride. Derudover blev 15-hydroxydutasterid-metabolitten dannet af CYP3A4. Dutasterid metaboliseres ikke in vitro af humane cytokrom P450 isoenzymer CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 og CYP2E1. I humant serum efter dosering til steady state, uændret dutasterid, 3 hovedmetabolitter (4'-hydroxydutasterid, 1,2-dihydrodutasterid og 6-hydroxydutasterid), og 2 mindre metabolitter (6,4'-dihydroxydutasterid og 15 -hydroxydutasterid), som vurderet ved massespektrometrisk respons, er blevet påvist. Den absolutte stereokemi af hydroxyltilsætningerne i 6- og 15-stillingerne er ikke kendt. In vitro er 4'-hydroxydutasterid- og 1,2-dihydrodutasterid-metabolitterne meget mindre potente end dutasterid mod begge isoformer af human 5-alfa-reduktase. Aktiviteten af 6β-hydroxydutasterid er sammenlignelig med aktiviteten af dutasterid.
Dutasterid og dets metabolitter blev hovedsageligt udskilt i fæces. Som en procentdel af dosis var der ca. 5 % uændret dutasterid (~1% til ~15%) og 40% som dutasterid-relaterede metabolitter (~2% til ~90%). Kun spormængder af uændret dutasterid blev fundet i urinen (
Den terminale eliminationshalveringstid for dutasterid er ca. 5 uger ved steady state. Den gennemsnitlige steady-state serum dutasteridkoncentration var 40 ng/ml efter 0,5 mg/dag i 1 år. Efter daglig dosering opnår dutasterid serumkoncentrationer 65 % af steady-state koncentrationen efter 1 måned og ca. 90 % efter 3 måneder. På grund af dutasterids lange halveringstid forbliver serumkoncentrationer påviselige (større end 0,1 ng/ml) i op til 4 til 6 måneder efter seponering af behandlingen.
Specifikke populationer
Pædiatriske patienter
Dutasterids farmakokinetik er ikke blevet undersøgt hos forsøgspersoner under 18 år.
Geriatriske patienter
Dosisjustering er ikke nødvendig hos ældre. Dutasterids farmakokinetik og farmakodynamik blev evalueret hos 36 raske mandlige forsøgspersoner i alderen mellem 24 og 87 år efter administration af en enkelt dosis på 5 mg dutasterid. I dette enkeltdosisforsøg steg dutasterids halveringstid med alderen (ca. 170 timer hos mænd i alderen 20 til 49 år, ca. 260 timer hos mænd i alderen 50 til 69 år og ca. 300 timer hos mænd over 70 år). Ud af 2.167 mænd, der blev behandlet med dutasterid i de 3 pivotale forsøg, var 60 % 65 år og derover, og 15 % var 75 år og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effekt mellem disse patienter og yngre patienter.
Mandlige og kvindelige patienter
AVODART er kontraindiceret under graviditet og er ikke indiceret til brug hos kvinder [se KONTRAINDIKATIONER , ADVARSLER OG FORHOLDSREGLER ]. Dutasterids farmakokinetik hos kvinder er ikke blevet undersøgt.
Race- og etniske grupper
Effekten af race på dutasterids farmakokinetik er ikke blevet undersøgt.
Patienter med nedsat nyrefunktion
Effekten af nedsat nyrefunktion på dutasterids farmakokinetik er ikke blevet undersøgt. Imidlertid genfindes mindre end 0,1 % af en steady-state 0,5 mg dosis af dutasterid i human urin, så der forventes ingen justering af dosis for patienter med nedsat nyrefunktion.
Patienter med nedsat leverfunktion
Virkningen af nedsat leverfunktion på dutasterids farmakokinetik er ikke blevet undersøgt. Da dutasterid metaboliseres i vidt omfang, kan eksponeringen være højere hos patienter med nedsat leverfunktion.
Lægemiddelinteraktionsstudier
Cytokrom P450-hæmmere
Der er ikke udført kliniske lægemiddelinteraktionsforsøg for at evaluere virkningen af CYP3A-enzymhæmmere på dutasterids farmakokinetik. Baseret på in vitro-data kan blodkoncentrationer af dutasterid dog stige ved tilstedeværelse af hæmmere af CYP3A4/5, såsom ritonavir, ketoconazol, verapamil, diltiazem, cimetidin, troleandomycin og ciprofloxacin.
Dutasterid hæmmer ikke in vitro-metabolismen af modelsubstrater for de vigtigste humane cytochrom P450-isoenzymer (CYP1A2, CYP2C9, CYP2C19, CYP2D6 og CYP3A4) ved en koncentration på 1.000 ng/ml, 25 gange højere end i humane serumkoncentrationer. .
Alfa-adrenerge antagonister
I et enkelt-sekvens, crossover-studie med raske frivillige, havde administrationen af tamsulosin eller terazosin i kombination med AVODART ingen effekt på steady-state farmakokinetikken af nogen af alfa-adrenerge antagonister. Selvom virkningen af administration af tamsulosin eller terazosin på dutasterids farmakokinetiske parametre ikke blev evalueret, var den procentvise ændring i DHT-koncentrationer ens for AVODART 0,5 mg alene sammenlignet med kombinationsbehandlingen.
Calciumkanalantagonister
en populationsfarmakokinetikanalyse blev et fald i clearance af dutasterid observeret ved samtidig administration med CYP3A4-hæmmere verapamil (-37 %, n = 6) og diltiazem (-44 %, n = 5). I modsætning hertil blev der ikke set noget fald i clearance, når amlodipin, en anden calciumkanalantagonist, der ikke er en CYP3A4-hæmmer, blev administreret sammen med dutasterid (+7 %, n = 4).
Faldet i clearance og efterfølgende stigning i eksponeringen for dutasterid i nærvær af verapamil og diltiazem anses ikke for at være klinisk signifikant. Ingen dosisjustering anbefales.
Kolestyramin
Administration af en enkelt dosis på 5 mg AVODART 0,5 mg efterfulgt 1 time senere af 12 g kolestyramin påvirkede ikke den relative biotilgængelighed af dutasterid hos 12 normale frivillige.
Digoxin
I et forsøg med 20 raske frivillige ændrede AVODART 0,5 mg ikke digoxins steady-state farmakokinetik, når det blev administreret samtidig med en dosis på 0,5 mg/dag i 3 uger.
Warfarin
et forsøg med 23 raske frivillige ændrede 3 ugers behandling med AVODART 0,5 mg/dag ikke steady-state farmakokinetikken af S- eller R-warfarin-isomererne eller ændrede virkningen af warfarin på protrombintiden, når det blev administreret sammen med warfarin.
Anden samtidig terapi
Selvom der ikke blev udført specifikke interaktionsforsøg med andre stoffer, tog ca. 90 % af forsøgspersonerne i de 3 randomiserede, dobbeltblindede, placebokontrollerede sikkerheds- og effektforsøg, der fik AVODART, anden medicin samtidig. Ingen klinisk signifikante uønskede interaktioner kunne tilskrives kombinationen af AVODART og samtidig behandling, når AVODART blev administreret sammen med antihyperlipidæmika, angiotensin-konverterende enzym (ACE)-hæmmere, beta-adrenerge blokerende midler, calciumkanalblokkere, kortikosteroider, diuretika, ikke-steroide antistoffer. -inflammatoriske lægemidler (NSAID'er), phosphodiesterase Type V-hæmmere og quinolonantibiotika.
Dyretoksikologi og/eller farmakologi
Toksikologiske undersøgelser af centralnervesystemet
Hos rotter og hunde resulterede gentagen oral administration af dutasterid i, at nogle dyr viste tegn på ikke-specifik, reversibel, centralt medieret toksicitet uden associerede histopatologiske ændringer ved eksponeringer på henholdsvis 425 og 315 gange den forventede kliniske eksponering (af moderlægemidlet) .
Kanin dermal Absorption
I en dermal farmakokinetikundersøgelse af kanin resulterede dermal absorption af dutasterid i CAPMUL (glyceryloleat) hos kaniner i serumkoncentrationer på 2,7 til 40,5 mcg/time/ml for doser på henholdsvis 1 til 20 mg/ml eller 56 % til 1000 af påført dutasterid, der skal absorberes under okkluderede og langvarige forhold. AVODART bløde gelatinekapsler administreret oralt indeholder 0,5 mg dutasterid opløst i en blanding af mono-di-glycerider af caprylsyre/caprinsyre og butyleret hydroxytoluen. Dutasterid i vand blev minimalt absorberet hos kaniner (2.000 mg/kg).
Kliniske Studier
Monoterapi
AVODART 0,5 mg/dag (n = 2.167) eller placebo (n = 2.158) blev evalueret hos mandlige forsøgspersoner med BPH i tre 2-årige multicenter, placebokontrollerede, dobbeltblindede forsøg, hver med 2-årige åbne forlængelser ( n = 2.340). Mere end 90% af forsøgsbefolkningen var hvide. Forsøgspersonerne var i alderen mindst 50 år med en serum-PSA ≥1,5 ng/ml og
Effekt på symptomscore
Symptomer blev kvantificeret ved hjælp af AUA-SI, et spørgeskema, der evaluerer urinsymptomer (ufuldstændig tømning, hyppighed, intermittens, haster, svag strøm, anstrengelse og nocturia) ved vurdering på en 0 til 5 skala for en samlet mulig score på 35, med højere numeriske samlede symptomscore, der repræsenterer større sværhedsgrad af symptomer. Baseline AUA-SI-score på tværs af de 3 forsøg var ca. 17 enheder i begge behandlingsgrupper.
Forsøgspersoner, der fik dutasterid, opnåede en statistisk signifikant forbedring i symptomer i forhold til placebo efter måned 3 i 1 forsøg og efter måned 12 i de andre 2 pivotale forsøg. Ved måned 12 var det gennemsnitlige fald fra baseline i AUA-SI samlede symptomscore på tværs af de 3 poolede forsøg -3,3 enheder for dutasterid og -2,0 enheder for placebo med en gennemsnitlig forskel mellem de 2 behandlingsgrupper på -1,3 (interval: -1,1) til -1,5 enheder i hvert af de 3 forsøg, P
Disse forsøg var prospektivt designet til at evaluere virkninger på symptomer baseret på prostatastørrelse ved baseline. Hos mænd med prostatavolumener ≥40 cc var det gennemsnitlige fald -3,8 enheder for dutasterid og -1,6 enheder for placebo, med en gennemsnitlig forskel mellem de 2 behandlingsgrupper på -2,2 ved måned 24. Hos mænd med prostatavolumener
Figur 1: AUA-SI-scoreaændring fra baseline (randomiserede, dobbeltblindede, placebokontrollerede forsøg samlet)
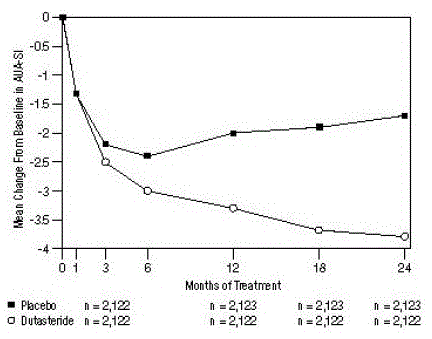
en AUA-SI-score går fra 0 til 35.
Effekt på akut urinretention og behovet for BPH-relateret kirurgi
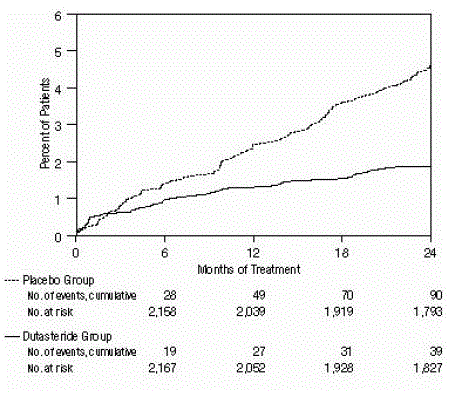
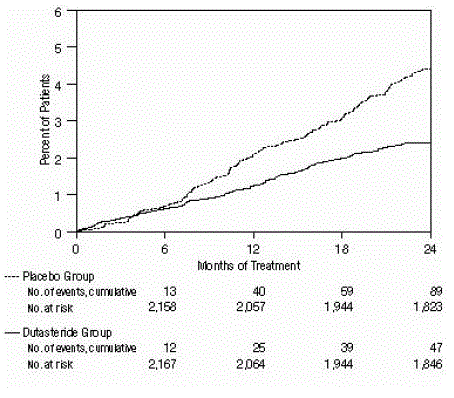
Effekten blev også vurderet efter 2 års behandling ud fra forekomsten af AUR, der krævede kateterisering og BPH-relateret urologisk kirurgisk indgreb. Sammenlignet med placebo var AVODART forbundet med en statistisk signifikant lavere forekomst af AUR (1,8 % for AVODART versus 4,2 % for placebo, P
Figur 2: Procentdel af forsøgspersoner, der udvikler akut urinretention over en 24-måneders periode (randomiserede, dobbeltblindede, placebokontrollerede forsøg samlet)
Figur 3: Procentdel af forsøgspersoner, der blev opereret for benign prostatahyperplasi over en 24-måneders periode (randomiserede, dobbeltblindede, placebokontrollerede forsøg samlet)
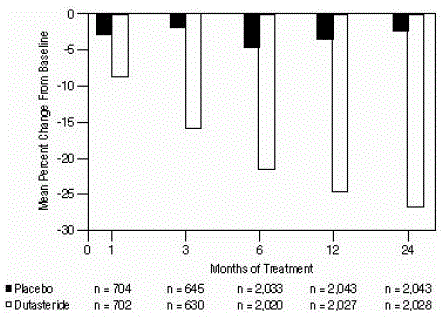
Effekt på prostatavolumen
Et prostatavolumen på mindst 30 cc målt ved transrektal ultralyd var påkrævet for at komme ind i forsøget. Det gennemsnitlige prostatavolumen ved forsøgets start var ca. 54 cc.
Statistisk signifikante forskelle (AVODART 0,5 mg versus placebo) blev noteret ved den tidligste måling af prostatavolumen efter behandling i hvert forsøg (måned 1, måned 3 eller måned 6) og fortsatte gennem måned 24. Ved måned 12 var den gennemsnitlige procentvise ændring i prostatavolumen på tværs af de 3 poolede forsøg var -24,7 % for dutasterid og -3,4 % for placebo; den gennemsnitlige forskel (dutasterid minus placebo) var -21,3 % (interval: -21,0 % til -21,6 % i hvert af de 3 forsøg, P
Figur 4: Prostatavolumenprocentændring fra baseline (randomiserede, dobbeltblindede, placebokontrollerede forsøg samlet)
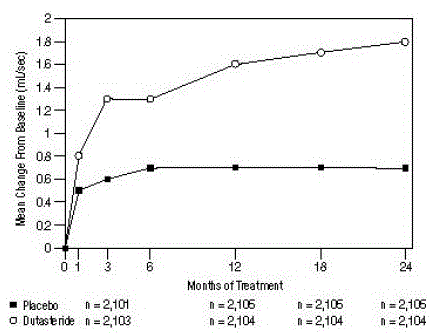
Effekt på maksimal urinstrøm
En gennemsnitlig maksimal uringennemstrømningshastighed (Qmax) på ≤15 ml/sek var påkrævet til forsøg. Qmax var ca. 10 ml/sek. ved baseline på tværs af de 3 pivotale forsøg.
Forskelle mellem de 2 grupper var statistisk signifikante fra baseline ved 3. måned i alle 3 forsøg og blev opretholdt gennem 12. måned. Ved 12. måned var den gennemsnitlige stigning i Qmax på tværs af de 3 sammenlagte forsøg 1,6 ml/sek. for AVODART 0,5 mg og 0,7 ml. /sek for placebo; den gennemsnitlige forskel (dutasterid minus placebo) var 0,8 ml/sek (interval: 0,7 til 1,0 ml/sek i hvert af de 3 forsøg, P
Figur 5: Qmax-ændring fra baseline (randomiserede, dobbeltblindede, placebokontrollerede forsøg samlet)
Sammenfatning af kliniske forsøg
Data fra 3 store, velkontrollerede effektforsøg viser, at behandling med AVODART (0,5 mg én gang dagligt) reducerer risikoen for både AUR og BPH-relateret kirurgisk indgreb i forhold til placebo, forbedrer BPH-relaterede symptomer, reducerer prostatavolumen og øger det maksimale urinstrømningshastigheder. Disse data tyder på, at AVODART 0,5 mg standser sygdomsprocessen af BPH hos mænd med en forstørret prostata.
Kombination med alfablokkerterapi (CombAT)
Effekten af kombinationsbehandling (AVODART 0,5 mg/dag plus tamsulosin 0,4 mg/dag, n = 1.610) blev sammenlignet med AVODART 0,5 mg alene (n = 1.623) eller tamsulosin alene (n = 1.611) i et 4-årigt multicenter, randomiseret , dobbeltblindet forsøg. Kriterierne for optagelse i forsøget svarede til de dobbeltblindede, placebokontrollerede effektforsøg med monoterapi beskrevet i afsnit 14.1. Otteogfirs procent (88%) af den indskrevne forsøgspopulation var hvid. Ca. 52 % af forsøgspersonerne havde tidligere været udsat for behandling med 5 alfa-reduktase-hæmmere eller alfa-adrenerge-antagonister. Af de 4.844 forsøgspersoner, der tilfældigt blev tildelt behandling, gennemførte 69 % af forsøgspersonerne i kombinationsgruppen, 67 % i gruppen, der fik AVODART 0,5 mg, og 61 % i tamsulosingruppen 4 års dobbeltblind behandling.
Effekt på symptomscore
Symptomerne blev kvantificeret ved hjælp af de første 7 spørgsmål i International Prostate Symptom Score (IPSS) (identisk med AUA-SI). Baseline-score var ca. 16,4 enheder for hver behandlingsgruppe. Kombinationsterapi var statistisk overlegen hver af monoterapibehandlingerne med faldende symptomscore ved måned 24, det primære tidspunkt for dette endepunkt. Ved måned 24 var de gennemsnitlige ændringer fra baseline (±SD) i IPSS totale symptomscore -6,2 (±7,14) for kombination, -4,9 (±6,81) for AVODART og -4,3 (±7,01) for tamsulosin, med en gennemsnitlig forskel. mellem kombination og AVODART 0,5 mg af -1,3 enheder (P
Figur 6: International prostata symptomscore ændring fra baseline over en 48 måneders periode (randomiseret, dobbeltblindet, parallelgruppeforsøg [CombAT Trial])
![International Prostate Symptom Score Change from Baseline over a 48Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/938dffdaeff5781f2931d79b1a2136fc.jpg)
Effekt på akut urinretention eller behovet for BPH-relateret kirurgi
Efter 4 års behandling gav kombinationsbehandling med AVODART 0,5 mg og tamsulosin ikke fordel i forhold til monoterapi med AVODART til at reducere forekomsten af AUR eller BPH-relateret kirurgi.
Effekt på maksimal urinstrøm
Baseline Qmax var ca. 10,7 ml/sek. for hver behandlingsgruppe. Kombinationsterapi var statistisk overlegen hver af monoterapibehandlingerne ved at øge Qmax ved måned 24, det primære tidspunkt for dette endepunkt. Ved 24. måned var de gennemsnitlige stigninger fra baseline (±SD) i Qmax 2,4 (±5,26) ml/sek. for kombination, 1,9 (±5,10) ml/sek. for AVODART 0,5 mg og 0,9 (±4,57) ml/sek. tamsulosin, med en gennemsnitlig forskel mellem kombination og AVODART på 0,5 ml/sek. (P = 0,003; [95 % CI: 0,17, 0,84]) og mellem kombination og tamsulosin på 1,5 mL/sek. (P
Den yderligere forbedring i Qmax af kombinationsbehandling i forhold til monoterapi med AVODART 0,5 mg var ikke længere statistisk signifikant ved måned 48.
Figur 7: Qmax-ændring fra baseline over en 24-måneders periode (randomiseret, dobbeltblindet, parallelgruppeforsøg [CombAT Trial])
![Qmax Change from Baseline over a 24-Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/30072d50275e4ed56a5493f8cc296f4f.jpg)
Effekt på prostatavolumen
Det gennemsnitlige prostatavolumen ved start af forsøget var ca. 55 cc. Ved måned 24, det primære tidspunkt for dette endepunkt, var den gennemsnitlige procentvise ændringer fra baseline (±SD) i prostatavolumen -26,9% (±22,57) for kombinationsbehandling, -28,0% (±24,88) for AVODART 0,5 mg og 0 % (±31,14) for tamsulosin, med en gennemsnitlig forskel mellem kombination og AVODART 0,5 mg på 1,1 % (P = NS; [95 % CI: -0,6, 2,8]) og mellem kombination og tamsulosin på -26,9 % (P
PATIENTOPLYSNINGER
AVODART (av o dart) (dutasterid) kapsler
AVODART 0,5 mg er kun til brug af mænd.
Læs denne patientinformation, før du begynder at tage AVODART 0,5 mg, og hver gang du får en genopfyldning. Der kan være nye oplysninger. Disse oplysninger træder ikke i stedet for at tale med din sundhedsplejerske om din medicinske tilstand eller din behandling.
Hvad er AVODART 0,5 mg?
AVODART 0,5 mg er et receptpligtigt lægemiddel, der indeholder dutasterid. AVODART 0,5 mg bruges til at behandle symptomerne på benign prostatahyperplasi (BPH) hos mænd med en forstørret prostata til:
- forbedre symptomer,
- reducere risikoen for akut urinretention (en fuldstændig blokering af urinstrømmen),
- reducere risikoen for behovet for BPH-relateret operation.
Hvem bør IKKE tage AVODART?
Tag ikke AVODART, hvis du er:
- gravid eller kan blive gravid. AVODART 0,5 mg kan skade dit ufødte barn. Gravide kvinder bør ikke røre ved AVODART kapsler. Hvis en kvinde, der er gravid med en mandlig baby, får nok AVODART 0,5 mg i kroppen ved at synke eller røre ved AVODART, kan den mandlige baby blive født med kønsorganer, der ikke er normale. Hvis en gravid kvinde eller kvinde i den fødedygtige alder kommer i kontakt med utætte AVODART 0,5 mg kapsler, skal kontaktområdet straks vaskes med vand og sæbe.
- et barn eller en teenager.
- allergisk over for dutasterid eller et af indholdsstofferne i AVODART. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i AVODART.
- allergisk over for andre 5 alfa-reduktasehæmmere, for eksempel PROSCAR (finasteride) ® tabletter.
Hvad skal jeg fortælle min sundhedsplejerske, før jeg tager AVODART 0,5 mg?
Inden du tager AVODART 0,5 mg, skal du fortælle det til din læge, hvis du:
- har leverproblemer
Fortæl din sundhedsudbyder om al den medicin, du tager, inklusive receptpligtig og ikke-receptpligtig medicin, vitaminer og naturlægemidler. AVODART og anden medicin kan påvirke hinanden og forårsage bivirkninger. AVODART 0,5 mg kan påvirke den måde, anden medicin virker på, og anden medicin kan påvirke, hvordan AVODART 0,5 mg virker.
Kend den medicin du tager. Hold en liste over dem for at vise din læge og apotek, når du får en ny medicin.
Hvordan skal jeg tage AVODART?
- Tag 1 AVODART kapsel én gang dagligt.
- Synk AVODART 0,5 mg kapsler hele. Du må ikke knuse, tygge eller åbne AVODART 0,5 mg kapsler, da indholdet af kapslen kan irritere dine læber, mund eller hals.
- Du kan tage AVODART 0,5 mg med eller uden mad.
- Hvis du glemmer en dosis, kan du tage den senere samme dag. Du må ikke erstatte den glemte dosis ved at tage 2 doser næste dag.
Hvad skal jeg undgå, mens jeg tager AVODART 0,5 mg?
- Du bør ikke donere blod, mens du tager AVODART eller i 6 måneder efter, at du er stoppet med AVODART. Dette er vigtigt for at forhindre gravide kvinder i at få AVODART gennem blodtransfusioner.
Hvad er de mulige bivirkninger af AVODART?
AVODART kan forårsage alvorlige bivirkninger, herunder:
- Sjældne og alvorlige allergiske reaktioner, herunder:
- hævelse af dit ansigt, tunge eller hals
- alvorlige hudreaktioner, såsom hudafskalning
Få lægehjælp med det samme, hvis du har disse alvorlige allergiske reaktioner.
- Større chance for en mere alvorlig form for prostatakræft.
De mest almindelige bivirkninger ved AVODART omfatter:
- problemer med at få eller holde en erektion (impotens)*
- et fald i sexlyst (libido)*
- udløsningsproblemer*
- forstørrede eller smertefulde bryster. Hvis du bemærker brystknopper eller udflåd fra brystvorten, bør du tale med din læge.
*Nogle af disse hændelser kan fortsætte, efter du holder op med at tage AVODART.
Deprimeret humør er blevet rapporteret hos patienter, der får AVODART.
AVODART 0,5 mg har vist sig at reducere sædtal, sædvolumen og sædbevægelse. Effekten af AVODART 0,5 mg på mandlig fertilitet er imidlertid ikke kendt.
Prostata-specifik antigen (PSA) test: Din læge kan tjekke dig for andre prostataproblemer, herunder prostatakræft, før du starter, og mens du tager AVODART. En blodprøve kaldet PSA (prostata-specifikt antigen) bruges nogle gange til at se, om du kan have prostatakræft. AVODART vil reducere mængden af PSA målt i dit blod. Din sundhedsplejerske er opmærksom på denne effekt og kan stadig bruge PSA til at se, om du muligvis har prostatakræft. Forøgelser i dine PSA-niveauer, mens du er i behandling med AVODART (selvom PSA-niveauerne er inden for normalområdet) bør vurderes af din læge.
Fortæl din læge, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger ved AVODART. For mere information, spørg din læge eller apotek.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare AVODART 0,5 mg?
- Opbevar AVODART 0,5 mg kapsler ved stuetemperatur (59°F til 86°F eller 15°C til 30°C).
- AVODART 0,5 mg kapsler kan blive deforme og/eller misfarvede, hvis de opbevares ved høje temperaturer.
- Brug ikke AVODART 0,5 mg, hvis dine kapsler er deforme, misfarvede eller utætte.
- Smid sikkert medicin ud, der ikke længere er nødvendigt.
Opbevar AVODART 0,5 mg og al medicin utilgængeligt for børn.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en indlægsseddel. Brug ikke AVODART 0,5 mg til en tilstand, som det ikke er ordineret til. Giv ikke AVODART til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Denne indlægsseddel opsummerer den vigtigste information om AVODART. Hvis du vil have mere information, så tal med din sundhedsplejerske. Du kan bede din apoteker eller sundhedsudbyder om oplysninger om AVODART 0,5 mg, der er skrevet til sundhedspersonale.
For mere information, gå til www.AVODART.com eller ring på 1-888-825-5249.
Hvad er indholdsstofferne i AVODART 0,5 mg?
Aktiv ingrediens: dutasterid.
Inaktive ingredienser : butyleret hydroxytoluen, ferrioxid (gul), gelatine (fra certificerede BSE-fri kvægkilder), glycerin, mono-di-glycerider af caprylsyre/caprinsyre, titaniumdioxid og spiseligt rødt blæk.
Hvordan virker AVODART?
Prostatavækst er forårsaget af et hormon i blodet kaldet dihydrotestosteron (DHT). AVODART sænker DHT-produktionen i kroppen, hvilket fører til krympning af den forstørrede prostata hos de fleste mænd. Mens nogle mænd har færre problemer og symptomer efter 3 måneders behandling med AVODART, er en behandlingsperiode på mindst 6 måneder normalt nødvendig for at se, om AVODART 0,5 mg vil virke for dig.
Denne patientinformation er blevet godkendt af US Food and Drug Administration.
